Method Article
Porcine Modell des Infrarot abdominalen Aortenaneurysmus
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses neuartige Modell erzeugt robuste infrarote abdominale Aortenaneurysmen bei Schweinen mit einer Kombination aus Ballonangioplastie, Elastase/Kollagennase-Perfusion, topischer Elastase-Anwendung und oraler Verbindung--Aminopropionitril-Verabreichung, die die Kollagenvernetzung stört.
Zusammenfassung
Große Tiermodelle zur Untersuchung von Abdominalaortenaneurysmen sind spärlich. Der Zweck dieses Modells ist es, reproduzierbare, klinisch signifikante infrarote Abdominalaortenaneurysmen (AAA) bei Schweinen zu erzeugen. Um dies zu erreichen, verwenden wir eine Kombination aus Ballonangioplastie, Elastase und Kollagennase und einem Lysyloxidase-Inhibitor, genannt "Aminopropionitril"(BAPN), um klinisch signifikante infrarote Aortenaneurysmen zu erzeugen, analog zu menschlichen Erkrankungen.
Nicht kastrierte männliche Schweine werden BAPN für 7 Tage vor der Operation gefüttert, um einen stabilen Zustand im Blut zu erreichen. Eine Mittellinien-Laparotomie wird durchgeführt und die Infrarot-Aorta wird umlaufend seziert. Eine erste Messung wird vor der Aneurysminduktion mit einer Kombination aus Ballonangioplastie, Elastase (500 Einheiten)/Kollagenase (8000 Einheiten) Perfusion und topischer Elastase-Anwendung aufgezeichnet. Schweine werden täglich bis zum terminalen Eingriff am postoperativen Tag 7, 14 oder 28 gefüttert, zu dem das Aneurysm gemessen und Gewebe beschafft wird. BAPN + Chirurgie Schweine werden mit Schweinen verglichen, die allein operiert wurden.
Schweine, die mit BAPN und Chirurgie behandelt wurden, hatten eine mittlere Aortendilatation von 89,9 % bis 47,4 % an Tag 7, 105,4 % bis 58,1 % am 14. Tag und 113,5 % bei 30,2 % am 28. Tag. Schweine, die allein mit einer Operation behandelt wurden, hatten deutlich kleinere Aneurysmen als BAPN + Operationstiere an Tag 28 (p < 0.0003). Die BAPN + Chirurgiegruppe hatte makroskopische und immunhistochemische Beweise für eine aneurysmale Endstadium-Erkrankung.
Klinisch signifikante infrarote AAA kann mit Ballonangioplastie, Elastase/Kollagenase-Perfusion und topischer Anwendung induziert werden, ergänzt mit oralem BAPN. Dieses Modell erzeugt große, klinisch signifikante AAA mit Merkmalen menschlicher Krankheiten. Dies hat wichtige Auswirkungen auf die Aufklärung der AAA-Pathogenese und die Erprobung neuartiger Therapien und Geräte zur Behandlung von AAA. Zu den Einschränkungen des Modells gehören Variationen in BAPN, die durch Schweine aufgenommen werden, die Qualität der Elastaseperfusion und die Kosten von BAPN.
Einleitung
Nach Angaben des Center for Disease Control (CDC) sind Aortenaneurysmen (AA) eine der Haupttodesursachen in den Vereinigten Staaten und stellen eine erhebliche Krankheitslastdar 1. Ein Aortenaneurysm ist definiert als eine Dilatation eines diskreten Teils des Gefäßlumens um über 50%2. Eine Teilmenge von AA im Bauch, die als abdominale Aortenaneurysmen (AAA) bezeichnet wird, sind ein wachsendes Problem. AAA bleiben klinisch still bis zu drohendem Bruch oder Zerlegung, mit akutem Beginn, starke Bauchschmerzen in der Regel das einzige präsentierende Symptom3,4. Rupture of AAA ist fast immer tödlich mit einer Sterblichkeitsrate von 90%5. Offene oder endovaskuläre Chirurgie ist die einzige therapeutische Option für Patienten, und kann ein hochmorbides Verfahren sein. Wichtig ist, dass AAA eine der wenigen Herz-Kreislauf-Erkrankungen ohne medizinische Therapie zur Heilung ist.
Bis heute konzentrierte sich ein Großteil der Forschung entocher nagetierese auf Nagetiermodelle, mit Elastase, einem Enzym, das Elastin in den Aortenmedien abbaut, um Aneurysmen zu induzieren. 6,7 Die klinische Übertragbarkeit von Kleintiermodellen auf menschliche aneurysmale Erkrankungen ist jedoch eingeschränkt, da die Bewertung struktureller Veränderungen in der Aorta und die veränderte Hämodynamik aufgrund ihrer Größe begrenzt sind. Aufgrund der anatomischen und größenähnlichen Ähnlichkeit korreliert das Schweinekreislaufsystem besser mit der menschlichen Biologie als Nagetiere8. Große Tiermodelle ermöglichen ein besseres Verständnis der zellulären Mechanismen des Krankheitsprozesses, können neuartige Behandlungen in therapeutischen Dosen für große Säugetiere entwickeln und mechanische Reparaturgeräte testen, was in Kleintiermodellen nicht möglich wäre. Darüber hinaus repliziert die akute Natur von Nagetiermodellen nicht die Chronik und pathologische Eigenschaften der menschlichen aneurysmalen Krankheit.
Die Kombination von Elastase und einer Verbindung namens "Aminopropionitril" (BAPN) hat murine AAA-Modelle revolutioniert, indem sie Größere aneurysmen erzeugt, die Fortsetzungen chronischer aneurysmaler Erkrankungen enthalten, einschließlich Wand-Thrombus, Dissektion und Bruch9. BAPN ist ein Inhibitor der Lysyloxidase, die für die Kollagenvernetzung unerlässlich ist, ein entscheidender Bestandteil der Aortenwand10,11,12. Lysyloxidase Aktivität nimmt mit dem Altern und angesichts der Assoziation des Alters und die chronische Natur der komplizierten AA, BAPN hat großes Potenzial, die Auswirkungen des Alterns experimentell zu imitieren9,13,14. Die Verwendung von BAPN und seine Fähigkeit, chronische Krankheiten in einer subakuten Umgebung zu replizieren, bietet einen neuen Vorteil gegenüber alternativen großen Tiermodellen von AAA. Im Vergleich zu anderen etablierten Poren-AAA-Modellen erzeugt dieses Modell die größten Aneurysmen mit Merkmalen der Endstadium-Krankheit, und die Ergebnisse wurden bereits veröffentlicht8,11,15.
Während bestimmte Vorteile gewährt werden, sind erhebliche Ressourcen und Investitionen erforderlich, um dieses Modell erfolgreich zu vervollständigen, was einige Ermittler abschrecken könnte. Zu diesen Ressourcen gehören der Zugang zu Operationssälen, qualifizierten Chirurgen und Anästhesieanbietern, Tierhaltung und Veterinärpersonal, um bei der postoperativen Versorgung zu helfen. Darüber hinaus können die Kosten für BAPN für einige Labore unerschwinglich teuer sein.
Es gibt nur wenige große Tiermodelle, um die komplexe Pathophysiologie der AAA-Bildung zu untersuchen und in menschliche Krankheiten zu übersetzen. Große Tiermodelle von AAA sind entscheidend, um die Lebensfähigkeit neuartiger Technologien und Behandlungen für menschliche Krankheiten zu beurteilen. Daher bestand der Zweck dieser Studie darin, ein reproduzierbares Modell des fortgeschrittenen Infrarot-AAA bei Schweinen zu erstellen. Die Begründung für die Verwendung von BAPN und Elastase-Schweinemodell ist es, die Pathophysiologie von AAA besser zu verstehen, indem die chronische Natur und Diefolgen der menschlichen aneurysmalen Krankheit in einer akuten oder subakuten Umgebung nachgeahmt werden, sowie neuartige Therapien und Geräte für AAA zu testen. Behandlung.
Protokoll
Tierprotokolle wurden vom Institutional Animal Care and Use Committee der University of Virginia (Nr. 3848) genehmigt.
HINWEIS: Dieses Modell wurde bereits von Cullen et al. veröffentlicht und ist ein modifiziertes Protokoll, das von Hynecek et al.8,15beschrieben wird.
1. Tiere
- Verwenden Sie nicht kastrierte männliche Schweine mit einem Gewicht von 20-30 kg für die Experimente.
- Um den Anteil der gewichtsbasierten Dosen von BAPN aufgenommen zu maximieren, geben Sie Schweinen geteilte Mahlzeiten von Standard-Chow und 0,15 g/kg BAPN gemischt mit Vollmilch-Normaljoghurt oder nassen Hundefutter. Starten Sie die BAPN-Administration 7 Tage vor der Indexoperation, um einen stabilen Zustand im Blut zu erreichen, und täglich während des postoperativen Kurses.
HINWEIS: BAPN hat zahlreiche Nebenwirkungen, wenn in großen Mengen aufgenommen. Isolationsvorkehrungen für Mitarbeiter wie Mütze, Kleider, Handschuhe und Schuhbezüge sollten getragen werden, wenn sie mit Tieren interagieren, die mit BAPN gefüttert werden, oder mit BAPN umgehen. - Machen Sie Schweine null pro os (NPO) in der Nacht vor der Operation.
2. Anästhesie
- Induzieren Sie Vollnarkose (GA) mit Tiletamin-Zolzepam 6 mg/kg, Xylazin (2 mg/kg) und Atropinsulfat (0,04 mg/kg) intramuskulär verabreicht.
- Intubieren Sie das Schwein mit einem Standard-Endotrachealrohr (ETT) und Miller-Klinge.
- Erhalten Sie peripheren intravenösen (IV) Zugang mit einem 16 oder 18 Gauge IV in einer Ohrvene und sicher an Ort und Stelle mit Klebeband.
- Schließen Sie die ETT an die Anästhesiemaschine an und halten Sie GA mit inhaliertem Isofluran (0,2 mg/kg).
- Wenden Sie Elektrokardiogramm (EKG) Leads und Pulsoximetrie an, um Vitalzeichen während der Operation zu überwachen. Nehmen Sie die orale Temperatur am Anfang des Gehäuses ein. Legen Sie ein Elektrokauter-Pad auf einen abhängigen Teil des Schweins.
- Stellen Sie sicher, dass ein Mitarbeiter ständig Vitalzeichen überwacht und regelmäßig aufzeichnet, um sicherzustellen, dass das Schwein angemessen beruhigt, belüftet und mit Sauerstoff versorgt wird, und um jede hämodynamische Instabilität während der Chirurgie.
3. Chirurgische Technik
- Sterilisation des Operationsbereichs mit steriler Gaze, Povidon-Jod und 70% Isopropylalkohol. Das Schwein in der üblichen sterilen Weise drapieren. Nehmen Sie eine Blutprobe vor dem Schnitt.
HINWEIS: An dieser Stelle müssen alle Geräte, einschließlich Instrumente, Ballons, Drähte usw. steril sein. - Mit einer Elf Klinge oder Bovie Elektrokautery, führen Sie eine Mittellinie Laparotomie, um die Bauchhöhle zu betreten.
- Verdrängen Sie die Bauchviszera cephalad auf die linke Seite des Schweins, um das Retroperitoneum freizulegen. Bedecken Sie den Darm mit einem feuchten blauen Handtuch, um Austrocknung zu vermeiden. Machen Sie einen scharfen Schnitt, um das Retroperitoneum zu betreten, so dass der Zugang zu den unteren Vena cava (IVC) und Infrarot-Bauchaorta.
HINWEIS: Die Identifizierung und der Schutz der Harnleiter bei diesem Teil des Falles ist von entscheidender Bedeutung. Die retroperitoneale Anatomie der Schweine (einschließlich des Verlaufs der Harnleiter) spiegelt grob den des Menschen wider, mit subtilen Variationen, die unten beschrieben werden. - Circumferentially sezieren die Aorta von den Nierengefäßen, minderwertig zu der aorten trifurkation. Achten Sie darauf, IVC und Lendenschlagsaderverletzungen zu vermeiden. Sobald die gesamte Infrarot-Aorta freigelegt ist, verwenden Sie Sättel, um den Aortendurchmesser im mittleren Teil der Infrarot-Aorta zu messen.
HINWEIS: Im Gegensatz zum Menschen haben Schweine eine Aortentrifurkation, nicht Bifurkation. - Identifizieren Sie die kaudale mesentische Arterie auf dem vorderen Teil der Infrarot-Aorta, die in der Regel ein paar Zentimeter proximal zur Aortentrifurkation liegt. Diese Arterie existiert beim Menschen nicht. Sezieren, klemmen und transsektifizieren diese Arterie. An diesem Punkt, verabreichen 5000 Einheiten von unfraktioniertem Heparinsulfat intravenös.
- Kanülieren Sie die kaudale mesenterische Arterie mit einer 0,018 in Edelstahl-Drahtführung aus einem Mikropuncture-Einführset. Die Arterie über den Draht mit einem 5 French (Fr) und dann einem 7 Fr Einführungsmittel zu depilieren.
- Lassen Sie den 7 Fr Einführungsmittel an Ort und Stelle, ersetzen Sie die 0.018 in Draht mit einem 0.035 in Guidewire, und entfernen Sie dann die 7 Fr Einführung, um sicherzustellen, dass Hämostase mit einem Finger über der Kanulationsstelle, wie der Einführer entfernt wird. Legen Sie einen 0,035 in Führungsdraht ein, bis ca. 30 cm Drahtreste oder Widerstand festgestellt werden.
- Legen Sie einen 16 mm perkutanen transluminalen Angioplastieballon über den Draht in die Infrarot-Aorta ein und positionieren Sie ihn in der Mitte der sezierten Aorta. Aufblasen Sie den Ballon, während Sie den Durchmesser der erweiterten Aorta zeitweise mit Sätteln messen, bis die maximale Dilatation etwa 80 % größer ist als Ihre Ausgangsmessung.
- Nach 10 min Reperfusion, Kreuz klemmen die Aorta nur distal zu den Nierengefäßen und proximal zur Aortentrifurkation. Identifizieren und klemmen Sie die zuvor sezierten Lendengefäße, um die Infrarotaorta aus der systemischen Zirkulation zu isolieren. Dies ist wichtig, um eine systemische Perfusion von Elastase zu vermeiden, die eine septische Reaktion in der akuten postoperativen Periode verursachen kann.
- Führen Sie den 7 Fr-Einflütiger über den Draht wieder ein und entfernen Sie den Draht. Spülen Sie das isolierte Aortensegment mit Einer Saline, die kein Auslaufen von Flüssigkeit sichsichert. Verbinden Sie die Elastase(500 Einheiten) und die Kollagenaselösung (8000 Einheiten) mit dem Einschleuser und durchdringen Sie 30 ml unter konstantem manuellen Druck 10 min in die isolierte Aorta. Die gesamten 30 ml Lösungen sollten in das isolierte Segment eingeführt werden.
HINWEIS: Ein gut durchlässiges Aortensegment sollte straff sein, ohne dass die Aortenwand oder die Kanulationsstelle austritt. Eine Gefäßschleife kann nur proximal zur Cannulationsstelle gewickelt werden, um sicherzustellen, dass keine Elastase entweicht. Im Laufe von 10 min kann eine Elastase/Kollagenase-Lösung beobachtet werden, die durch die Aortenwand "weint". - Nach 10 min die Lösung aus dem Aortenlumen mit Saline bewässern. Entfernen Sie den Einfläten und ligate den kaudalen mesenterischen Arterienstumpf. Lösen Sie alle Klemmen (Lumbarklemmen zuerst, gefolgt von distaler Klemme, dann proximale Klemme).
HINWEIS: Beschränken Sie die Klemmzeit auf nicht mehr als 10 min, um Rückenmarks-Ischämie zu verhindern. Lassen Sie einen Reparaturstich (5-0 Polypropylen) im Falle einer Blutung aus dem kaudalen mesenterischen Arterienstumpf nach dem Lösen der Kreuzklemmen beladen. - Ein 2 cm x 5 cm chirurgisches Gazestück mit 20 ml unverdünnter Elasse (27 Einheiten/ml) einweichen und 10 min um die eingegriffene Aorta wickeln. Nehmen Sie ein Maß der Aorta nach allen Eingriffen mit einem Bremssattel.
- Den Bauch mit Derinlin bewässern, den Darm ersetzen und den Bauch in drei Schichten schließen. BAPN hemmt die Wundheilung, so um das Risiko von Wundabbau und faszialer Dehiszenz zu minimieren, verwenden Sie Naht mit einer langen Absorptionszeit und achten Sie darauf, vernünftig kleine Bisse von Gewebe auf jeder Schicht zu nehmen. Verwenden Sie eine laufende synthetische resorbierbare Monofilament 1 Looped Polydioxanone (PDS) Naht für die Faszie, eine laufende geflochtene resorbierbare 2-0 Naht für die tiefe Dermal später, und eine laufende subkutikuläre resorbierbare Monofilament-Naht (4-0) für die Haut.
4. Postoperative Pflege
- Verwenden Sie 0,2 mg/kg subkutanes Buprenorphin-SR für postoperative Analgesie. Bewerten Sie jedes Schwein dreimal täglich für die ersten drei postoperativen Tage auf Anzeichen von Schmerzen und Beschwerden und verabreichen Sie zusätzliche Analgesie, wenn sie identifiziert werden.
- Verabreichen Sie postoperative Antibiotika (1 g Cephalexin intramuskulär) auf POD 1-3.
- Sozial beherbergenTiere nach POD 3.
5. Aortengewebebeschaffung
- Führen Sie die Gewebebeschaffung entweder auf POD 7, 14 oder 28 durch.
- Induzieren Sie GA, wie in den Schritten 2.1-2.5 oben beschrieben.
HINWEIS: Die Endaortengewebebeschaffung muss nicht steril sein. - 5.3. Öffnen Sie den vorherigen Mittellinien-Laparotomie-Einschnitt wieder, da sie sich des anderebauchigen Darms an der vorderen Bauchwand bewusst ist. Spiegeln Sie den Darm, um das Retroperitoneum und Aorta ähnlich Schritt 3.3 oben auszusetzen.
- Sezieren Sie die Aorta, bis das Aneurysm freigelegt wird, und messen Sie den Außendurchmesser des aneurysmalen Segments mit Sätteln. Aortendilatation berechnen (%) mit der folgenden Gleichung: [(Ernte Infrarotdurchmesser - anfänglicher operativer Infrarotdurchmesser) x 100%]. Sobald die Messung erreicht ist, verabreichen Sie eine tödliche Dosis von Pentobarbital-Phenytoin (z. B. Euthasol) durch Injektion in das IVC.
- Sezieren Sie die Aorta von der Trifurkation zur suprarenalen Aorta und expflanzen Sie das aneurysmale Segment mit einem Kontrollsegment unbehandelter Aorta. Legen Sie die Probe entweder in flüssigen Stickstoff oder Formalin für die histologische Bewertung.
Ergebnisse
Alle statistischen Analysen wurden mit Fisher exakter Test oder Chi-Quadrat-Test durchgeführt. Datenwerte werden als mittlere Aortendilatation (%) - Standardabweichung (%) gemeldet. Die statistische Signifikanz wurde P < 0,05 festgelegt. Die Kombination von BAPN und Chirurgie, die eine Elastase-Behandlung (Chirurgie/Elastase) bietet, schafft eine robustere und reproduzierbarere AAA bei Schweinen an Tag 28 im Vergleich zu denen, die mit Einer Operation und Elastase allein behandelt werden (mittlere Aortendilatation (%) - Standardabweichung (%): 113,5% bei 30,2% (n = 8) versus 59,7% bei 29,2% (n = 12); P < .01) wie in Abbildung 1dargestellt . AAA wuchs mit fortschreitender Zeit immer größer (mittlere Aortendilatation (%) - Standardabweichung (%) von 86,9 % bis 47,4 % (n = 4), 105,4 % bis 58,1 % (n = 5) und 113,5 % bis 30,2 % (n = 8) bei 7, 14 bzw. 28 Erntezeitpunkten, Abbildung 1). Hinweise auf eine chronische aneurysmale Erkrankung sind bei Tieren, die mit BAPN und Operation/Elastase behandelt wurden, einschließlich intraluminaler Thrombus und Arteriosklerose (Abbildung 2) offensichtlich. Die histologische Bewertung zeigte eine signifikant erhöhte Elastinfragmentierung und Kollagenveränderung bei BAPN-behandelten Schweinen AAA als nur Operation/Elastase(Abbildung 3 bzw. Abbildung 4).
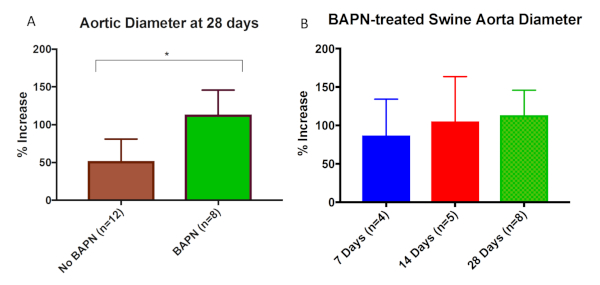
Abbildung 1: Die Behandlung mit dem Aminopropionitril (BAPN) erhöht die Größe des Schweineabdominalaorteneurysms (AAA). (A) BAPN + Chirurgie/Elastase-Schweine hatten eine signifikant höhere mittlere Aortendilatation im Vergleich zu nicht-BAPN-behandelten (Chirurgie/Elastase allein) Schweinen nach 28 Tagen (113,5 % bei 30,2 % vs. 59,7 % bis 29,2 %; P < .01). (B) BAPN-behandelte Schweine wiesen eine mittlere Aortendilatation von 86,9 % bis 47,4 %, 105,4 % bis 58,1 % bzw. 113,5 % bei 7, 14 bzw. 28-Tage-Erntezeitpunkten auf. Diese Figur wurde von Cullen et al.15 veröffentlicht und hier mit Genehmigung reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Beispielfotos von Schweineabdominalaorteneurysmen (AAA). (A) Kontrolle der Bauchaorta (keine Behandlung mit BAPN oder Elastase). (B) Infrarot-AAA gebildet am postoperativen Tag (POD) 28 nach der Behandlung mit Operation/Elastase, und BAPN (C) Intraluminal Thrombus in AAA auf POD 28 bei operationen/elastase und BAPN behandelten Tieren (D) Atherosklerose in infraroten AAA auf POD 28 in Chirurgie/Elastase und BAPN behandelten Tieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
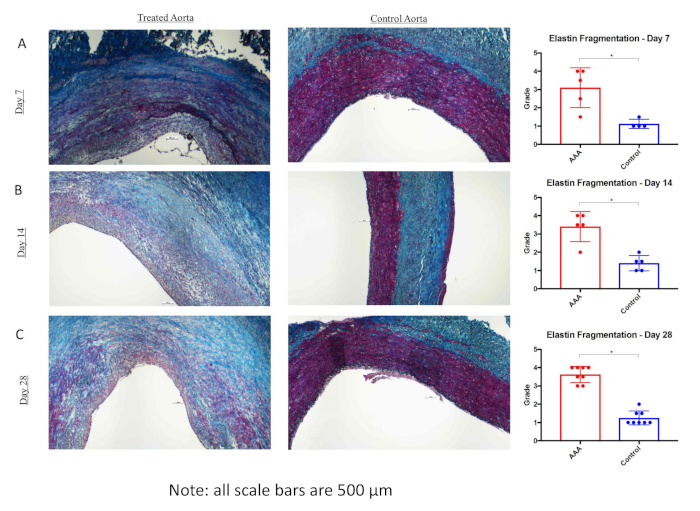
Abbildung 3: Die Elastin-Fragmentierung ist bei der mit Schweinen behandelten Schweineabdominalaortikaeurysm (AAA) erhöht. van Gieson Färbung in Infrarot-Aorta und suprarenale Aorta bei 7 Tagen (A), 14 Tage (B)und 28 Tage (C). Rechtsextreme Elastin -Fragmentierung (schwarz), gemessen von unabhängigen Gutachtern von Infrarot-Aorta versus Suprarenalaorta bei 7, 14 und 28 Tagen. Die Skalenstange steht für 500 m; 4x Objektiv. *P < 0,05. Diese Figur wurde von Cullen et al.15 veröffentlicht und hier mit Genehmigung reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
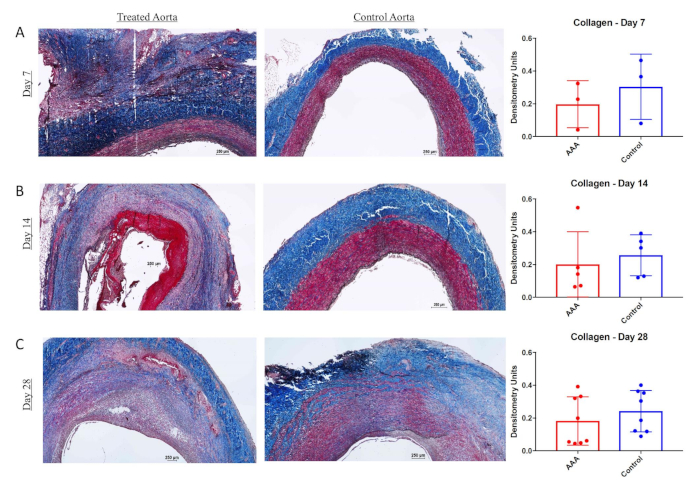
Abbildung 4: Kollagen wird in mit dem BaPN behandelten Schweineabdominalaeurysm (AAA) verändert. Masson trichrome und van Gieson Färbung in Infrarot-Aorta und suprarenale Aorta bei 7 Tagen (A), 14 Tage (B) und 28 Tage (C). Rechtsextremer, Kollagengehalt (blau) in der Wand der Infrarot- oder Suprarenalaorta, gemessen durch Densitometrieeinheiten bei 7, 14 und 28 Tagen. Skalenstange steht für 250 mm; 4x Objektiv. Diese Figur wurde von Cullen et al.15 veröffentlicht und mit Genehmigung reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Ein neuartiges Modell der infraroten AAA in Schweinen wurde mit einer Kombination aus Ballonangioplastie, Perfusion und topischer Elastase und Diät als BAPN erstellt. Mit diesem Modell wurde eine aortende Dilatation von >100% mit groben und histologischen Merkmalen der chronischen menschlichen aneurysmalen Erkrankung erreicht. Dieses Modell bietet ein Tor, um die komplexe Pathophysiologie von AAA weiter zu verstehen und mögliche Therapien in menschliche Krankheiten zu übersetzen.
Frühere Modelle von AAA in Schweinen wurden mit bescheidenem Erfolg erreicht. Marinov et al. verwendeten Elastase-Perfusion allein und sahen einige histologische Veränderungen einschließlich Elastin-Störung, aber waren nicht in der Lage, den Phänotyp zu erreichen, der ein Aneurysm definiert (>50% Dilatation)16. Angesichts der Haltbarkeit der Porcine Aorta ist mehr als eine Intervention erforderlich, um klinisch signifikante Aneurysmen zu erreichen, die ursprünglich von Hynecek et al. mit einer Kombination aus Elastase und Kollagennaseperfusion und Ballonangioplastie8beschrieben wurden. Sie sahen einen mittleren Aortendurchmesser von 73% sowie histologische Veränderungen der aneurysmalen Krankheit, einschließlich Endothelverlust, neutrophiler Infiltration und Elastin-Störung.
Frühere Modelle behandeln jedoch nicht alle AAA-Modelle ein grundlegendes Problem: wie man einen chronischen Krankheitsprozess in einer akuten oder subakuten Umgebung repliziert. Die meisten Elastase-Modelle von AAA bei Mäusen zeigen eine maximale Dilatation von etwa 2 Wochen, gefolgt von einer Regression danach, während sich menschliche Krankheiten chronisch über Jahre entwickeln. Der Schlüssel zu dieser Frage kann in der Verwendung von BAPN, einem Lysyloxidase-Inhibitor zur Verhinderung der Kollagenvernetzung, liegen. BAPN hat eine "Aging"-Wirkung, und in Kombination mit Derasase-Behandlung, Es hat sich gezeigt, chronisches Aneurysmwachstum zu simulieren. In einem murinen Modell von Lu et al. wurden Mäuse 100 Tage postoperativ beobachtet und zeigten Hinweise auf eine AAA im Endstadium mit Thrombusbildung und spontanem Bruch9. Die Neuheit und Bedeutung unseres Poren-AAA-Modells liegt in der Verwendung von BAPN, das diesen chronischen Krankheitsprozess in einer subakuten Umgebung und einer übersetzbareren Tierart nachbildet. Schweine fütterten eine Diät von BAPN in Kombination mit Ballon-Angioplastie, Elastase-Perfusion und topische Elastase-Anwendung zeigte robustere Aneurysmen mit Nachweisen von Endstadium-Krankheit, einschließlich Wand-Thrombus, Arteriosklerose, und Bruch im Vergleich zu denen mit Operation und Elastase allein behandelt (Abbildung 1). Dieses Modell erweitert und verbessert das vorherige Modell von Hynecek et al. durch die Schaffung größerer Aneurysmen mit Fortsetzung der chronischen Krankheit8.
Obwohl BAPN wichtig ist, um die Chronik von AAA zu replizieren, bietet ein chirurgischer Eingriff die anfängliche Beleidigung der Aorta, um aneurysmbildung zu induzieren. BAPN ohne Operation oder Elastase-Anwendung wurde untersucht, zeigte aber keine signifikante Aortendilatation11. Für nicht-chirurgisch ausgebildete Forscher kann die Induktion von AAA bei Schweinen über Laparotomie entmutigend sein. Jeder Schritt ist mit möglichen Komplikationen behaftet, von Darm- und Harnleiterverletzungen bis hin zu arteriellen oder venösen Blutungen, die repariert werden müssen, bis hin zu postoperativen Wundinfektionen. Der Ermittler muss auf Eventualitäten vorbereitet sein, um das Schwein bis zum Zielziel zu überleben. Eine echte Teamleistung ist erforderlich, einschließlich eines erfahrenen Chirurgen, der sich mit Bauchanatomie auskennt, der Bereitstellung einer außergewöhnlichen Anästhesie einschließlich der Aufmerksamkeit für Vitalzeichen und Flüssigkeitsstatus und einer aufmerksamen postoperativen Versorgung. Unser Team hat alle oben genannten Komplikationen erlebt und entsprechend gehandelt, ob bei der Reparatur von Enterotomie oder Kavaliersverletzungen oder Antibiotika für Infektionen. Eine unvorhergesehene Komplikation betraf jedoch den Grad, in dem BAPN die Inzisionswundheilung bei den Schweinen beeinträchtigte. Etwa 3 Wochen nach der Operation zeigten einige Schweine einen Zusammenbruch ihrer Schnitte mit gelegentlicher faszialer Dehiszenz, die eine Rücknahme zum Operationssaal zur Überarbeitung und Debridement erforderte. Eine sorgfältige Überwachung von Einschnitten nach der Operation sowie das Verschließen in mehreren Schichten wird empfohlen, um diese Komplikation zu verhindern.
Der kritische Teil der Operation beinhaltet die Cannulation von Aorta über die kaudale mesenterische Arterie, die aufgrund ihrer geringen Größe frustrierend sein kann. Die Verwendung von Mikropunktionsdrähten hat uns bei dieser Cannulation unterstützt. Dieser Schritt ist wichtig, da der Cannulationsdraht den Zugang zur Aorta für die Ballon- und Perfusionskanüle ermöglicht. Ballonangioplastie vor der Perfusion ist nach unserer Erfahrung von wesentlicher Bedeutung, da die Ballondilatation hypothetisch zu einer endothelialen Störung führt, die es der Elastaseperfusion ermöglicht, leichter in die Aortenmedien einzudringen. Eine angemessene Perfusion ist definiert als ein straffes Segment von Aorta ohne Leckoder oder Entweichen von Flüssigkeit um den Katheter oder aus der Aortenwand. Die Erreichung einer ausreichenden Perfusion der Elastase bei gleichzeitiger Begrenzung der gesamten Aortenkreuzklemmenzeit auf nicht mehr als 10 min ist für eine gute Aneurysmenbildung unerlässlich und gleichzeitig ischämische Komplikationen zu vermeiden. Die Begrenzung der gesamten Aortenkreuzklemmenzeit auf weniger als 20 min für das gesamte Verfahren und die Möglichkeit einer ausreichenden Zeit für die Reperfusion zwischen Ballondilatation und Elastaseperfusionen vermeidet die gefürchtete Spinalischämiekomplikation. Wenn keine ausreichende Durchblutung erzielt wird, liegt wahrscheinlich ein Leck irgendwo im durchlässigen Segment der Aorta vor, in der Regel eine unbeabsichtigte Aortotomie aus der Zerlegung oder retrograde Leck aus der Cannulationsstelle. Es ist von entscheidender Bedeutung, jeden Defekt im durchgedreten Segment zu beheben, um eine ausreichende Perfusion von Elastase zu ermöglichen. Eine Gefäßschleife kann nur proximal bis aortenkantimulationsstelle eingewickelt werden, um einen retrograden Fluss der Elastase zu verhindern. Jede Lendenarterie sollte auch während der Perfusion vorübergehend eingeklemmt werden, um zu verhindern, dass Die Elastase in den systemischen Kreislauf gelangt, was eine septische Reaktion bei den Schweinen verursachen kann.
Logische nächste Schritte für dieses Modell sind die Erprobung neuartiger Therapien für die medizinische Behandlung von AAA. Wie bereits erwähnt, gibt es keine bekannten medizinischen Therapien, um aortenartiges Aneurysmwachstum zu dämpfen oder zurückzudrängen, und die aktuelle definitive Versorgung beinhaltet offene chirurgische oder endovaskuläre Ansätze. Vorherige Studie hat die Rollen der proinflammatorischen Zytokine definiert, Interleukin-1 (IL-1) und Interleukin-6 (IL-6) in der Pathogenese von absteigenden thorakalen Aortenaneurysmen und AAA, und Hemmung dieser Rezeptoren kann potenzielle therapeutische Wege für die Behandlung dieser Krankheiten bieten17,18,19. Diese Studien wurden nur in murinen Modellen durchgeführt, so dass die nächsten Schritte große Tiermodelle umfassen sollten. Darüber hinaus ist ein großes Tier absteigende thorakakales Aortenaneurysm eine weitere Möglichkeit für zukünftige Studien. Aufgrund unterschiedlicher embryologischer Ursprünge gibt es inhärente Unterschiede in der Wandzusammensetzung der Thorax- und Bauchaorta, was zu einer unterschiedlichen Pathophysiologie der Aneurysmen in diesen beiden Segmenten20führt.
Es gibt einige Einschränkungen dieses Modells. Da mehrere Interventionen eingesetzt werden, ist es schwierig zu bestimmen, welche Intervention am meisten zur Aneurysmbildung beiträgt. Der Druck, der erforderlich ist, um ein ausreichend elastasedurchiertes Aortensegment zu erreichen, ist schwer zu messen und kann variieren. Dies könnte sich auf die Menge der Elastase auswirken, die in die Aortenmedien eintritt, und die anschließende Aneurysmusbildung von einem Schwein zum nächsten. Wir prüfen derzeit eine Strategie, um dieses Problem anzugehen. BAPN wurde mit der Schweinenahrung vermischt, und die Schweineaufnahme in der perioperativen Periode kann variieren, was die Mengen von BAPN pro Schweineaufnahme ändert. Schließlich erfordert dieses Modell viele Ressourcen und Investitionen, um erfolgreich zu sein. Dazu gehören Operationssäle, Chirurgen und Anästhesieanbieter, Tierhaltung, postoperative Pflege und Kauf von BAPN, die unerschwinglich teuer sein können. Jedes Labor sollte seine Ressourcen und Finanzierung sorgfältig bewerten, bevor es dieses Modell versucht.
Insgesamt, trotz bestimmter Einschränkungen, Schweine AAA mit Fortsetzungen der chronischen Krankheit kann reproduzierbar mit einer Kombination von BAPN, Ballon-Angioplastie, Elastase-Perfusion und topische Elastase Anwendung erstellt werden. Dies hat wichtige Auswirkungen auf die translationale Forschung, die auf menschliche Krankheiten anwendbar ist.
Offenlegungen
nichts
Danksagungen
Wir danken Anthony Herring und Cindy Dodson für ihr Wissen und ihr technisches Know-how.
Finanzierungsquellen:
Die Finanzierung dieser Studie wurde vom National Heart, Lung, and Blood Institute des National Institute of Health unter Dem Award No. T32HL007849 und Grant Nos. R01HL081629-07 (G.R.U.) und R01HL124131-01 (G.R.U.).
Materialien
| Name | Company | Catalog Number | Comments |
| Arrow Ergo Pack System | Arrow | CDC-21242-X1A | Just need 7 Fr dilator |
| Atlas PTA Balloon dilation catheter | Bard | AT-120184 | 16 mm x 4 cm x 120 cm |
| Bovie electrocautery | Bovie Medical | A2350 | |
| Collagenase Type 1 (5 gm) | Worthington | LS004196 | |
| Crile Needle drviers | MFI medical | 61-2201 | |
| DeBakey Atraumatic Forceps | MFI medical | 52-4977 | |
| DeBakey Peripheral Vascular Clamp | Medline | MDS1318119 | |
| Glidewire | Terumo Interventional Systems | GS3506 | outer Wire diameter 0.035 mm, Length 150 cm |
| GraphPad Prism 6 | GraphPad Software Inc. La Jolla, Calif) | statistical software | |
| Metzenbaum Scissors | MFI medical | 61-0004 | |
| Mayo-Hegar Needle Holder | tiger medical | N407322 | |
| Micropuncture Introducer Set | Cook | G47946 | |
| Mixter Forceps, Standard Grade, Right angle | Cole-Parmer | UX-10818-16 | |
| Monocryl suture | Ethicon | Y496G-BX | 4-0 monocryl |
| PDS II suture | Ethicon | D8926 | Number 1 looped |
| Porcine Pancreatic Elastase | Sigma-Aldrich | E1250 | |
| Satinsky Vascular Clamps | Medline | MDs5632515 | |
| Suction canister | Cardinal Health | 65651212 | |
| Schuco Aspirator | MFI medical | S430A | |
| Vicryl suture | Ethicon | J789D-SD | 2-0 vicryl |
| Yankauer Suction tube | Sklarcorp | 07-1801 |
Referenzen
- . Leading Causes of Death Reports, National and Regional, 1999 - 2016 Available from: https://webappa.cdc.gov/sasweb/ncipc/leadcause.html (2018)
- Erbel, R., et al. Diagnosis and management of aortic dissection. European Heart Journal. 22 (18), 1642-1681 (2001).
- Cameron, J., Cameron, J. . Current Surgical Therapy 11th edition. 11, 777-783 (2014).
- . Overview of abdominal aortic aneurysm Available from: https://www-uptodate-com.remotexs.ntu.edu.sg/contents/overview-of-abdominal-aortic-aneurysm (2017)
- Pearce, W. H., Zarins, C. K., Bacharach, J. M. Atherosclerotic Peripheral Vascular Disease Symposium II: controversies in abdominal aortic aneurysm repair. Circulation. 118 (25), 2860-2863 (2008).
- Daugherty, A., Cassis, L. A. Mouse models of abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 24 (3), 429-434 (2004).
- Anidjar, S., et al. Elastase-induced experimental aneurysms in rats. Circulation. 82 (3), 973-981 (1990).
- Hynecek, R. L., et al. The creation of an infrarenal aneurysm within the native abdominal aorta of swine. Surgery. 142 (2), 143-149 (2007).
- Lu, G., et al. A novel chronic advanced stage abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
- Barrow, M. V., Simpson, C. F., Miller, E. J. Lathyrism: a review. The Quarterly Review of Biology. 49 (2), 101-128 (1974).
- Coulson, W. F., Linker, A., Bottcher, E. Lathyrism in swine. Archives of Pathology & Laboratory Medicine. 87 (4), 411-417 (1969).
- McCallum, H. M. Experimental Lathyrism in Mice. The Journal of Pathology and Bacteriology. 89, 625-636 (1965).
- Behmoaras, J., et al. Differential expression of lysyl oxidases LOXL1 and LOX during growth and aging suggests specific roles in elastin and collagen fiber remodeling in rat aorta. Rejuvenation Research. 11 (5), 883-889 (2008).
- Davies, I., Schofield, J. D. Connective tissue ageing: the influence of a lathyrogen (beta-aminopropionitrile) on the life span of female C57BL/Icrfat mice. Experimental Gerontology. 15 (5), 487-494 (1980).
- Cullen, J. M., et al. A novel swine model of abdominal aortic aneurysm. Journal of Vascular Surgery. , (2018).
- Marinov, G. R., et al. Can the infusion of elastase in the abdominal aorta of the Yucatan miniature swine consistently produce experimental aneurysms. Journal of Investigative Surgery. 10 (3), 129-150 (1997).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Johnston, W. F., et al. Genetic and pharmacologic disruption of interleukin-1beta signaling inhibits experimental aortic aneurysm formation. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (2), 294-304 (2013).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), 51-59 (2014).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten