Method Article
High-Throughput DNA Plasmid Multiplexing und Transfektion mit akustischer Nanodispensing-Technologie
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Durchsatz-Plasmidtransfektion von Säugetierzellen in einer 384-Well-Platte mit akustischer Tröpfchenauswurftechnologie. Die zeitaufwändige, fehleranfällige DNA-Dosierung und Multiplexing, aber auch die Transfektionsreagenz-Dosierung, sind softwaregesteuert und werden von einem Nanospenderdurchgeführt ausgeführt. Die Zellen werden dann in diesen vorgefüllten Brunnen gesät.
Zusammenfassung
Die Zelltransfektion, die für viele biologische Studien unverzichtbar ist, erfordert die Kontrolle vieler Parameter für eine genaue und erfolgreiche Leistung. Am häufigsten bei geringem Durchsatz durchgeführt, ist es darüber hinaus zeitaufwändig und fehleranfällig, noch mehr beim Multiplexing mehrerer Plasmide. Wir haben eine einfache, schnelle und genaue Methode entwickelt, um die Zelltransfektion in einem 384-Well-Plattenlayout mit akustischer Droplet-Auswurf-Technologie (ADE) durchzuführen. Das in dieser Studie verwendete Nanodispenser-Gerät basiert auf dieser Technologie und ermöglicht eine präzise Nanovolumenabgabe bei hoher Geschwindigkeit von einer Quellbrunnenplatte zu einem Ziel. Es kann nach einer vorgefertigten Kalkulationstabelle DNA- und Transfektionsreagenz abgeben und multiplexieren. Hier präsentieren wir ein optimales Protokoll zur Durchführung einer ADE-basierten Hochdurchsatz-Plasmidtransfektion, die es ermöglicht, einen Wirkungsgrad von bis zu 90% und eine fast 100% Kotransfektion in Kotransfektionsexperimenten zu erreichen. Wir erweitern die anfängliche Arbeit, indem wir ein benutzerfreundliches, auf Tabellenkalkulationen basierendes Makro vorschlagen, das in der Lage ist, bis zu vier Plasmide/Brunnen aus einer Bibliothek mit bis zu 1.536 verschiedenen Plasmiden und eine Tablett-basierte Pipettieranleitung zu verwalten. Das Makro entwirft die erforderlichen Schablonen der/die Quellplatte(n) und generiert die gebrauchsfertigen Dateien für die Nanospender- und Tablet-basierte Anwendung. Das vierstufige Transfektionsprotokoll beinhaltet i) eine Verdünnungsmittelabgabe mit einem klassischen Flüssigkeitshandler, ii) Plasmidverteilung und Multiplexing, iii) eine transfektionspflichtige Reagenz, die vom Nanospender abgegeben wird, und iv) Zellbeschichtung auf den vorgefüllten Brunnen. Die beschriebene softwarebasierte Steuerung von ADE-Plasmidmultiplexing und -transfektion ermöglicht es auch Nicht-Spezialisten auf dem Gebiet, eine zuverlässige Zelltransfektion schnell und sicher durchzuführen. Diese Methode ermöglicht eine schnelle Identifizierung optimaler Einstellungen für einen bestimmten Zelltyp und kann auf höherskalige und manuelle Ansätze übertragen werden. Das Protokoll erleichtert Anwendungen, wie z. B. menschliches ORFeome-Protein (Satz offener Leserahmen [ORFs] in einem Genom) oder CRISPR-Cas9-basierte Genfunktionsvalidierung, in nicht gepoolten Screening-Strategien.
Einleitung
Die hier vorgestellte Methode beschreibt detailliert, wie DNA-Plasmidmultiplexing und -transfektion in Säugetierzellen bei hohem Durchsatz mit einem akustischen flüssigen Nanospender in einer 384-Well-Platte durchgeführt werden kann, selbst für Nicht-Spezialisten auf diesem Gebiet. Diese kürzlich veröffentlichte Methode1 ermöglicht die Durchführung von bis zu 384 unabhängigen Plasmid-DNA-Multiplex- und Transfektionsbedingungen in einem Experiment in weniger als 1 h. Einzel- oder Kotransfektionsexperimente waren erfolgreich und erreichten fast 100 % Kotransfektion innerhalb der Population der transfizierten Zellen. Dieses Protokoll erleichtert die Transfektion, da die meisten mühsamen, zeitaufwändigen und fehleranfälligen Schritte jetzt softwaregesteuert sind (eine allgemeine Übersicht siehe Abbildung 1). Es wurden weitere Anstrengungen unternommen, um spezielle Instrumente zu entwickeln, um die Benutzerfreundlichkeit zu verbessern und menschliche Fehler während des gesamten Prozesses zu vermeiden und eine erfolgreiche Transfektion auch für Nicht-Spezialisten auf diesem Gebiet zu fördern. Das beschriebene Protokoll enthält eine "benutzerfreundliche" Makrotabelle, die wir entwickelt haben, um 384 unabhängige Transfektionsbedingungen mit Multiplexing-Möglichkeiten von bis zu vier Plasmiden in jedem Brunnen zu verwalten. Das Makro generiert automatisch Vorlagen der Quellplatte(n), um das erwartete DNA-Plasmidvolumen vom Start von Bestandslösungen und die Dateien zu laden, die erforderlich sind, um die Nanodispenser-Software nach dem eingegebenen experimentellen Design anzutreiben. Da die manuelle Abgabe von DNA in einer 384-Well-Quellplatte mühsam und fehleranfällig ist, haben wir auch eine spezielle Tablet-basierte Anwendung entwickelt, um den Benutzer zu führen und gleichzeitig dna-Lösung entsprechend der Vorlage zu dosieren.
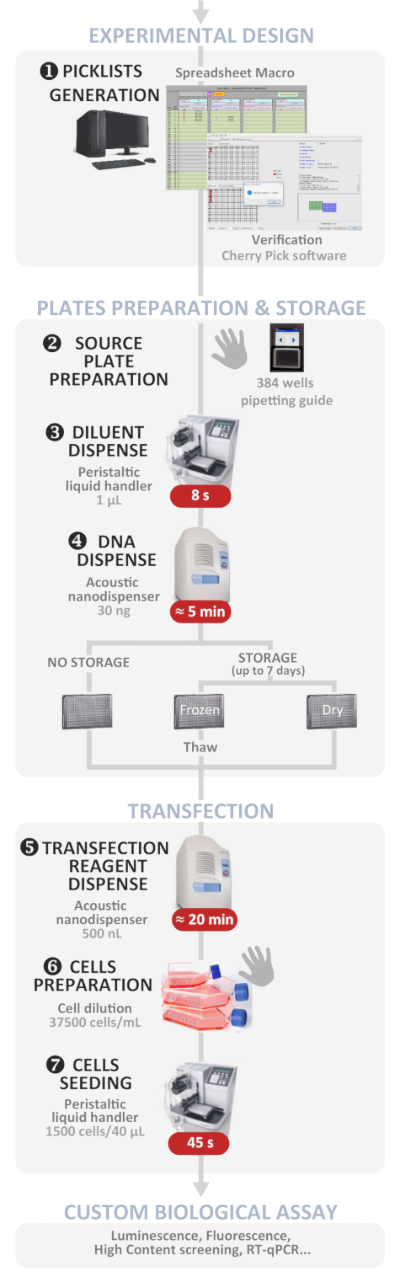
Abbildung 1: Experimenteller Workflow. Schematische Darstellung des optimalen automatisierten Hochdurchsatz-Reverse-Transfektionsprotokolls (vom experimentellen Design bis zum benutzerdefinierten biologischen Assay). Manuelle Schritte werden durch das Handsymbol angezeigt und die ungefähre Zeit für jeden Schritt ist in ein rotes Feld geschrieben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Viele zellbasierte Experimente beginnen mit der Plasmid-DNA-Transfektion, und selbst wenn viele dedizierte Reagenzien entwickelt wurden und werden, um die Transfektionseffizienz zu verbessern und/oder das Verfahren zu erleichtern, bleibt noch viel zu tun2,3 , 4. DNA-Plasmid-Zell-Transfektion umfasst mehrere Schritte, um eine hohe Effizienz zu erreichen, wie eine anfängliche komplexe Aufnahme, endosomale Flucht und zytoplasmatischen Transport zum Kern5,6. Neben Kalziumfällung oder physikalischen Techniken wie Elektroporation oder Mikroinjektion mit speziellen Geräten7haben sich moderne chemische Methoden auf die Verbesserung der DNA-Zell-Entbindung konzentriert und gleichzeitig die Zellzytoxizitätgesenkt 8, 9. Die Verwendung von Lipiden oder kationischen Polymeren, die liposomeähnliche Komplexe bilden, und in jüngerer Zeit nichtliposomaler polymerer Chemiesysteme hat die Transfektion einfacher und effizienter gemacht10. Trotz dieser Entwicklungen erfordert die Zelltransfektion immer noch spezifische Fähigkeiten, die genau ausgeführt werden müssen, da die meisten dieser physikalischen oder chemischen Transfektionsprotokolle von Wissenschaftlern verlangen, jeden DNA-Transfektionsreaktionszustand manuell vorzubereiten. den Durchsatz zu beeinträchtigen. Um dieses Problem zu umgehen, wurden Reverse-Transfektionsprotokolle mit chemischen Transfektionsreagenzien11,12,13entwickelt, die es dem Anwender ermöglichen, mehrere Plasmide schneller zu testen oder zu kombinieren. In diesen Protokollen werden Nukleinsäurekomplexe mit Transfektionsreagenzien gebildet, bevor die Zellen auf den Komplexen gesät werden. Diese Reverse-Protokolle sind jedoch nach wie vor durch den manuellen Umgang mit DNA-Lösungen und durch die Kombination der einzelnen unabhängigen Bedingungen begrenzt. Obwohl es machbar ist, sie in einem 96-Well-Plattenformat durchzuführen, wird die DNA-Vorbereitung und die Abgabe mühsam sein, und es wird wahrscheinlich Fehler geben. Wenn unterschiedliche Mengen von mehreren DNA-Plasmiden erforderlich und miteinander multiplexiert werden, wird die Zelltransfektion noch schwieriger zu erreichen und zeitaufwändiger, und menschliche Fehler werden unvermeidlich. Die Skalierung auf das 384-Well-Plattenformat in einem umgekehrten Transfektionsansatz wird trotz weniger multiplexierter DNA-Transfektionsbedingungen aus folgenden Gründen zu einer unmöglichen Herausforderung. i) Die zu verwaltenden DNA-Mengen, Transfektionsreagenz oder Reaktionsgemischvolumina sind für jeden Brunnen weniger als 1 L. ii) Das Multiplexing von Plasmiden für 384 unabhängige Erkrankungen wird extrem kompliziert. Die Lieferung in jeder der 384 Brunnen ist auch iii) sehr zeitaufwändig und iv) fehleranfällig. Tatsächlich ist es schwierig, die richtige Lösung in den erwarteten Brunnen zu verteilen, da die bereits ausgegebenen geringen Volumina keine visuelle Überwachung zwischen den leeren und bereits gefüllten Brunnen ermöglichen. v) Schließlich besteht ein hohes Risiko, das Gemisch durch Verdunstung zu trocknen, bevor die Zellen hinzugefügt werden, da die für die Durchführung der erforderlichen Dosierschritte erforderlichen Zeit benötigt wird. Zusammenfassend scheint der begrenzende Faktor für die Einrichtung von DNA-Plasmid-Transfektions-Assays mit hohem Durchsatz die Miniaturisierung des Assays zu sein, was ein Low-Volume-Multiplexing und -Management impliziert, das nicht mehr manuell behandelt werden kann, aber auch in einem zuverlässigen Weg durch klassische peristatische Flüssigkeitshandler.
Als Beweis für die Schwierigkeit, solche Tests zu automatisieren und einen hohen Durchsatz zu erzielen, wurden bisher nur wenige Versuche zur Automatisierung der Transfektion veröffentlicht: ein 96-Well-Plattenformat mit einem kommerziellen Flüssigkeitshandhabungsgerät und Calciumphosphatniederschlag14 und in jüngerer Zeit ein Lipoplex-Reagenz und ein mikrofluidischer Chip, der 280 unabhängige Transfektionen15 ermöglicht, aber spezielle Fähigkeiten in diesem Bereich erfordert. Eine andere Methode, die Acoustophorese, die eine Flüssigkeitsschwebe ermöglicht und zu Flüssigkeitsmanipulation und -mischung führt, wurde verwendet, um DNA-Transfektion in 24- bis 96-Well-Plattenformaten16durchzuführen. Obwohl dieser Ansatz machbar ist, leidet er unter einem extrem niedrigen Durchsatz, da das Mischen von Zellen mit DNA-Transfektionsgemisch eine Inkubation von 60 s für jeden einzelnen Punkt vor der Aussaat erfordert. Dies bedeutet eine Dauer von mindestens 96 min für eine komplette 96-Well-Platte. Darüber hinaus ist dieses Protokoll weit davon entfernt, dem Publikum der Biologen zugänglich zu sein, da diese Arbeit mit einem eigens entwickelten und hergestellten Gerät durchgeführt wurde, das derzeit nicht auf dem Markt erhältlich ist. Im Gegenteil, in den letzten Jahren ist mit Nanovolumen-Dispenser-Geräten eine einfach zu bedienende softwaregesteuerte akustische Dosiertechnologie entstanden. Mit fokussierter akustischer Energie ermöglichen diese Geräte den streng kontrollierten Auswurf kleiner Flüssigkeitsvolumina von 2,5 nL bis 500 nL von einer Quellplatte zu einem Ziel17. Diese Technologie, die als akustischer Tröpfchenauswurf (ADE) bezeichnet wird, hat zahlreiche Vorteile: Sie ist vollautomatisiert, berührungslos, spitzenlos, präzise, präzise und hoch reproduzierbar und hat einen hohen Durchsatzvon 18. Zuerst für die Lieferung von Dimethylsulfoxid (DMSO) Lösungen gewidmet, wurden die Einstellungen verbessert, um wässrige Puffer zu verteilen19. Akustische Nanospender scheinen daher für Reverse-Zell-Transfektionsprotokolle geeignet zu sein und könnten die meisten der oben genannten manuellen Einschränkungen umgehen. Da bisher keine Plasmidtransfektionsversuche mit dieser Technologie beschrieben wurden, haben wir kürzlich die Eignung eines akustischen Dosiersystems für die Durchführung von Reverse-Zell-Transfektionen bewertet.
Unter Ausnutzung des Nanodispensers-Durchsatzes und der Benutzerfreundlichkeit optimierten wir ein Reverse-Transfektionsprotokoll für HeLa-Zellen, indem wir mehrere Parameter kreuztesten, die die DNA-Transfektion auf einer 384-Well-Einzelplatte beeinflussen können, nämlich die gesamte DNA-Menge und Dna-Ausgangskonzentration, Verdünnungsvolumen, Transfektionsreagenz und Anzahl der Streuzellen. Das entwickelte Protokoll umgeht die oben beschriebenen manuellen Einschränkungen der Zelltransfektion und bietet mehrere Vorteile gegenüber anderen automatisierten Transfektionsversuchen. Erstens wird es miniaturisiert, wodurch ein kostengünstiges Transfektionsreagenz durch Speichern von DNA-Plasmidpräparaten und Transfektionsreagenz ermöglicht wird. Zweitens ist es viel mehr durchsatzfähig und reproduzierbar als das manuelle Protokoll (auch für Anfänger), da die Transfektion einer ganzen 384-Well-Platte in weniger als 1 h erreicht werden kann. Schließlich ist es softwaregesteuert, so dass die Kontrolle der abgegebenen DNA-Menge und die Multiplexing von mehreren Plasmiden. Dank der Nanodispenser-Software (Table of Materials) kann der Anwender einen Studienplan ausarbeiten, um die Volumina zu steuern, die von einer definierten Quellbrunnenplatte zu einem Zielschild abgegeben werden sollen.
Das hier vorgestellte Protokoll richtet sich vor allem an diejenigen, die Zugang zu einem Nanospender haben und Transfektionsexperimente mit hohem Durchsatz einrichten möchten, aber auch für diejenigen, die ihre Transfektionsparameter für einen bestimmten Zelltyp schnell optimieren möchten, Anwendung dieses Protokolls, um mehrere Parameter bei hohem Durchsatz zu kreuztesten. Tatsächlich haben wir gezeigt, dass optimierte Parameter, die mit diesem nanoskaligen Protokoll identifiziert wurden, auf größere und manuelle Transfektionsexperimente übertragen werden können. Da das im vorliegenden Protokoll verwendete Transfektionsreagenz dna- oder siRNA-Transfektion nach Angaben des Herstellers zulässt, ist das Protokoll auch für diejenigen von Interesse, die Array-Ansätze für Genüberexpression oder Knockdown durchführen wollen. Die mit DNA vorgefüllten Zielplatten können bis zu 7 Tage vor der Anwendung in einem Transfektionstest ohne Wirksamkeitsverlust konserviert werden, was ein weiterer Vorteil des folgenden Protokolls für diese Art der Anwendung ist.
Protokoll
1. Vorarbeiten
- Vorbereitung der peristaltischen Flüssigkeitshandlerprogramme
HINWEIS: Für die Verdünnungs- und Zelldosierschritte des Protokolls muss ein spezielles Programm vorbereitet werden, das die Höhe des Dosierkopfes an der verwendeten Platte und die Schrittabsicht berücksichtigt.- Montieren Sie für den Verdünnungsgang 1 l eine 1-L-Kassette und bereiten Sie ein Programm mit den Einstellungen gemäß den Schritten 1.1.1.1 und 1.1.1.2 vor.
- Passen Sie den Durchflussparameter auf Hoch für den besten Durchsatz an, da in diesem Schritt kein schaden biologischer Wert zu erwarten ist. Stellen Sie die Dosierhöhe auf 9,6 mm ein (entsprechend der verwendeten Zellkulturplatte, Zusatzabbildung 1), damit der Tropfen 1 L während der Dispensation den Boden der Brunnen berührt.
HINWEIS: Dieser Schritt ist entscheidend, um die Retention der Tröpfchen auf dem Dosierkopf zu vermeiden, bis ein ausreichendes Volumen zum Ablegen erreicht ist. - Stellen Sie die Plattensichthöhe auf 14,4 mm ein, um nach dem Dosieren jeder Reihe eine freie Verschiebung des Dosierkopfes über die Platte zu ermöglichen. Visuelle Kontrolle der richtigen Einstellungen der peristaltischen Flüssigkeitshandler Kopfhöhe: Stellen Sie sicher, dass keine Tropfen auf den Dosierspitzen während der Abgabe zurückgehalten werden und überprüfen Sie, ob der Kopf hoch genug ist, um eine Verschiebung des Kopfes nach dem Dosieren jeder Reihe zu ermöglichen.
HINWEIS: Die Vermeidung der Fallretention ist ein entscheidender Parameter, da er die Genauigkeit des Volumens der Dispensation beeinträchtigt.
- Passen Sie den Durchflussparameter auf Hoch für den besten Durchsatz an, da in diesem Schritt kein schaden biologischer Wert zu erwarten ist. Stellen Sie die Dosierhöhe auf 9,6 mm ein (entsprechend der verwendeten Zellkulturplatte, Zusatzabbildung 1), damit der Tropfen 1 L während der Dispensation den Boden der Brunnen berührt.
- Für die Abgabe der 40-L-Zellaufhängung eine 10-L-Kassette montieren und ein Programm mit den in den Schritten 1.1.2.1-1.1.2.2 beschriebenen Einstellungen vorbereiten.
- Passen Sie den Durchflussparameter auf Niedrig an, um Zellen mit einer niedrigen Geschwindigkeit zu verzichten, um potenzielle Schäden an den Zellen durch Scherspannung und hohe Auswirkungen auf den Boden der Brunnen zu vermeiden. Stellen Sie die Dispensationshöhe auf 11,43 mm (entsprechend der verwendeten Zellkulturplatte, Zusatzfigur 1), hoch genug, um den Zelleinfluss auf den Boden der Brunnen während des Dosierprozesses zu senken, aber niedrig genug, um eine Retention der Tröpfchen auf dem Dosierkopf. Stellen Sie die Plattenklarheitshöhe auf 16 mm ein, um eine freie Verschiebung des Dosierkopfes über die Platte nach dem Dosieren jeder Reihe zu ermöglichen.
- Visuelle Kontrolle der richtigen Einstellungen der peristaltischen Flüssigkeitshandler Kopfhöhe: Stellen Sie sicher, dass keine Tropfen auf den Dosierspitzen während der Abgabe zurückgehalten werden und überprüfen Sie, ob der Kopf hoch genug ist, um eine Verschiebung des Kopfes nach dem Dosieren jeder Reihe zu ermöglichen.
HINWEIS: Die Vermeidung der Drop-Retention ist ein entscheidender Parameter, da er zur Ausgabe einer unzuverlässigen Zellnummer führt.
- Montieren Sie für den Verdünnungsgang 1 l eine 1-L-Kassette und bereiten Sie ein Programm mit den Einstellungen gemäß den Schritten 1.1.1.1 und 1.1.1.2 vor.
- DNA-Plasmid-Präparation (klassisches Miniprep-Extraktionsprotokoll)
- Wachsen Sie einen transformierten DH5-Bakterienstamm in LB-Medium, ergänzt durch 125 g/ml Ampicillin-Auswahl-Antibiotikum (Materialtabelle) über Nacht bei 37 °C und unter sanfter Erregung (200 U/min) auf einem Orbital-Shaker (Tisch aus Materialien).
- 2 ml der Kultur ernten, die Zellen durch Zentrifugieren für 5 min bei 6.000 x gpellet und den Überstand entsorgen.
- Setzen Sie das Zellpellet mit 250 L Resuspensionspuffer, der RNase A (Materialtabelle )enthält, wieder auf. Fügen Sie 250 l Lysepuffer hinzu und brüten Sie 5 min bei Raumtemperatur, gemäß den Anweisungen des Herstellers.
- Beenden Sie die Lyse-Reaktion, indem Sie 300 L Neutralisationspuffer (Materialtabelle) hinzufügen und in Kürze vortexten. Zentrifugieren Sie die Rohre für 5 min bei 11.000 x g.
- Legen Sie eine neue Plasmid-Minisäule (Materialtabelle) in ein 2 ml-Sammelrohr und dekantieren Sie den Überstand in der Spalte durch Zentrifugieren für 1 min bei 11.000 x g.
- Entsorgen Sie den Durchfluss und legen Sie die Minisäule wieder in das Sammelrohr.
- Waschen Sie die Plasmid-Minisäule mit 500 l optionalem Waschpuffer (Materialtabelle) und Zentrifuge für 1 min bei 11.000 x g, gemäß den Anweisungen des Herstellers.
- Entsorgen Sie den Durchfluss und legen Sie die Plasmid-Minispalte wieder in das Sammelrohr.
- Fügen Sie 700 l Waschpuffer(Materialtabelle) mit Ethanol und Zentrifuge für 1 min bei 11.000 x gergänzt, nach den Anweisungen des Herstellers.
- Entsorgen Sie den Durchfluss und zentrieren Sie die Plasmid-Minisäule und ihr Sammelrohr 1x mehr für 2 min bei 11.000 x g, um die Kieselsäuremembran zu trocknen.
- Die getrocknete Plasmid-Minisäule in ein neues 1,5 ml-Rohr geben und 30 l destilliertes Wasser bei 60 °C vorwärmen, 2 min bei Raumtemperatur inkubieren und dann 1 min bei 11.000 x gzentrieren.
- Entsorgen Sie die Plasmid-Minispalte und bewahren Sie das Eluat, das das gereinigte DNA-Plasmid enthält.
- Messen Sie die DNA-Konzentration der eluierten DNA mit einem Mikrovolumenspektrophotometer (Materialtabelle).
- Schalten Sie das Spektralphotometer ein und wählen Sie die DNA-Messeinstellungen aus.
- Heben Sie den Probenahmearm des Spektralphotometers und der Pipette 1 L Wasser auf den Messsockel, um eine leere Kalibrierung durchzuführen.
- Senken Sie den Probenahmearm, starten Sie die Leermessung, und warten Sie auf den Abschluss.
- Heben Sie den Probenahmearm an und wischen Sie die Probe von den oberen und unteren Sockeln ab.
- Pipette 1 l der DNA-Lösung auf den unteren Sockel, um es zu messen.
- Senken Sie den Probenahmearm, starten Sie die DNA-Konzentrationsmessung und warten Sie auf die Fertigstellung.
- Heben Sie den Probenahmearm an und wischen Sie die Probe von den oberen und unteren Sockeln ab.
- Für weitere DNA-Konzentrationsmessungen wiederholen Sie die Schritte 1.2.13.5-1.2.13.7.
- Sobald die Messungen abgeschlossen sind, lagern Sie die DNA-Lösungen bei 4 °C bis zum Gebrauch.
2. Experimentelles Design und Generierung der Picklists zur Antrieb der ADE-basierten Dispense
HINWEIS: Ein spezielles "benutzerfreundliches" Tabellenmakro wurde entwickelt, um DNA-Mengen zu verwalten und bis zu vier Plasmide in einem 384-Well-Plattenformat zu mischen. Basierend auf dem eingegebenen experimentellen Design generiert dieses Makro die notwendigen Dateien, um das ADE-basierte DNA-Transfektionsprotokoll per Nanodispenser zu fahren. Um diese Dateien zu generieren, müssen mehrere Felder im Vorlagenblatt ausgefüllt werden, wie in Abbildung 2dargestellt.

Abbildung 2 : Generierung der Auswahllisten, um die ADE-Dispensation mithilfe des Tabellenkalkulationsmakros zu verwenden. Es müssen mehrere Parameter gefüllt werden, nämlich (1) das Transfektionsreagenz (TR) und die in der Quellplatte zu verwendenden minimalen/maximalen Volumina, (2) die anfänglichen Plasmidkonzentrationen, die in der Quellplatte abgegeben werden sollen, und (3) die Vollplatten-Design, einschließlich der erwarteten Plasmidmengen und Multiplexing in jedem der 384-Wells. (4) Die Aktivierung von Picklists generieren ermöglicht die Überprüfung der verschiedenen Felder und nach ordnungsgemäßer Befüllte werden automatisch Picklists für DNA- und TR-Dispensation und die notwendige Quellplattenvorlage generiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Geben Sie die Parameter des Nanodispenser-Protokolls in den rosa Feldern ein. Stellen Sie den Transfektionsreagenz (TR)-Gemischwert auf 500 nL ein. Stellen Sie den minimalen Volumenwert in den Quellplattenbrunnen auf 4 l. Stellen Sie das maximale Volumen in den Quellplattenbohrungen auf 11,25 l ein.
HINWEIS: Der hier verwendete Nanospender kann nur maximal 500 nL in einem ADE-Lauf übertragen. Diese rosa Felder werden mit den empfohlenen Werten vorgefüllt, können aber entsprechend den Benutzeranforderungen geändert werden. - Geben Sie 100 ng/l DNA-Ausgangskonzentrationen in die blauen Felder ein, die der zugrunde liegenden DNA entsprechen.
HINWEIS: Dieser Wert ist die zuvor definierte optimale Konzentration, kann jedoch für unterschiedliche Benutzeranforderungen geändert werden. - Geben Sie die gewünschte DNA-Menge in den grau/grünen Feldern ein. Geben Sie die Mengen und Plasmidnamen für die 384 Brunnen ein, um die gleiche Schreibweise zu gewährleisten, wenn dasselbe Plasmid in mehreren Brunnen verwendet wird.
- Generieren Sie das Quellplattendesign, die Auswahllistendateien und die Pipettierführungsdatei. Klicken Sie auf Picklists generieren, damit das Makro die Dateien DNA-Picklist.csv, T.R.-Picklist.csv und 384-Wells-Pipetting-Guide.csv aus Daten generieren kann, die auf dem entsprechenden Blatt gesammelt wurden. Korrigieren Sie auf Wunsch die orange gefüllten Zellenwerte, da sie auf Fehler oder Volumes hinweisen, die vom Nanospender nicht verarbeitet werden können.
- Drucken Sie die Schablone(n) aus dem Blatt "Quellplatte". Plasmidnamen und minimales Volumen zum Ausfüllen der Brunnen sind angegeben. Ebenso werden Transfektionsreagenz-Mischungsvolumina, die als nächstes in den folgenden Brunnen gefüllt werden müssen, als TR angegeben und grün hervorgehoben.
3. DNA-Quellenplattenvorbereitung mit der 384-Well-Pipettieranleitung
- Verdünnen Sie das gespeicherte DNA-Plasmid von Schritt 1.2.14 auf 100 ng/L mit destilliertem Wasser.
- Kalibrieren Sie das 384-Well-Raster auf die Plattenabmessungen: Öffnen Sie die 384-Well-Pipettierführung auf einer Tablette (Abbildung 3). Platzieren Sie die Quellplatte auf dem Raster auf dem unteren Bildschirm, und im oberen linken Kalibrierungsmenü klicken Sie auf + oder - (oder verwenden Sie den roten Cursor), um die Größe des Gitters und der Brunnen zu verbessern oder zu verkleinern, um die grünen Brunnen an die vier Eckbrunnen der Platte anzupassen. .

Abbildung 3 : Verwendung der 384-Well-Pipettieranleitung. (1) Kalibrierung des 384-Well-Gitters auf die Plattengröße; (2) ) Montage eines universellen 3D-gedruckten Plattenadapters auf der Tablette mit doppelseitigem Klebeband; (3) Platzierung der Platte auf dem Adapter; (4) Verschiebung des Gitters, um es auf die montierte Platte zu zentrieren. (5) Sperren des Kalibrierschritts. (6) Öffnen der Datei 384 wells pipetting guide.csv. (7) In Anblick der Aktenliste gibt die Anmeldung den voraussichtlichen Quellschildnamen, das Reagenz (DNA oder Transfektionsreagenz), die Konzentration und das Volumen an, das nacheinander in die Zielbrunnen abgegeben wird. (8) Die Pfeiltasten nach links und rechts ermöglichen es dem Benutzer, der Pipettieranleitung zu folgen, um die Reagenzien einfach gemäß der Tabellenkalkulation Makro-Quellplatten-Vorlage(n) zu verteilen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Montieren Sie mit doppelseitigem Klebeband den 3D-gedruckten Plattenadapter auf dem Bildschirm, um Quellplattenbewegungen während der Abgabe zu vermeiden. Verschieben Sie bei Bedarf das kalibrierte Raster mit den Drehpfeilen und den Schaltflächen Nach oben/ unten/ rechts/links, um das Raster auf dem Bildschirm an die Plattenposition anzupassen. Sobald das Raster und die Brunnengrößen richtig kalibriert und lokalisiert sind, aktivieren Sie das Sperrkalibrierungsfeld.
- Klicken Sie auf FILE und öffnen Sie die Datei 384 wells pipetting guide.csv. Befolgen Sie die Bildschirmanweisungen, um das angegebene Volumen des angegebenen Plasmids bei der angegebenen Konzentration in dem weiß hervorgehobenen Brunnen, der dem richtigen Zielder der erwarteten Platte entspricht, manuell abzugeben. Verwenden Sie - oder + Pfeile, um zurück oder weiter in den DNA-Dosierprozess zu gehen. Beenden Sie die Abgabe, wenn Sie die erste transfektionspflichtige Reagenzlösung zum Laden erreichen.
- Sobald die DNA-Dosierungen abgeschlossen sind, entfernen Sie die Quellplatte aus dem Adapter. Wenn mehrere Quellplatten gefüllt werden müssen, legen Sie eine neue Quellplatte auf den Adapter und folgen Sie den Dosieranweisungen. Zentrifugieren Sie nach Beendigung der DNA-Dispensation die DNA-gefüllten Quellplatten (bei 1.500 x g für 2 min), um eine ordnungsgemäße Flüssigkeitsnivellierung zu gewährleisten und Blasen zu entfernen, die zu Ungenauigkeiten bei den ADE-basierten Übertragungen führen.
4. Peristaltische Flüssigkeitshandler-basierte 1 l Verdünnungsdisdosierung in der Zielplatte
HINWEIS: Führen Sie die Schritte 4.1-4.5 in einem biologischen Sicherheitsschrank aus.
- Desinfizieren Sie den 1 l Kassettenkopf, indem Sie ihn mit einem Sprühdesinfektionsmittel (Materialtabelle )besprühen, und lassen Sie diese Lösung in den Spitzenhalter gelangen. Absorbieren Sie das Restdesinfektionsmittel auf absorbierendem Papier. Montieren Sie die 1-L-Kassette auf dem peristaltischen Flüssigkeitshandlergerät. Schalten Sie das Gerät ein und stellen Sie sicher, dass die Einstellung für den Kassettentyp korrekt ist (1 L), sowie das Plattenformat (384 Brunnen).
- Desinfizieren Sie das gesamte Lumen der Schläuche: Legen Sie den Rohrorganisator (die acht Röhren zusammen) in ein steriles Gefäß ein und füllen Sie ihn mit 5 ml 70% Alkohol. Mit der Grundierfunktion des peristaltischen Flüssigkeitshandlers den Alkohol zunächst in den Schläuchen spülen und dann durch 5 ml destilliertes Wasser und 5 ml serumfreies Medium (Dulbeccos modifiziertes Adlermedium [DMEM] ergänzt mit 100 U/ml Penicillin-Streptomycin; Tabelle des Materials), sukzessive Füllung in dem gleichen Behälter. Stellen Sie sicher, dass keine der Spitzen verstopft ist, indem Sie den Flüssigkeitsfluss von allen visuell überprüfen.
- Den Schlauch mit serumfreiem Medium grundieren, indem Sie ein neues steriles Gefäß mit 10 ml vorgewärmtem serumfreiem Medium füllen und den Röhrenorganisator darin tauchen. Drücken Sie die Prime-Taste des peristaltischen Flüssigkeitshandlers für ca. 10 s. Stellen Sie erneut sicher, dass keine Spitze verstopft ist, indem Sie den Flüssigkeitsfluss von allen visuell überprüfen.
- Füllen Sie die Platte mit 1 l Verdünnungsmittel. Legen Sie eine sterile 384-Well-Kulturplatte (Ziel) auf den peristaltischen Flüssigkeitshandler-Plattenträger und entfernen Sie ihren Deckel.
- Führen Sie das vorkalibrierte Programm aus, um in jedem Brunnen der 384-Well-Platte 1 L zu verteilen. Die Dosierzeit beträgt ca. 8 s. Dann den Deckel der 384-Well-Platte austauschen.
HINWEIS: Alternativ kann dieser Schritt manuell in einem Sicherheitsschrank mit einer Mehrkanal-Mikropipette behandelt werden.
5. Durchführung einer Erhebung zur Steuerung der manuell abgegebenen Volumina
HINWEIS: Weitere Informationen finden Sie in Abbildung 4.
- Führen Sie das Nanodispenser-Programm aus, gehen Sie zur Diagnose-Registerkarte, markieren Sie das Quellschild Out-Box, laden Sie die Quellplatte auf den Plattenhalter und kreuzen Sie Ein, um die Platte einzugeben. Wenn Sie dazu aufgefordert werden, wählen Sie 384LDV_AQ_B2 aus, um den Nanodispenser auf den wässrigen Pufferausgabemodus festzulegen, und drücken Sie Ok.
- Wählen Sie Umfrage im Menü Verschiedenes und klicken Sie auf Start. Wählen Sie die vorgefüllten Brunnen aus, um sie zu analysieren, und klicken Sie auf die Schaltfläche Gehen. Stellen Sie sicher, dass die gemessenen Volumes mit den erwarteten übereinstimmen, und stellen Sie sicher, dass keine Brunnen mit Volumes von mehr als 12 L beladen wurden, da dies Übertragungen vermeidet.
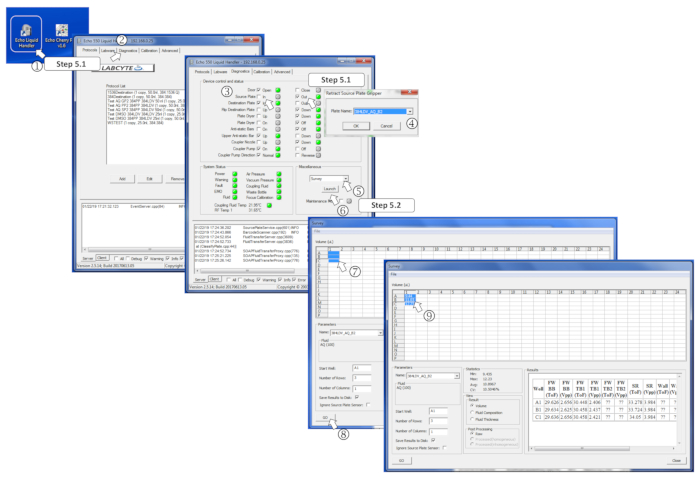
Abbildung 4 : Definieren der Parameter der Umfragesoftware. (1) Starten Sie das Nanodispenser-Programm. (2) Öffnen Sie die Registerkarte Diagnose. (3) Fügen Sie die Quellplatte ein, indem Sie für die Quellplatte ausklicken und dann In. (4) Definieren Sie den Quellplattentyp im Menü, wenn Sie dazu aufgefordert werden. (5) Wählen Sie im Feld Verschiedenes im Dropdown-Menü Umfrage aus. (6) Starten Sie das Umfrageprogramm, indem Sie auf Launchklicken. (7) Wählen Sie die zu messenden vorgefüllten Brunnen aus. (8) Starten Sie die Analyse, indem Sie auf Go klicken. (9) Sobald die Erhebung durchgeführt ist, werden die gemessenen Volumina in die entsprechenden ausgewählten Brunnen geschrieben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. ADE-gesteuerte DNA-Dispensation in die Zielplatte
- Führen Sie die Picklist-Software aus, stellen Sie die 384-Well-Quell- und Zielplattentypen auf 384_LDV bzw. Greiner 384PS_781096 (Abbildung 5) ein. Stellen Sie das Gerät auf den wässrigen Pufferdosiermodus ein, indem Sie 384LDV_AQ_B2auswählen und "Transferdurchsatz optimieren" deaktivieren.

Abbildung 5 : Leistung der Picklist-basierten Dispensationen. (1) Starten Sie die Nanodispenser-Software. Wählen Sie auf der Registerkarte Protokoll (2) das Probenplattenformat aus, (3) den Zielplattentyp und (4) wird "Transferdurchsatz optimieren" abgehakt. (5) Wählen Sie die Registerkarte Pick List. (6) Klicken Sie auf Importieren und wählen Sie die richtige *.csv-Datei (DNA-PickList oder T.R.-Picklist). (7) Sobald sie ausgewählt ist, klicken Sie auf Importieren. (8) Klicken Sie auf Play und speichern Sie das Protokoll. (9) Führen Sie eine Dispensationssimulation durch, indem Sie auf Simulierenklicken, oder (10) Starten Sie die programmierte Dispensation, indem Sie auf Ausführenklicken. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Wählen Sie die Registerkarte "Auswahlliste", klicken Sie auf Importieren, wählen Sie die Datei DNA-Picklist.csv aus. Klicken Sie auf Spielen und speichern Sie das Protokoll. Klicken Sie auf Simulieren, um eine Simulation der programmierten Dispensationen durchzuführen, um sicherzustellen, dass die Auswahlliste dem erwarteten experimentellen Entwurf entspricht. Sobald Sie fertig sind, klicken Sie auf Schließen.
- Klicken Sie auf Play, und dann Run, um das Dosierprogramm zu starten: Legen Sie auf Anfrage die gewünschte Quellplatte (DNA-Lösungen manuell gefüllt) und die Zielplatte (verdünnt gefüllt) in den Nanospender ein.
ANMERKUNG: Die Dosierzeit beträgt ca. 5-20 min für eine komplette 384-Well-Platte, abhängig von den ausgewählten Volumina und der Gesamtzahl der Dispensationen im experimentellen Design. - Alternativ können Sie hier das Protokoll anhalten, da die verdünnten und DNA-gefüllten Platten trockene oder gefrorene Lagerung für bis zu 7 Tage verarbeiten können. Für die trockene Lagerung die Platten bei Raumtemperatur auf der Bank trocknen lassen und dann auf die gleiche Weise lagern. Tauen und Zentrifuge (bei 1.500 x g für 2 min) gefrorene gelagerte Platten vor der Verwendung in einem Transfektionsschritt (Abschnitt 7).
7. ADE-gesteuerte Transfektionsreagenzdispensation
- In einem Biosicherheitsschrank wird das lipopolyplextransfektionspflichtige Reagenz in serumfreiem Medium extemporiert bis zu einer 1x Endkonzentration verdünnt. Vortex und geben Sie diese Transfektionsreagenzmischung sofort gemäß den vordefinierten Quellplatten, die vom Makro entworfen wurden, und unter Verwendung der vorkalibrierten 384-Well-Pipettierführungsanwendung, wie in Schritt 3.4 beschrieben.
HINWEIS: Zentrieren Sie die Quellplatte nicht, sobald sie mit dem Reagenz beladen ist, da nach der Zentrifugation keine Transfektion festgestellt wird. - Führen Sie das Nanodispenser-Programm aus, um eine "Vermessung" durchzuführen, wie in Abschnitt 5 beschrieben, um die Volumina aller manuell gefüllten TR-Bohrungen der Quellplatte(n) zu steuern, um Dosierfehler aufgrund von Volumen von mehr als 12 l zu vermeiden.
- Klicken Sie auf Zurücksetzen, um die Beispielliste der DNA-Auswahlliste in der Auswahllistensoftware zu löschen, und stellen Sie sicher, dass die Geräteparameter weiterhin auf wässrige Puffer und auf die verwendeten Quell- und Zielplattentypen eingestellt sind, wie in Schritt 6.1.
- Klicken Sie auf Importieren und wählen Sie die Datei TR-Picklist.csv. Klicken Sie auf Spielen und speichern Sie das Protokoll, wenn Sie dazu aufgefordert werden, und (dies wird optional empfohlen), führen Sie eine Simulation der programmierten Transfektionsreagenz-Mischungsdosierungen durch, um eine ordnungsgemäße Gestaltung der Dispensationen zu gewährleisten, indem Sie auf die Simulieren Sie die Schaltfläche. Sobald Sie fertig sind, klicken Sie auf Schließen.
- Klicken Sie auf Play, und dann die Schaltfläche Ausführen, um das Dosierprogramm zu starten: Legen Sie wie gewünscht die Quellplatte(n) (TR-Mischung gefüllt) und die Zielplatte (verdünnt und DNA-gefüllt) in den Nanospender.
HINWEIS: Die Dosierzeit beträgt weniger als 20 min für eine komplette 384-Well-Platte bei der Abgabe von 500 nL TR-Mischung. - Inkubieren Sie 15-30 min bei Raumtemperatur, nachdem Sie den TR der DNA hinzugefügt haben, wie im Herstellerprotokoll angegeben.
8. Peristaltische Flüssigkeitshandler-basierte Zelldispensation
- Bereiten Sie den peristaltischen Flüssigkeitshandler für die Abgabe von Zellen vor. Desinfizieren Sie einen 10-L-Kassettenkopf, indem Sie ihn mit Aniospray Surf 29 Desinfektionsmittel besprühen und den Rest auf Papier aufnehmen. Montieren Sie die Kassette auf dem peristaltischen Flüssigkeitshandlergerät, ändern Sie die Einstellung für den Kassettentyp auf 10 l, und stellen Sie sicher, dass das Plattenformat auf 384 Bohrungen eingestellt ist.
- Desinfizieren Sie die 10 L-Kassettenschläuche, wie in Schritt 4.2 beschrieben. Tauchen Sie den Rohrveranstalter in ein steriles Gefäß und spülen Sie die Schläuche mit 5 ml 70% Alkohol, dann mit 5 ml destilliertem Wasser und schließlich, mit 5 ml serumfreiem Medium, sukzessive in das gleiche Gefäß gefüllt und bis jedes Rohr leer ist.
- Bereiten Sie die Zellsuspension vor, um sie zu verteilen. Von einer konfluenten HeLa-Zelle B10-Kulturschale die Zellen 1x mit 1x phosphatgepufferter Kochsaline(PBS) Lösung waschen und dann die Zellen mit Trypsin/EDTA 5 min bei 37 °C dissoziieren.
- Verifizieren Sie die Zelldissoziation unter dem Mikroskop und stoppen Sie die Trypsin/EDTA-Wirkung, indem Sie 10 ml komplettes Medium (DMEM ergänzt mit 10% fetalem Rinderserum und 100 U/ml Penicillin-Streptomycin; siehe Tabelle desMaterials) in die Kulturschale fügen. Ernten Sie Zellen in einem 50 ml Rohr und zählen Sie die Zellen unter dem Mikroskop, mit einer Malassez-Zelle oder einem automatischen Zellzähler.
- Bereiten Sie mindestens 25 ml HeLa-Zellsuspension bei einer Konzentration von 37.500 Zellen/ml in einem vollständigen Medium (d. h. 1.500 Zellen/40 l) für eine komplette 384-Well-Platte vor, um eine Rohrgrundierung und 40 l/Well-Dispensation zu gewährleisten.
- Um die Zellen zu verteilen, füllen Sie ein neues steriles Gefäß mit der vorbereiteten Zellsuspension und rühren Sie es, um Sedimentationen zu vermeiden, die zu Ungenauigkeiten in der Zelldichte der Dispensation führen. Setzen Sie den Rohrorganisator in diese Lösung ein und drücken Sie die Prime-Taste, bis die Zellsuspension vom Dosierkopf zu spülen beginnt. Stellen Sie sicher, dass keine der Spitzen verstopft ist, indem Sie den Flüssigkeitsfluss von allen von ihnen visuell überprüfen, und stellen Sie sicher, dass jedes Rohr mit Zellsuspension beladen ist.
- Laden Sie die DNA und TR-gefüllte 384-Well-Zielplatte auf den peristaltischen Flüssigkeitshandler-Plattenträger und entfernen Sie dessen Deckel. Führen Sie das vorkalibrierte Programm aus, um 40 l der Zellsuspension auf die komplette 384-Well-Platte (d. h. 1.500 Zellen/Well) zu verteilen. Die Dosierzeit beträgt ca. 8 s. Ersetzen Sie den Deckel der 384-Well-Platte.
HINWEIS: Alternativ kann die 40-L-Zellsuspension manuell mit einer Mehrkanal-Mikropipette abgegeben werden.
9. Benutzerdefinierter biologischer Assay (Zelltransfektionseffizienzüberwachung)
ANMERKUNG: Verwenden Sie nach den experimentellen Einstellungen und der Absicht des Experiments die erforderlichen Methoden für Lumineszenz, Fluoreszenz, Hochgehalt und Reverse-Transkription quantitative Polymerase-Kettenreaktion (RT-qPCR). In diesem Abschnitt des Protokolls wird die Effizienz der Zelltransfektion durch automatisierte Fluoreszenzmikroskopie und Bildanalyse bewertet.
- Inkubieren Sie die Platte bei 37 °C mit 5% CO2 in einer wassergesättigten Atmosphäre und bis zur richtigen Proteinexpression.
HINWEIS: Hier wird eine Inkubationszeit von 48 h für HeLa-Zellen verwendet, um die Transfektionseffizienz mit tdTomato- und mVenus-exemitten Plasmiden zu überwachen. - Entfernen Sie das Kulturmedium 48 h nach der Transfektion, indem Sie die Platte invertieren, 30 l/Well von 10% Formalin mit dem peristaltischen Flüssigkeitshandler (10 l Kassette) hinzufügen und 15 min bei Raumtemperatur inkubieren.
- Entfernen Sie das Formalin, indem Sie die Platte invertieren; dann die Zellen für 15 min bei Raumtemperatur mit 0,1 ng/mL Hoechst in 1x PBS-Lösung verdünnt inkubieren.
- Waschen Sie die Zellen 3x für 15 min mit 80 l 1x PBS, die auf pH = 8 eingestellt sind, um das hohe Fluoreszenzsignal wiederherzustellen, das durch den 6,9 pH des Inkubationsschritts der Formalinlösung verloren gegangen ist.
- Erfassen Sie mit einem automatisierten Fluoreszenzmikroskop Bilder von zwei oder drei fluoreszierenden Kanälen (Hoechst, tdTomato und mVenus) sequenziell mit 10-fachen Objektiven und einem geeigneten Emissionsfiltersatz (4,6-Diamidino-2-Phenylindole [DAPI], dsRed und Fluorescein Isothiocyanat [FITC]).
- Um die Transfezierungseffizienz zu bewerten, verwenden Sie Bildanalysesoftware, um die Transfektionseffizienz mithilfe einer Skriptanalyse auf der Grundlage der Kernfärbung zu bestimmen.
Ergebnisse
fUm festzustellen, ob die ADE-Technologie für ein automatisiertes Reverse-Transfektionsprotokoll verwendet werden könnte, überwachten wir die Effizienz der Zelltransfektion durch Fluoreszenzmikroskopie, indem wir ein rotes fluoreszierendes tdTomato-exzierendes Plasmid verwendeten. Zunächst wurden die besten Transfektionsparameter ermittelt, verschiedene Verdünnungsvolumina und Gesamtmengen an DNA wurden kreuzgetestet. Das Verdünnungsvolumen wurde verwendet, um die nach der Abgabe verteilten DNA-Tröpfchen über die Brunnen auszubreiten, um inhomogene Transfektion zu umgehen, die in Vorversuchen beobachtet wurde (d. h. nur in der Mitte der Brunnen). Wie in Abbildung 6Adargestellt, war die Transfektion von HeLa-Zellen mit Lipopolyplexer Reagenz20 erfolgreich. Interessanterweise zeigten DNA-Mengen von 5 bis 30 ng mit einem Verdünnungsvolumen von 1 l die gleiche Effizienz und bis zu 90 % Zelltransfektion im Vergleich zu höheren Mengen, wie 50 und 100 ng, für die eine abrupte Abnahme beobachtet wurde. Wir haben verschiedene Verdünnungsvolumina von 15 nL bis 4 l ausprobiert und 1 l als den besten Zustand identifiziert, wie hier mit 30 ng DNA signifikant veranschaulicht.

Abbildung 6 : Repräsentative Ergebnisse. (A) Auswirkungen der DNA-Menge und des Verdünnungsvolumens auf die Transfektionseffizienz. HeLa-Zellen wurden mit dem Nanodispenser-Gerät und Lipopolyplex mit einer 1-fachen Konzentration, wie vom Hersteller empfohlen, umgedreht. Von dem empfohlenen Verdünnungsmittel (serumfreies Medium) wurden 15-4.000 nL mit 10-100 ng Mengen rotfluoreszierendem Plasmid (tdTomato) verwendet. Transfektionseffizienzen wurden 48 h nach der Transfektion mit hilfe einer bildbasierten Analysesoftware ermittelt. Die Ergebnisse werden als Prozentsatz der transfizierten Zellen für die zunehmende DNA-Menge ausgedrückt, und das Verdünnungsvolumen zeigt die optimalen Bedingungen: 30 ng der gesamten DNA mit einem zunehmenden Verdünnungsvolumen und 1 l Verdünnungsmittel mit zunehmenden DNA-Mengen. Die Fehlerbalken stellen das SEM mit n n 4 dar. Für die statistische Analyse wurden zweiwegweise ANOVA und Bonferroni nach dem Test verwendet. *p < 0,05 im Vergleich zu anderen Punkten. (B) Stabilität der hergestellten DNA-Platten. Verdünnungsmittel (1 l) wurde mit dem peristaltischen Flüssigkeitshandler abgegeben, und 30 ng DNA wurden mit Lipopolyplex-Reagenz, das von ADE (Kontrolle) abgegeben oder entweder bei Raumtemperatur gelagert wurde, einmal trocken oder gefroren bei -20 °C, übertragen und sofort transfiziert. An den Tagen 0, 2 oder 7 wurde trockene DNA mit 1 l Verdünnungsmittel rehydriert, die mit dem peristaltischen Flüssigkeitshandler abgegeben wurde, und gefrorene Platten wurden bei Raumtemperatur aufgetaut und zentrifugiert (bei 1.500 x g für 2 min). Die Zellen wurden dann mit dem peristaltischen Flüssigkeitshandler gemäß dem beschriebenen Protokoll gesät. Die Fehlerbalken stellen das SEM mit n 3 dar. Für die statistische Analyse wurden zweiwegweise ANOVA und Bonferroni nach dem Test verwendet. ns = nicht signifikant unterschiedlich. (C) Plasmid-DNA-Kotransfektionseffizienz. HeLa-Zellen wurden mit 30 ng mVenus- und tdTomato-exezierendem Plasmid transfiziert, das in zwei separaten Quellbrunnen geladen wurde (mit einem Verhältnis von 1,7 mVenus über tdTomato, um ihre relative Fluoreszenzleistung zu nivellieren). Transfektionseffizienzen wurden 48 h nach der Transfektion mit bildbasierter Analysesoftware verglichen und als Prozentsatz der transfizierten Zellen und als Prozentsatz der kotransfizierten Zellen innerhalb der transfizierten Population ausgedrückt. Der Prozentsatz der kotranstransfizierten Zellen wurde durch Berechnung der grünfluoreszenzerklärenden Zellzahl in den roten fluoreszierenden Populationszellen bestimmt. Die Fehlerbalken stellen das SEM mit n 3 dar. Für die statistische Analyse wurden zweiwegweise ANOVA und Bonferroni nach dem Test verwendet. ns = nicht signifikant unterschiedlich. (D) Repräsentative Bereiche der Fluoreszenzmikroskopie aus der bildlichen Aufnahme in Tafel C mit drei fluoreszierenden Kanälen (Hoechst, tdTomato und mVenus), die sequenziell von einer bildgebenden Plattform (Materialtabelle) erworben wurden ), mit 10-fachen Objektiven und einem geeigneten Emissionsfiltersatz (DAPI, dsRed bzw. FITC). Diese Zahl wurde von Colin et al.1geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um den Durchsatz dieses Protokolls weiter zu verbessern, haben wir als nächstes untersucht, ob eine mit DNA und Verdünnungslösungen vorgefüllte Quellplatte lagerungsmittelgelagert und zu einem späteren Zeitpunkt verwendet werden könnte. Es wurden zwei Möglichkeiten zur effizienten DNA-Speicherung getestet, nämlich die trockene Lagerung der Platte durch Trocknen auf der Bank oder eine gefrorene Lagerung (bei -20 °C). Beide Lagerungsverfahren führten nicht zu signifikant unterschiedlichen Ergebnissen als frisch abgegebene DNA-Lösung, die bis zu 7 Tage lang gelagert wurde (Abbildung6B), und beide Methoden ermöglichten die Transfektion von gespeicherten DNA-Vorgefüllten, wie z. B. einer Bank von Plasmide.
Da schließlich die Plasmidtransfektion am häufigsten mit mindestens zwei verschiedenen Plasmiden auftritt, untersuchten wir als nächstes die DNA-Multiplexing-Fähigkeit des hier vorgestellten Protokolls unter Verwendung der am besten identifizierten Bedingungen (1 L Verdünnungsmittel und 30 ng DNA). Das zuvor verwendete tdTomato rotfluoreszierendes Protein-exprimierende Plasmid wurde modifiziert, um mVenus, ein leuchtend gelbes fluoreszierendes Protein, auszudrücken, und beide wurden dann bei Kotransfektionsversuchen verwendet. Die Rot- oder Grünfluoreszenz-positive Zellanalyse (Abbildung 6C) zeigte, dass die Transfektionseffizienz bei etwa 80 % lag; in der roten Population wurden jedoch fast 100% der Zellen auch mit dem mVenus-exezierenden Plasmid kotransfiziert, wie in der repräsentativen softwarebasierten Bildanalyse von Abbildung 6Dzu sehen ist.
Ergänzende Abbildung 1: Diagramm zeigt eine geeignete Dosierhöhe für den Tropfen, um den Boden des Brunnens zu berühren, um seine Retention auf der Dosierspitze zu vermeiden. Auf der linken Seite, richtige Einstellungen ermöglichen den Tropfen auf der Brunnenoberfläche zu verbreiten, um seine Retention auf den Dosierspitzen zu vermeiden. Auf der rechten Seite führen schlechte Einstellungen zur Tröpfchenretention, die während der Kopfbewegung zum nächsten Rohlauf beobachtet werden kann. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Diskussion
Die Etablierung und Optimierung einer genauen Transfektionsmethode mit hohem Durchsatz für eine bestimmte Zelllinie erfordert, dass die Wissenschaftler einige wichtige Parameter befolgen, die in diesem Abschnitt beschrieben werden. Wir empfehlen dringend, mit den empfohlenen Werten im gesamten Protokoll zu beginnen, da sich diese für HeLa-Zellen optimierten Einstellungen auch für HEK-Zellen als effizient erwiesen haben. Da jedoch die besten Parameter von den Zelllinien und Transfektionsreagenzien abhängen können, können optimale Bedingungen definiert werden, indem die Zellzahl, das Verdünnungsvolumen, die gesamte DNA-Menge und das Transfektionsreagenz, die Konzentration oder sogar das verwendete Volumen so variieren, wie es die bei der Optimierung dieses Protokolls für HeLa-Zellen1.
Das hier vorgestellte Gesamtprotokoll wurde weiterentwickelt und weiter optimiert, um die Zelltransfektion auch von Unerfahrenen im Feld zu ermöglichen. Um dieses Ziel zu erreichen, wurden wichtige Tools entwickelt, um das Protokoll so einfach wie möglich zu gestalten und menschliche Fehler zu vermeiden: ein benutzerfreundliches Tabellenmakro zum einfachen Entwerfen des Experiments und eine Tablet-Anwendung, die den Benutzer anleitet, die Quelle richtig auszufüllen. Platten( die platten).
Um die Zuverlässigkeit des Protokolls zu gewährleisten, müssen daher nur wenige kritische Schritte kontrolliert werden: i) ein geeignetes experimentelles Design; ii) die richtigen peristaltischen Dispensationen vom klassischen peristaltischen Flüssigkeitshandler; iii) die richtige DNA- und Transfektionsreagenz akustische Nagung; iv) Vermeidung der Zentrifugation der Quellplatte vor der Transfektionsreagenzdispensation, da dies die Transfektion zu beeinträchtigen schien. Die Befolgung dieser wenigen Empfehlungen würde die effiziente Transfektion der Zellen gewährleisten.
Richtiges experimentelles Design
Der experimentelle Aufbau wurde durch die Entwicklung der Makrotabelle benutzerfreundlich gemacht, die nur mit dem erwarteten DNA-Plasmidnamen, der gewünschten Menge und einigen wichtigen Parameterwerten gefüllt werden muss. Nach dem Befüllen analysiert das Makro zunächst die eingegebenen Parameter, um potenzielle Fehler zu erkennen, wie z. B. geeignete minimale und maximale Volumina, die für die Quellbrunnen eingegeben werden, und das Transfektionsreagenzdispensationsvolumen. Darüber hinaus überprüft das Makro auf der Grundlage der in jeder der vier möglichen Reihen eingegebenen DNA-Konzentrationen und der in den zugrunde liegenden Feldern eingegebenen Plasmidmenge, ob die zu erwartenden Mengen, die abgegeben werden sollen, ein Vielfaches von 2,5 nL (Volumen der Tropfen, die von der Nanospender). Sobald eine Überprüfung auf Fehler durchgeführt wurde, berechnet das Makro die Gesamtmenge jeder DNA-Probe, die abgegeben werden muss, und entwirft dann die Quellplattenvorlage (durch Sortieren der DNA-Namen in alphabetischer Reihenfolge). Die in der Quellplatte(n) angegebenen Volumen berücksichtigen die in einem Quellbrunnen erwarteten Arbeitsvolumina (berechnet aus den minimalen und maximalen Volumenwerten, die im Vorlagenblatt ausgefüllt werden). Alle erwarteten DNA-Dispensationen in jedem der Brunnen werden dann auf das DNA-Picklist-Blatt geschrieben. Die Liste der DNA-transfizierten Brunnen wird dann verwendet, um das TR-Picklist-Blatt mit dem auf dem Schablonenblatt angegebenen Transfektionsreagenzvolumen zu schreiben. Die auf dem Quellplattenblech berechneten Volumina werden dann auf das 384-Well-Pipettier-Führungsblatt übertragen. Daten aus der DNA-Picklist, TR-Picklist und 384-Well Pipettieranleitung werden dann verwendet, um die entsprechenden Dateien im *.csv-Format zu generieren.
Richtige DNA- und TR-Dispensation auf der Quellplatte
Da das Dosieren auf einer 384-Well-Quellplatte und insbesondere das Auffinden des Zielbrunnens Fehler fördern und zudem zeitaufwändig sind, haben wir eine spezielle Tablet-basierte Anwendung ähnlich iPipet21entwickelt. Im Gegensatz zu iPipet kann die hier beschriebene mit Android verwendet werden (nur Android Version 4.4 und -up wird unterstützt). Basierend auf der 384-Wells-Pipetting-Guide.csv-Datei, die von der Makrotabelle generiert wird, hilft sie dem Benutzer beim gesamten Dosiervorgang. Während sich die Verwendung für ein paar Dispensationen nicht lohnt, kann es interessant sein, Zeit zu sparen und Fehler zu vermeiden, wenn eine große Anzahl von DNA- und TR-Dispensationen erwartet wird. Die .csv-Datei muss Gut-, Platten-, Namens-, Konzentrations- und Volumeninformationen enthalten. Diese Anwendung könnte dann für andere Anwendungen verwendet werden, wie Dosierlösungen (Reagenzien, Farbstoff, Verbindung, etc.) im Zielbrunnen, nach einer benutzerdefinierten csv-Datei. Darüber hinaus ermöglicht es dem Benutzer, eine ganze Zeile oder Zeile zu beleuchten, indem er die relevanten Informationen in die Zielbrunnenspalte mit diesem erwarteten Format eingibt: Row_1 (bis 24) oder Line_A (bis P).
Fehlerbehebung bei der Fehlerbehebung bei der Effizienz der Zelltransfektion
Mehrere unten beschriebene Parameter können die Zelltransfektion im beschriebenen ADE-basierten Protokoll beeinträchtigen und müssten bei Effizienzproblemen einzeln überprüft und umgangen werden.
Einer der ersten wichtigen Parameter für die Transfektion ist die Qualität der Zellen und die Dichte, die bei der Aussaat verwendet wird. Obwohl jeder Zelltyp unterschiedliche Parameter erfordert, müssen einige von ihnen respektiert werden, um eine erfolgreiche Transfektion zu gewährleisten. Zunächst muss die Zellsuspension extemporisch aus einer Subkonfluentplatte vorbereitet werden, um Zellstress vor der Transfektion zu vermeiden, und sie sollten nicht zu lange auf der Bank liegen gelassen werden (maximal 2 h). Zweitens muss die Saatdichte der Zellen aus zwei Gründen niedrig genug sein: zelluläre Kontakte zu vermeiden und eine hohe Zelloberfläche zu fördern, sobald sie sich ausbreitet, aber auch, weil aktiv teilende Zellen besser fremde Nukleinsäure aufnehmen22,23. Leider variiert die optimale Zelldichte für die Transfektion je nach Zelltyp und Transfektionstechnologie und muss für jede Zelllinie bestimmt werden. Dies sind entscheidende Parameter für eine effektive Transfektion.
Ein weiterer wichtiger Parameter, der die Transfektionseffizienz modulieren kann, ist die Zelldurchgangsnummer24. Tatsächlich sind Zellen in der Kultur aufgrund von Wettbewerb und natürlicher Selektion ständig der Evolution ausgesetzt. Es ist allgemein bekannt, dass die Differenzgenexpression zwischen niedrigen und hohen Zelldurchgangszahlen in den meisten Zelllinien aufgrund der Dedifferenzierung erwartet wird, wenn die Durchgangszahl zunimmt. Nach diesem Phänomen kann auch die Transfektionseffizienz beeinträchtigt werden. Es wurde jedoch nachgewiesen, dass passagenbezogene Effekte stark von der Zelllinie und den Kulturbedingungen abhängig sind. Darüber hinaus variiert das, was als "hohe" Durchgangsebene betrachtet wird, von einer Zelllinie zur anderen. Das bedeutet, dass der Durchlaufnummernbereich, unter dem eine Reihe von Experimenten zuverlässig durchgeführt werden kann, für jede gegebene Zelllinie bestimmt werden muss.
Ein weiterer Parameter, der die Schwierigkeit bei der Bestimmung der besten Bedingungen für die Transfektion erhöht, ist, dass die Zusammensetzung des Kulturmediums ebenfalls eine entscheidende Rolle spielt, da das Vorhandensein von Serum und/oder Antibiotika die Transfektionseffizienz moduliert. In der Tat empfehlen die meisten kommerziellen Protokolle die Verwendung von serumfreiem Medium während des Transfektionsschritts, um die Effizienz zu verbessern oder Probleme mit schlechter Effizienzzuumgehen 3,25,26,27. Allerdings ist dieser Parameter in der Tat komplexer zu erfassen, da gezeigt wurde, dass für eine bestimmte Zelllinie frühe oder späte Passagen die Effizienz je nach Serumpräsenz oder Abwesenheit im Kulturmedium28erhöhen oder senken können. Andere Forscher präkonisieren die Verwendung von antibiotikafreiem Medium für den Durchgang vor der Transfektion beim Kultivieren von Zellen, um hochwertige Zellen für die Transfektion zu erhalten29. Abschließend möchte ich sagen, dass bei der Optimierung der Transfektionsbedingungen für einen bestimmten Zelltyp jeder dieser Parameter getestet werden sollte: frühe oder späte Durchgangszellen und die Verwendung von Medium mit oder ohne Serum während des letzten Durchgangs vor der Ernte der Zellen und/oder während der Transfektionsschritt selbst.
Bei der Optimierung des hier vorgestellten Protokolls wurden zwei Arten von Reagenzen verwendet: ein liposomales Reagenz, das liposomeähnliche Komplexe bildet, und Lipopolyplexreagenz, eine nichtliposomale polymere Verbindung1. Während wir jahrelang erfolgreich Waren, HeLa-Zellen mit der ersten manuell zu transfizieren, wurde im aktuellen automatisierten Protokoll eine schlechte Transfektionseffizienz beobachtet. Dies war wahrscheinlich auf einen erforderlichen Wirbelschritt beim Mischen von DNA mit Transfektionsreagenz zurückzuführen, das nicht im 384-Well-Plattenformat durchgeführt werden kann. Das Lipopolyplex benötigt einen solchen Schritt nicht und hat daher zu höheren Transfezeffekten in allen getesteten Einstellungen geführt. Obwohl dies in der aktuellen Studie nicht bestätigt wurde, wird die Vermeidung von Transfektionsreagenzien, die einen physikalischen Mischschritt erfordern, wie Pipettieren oder Wirbeln wahrscheinlich zu besseren Ergebnissen führen.
Wir empfehlen auch die Verwendung eines Transfektionsreagenzes, das mit der Reverse-Transfektion kompatibel ist, da das vorgestellte Protokoll auf einer umgekehrten Transfektion basiert. Einige Zellen sind bekannt, schwierig zu transfekieren und einige dedizierte chemische Verbindungen sind entwickelt, um höhere Transfektionseffizienz zu fördern30,31. Wenn es darum geht, schwer transfekte Zellen zu transfizieren, empfehlen wir, die gegebenen zelltyp- oder zelllinien-dedizierten Transfektionsreagenzien zu testen, vorausgesetzt, dass eine umgekehrte Transfektion mit diesen möglich ist.
Mehrere Parameter, die in den zugrunde liegenden Absätzen aufgeführt sind, können Auswirkungen haben und den ADE-Dosierprozess etwas beeinträchtigen, was möglicherweise das letzte Experiment ruiniert.
Der Nanodispenser wurde entwickelt, um 2,5 nL Tröpfchen aus Quellbrunnen zu verteilen, die mit 3-12 l wässrigem Puffer gefüllt sind (d. h. 9 l Arbeitsvolumen). Das in dieser Studie verwendete Nanodispenser-Gerät integriert eine dynamische Flüssigkeitsanalysetechnologie zur Bestimmung der Flüssigkeitszusammensetzung und der Flüssigkeitshöhe in der Quellplatte, um die Leistung zu steuern, die zum Auswerfen von 2,5 nL Tröpfchen benötigt wird19. Beim manuellen Befüllen der Quellplatte oder mit einem klassischen peristaltischen Flüssigkeitshandler sind die Volumina meist nicht so genau als die, die durch die dynamische Flüssigkeitsanalyse bestimmt werden. Dies ist ein entscheidender Punkt zu berücksichtigen, da das Gerät nicht in der Lage ist, von Quellbrunnen zu verzichten, die mit mehr als 12 l beladen sind. Daher würde ihre Anwesenheit das Experiment gefährden. Natürlich kann eine Liste der durchgeführten Dispensationen am Ende des Programms generiert werden, aber dies erfordert, dass der Benutzer Volumes anpasst und ein Programm ausführt, um nur die verpassten Dispensationen wiederherzustellen. Um diese Meinungsverschiedenheiten zu vermeiden, wird empfohlen, eine "Untersuchung" durchzuführen, sobald die DNA-Plasmide geladen wurden, um das erwartete Volumen in jedem Betroffenen gut zu überprüfen.
Ein entscheidender Parameter für das Auswerfen von Tröpfchen ist die Variation der flüssigen Oberflächenspannung17,32. Wasser-DNA-Lösungen sind für ihre Viskosität bekannt; dies könnte den Dosierprozess von ADE beeinträchtigen. Während die physikalischen Parameter in unserer vorherigen Studie1nicht bestimmt wurden, führten höhere DNA-Lösungskonzentrationen in der Quellplatte zu einer geringeren Transfektionseffizienz, selbst bei gleicher Gesamtmenge der abgegebenen DNA, wahrscheinlich aus diesem Grund. phänomen. Daher empfehlen wir die Verwendung einer Plasmidverdünnung von 100 ng/l für beste Ergebnisse, obwohl andere Konzentrationen auf Benutzerfreundlichkeit getestet werden könnten. Um eine ordnungsgemäße ADE mit der vom Benutzer benötigten DNA-Konzentration zu gewährleisten, kann der Lösung ein Farbstoff hinzugefügt werden, um den Tropfenauswurf in den Brunnen oder, noch besser, auf dem Plattendeckel zu überwachen. Da das erste Ziel des vorgestellten Protokolls darin bestand, einen hohen Durchsatz zu erzielen, wurden billige Minispalten-basierte Plasmid-DNA-Minivorbereitungskits verwendet, die mit plattenbasierten Hochdurchsatz-Plasmid-Reinigungsprotokollen kompatibel sind. Während es während der Durchführung des Experiments ordnungsgemäß funktionierte, wird bei geringer Effizienz und schlechter Zelllebensfähigkeit nach der Transfektion empfohlen, höherwertige DNA-Reinigungsmethoden wie Midi- oder Maxipräparate oder sogar endotoxinfreie kommerziell erhältliche Kits, die eine bessere DNA-Reinheit und geringere Toxizität für die Zellen gewährleisten würden33.
Fehlerbehebung bei der inhomogenen Zelltransfektion über die Brunnenoberfläche
Erste Versuche beim Einrichten des Protokolls führten nur in der Mitte der Brunnen zur Zelltransfektion, wo die Tropfen von ADE gesendet wurden. Tatsächlich stellten wir fest, dass sich die DNA- und Transfektionsmischung nicht über die gesamte Brunnenoberfläche ausbreitete und aufgrund der geringen abgegebenen Volumina (knapp 500 nL) vor der Zellzugabe trocknete. Um dieses Problem zu umgehen, wurde ein Verdünnungsdosierschritt hinzugefügt, damit sich die DNA/TR-Mischung vor der Zellzugabe über die Brunnen ausbreiten konnte. Dies führte zu einer homogenen Zelltransfektion im Brunnen. Wenn also das Experiment reproduziert wird und sich die DNA/TR-Mischung nicht über die Brunnen verteilt, kann das Verdünnungsvolumen an die Bedürfnisse des Benutzers angepasst werden.
Da der akustische Flüssigkeitshandler Volumen im Nanoliterbereich verteilen kann, hat die beschriebene Methode möglicherweise keine technischen Einschränkungen. Wir stellten jedoch fest, dass wässrige, lösungsgefüllte Brunnen einer Verdunstung unterliegen, was eine Einschränkung darstellen könnte. Wenn die genauen Zudosierungsmengen durch diese Verdunstung abgesenkt werden, wird die Nanodosierung nicht bis zum erwarteten Ende durchgeführt. In diesem Fall wird ein Fehlerbericht vom Nanodispenser generiert. Um dieses Problem zu umgehen, verwenden Sie höhere Volumina als erwartet, während Sie im akzeptablen oberen Bereich bleiben (in der Tat unter 12 L). Führt die Verdunstung jedoch zur Beeinträchtigung einiger Dispensationen, wird ein Fehlerbericht durch den Nanospender generiert. Diese Datei kann verwendet werden, um die Quellplatte mit einem neuen Reagenz zu füllen, das an den betreffenden Zielbrunnen abgegeben werden soll. Dies in einem kurzen Zeitintervall zu tun, schien die Transfektionseffizienz nicht zu beeinträchtigen.
Das hier beschriebene Protokoll ist das erste, das einen solchen Durchsatz für unabhängige DNA-Plasmidtransfektionen erhält. Die besten zuvor erreichten Preise waren für 288 verschiedene Bedingungen, die hochspezialisierte Fähigkeiten gleichzeitig durchgeführt werden mussten15. Dies, abgesehen von seinem hohen Durchsatz, hat das aktuelle Protokoll weitere wesentliche Vorteile, da der gesamte Prozess optimiert wurde, um seine Verwendung durch Nicht-Spezialisten zu ermöglichen und Tools wurden entwickelt, um Fehler zu vermeiden, nämlich i) ein dediziertes Tabellenmakro, das es ermöglicht, die einfache Gestaltung der Versuchsvorlage, ii) die automatische Generierung der entsprechenden DNA- und Transfektionsreagenz-Quellplatte(en) durch dieses Makro, iii) die Generierung von zwei gebrauchsfertigen Dateien zur Steuerung der softwaregesteuerten DISpensationen von DNA und Transfektionsreagenz durch das Nanospendergerät und iv) den Export einer "384-Well Pipettieranleitung" der Entrohrungsplatte(n) entspricht, die von einer speziellen Tablet-basierten Anwendung verwendet werden soll, die ebenfalls entwickelt wurde, um menschliche Fehler zu vermeiden, während Dosierung in der 384-Well-Quellplatte(n).
Zukünftige Verbesserungen des Protokolls
Um den Durchsatz und die Reproduzierbarkeit zu verbessern, könnte die mit Plasmiden gefüllte Quellplatte bei 4 °C gelagert oder wie üblich für DNA-Stammlösungen eingefroren werden. Darüber hinaus haben wir gezeigt, dass die mit DNA vorgefüllte vorbelastete Zielplatte auch mindestens 7 Tage lang trocken oder gefroren gelagert werden kann, bevor das Transfektionsreagenz und die Zellen hinzugefügt werden, was zur Verbesserung des Gesamtdurchsatzes und der Leichtigkeit des Protokolls führt. Die DNA-Konservierung wurde bereits seit mehr als 4 Jahren mit optimierten Medien34 gemeldet und sollte daher im Rahmen dieses Protokolls getestet werden, da es es einen Schritt weiter vorantreiben wird, was die langfristige Lagerung von Platten ermöglicht, die mit Banken von Plasmide und gebrauchsfertig in Transfektionsexperimenten.
Wir haben zuvor gezeigt, dass die identifizierten optimalen Transfektionsbedingungen auf höherskatsche Experimente übertragen werden können, von 96-well bis 10 cm Kulturschalen1, durch Berechnung der DNA-Menge, des Transfektionsreagenzvolumens und der Zelldichte, die auf Basis des optimierten 384-Well-Plattenprotokolls eingesetzt werden. Da die 1536-Well-Plattendispensation auch durch den Nanospender beherrschbar ist, kann das Protokoll auch in einem niedrigeren Maßstab durchgeführt werden, wodurch sein Durchsatz erhöht wird. Eine wesentliche Einschränkung, um dieses Format zu erreichen, ist jedoch die Möglichkeit, Zellen zu verteilen und das endgültige Auslesen in einem solchen miniaturisierten Format zu verwalten. Die Zelldosierung durch ADE wurde bereits im 1536-Well-Plattenformat35 mit einer Lösung neutraler Dichte erfolgreich durchgeführt, die die Zellaussaat verhinderte und eine gleiche Zelldichte in der Zeit gewährleistete. Basierend auf der hier verwendeten Zellzahl und dem Oberflächenverhältnis von 384 (0,056 cm2) gegenüber 1536 Brunnen (0,025 cm2)würden 500-650 Zellen in diesem letzten Format abgegeben. Ein solcher Zelldispensationsnummernbereich hat sich als sehr zuverlässig erwiesen, wenn eine 14%-18% konzentrierte Lösung neutraler Dichte verwendet wird. Unter diesen Einstellungen würden 100 nL Zellsuspension auf 1536 Brunnen verteilt werden. Bei einer Arbeitslösung von 5-8 l in solchen Brunnen würde die Zugabe von 5-8 L Kulturmedium mit klassischen peristaltischen Flüssigkeitshandlern die Antisaatlösung auf weniger als 0,3% verdünnen und somit eine ordnungsgemäße Zellaussaat ermöglichen. Die Transfizierung von Zellen in einem so geringen Maßstab scheint daher technisch möglich; Die Wirkung der Restkonzentration der Neutraldichtelösung auf die Transfektionseffizienz bleibt jedoch durch weitere Arbeiten zu bestimmen.
Die Verwendung von Quellplattentypen mit höheren Arbeitsvolumina für die Abgabe von Zellen, wie z. B. 384-Well-Polypropylen-Quellplatten mit einem Arbeitsvolumen von 45 l, würde 100 nL-Zelllösungsdosierungen aus nur vier Quellbohrungen für eine insgesamt 1536-Well-Platte ermöglichen. Darüber hinaus sind neue Nanodispenser in der Lage, Tropfen von 25 nL anstelle der 2,5 nL, die in diesem Protokoll verwendet wurde, zu verteilen. Diese Tropfengröße teilt also das 10-fache der Dosierzeit, impliziert aber, ein Vielfaches von 25 nL-Volumes zu verwenden, die jedoch mit den verschiedenen Volumes kompatibel bleiben, die in dem hier vorgestellten Protokoll ausgegeben werden.
Basierend auf diesen neuesten Arbeiten und technologischen Verbesserungen könnte ein weiterer ADE-Zelldosierschritt zur Erreichung einer 1536-Well-Plattentransfektion einfach in das aktuelle Protokoll aufgenommen werden. Solche Miniaturisierungen zu erreichen lohnt sich jedoch nur, wenn der Bioassay in einem solchen miniaturisierten Format gleichzeitig möglich ist.
Zusammenfassend haben wir ein einfaches, hochdurchsatziges und präzises Transfektionsverfahren entwickelt, das durch Miniaturisierung mehrere Vorteile mit sich bringt: (1) Senkung der Kosten für Transfektionsreagenz; (2) Verringerung der Verschwendung von DNA-Präparaten; (3) sicherzustellen, dass auch Anfänger erfolgreich Zelltransfektion durchführen können. In der Tat erfordert es nur wenige einfache manuelle Schritte, nämlich die Verdünnung der DNA auf 100 ng/L, die Abgabe auf einer Quellplatte (ein Plasmid/Well) gemäß der tabellengenerierten Vorlage und die Verwendung der tablettenbasierten Pipettieranleitung und die Vorbereitung der Zellsuspension vor der Aussaat. Der ADE-basierte Nanodispenser ist für die zeitaufwändige und fehleranfällige Dosisabgabe und Multiplexing der Plasmide gemäß der vorgegebenen Versuchsvorlage verantwortlich.
Darüber hinaus könnte dieses Protokoll zwar die meisten grundlegenden biologischen Absichten klassischer Transfektionsexperimente sicherstellen, aber auch neue Wege für Array-basierte Experimente eröffnen. Zum Beispiel würde das Ausdrücken oder Abklopfen jedes menschlichen Protein-Kodierungsgens aus der menschlichen ORFeome-Sammlung36 bzw. CRISPR-Cas9-Bibliotheks-basierte Ansätze37,weniger als 24 h auf einer dedizierten automatisierten Plattform erfordern (53 x 384- statt 2-3 Tage menschlicher Arbeit, unter der Annahme einer DNA-vorbelasteten Plattenbank. Aufgrund seiner hohen Effizienz und hohen Durchsatzleistung könnte das hier vorgestellte Protokoll sogar neue nicht gepoolte Ansätze für CRISPR-Cas9-basierte Studien mit gRNA-Bibliotheken/CRISPR-Cas9-exemitten Plasmiden erreichen. Tatsächlich wären milde zelluläre Phänotyp-Änderungen, die derzeit den erforderlichen Zellsortierungsschritt nicht zulassen können, endlich überschaubar, da ein Selbstgewähchen ein geschlagenes Gen darstellen würde.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren gaben die folgende finanzielle Unterstützung für die Recherche, Die Urheberschaft und/oder die Veröffentlichung dieses Artikels bekannt: Inserm, Universität Lille, Lille Pasteur Institute, Conseil Régional du Nord und PRIM-HCV1 und 2 (Péle de Recherche Interdisciplinaire sur le Médicament), Agence Nationale de la Recherche (ANR-10-EQPX-04-01), feder (12001407 (D-AL) Equipex Imaginex BioMed) und die Europäische Gemeinschaft (ERC-STG INTRACELLTB n° 260901). Die Autoren danken Dr. S. Moureu, Dr. B. Villemagne, Dr. R. Ferru-Clément und Dr. H. Groult für ihre kritische Überprüfung und Korrektur des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder | 12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). | version 2.79b | used to design the plate adapter |
Referenzen
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064(2018).
- Mirus Bio. Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. Factors Influencing Transfection Efficiency | Thermo Fisher Scientific - FR. , https://www.thermofisher.com/fr/fr/home/references/gibco-cell-culture-basics/transfection-basics/factors-influencing-transfection-efficiency.html (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36(2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4(2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. Reverse transfection method. , WO2001020015A1(2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937(2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023(2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- Transfection | TransIT Transfection Reagents | Mirus Bio. , https://www.mirusbio.com/products/transfection (2015).
- American Type Culture Collection. General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , https://www.atcc.org/~/media/Transfection%20protocols/TransfeX/TransfeX%20General%20Protocol%20on%20letterhead.ashx (2017).
- American Type Culture Collection. Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , http://www.lgcstandards-atcc.org/~/media/PDFs/Marketing%20Material/Cell%20Biology/Transfection%20reagents%20for%20nucleic%20acid.ashx (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. FuGENE® 6 Transfection Reagent. , https://www.promega.com/-/media/files/resources/protocols/technical-manuals/101/fugene-6-transfection-reagent-protocol.pdf (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Eliminating Endotoxin at the Source - A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. Mamat, U., et al. 28th Annual Symposium of the Protein Society, San Diego, CA, , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , https://www.labcyte.com/content/applications/high-precision-cell-dispensing-with-the-labcyte-echo-liquid-handler (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten