Method Article
Dreidimensionales Pattern von Ingenieurbiofilmen mit einem Do-it-yourself-Bioprinter
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt eine Methode, einen kostengünstigen kommerziellen 3D-Drucker in einen bakteriellen 3D-Drucker zu verwandeln, der das Drucken von gemusterten Biofilmen erleichtern kann. Es werden alle notwendigen Aspekte der Zubereitung von Bioprinter und Bio-Tinte beschrieben, sowie Verifizierungsmethoden zur Beurteilung der Biofilme.
Zusammenfassung
Biofilme sind Aggregate von Bakterien, die in eine selbst produzierte, räumlich gemusterte extrazelluläre Matrix eingebettet sind. Bakterien innerhalb eines Biofilms entwickeln eine verbesserte Antibiotikaresistenz, die potenzielle gesundheitliche Gefahren birgt, aber auch für Umweltanwendungen wie die Reinigung von Trinkwasser von Vorteil sein kann. Die Weiterentwicklung von antibakteriellen Therapeutika und biofilm-inspirierten Anwendungen erfordert die Entwicklung reproduzierbarer, technischer Methoden zur Biofilmbildung. In jüngster Zeit wurde eine neuartige Methode zur Biofilm-Aufbereitung mit einem modifizierten dreidimensionalen (3D) Drucker mit einer bakteriellen Tinte entwickelt. Dieser Artikel beschreibt die Schritte, die notwendig sind, um diesen effizienten, kostengünstigen 3D-Bioprinter zu bauen, der mehrere Anwendungen in der bakterieninduzierten Materialverarbeitung bietet. Das Protokoll beginnt mit einem angepassten kommerziellen 3D-Drucker, bei dem der Extruder durch einen Bio-Tinte-Spender ersetzt wurde, der an ein Spritzenpumpensystem angeschlossen ist und einen kontrollierbaren, kontinuierlichen Fluss von Bio-Tinte ermöglicht. Um eine für den Biofilmdruck geeignete Bio-Tinte zu entwickeln, wurden in einer Lösung aus Alginat konstruierte Escherichia coli-Bakterien aufgehängt, so dass sie sich in Kontakt mit einer kalziumhaltigen Oberfläche verfestigen. Die Aufnahme einer Induktionschemie in das Drucksubstrat treibt die Ausprägung von Biofilm-Proteinen in die gedruckte Bio-Tinte. Diese Methode ermöglicht den 3D-Druck verschiedener räumlicher Muster, die aus diskreten Schichten von gedruckten Biofilmen bestehen. Solche räumlich gesteuerten Biofilme können als Modellsysteme dienen und Anwendungen in mehreren Bereichen finden, die weitreichende Auswirkungen auf die Gesellschaft haben, unter anderem auf die Antibiotikaresistenz oder die Trinkwasserreinigung.
Einleitung
Aufgrund der wachsenden Zahl von Märkten für solche Materialien wird derzeit zunehmend umweltfreundliche und nachhaltige Lösungen für die Herstellung von räumlich gemusterten Materialienentwickelt. Dieser Artikel stellt eine einfache, kostengünstige Methode zur Herstellung solcher Materialien vor und bietet somit ein breites Spektrum an zukünftigen Anwendungen. Die hier vorgestellte Methode ermöglicht das dreidimensionale (3D) Drucken von räumlich gemusterten Strukturen mit einer Bio-Tinte, die lebende Bakterien enthält. Bakterien bleiben innerhalb der gedruckten Strukturen über eine Woche lebensfähig, so dass die Bakterien natürliche oder technische Stoffwechselaktivitäten ausführen können. Druckbakterien können so gewünschte Bauteile innerhalb der gedruckten Struktur herstellen und ablagern, zum Beispiel einen funktionellen, vernetzten Biofilm2.
Traditionelle Methoden zur Herstellung von fortschrittlichen Materialien sind mit hohen Energiekosten (z.B. hohe Temperaturen und/oder Drücke) verbunden und können große Mengen an chemischen Abfällen produzieren, oft giftige Stoffe, die eine kostenintensive Nutzung erfordern 3 ,4. Im Gegensatz dazu sind mehrere Bakterienarten in der Lage, Materialien herzustellen, die in verschiedenen Branchen leicht einsetzbar sind. Zu diesen Materialien gehören Polymere wie Polyhydroxyalkanoate (PHA) 5 oder Poly (Glycolide-Co-lactide) (PGLA)6, bakterielle Zellulose7, bakterielle Betonmaterialien8, biomimetische Verbundstoffe9, Amyloid-basierte Klebstoffe10, oder biobasierte elektrische Schalter11, unter anderem. Darüber hinaus erfolgt die bakterielle Produktion wertvoller Materialien in der Regel bei nahezu Umgebungstemperaturen und Drücken und in wässrigen Umgebungen, ohne dass toxische Verbindungen benötigt oder produziert werden. Während die Herstellung von Materialien mit Bakterien in der Literatur nachgewiesen wurde und einige industrielle Anwendungen bereits12,13entstanden sind, bleibt eine zuverlässige Methode zur räumlichen Musternährung solcher Materialien eine Herausforderung.
Dieser Artikel zeigt eine geradlinige Methode, einen kostengünstigen kommerziellen 3D-Drucker in einen 3D-Bakteriater-Drucker umzuwandeln. Das Protokoll zeigt, wie eine Bio-Tinte, die die lebenden Bakterien enthält und erhält, hergestellt werden kann, sowie wie Substrate hergestellt werden können, auf die der 3D-Druck durchgeführt werden kann. Diese Methode ist geeignet, um mit einer Vielzahl von natürlichen und technischen Bakterienstämmen in der Lage, Materialien zu produzieren. Diese Bakterien können räumlich in einer 3D-gedruckten Struktur verteilt werden und setzen ihre Stoffwechselaktivität fort, was zu einer räumlichen Verteilung der gewünschten Materialien der Bakterien führt.
Diese Druckmethode ermöglicht die additive Herstellung von Biofilmen, Aggregaten von Bakterien, die von einer selbst produzierten extrazellulären Matrix umgeben sind. Biofilme sind heterogene 3D-Netzwerke, in denen Proteine, Polymere, Bakterienzellen, Sauerstoff und Nährstoffe alle räumlich strukturiertsind. Während Bakterien in Form eines Biofilms eine erhöhte Antibiotikaresistenz und strukturelle Robustheit aufweisen, was es schwierig macht, sie von Oberflächen wie medizinischen Kathetern und Implantaten auszulöschen. Der Schlüssel zu Biofilm-Eigenschaften und auch die größte Herausforderung für die Biofilm-Forschung scheint die Heterogenität von Biofilmen15,16,17zu sein. Die Herstellung von räumlich gesteuerten Modellbiofilmen ist von besonderem Interesse, da sie es ermöglichen würde, die räumlichen Muster von Biofilm-Komponenten zu reproduzieren oder zu stimmen, was das Verständnis für die stabile Ablagerung von Biofilmen auf nahezu jeder Oberfläche in der natur.
Dieser Artikel stellt ein Verfahren zur Herstellung von Biofilmen vor, bei denen 3D-gedruckte Hydrogele mit technischen E . coli-Bakterien , die Biofilm-Proteine in Anwesenheit eines Indukters produzieren, sowie Methoden zur Überprüfung der Biofilmbildung verwendet werden. . Die wichtigsten extrazellulären Matrixkomponenten dieser Biofilme sind curli Amyloid-Fasern 18, die selbst zusammengesetzte CsgA-Proteine enthalten. Wenn die E . coli-Bakterien zum Ausdruck von CsgA-Proteinen verleitet werden, bilden sie einen stabilen Modellbiofilm, der die Zellen vor dem Abwaschen der Druckfläche schützt. Ein solcher 3D-gedruckter Biofilm kann räumlich gesteuert werden und als nützliches Forschungsinstrument zur Untersuchung von mehrstufigen Biofilm-Strukturfunktionsmechanik oder Materiomik19dienen. Diese maßgeschneiderten Biofilme werden das Verständnis der Prinzipien der Biofilmbildung und ihrer mechanischen Eigenschaften fördern und unter anderem die Mechanismen der Antibiotikaresistenz weiter erforschen.
Protokoll
1. Umwandlung eines kommerziellen 3D-Druckers in einen 3D-Bioprinter
- Entfernen Sie den Extruder und die Heizung eines kommerziellen 3D-Druckers (Materialtabelle) aus dem Druckerrahmen und ziehen Sie die Verkabelung, die diese Elemente aus der Hauptleiterplatte (Abbildung 1A) steuert. Da der Sensor, der die Betriebstemperatur des Druckers steuert, funktionell sein muss, um mit der Druckersoftware zu kommunizieren, entfernen Sie aus der Drucksoftware den Algorithmus, der den Druck verzögert, bis die Betriebstemperatur erreicht ist.
- Verbinden Sie eine Pipette-Spitze (200 μL-Spitze) über Siliziumrohre (Innendurchmesser 1 mm) mit einer 5 mL-Spritze, die in eine Spritzenpumpe geladen wird. Als Ersatz für den Original-Extruder (Abbildung 1B) wird die Pipette-Spitze auf den3D-Drucker-Extruderkopf geklebt.
- Wenn mehr als eine Art von Bio-Tinte verwendet wird, montieren Sie zusätzliche Schlauchsysteme (n) und Pipette-Spitze (n) in den Drucker.
2. Substratvorbereitung für den 3D-Druck
- Fügen Sie 4 mL von 5 M CaCl 2-Lösung zu 400 mL von 1% w/agar in Luria-Bertani Brüte (LB) Medium aufgelöst, ergänzt mit entsprechenden Antibiotika und Induktoren (hier 34 μg/mL Chloramphenicol und 0,5% Rhamnose).
- In je 150 mm x 15 mm Petrischale 20 ml der LB-Agar-Lösung ablegen. Trockene 30 min bei Raumtemperatur mit dem Deckel halb offen.
Hinweis: Das Protokoll kann hier angehalten werden, indem diese Drucksubstrate bis zu mehreren Tagen bei 4 ° C gelagert werden.
3. Bio-Tinte-Vorbereitung
- Bereiten Sie eine Natriumalginatlösung (3% w/v) vor und erhitzen Sie dreimal auf den Siedepunkt, um die Lösung zu sterilisieren. Bei 4 ° C lagern, bis sie verwendet werden.
- Wachsen Sie E. coli MG1655 PRO c-sgA ompR234 ( E. Coli) Bakterien,die Plasmide pSB1C3-grünes Leuchtstoffprotein (GFP)( konstitutiver GFP-Ausdruck) 2 oder pSB1C3-GFP-CsgA (konstitutive GFSP-Expression, rhamnose-induzierbare CsgA) tragen Ausdruck) über Nacht bei 37 ° C mit Schütteln bei 250 U/min in 50 ml LB-Medium mit 34 μg/mL Chloramphenicol und 0,5% Rhamnose.
- Zentrifugen Sie die Zellkultur für 5 min bei 3.220 x g, um die Bakterien zu pleiten. Den Supernatant entfernen.
- Das Bakterienpellet in 10 mL LB-Medium neu aussetzen und 10 ml Natriumalginat (3% w/v) hinzufügen.
4.3D-Druckverfahren
- Installieren und öffnen Sie die 3D-Drucksoftware (Materialtabelle) auf einem Computer. Schließen Sie den 3D-Drucker an den Computer an. Bewegen Sie den Printhead in seine Heimatposition, indem Sie auf den Home-Button für die Achsen X, Y und Z klicken.
- Für jeden Druck ein präpariertes Drucksubstrat auf eine bestimmte Stelle auf dem Druckbett legen.
- Kalibrieren Sie die Höhe des Druckers in der Z-Achse.
- Heben Sie den Druckkopf unter manueller Kontrolle auf eine Höhe von 22 mm, damit er beim Umzug in die gewünschte Position nicht mit der Kante der Petrischale kollidiert. Positionieren Sie den Druckkopf oben auf der Platte und bewegen Sie ihn nach unten, bis die Pipette-Spitze die Druckfläche berührt. Weisen Sie diese Z-Achsen-Position als Z1 (Höhe der Druckfläche) an.
- Heben Sie den Druckkopf an und bewegen Sie ihn durch manuelle Steuerung in den Achsen X, Y und Z außerhalb des Plattenbereichs. Wenn der Arbeitsabstand zwischen dem Druckkopf und der Plattenoberfläche als Z2 definiert ist, geben Sie Z1 + Z2 als Z-Wert beim Drucken in das Druckprogramm ein.
- Programmieren Sie die Druckform nach der gewünschten Flugbahn durch eine selbst entwickelte punktgenaue Koordinationsmethode.
- Wenn die gewünschte Flugbahn eine gerade Linie ist, definieren Sie nur die Start-und Endpunkte. Die Aufnahme zusätzlicher Punkte auf den geschwungenen Linien führt zu glatteren Kurven. Bewegen Sie den Druckkopf nacheinander manuell zu jedem Punkt und zeichnen Sie die Koordinaten dieser Punkte in der Reihenfolge auf. Geben Sie alle diese Koordinaten sowie die Druckergeschwindigkeit für jedes gedruckte Segment in den G-Code-Editor ein.
- Heben Sie den Druckkopf vor und nach dem Druck auf eine Distanz, die höher ist als die Plattenkante (20 mm), und bewegen Sie sich direkt aus der Plattenregion. Speichern Sie dieses Programm als G-Code-Datei und laden Sie direkt für den Einsatz in nachfolgenden Drucken, während Sie die Z-Achsenhöhe für jedes neue Drucksubstrat neu messen.
Hinweis: Siehe Tabelle 1 für einen Beispiel G-Code zum Drucken eines Quadrats. - Laden Sie die vorprogrammierte G-Code-Datei. Öffnen Sie den G-Code-Editor in der Software und programmieren Sie in den Befehlen zum Drucken der gewünschten Form. An jeder Kommandozeile kann die Position des Druckers in der Achse X, Y, and/oder Z geändert werden. Geben Sie den Z-Wert während aller Druckschritte als Z1 + Z2 ein (Höhe der Druckfläche + Arbeitsabstand).
Hinweis: Auch die Fahrgeschwindigkeit ist einstellbar; 9.000 mm/. - Laden Sie die flüssige Bio-Tinte in Spritze (n) und montieren Sie sie in die Spritzenpumpe des 3D-Bioprinters.
- Drucken Sie die Bio-Tinte auf das Drucksubstrat aus , indem Sie auf den Druckknopf klicken.
- Während des Drucks steuern Sie die Druckbewegung vollständig durch die Software. Starten Sie die Spritzenpumpe manuell, bevor der Druckkopf mit der Druckfläche in Berührung kommt.
Hinweis: Die Koordination der Spritzenpumpe und des Druckers wird empirisch bestimmt, abhängig von der Extrusionsgeschwindigkeit, der Geschwindigkeit, mit der sich der Druckkopf zum ersten Druckpunkt bewegt, und der Ausgangsposition des Druckers. Wenn die anfängliche Druckerposition 20 mm beträgt, mit einer Druckgeschwindigkeit von 9.000 mm und einer Extrusionsgeschwindigkeit von 0,1 mL/h, starten Sie die Spritzenpumpe unmittelbar nach dem Druckstart. Wenn die Extrusionsgeschwindigkeit von 0,1 mL/h auf 0,3 mL/h geändert wird, dann warten Sie 2 − 3 s, um die Spritzenpumpe nach dem Druckstart zu starten. - Stoppen Sie die Spritzenpumpe, sobald der Druckkopf an der letzten Druckstelle ankommt. Verbinden Sie die Spritzenpumpe, bevor sich der Druckkopf am Ende des Druckprozesses hebt, sonst wird überschüssige Bio-Tinte auf das Drucksubstrat fallen und die Druckauflösung reduzieren.
- Für den Aufbau von 3D-Strukturen, steuern Sie alle Bewegungen des Druckers im G-Code-Editor. Geben Sie die Druckhöhe der ersten Schicht ein. Erhöhen Sie den Z-Wert im G-Code um 0,2 Millimeter, damit die zweite Schicht die Druckhöhe erhöht. Danach den Z-Wert um 0,1 Millimeter erhöhen, wenn man sich auf eine höhere Schicht bewegt. Bewegen Sie die Platte während des Druckprozesses nicht.
- Um die Breite und Höhe des bedruckten Hydrogels zu messen, verwenden Sie ein Stahlregal, das unter oder neben der Probe platziert wird.
5. Wachstum und Erprobung der Wirksamkeit der Biofilmproduktion durch E. coli
- Inkubieren Sie die bedruckten Proben bei Raumtemperatur für 3 − 6 Tage, um die Herstellung von Biofilm-Komponenten (Curli-Fasern) zu ermöglichen. Bildmachen Sie die Platten mit einer Kamera oder einem Leuchtstoffscanner.
- Um die Alginatmatrix aufzulösen, fügen Sie 20 mL von 0,5 M Natriumcitrat-Lösung (pH = 7, die mit NaOH eingestellt ist) zu den Drucksubstraten hinzu und inkubieren Sie für 2 Stunden mit 30 U/min Schütteln bei Raumtemperatur. Verwerfen Sie die Flüssigkeit und Bild der Platten wieder, um mit den Bildern der Platten vor der Zitatbehandlung zu vergleichen.
Ergebnisse
Der erste Schritt für den erfolgreichen 3D-Druck von Biofilmen ist die Umwandlung eines kommerziellen 3D-Druckers in einen Bioprinter. Diese Umstellung erfolgt durch das Entfernen des Extruders und der Heizung des Druckers, der für den Druck mit einer polymeren Tinte ausgelegt ist, und durch Komponenten, die für den Druck von Biofarb-Tinte mit lebenden Bakterien geeignet sind (Abbildung 1A). Der Extruder wird durch eine Pipette-Spitze (oder Spitzen, wenn mehrere Bio-Tinten im Druckprozess verwendet werden) ersetzt, die an einem Schlauchsystem befestigt ist, das an eine Spritzenpumpe angeschlossen ist (Abbildung 1B). Die erfolgreiche Umwandlung des gewerblichen Druckers in einen Bioprinter kann anhand der Möglichkeit beurteilt werden, die gewünschten Biofarbchen von der Spritzenpumpe über das Rohrsystem und Pipette-Spitze (n) auf eine Druckfläche zu übertragen, ohne zu durchsickern oder die Bio-Tinte. Wenn die Rohre durch den Fluss der Bio-Tinte während des Drucks geschwemmt werden, kann es durch Schläuche mit dickeren Wänden ersetzt werden. Es ist zu beachten, dass diese Drucktechnik in der Lage sein sollte, mit jeder Art von kommerziellem 3D-Drucker zu arbeiten, für die Schläuche am Druckkopf befestigt werden können.
Der 3D-Bioprinter kann bakterienverkapselnde Hydrogele in einer Vielzahl von zweidimensionalen (2D) und 3D-Formen (Abbildung2) erzeugen. Kalziumionen im Drucksubstrat führen zur Verfestigung (Chelation von Kalzium-Ionen mit Alginat-Carboxylgruppen) der Bio-Tinte beim Druck und wandeln die flüssige Bio-Tinte in ein festes Hydrogel um. Die Auflösung des Bioprinting hängt von der Extrusionsgeschwindigkeit, der Größe der Pipette-Spitze, der Geschwindigkeit des Druckers, der Lautstärke und Konzentration der CaCl2-Lösung ab, die der Agar-Lösung hinzugefügt wird, der Flachheit der Druckfläche und der Viskosität der Die verwendete Bio-Tinte. Die Konzentration der CaCl2-Lösung hat einen großen Einfluss auf die Hydrogel-Schärfe. Vier verschiedene Konzentrationen von CaCl 2 (0,1 M, 0,2 M, 1 M und 5 M) wurden abgetastet, und nur 5 M CaCl2-Lösung führte zu Hydrogel, das nach dem Druck nicht verschwimmt. Daher wurde 5 M als optimale Konzentration der CaCl2-Lösung gewählt.
In einer früheren Version dieses Protokolls wurde die CaCl2-Lösung auf die Oberfläche der Agarplatte aufgetragen und vor dem Gießen der Agarplatte in die Agar-Lösung gemischt. Bei der Verwendung dieser Version hat das Volumen der CaCl2-Lösung einen entscheidenden Einfluss auf Druckqualität und-auflösung. Bei der Verwendung einer 150 x 15 mm Petrischale führt das Auftragen eines Kalziumchloridvolumens von mehr als 100 μL (oder 30 μL für eine 90-mm-Petrischale) dazu, dass zu viel Flüssigkeit auf der Druckfläche verbleibt. Diese Flüssigkeit kann sich ungleichmäßig ausbreiten, wenn die Platte bewegt wird, was den Arbeitsabstand verändern und zu einer Blockade der Pipette-Spitze führen kann. Zu viel Volumen von CaCl2 kann auch dazu führen, dass bedruckte Hydrogele über die Lösung schweben und gleiten, was die Form und Position des bedruckten Hydrogels verändert. Wenn das Volumen der Kalziumchlorid-Lösung zu klein ist, können einige Regionen der Platte keine CaCl2-Lösung erhalten und haben eine schlechte Hydrogel-Fardifizierung. In diesem verbesserten Protokoll führte die direkte Zugabe der CaCl 2-Lösung in die Agar-Lösung vor dem Gießen der Agarplatte zu wesentlich weniger Feuchtigkeit auf der Oberfläche des Drucksubstrats im Vergleich zur oberflächlichen Methode, was zu einer wesentlich geringeren Feuchtigkeit auf der Oberfläche des Drucksubstrats führte, was zu einer wesentlich geringeren Feuchtigkeit auf der Oberfläche des Drucksubstrats führte. Die Druckauflösung wurde deutlich verbessert.
Die Extrusionsgeschwindigkeit und die Druckbewegung sind voneinander abhängig und können koordiniert auf die Druckauflösung abgestimmt werden. Wird der Drucker zum Beispiel mit einer Extrusionsgeschwindigkeit zwischen 0,1 mL/h und 0,5 mL/h mit einer konstanten Druckbewegung von 300 mm/min betrieben,erhöhtsich der Durchmesser des bedruckten Hydrogels mit der Erhöhung der Extrusionsgeschwindigkeitvon 2,20. Bei Extrusionsgeschwindigkeiten von über 0,5 mL/h wechseln sich die äußeren Kanten der gedruckten Hydrogellinien von geraden, parallelen Linien zu wellenförmigen Linien, und auch die Linienbreite steigt. Die Geschwindigkeit des Printheads hat auch Einfluss auf die Druckauflösung. Mit einer konstanten Extrusionsgeschwindigkeit von 0,3 mL/h führt die Erhöhung der Druckgeschwindigkeit von 300 mm/min auf 500 mm/min dazu, dass die Breite des bedruckten Hydrogeles schmaler wird und von 1,8 mm auf 0,9 mm abnimmt. Wenn die Druckschrift über 500 mm/min ist, wird die Gel-Linie leicht diskontinuierlich. Für eine 200 μL-Pipettspitze und die in der aktuellen Studie verwendete Bio-Tinte gelten mehrere Kombinationen der Druckauflösung als optimal (Tabelle 2). Bei Pumpgeschwindigkeit 0,3 mL/h, Druckerbewegung von 500 mm/min und Arbeitsabstand 0,2 mm wird bedrucktes Hydrogel mit einer Breite von ca. 0,9 mm hergestellt.
Eine entscheidende Errungenschaft der bakteriellen 3D-Druckmethode ist die Fähigkeit, technische Biofilme zu erstellen. Um einen technischen und räumlich gesteuerten Biofilm zu schaffen, sollten die Bakterien nicht nur den 3D-Druckprozess überleben, sondern auch Biofilmkomponenten herstellen, während sie im gedruckten Muster verbleiben. Die in diesem Protokoll verwendeten technischen E. coli-Bakterien , E. coli-csgA Bakterien , die das Plasmid pSB1C3-GFP-CsgA tragen, ermöglichen eine kontrollierbare Expression von Curli-Proteinen. Die Verwendung eines csgA-Knockout-Stammes sorgt dafür, dass das CsgA-Protein nur dann zum Ausdruck kommt, wenn es aus einem Plasmid mit Rhamnose induziert wird. Die Bakterien exportieren die induzierten CsgA-Proteinuntereinheiten, die sich dann 21 auf CsgB-Proteine auf der bakteriellen Außenmembran 22 zusammensetzen, um Curli-Fasern zu bilden. Diese amyloidartigen Fasern sind die wichtigsten proteinhaltigen Bestandteile der biofilmextrazellulären Matrix: Ein vernetztes Netzwerk von Proteinen und Polymeren, in das die Bakterien eingebettet sind. Die bedruckte Alginatmatrix der 3D-Drucke Bio-Tinte verleiht den Bakterien während des Curli-Produktionsprozesses körperliche Unterstützung und Struktur. Die Verwendung eines konstitutiven GFP-Ausdrucks ermöglicht die Visualisierung und Quantifizierung von gedruckten Zellen mittels Fluoreszenz-Bildgebung.
Um zu beurteilen, ob die Bildung von Biofilm erfolgreich war, wurde die Alginatmatrix mit einer Natriumcitrat-Lösung aufgelöst und die Form der gedruckten Biofarbe nach der Zitratbehandlung bewertet (Abbildung3). Bei Bio-Tinte ohne induzierbares Curli-Produktionsplasmid wurde das gedruckte Muster nach der Natriumcitrat-Behandlung vollständig aufgelöst, was bedeutet, dass sich kein Biofilm-Kurli-Netzwerk gebildet hatte (Abbildung 3A, B). Bei Bakterien, die die induzierbare Curli-Produktion Plasmid enthalten, wurde das Gel nach der Natriumcitrat-Behandlung nicht aufgelöst (Abbildung 3C, D). Dieses Ergebnis deutet darauf hin, dass die bedruckten Bakterien in der Lage waren, ein Curli-Netzwerk zu bilden, das umfangreich genug war, um das bedruckte Muster von Bakterienzustabilisieren 2.
Um mehrschichtige Strukturen zu konstruieren, wurden zusätzliche Schichten gedruckt (Abbildung 4), indem die Druckhöhe und die Druckbahn im G-Code-Editor angepasst wurden. Die Erhöhung der Anzahl der gedruckten Schichten in einer Probe führte dazu, dass die Breite und Höhe der gedruckten Strukturen stufenweise anstieg (Abbildung5)2,20,aberauch 5-Schicht-Druckkonstruktionen konnten mit einer Auflösung erstellt werden. Millimeter bis Submillimeter. Als E. coli zur induzierenden Herstellung von Curli-Proteinen in vielschichtige Strukturen gedruckt wurde, löste die Natriumcitrat-Behandlung die Proben nicht auf, während mehrschichtige Strukturen, die nicht-curli-produzierende E. coli enthielten , in vielschichtige Strukturen bedruckt wurden. Aufgelöst in Natriumcitrat-Lösung (Abbildung 6). Dieses Experiment zeigt, dass technische Biofilme in mehrschichtigen, dreidimensionalen Druckstrukturen sowie in einschichtigen Druckstrukturen entstehen können.

Abbildung 1: Fotos, die die Umwandlung eines kommerziellen 3D-Druckers in einen 3D-Bioprinter zeigen. (A) Die Komponenten des 3D-Bioprinters nach der Konvertierung aus einem kommerziellen 3D-Drucker. (B) Der Bio-Tintenextruder, der durch ein Schlauchsystem gebildet wird, das an einer Pipette-Spitze befestigt ist. Zusätzliche Drucktipps können im zweiten Druckbohrloch oder durch das Hinzufügen zusätzlicher Löcher in den Druckkopf hinzugefügt werden, um mehrere Arten von Bio-Tinte zu drucken. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
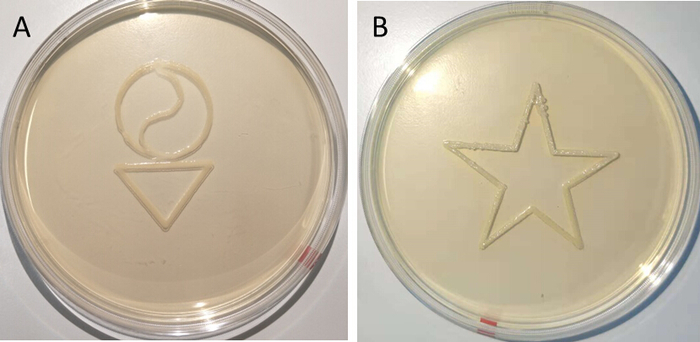
Abbildung 2: Beispiele für 3D-Bioprinted Muster, die E. coli pSB1C3-GFP-CsgA enthalten. Diese Bilder wurden zwei Tage nach dem Druck aufgenommen. Diese Druckauflösung wurde mit Pumplungsgeschwindigkeit 0,3 mL/h, Druckerbewegung 300 mm/min und Arbeitsabstand 0,2 mm erreicht. Die G-Codes für den Druck dieser Formen finden Sie in den Zusatzdateien. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3: Eine Methode, um zu überprüfen, ob Biofilm-Komponenten von E. coli-Bakterien innerhalb eines gedruckten Musters hergestellt wurden. Beim Druck von E. coli enthielt ein Plasmid, das für die Curli-Induktion nicht kodiert war, wurde das gedruckte Muster durch die Natriumcitrat-Behandlung (A und B) vollständig aufgelöst. Als E. coli , das ein Plasmid-Kodierungsplanz enthält, induzierbare Curli-Proteine verwendet wurde, war der bedruckte Biofilm resistent gegen die Behandlung von Natriumcitrate (C und D). Der Programmierprozess und die Erläuterungen des G-Codes für den Druck dieses quadratischen Musters sind in Tabelle 1enthalten. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 4: Oberansicht (A) und Seitenansicht (B) von mehrschichtigen Druckstrukturen, die E. coli pSB1C3-GFP-CsgA enthalten. Diese Probe wurde mit Pumpgeschwindigkeit 0.3 mL/h, Druckerbewegung Tempo 200 mm/min und Arbeitsabstand 0,2 mm gedruckt.

Abbildung 5: Die Linienbreite und Höhe der bedruckten Hydrogele, die unterschiedliche Anzahl von bedruckten Schichten enthalten. Die Messungen wurden an Proben durchgeführt, die mit Pumpgeschwindigkeit 0,3 mL/h, Druckmaschinenbewegungsgeschwindigkeit 500 mm/min und Arbeitsabstand 0,2 mm gedruckt wurden .

Abbildung 6: Eine Methode, um zu überprüfen, ob Biofilmbestandteile von E. coli-Bakterien in mehrschichtigen Druckstrukturen hergestellt wurden. Die Ingenieurin E. coli wurde in 1-, 3-oder 5-Schicht-Hydrogele gedruckt und 6 Tage lang inbratiert. Als das gedruckte E. coli ein Plasmid enthielt, das für die Curli-Induktion nicht kodiert war, wurde das gedruckte Muster durch die Natriumcitrat-Behandlung (A und B) vollständig aufgelöst. Als das bedruckte E . coli ein Plasmid-Kodierung-induzierbare Curli-Proteine enthielt, war der bedruckte Biofilm resistent gegen die Behandlung von Natriumcitrate (C und D). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| G-Code-Befehle | Aufgaben |
| G1 Z20 F9000 | Heben Sie die Z-Achse auf eine Höhe von 20 mm mit einer Geschwindigkeit von 9.000 mm. |
| G1 X95 Y65 F9000 | Bewegen Sie sich mit einer Geschwindigkeit von 9.000 mm/min zum Ausgangspunkt der ersten Linie. |
| G1 Z6 F9000 | Bewegen Sie sich nach unten in Z-Richtung in einen ordentlichen (hier Z = 6 mm) Druckabstand. |
| G1 X95 Y105 F300 | Endpunkt der ersten Zeile und Startpunkt der zweiten Zeile. |
| G1 X135 Y105 | Endpunkt der zweiten Linie und Startpunkt der dritten Linie. |
| G1 X135 Y65 | Endpunkt der dritten Linie und Startpunkt der vierten Linie. |
| G1 X95 Y65 | Endpunkt der vierten Zeile und Startpunkt der ersten Zeile; Ein Quadrat wird gebildet. |
| G1 Z20 F9000 | Heben Sie die Z-Achse auf eine Höhe von 20 mm bei 9.000 mm/min. |
| G1 X55 Y40 F9000 | Bewegen Sie sich auf eine Koordinate (55,40) außerhalb der Petrischale. |
Tabelle 1: Programmierprozess und Erläuterungen zum G-Code zum Drucken eines Quadrats.
| Extrusionsgeschwindigkeit (mL/h) | Druckansicht bewegliche Geschwindigkeit (mm/min) | Gelbreite (mm) |
| 0,1 | 100 | 1,6 ± 0,1 |
| 0,1 | 200 | 1,1 ± 0,1 |
| 0,1 | 300 | 1,0 ± 0,1 |
| 0,3 | 300 | 1,8 ± 0,1 |
| 0,3 | 400 | 1,2 ± 0,1 |
| 0,3 | 500 | 0,9 ± 0,1 |
| 0,5 | 200 | 2,2 ± 0,2 |
| 0,5 | 1.200 | 1,2 ± 0,2 |
| 0,7 | 200 | 2,8 ± 0,1 |
| 0,7 | 1.200 | 1,3 ± 0,1 |
Tabelle 2: Die optimalen Druckparameter für Hydrogele mit hoher Auflösung. Für jede Bedingung wurden fünf Punkte gemessen. Der Durchschnittswert und die Standardabweichung werden in der Tabelle angezeigt.
Diskussion
Das hier vorgestellte Protokoll für den 3D-Druck von technischen Biofilmen hat zwei kritische Schritte. Der erste ist die Vorbereitung der Agar-Druckfläche, die der kritischste Faktor für die Erzeugung einer bestimmten Druckauflösung ist. Wichtig ist, dass die Druckfläche flach ist und die Pipette-Spitze auf dem Druckkopf in der richtigen Höhe von der Oberfläche aus positioniert wird. Ist die Oberfläche nicht flach, ändert sich der Arbeitsabstand während des Druckprozesses. Wenn der Arbeitsabstand weniger als 0,1 mm beträgt, könnte die CaCl2-Lösung in die Pipette-Spitze eindringen und die Hydrogelbildung verursachen, wodurch die Pipette-Spitze verstopft wird. Liegt der Arbeitsabstand bei mehr als 0,3 mm, kann das Gel nicht kontinuierlich gedruckt werden. Der optimale Arbeitsabstand in dieser Studie liegt bei 0,2 mm. Gute Ansätze für die Zubereitung von flachen Agar-Druckflächen sind die Verwendung von Petrischalen mit einem größeren Durchmesser (Petrischale mit 150 mm-Durchmesser statt einer Bleche mit 90 mm-Durchmesser), die Platten auf einen flachen Tisch legen, den Agar gießen. Lösung mit schneller und gleichmäßiger Geschwindigkeit, und vermeiden Sie das Verschieben der Agarplatte während der Verfestigung.
Der zweite kritische Schritt ist die Auswahl der gewünschten Druckparameter wie Pumpgeschwindigkeit, Viskosität der verwendeten Bio-Tinte und Druckgeschwindigkeit, die die resultierende Druckauflösung bestimmen. Um diese Parameter effizient auszuwählen, kann der Anwender mehrere Extremwerte für die Druckgeschwindigkeit mit einer konstanten Extrusionsrate ausprobieren und dabei die Breite des gedruckten Hydrogels für jede Menge Bedingungen angeben. Dann wiederholen Sie dieses Experiment mit 4 anderen Extrusionsraten. Als Nächstes nehmen wir die fünf Kombinationen, die die beste Druckauflösung für die Anwendung erzeugten, und variieren beide Druckparameter (Pump-und Druckgeschwindigkeit) in kleineren und kleineren Schritten, bis die gewünschte Auflösung erreicht ist.
Die Dicke der bedruckten Linien hat Auswirkungen auf die Fähigkeit der bedruckten Bakterien, stabile Biofilme zu bilden. Unter optimalen Druckbedingungen (Pumpgeschwindigkeit 0,3 mL/h, Druckgeschwindigkeit 300 mm/. Minute und Arbeitsabstand 0,2 mm) werden gedruckte Linien der Bio-Tinte nach 3-6 Tagen Inkubation bei Raumtemperatur stabile Biofilme produzieren. Wenn die Leitungen dicker werden, etwa durch die Erhöhung der Pumpgeschwindigkeit, können die mittleren Regionen jeder Linie nicht ausreichend induziert werden, um stadtstabile Biofilme zu produzieren.
Beim Drucken eines mehrschichtigen Bio-Tinte-Hydrogels wird jede gedruckte Schicht bei Kontakt mit den Kalzium-Ionen, die sich in die vorherige gedruckte Schicht ausgeblendet haben, verfestigt. Da die Ca2 +-Konzentration im Drucksubstrat hoch ist, können sich Ca2 + -Ionen schnell durch die unteren Schichten ausbreiten. Daher können die oberen Schichten sofort nach dem Drucken der bisherigen Schichten gedruckt werden, indem die Druckhöhe im G-Code-Editor eingestellt wird. Außerdem sollte der Druckabstand der oberen Schicht auf nur 0,1 − 0,2 mm höher als der Druckabstand der vorherigen Schicht begrenzt werden. Liegt der hinzugefügte Druckabstand unter 0,1 mm, zieht sich die Spitze über die erste Schicht und reduziert die Auflösung des bedruckten Hydrogels. Wenn der hinzugefügte Druckabstand größer als 0,2 mm ist, bildet die Bio-Tinte während der Extrusion Flüssigkeitstropfen, wodurch das gedruckte Hydrogel diskontinuierlich wird.
Der aktuelle Bioprintierungsansatz ermöglicht die Herstellung reproduzierbarer, räumlich gesteuerter technischer Biofilme, die für die Untersuchung von biofilmmechanischen Eigenschaften oder der biologischen Resistenz von Biofilmbakterien gegen verschiedene Faktoren geeignet sind, darunter Antibiotika, Tenside, etc. Diese Fähigkeit gewährleistet eine direkte Nutzbarkeit der vorgeschlagenen Methode. Die Entwicklung von höherpräzisen Do-it-yourself-Bioprinters (DIY) wird wahrscheinlich möglich sein, indem der Druckarbeitdistanz-Bereich beibehalten wird, aber die Pumplungsgeschwindigkeit und die bewegliche Geschwindigkeit des Druckers gesenkt wird, oder indem verschiedene Extruder-Geometrien Stichproben und Bio-Tinte-Chemie. Mit zukünftigen Verbesserungen der Druckauflösung können weitere Anwendungen wie die Gewebe-Technik oder die Medikamentenzufuhr ermöglicht werden. Der hier beschriebene 3D-Bioprintierungsansatz soll auch auf den Druck zusätzlicher Bakterienarten erweitert werden können, die biokompatibel mit unserer alginalen Bio-Tinte sind. Das aktuelle Protokoll sorgt für eine ausreichende Sterilität, indem es die Bio-Tinte während der Zubereitung immer wieder kocht, sterile Spritzen und Druckspitzen verwendet und Antibiotika sowohl in der Bio-Tinte als auch in der Druckplatte verwendet. Zukünftige Experimente mit Wildbakterien können zusätzliche Sterilisationsmaßnahmen erfordern, wie zum Beispiel das Ersetzen oder Desinfonisieren des Schlauchsystems zwischen den Drucken.
Nach bestem Wissen der Autoren ist die vorgestellte Methode (ursprünglich in Lehner et al.20entwickelt) das erste veröffentlichte Beispiel für einen additiven Herstellungsstil für den 3D-Druck von Bakterien. Im ersten Teil dieses Protokolls wird diese allgemeine Methode detailliert für den 3D-Druck von Bakterien beschrieben, der für die Herstellung von technischen Biofilmen 2 angewendet wird. Mit dieser Methode sind mehrere zukünftige Anwendungen von 3D-gedruckten Biofilmen möglich. In der Natur haben sich mehrere Bakteriensysteme entwickelt, die verschiedene Arten von Biofilmen schaffen, von denen in diesem Artikel ein einziges System erforscht wurde. Mehrere andere Systeme lassen sich leicht untersuchen, indem 3D-gedruckte Biofilme mit anderen bakteriellen Systemen wie Bacillus subtilis oder Acetobacter xylinumerstellt werden. Auch für die räumliche ModellierungvonBakterien mit optischer Signaltechnik wurden alternative Methoden 23, 24 entwickelt . Diese Ansätze erfordern teurere, kompliziertere Geräte, um sie im Vergleich zu diesem Drucker zu erreichen, und eignen sich nur für das Mustern von gentechnisch veränderten Bakterien.
Die Fähigkeit, 3D-gedruckte Biofilme mit dieser Methode räumlich zu modellieren, kann die Schaffung von technischen Biofilmen ermöglichen, die die räumliche Heterogenität natürlicher Biofilme 25 reproduzieren. Durch die sehr detailgetreue Anordnung von Protein-und Polymerfasern innerhalb eines Biofilms erreichen Bakterien im Biofilm-Zustand eine deutlich höhere Resistenz gegen chemische und physikalische Reize, wie eine erhöhte Resistenz gegen Antibiotika im Vergleich zu den gleichen Bakterien im planktonischen Zustand. Darüber hinaus zeigen Bakterien innerhalb eines Biofilms eine erhöhte Resistenz gegen Flüssigkeitsfluss, was die Wartung und Sterilität von implantierbaren Medizinprodukten deutlich erschwert 26. Gedruckte, technische Biofilme, die versuchen, die spezifischen räumlichen Verteilungen von Biofilm-Komponenten zu reproduzieren, sind leistungsfähige Werkzeuge, um die Mechanismen zu untersuchen, mit denen Bakterien innerhalb eines Biofilms Resistenzphänotypen erreichen.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch einen AOARD-Zuschuss (Nr. FA2386-1-1-4059), die niederländische Organisation für wissenschaftliche Forschung (NWO/OCW) im Rahmen des Programms "Frontiers of Nanoscience" und das Advanced Materials NWO-NSFC Programm (Nr. 729.001.016). Die Autoren bestätigen die Laborhilfe von Ramon van der Valk und Roland Kieffer.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D printer | CoLiDo | 3D-P Kit | |
| 3D printing software | CoLiDo | Print-Rite ColiDo Repetier-Host v2.0.1 | |
| Agar | Sigma-Aldrich | 05040 | |
| CaCl2 dihydrate | Sigma-Aldrich | C7902 | |
| Centrifuge | Eppendorf | 5810 R | |
| Chloramphenicol | Sigma-Aldrich | 3886.1 | |
| LB broth powder | Sigma-Aldrich | L3022 | |
| Orbital shaker | VWR | 89032-092 | Model 3500 |
| Petri dish | VWR | 25384-326 | 150 x 15 mm |
| Rhamnose | Sigma-Aldrich | 83650 | |
| Silicon tubing | VWR | DENE 3100103/25 | |
| Syringe pump | ProSense B.V. | NE-300 | |
| Sodium alginate | Sigma-Aldrich | W201502 | |
| Sodium citrate monobasic | Sigma-Aldrich | 71498 | |
| Sodium hydrooxide | VWR | 28244.295 |
Referenzen
- Tibbitt, M. W., Rodell, C. B., Burdick, J. A., Anseth, K. S. Progress in material design for biomedical applications. Proceedings of the National Academy of Sciences of the United States of America. 112 (47), 14444-14451 (2015).
- Schmieden, D. T., et al. Printing of Patterned, Engineered E. coli Biofilms with a Low-Cost 3D Printer. ACS Synthetic Biology. 7 (5), 1328-1337 (2018).
- Mao, L. B., et al. Synthetic nacre by predesigned matrix-directed mineralization. Science. 354 (6308), 107-110 (2016).
- Gao, H. L., et al. Mass production of bulk artificial nacre with excellent mechanical properties. Nature Communications. 8 (1), 287(2017).
- Poirier, Y., Nawrath, C., Somerville, C. Production of Polyhydroxyalkanoates, a Family of Biodegradable Plastics and Elastomers, in Bacteria and Plants. Nature Biotechnology. 13, 142-150 (1995).
- Choi, S. Y., et al. One-step fermentative production of poly(lactate-co-glycolate) from carbohydrates in Escherichia coli. Nature Biotechnology. 34 (4), 435-440 (2016).
- Mohammadi, P., Toivonen, M. S., Ikkala, O., Wagermaier, W., Linder, M. B. Aligning cellulose nanofibril dispersions for tougher fibers. Scientific Reports. 7 (1), 11860(2017).
- Jonkers, H. M. Bacteria-based self-healing concrete. Heron. 56 (1/2), (2011).
- Schmieden, D. T., Meyer, A. S., Aubin-Tam, M. E. Using bacteria to make improved, nacre-inspired materials. MRS Advances. 1 (8), 559-564 (2016).
- Zhong, C., et al. Strong underwater adhesives made by self-assembling multi-protein nanofibres. Nature Nanotechnology. 9 (10), 858-866 (2014).
- Chen, A. Y., et al. Synthesis and patterning of tunable multiscale materials with engineered cells. Nature Materials. 13 (5), 515-523 (2014).
- Gatenholm, P., Klemm, D. Bacterial Nanocellulose as a Renewable Material for Biomedical Applications. MRS Bulletin. 35, 208-213 (2010).
- Rodriguez-Carmona, E., Villaverde, A. Nanostructured bacterial materials for innovative medicines. Trends in Microbiology. 18 (9), 423-430 (2010).
- Hung, C., et al. Escherichia coli biofilms have an organized and complex extracellular matrix structure. MBio. 4 (5), (2013).
- Donlan, R. M., Costerton, J. W. Biofilms: Survival Mechanisms of Clinically Relevant Microorganisms. Clinical Microbiology Reviews. 15 (2), 167-193 (2002).
- Wu, H., Moser, C., Wang, H. Z., Hoiby, N., Song, Z. J. Strategies for combating bacterial biofilm infections. International Journal of Oral Science. 7 (1), 1-7 (2015).
- Stewart, P. S., Franklin, M. J. Physiological heterogeneity in biofilms. Nature Reviews Microbiology. 6 (3), 199-210 (2008).
- Kikuchi, T., Mizunoe, Y., Takade, A., Naito, S., Yoshida, S. Curli Fibers Are Required for Development of Biofilm Architecture in Escherichia coli K-12 and Enhance Bacterial Adherence to Human Uroepithelial Cells. Microbiology and Immunology. 49 (9), 875-884 (2005).
- Cranford, S., Buehler, M. J. Materiomics: biological protein materials, from nano to macro. Nanotechnology, Science and Applications. 3, 127-148 (2010).
- Lehner, B. A. E., Schmieden, D. T., Meyer, A. S. A Straightforward Approach for 3D Bacterial Printing. ACS Synthetic Biology. 6 (7), 1124-1130 (2017).
- Wang, X., Smith, D. R., Jones, J. W., Chapman, M. R. In vitro polymerization of a functional Escherichia coli amyloid protein. Journal of Biological Chemistry. 282 (6), 3713-3719 (2007).
- Hammar, M., Bian, Z., Normark, S. Nucleator-dependent intercellular assembly of adhesive curli organelles in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 93 (13), 6562-6566 (1996).
- Huang, Y. J., Xia, A. G., Yang, G., Jin, F. Bioprinting Living Biofilms through Optogenetic Manipulation. ACS Synthetic Biology. 7 (5), 1195-1200 (2018).
- Jin, X. F., Riedel-Kruse, I. H. Biofilm Lithography enables high-resolution cell patterning via optogenetic adhesin expression. Proceedings of the National Academy of Sciences of the United States of America. 115 (14), 3698-3703 (2018).
- Stewart, P. S., Franklin, M. J. Physiological heterogeneity in biofilms. Nature Reviews Microbiology. 6 (3), 199-210 (2008).
- Percival, S. L., Suleman, L., Vuotto, C., Donelli, G. Healthcare-associated infections, medical devices and biofilms: risk, tolerance and control. Journal of Medical Microbiology. 64, 323-334 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten