Method Article
Umwandlung von vom Menschen induktiven Pluripotent-Stammzellen (iPSCs) in funktionale Wirbelsäulen-und Krankheitsanleitungsneuronen mit PiggyBac-Vektoren
In diesem Artikel
Zusammenfassung
Dieses Protokoll ermöglicht eine schnelle und effiziente Umwandlung von induzierten pluripotenten Stammzellen in motorische Neuronen mit einer Wirbelsäulen-oder Schädelidentität, indem es die Transkriptionsfaktoren von induzierbaren PiggyBac-Vektoren ausführt.
Zusammenfassung
Wir beschreiben hier eine Methode, um funktionelle Wirbelsäulen-und Schädelmotor-Neuronen aus vom Menschen induzierten pluripotenten Stammzellen (iPSCs) zu erhalten. Die direkte Umwandlung in Motorneuron erfolgt durch die ektopische Expression alternativer Module von Transkriptionsfaktoren, nämlich Ngn2, Isl1 und Lhx3 (NIL) oder Ngn2, Isl1 und Phox2a (NIP). NIL und NIP geben jeweils die Identität des Wirbelsäulen-und Schädelmotors Neuron an. Unser Protokoll beginnt mit der Generierung von modifizierten iPSC-Leitungen, bei denen NIL oder NIP über einen PiggyBac-Transpospo-Vektor stabil in das Genom integriert sind. Die Expression der Transgene wird dann durch Doxycyclin induziert und führt in 5 Tagen zur Umwandlung von iPSCs in MN-Vorläufer. Die anschließende Reifung führt zu einer homogenen Population von Wirbelsäulen-oder Schädelmlassen. Unsere Methode hat gegenüber früheren Protokollen mehrere Vorteile: Sie ist extrem schnell und vereinfacht; Es erfordert keine Virusinfektion oder eine weitere MN-Isolierung; Es ermöglicht die Erzeugung von verschiedenen MN-Subpopulationen (Wirbelsäule und Schädelung) mit einem bemerkenswerten Reifungsgrad, wie die Fähigkeit zeigt, Züge von Aktionspotenzialen zu befeuern. Darüber hinaus kann eine große Anzahl von motorischen Neuronen ohne Reinigung von gemischten Populationen gewonnen werden. Die iPSC-abgeleiteten Wirbelsäulen-und Schädelmotor-Neuronen können für die In-vitro-Modellierung der amyotrophen Lateralsklerose und anderer neurodegenerativer Erkrankungen des motorischen Neurons eingesetzt werden. Homogene motorische Neuronenpopulationen könnten eine wichtige Ressource für zelltypspezifische Arzneimittel-Screenings darstellen.
Einleitung
Motor-Neuron (MN) Degeneration spielt eine ursächliche Rolle bei menschlichen Erkrankungen wie der amyotrophen Lateralsklerose (ALS) und der Wirbelsäulenmuskulären Atrophie (SMA). Die Etablierung geeigneter In-vitro-Zellmodellsysteme, die die Komplexität des menschlichen MN rekapitulieren, ist ein wichtiger Schritt zur Entwicklung neuer therapeutischer Ansätze. Ausgeführte pluripotente Stammzellen (iPSCs), die mit bemerkenswerten Plurilinage-Differenzierungseigenschaften ausgestattet sind, stammen inzwischen von einer Reihe von Patienten, die von motorischen Neuronenkrankheiten 1,2betroffen sind. Zusätzliche iPSC-Linien, die pathogene Mutationen im Zusammenhang mit MN-Erkrankungen tragen, wurden durch die Genbearbeitung erzeugt, angefangen von der Kontrolle "gesunder" pluripotenter Stammzellen 3. Diese Linien stellen nützliche Werkzeuge für die Modellierung von In-vitro-Krankheiten und das Arzneimittelscreening dar, vorausgesetzt, dass geeignete Methoden für die iPSC-Figierung in MNs zur Verfügung stehen. Die Begründung für die Entwicklung dieser Methode besteht darin, der an PN-Krankheiten interessierten wissenschaftlichen Gemeinschaft ein schnelles und effizientes Differenzierungsprotokoll zu bieten, das zu reifen funktionellen MNs führt. Der erste Vorteil dieser Methode ist der Zeitrahmen der Ausführung. Ein weiterer relevanter Punkt der Stärke ist die Beseitigung eines Reinigungsschrittes. Schließlich kann das Protokoll verwendet werden, um zwei verschiedene Populationen von motorischen Neuronen zu erzeugen.
Die Möglichkeit, verschiedene Subtypen von MNs zu erzeugen, ist besonders für die Modellierung von MN-Erkrankungen relevant. Nicht alle MN-Subtypen sind in ALS und SMA gleich anfällig und das Auftreten von Symptomen in verschiedenen Motoreinheiten beeinflusst die Prognose stark. Bei ALS führt der Wirbelsäuleneintritt mit Symptomen, die in der oberen und unteren Gliedmaßen beginnen, in etwa 3-5 Jahren 4 zum Tod. Umgekehrt hat der Bulbar-Auftakt, beginnend mit der Degeneration der Schädelmähne, eine schlechteste Prognose. Darüber hinaus ist der Anteil des Bulbar-Ansatzes bei Patienten mit Mutationen in den RNA-bindenden Proteinen FUS und TDP-43 signifikanthöherals bei Personen mit SOD1-Mutationen 5. Fast die Gesamtheit alternativer MN-Differenzierungsprotokolle beruht auf der Aktivität der Retinosäure (RA), die der Differenzierung von iPSCs6,7,8einenWirbelsäulencharakter verleiht. Dies schränkt die Möglichkeit ein, intrinsische Faktorenzuuntersuchen, die in bestimmten PN-Subtypen 9,10Schutz bieten könnten.
Im Einklang mit einer früheren Arbeit in der Maus embryonalen Stammzellen11, Wir haben vor kurzem gezeigt, dass in menschlichen iPSCs ectopischen Ausdruck von Ngn2, Isl1 und Lhx3 (NIL) induziert eine Wirbelsäulen-MN-Identität, während Ngn2 und Isl1 plus Phox2a (NIP) angeben,kranial MNs 12. Deshalb haben wir ein effizientes Protokoll entwickelt, das zur Produktion von menschlichen MNs führt, die in einem 12-tägigen Turnaround mit funktionalen Eigenschaften ausgestattet sind. Ziel dieser Methode ist es, in kurzer Zeit und ohne Reinigungsbedarf (z.B. durch FACS) Zellpopulationen zu erhalten, die für MNs mit Wirbelsäulen-oder Schädelidentität hoch angereichert sind.
Protokoll
1. Wartung menschlicher iPSCs
-
Zubereitung von matrix-beschichteten Platten
- Tauen Sie eine 5 mL Ampull-Ampull-Matrix (siehe Materialtabelle) über Nacht bei 4 ° C auf. Die ursprünglichen Matrixbestände kommen in unterschiedlichen Lagerkonzentrationen und Aliquots werden nach dem auf dem Datenblatt angegebenen Verdünnungsfaktor hergestellt, der für das einzelne Los spezifisch ist. Es ist wichtig, die Ampullen und Rohre eiskalt zu halten, um ein vorzeitiges Gelalten der Matrix zu verhindern. Despense Matrix in Aliquots in vorgekühlten Kryotubes auf Eis. Ungenutzte Aliquots bei-20 ° C einfrieren.
- Legen Sie ein Aliquot auf Eis für etwa 2 h zu tauen.
- Das Aliquot der Matrix mit 20 ml kaltem DMEM/F12 in einem 50 mL konischen Rohr verdünnen.
- Gut verrühren und 1 mL verdünnte Matrix in 35 mm-Geschirr verteilen (Gegenwerte pro Oberfläche anderer Gerichte).
- Halten Sie die Schalen mit verdünnter Matrix für 1 Stunde bei Raumtemperatur, um die Beschichtung zu ermöglichen.
NOTE: Geschirr, die mit Parafilm versiegelt sind, kann bei 4 ° C bis zu 2 Wochen gelagert werden.
-
Vorbereitung der Bestandslösung (20 mL) und 1x funktionierende Aliquots des sanften Zelldissoziationsreagenzials (Siehe Materialtabelle).
- Pulver auf 10 mg/mL in PBS auflösen (Ca2 +/mg2 + free).
- Filter sterilisieren durch eine 0,22 μm Filtermembran.
- 20 Aliquots (je 1 ml) vorbereiten und bei-20 ° C lagern.
- Vor dem Gebrauch einen Aliquotot in PBS (Ca2 +/Mg2 + free) auf 1 mg/mL (1x funktionierende Aliquots) verdünnen.
Hinweis: 1x funktionierende Aliquots können bei 4 ° C bis zu 2 Wochen gelagert werden.
-
Die Weitergabe menschlicher iPSCs.
- Vor dem Start: Bei 4 ° C gelagert, werden vorwärme Matrix-beschichtete Platten im Inkubator bei 37 ° C für 20-30 min gelagert. Bei Raumtemperatur ist die Menge des menschlichen iPSC-Mediums (siehe Materialtabelle) vorwarm. Der DMEM/F12 vorwarm.
- Aspirate Kultur Medium.
- IPSCs mit PBS abspülen (Ca2 +/Mg2 + free).
- 1x schonende Dissoziationslösung (0,5 ml für eine 35-mm-Schale) hinzufügen. Inkubieren Sie bei 37 ° C, bis sich die Kanten der Kolonien von der Platte lösen, in der Regel 3-5 min.
- Aspirieren Sie die sanfte Dissoziationslösung, wobei man darauf achtet, die iPSC-Kolonien nicht zu trennen.
- Waschen Sie die Zellen mit DMEM/F12 (2 ml für eine 35-mm-Schale) und Aspirat darauf zu achten, die Zellen nicht zu lösen. Wiederholen Sie diesen Schritt noch einmal.
- Das menschliche iPSC-Medium (1 mL für eine 35 mm Schüssel) hinzufügen.
- Die Kolonien mit einem Zellheber sanft abschalten und auf ein 15 mL Rohr übertragen.
- Mit einem P1000-Pipettor 3-4 mal die Zellklumpen vorsichtig brechen.
- Aspirieren Sie den Supernatant von der matrix-beschichteten Platte (n).
- Saatgut die Zellen im entsprechenden Kulturvolumen des menschlichen iPSC Mediums. Das Split-Verhältnis kann von Linie zu Linie variieren und ist etwa 1:4-1:8. Wechseln Sie das Medium täglich.
2. Generation von NIL und NIP-iPSC Linien
-
Zelltransfektion.
- Spülen Sie die Zellen mit PBS (Ca2 +/Mg2 + kostenlos).
- Fügen Sie das Zelldissoziations-Reagenz hinzu (siehe Materialtabelle) (0,35 mL für eine 35-mm-Schale) und inkubieren Sie bei 37 ° C, bis einzelne Zellen getrennt sind (5-10 min).
- Sanft komplette Zelltrennung durch Pipettieren mit einem P1000-Pipettor 3-4 mal.
- Sammeln Sie in einem 15 mL-Rohr und fügen Sie PBS (Ca2 +/Mg2 + frei) zu 10 mL. Zählen Sie die Zellen.
- Pellet 10 6Zellen und Wiedersehen in 100 μl von Buffer R (im Zell-Elektroporation-Kit enthalten, siehe Materialtabelle).
- Plasmid-DNA für die Transfektion hinzufügen: 4,5 μg umsetzbarer Vektor (epB-Bsd-TT-NIL oder epB-Bsd-TT-NIP12) und 0,5 μg des PiggyBac-Transposaals Plasmid 13.
- Transfekt mit dem Zellelektroporationssystem (siehe Materialtabelle) nach Herstellerangaben und wie bereits beschrieben 3 mit folgenden Parametern: 1.200 V Spannung, 30 ms Breite, 1 Puls. Die Zellen des menschlichen iPSC-Mediums werden mit 10 μM Y-27632 (ROCK-Inhibitor, siehe Materialtabelle) in einer 6-mm-matrix-beschichteten Schüssel ergänzt.
-
Selektion mit Antibiotika.
- Zwei Tage nach dem Transkriptions 5 μg/mL Blasticidin in das Kulturmedium geben.
- Die meisten der nicht transferierten Zellen werden innerhalb von 48 Stunden an Blasticidin-Selektion sterben. Halten Sie die Zellen in Blasticidin für mindestens 7-10 Tage, um die Zellen, die die Transgene nicht in das Genom integriert haben, zu konterkarieren.
- Halten Sie stüftige transflektierte Zellen als gemischte Population, die aus Zellen mit unterschiedlicher Anzahl von Transgenen und verschiedenen Integrationsstätten besteht, oder isolieren Sie einzelne Klone.
- Bereiten Sie ein zusätzliches Gericht vor, um die Transgene auf 1 μg/mL Doxycycline-Induktion durch RT-PCR mit transgenspezifischen Primern für Ngn2 (Forward: TATGCCACCTCACCTCCCCATAG) wirksam auszudrücken; Umgekehrt: GAAGGAGGAGGCGCGCGACT), wie bereitsbeschrieben12.
- In dieser Phase werden die Vorräte der neuartigen NIL-und NIP-iPSC-Leitungen im Gefriermedium für menschliche iPSCs gefrieren (siehe Materialtabelle ).
3. Motor Neuron Differenzierung
- Dissoziieren Sie die Zellen mit Zelldissoziationsreagenz, wie beschrieben (Schritte 2.1.1 .-2.1.3.). Sammeln Sie getrennte Zellen in einem 15 mL Rohr und verdünnen Sie mit 5 Volumina DMEM/F12. Die Zellen pumpen und im menschlichen iPSC-Medium wiederbeleben, das mit 10 μM ROCK-Inhibitor ergänzt wird. Zählen Sie die Zellen und Samen auf matrix-beschichtete Gerichte mit einer Dichte von 62.500Cells/2.
- Am Tag danach ersetzen Sie das Medium durch DMEM/F12, ergänzt durch 1x stabile L-Glutamin-Analogie, 1x nicht-essentielle Aminosäure (NEAA) Zellkultur-Ergänzung und 0,5x Penicillin/Streptomycin, und die 1 μg/mL Doxycycline enthält. Dies gilt als Tag 0 der Differenzierung. Am ersten Tag das Medium und die Doxycycline erfrischen.
- Wechseln Sie am 2. Tag das Medium auf Neurobasal/B27 (Neurobasal Medium ergänzt mit 1x B27, 1x stabiles L-Glutamin-Analogon, 1x NEAA und 0,5x Penicillin/Streptomycin), mit 5 μM DAPT, 4 μM SU5402 und 1 μg/mL Doxycycline (siehe Materialtabelle) ). Erfrischen Sie das Medium und die Doxycycline täglich bis zum 5. Tag.
-
Tag 5: Zellen trennen sich mit Zelldissoziation Reagenz (Siehe Materialtabelle).
- Spülen Sie die Zellen mit PBS (Ca2 +/Mg2 + kostenlos).
- Die Zelldissoziation Reagenz (0,35 mL für eine 35-mm-Schale) dazugeben und bei 37 ° C inkubieren, bis sich der gesamte Zellmonolayer von der Schale trennt. Beachten Sie, dass einzelne Zellen während der Inkubation nicht getrennt werden.
- 1 ml DMEM/F12 hinzufügen und die Zellen in einem 15 mL Rohr sammeln.
- Sanft komplette Zelltrennung durch Pipettieren mit einem P1000-Pipettor 10-15 mal.
- Fügen Sie 4 ml DMEM/F12 hinzu und zählen Sie die Zellen.
- In diesem Stadium können Motorneuronenvorläufer im Zellgefrieren einfrieren (siehe Materialliste), nach Herstellerangaben.
- Pelletieren Sie die Zellen und wiederbeleben in Neuronal Medium (Neurobasal/B27 Medium mit 20 ng/mL BDNF, 10 ng/mL GDNF und 200 ng/mL L-Ascorbinsäure, siehe Tabelle von Material s) mit 10 μM ROCK-Inhibitor ergänzt.
- Die Zellen auf polyornithine/laminin-oder alternativ auf matrix-beschichteten Stützen bei der Dichte von 100.000 Cells/2. Verwenden Sie für die Immunfärbung die Kunststoffträger mit Polymer-Kokslip (siehe Materialtabelle).
- An Tag 6 wechseln Sie das Medium mit frischem neuronalen Medium ohne ROCK-Inhibitor. An den nächsten Tagen alle 3 Tage die Hälfte des Mediums erfrischen. Das Kulturmedium muss sehr sorgfältig verändert werden, um eine Ablösung von der Oberfläche zu verhindern.
4. Immunfluoranalyse
- Zellbefestigung. Spülen Sie die Zellen mit PBS (mit Ca2 +/Mg2 +) und inkubieren Sie die Zellen für 15 Minuten in 4% Paraformaldehyd in PBS (mit Ca2 +/Mg2 +) bei Raumtemperatur.
CAUTION: Paraformaldehyd ist giftig und steht im Verdacht, Krebs zu verursachen. Vermeiden Sie den Kontakt mit Haut und Augen und behandeln Sie unter einer chemischen Rauchhaube. - Durchlässigkeit mit PBS (mit Ca2 +/Mg2 +), die 0,1% Triton X-100 für 5 min bei Raumtemperatur enthält.
- Inkubieren Sie 30 Minuten bei Raumtemperatur in Antikörper-Sperrlösung (ABS: 3% BSA in PBS mit Ca2 +/Mg2 +).
- Inkubieren Sie 1 h bei Raumtemperatur mit primären Antikörpern in ABS: Anti-TTUJ1 (1:1000; Kaninchen) und Anti-Oct4 (1:200; Maus) oder Anti-CHAT (Anti-Choline Acetyltransferase; 1:150; Ziege). Siehe Materialtabelle.
- 45 Minuten bei Raumtemperatur mit entsprechendem Esel-Sekundie-Antikörper-Paar in ABS inkubieren: Anti-Maus Alexa Fluor 647 (1:250), Anti-Kaninchen Alexa Fluor 594 (1:250) und Anti-Ziege Alexa Fluor 488 (1:250). Siehe Materialtabelle.
- Inkubieren Sie in 0,4 μg/mL DAPI für 5 min bei Raumtemperatur, um Kerne zu kennzeichnen.
- Montieren Sie die Zellen mit Mounting Medium (siehe Materialtabelle) für die Bildgebung mit einem Fluoreszenzmikroskop.
5. Funktionelle Charakterisierung über Patch-Klamperaufnahmen
- Bereiten Sie die HEPES-ausgleichbare externe Lösung (NES) wie folgt vor: 140 mM NaCl, 2,8 mM KCl,2 mM CaCl 2,2, 2 mM MgCl2,10mM HEPES und 10 mM Glukose. Stellen Sie die Osmolarität zwischen 290-300 m-und. Stellen Sie den pH-Wert auf 7,3 mit 1N NaOH ein und speichern Sie die Lösung bei 4 ° C.
- Die interne Lösung vorbereiten: 140 mM K-Gluconat, 2 mM NaCl, 5 mM BAPTA,2 mM MgCl 2,10 mM HEPES, 2 mM Mg-ATP, 0,3 mM Na-GTP. Stellen Sie den pH-Wert mit 1M KOH auf 7,3 ein und überprüfen Sie, ob die Osmolarität auf rund 290 m angesetzt ist. Die Lösung bei-20 ° C in kleinen Aliquots einfrieren.
- Bevor die Experimente durchgeführt werden, die NES-Lösung in einem Wasserbad auf etwa 28-30 ° C vorwärmen.
- Ziehen Sie einige Borosilikat-Mikropipetten (ID 0,86 mm; OD 1,5 mm) mit einem Spitzwiderstand: 5-6 M-und mit der intrazellulären Lösung füllen, bevor sie in den Pipette-Halter eingebaut wird.
NOTE: Denken Sie daran, die Silberdrähte der Aufzeichnungselektrode und der Referenzelektrode in Bleichmittel für mindestens 30 Minuten zu chlorid zu chlorid, um eine gleichmäßige Schicht von AgCl auf der Drahtoberfläche zu bilden. - Die Petrischale in die Aufnahmekammer geben und die Kammer mit der NES-Lösung bei 1-2 mL/min ablegen. Lassen Sie den Fluss durch eine Inline-Heizung bei einer Temperatur von 30 ° C gesetzt, um die Lösung warm zu halten.
- Platzieren Sie die elektrophysiologische Aufnahmekammer unter ein aufrechtes Mikroskop. Mit dem Patch-Klemmverstärker Membranströme aufzeichnen und Daten mit einer entsprechenden Software erfassen.
- Öffnen Sie die Verstärker-Steuerungssoftware und setzen Sie die Signalgewinne auf den Wert 1 und den Bessel-Filter auf 10 kHz. Stellen Sie sicher, dass der Bessel-Filter 2,5-mal niedriger ist als die Abtastfrequenz.
- Stellen Sie die Versuchsprotokolle für Spannungs-und Stromklemmversuche in der Aufnahmesoftware ein.
- In der Protokolleinstellung ticken Sie den episodischen Stimulationsmodus an und setzen die Sampling-Frequenz auf 25 kHz. Dann bewegen Sie sich auf die Wellenform und geben Sie die Spannung oder Stromschritt Amplitude und-länge als folgt.
- Für die spannungsverschlachten Natriumströme verwenden Sie 15 Spannungsschritte (jeweils 50 ms Dauer) von-100 mV bis + 40 mV (10 mV-Zuwachs). Führen Sie das Protokoll aus, nachdem Sie der gepatchten Zelle ein Haltepotenzial von-60 mV durch den Verstärker auferlegt haben. In ähnlicher Weise werden die spannungsgezeichneten Kalienströme durch Spannungsschritte (je 250 ms Dauer) von-30 mV bis + 50 mV (10 mV-Zuwachs) hervorgerufen, die die aufgezeichnete Zelle auf-40 mV halten.
- Für die Untersuchung der Brenneigenschaften von iPSC-abgeleiteten Schädel-und WirbelsäulenmNs, Klemmzellen, im Stromklemmmodus, bei einem Membranpotenzial von-70 mV und Verwendung von 4 Strompulsen (je 1) von zunehmender Amplitude (von + 20 pA bis + 80 pA; 20 pA-Zuwachs).
- Erwerben Sie für jede Zelle spannungsaktivierte Ströme, evozierte Brennaktivität und drei passive Eigenschaften wie Ganzzellen-Kapazität (Cm), Zellmembranwiderstand (Rm) und Resting Membran-Potential (RMP).
Ergebnisse
Eine schematische Beschreibung der Differenzierungsmethode ist in Abbildung1 dargestellt. Die menschlichen iPSCs (WTIline 3) wurden mit epB-Bsd-TT-NIL oder epB-Bsd-TT-NIP transferiert, wodurch bei der Blasticidin-Auswahl stabile und induzierbare Zelllinien12erzeugt wurden, im Folgenden iPSC-NIL und iPSC-NIP genannt. Für die Expression des Pluripotenzmarkers OCT4 und des panneuronalen Markers TUJ1 wurden unterschiedliche Zellen charakterisiert. Die Immunfluoranalyse zeigte eine einheitliche Expression von OCT4 in allen Zellen am Tag 0, in Ermangelung der TUJ1-Positivität(Abbildung2A). An Tag 3 beobachteten wir einen starken Rückgang der Anzahl der OCT4-positiven Zellen, der sich in einer Untergruppe von differenzierenden iPSCs (Abbildung2B) durch die Expression von TUJ1 widerspiegelt. An Tag 5 wurde in der Bevölkerung kein Ausdruck von OCT4 beobachtet, der eine konsistente Expression von TUJ1 zeigte und eine neuronale Morphologie erwarb (Abbildung2C). Motor-Neuron-Vorläufer wurden dann getrennt und zur weiteren Reifung wieder verputzt. Nach 7 Tagen (12 Tage seit Tag 0) haben die Zellen TUJ1 und den reifen Motorneuronenmarker CHAT gleichmäßig ausgedrückt (Abbildung3). Ähnliche Ergebnisse wurden mit zwei zusätzlichen kommerziellen iPSC-Leitungen (siehe Materialtabelle) unter Verwendung der gleichen Kultur-und Differenzierungsbedingungen erzielt (Zusatzabbildung S1 und Zusatzabbildung S2). Ähnlich wie bei NIL-induzierten Motorneuronen aus der MausESCs 11, haben menschliche iPSCs, die mit NIL und NIP induziert wurden, niedrige Konzentrationen von HOX-Transkriptionsfaktoren ausgedrückt und können entlang der rostro-kaudalen Achse mit Retinosäure gemustert werden (Ergänzungsfigur S3 ).
Diese Ergebnisse wurden erzielt, als 62.500 Cells/cm 2 zu Beginn der Differenzierung gesät und mit 1 μM Doxycycline am Tag 0 induziert wurden. Dies führte zu einer optimalen Doxycyclin, um eine maximale Induktion der Transgene ohne offensichtliche Toxizität für die Zellen zu erreichen (Ergänzende Abbildung S4A). Bei der Entfernung der Doxycycline am 5. Tag wurde die Expression der Transgene zum Schweigen gebracht (Ergänzende Abbildung S4B). Wir haben auch Pilotversuche durchgeführt, um die optimale Dichte der Zellen an dieser Stelle des Protokolls festzustellen. Wir haben festgestellt, dass die Variation dieses Parameters in parallelen Differenzierungsexperimenten unterschiedliche Ergebnisse lieferte. Bei einer auf 31.250 Cells/cm 2 abgesenkten Anfangsdichte war die Differenzierung scheinbar normal, wie durch die Beobachtung der Zellmorphologie ausgewertet wurde. Allerdings haben wir den Widerstand gegen die Dissoziation an Tag 5 (Abschnitt 3.4) und die Verringerung der Lebensfähigkeit in der anschließenden Reifephase festgestellt. Umgekehrt, als die anfängliche Dichte der Zellen auf 125.000 Cells/2 angehoben wurde, beobachteten wir eine ineffiziente Differenzierung, wie sie durch den Mangel an Erwerb der typischen neuronenähnlichen Morphologie beurteilt wurde. Dies führte zu einer gemischten Population, die nur einen geringen Bruchteil der MNs enthielt, die eine weitere Reinigung benötigen würde (z.B. durch FACS). Wir haben daher festgestellt, dass die optimale Dichte, um eine reine Population von neuronalen Zellen zu erhalten, in der Lage, in der Kultur für mehr als zwei Monate zu überleben, ist 62.500 Cells/2.
Anschließend haben wir die funktionelle Reifung der iPSC NIL-abgeleiteten Wirbelsäulenmotor-Neuronen anhand ihrer elektrophysiologischen Eigenschaften (Abbildung 4), wie zuvor für iPSC NIP-abgeleitete Schädelmotor-Neuronen 12 berichtet, bewertet. Die Patchklemmaufnahmen, sowohl in der Strom-als auch in der Stromklemmmodalität, wurden an Tag 7 des MNs-Reifungsschrittes des Protokolls durchgeführt (siehe Abbildung 1; Gesamtzeit derDifferenzierung: 12 Tage) (Abbildung4 A). Zu diesem Zeitpunkt zeigten die iPSC NIL-abgeleiteten Motorneuronen ein etwas geringeres Ruhemmembranpotenzial (-30 ± 2 mV; n = 24) und einen ähnlichen ZellKapazitätswert (+ 25 ± 2 pF; n = 25) im Vergleich zu zuvor gemeldeten iPSC NIP-abgeleiteten MNs 12. Um dann den Reifungsgrad der differenzierten Zellen zu charakterisieren, untersuchten wir ihre Fähigkeit, Natrium-und Kaliumströme zu evozieren, wenn sie mit einer Reihe von Spannungsimpulsen stimuliert wurden. In diesen Experimenten zeigten iPSC NIL-abgeleitete Neuronen erfolgreich spannungsabhängige Natriumströme (Abbildung 4B) und spannungsabhängige Kaliumströme (Abbildung 4C), die bei einem Klemm- Membranpotenzial bei − 20 mV bzw. + 50 mV. Die Gleichgewichtspotenziale für Na+ und K+,berechnet mit der Nernst Gleichung (www.physiologyweb.com/calculators/nernst_potential_calculator.html) mit den zuvor gemeldeten extrazellulären und intrazellulären Lösungen, waren + 110 mV und-102 mV. Darüber hinaus konnten die 80% der in der Stromklemmmodalität geklemmten iPSC NIL-abgeleiteten MNs bei einer Injektion mit einem Strompuls von + 60 pA oder mehr (Abbildung4 D) Spitzenzüge auslösen. Der Mindeststrom, der benötigt wird, um in mehr als 50% der aufgezeichneten Zellen wiederholende Brennen auszurufen, betrug + 40 pA (15 von 18 Zellen; Bild 4 E). Die Spike-Schwelle lag bei-37,6 ± 0,8 mV und die durchschnittliche Brennfrequenz lag bei + 40 pA bei etwa 7,9 ± 2,2 Hz (n = 18; Bild 4 F).
Insgesamt deuten diese Daten darauf hin, dass iPSC-NIL-abgeleitete WirbelsäulenmNs, ähnlich wie zuvor gemeldete iPSC NIP-abgeleitete Schädelkraniziale MNs 12, funktionelle Eigenschaften haben, die typisch für ausgereifte Neuronen sind.

Bild 1 : Motor-Neuronenzierungsprotokoll. Die Abbildung zeigt eine schematische Darstellung des Differenzierungsprotokolls, von der Generierung stabiler iPSC-Leitungen mit den PiggyBac-Vektoren bis zum Zeitpunkt der im Text gemeldeten Funktionsanalyse. Es werden repräsentative Phasenkontrastbilder der Zellen in verschiedenen Schritten des Protokolls gezeigt. Maßstabs = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
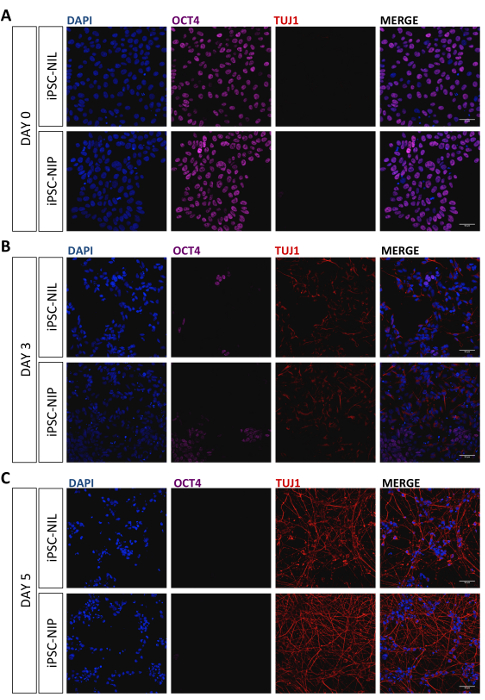
Bild 2 : Repräsentative Immunfluoranalyse von differenzierenden Zellen. Die iPSC-NIL und die iPSC-NIP-Zellen wurden durch Immunfärbung zur Expression des Pluripotenzmarkers OCT4 (lila) und des panneuronalen Markers TUJ1 (rot) am Tag 0 (A), Tag 3 (B) und Tag 5 (C) analysiert. Nuclei wurden mit DAPI kontrastiert. Konfokale Bilder wurden am Laser-Scan-konfokalen Mikroskop (siehe Materialtabelle) mit einem 20X NA 0,75 Objektiv mit Zoom 2X, 1024 x 1024 Pixel, ausgestattet mit 405 nm, 473 nm, 559 nm und 635 nm Lasern, aufgenommen. Es wurden Filtereinstellungen für DAPI, Alexa Fluor 594 und Alexa Fluor 647 verwendet. Maßstabs = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Bild 3 : Repräsentative Immunfluoranalyse von iPSC-abgeleiteten Motorneuronen. Die iPSC-NIL und iPSC-NIP-Zellen wurden am Tag 12 durch Immunfärbung zur Expression des panneuronalen Markers TUJ1 (rot) und des motorischen Neuronenmarkers CHAT (Choline acetyltransferase; grün) analysiert. Nuclei wurden mit DAPI kontrastiert. Konfokale Bilder wurden, wie in der Abbildung 2 der Legende beschrieben , aufgenommen. Maßstabs = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
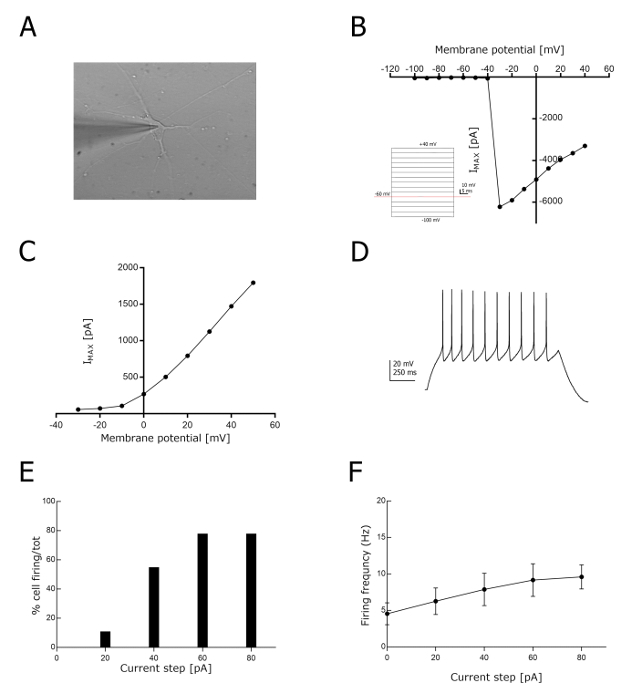
Bild 4 : Funktionelle Analyse von Wirbelsäulen-und Schädelmotor-Neuronen. (A) Bright Field Bild der Ganz-Zell-Patchklemme auf iPSC NIL-abgeleiteter Wirbelsäulenmotor-Neuron. (B) Repräsentant I/V-Kurve für Na+ Strom, der in iPSC NIL-abgeleiteten MNs als Reaktion auf eine Reihe von steigenden Spannungsschritten aufgezeichnet wurde (n = 26; das Potenzial von-60 mV). C) Repräsentant I/V-Kurve für K+, die in iPSC NIL-abgeleiteten MNs als Reaktion auf eine Reihe von steigenden Spannungsschritten aufgezeichnet wurde (n = 23; das Potenzial von-40 mV). D) repräsentative Spur eines Zuges von Aktionspotenzialen, die als Reaktion auf eine 1-treibende aktuelle Injektion von + 60 pA hervorgerufen werden. (E) Histogramm, das den Anteil der iPSC NIL-abgeleiteten MNs darstellt, die an jedem aktuellen Puls (n = 18) Aktionspotenziale ausschöpfen. (F) Histogramm, das die evozierte Brennfrequenz an jedem Strompuls (n = 18) anzeigt. Die elektrophysiologische Aufnahme wurde unter einem aufrechten Mikroskop durchgeführt. Das Membranstromaufzeichnungssystem ist in der Materialtabelle angegeben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
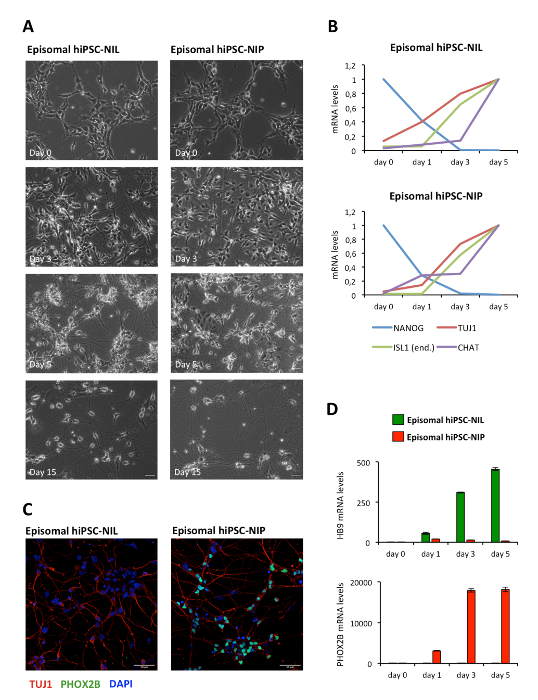
Ergänzende Abbildung S1: MN-Differenzierung mit Episomal-hiPSCs. (A) Brightfield-Bilder zur Differenzierung von Episomal-hiPSC-NIL (links) und Episomal hiPSC-NIP (rechts) zu den angegebenen Zeitpunkten. Maßstabs = 50 μm. (B) Analyse des Ausdrucks der angezeigten Marker bei der Differenzierung von Episomal-HiPSC-NIL (oben) und Episomal-hiPSC-NIP-Zellen (unten) durch EchtzeitqRT-PCR. Für jeden Marker wurde der Zeitpunkt mit dem höchsten Ausdruck als Kalibrator-Probe verwendet. Primer, die für ISL1 verwendet werden, sind spezifisch für das endogene Gen. (C) Immunfärbung für den panneuronalen Marker TUJ1 (rot) und Schädel-MN-Marker PHOX2B (grün) in differenzierten (Tag 6) Episomal-hiPSC-NIL (links) und Episomal-hiPSC-NIP-Zellen (rechts). Nuklei werden mit DAPI konterbefleckt. Skalierbalken für alle Paneele: 50 μm. (D) Analyse des Ausdrucks von HB9 und PHOX2B bei der Differenzierung von Episomal-hiPSC-NIL (oben) und Episomal-hiPSC-NIP-Zellen (unten) durch EchtzeitqRT-PCR. Tag 0 wurde als Kalibrator-Probe verwendet. PCR-Primer und-Methoden werden in De Santis et al., 201812,berichtet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
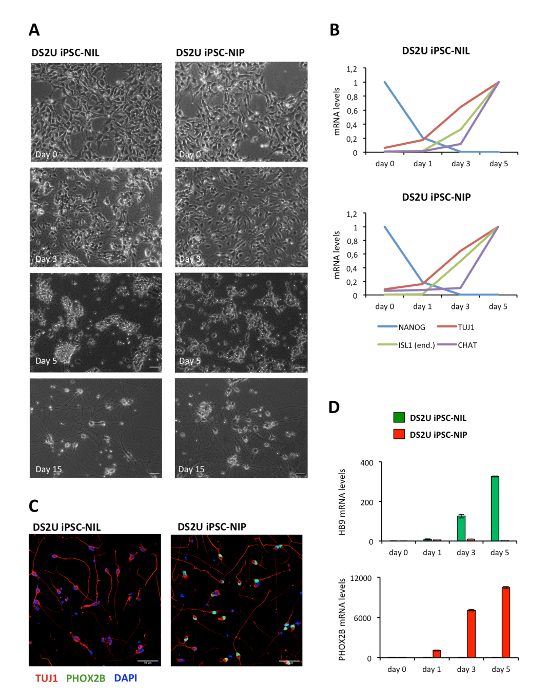
Ergänzende Abbildung S2: MN-Differenzierung mit DS2U iPSCs. (A) Brightfield-Bilder der Differenzierung von DS2U-NIL (links) und DS2U-NIP (rechts) zu den angegebenen Zeitpunkten. Maßstabs = 50 μm. (B) Analyse des Ausdrucks der angezeigten Marker in der Differenzierung von DS2U-NIL (oben) und DS2U-NIP (unten)-NIP-Zellen durch EchtzeitqRT-PCR. Für jeden Marker wurde der Zeitpunkt mit dem höchsten Ausdruck als Kalibrierprobe verwendet. Primer, die für ISL1 verwendet werden, sind spezifisch für das endogene Gen. (C) Immunfärbung für den panneuronalen Marker TUJ1 (rot) und Schädel-MN-Marker PHOX2B (grün) in differenzierten (Tag 6) DS2U-NIL (links) und DS2U-NIP (rechts) Zellen. Nuklei werden mit DAPI konterbefleckt. Maßstabs = 50 μm. (D) Analyse des Ausdrucks von HB9 und PHOX2B bei der Differenzierung von DS2U-NIL (oben) und DS2U-NIP-Zellen (unten) durch EchtzeitqRT-PCR. Tag 0 wurde als Kalibrator-Probe verwendet. PCR-Primer und-Methoden werden in De Santis et al., 201812,berichtet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Ergänzende Abbildung S3: HOX Genexpression. (A) Analyse der Expression von vier verschiedenen HOX-Genen (HOX A2, HOX B1, HOX A4, HOX B5) nach 5 Tagen Differenzierung der iPSC-NIL und iPSC-NIL + RA-Zellen durch Echtzeit-qRT-PCR. IPSC-NIL am Tag 0 wurde als Kalibrator-Probe verwendet. (B) Analyse der Expression von vier verschiedenen HOX-Genen (HOX A2, HOX B1, HOX A4, HOX B5) nach 5 Tagen Differenzierung von iPSC-NIP und iPSC-NIP + RA-Zellen durch Echtzeit-qRT-PCR. IPSC-NIP am Tag 0 wurde als Kalibrator-Probe verwendet. (C) PCR-Primerpaare. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
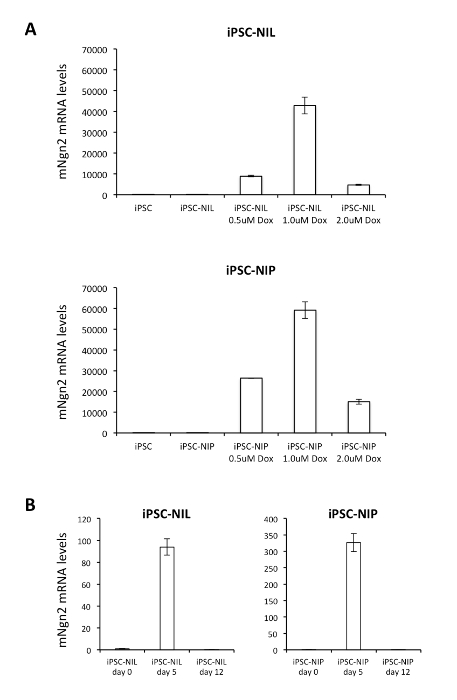
Ergänzende Abbildung S4: Doxycycline-Induktionsanalyse. (A) Analyse des Ausdrucks von exogenen Ngn2 in iPSC-NIL (oben) und iPSC-NIP-Zellen (unten), die für 24 Stunden unbehandelt oder kultiviert wurden, in Anwesenheit von Doxycycline in Anwesenheit von Doxycycline in unterschiedlicher Konzentration (0,5 μM, 1,0 μM, 2,0 μM). Ngn2 wurde mit Primern analysiert, die speziell für das exogene Maus-Gen bestimmt sind. Die elterliche iPSC-Linie, ohne NIL-und NIP-Konstrukte, wurde als Steuerung in die Analyse aufgenommen. Die Expression der Transgene in iPSC-NIL und iPSC-NIP war ohne Doxycycline vernachlässigbar. iPSC-NIL und iPSC-NIP am 0. Tag wurden als Kalibrator-Proben verwendet. B) Analyse des Ausdrucks von exogenen Ngn2 in der Differenzierung von iPSC-NIL (links) und iPSC-NIP (rechts) Zellen an den angegebenen Zeitpunkten des Protokolls durch Echtzeit.RT-PCR. Ngn2 wurde mit Primern analysiert, die speziell für das exogene Maus-Gen bestimmt sind. iPSC-NIL und iPSC-NIP am 0. Tag wurden als Kalibrator-Proben verwendet. PCR-Primer und-Methoden werden in De Santis et al., 201812,berichtet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Dieses Protokoll ermöglicht es, menschliche iPSCs dank der ektopischen Expression von linearpezifischen Transkriptionsfaktoren effizient in Wirbelsäulen-und Schädelmotorneuronen umzuwandeln. Diese Transgene sind durch Doxycyclin induzierbar und dank eines Transpokortvektors auf Sparkug stabil in das Genom integriert. In einer gemischten Population wird ein oder mehrere Exemplare des Huckepitschwein-Vektors nach dem Zufallsprinzip in das Genom einzelner Zellen integriert, was das Risiko von Veränderungen der Genomintegrität erhöht. Darüber hinaus kann es im Laufe der Zeit zu einer fortschreitenden Auswahl von iPSC-Subklonen kommen, mit möglichen Folgen für die Differenzierung und die vergleichende Analyse von Krankheits-und Kontrollzelllinien. Insgesamt werden iPSC-abgeleitete MNs, die mit diesem Protokoll gewonnen werden, für die regenerative Medizin ungeeignet sein. Unsere Methode könnte jedoch besonders nützlich für die In-vitro-Motorenneuronenkrankheitsmodellierung sein. Die wesentlichen Stärken sind die extrem vereinfachten Kulturbedingungen, die Schnelligkeit der MN-Umwandlung, der hohe Reifungsgrad von iPSC-abgeleiteten MNs und die Möglichkeit, sowohl Wirbelsäulen-als auch Schädel-MNs zu erhalten, wie zuvor gezeigt wurde. Analyse von spezifischen Marker-Genen Ausdruck12. Die Robustheit des Protokolls wird durch seine Reproduzierbarkeit demonstriert. Bisher haben wir dieses Protokoll mehr als 30-mal erfolgreich für die Wirbelsäulen-und Schädel-oder Schädel-MN-Generation eingesetzt, um die Ergebnisse durch Marker und/oder Funktionsanalysen zu bewerten. Wir haben Motorneuronkulturen bis zu zwei Monate lang erfolgreich erhalten, ohne dass die Lebensfähigkeit deutlich verringert wird. Darüber hinaus kann jedes Experiment, sobald die stabil überführte iPSC-Linie erreicht ist, durch Doxycycline-Induktion ohne neue Transfektion gestartet werden. Auch Virusvektoren sind nicht erforderlich. Die hier vorgestellten repräsentativen Ergebnisse wurden durch die Elektroporation von iPSCs mit dem in der Materiallisteangegebenen Zellelektroporationssystem erzielt. Andere Elektroporationsmethoden könnten jedoch alternative Optionen darstellen. Umgekehrt sind Transfektionssysteme, die auf der Lipofektion basieren, nach unserer Erfahrung keine gute Option für pluripotente Stammzellen12. Zellpopulationen, die am Ende des Prozesses gewonnen werden, bestehen fast ausschließlich aus MNs, wodurch eine weitere Reinigung (z.B. durch FACS) vermieden wird. Wie wir bereits12gezeigt haben, ermöglicht das Protokoll die Gewinnung von 90% TUJ1-positiven Zellen, von denen 95% auch PHOX2B positiv in NIP-abgeleiteten Kulturen waren.
Wir können uns einige kritische Punkte vorstellen, die genau berücksichtigt werden müssen. Erstens ist die Qualität der Anfangsbevölkerung von iPSCs entscheidend, um eine homogene und konsequente Umwandlung in MNs zu gewährleisten. Kulturen, die einen erheblichen Anteil an Differenzierung enthalten (mehr als 5-10%) Muss vermieden werden. Wir haben das Protokoll mit dem menschlichen iPSC-Medium eingerichtet, das in der Materialtabelle als Wartungsmedium für undifferenzierte iPSCs beschrieben wird. Andere kommerziell verfügbare, definierte Medien könnten gültige Alternativoptionen darstellen, obwohl wir diesen Punkt in der vorliegenden Arbeit nicht experimentell angesprochen haben. Da die Medienzusammensetzung die Proliferationsrate der Startzellpopulation beeinflussen kann, könnte die Anpassung des Protokolls an andere Wartungsmedien eine Optimierung der Anfangsdichte am Tag 0 erfordern. Nach der Transfektion ist es wichtig, Zellen mindestens 2 Wochen unter der Antibiotikaauswahl zu halten, um stabile Zelllinien zu erhalten. Es könnte für einige Anwendungen angemessen sein, nach der Integration von piggygyBac klonale Linien abzuleiten, um eine homogenere Population in Bezug auf die Grad der transgenen Expression und eine bessere Kontrolle der Integrationsstätten zu erhalten. Die Dichte der Zellen am Tag 0, der Zeit der Doxycycline-Addition zum Medium, ist ein entscheidender Parameter. Wie in der Sektion repräsentative Ergebnisse erwähnt, haben wir eine optimale Zelldichte geschätzt, um die Reproduzierbarkeit zu gewährleisten. Wir können nicht ausschließen, dass andere pluripotente Stammzelllinien eine andere Anfangsdichte erfordern könnten, die in Pilotversuchen empirisch bestimmt werden sollte, da die Duplikationsrate zwischen den einzelnen Leitungen erheblich variieren kann. Der Mittelschalter auf Neurobasal/B27 muss nach 48 Stunden erfolgen, da die Doxycycline-Induktion erfolgt (Abschnitt 3.3): Die Differenzierung kann langsamer und weniger effizient führen, wenn die Zellen im DMEM/F12-Medium 2 Tage lang nicht gehalten werden. Die Dissoziation am 5. Tag muss ohne Betonung der Differenzierungszellen erfolgen. Die Inkubationszeit mit dem Zelldissoziationsreagenz (Schritt 3.4) kann sich von Charge zu Charge unterscheiden und sollte in Pilotversuchen sorgfältig geschätzt werden. Bei der Inkubation mit dem Zelldissoziationsreagenz löst sich der gesamte Zellmonolayer von der Platte. Dann muss sie sorgfältig durch Pipettieren, wie in Abschnitt 3.4 beschrieben, getrennt werden, um die Zellintegrität zu erhalten und mechanische Belastungen zu vermeiden, die sich negativ auf die Erhaltung der Zellkultur über D5 hinaus auswirken könnten. Schließlich haben wir gemerkt, dass MNs nach der Neubeschichtung MNs besser auf Gewebekultur Plastik haften als Glas. Polymer-Coverslips, die eine optimale Zellhaftung und geeignete optische Eigenschaften gewährleisten, sind eine gute Option für mikroskopbasierte Anwendungen.
Unsere Methode stellt eine direkte "Programmierung" von pluripotenten Zellen in ein MN-Missmus dar und rekapituliert die Zwischenschritte, durch die embryonale Zellen während der vivo-Entwicklung eine MN-Identität erlangen, wie die anfängliche Spezifikation des neuronalen Ektoderms und Muster entlang der dorso-ventralen und rostro-kaudalen Achsen. Daher wäre es nicht geeignet, die menschliche MN-Spezifikation in vitro zu modellieren, um beispielsweise molekulare Mechanismen zu untersuchen, die der Differenzierung zugrunde liegen. Auf der anderen Seite ermöglicht unser Protokoll die Erzeugung einer beträchtlichen Menge an Wirbelsäulen-oder Schädelmassen ohne weitere Reinigung. Unter Berücksichtigung des erreichten Reifungsgrades ist dies ein nützliches Instrument zur Untersuchung der molekularen Grundlagen neurodegenerativer Erkrankungen des motorischen Neurons. Eine konstante Anzahl von iPSC-Leitungen mit pathogenen Mutationen in motorischen Neuroniegenen wurde in den letzten Jahren von der Wissenschaft produziert. Sammlungen von MN "programmierbaren" iPSC-Leitungen könnten daher durch eine stabile Integration von NIL und NIP-Modulen in diese mutmaßlichen iPSC-Leitungen leicht erzeugt werden. Als mögliche zukünftige Anwendung der Methode können wir die Charakterisierung der zellautonomen Determinanten, die eine unterschiedliche Anfälligkeit für einzelne MN-Subtypen aufweisen, durch den Vergleich von seitlichen Schädel-und WirbelsäulenmNs, die von iPSCs gewonnen werden, mit Der gleiche genetische Hintergrund. Darüber hinaus könnte eine effektive Umwandlung von iPSCs in MNs in vereinfachte Kulturbedingungen, die minimale Manipulationen erfordern (d.h. ohne Übergang durch embryonierte Körper) und die leicht skalierbar sind, ein automatisiertes Hochdurchsatz-Medikament erheblich erleichtern. Screening-Ansätze für motorische Neuronenkrankheiten. Die In-vitro-Modellierung von neurodegenerativen Erkrankungen von Erwachsenen kann aufgrund der foetallenartigen Natur von iPSC-abgeleiteten Neuronen14 eine Herausforderung darstellen. Frühere Strategien, die entwickelt wurden, um die Alterung von MNs zu beschleunigen, die durch die konventionelle Differenzierung von iPSCs abgeleitet werden, wie zum Beispiel die Proerher-Überexpression 15, könnten mit unserer Methode kombiniert werden, um bessere Krankheitsmodelle zu erhalten.
Die hier beschriebene Methode, die auf der induzierbaren Expression von Transkriptionsfaktoren basiert, die von einem PiggyBac-Vektor vermittelt werden, kann auf andere induzierte Zelltypen angewendet werden. Wir haben bereits gezeigt, dass Skelettmuskelzellen durch den Ausdruck von BAF60c und Myod16aus menschlichen iPSCs gewonnen werden können. Ebenso können wir uns die Möglichkeit vorstellen, die Methode auf andere Zelltypen von Interesse auszudehnen, einschließlich anderer neuronaler Subtypen und Astrozyten, durch die Piggybac-vermittelte Expression der richtigenSätze von Programmierfaktoren 17,18, 19.,20.,21.
Offenlegungen
Die Autoren haben nichts zu offenbaren
Danksagungen
Die Autoren danken der Imaging Facility at Center for Life Nano Science, Istituto Italiano di Tecnologia, für die Unterstützung und technische Beratung. Wir danken den Mitgliedern des Center for Life Nano Science für die hilfreiche Diskussion. Diese Arbeit wurde teilweise durch ein Stipendium von AriSLA (Pilotstipendium 2016 "StressFUS") an AR unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-Bapta | Sigma-Aldrich | A4926-1G | chemicals for electrophysiological solutions |
| Accutase | Sigma-Aldrich | A6964-100ML | Cell dissociation reagent |
| anti-CHAT | EMD Millipore | AB144P | Anti-Choline Acetyltransferase. Primary antibody used in immunostaining assays. RRID: AB_2079751; Lot number: 2971003 |
| anti-goat Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | Secondary antibody used for immonofluorescence assays. RRID: AB_2534102; Lot number: 1915848 |
| anti-mouse Alexa Fluor 647 | Thermo Fisher Scientific | A31571 | Secondary antibody used for immonofluorescence assays. RRID: AB_162542; Lot number: 1757130 |
| anti-Oct4 | BD Biosciences | 611202 | Primary antibody used in immunostaining assays. RRID: AB_398736; Lot number: 5233722 |
| anti-Phox2b | Santa Cruz Biotechnology, Inc. | sc-376997 | Primary antibody used in immunostaining assays. Lot number: E0117 |
| anti-rabbit Alexa Fluor 594 | Immunological Sciences | IS-20152-1 | Secondary antibody used for immonofluorescence assays |
| anti-TUJ1 | Sigma-Aldrich | T2200 | Primary antibody used in immunostaining assays. RRID: AB_262133 |
| B27 | Miltenyi Biotec | 130-093-566 | Serum free supplement for neuronal cell maintenance |
| Bambanker | Nippon Genetics | NGE-BB02 | Cell freezing medium, used here for motor neuron progenitors |
| BDNF | PreproTech | 450-02 | Brain-Derived Neurotrophic Factor |
| Blasticidin | Sigma-Aldrich | 203350 | Nucleoside antibiotic that inhibits protein synthesis in prokaryotes and eukaryotes |
| BSA | Sigma-Aldrich | A2153 | Bovine Serum Albumin. Blocking agent to prevent non-specific binding of antibodies in immunostaining assays |
| CaCl2 | Sigma-Aldrich | C3881 | chemicals for electrophysiological solutions |
| Clampex 10 software | Molecular Devices | Clampex 10 | Membrane currents recording system |
| Corning Matrigel hESC-qualified Matrix | Corning | 354277 | Reconstituted basement membrane preparation from the Engelbreth-Holm-Swarm (EHS) mouse sarcoma. Used for adhesion of iPSC to plastic and glass supports |
| CRYOSTEM ACF FREEZING MEDIA | Biological Industries | 05-710-1E | Freezing medium for human iPSCs |
| D-Glucose | Sigma-Aldrich | G5146 | chemicals for electrophysiological solutions |
| DAPI powder | Roche | 10236276001 | 4′,6-diamidino-2-phenylindole. Fluorescent stain that binds to adenine–thymine rich regions in DNA used for nuclei staining in immonofluorescence assays |
| DAPT | AdipoGen | AG-CR1-0016-M005 | Gamma secretase inhibitor |
| Dispase | Gibco | 17105-041 | Reagent for gentle dissociation of human iPSCs |
| DMEM/F12 | Sigma-Aldrich | D6421-500ML | Basal medium for cell culture |
| Doxycycline | Sigma-Aldrich | D9891-1G | Used to induce expression of transgenes from epB-Bsd-TT-NIL and epB-Bsd-TT-NIP vectors |
| DS2U | WiCell | UWWC1-DS2U | Commercial human iPSC line |
| E.Z.N.A Total RNA Kit | Omega bio-tek | R6834-02 | Kit for total extraction of RNA from cultured eukaryotic cells |
| GDNF | PreproTech | 450-10 | Glial-Derived Neurotrophic Factor |
| Gibco Episomal hiPSC Line | Thermo Fisher Scientific | A18945 | Commercial human iPSC line |
| Glutamax | Thermo Fisher Scientific | 35050038 | An alternative to L-glutamine with increased stability. Improves cell health. |
| Hepes | Sigma-Aldrich | H4034 | chemicals for electrophysiological solutions |
| iScript Reverse Transcription Supermix for RT-qPCR | Bio-Rad | 1708841 | Kit for gene expression analysis using real-time qPCR |
| iTaqTM Universal SYBR Green Supermix | Bio-Rad | 172-5121 | Ready-to-use reaction master mix optimized for dye-based quantitative PCR (qPCR) on any real-time PCR instrument |
| K-Gluconate | Sigma-Aldrich | G4500 | chemicals for electrophysiological solutions |
| KCl | Sigma-Aldrich | P9333 | chemicals for electrophysiological solutions |
| L-ascorbic acid | LKT Laboratories | A7210 | Used in cell culture as an antioxidant |
| Laminin | Sigma-Aldrich | 11243217001 | Promotes attachment and growth of neural cells in vitro |
| Laser scanning confocal microscope | Olympus | iX83 FluoView1200 | Confocal microscope for acquisition of immunostaining images |
| Mg-ATP | Sigma-Aldrich | A9187 | chemicals for electrophysiological solutions |
| MgCl2 | Sigma-Aldrich | M8266 | chemicals for electrophysiological solutions |
| Mounting Medium | Ibidi | 50001 | Mounting solution used for confocal microscopy and immunofluorescence assays |
| Multiclamp patch-clamp amplifier | Molecular Devices | 700B | Membrane currents recording system |
| Na-GTP | Sigma-Aldrich | G8877 | chemicals for electrophysiological solutions |
| NaCl | Sigma-Aldrich | 71376 | chemicals for electrophysiological solutions |
| NEAA | Thermo Fisher Scientific | 11140035 | Non-Essential Amino Acids. Used as a supplement for cell culture medium, to increase cell growth and viability. |
| Neon 100 μL Kit | Thermo Fisher Scientific | MPK10096 | Cell electroporation kit |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Cell electroporation system |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Basal medium designed for long-term maintenance and maturation of neuronal cell populations without the need for an astrocyte feeder layer |
| NutriStem-XF/FF | Biological Industries | 05-100-1A | Human iPSC culture medium |
| Paraformaldehyde | Electron Microscopy Sciences | 157-8 | Used for cell fixation in immunostaining assays |
| PBS | Sigma-Aldrich | D8662-500ML | Dulbecco's Phosphate Buffer Saline, with Calcium, with Magnesium |
| PBS Ca2+/Mg2+ free | Sigma-Aldrich | D8537-500ML | Dulbecco's Phosphate Buffer Saline, w/o Calcium, w/o Magnesium |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333-100ML | Penicillin/Streptomicin solution used to prevent cell culture contamination from bacteria. |
| poly-ornithine | Sigma-Aldrich | P4957 | Promotes attachment and growth of neural cells in vitro |
| SU5402 | Sigma-Aldrich | SML0443-5MG | Selective inhibitor of vascular endothelial growth factor receptor 2 (VEGFR-2) |
| Triton X-100 | Sigma-Aldrich | T8787 | 4-(1,1,3,3-Tetramethylbutyl)phenyl-polyethylene glycol, t-Octylphenoxypolyethoxyethanol, Polyethylene glycol tert-octylphenyl ether. Used for cell permeabilization in immunostaining assays |
| Upright microscope | Olympus | BX51VI | Microscope for electrophysiological recording equipped with CoolSnap Myo camera |
| Y-27632 (ROCK inhibitor) | Enzo Life Sciences | ALX-270-333-M005 | Cell-permeable selective inhibitor of Rho-associated, coiled-coil containing protein kinase (ROCK). Increases iPSC survival |
| μ-Slide 8 Well | Ibidi | 80826 | Support for high–end microscopic analysis of fixed cells |
Referenzen
- Dimos, J. T., et al. Induced Pluripotent Stem Cells Generated from Patients with ALS Can Be Differentiated into Motor Neurons. Science (New York, NY). 321 (5893), 1218 (2008).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457 (7227), 277-280 (2009).
- Lenzi, J., et al. ALS mutant FUS proteins are recruited into stress granules in induced Pluripotent Stem Cells (iPSCs) derived motoneurons. Disease models & mechanisms. 8 (7), 755-766 (2015).
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet journal of rare diseases. 4 (3), 1-22 (2009).
- Yan, J., et al. Frameshift and novel mutations in FUS in familial amyotrophic lateral sclerosis and ALS/dementia. Neurology. 75 (9), 807-814 (2010).
- Boulting, G. L., et al. A functionally characterized test set of human induced pluripotent stem cells. Nature biotechnology. 29 (3), 279-286 (2011).
- Amoroso, M. W., et al. Accelerated high-yield generation of limb-innervating motor neurons from human stem cells. The Journal of neuroscience: the official journal of the Society for Neuroscience. 33 (2), 574-586 (2013).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature biotechnology. 33 (1), 89-96 (2015).
- Allodi, I., et al. Differential neuronal vulnerability identifies IGF-2 as a protective factor in ALS. Scientific reports. 6, 25960 (2016).
- Kaplan, A., et al. Neuronal matrix metalloproteinase-9 is a determinant of selective neurodegeneration. Neuron. 81 (2), 333-348 (2014).
- Mazzoni, E. O., et al. Synergistic binding of transcription factors to cell-specific enhancers programs motor neuron identity. Nature neuroscience. 16 (9), 1219-1227 (2013).
- De Santis, R., Garone, M. G., Pagani, F., de Turris, V., Di Angelantonio, S., Rosa, A. Direct conversion of human pluripotent stem cells into cranial motor neurons using a piggyBac vector. Stem Cell Research. 29, 189-196 (2018).
- Yusa, K., Zhou, L., Li, M. A., Bradley, A., Craig, N. L. A hyperactive piggyBac transposase for mammalian applications. Proceedings of the National Academy of Sciences of the United States of America. 108 (4), 1531-1536 (2011).
- Sances, S., et al. Modeling ALS with motor neurons derived from human induced pluripotent stem cells. Nature Neuroscience. 16 (4), 542-553 (2016).
- Miller, J. D., et al. Human iPSC-based modeling of late-onset disease via progerin-induced aging. Cell stem cell. 13 (6), 691-705 (2013).
- Lenzi, J., et al. Differentiation of control and ALS mutant human iPSCs into functional skeletal muscle cells, a tool for the study of neuromuscolar diseases. Stem Cell Research. 17 (1), 140-147 (2016).
- Zhang, Y., et al. Rapid Single-Step Induction of Functional Neurons from Human Pluripotent Stem Cells. Neuron. 78 (5), 785-798 (2013).
- Theka, I., et al. Rapid generation of functional dopaminergic neurons from human induced pluripotent stem cells through a single-step procedure using cell lineage transcription factors. Stem cells translational medicine. 2 (6), 473-479 (2013).
- Pawlowski, M., et al. Inducible and Deterministic Forward Programming of Human Pluripotent Stem Cells into Neurons, Skeletal Myocytes, and Oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
- Li, X., et al. Fast Generation of Functional Subtype Astrocytes from Human Pluripotent Stem Cells. Stem Cell Reports. 11 (4), 998-1008 (2018).
- Nehme, R., et al. Combining NGN2 Programming with Developmental Patterning Generates Human Excitatory Neurons with NMDAR-Mediated Synaptic Transmission. Cell reports. 23 (8), 2509-2523 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten