Method Article
Ein Rhodopsin Transport Test von High-Content Imaging-Analyse
In diesem Artikel
Zusammenfassung
Wir beschrieben hier, ein High-Content bildgebendes Verfahren zur Quantifizierung des Transports von Rhodopsin Mutanten mit Retinitis Pigmentosa verbunden. Eine Multiple-Wellenlänge scoring Analyse wurde zur Rhodopsin Proteine auf der Zelloberfläche oder in der ganzen Zelle zu quantifizieren.
Zusammenfassung
Rhodopsin Fehlfaltung Mutationen führen zum Stab Photorezeptor Tod, die manifestiert als autosomal dominante Retinopathia Pigmentosa (RP), eine Progressive Verblindung Krankheit, die wirksame Behandlung fehlt. Wir vermuten, dass die Zytotoxizität des mutierten fehlgefaltete Rhodopsin gelindert werden kann, indem Sie pharmakologisch stabilisieren das mutierte Rhodopsin-Protein. P23H Mutation, unter die andere Klasse II Rhodopsin Mutationen, kodiert ein strukturell instabil Rhodopsin mutierte Protein, das in das endoplasmatische Retikulum (ER), akkumuliert wird, während das Wildtyp Rhodopsin in der Plasmamembran in Säugetieren transportiert wird Zellen. Wir zuvor eine Lumineszenz-basierte Hochdurchsatz-Screen (HTS) durchgeführt und identifiziert eine Gruppe von pharmakologischen Chaperonen, die den Transport von das P23H Rhodopsin aus ER auf die Plasmamembran gerettet. Hier quantifiziert ein Immunostaining Methode, gefolgt von einer hohen bildgebenden Inhaltsanalyse, wir den mutierten Rhodopsin Protein Betrag in die ganze Zelle und auf die Plasmamembran. Diese Methode ist informativ und effektiv, um wahre Hits aus Fehlalarme nach HTS identifizieren Die High-Content Bildanalyse ermöglichte darüber hinaus mehrere Parameter aus einem einzigen Experiment auszuwertende die pharmakologischen Eigenschaften von jeder Verbindung zu quantifizieren. Mit Hilfe dieser Assay, analysierten wir die Wirkung von 11 verschiedenen Verbindungen in Richtung sechs RP verbundenen Rhodopsin Mutanten, erhalten ein 2-D pharmakologischen Profil für eine quantitative und qualitative Verständnis über die strukturelle Stabilität dieser Rhodopsin-Mutanten und Wirksamkeit verschiedener Verbindungen in Richtung dieser Mutanten.
Einleitung
Protein misfolding ist Muskeldystrophie sowie neuronale Degenerationen und blendende Krankheiten, einschließlich Retinitis Pigmentosa (RP)1beteiligt. RP ist eine vererbte und progressive Degeneration der Netzhaut Mutationen in mehr als 60 Gene beeinflussen die Funktion und die Homöostase des Stabes Photorezeptoren oder die Netzhaut pigmentiert Epithele (RPEs)2,3zugeordnet. Keine wirksame Behandlung gibt es derzeit für RP. Rhodopsin Mutationen entfallen etwa 25-30 % der autosomal-Dominant (n. Chr.) RP-Fällen. Unter den mehr als 150 Rhodopsin Mutationen4 (Human Gene Mutation Database, http:/ www.hgmd.cf.ac.uk/), die Klasse II-Mutationen verursachen die strukturelle Instabilität des Proteins Rhodopsin, die zum Stab Photorezeptor Tod beiträgt und Vision Verlust5,6,7,8. Die P23H ist die häufigste Rhodopsin -Mutation in Nordamerika, die auch ein typisches Beispiel für die Klasse II Rhodopsin Mutationen9,10. Aufgrund seiner inhärenten strukturelle Instabilität ist das fehlgefaltete Rhodopsin in das endoplasmatische Retikulum (ER) in Säugerzellen, angesammelt, während der Wildtyp Rhodopsin auf der Plasmamembran5befindet. Das fehlgefaltete Rhodopsin P23H mutierte Exponate dominant negativen Zytotoxizität, die nicht aufgrund von Haploinsufficiency, sondern bezieht sich auf die Aktivierung der ER Protein Degradation Weg und der unterbrochenen Stab äußere Segment Organisation verbunden. Um die Rute Photorezeptor Zelle Stress zu lindern, ist eine Strategie zur Stabilisierung der native Faltung der mutierten Rhodopsin mit pharmakologische Chaperon.
Um dieses Ziel zu erreichen, führten wir eine zellbasierten Hochdurchsatz-Screen (Cloggings)11,12,13 mit einem β-Galaktosidase Fragment Komplementierung Assay, das P23H Rhodopsin mutierte transportiert auf dem Plasma zu quantifizieren Membran. Die robuste und einfache Protokoll des HTS Assays konnten wir die Aktivitäten der rund 79.000 kleine Moleküle für jeden Bildschirm zu erkunden. Weil dieser HTS Assay Lumineszenz Signale liest, sind falsch positive Ergebnisse, einschließlich der β-gal-Hemmer jedoch farbige oder zytotoxische Substanzen in der Trefferliste, die darauf warten, von einem sekundären Assay identifiziert werden enthalten.
Die traditionelle Immunostaining und Fluoreszenz bildgebenden Verfahren wurden jahrelang zur Studie des Rhodopsin-Transports in Säugerzellen5,14,15,16. Jedoch können nicht diese konventionellen Methoden verwendet werden, um die pharmakologische Wirkungen von mehr als 10 Verbindungen in Richtung Rhodopsin Verkehr zu quantifizieren, da eine zuverlässige bildgebende Analyse erfordert eine große Anzahl von Aufnahmen unter einer sehr konsistent Bedingung, die von der konventionellen bildgebenden Verfahren nicht geändert. Hier entwickelten wir eine Immunostaining basierten High-Content imaging Protokoll als eine sekundäre Assay, der Cell Landverkehre fehlgefaltete Rhodopsin Mutanten11,13,17zu quantifizieren. Rhodopsin auf der Plasmamembran beschriften, wir dem Schritt übersprungen Permeabilisierung der Zellmembran und Immunostained die Rhodopsin-Mutanten durch einen monoklonalen (B6-30) Anti-Rhodopsin erkennen die N-terminale Epitop des Rhodopsin auf der extrazellulären Seite der Zelle Membran-18. Um das mutierte Rhodopsin in der ganzen Zelle zu visualisieren, verschmolzen wir Rhodopsin mit dem Venus-Fluoreszenz-Protein. Durch die Quantifizierung der Fluoreszenz-Intensitäten in verschiedenen Fluoreszenz Kanälen sind wir in der Lage, mehrere Parameter von einem einzigen Experiment einschließlich der gesamten Rhodopsin-Intensität in der ganzen Zelle auf der Zelloberfläche und das Verhältnis von zu erhalten Rhodopsin Fluoreszenz auf der Zelloberfläche, die in der ganzen Zelle. Anwendung dieser Methode zu stabilen Zellen insgesamt sechs fehlgefaltete Rhodopsin durch Mutation entstehende Variationen zum Ausdruck zu bringen, können wir eine pharmakologische Profil der mehrere kleine Molekül Chaperone gegenüber diesen Mutanten erzeugen. In diesem Protokoll alle Zellen sind Immunostained in einem 384-Well-Platte und abgebildet, mit einem automatisierten imaging System unter einer sehr konsistent bildgebenden Bedingung. Eine Bildanalyse erfolgt in jede Vertiefung, mit Bildern von mehr als 600 Zellen Variante aufgrund der Heterogenität der Zellen mit unterschiedlichen Zellebene Form und Protein-Expression zu reduzieren. Der Workflow dieses Protokolls ist in Abbildung 1zusammengefasst. Der Vorteil dieser Methode ist, dass wir hochauflösende Bilder sowie Multi-Parameter-Quantifizierungen aus der Image-basierte Analyse erhalten. Im Allgemeinen kann dieses Protokoll geändert und angewendet, um den Transport fehlgefaltete Membran Proteins des Interesses zu quantifizieren.
Protokoll
Hinweis: Das Rhodopsin Transport Assay.
1. Vorbereitung und die Kultur der Zellen
- Wiederzubeleben Sie Cryo-erhalten U2OS stabile Zellen mit dem Ausdruck der Wildtyp (WT) oder mutierte Maus Rhodopsin-Venus Fusionsproteine. Auftauen der Zellen bei 37 ° C, bis nur kleine Eiskristalle in der Flasche übrig sind.
Hinweis: Die U2OS Zellen sind in diesem Protokoll verwendet, da gibt es keine Photorezeptor-Zell-Linie für in-vitro- Studien und die Pre-ciliary Biosynthese von Rhodopsin ähnlichen molekularen Mechanismen in Säugetierzellen unterliegt. Darüber hinaus die U2OS Zellen legen fest auf der Unterseite der Platte und haben große Zelle Körper, sie sind also ideal für die Rhodopsin-Transport-Assay. Sieben U2OS stabile Zellen mit dem Ausdruck der WT, T4R, P23H, P53R, C110Y, D190N und P267L Rhodopsin Mutanten dienen hier als ein Beispiel für die Qualität und Zuverlässigkeit des Tests zeigen. Stabile Zellen mit dem Ausdruck andere Rhodopsin-Mutanten oder andere Membranproteine können je nach Ziel des Tests verwendet werden. Stabile Zellen mit dem Ausdruck menschlicher Rhodopsin können falls vorhanden in diesem Test verwendet werden. Die Maus Rhodopsin wurde hier verwendet, da Maus und menschlichen Rhodopsin Proteine 95 % Homologie teilen, und die Verbindungen von diesem Test identifiziert werden getestet in Vivo mit einem Mausmodell AdRP tragen das Rhodopsin P23H Mutation8. Die stabile Zellen entstanden bereits19beschrieben. WT und mutierten Rhodopsin Transkripte wurden durch die Q-PCR quantifiziert und die Klone des stabilen Zellen auszudrücken vergleichbarem WT und mutierten Rhodopsin Transkripte wurden für diesen Test ausgewählt. Die Expression von Proteinen Rhodopsin bestätigte Immunoblot und Immunostaining. Im Laufe der in diesem Test verwendeten Zellen sollte kleiner als 20 sein. - Übertragen Sie jede Zeile der Zellen in einer 15 mL konische Röhrchen mit 10 mL Wachstumsmedium (hohe Glukose Dulbecco modifiziert Adlers Medium (DMEM) mit 10 % fetalen bovine Serum (FBS) und 5 µg/mL Plasmocin).
- Zentrifugieren der Röhre bei 200 X g für 5 min. verwerfen des Überstands und Aufschwemmen der Zelle Pellet mit 5 mL der Zelle Wachstumsmedium für jede Zelllinie. Jede Zeile der Zellsuspension in einer Kulturschale 60 mm Gewebe übertragen und Inkubation bei 37 ° C mit 5 % CO2.
- Subkultur der Zellen erreicht die Gewebekultur-Schüssel 90 % Zusammenfluss als Referenz12beschrieben.
2. Aussaat Zellen bei 5.000 Zellen pro Bohrloch
Hinweis: Führen Sie die folgenden Verfahren in einer Gewebekultur-Haube.
- Die Platte mit Poly-Lysin zu behandeln.
- Einen Tag vor der Aussaat der Zellen behandeln eine schwarze-Wand und klare unten 384-Well-Platte mit 20 µL/Well Poly-Lysin-Lösung für 30 min.
- Abzusaugen Sie die Flüssigkeit und erlauben Sie alle Brunnen trocknen für 1 Stunde Platte Deckel zurückgestellt und speichern Sie die Platte bei 4 ° C über Nacht für die Zelle Saat.
- Bereiten Sie die Zellsuspension.
- Jede Zelllinie im Wachstumsmedium in der Kulturschale 100 mm Gewebe bis zu 90 % Zusammenfluss Kultur.
- Waschen Sie jedes Gericht mit Phosphat gepufferte Kochsalzlösung (PBS) und lösen die Zellen mit 0,05 % 1 mL Trypsin bei 37 ° C.
- Jede Zeile der Zellen in 10 mL Assay Medium (High-Glukose DMEM mit 10 % FBS, 100 Einheiten/mL Penicillin und 100 μg/mL Streptomycin) aufzuwirbeln.
- Zählen der Zellen und jede Zeile von Zellen auf 1,25 x 105 Zellen/mL mit dem Assay-Medium zu verdünnen.
- Samen der Zellen.
- Verwenden Sie eine elektronische Mehrkanal-Pipette oder einem automatisierten Reagenz Dispenser 40 µL/Well der Zellsuspension auf drei Spalten pro Zell-Linie und Füllung Spalten 1-21 von 384-Well-Platte (Abbildung 2) zu verzichten.
- Hinzufügen von 40 µL/Well des U2OS (P23H-Rhodopsin-Venus) Spalten 22-23 und 40 µL/Well des U2OS (Rhodopsin-Venus) Spalte 24, als Steuerelemente.
- Zentrifugieren Sie die Platte 300 X g für 30 s, um alle Zellen am unteren Rand der 384-Well-Platte zu bringen.
Hinweis: Vermeiden Sie Erschütterungen auf die Platte nach der Aussaat der Zelle. Andernfalls Zellen werden zu einer Ecke jedes gut zerkleinert werden, und die Platte werden nicht geeignet für High-Content-Bildgebung. - Inkubieren Sie 384-Well-Platte bei 37 ° C mit 5 % CO2 für 3 h für die Zellen an der Unterseite der Platte befestigen.
3. Behandlung der Zellen mit Verbindungen
- Erstellen Sie eine Platte Karte mit Behandlungsbedingungen wie in Abbildung 2dargestellt.
- Bereiten Sie 300 µL 5 x Gebrauchslösungen von bis zu 15 Verbindungen in einer 96-Well-Platte.
- Verdünnen Sie cps 1 bis 15 mit dem Assay Medium bis fünfmal ihre endgültige Konzentrationen in Brunnen A1, G2 von 96-Well Platte (Abbildung 2A). 300 µL Assays Medium in gut H2 hinzufügen.
Hinweis: Die Endkonzentration von jeder Verbindung bei der wirksamste Konzentration dient für den Transport von das P23H Rhodopsin Rettung durch das HTS12,13. - Hinzufügen von 100 µL pro Bohrloch von 2 % Dimethyl Sulfoxid (DMSO) und 25 µM 9 -Cis-Retinal, die mittelfristig Assay Spalten 11 und 12, bzw. verdünnt werden. Fügen Sie 9 -Cis-retinal bei schwachem Licht.
- Verdünnen Sie cps 1 bis 15 mit dem Assay Medium bis fünfmal ihre endgültige Konzentrationen in Brunnen A1, G2 von 96-Well Platte (Abbildung 2A). 300 µL Assays Medium in gut H2 hinzufügen.
- Hinzufügen von 10 µL pro Bohrloch 5 x funktionierende Lösungen, die 384-Well-Platte mit den Zellen (Abb. 2 b) kultiviert.
- Verwenden Sie eine elektronische Multi-Kanal-Pipette hinzu Verbindungen 1, 3, 5, 7, 9, 11, 13 und 15 Zeilen A, C, E, G, ich, K, M und O aus Spalten 1 bis 21 (Abbildung 2). Hinzufügen von Verbindungen 2, 4, 6, 8, 10, 12, 14 und M Zeilen B, D, F, H, J, L, N und P aus Spalten 1 bis 21.
- Spalten, 22 und 24 10 µL pro Bohrloch von 2 % DMSO hinzufügen. Fügen Sie 10 µL pro Bohrloch von 25 µM 9 -Cis-retinal Spalte 23.
Hinweis: DMSO ist als eine Fahrzeugkontrolle verwendet, da alle Verbindungen wie Aktien zunächst in DMSO gelöst sind. Spalte 22 mit DMSO behandelt Zellen mit dem Ausdruck der P23H Rhodopsin als die 0 %-Steuerelement verwendet wird. 9 -Cis-retinale behandelte Zellen mit dem Ausdruck des P23H Rhodopsin wird als 100 % ige Kontrolle verwendet.
- Decken Sie 384-Well-Platte mit Alu-Folie ab und inkubieren Sie die Platte bei 37 ° C für 24 h.
4. Immunostaining ohne Membran Permeabilisierung Rhodopsin Proteine auf der Zelloberfläche zu beflecken.
Hinweis: Vermeiden Sie Reinigungsmittel im gesamten Immunostaining Prozess Zellmembran intakt zu halten.
- Bereiten Sie 4 % Paraformaldehyd (PFA) durch eine Verdünnung der 16 % PFA mit PBS in einer 1:4-Volumen-Verhältnis in einem chemischen Abzug. Übertragen Sie die 4 % PFA in einem Reagenz-Reservoir.
- Nehmen Sie die 384-Well-Platte in einem dunklen Raum mit roten Dämmerlicht. Verwenden Sie eine 8-Kanal-Absauganlage mit einem Vakuum Sammelflasche verbunden, um sanft das Medium Aspirieren. Mit Hilfe einer elektronischen Mehrkanal-Pipette hinzu 20 µL pro Bohrloch von frisch zubereiteten 4 % PFA, die gesamte 384-Well-Platte und 20 min bei Raumtemperatur inkubieren. Zur Vermeidung von Zelle Ablösung immer zeigen Sie die Spitzen der Absauganlage auf der gleichen Seite von jedem Bohrloch während Bestrebungen. Berühren Sie nicht den mittleren unteren Bereich des jedes gut. Bei der Einnahme von Bildern wählen Sie Felder aus die Region durch die Absauganlage berührt zu vermeiden. Decken Sie für Inkubationen länger als 10 min die 384-Well-Platte mit dem Deckel um Verdunstung zu vermeiden.
Hinweis: Zellen sind fixiert in einem dunklen Raum Immunofluoreszenz von regenerierten Isorhodopsin zu vermeiden, die das Ergebnis von 100 % Kontrolle auswirkt. Nach der Fixierung kann die 384-Well-Platte unter normalem Licht herausgenommen werden. - Verwenden Sie eine 8-Kanal-Absauganlage Aspirieren der PFA in jede Vertiefung und mit Hilfe einer elektronischen Multi-Kanal-Pipette hinzu 50 μL pro Well von PBS. Wiederholen Sie die zweimal drei Wäschen mit PBS durchführen.
Achtung: Die Abfälle Flüssigkeit enthaltenden PFA werden in einer verschlossenen Flasche gesammelt und nach dem Experiment als ein gefährlicher chemischer Abfall entsorgt werden soll. - Blockieren Sie die Zellen zu, indem Sie die gesamte 384-Well-Platte 20 µL pro Bohrloch von 5 % Ziegenserum hinzufügen und bei Zimmertemperatur 30 min inkubieren.
- 5 % Ziegenserum Aspirieren und Zeilen A O. hinzufügen 15 µL pro Bohrloch von 1 % Ziegenserum Zeile P für den sekundären Antikörper nur Kontrollgruppe 15 µL pro Bohrloch von 20 µg mL-1 B6-30 Anti-Rhodopsin Antikörper in 1 % Ziegenserum hinzufügen.
- Über Nacht inkubieren Sie die 384-Well-Platte bei Raumtemperatur für 90 min oder bei 4 ° C. Decken Sie die 384-Well-Platte mit Alu-Folie, Immunofluoreszenz die Fluorophore zu vermeiden.
- Waschen Sie die Platte 3 Mal mit 50 µL pro Bohrloch von PBS.
- Aspirieren Sie PBS und fügen Sie 15 µL pro Bohrloch 5 µg mL-1 Ziege Cy3 konjugierten Anti-Maus IgG Antikörper hinzu. 384-Well-Platte mit Alufolie abdecken und bei Raumtemperatur 1 h oder bei 4 ° C über Nacht inkubieren.
- Waschen Sie die Platte 3 Mal mit 50 µL pro Bohrloch von PBS. Fügen Sie 50 µL pro Bohrloch von PBS mit 1 µg mL-1 Hoechst 33342 Kerne bei Raumtemperatur 15 min. Fleck.
- 384-Well-Platte mit einer transparenten Folie vor Bildgebung zu versiegeln. Decken Sie 384-Well-Platte mit Alufolie ab und bei 4 ° C bis zu einer Woche zu speichern Sie, wenn Bilder sofort getroffen werden.
(5) Imaging.
Hinweis: Dieses High-Content bildgebende Verfahren wird an das Abbildungssystem aufgeführt in der Tabelle des Materialsangepasst. Verfahren können wenn andere High-Content bildgebenden Systemen unterscheiden.
- Entfernen Sie den Deckel und 384-Well-Platte in den High-Content-Imager mit A1 auf der oberen linken Ecke der Platte positioniert.
- Öffnen Sie die Bild-Datenerfassungs-Software für die Bildaufnahme einstellen.
- Die Platte Erwerb Setup-Fenster zu öffnen und neue Einstellung erstellen oder Laden einer bestehenden Setup-Datei.
- Wählen Sie die 20 X Objektiv und richten Sie Pixel binning 2, so dass die kalibrierten Pixelgröße 0,80 x 0,80 µm. Stellen Sie die Scanlinien als 2.000 und die Bildgröße (W x H) 1.000 x 1.000 Pixel (800,00 x 800,00 µm) pro Seite.
- Wählen Sie den Teller, abgebildet werden. Verwenden Sie die Informationen des Herstellers von 384-Well-Platte, um in den Dimensionen der Platte zu füllen.
- Wählen Sie die Vertiefungen für die 384-Well-Platte abgebildet werden.
- Wählen Sie aus vier Seiten pro Bohrloch abgebildet werden. Vermeiden Sie die Seite des gut gerührt von der Aspiration-Tipps.
- Wählen Sie Anregung Laser als 405, 488 und 561 nm. Wählen Sie Emission Filter für DAPI, FITC und Texas Red-Kanäle. Optimieren Sie die Laserleistung und Gewinne von jedem Kanal, um die Helligkeit der Bilder aus der Positivkontrolle Brunnen sicherzustellen sind kleiner als die Sättigung-Schwellenwert.
- Wählen Sie gut-zu-gut-Fokus für den Autofokus. Wählen Sie die erste Bohrung als erster gut für die Suche nach Proben erworben. Set Seite Autofokus an allen Standorten.
- Wählen Sie aus vier Durchschnittswerte pro Zeile für jeden Kanal. Optimieren Sie den Z-Offset-Wert für jeden Kanal.
- Test 2-3 Brunnen an den diagonalen Ecken von 384 well-Platte um sicherzustellen, dass die Bilder sind im Vordergrund für alle getestete Brunnen, Bilder von allen Seiten pro Bohrloch Zellen mit mehr als 40 % Confluence und Fluoreszenz-Intensitäten aller Kanäle haben etwa die Hälfte in der 100 % gesättigt sind Kontroll-Vertiefungen.
- Speichern Sie das Bild Erwerbsmethode.
- Führen Sie die gesamte Platte. Den Imager zu sehen, bis es beendet, Aufnahmen aus der ersten Spalte der Platte auf die Bildqualität überprüfen vor dem Verlassen des Imagers. 384-Well-Platte herausnehmen und bei 4 ° C für eine spätere Verwendung zu speichern.
Hinweis: Abhängig von der Anzahl der Seiten pro Brunnen und Kanäle genommen ausgewählt, dauert es 40 min bis 3 h, imaging ein 384-Well-Platte zu beenden.
(6) Bildanalyse.
- Ziehen Sie die Bilddaten mit einer High-Content Bildanalyse-Software. Wählen Sie eine der 100 % ige Kontrolle Brunnen (Spalte 23) einstellen.
- Wählen Sie die Multi-Wellenlänge Zelle Scoring als Analysemethode und Einstellungen konfigurieren.
- Definieren Sie die Kerne mit Bildern aus der DAPI-Kanal. Vorschau anzeigen Sie, um sicherzustellen, dass die definierten Kerne Formen in den ausgewählten passt gut auch mit den Kernen Bildern.
- Definieren Sie die Form der Zelle in der FITC-Kanal wo Rhodopsin-Venus abgebildet wird.
- Definieren Sie das Rhodopsin Zellbereiche Oberfläche Fleck im Texas Rot-Kanal.
- Testen Sie die aktuelle Algorithmus in 5 Brunnen um festzustellen, ob die Einstellungen optimiert werden. Speichern Sie die Einstellungen und schließen Sie das Konfigurationsfenster .
- Führen Sie alle Brunnen mit der optimierten Analysemethode.
- Exportieren Sie Objektnummer als intakte Zellennummer. Die Durchschnittliche Intensität der FITC-Kanal als Rhodopsin-Venus Intensität (Rhodopsin-Venus INT) exportieren. Die Durchschnittliche Intensität des Texas Red Kanals als Rhodopsin Intensität auf der Zelloberfläche (Rhodopsin INT auf der Zelloberfläche) exportieren.
- Öffnen Sie die exportierten Daten in eine Tabellenkalkulation. Teilen Sie die Rhodopsin-Intensität auf der Zelloberfläche durch die Rhodopsin-Venus INT als MEM-insgesamt Verhältnis. Berechnen Sie die Z'-Faktoren für jeden Parameter zur Bewertung der Assay-Qualität. Z′ = 1−3X (STD+100 % KontrolleSTD0 % Steuern) / | Meine100 % ige Kontrolle−Mean0 % Steuern|
Hinweis: Z'-Faktor höher als 0 steht für eine moderate Assay ausreichend für einen High-Content-Bildschirm und ein Z' Faktor zwischen 0,5 und 1 schlägt einen herausragenden Assay für eine Hochdurchsatz-Bildschirm20,21erforderlich. - Verwenden Sie der Tabellenkalkulations-Software zum Generieren einer Zweifarben-Heatmap für jeden Parameter. Ordnen Sie den Namen des Zell-Linien auf der X-Achse und die Verbindungen auf der Y-Achse.
Ergebnisse
Wir zeichnen die Rhodopsin-Transport mit drei Parameter: die Rhodopsin-Venus-Intensität in der ganzen Zelle (Rhodopsin-Venus INT), die Immunostaining Intensität des Rhodopsin auf der Plasmamembran (Rhodopsin INT auf der Zelloberfläche) und das Verhältnis von Rhodopsin Fleck auf der Zelloberfläche Rhodopsin-Venus-Intensität in der ganzen Zelle (MEM-Total-Ratio). Ein repräsentatives Ergebnis des Rhodopsin-Transport-Assays ist in Abbildung 3 und Abbildung 4gezeigt. Verwendung von DMSO und 9 -Cis-Retinal behandelten Zellen mit dem Ausdruck der P23H-Rhodopsin-Venus als die 0 und 100 % Kontrollen, bzw. die Z'-Faktoren für diese drei Parameter im Bereich sind zwischen 0 bis 0,5, darauf hindeutet, dass der Assay mäßigen Qualität hat ausreichend für High-Content imaging21. Obwohl die optimierte Z'-Faktoren sind geringer als 0,5 aufgrund seiner relativ komplexen Verfahren im Vergleich zu einem HTS Assay, dieser Test ist nach wie vor robust und zuverlässig für eine Image-basierte Analyse. Eine aktive Verbindung, die eine fehlgefaltete Rhodopsin rettet sollten höhere Werte des Rhodopsin INT auf der Zelloberfläche und MEM-Total-Verhältnis als DMSO, mit einem P -Wert geringer als 0,05 angezeigt. Drei 2-D-Heatmaps entstanden aus diesen drei Parametern zum Vergleich der durchschnittlichen Rhodopsin Betrag und Lokalisierung pro Zelle (Abbildung 4). In Triplicates wiederholt, WT und sechs Rhodopsin-Mutanten sind horizontal aufgeführt, und die Auswirkungen der zusammengesetzten Behandlungen werden vertikal verglichen. In Übereinstimmung mit früheren Studien das Rhodopsin INT auf der Zelloberfläche und das MEM-Total-Verhältnis von liegen für die sechs Mutanten im Vergleich zu den WT Rhodopsin mit DMSO (Abbildung 4)5,22,23behandelt. Das Rhodopsin INT auf der Zelloberfläche und seine MEM-Total-Ratio stieg 9 -Cis-retinal Behandlung für die T4R, P23H, D190N und P267L, aber nicht die P53R oder C110Y durch Mutation entstehende Variationen, darauf hindeutet, dass 9 -Cis-Retinal rettet den Transport von T4R, P23H, D190N und P267L Rhodopsin-Mutanten. Die cps zeigte unterschiedlicher Anstieg in der Rhodopsin-INT auf der Zelloberfläche für T4R, P23H und D190N. CPS 3, 4, 5, 7, 8 und 11 erhöht die Rhodopsin-Venus-INT aber nicht das MEM-insgesamt Verhältnis dieser Rhodopsin-Mutanten, was darauf hindeutet, dass diese Verbindungen nur Rhodopsin erhöht. CPS 1, 2, 6 und 9 deutlich erhöht das MEM-Gesamt-Verhältnis von T4R, P23H, D190N und P267L Rhodopsin-Mutanten, die darauf hindeutet, dass diese Verbindungen den Transport dieser Rhodopsin-Mutanten, die Plasmamembran zu retten. Die 2-D-Profile bieten einen umfassenden Überblick über Rhodopsin Transport betroffen durch diese AdRP verbundenen Mutationen, die durch unterschiedliche pharmakologische Behandlung gemildert werden.

Abbildung 1: der Workflow des Rhodopsin Transport Assays. Verfahren zur Zelle Oberfläche Färbung des Rhodopsin ohne Membran Permeabilisierung für das Rhodopsin-Transport-Assay. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Illustrationen für die Zubereitung von 5 x funktionierende Lösungen und die flüssige Übertragung von 96-Well-Platte auf 384-Well-Platte. (A) die 96-Well-Platte Layout der 5 x funktionierende Lösungen. Brunnen-A1, G2 haben 300 µL pro Bohrloch von bis zu 15 5 x Gebrauchslösungen und Assay-Medium (M), wie in den Spalten 1 und 2 dargestellt. Verbindungen, 14 und 15 sind 2 % DMSO und 25 µM 9 -Cis-Netzhaut, bzw. für die Behandlung der sieben Zelllinien WT und mutierten Rhodopsin zum Ausdruck bringt. Darüber hinaus haben Spalten 11 und 12 100 µL pro Bohrloch von 2 % DMSO und 25 µM 9 -Cis-Retinal steuert bzw. behandelt, um die Zellen mit dem Ausdruck des P23H Rhodopsin für die Berechnung der Z'-Faktoren. (B) 384-Well-Platte-Layout für die Zelle Art und Behandlung. Die U2OS Zellen mit dem Ausdruck der WT, T4R, P23H, P53R, C110Y, sind D190N und P267L Rhodopsin-Venus ausgesät, wie abgebildet. Behandlungsbedingungen sind blau gekennzeichnet. Rosa und blaue Tipps zeigen die Brunnen-Brunnen flüssige Übertragung von 96-Well-Platte 384 Platte mit einer Mehrkanal-Pipette. Bitte klicken Sie hier für eine größere Version dieser Figur.
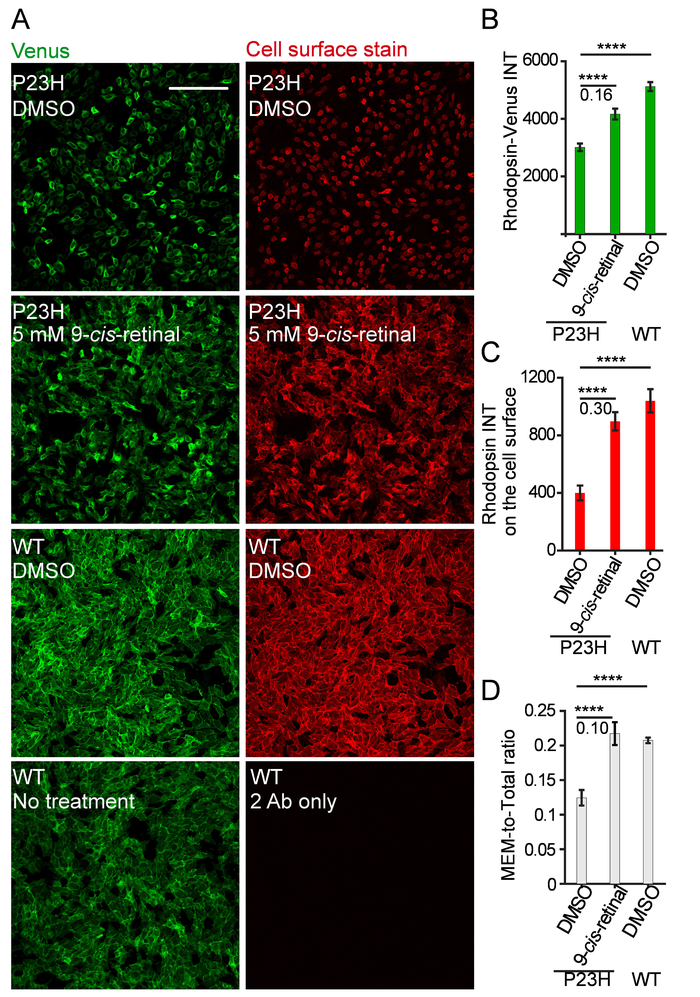
Abbildung 3: repräsentative Bilder und Quantifizierungen für die Steuerelemente des Rhodopsin Transport Assays. (A) Venus Fluoreszenz (grün) und Zelle Oberfläche Immunostaining (rot) von U2OS Zellen mit dem Ausdruck WT oder P23H Rhodopsin-Venus behandelt mit DMSO oder 5 µM 9 -Cis-Retinal. Maßstabsleiste = 200 µm. (B) A Spalte Plotten der mittlere Venus Intensität pro Zelle, Rhodopsin Betrag in der ganzen Zelle (Rhodopsin-Venus INT). p< 0,0001. Z'-Faktor wird unter die schwarze Linie angezeigt. Spalte Wert und Fehler Bar sind jeweils Mittelwert und Standardabweichung (S.D.) von 16 Wiederholungen. (C) eine Spalte Grundstück bedeuten Cy3 Intensität pro Zelle, das Rhodopsin gebeizt auf der Zelloberfläche (Rhodopsin INT auf der Zelloberfläche) darstellt. (D) eine Spalte Grundstück das Verhältnis der mittleren cy3 Intensität pro Zelle zu Venus Intensität pro Zelle repräsentieren das Verhältnis von Rhodopsin-Ebene auf der Zelloberfläche, seine gesamte Zellenebene (MEM-insgesamt Verhältnis) bedeuten. Bitte klicken Sie hier für eine größere Version dieser Figur.
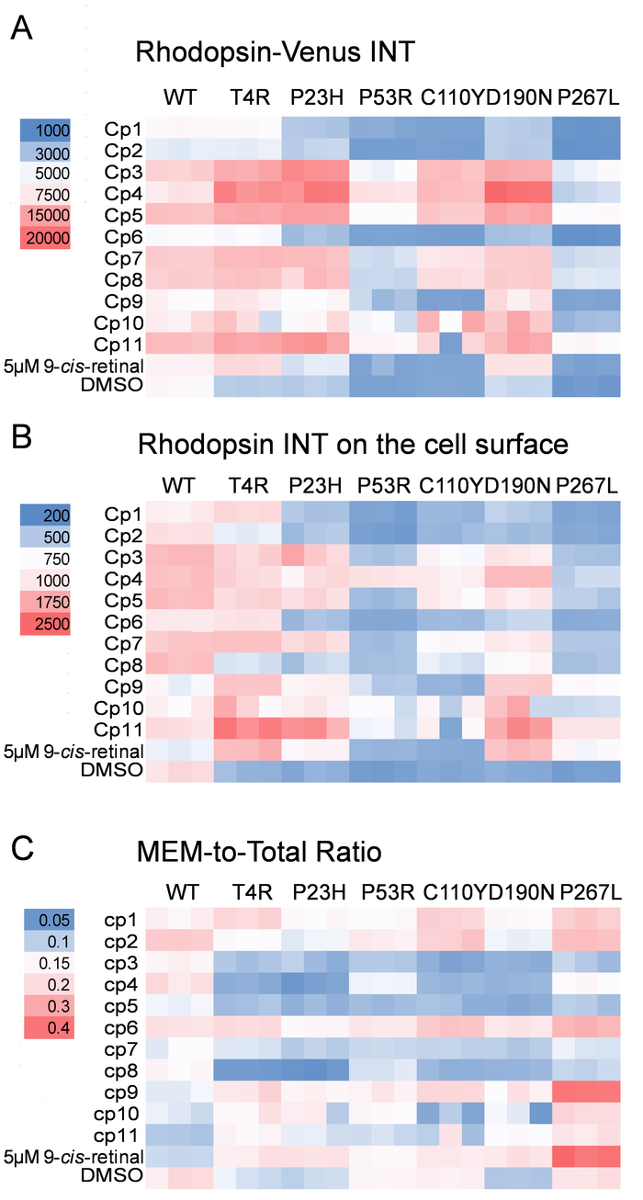
Abbildung 4: eine repräsentative High-Inhaltsanalyse des Rhodopsin Transport Assays gezeigt wie 2-farbige Heatmaps. (A) die Heatmap von meine Venus Intensität pro Zelle, was dem ganzen Zelle Rhodopsin-Niveau (Rhodopsin-Venus INT). Jeder Block stellt einen Datenpunkt und jede Bedingung in dreifacher Ausfertigung getestet wurde. Die Farblegende wird auf der linken Seite angezeigt. CP, zusammengesetzte. (B) die Heatmap von bedeuten Cy3 Intensität pro Zelle, das Rhodopsin gebeizt auf der Zelloberfläche (Rhodopsin INT auf der Zelloberfläche) darstellt. (C) der Heatmap des Mittelwerts Cy3 Intensität pro Zelle zum Mittelwert Venus Intensität pro Zelle, das Verhältnis von Rhodopsin-Ebene auf der Zelloberfläche, seine gesamte Zellenebene (MEM-insgesamt Verhältnis) darstellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Hier zeigten wir einen High-Content imaging Assay verwendet für die Charakterisierung von Hits aus einem HTS identifiziert Die einzige Automatisierung dieser Protokolle beteiligt ist der High-Content-Imager. Die Immunostaining und Fluoreszenz-Bildgebung des Rhodopsin haben häufig verwendet, um die Lokalisierung von Rhodopsin5,14,15,16zu charakterisieren. Allerdings ist die Quantifizierung der Aufnahmen von den herkömmlichen bildgebenden Verfahren durch den Mangel an ausreichenden Zelle Bilder pro Zustand, geringe Kapazität von Bildern pro Experiment und mangelnde Qualitätskontrolle Parameter begrenzt. Wir das traditionelle Immunostaining Protokoll in das 384-Well-Format angepasst und ersetzt die traditionellen Bildgebung mit hoher Inhalt Bildgebung. Mit diesem High-Content imaging Protokoll, wir erfolgreich ausgewählt und charakterisiert die Aktivitäten von Treffern, die durch ein HTS11,13,17identifiziert. Im Vergleich zu den traditionellen Immunostaining und bildgebenden Verfahren, erhöht dieses Protokoll deutlich die Konsistenz der bildgebenden Bedingungen, bildgebenden Kapazität und Bild-Analyse macht, die uns ermöglicht, die pharmakologischen Effekte quantitativ zu vergleichen 11 Verbindungen auf den Transport von sechs AdRP verbundenen Rhodopsin Mutanten.
Die wichtigsten Änderungen dieses Protokolls im Vergleich zu den bisher verwendeten Protokollen für Rhodopsin Immunostaining und Bildgebung sind: (1) wachsen und Immunostaining Zellen in eine Clear-Boden-384-Well-Platte; (2) imaging-Zellen unter Verwendung eines High-Content-Imagers; und (3) Analyse von Daten mit einer High-Content Bildanalyse-Software. Aufgrund dieser Veränderungen ist eine erste Optimierung erforderlich, um die besten seeding Zellzahl, Antikörper-Konzentrationen, bildgebenden Bedingungen und Bild Analysealgorithmen finden.
Die entscheidenden Schritte des Protokolls gehören: (1) Aussaat Zellen, mit denen 50-70 % Zusammenfluss vor Fixierung; (2) vorsichtig Bestrebungen Zelle Loslösung zu vermeiden; (2) mehrere Brunnen über die ganze Platte, um sicherzustellen, dass Bilder auf Focus und fluoreszieren aller Kanäle imaging übersteigen nicht die Hälfte von der Schwelle der Imager für die Positivkontrolle Brunnen vor die ganze Platte imaging; und (3) halten die Z'-Faktor höher als 0, um die Zuverlässigkeit des Tests zu gewährleisten.
Die häufigsten Probleme, die für dieses Protokoll angetroffen werden konnte sind Zelle ablösen und niedrige Z'-Faktoren. Um die erste Ausgabe zu vermeiden, vorbehandeln Sie 384-Well-Platte mit Poly-L-Lysin zu erleichtern die Zellhaftung und vermeiden die Verwendung von Zelllinien, die lösen leicht wie die Hek293 Zellen. Darüber hinaus begrenzen Sie die Aspiration Spitze zu berühren nur die eine Seite von jedem Bohrloch während der Aspiration und wählen die andere Seite von jedem Bohrloch für die Bildgebung. Verbesserung die Z'-Faktor und der Assay-Qualität, die Zelle Nummer und Bild Analyseparameter um sicherzustellen, dass die Zellform oder Kerne Form definiert durch die Software passt sehr gut zu jedem Objekt in jedem Kanal Fluoreszenz Aussaat zu optimieren.
Im Vergleich zu anderen Methoden zur Quantifizierung Rhodopsin Transport, z. B. eine Zelle Oberfläche ELISA oder ein β-Galaktosidase Fragment Komplementierung Assay, die welche das Zielniveau Proteine auf der Zelloberfläche in allen Zellen berechnen, quantifiziert diese High-Content bildgebende Methode durchschnittliche Proteingehalt pro Zelle; und diese einzigartige Funktion vermeidet eine kritische Variante Faktor, die Anzahl von Zellen, die die endgültige anzeigen in anderen Methoden betrifft. Darüber hinaus aufgrund der großen Anzahl von Zellen abgebildet und durch das High-Content bildgebende Verfahren quantifiziert, die Parameter im Durchschnitt aus allen Zellen pro gut zeigte geringe Unterschiede zwischen den einzelnen Wiederholungen, damit du die Zuverlässigkeit des Tests.
Eine Einschränkung dieses Protokolls ist, dass sie nicht die besten Assays für HTS, aufgrund seiner relativ komplizierten Verfahren und die 2 h pro Platte imaging-Zeit. So, wir empfehlen alternative Reporter Assays für die screening-großer kleine Molekül-Bibliotheken mit mehr als 5.000 Verbindungen, und verwenden Sie dieses High-Content Image Protokoll für gezielte Charakterisierung Assays auf weniger als 100 Verbindungen beschränkt. Die zweite Einschränkung dieses Protokolls ist der Mangel an Standards, die zeigen, ob die Venus Fluoreszenz oder die Immunostaining Fluoreszenz-Intensitäten in eine lineare Korrelation mit der Menge der Rhodopsin-Protein-Menge pro Zelle. Zur Vermeidung von Sättigung von Immunostaining empfehlen wir testen und Plotten die Immunostaining Intensitäten der Zellen mit verschiedenen Konzentrationen von primären und sekundären Antikörper inkubiert. Wählen Sie die Antikörper-Konzentrationen innerhalb des linearen Bereichs der Blüte ändern.
Ausbau von der aktuellen Anwendung, werden wir Rhodopsin Transport von Aufnahmen von Zellen mit 28 verschiedenen Rhodopsin-Mutanten unter der Behandlung mit bis zu 10 Verbindungen um eine pharmakologische Datenbank dieser Verbindungen zu generieren vorübergehend transfiziert quantifizieren Aktivität zur Führung von möglichen Behandlungen AdRP Patienten tragen diese Rhodopsin-Mutationen. Dieses Protokoll kann auch leicht an die Translokation Assays Membran Proteins des Interesses angepasst werden, die Droge Entdeckungen der anderen Protein misfolding Krankheiten nützlich sein wird.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir bedanken uns bei Dr. Mark E. Schurdak und University of Pittsburgh Drug Discovery Institute für die Bereitstellung von High-Content Imager und erste Schulungen. Dr. Krzysztof Palczewski (Case Western Reserve University) teilten großzügig 1-4 und B630 Anti-Rhodopsin Antikörper. Das Plasmid enthält die cDNA Maus Rhodopsin-Venus Konstrukt wurde von Dr. Nevin Lambert (Augusta Universität) geteilt. Diese Arbeit wurde durch das National Institute of Health Grant EY024992 YC und P30EY008098 von der University of Pittsburgh Vision Forschung Core Grant unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| U2OS (rhodopsin-Venus) cells | NA | NA | Stable cells generated from U2OS cells |
| U2OS (T4R-rhodopsin-Venus) cells | NA | NA | Stable cells generated from U2OS cells |
| U2OS (P23H-rhodopsin-Venus) cells | NA | NA | Stable cells generated from U2OS cells |
| U2OS (P53R-rhodopsin-Venus) cells | NA | NA | Stable cells generated from U2OS cells |
| U2OS (C110Y-rhodopsin-Venus) cells | NA | NA | Stable cells generated from U2OS cells |
| U2OS (D190N-rhodopsin-Venus) cells | NA | NA | Stable cells generated from U2OS cells |
| U2OS (P267L-rhodopsin-Venus) cells | NA | NA | Stable cells generated from U2OS cells |
| DMEM high glucose | Genesee Scientific | 25-500 | With L-Glutamine, sodium pyruvate |
| Fetal bovine serum (FBS) | Gibco | 16140071 | Heat inactivated |
| Plasmocin | InvivoGen | ant-mpt | Mycoplasma elimination reagent |
| Penicillin-Streptomycin (100X) | Gibco | 15140122 | 100X concentrated antibiotic solutions to prevent bacteria contamination of cell cultures |
| Trypsin-EDTA | Genesee Scientific | 25-510 | 0.25%, 1mM EDTA in HBSS without calcium and magnesium |
| Poly-L-lysine solution | Sigma-Aldrich | P4707-50ML | Mol wt 70,000-150,000, 0.01%, sterile-filtered, BioReagent, suitable for cell culture |
| CellCarrier-384 Ultra Microplates | PerkinElmer | 6057300 | 384-well tissue culutre-treated microplates with black well walls and an optically -clear cyclic olefin bottom for imaging cells in high content analysis |
| Sterile 96-well plate | Eppendorf | 30730119 | Tissue culture treated with lid flat bottom, sterile, free of detectable pyrogens, Rnase, DNase and DNA. Non-cytotoxic |
| Phosphate Buffered Sailine (PBS) | Invitrogen | AM9625 | 10 x PBS Buffer, pH 7.4 |
| DMSO | Sigma-Aldrich | D4540 | >99.5%, cell culture tested |
| 9-cis-retinal | Sigma-Aldrich | R5754 | |
| Compounds tested | Selleckchem/Life Chemicals/Custom synthesized | NA | Compounds were purchased from different vendors or custom synthesized |
| B6-30 anti-rhodopsin antibody | Novus | NBP2-25160 | Gift from Dr. Krzysztof Palczewski |
| Cy3-conjugated goat anti-mouse secondary antibody | Jackson ImmunoResearch Laboratories, Inc | 115-165-146 | |
| 16% paraformaldehyde | Thermo Fisher Scientific | 28908 | Methanol-free |
| 10% Normal Goat Serum | Thermo Fisher Scientific | 50062Z | Blocking buffer |
| Hoechst 33342, Trihydroch | Invitrogen | H3570 | Nuclear staining solution |
| High-content imager | Molecular Devices | ImageXpress | ImageXpress® Micro Confocal High-Content Imaging System |
| MetaXpress high-content image acquisition and analysis software | Molecular Devices | MetaXpress | High-content image acquisition and analysis software |
| Multichannel pipette (0.5-10 µL) | Rainin | 17013802 | Manual 8-channel pipette, 0.5-10 µL |
| Multichannel pipette (0.5-10c | Rainin | 17013805 | Manual 8-channel pipette, 20-200 µL |
| Electronic multichannel pipette (10-200 μL) | Thermo Scientific | 14-3879-56BT | Electronic multichanenel pipette for 96- and 384-well microplate pipetting tasks |
| 50ml Reagent Reservoir | Genesee Scientific | 28-125 | Reagent reservior for multichannel pippte dispensing |
| 8-Channel aspirator | ABC Scientific | EV503 | 8-Channel stainless steel adaptor for aspirating liquids from 96- or 384-well plates |
| Excel spreadsheet software | Microsoft | Excel2016 | The spreadsheet software for data analysis and heatmap generation |
| Origin2018 scientific data analysis and graphing software | OriginLab | Origin2018 | The data analysis software for generating the dose response curves |
Referenzen
- Gregersen, N., Bross, P., Vang, S., Christensen, J. H. Protein misfolding and human disease. Annual Review of Genomics and Human Genetics. 7, 103-124 (2006).
- Daiger, S. P., Bowne, S. J., Sullivan, L. S. Perspective on genes and mutations causing retinitis pigmentosa. Archives of Ophthalmology. 125 (2), 151-158 (2007).
- Daiger, S. P., Sullivan, L. S., Bowne, S. J. Genes and mutations causing retinitis pigmentosa. Clinical Genetics. 84 (2), 132-141 (2013).
- Stenson, P. D., et al. The Human Gene Mutation Database: towards a comprehensive repository of inherited mutation data for medical research, genetic diagnosis and next-generation sequencing studies. Human Genetics. 136 (6), 665-677 (2017).
- Sung, C. H., Schneider, B. G., Agarwal, N., Papermaster, D. S., Nathans, J. Functional heterogeneity of mutant rhodopsins responsible for autosomal dominant retinitis pigmentosa. Proceedings of the National Academy of Sciences of the United States of America. 88 (19), 8840-8844 (1991).
- Athanasiou, D., et al. The molecular and cellular basis of rhodopsin retinitis pigmentosa reveals potential strategies for therapy. Progress in Retinal and Eye Research. 62, 1-23 (2018).
- Chiang, W. C., et al. Robust Endoplasmic Reticulum-Associated Degradation of Rhodopsin Precedes Retinal Degeneration. Molecular Neurobiology. 52 (1), 679-695 (2015).
- Sakami, S., et al. Probing mechanisms of photoreceptor degeneration in a new mouse model of the common form of autosomal dominant retinitis pigmentosa due to P23H opsin mutations. Journal of Biological Chemistry. 286 (12), 10551-10567 (2011).
- Dryja, T. P., et al. Mutations within the rhodopsin gene in patients with autosomal dominant retinitis pigmentosa. New England Journal of Medicine. 323 (19), 1302-1307 (1990).
- Sohocki, M. M., et al. Prevalence of mutations causing retinitis pigmentosa and other inherited retinopathies. Human Mutation. 17 (1), 42-51 (2001).
- Chen, Y., et al. A novel small molecule chaperone of rod opsin and its potential therapy for retinal degeneration. Nature Communications. 9 (1), 1976 (2018).
- Chen, Y., Tang, H. High-throughput screening assays to identify small molecules preventing photoreceptor degeneration caused by the rhodopsin P23H mutation. Methods in Molecular Biology. 1271, 369-390 (2015).
- Chen, Y., et al. A High-Throughput Drug Screening Strategy for Detecting Rhodopsin P23H Mutant Rescue and Degradation. Investigative Ophthalmology & Visual Science. 56 (4), 2553-2567 (2015).
- Noorwez, S. M., et al. Pharmacological chaperone-mediated in vivo folding and stabilization of the P23H-opsin mutant associated with autosomal dominant retinitis pigmentosa. Journal of Biological Chemistry. 278 (16), 14442-14450 (2003).
- Saliba, R. S., Munro, P. M., Luthert, P. J., Cheetham, M. E. The cellular fate of mutant rhodopsin: quality control, degradation and aggresome formation. Journal of Cell Science. 115, 2907-2918 (2002).
- Kaushal, S., Khorana, H. G. Structure and function in rhodopsin. 7. Point mutations associated with autosomal dominant retinitis pigmentosa. Biochemistry. 33 (20), 6121-6128 (1994).
- Chen, Y., Brooks, M. J., Gieser, L., Swaroop, A., Palczewski, K. Transcriptome profiling of NIH3T3 cell lines expressing opsin and the P23H opsin mutant identifies candidate drugs for the treatment of retinitis pigmentosa. Pharmacological Research. 115, 1-13 (2016).
- Adamus, G., et al. Anti-rhodopsin monoclonal antibodies of defined specificity: characterization and application. Vision Research. 31 (1), 17-31 (1991).
- Goodson, H. V., Dzurisin, J. S., Wadsworth, P. Generation of stable cell lines expressing GFP-tubulin and photoactivatable-GFP-tubulin and characterization of clones. Cold Spring Harbor Protocols. 2010 (9), pdb prot5480 (2010).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Bray, M. A., Carpenter, A., et al. Advanced Assay Development Guidelines for Image-Based High Content Screening and Analysis. Assay Guidance Manual. Sittampalam, G. S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences. Bethesda (MD). (2004).
- Sung, C. H., Davenport, C. M., Nathans, J. Rhodopsin mutations responsible for autosomal dominant retinitis pigmentosa. Clustering of functional classes along the polypeptide chain. Journal of Biological Chemistry. 268 (35), 26645-26649 (1993).
- Krebs, M. P., et al. Molecular mechanisms of rhodopsin retinitis pigmentosa and the efficacy of pharmacological rescue. Journal of Molecular Biology. 395 (5), 1063-1078 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten