Method Article
Verwendung der Elektron-paramagnetische Resonanz in biologischen Proben bei Umgebungstemperatur und 77 K
In diesem Artikel
Zusammenfassung
Elektron-paramagnetische Resonanz (EPR)-Spektroskopie ist eine eindeutige Methode, freie Radikale zu messen. Die Verwendung von selektive Spin Sonden kann für die Erkennung von freien Radikalen in verschiedenen zellulären Kompartimenten. Wir präsentieren Ihnen eine praktische und effiziente Methode zur biologische Proben zu sammeln, die zu erleichtern, Behandlung, Speicherung und Übertragung von Proben für EPR-Messungen.
Zusammenfassung
Die genaue und spezifische Detektion von reaktiven Sauerstoffspezies (ROS) in verschiedenen Mobilfunk- und Gewebe Kompartimenten ist wichtig für die Untersuchung von Redox-regulierten Signalisierung in biologischen Einstellungen. Elektron-paramagnetische Resonanz-Spektroskopie (EPR) ist die einzige direkte Methode, um freie Radikale eindeutig zu beurteilen. Sein Vorteil ist, dass physiologische Ebenen von bestimmten Arten mit hoher Spezifität erkennt, aber es erfordert spezialisierte Technologie, sorgfältige Probenvorbereitung und entsprechende Kontrollen, um genaue Interpretation der Daten zu gewährleisten. Zyklische Hydroxylamin Spin Sonden reagieren selektiv mit Superoxid oder andere radikale ein Nitroxid-Signal generieren, die von EPR-Spektroskopie quantifiziert werden können. Zelle durchlässig Spin Sonden und Spin Sonden entwickelt, um schnell in den Mitochondrien sammeln ermöglichen die Bestimmung der Superoxid-Konzentration in verschiedenen zellulären Kompartimenten.
In kultivierten Zellen, die Verwendung der Zelle durchlässig 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) zusammen mit und ohne Handy-undurchlässig Superoxid Dismutase (SOD) Vorbehandlung oder Verwendung der Zelle durchlässig PEG-SOD, ermöglicht die Differenzierung der extrazellulären aus cytosolischen Superoxid. Die mitochondriale 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] Piperidinium Paraquatdichlorid (Mito-TEMPO-H) ermöglicht die Messung von mitochondrialen ROS (überwiegend Superoxid).
Spin-Sonden und EPR-Spektroskopie können auch auf in Vivo Modelle angewendet werden. Superoxid kann in extrazellulären Flüssigkeiten wie Blut und alveoläre Flüssigkeit sowie Gewebe wie Lungengewebe erkannt werden. Verschiedene Methoden werden vorgestellt, um zu verarbeiten und speichern Gewebe für EPR-Messungen und intravenöse 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) Spin Sonde in Vivozu liefern. Während Messungen bei Raumtemperatur durchgeführt werden können, können durch EPR bei 77 K. Proben aus in Vitro und in Vivo Modellen auch bei-80 ° C gelagert und analysiert werden Die Proben können in spezialisierten Schläuche stabil bei-80 ° C gelagert und laufen bei 77 K ermöglichen eine praktische, effiziente und reproduzierbare Methode, das erleichtert die Speicherung und Übertragung von Proben.
Einleitung
Maßnahmen der oxidativen Stress und reaktive Sauerstoffspezies sind, zwar wichtig für die Untersuchung von verschiedenen Krankheiten auf alle Organsysteme ist die Detektion von reaktiven Sauerstoffspezies (ROS) durch eine kurze Halbwertszeit und hohe Reaktivität anspruchsvoll. Eine Elektron-paramagnetische Resonanz (EPR)-Technik ist die am meisten eindeutige Methode zur Erkennung von freien Radikalen. Spin-Sonden haben Vorteile gegenüber den häufig verwendeten fluoreszierenden Sonden. Obwohl fluoreszierende Sonden sind relativ preiswert und einfach zu bedienen und ermöglichen eine schnelle, empfindliche Erkennung von ROS, haben sie gravierende Einschränkungen aufgrund Serums Signale, die Unfähigkeit, ROS Konzentration und einen allgemeinen Mangel an Spezifität1 berechnen .
Für eine einfache Handhabung des EPR für biologische Studien besagt eine Vielzahl von Spin Sonden synthetisiert worden, die eine Reihe von biologisch relevante radikalische Spezies sowie pO-2, pH und Redox messen können2,3, 4,5,6,7. Spin fallen auch entwickelt wurden, um kurzlebige radikale einzufangen und Form langlebige Addukte, die Erkennung von EPR8erleichtert. Beide Klassen (Spin-Sonden und Spin Traps) haben Vorteile und Einschränkungen. Eine häufig verwendete Klasse von Spin-Sonden sind zyklische Hydroxylamines, die EPR-Silent und reagieren mit kurzlebigen radikalen eine stabile Nitroxid bilden. Zyklische Hydroxylamines mit Superoxid 100 Mal schneller reagieren als Spin fallen, damit zu konkurrieren mit zellulären Antioxidantien, aber es fehlt Ihnen Spezifität und erfordern den Einsatz von geeigneten Kontrollen und Inhibitoren, die radikale Art oder Quelle zu identifizieren verantwortlich für das Nitroxid-Signal. Während Spin Ausstellung Spezifität Traps, Addukte mit unterschiedlichen spektralen Mustern je nach Gattung gefangen, sie haben langsame Kinetik für Superoxid spin überfüllen und sind anfällig für biologischen Abbau der radikalen. Anwendungen für Spin Überfüllung wurden gut dokumentiert in der biomedizinischen Forschung9,10,11,12,13.
Das Ziel dieses Projektes ist es, praktische EPR-Methoden für die Gestaltung von Experimenten zeigen und Probenvorbereitung, Superoxid mit Spin zu erkennen-Sonden in verschiedenen zellulären Kompartimenten in Vitro und in verschiedene Gewebe Fächer in Vivo. Mehrere Handschriften wurden Protokolle für diese Ziele mit Zelle durchlässig, Zelle-undurchlässig und mitochondriale gezielte Spin Sonden zu verschiedenen zellulären Kompartimenten in Vitro und Prozess Zielgewebe zur Analyse in Mausmodellen veröffentlicht. 14 , 15. Wir bauen auf diesem Körper der Literatur durch die Überprüfung eines Ansatzes zur Messung der Superoxid mittels 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) Spin Sonde in verschiedenen zellulären Kompartimenten in-vitro- um genau zu gewährleisten Messungen, Hervorhebung mögliche technische Probleme, die die Ergebnisse verzerren können. Wir bieten auch Methoden zum Ausführen von EPR-Messungen im Blut, alvéolaire Lavage Fluid und Lungengewebe mit der CMH-Spin-Sonde. Diese Studien vergleichen verschiedene Methoden, um Gewebe zu verarbeiten sowie eine Methode, um ein weiteres Spin-Sonde, CPH, in Mäuse vor der Ernte Gewebe injizieren zu präsentieren. Schließlich entwickeln wir eine praktische Methode zum Speichern von Proben in Polytetrafluorethylen (PTFE) Schlauch ermöglicht die Speicherung und Übermittlung von Proben vor dem EPR-Messungen bei 77 K.
Protokoll
Alle Tierversuche wurden von der University of Colorado Denver institutionelle Animal Care and Use Committee genehmigt.
1. Vorbereitung der Reagenzien
-
Diethylenetriaminepentaacetic Säure (DTPA) Lager (150 mM)
- Fügen Sie 2,95 g DTPA (393.35 g/Mol) auf 10 mL entionisiertem Wasser.
- Auflösen von DTPA, 1 M NaOH tropfenweise hinzufügen und bringen einem pH-Wert von 7,0.
- Bringen Sie die Lautstärke auf 50 mL mit Wasser für eine Endkonzentration von DTPA von 150 mM und bei 4 ° c lagern
-
Phosphat-Puffer Kochsalzlösung (PBS) (50 mM, pH 7.4)
- 5 M von Natriumchlorid (NaCl) (58.44 g/Mol; 29,22 g/100 mL) vorzubereiten.
- Bereiten Sie 1 M von Kalium Phosphat Diabas-HK2PO4 (174.18 g/Mol; 17,42 g/100 mL)
- Bereiten Sie 1 M von Kalium Phosphat monobasic KH2PO4 (136.1 g/Mol; 13,61 g/100 mL). Mischen Sie 3 mL 5 M NaCl mit 4,24 mL 1 M Kalium Phosphat Diabas- und 0,760 mL 1 M Kalium Phosphat monobasic. Überprüfen Sie den pH-Wert.
- Bringen Sie die Lautstärke auf 100 mL mit entionisiertem Wasser.
- Bei Raumtemperatur (RT) für kurzfristige (Tage) und bei 4 ° C für langfristige (Wochen) Speicher speichern.
-
Krebs-Henseleit-Puffer (KHB), enthält 100 µM DTPA
- Fügen Sie in 50 mL konische Zentrifugenröhrchen 33,3 µL der Stammlösung 150 mM DTPA.
- Eine 50 mL Volumen mit Krebs-Henseleit-Puffer (KHB) bringen.
- Bereiten Sie frische Puffer mit DTPA jeden Tag und halten Sie es bei RT
-
Tris-EDTA Puffer mit Saccharose
- 0,5 M Tris Lager vorbereiten: 15,14 g Tris-Base (121.14 g/Mol) in 150 mL entionisiertem Wasser auflösen. Mit HCl, stellen Sie den pH-Wert auf 7,8 und bringen Sie zu einem Endvolumen von 250 mL.
- Auflösen von 21,4 g Saccharose (342.29 g/Mol; Endkonzentration = 0,25 mM) in 150 mL entionisiertem Wasser.
- Saccharose, 10 mM Tris Endkonzentration zu erreichen fügen Sie 5 mL Tris Bestand hinzu.
- Fügen Sie 0,5 mL 0,5 M EDTA bestand Tris-Saccharose, eine Endkonzentration von 1 mM zu erreichen hinzu.
- Überprüfen Sie den pH-Wert und auf 7,4 einstellen.
- Bringen Sie zu einem Endvolumen von 250 mL mit entionisiertem Wasser und Lagerung bei 4 ° C.
-
Bovine Erythrozyten Cu/Zn-Superoxid-Dismutase (SOD) Lager (30.000 U/mL)
- Bereiten Sie 30.000 U SOD in 1 mL PBS (ca. 5,7 mg, je nach Aktivität des SOD-Menge).
- Vermischen Sie, aliquoten und bei-20 ° C für kurzfristige (6-12 Monate) und bei-80 ° C für die Langzeitspeicherung zu speichern.
-
SOD funktionierende Lösung (1000 U/mL)
- Übertragen Sie ein 30 µL aliquoten von 30.000 U/mL SOD-Lager in ein 870 µL steriler PBS.
- Halten Sie die Lösung auf dem Eis und verwenden Sie frisch.
-
Phorbol Myristate-12 13-Acetat (PMA) Lager (5 mM)
- Auflösen von 1 mg PMA (616.83 g/Mol) in 325 µL DMSO (Endkonzentration = 5 mM).
- Aliquoten eine 5 mM-PMA-Lösung und bei-20 ° c lagern
-
PMA funktionierende Lösung (125 µM)
- Verdünnen Sie eine aliquote 10 µL 5 mM PMA bestand in 390 µL steriler PBS.
- Halten Sie die Lösung auf dem Eis und verwenden Sie frisch.
- Verwenden Sie für eine Fahrzeugkontrolle für PMA 10 µL des DMSO in 390 µL PBS.
-
Diphenyliodonium-Chlorid (DIP) (2,5 mM)
- Auflösen von 3,2 mg Tauchen (316.57 g/Mol) in 4 mL, ein 2,5 mM-Lager zu erhalten.
- Bereiten Sie die Lösung und verwenden Sie frisch.
-
Deferoxamin Mesylate Salz (DFO) (20 mM)
- Auflösen von 4,5 mg DFO (656,79 g / Mol) in 340 µL eine 20 mM-Aktie zu erhalten.
- Bereiten Sie die Lösung und verwenden Sie frisch.
-
Vorbereitung der Antimycin A (AA) Lager (5 mM)
- Auflösen von 5,4 mg von AA (532 g/Mol) in 2 mL Ethanol (Endkonzentration = 5 mM).
- Aliquoten Lager in Glasfläschchen und Speicher bei-20 ° C.
-
Vorbereitung von Spin-Sonden
- Blase 50 mM Phosphat-Puffer mit 100 µM DTPA mit Stickstoff für 30 min, gelösten Sauerstoff aus dem Puffer zu entfernen.
- Die Spin-Sonde aus dem Tiefkühler-20 ° C und des Containers zu RT (10-15 min) kommen.
- Wiegen Sie 2,4 mg 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237,8 g/Mol)
- CMH in 1 mL des Puffers sauerstoffarmes Phosphat für eine Endkonzentration von 10 mM auflösen.
- 5 mg 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium Paraquatdichlorid (Mito-TEMPO-H) (529.1 g/Mol) wiegen.
- Mito-TEMPO-H in 1 mL des Puffers sauerstoffarmes Phosphat für eine Endkonzentration von 9,5 mM auflösen.
- Wiegen Sie 4,9 mg 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223.7 g/Mol).
- CPH in 1 mL des Puffers sauerstoffarmes Phosphat für eine Endkonzentration von 22 mM auflösen.
- Aliquoten und Store bei-80 ° C (Frost-Tau-Wechseln wird nicht empfohlen).
2. Nachweis von Superoxid in vitro
-
Erkennung von insgesamt extrazellulären und intrazellulären Superoxid in RAW 264,7 PMA-stimulierten Zellen bei RT
- Folgende korrekte aseptische Technik, RAW 264,7 Zellen auftauen lassen und sie in DMEM Medien mit 10 % FBS (niedrig Endotoxin-frei) und 1 % antimykotische/Ampicillin bei 37 ° C in CO2 Inkubator ergänzt die passage.
- RAW 264,7 Samenzellen bei 1 x 106 Zellen/weit ins 6-Well Platten einen Tag vor der Behandlung.
- Sanft entfernen Sie Medien zu und waschen Sie die Zellen einmal mit 1 mL der KHB Puffer.
- KHB, enthält 100 µM DTPA in jede Vertiefung hinzufügen, und behandeln in einem Gesamtvolumen von 500 µL mit folgendem:
- Für Brunnen vorbehandelt mit SOD, fügen Sie 15 µL/Well der Arbeitslösung SOD (1000 U/mL; Endkonzentration von SOD = 30 U/mL) und inkubieren Sie für 10 min bei 37 ° C vor der Zugabe von CMH und PMA.
- Fügen Sie 12,5 µL/Well von 10 mM CMH Lager (Endkonzentration = 0,25 mM).
- Hinzufügen von 125 µM PMA Arbeitslösung 40 µL/Well (Endkonzentration = 10 µM) oder 40 µL Fahrzeug (Lager 10 µL des DMSO in 390 µL PBS).
- 50 min bei 37 ° C in einem CO2 Inkubator inkubieren.
- Entfernen Sie die Platten aus dem Inkubator und sofort auf Eis legen.
- Sammeln Sie Puffer aus jedem Brunnen in separaten, 1,5 mL Röhrchen beschriftet. Halten Sie auf dem Eis im ganzen.
- Hinzufügen 100 µL frische KHB-Puffer mit 100 µM DTPA, sanft kratzen die Zellen und Aufschwemmen von oben und unten mehrmals pipettieren. Halten Sie auf dem Eis in der gesamten Zelle Wiederfreisetzung.
- Belastung der Probe gesammelt in den Schritten 2.1.10 und 2.1.11 (50 µL) in jedem der Kapillaren. Versiegeln Sie beiden Enden und führen Sie den EPR.
Hinweis: Immer ein Rohr zu testen oder auch (ohne Zellen) enthält die Sonde im Puffer (gleiche Konzentration = 0,25 mM), unter den gleichen Bedingungen wie die Zellen (gleiche Inkubationszeit und Temperatur) als Kontrolle, da Hintergrundintensität der Sonde Temperatur - wird behandelt und zeitabhängig. - Festlegen der EPR Aufnahmeparameter an folgende: Mikrowellen-Frequenz = 9,65 GHz; Feld = 3432 G; Amplitude Modulation = 2,0 G; Breite zu fegen = 80 G; Mikrowellen-Leistung = 19,9 mW; Gesamtanzahl der Scans = 10; Sweep-Zeit = 12.11 s; und Zeitkonstante = 20,48 ms.
-
Erkennung von mitochondrialen Superoxid in RAW 264,7 Zellen
- Führen Sie Schritte 2.1.1 und 2.1.2 zu RAW 264,7 Samenzellen einen Tag vor dem Experiment.
- Entfernen Sie Medien zu und waschen Sie die Zellen einmal mit 1 mL der KHB Puffer.
- Fügen Sie 200 µL der KHB mit 100 µM DTPA in jede Vertiefung.
- 5.3 µL/Well von 9,5 mM Mito-TEMPO-H Aktien hinzufügen (Endkonzentration = 0,25 mM)
- 10 min bei RT inkubieren
- Fügen Sie 1 µL/Well von Antimycin A (AA), 5 mM-Stammlösung in Ethanol (Endkonzentration = 25 µM).
- 50 min bei 37 ° C in einem CO2 Inkubator inkubieren.
- Entfernen Sie die Platten aus dem Inkubator und sofort auf Eis legen.
- Sanft die Zellen zu kratzen und Aufschwemmen durch Pipettieren rauf und runter. Halten Sie auf dem Eis.
- Laden Sie die Probe in einem Kapillarröhrchen. Versiegeln Sie beiden Enden.
- Finden Sie im vorherigen Abschnitt für EPR-Einstellung.
-
Erkennung von Superoxid in RAW 264,7 Zellen bei 77 K
- Legen Sie den Puffer in Schritt 1.1.10 in vorbereiteten PTFE Schlauch 1 2 Zoll in der Länge (3/16" x 1/8" ID OD) gesammelt. Stellen Sie sicher, dass der PTFE-Schlauch ist gerade, so kann es leicht eingefügt und vom Finger entfernt Dewar. Verwenden Sie einen Gummistopfen schließen Sie ein Ende des PTFE-Schläuche, pipette Puffer oder Zellsuspension (100 bis 150 µL) in die PTFE-Schläuche und den Schlauch mit einem zweiten Stopfen verschließen.
- Flash-Einfrieren der Probe in flüssigem Stickstoff. Die Probe kann auf einem beschrifteten Kryokonservierung Rohr für die Lagerung bei-80 ° C übertragen oder sofort ausführen.
- Füllen Sie den Finger Dewar mit flüssigem Stickstoff und Einsatz der PTFE-Schlauch mit der Probe in die Finger Dewar. Stellen Sie sicher, die Probe ist in den aktiven Raum des Resonators zentriert und EPR bei 77 K.
Hinweis: Starten Sie den Stickstoff Gasdurchfluss zu Ihrem Spektrometer 15-30 min vor den Messungen und weiter dieser Fluss durch die Messungen um Kondenswasser im Resonator zu verhindern. - EPR Aufnahmeparameter an folgende stellen: Mikrowellen-Frequenz = 9,65 GHz; Feld = 3438 G; Amplitude Modulation = 4,0 G; Sweep Breite = 150 G; Mikrowellen-Leistung = 0.316 mW; Gesamtanzahl der Scans = 10; Sweep-Zeit = 60 s; und Zeitkonstante = 1,28 ms.
(3) EPR-Messungen in Flüssigkeiten
-
Vollblut
- Mäuse (8-12 Wochen alt) mit einer Einzeldosis von intratrachealen Bleomycin (Bleo; 100 µL bei 1 U/mL) aufgelöst in PBS oder PBS allein als zuvor beschriebenen16,17zu behandeln.
- Einschläfern Sie Mäuse durch die Gabe von inhalativen Isofluran (1.5-4 %), gefolgt von Entbluten und zervikale Dislokation. Aspirieren Sie Blut durch den rechten Ventrikel in eine Spritze mit Heparin (1000 USP/mL) mit 100 µM DTPA und Übertragung auf einen 1,5 mL-Tube beschichtet.
- Fügen Sie in einem separaten 1,5 mL Röhrchen 15 µL PBS mit 100 µM DTPA und 3 µL CMH (10 mM), 132 µL Blut für ein Gesamtvolumen von 150 µL und CMH Endkonzentration von 0,2 mM.
- Inkubieren Sie Blut für 10 min bei 37 ° C im Wasserbad.
- Nehmen Sie die Rohre aus Wasserbad.
- Eine aliquote durch das Blut in einem Kapillarröhrchen laden und ausführen EPR bei RT mit den folgenden Parametern der EPR-Übernahme: Mikrowellen-Frequenz = 9,65 GHz; Feld = 3432 G; Amplitude Modulation = 1,0 G; Breite zu fegen = 80 G; Mikrowellen-Leistung = 19,9 mW; Gesamtanzahl der Scans = 3; Sweep-Zeit = 12.11 s; und Zeitkonstante = 20.48 Frau alternativ Proben kann gefroren wie in beschrieben Schritt 2.3 Flashen für Messungen bei 77 K. EPR Aufnahmeparameter die folgenden sind: Mikrowellen-Frequenz = 9,65 GHz; Feld = 3438 G; Amplitude Modulation = 4,0 G; Sweep Breite = 150 G; Mikrowellen-Leistung = 0.316 mW; Gesamtanzahl der Scans = 2; Sweep-Zeit = 60 s; und Zeitkonstante = 1,28 ms.
-
Alvéolaire Lavage-Flüssigkeit (BALF)
- Nach der Euthanasie (siehe Punkt 3.1.2), BALF sammeln, indem Sie langsam Einträufeln und abheben von 1 mL PBS mit 100 µM DTPA dreimal in eine Spritze mit eine Kanüle in der Luftröhre platziert.
- In einer 1,5 mL Tube behandeln Sie 200 µL BALF mit 4 µL CMH (10 mM), eine Endkonzentration von 0,2 mM zu erhalten.
- 50 min bei 37 ° C in einem Wasserbad inkubieren Sie BALF.
- Rohre aus dem Wasserbad nehmen und auf Eis legen.
- Last BALF in einem Kapillarrohr und laufen EPR bei RT mit den gleichen EPR-Einstellungen wie in Schritt 1.1.13 oder Blitz Einfrieren in flüssigem Stickstoff, wie unter Punkt 2.3 beschrieben.
-
EPR-Messungen im Blut und BALF bei 77 K
- Folgen Sie das Protokoll oben, um Blut zu sammeln (Schritte 3.1.1. zu 3.1.4) und BALF (Schritte 3.2.1 bis 3.2.4).
- Platz 150 µL des behandelten Blut oder BALF in PTFE Schläuche (1-2 Zoll). Verwenden Sie einen Gummistopfen, schließen Sie ein Ende des PTFE Schläuche vor dem Hinzufügen der Probe und eine weitere Stopper um den Schlauch zu versiegeln.
- Flash-Einfrieren der Probe in flüssigem Stickstoff.
- Siehe Abschnitt 2.3 Einzelheiten zum Ausführen von EPR in gefrorenen Proben in PTFE-Schlauch mit dem Finger, den Dewar bei 77 K. Run Frozen CMH Blutproben mit in einer Woche behandelt.
(4) EPR-Messungen am Lungengewebe
-
Flash-gefrorene Lungengewebe
- Nach dem Sammeln der BALF in Schritt 3.2.1, die Truhe geöffnet und Lunge gespült mit 10 mL kaltem PBS über den rechten Ventrikel um Blut zu entfernen. Flash Einfrieren in flüssigem Stickstoff des Lungengewebes. Gefrorene Lungengewebe kann bis zu 6 Monate bis zur Verwendung für EPR-Messungen bei-80 ° C aufbewahrt werden.
- Stabilisieren Sie das Lungengewebe auf Trockeneis mit Pinzette und schneiden Sie mehrere kleine Stücke (5-15 mg) von Lungengewebe mit einer Single-Kante-Klinge.
- Wiegen Sie das Gewebe in einem 1,5 mL Röhrchen, legen Sie das Rohr auf die Waage und tarieren Sie die Waage dann fügen Sie die Gewebe-Stücke und nehmen Sie das Gewicht.
- Das Gewebe in der 1,5 mL Tube fügen Sie 196 µL der KHB mit DTPA und 4 µL CMH (0,2 mM) um 200 µL Gesamtvolumen zu erreichen hinzu.
- 1 h bei 37 ° C im Wasserbad inkubieren.
- Spin-down (für ein paar Sekunden) in einem Microcentrifuge 3.884 x g.
- Auf Eis legen und pipette 150 µL des Überstands in der PTFE-Schläuche und frieren für die 77 K-Messungen, wie in Abschnitt 2.3 beschrieben.
Hinweis: Für diese Methode, die Heterogenität der Verletzung muss berücksichtigt werden. Für Bleomycin-induzierte Lungenschädigung angesichts der Tatsache, dass es ein sehr heterogen Schädigung, empfiehlt es sich, mehrere Gewebe Stücke aus verschiedenen Teilen der Lunge aus jeder Maus zu schneiden. Alternativ kann ein größeres Stück des Gewebes im KHB Puffer mit 100 µM DTPA in einem 1:6-Gewicht-Volumen-Verhältnis (mg/µL), wie unten beschrieben homogenisiert werden.
-
Frische Lungengewebe in Saccharose Puffer erhalten
- Spülen Sie die lavaged Lungen mit kaltem PBS, Blut zu entfernen, wie in Schritt 3.1.2 getan.
- Die frischen Lungengewebe in Tris-EDTA Puffer mit 0,25 M Saccharose mit einem 1:6 Lunge/Puffer (mg/µL) Verhältnis mit Dounce-Gewebe-Schleifer mit einem Glas oder PTFE Stößel zu homogenisieren.
- KHB, enthält 100 µM DTPA 450 µL fügen Sie 50 µL der Lunge Homogenat hinzu.
- Fügen Sie in einem 1,5 mL Rohr (in einem Gesamtvolumen von 100 µL), 98 µL der Lunge Homogenat in KHB 2 µL CMH 10 mM Lager, eine Endkonzentration von 0,2 mM zu erhalten.
- 20 min 37 ° C im Wasserbad inkubieren.
- Legen Sie die Proben auf Eis und laden Sie sie in ein Kapillarröhrchen. Laufen Sie EPR bei RT (Einstellungen in Schritt 2.1.13 verwendet).
- Um den Beitrag der spezifischen Arten und Quellen mit verschiedenen Inhibitoren zu testen, behandeln Sie 88 µL der Lunge Homogenat + /-Inhibitor, Anpassung mit KHB zu einem Endvolumen von 98 µL zu erreichen vor. In diesem Experiment die Inhibitoren enthalten 10 µL der SOD (100 U/mL), 4 µL Deferoxamin (DFO; Endkonzentration = 800 µM), oder 4 µL Diphenyliodonium Chlorid (DIP; Endkonzentration = 100 µM). 20 min bei 37 ° C im Wasserbad inkubieren.
- Fügen Sie 2 µL CMH und inkubieren Sie für weitere 20 Minuten bei 37 ° C, gefolgt von EPR-Messungen, wie oben beschrieben. Beinhalten Sie eine einmalige abgestimmte leere Probe mit CMH KHB mit Saccharose-Puffer. Alternativ speichern Sie Aliquote der verbleibenden Lunge Homogenates (Schritt 3.1.2) bei-80 ° C für zukünftige Messungen.
Hinweis: Das Gesamtvolumen kann je nach Bedarf skaliert werden.
-
EPR-Messungen am Lungengewebe von Mäusen injiziert mit Spin Sonden in Vivo (bei RT mit Gewebe Zelle)
- Bereiten Sie CPH-Stammlösung durch Auflösen von 4,9 mg CPH in 1 mL der gefilterten und sauerstoffarmes 50 mM Phosphatpuffer vor.
- Mäuse mit inhalativen Isofluran (1.5-4 %) für 20-30 Sekunden, bis nicht mehr reagiert, bis zu den Zehen Prise zu betäuben. Mit 100 µL der CPH-Spin-Sonde für ein Körpergewicht von 25 g Maus Mäuse über Retroorbital Route zu injizieren (letzte Dosis = 20 mg/kg), und lassen Sie die Sonde zu zirkulieren für 1 h unmittelbar nach Retroorbital Injektion, geben Sie einen Tropfen von 0,5 % Proparacaine HCl, hinaus auf die Augenpartie NT Augenschmerzen und Trockenheit. Überwachen Sie Mäuse für 1 h zu und fahren Sie bis zur Ernte Gewebe.
- Das Lungengewebe zu ernten, wie oben beschrieben und Blitz Einfrieren der Lunge.
- Schneiden Sie 20-30 mg von tiefgefrorenem Gewebe auf Trockeneis und notieren Sie das exakte Gewicht.
- Wischen Sie das Gewebe mit Reinigungstücher, Oberflächenwasser zu absorbieren.
- Legen Sie das Gewebe innerhalb des Fensters der Gewebe Zelle (Zubehör erlaubt EPR-Messungen für Gewebeproben) und führen Sie EPR um insgesamt dreht zu bestimmen. Die Daten können als total Spins pro mg Gewebe ausgedrückt werden.
(5) Datenanalyse
- Die EPR-Spektren mit SpinFit Modul integriert in die Xenon-Software die Bankoberseite EMXnano EPR-Spektrometers zu simulieren. Bestimmen Sie die Nitroxid-Konzentration durch das SpinCount-Modul. Alternativ eine Kalibrierkurve des eine stabile Nitroxid wie 4-hydroxy-TEMPO oder TEMPOL erfolgen kann, und die Konzentration erhalten Sie durch den Vergleich der Intensität des Signals mit der Probe und Standard.
- Verwenden Sie für die bei 77 K gesammelten Daten doppelte Integration gefolgt von SpinCount.
Ergebnisse
Superoxid-Erkennung mit CMH validiert wurde, mit dem X / XO Superoxid generieren System nachweisen können, dass das Nitroxid (CM.) Signal voll von SOD, gehemmt wurde, während die Katalase keinen Effekt (Abbildung 1A hatte). Total, extrazelluläre Superoxid wurde dann im RAW 264,7 Zellen durch Inkubation der Zellen mit der Zelle durchlässig CMH-Spin-Sonde + / SOD Vorbehandlung bewertet. Die Nitroxid-Konzentration wurde gemessen, in der Zellsuspension und Puffer, die bewiesen, dass die Werte in den beiden Probe aufgrund der durchlässigen Natur und schnelle Gleichgewichtherstellung der Spin-Sonde (Abbildung 1 b) ähnelten. Mit PMA im Vergleich zu Kontrollzellen erhöht das Nitroxid-radikalen-Signal in RAW 264,7 Zellen stimuliert. Dieses Signal wurde in Zellen vorbehandelt mit Zelle undurchlässig SOD (Abbildung 1) deutlich abgeschwächt. Jede Farbe repräsentiert Brunnen getestet an verschiedenen Tagen demonstriert die Konsistenz der Daten, die an bestimmten Tagen und Reproduzierbarkeit der Ergebnisse über die Zeit. Die Konzentration der extrazellulären Superoxid wurde bestimmt durch Subtraktion des Signals im PMA Zellen vorbehandelt mit SOD aus dem Signal nach PMA in Ermangelung von SOD (T). Die restlichen Signal wurde intrazellulären Superoxid (Abbildung 1) zugeschrieben. Abbildung 1 zeigt die Berechnung des Gesamt- und extrazellulären Superoxid. (E) das intrazelluläre Signal wurde im PMA-behandelten Zellen nach Entfernung der Medien und durch die Wirkung von PEG-SOD auf das Signal bestätigt. In diesem Diagramm, im Gegensatz zu (C) der CMH-Blank wurde aus den Messungen nicht abgezogen und die raw-Daten werden angezeigt.
Mitochondrialen Superoxid in RAW 264,7 Zellen wurde mit dem EPR Spin Sonde Mito-TEMPO-H, die reichert sich in Mitochondia nachgewiesen. (A) Vertreter EPR Spektren für die Basislinie Mito-TEMPO-H-Signal im Puffer, der erhöhte Mito-TEMPO-H-Signal in Kontrollzellen (Con) und das weiter verbesserte Signal in den Zellen stimuliert mit dem mitochondrialen Inhibitor Antimycin A (AA). Der Anstieg des Signals wurde der mitochondrialen Superoxid, basierend auf unseren vorherigen Studie zeigt, dass SOD2-Überexpression deutlich abgeschwächte Messungen mit Mito-TEMPO-H10zugeschrieben. In Abbildung 2 bwar die mitochondriale Nitroxid-Konzentration durch Subtraktion der Mito-TEMPO-H-Signal in Zeit abgestimmt Puffer aus der Zelle-Messungen bestimmt. CM. Signal bei niedrigen Temperaturen in RAW 264,7 Zellen nach Stimulation mit PMA in an- und Abwesenheit von SOD erhalten. (Abbildung 3A) Das CM. -Signal wurde in Anwesenheit von SOD, konsistent mit den Daten der Raumtemperatur (Abbildung 1) abgeschwächt. Abbildung 3 b zeigt das Foto von PTFE-Schläuche mit den Stöpseln verwendet, um Daten bei 77 K für Zellen und in-Vivo -Proben sammeln. Superoxid-Produktion war im Blut und BALF mit der CMH-Spin-Sonde entdeckt. Blut-oder BALF wurden von PBS und Bleo-behandelten Mäusen gesammelt und sofort mit CMH inkubiert. Die Proben wurden zu PTFE-Schläuche und Blitz eingefroren und EPR-Daten wurden bei 77 K. Die Konzentration von Nitroxid (CM.) im Blut mit CMH (0,2 mM) bei 37 Grad für 10 min (Abb. 4A) inkubiert angesammelt. Nitroxid (CM.) Konzentration von BALF inkubiert für 50 min (Abbildung 4 b). Nitroxid Konzentration stellt die Konzentration von (CM.) im Volumen von Blut angesammelt oder BALF in das Experiment verwendet.
Drei Methoden wurden getestet, um verschiedene veröffentlichten Techniken zur Erhaltung der Gewebe zu bewerten und Verwaltung von Spin Sonden ex Vivo Vs. in-vivo. Um EPR-Messungen am Lungengewebe durchzuführen, wir zuerst verwendet Flash-gefrorene Lungengewebe von Kontrolle oder verletzte Mäuse. Abbildung 5A zeigt am Gesamtsignal CM. im Überstand von einem kleinen Stück des Lungengewebes bzw. bei 37 ° C mit CMH in PBS und Bleo-behandelten Mäusen inkubiert. Aufgrund der Heterogenität der Lungenschädigung nach Bleo Behandlung empfiehlt es sich, Zuschnitte aus verschiedenen Regionen der Lunge und im Durchschnitt mehrerer Messungen um einen repräsentativen Wert angeben. Alternativ kann die gesamte Lunge zu homogenisieren und verwenden Sie eine Probe von diesem Homogenat. Datenerhebung bei 77 K mit PTFE-Schläuche und finger Dewar. Abbildung 5 b zeigt repräsentative Spektren von Nitroxid (CM.) Signale von PBS und Bleo-behandelten Mäusen, beziehungsweise.
Eine Einschränkung zur Behandlung von Lungenkrebs Gewebe ex Vivo ist, dass es nicht möglich, zuverlässig extrazelluläre von intrazellulären Superoxid durch die Verarbeitung des Gewebes zu unterscheiden, die Zellmembranen stört. Wenn diese Informationen für die experimentelle Frage wichtig ist, können sie mithilfe der in Vivo CPH Instillation unten beschriebenen Methode angesprochen werden. Gefrorenes Gewebe kann nicht verwendet werden, um mitochondrialen Superoxid zu beurteilen; jedoch für diese Messung adaptierbar des Protokolls mit Mito-TEMPO-H in das Gewebe oder frisch isolierte Mitochondrien.
Als zweite Methode für EPR-Messungen im Lungengewebe war frisches Gewebe in Saccharose Puffer homogenisiert. Die Lunge-Homogenat wurde mit CMH-Sonde im KHB Puffer mit DTPA inkubiert. EPR-Messungen wurden an RT. Abbildung 6A zeigt die Zunahme der CM. mit Bleo. Präsentierten wir eine zusätzliche Tests mit verschiedenen Inhibitoren, die verwendet werden können, um die Arten zu bestimmen, die zu den CM. Signal. Um den Ursprung der CM. -Signal generiert aus Lungengewebe zu erhellen, vorbehandelt wir die Lunge Homogenates mit mehreren Radikalfänger und Enzyme-Hemmer. Lung Homogenates wurden mit CMH in Abwesenheit oder das Vorhandensein von SOD, Deferoxamin (DFO) und Diphenyliodonium Chlorid (DIP), (beziehungsweise) entfallen die Beiträge von Superoxid, Eisen oder Superoxid generiert aus Flavin-haltigen inkubiert. Enzyme (Abb. 6 b). Dieser Ansatz lässt sich die spezifische radikale Art erzeugt in einem System zu bewerten oder den Beitrag der anderen enzymatischen Quellen zu erhellen anpassen (zB., NOX, eNOS oder Xanthin-Oxidase).
Mäuse wurden mit CPH Spin Sonden (20 mg/kg) über die Retroorbital Route ausführen EPR Messungen in Vivoinjiziert. Es ist unbekannt, ob CMH sicher an Tiere verabreicht werden kann, während die CPH-Sonde berichtet wurde, nicht toxisch sein; So wählten wir CPH für die in-Vivo -Experimente. Lungengewebe wurden geerntet und flash in flüssigem Stickstoff 1 h nach Auflage von CPH Sonden eingefroren. Mäuse können mit speziellen Antioxidantien zu unterscheiden, die Spezies verantwortlich für das Signal gleichzeitig behandelt werden. Abbildung 7A zeigt die höhere CP. Signal in Bleo-behandelten Mäusen im Vergleich zu Kontroll-Mäusen. Repräsentative Spektren von Lungengewebe von Kontroll- und Bleo-behandelten Mäusen sind in Abbildung 7gezeigt. Eine gemischte EPR-Spektren von CP. und Ascorbinsäure radikale beobachtet wurde. Die Werte in Abbildung 7A berichtet sind die Konzentrationen von CP. Komponenten. Bei RT der Gewebe-Zelle mit Daten.
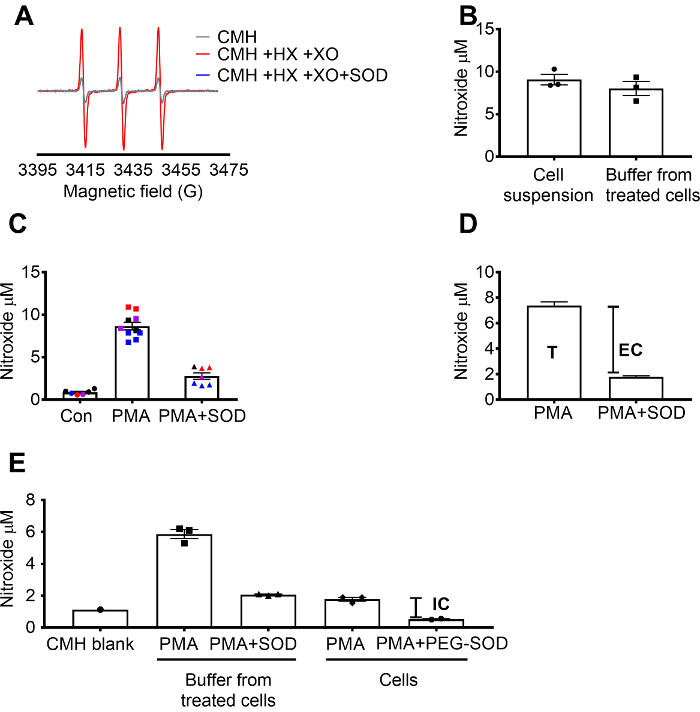
Abbildung 1: Erkennung von Superoxid in andere Zelle Abteilen. (A) EPR-Spektren von 0,25 mM CMH in 0,5 mM Hypoxanthin/Xanthin Oxidase (8 mU/mL) mit und ohne SOD generiert (30 U/mL). (B) RAW 264,7 Zellen (1 x 106 Zellen/Na) wurden mit 10 µM PMA in Anwesenheit von CMH für 50 min bei 37 ° C und Nitroxid-Konzentration (µM) in Zellsuspension (Zellen + Puffer) erkannt und Puffer gesammelt von behandelten Zellen stimuliert. (C) RAW 264,7 Zellen wurden mit PMA Vsstimuliert. Fahrzeugkontrolle (Con). Eine Gruppe von Zellen wurden für 10 min bei 30 U/mL Zelle undurchlässig SOD (PMA + SOD) vorbehandelt. Jede Farbe repräsentiert Daten von verschiedenen experimentellen Tagen und jeder Punkt repräsentiert Zellen von einer einzelnen Person gut. Das Nitroxid-Signal in eine leere Zeit abgestimmt mit CMH in KHB war subtrahiert jedes Signal um endgültige Werte zu erhalten. (D) Berechnung des Gesamt- und extrazellulären Superoxid in PMA stimulierte Zellen; T = total Superoxid, EG = extrazelluläre Superoxid (SOD inhibierbare Signal). (E) um den intrazellulären Superoxid-Signal (IC) zu bewerten, wurde das Signal im Puffer nach PMA + SOD nach dem Entfernen des Puffers mit PMA-behandelten Zellen verglichen. Um zu bestätigen, wurden Brunnen mit 60 U/mL Zelle durchlässig PEG-Spatenstich für 1,5 Stunden zu bestimmen, die intrazelluläre SOD inhibierbare vorbehandelt. Der Zeit abgestimmt CMH Blank gezeigt und Daten reflektieren absolute Nitroxid-Signal. Daten ausgedrückt als Mittelwert ± SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 2: Nachweis von mitochondrialen Superoxid in RAW Zellen stimuliert mit Antimycin A. (A) repräsentative Spektren der mitochondrialen-spezifische EPR Spin Sonde, 0,25 mM Mito-TEMPO-H in RAW 264,7 Zellen ohne (Con) oder mit 25 µM Antimycin A (AA) für 50 min. bei 37 ° C. (B) CM. Konzentration (µM) in Zellen behandelt mit AA im Vergleich zur Kontrolle. Das Nitroxid-Signal in einer Zeit abgestimmt Mito-TEMPO-H leer war vom Gesamtsignal Endwerte zu erhalten subtrahiert. Daten ausgedrückt als Mittelwert ± SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 3: Nachweis von Superoxid in RAW 264,7 Zellen bei 77K. (A) RAW 264,7 Zellen stimuliert mit 10 µM PMA und EPR-Spin-Sonde, CMH 0,25 mM (50 min bei 37 ° C) mit (schwarz) oder ohne (rot) Vorbehandlung mit 30 U/mL SOD. 100 µL des Überstandes wurde in einem 1-Zoll in Länge Stück PTFE Schlauch dann Blitz in flüssigem Stickstoff eingefroren geladen. Die Anschläge wurden entfernt, und gefrorenen PTFE-Schläuche in den Finger gelegt wurde Dewar zur Datenerfassung bei 77 K. (B) ein Foto von PTFE-Schläuche und stopfen. Bitte klicken Sie hier für eine größere Version dieser Figur.
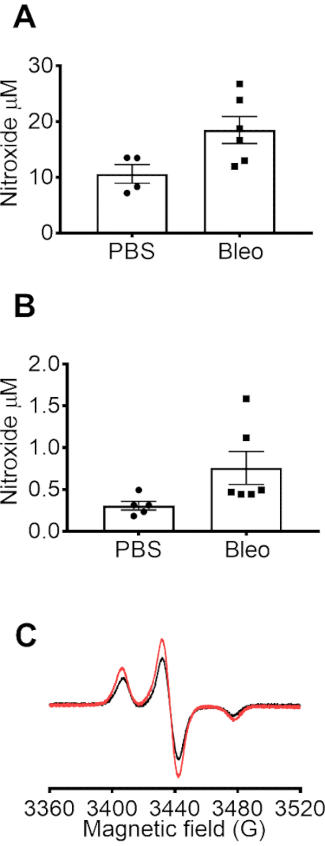
Abbildung 4: EPR-Messungen im Blut und BALF aus Kontrolle und Bleomycin behandelten Mäusen. Mäuse mit einer Einzeldosis von intratrachealen Bleomycin (IT Bleo) behandelt wurden (100 µL bei 1 U/mL) oder PBS Fahrzeug. 7 Tage wurden Mäuse betäubt und eingeschläfert. Blut wurde gesammelt über rechtsventrikuläre Punktion in eine Spritze mit 1000 beschichtet USP/mL Heparin mit 100 µM DTPA. Alvéolaire Lavage-Flüssigkeit (BALF) wurden durch Lavaging der Lunge mit 1 mL 100 µm DTPA in PBS. Blut und BALF wurden für 10 oder 50 min, bzw. mit 0,2 mM CMH bei 37 ° c inkubiert 150 µL Blut oder BALF wurde geladen in PTFE Schlauch Blitz Einfrieren in flüssigem Stickstoff und EPR-Daten, die bei 77 K mit einem Finger Dewar. Daten weisen Nitroxid-Konzentrationen im Blut (A) und (B) BALF von PBS und Bleo-behandelten Mäusen (n = 4-6). Daten zum Ausdruck gebracht als ± SEM. (C) Representative-Spektren von Nitroxid im Blut von PBS und Bleo-behandelten Mäusen bedeuten. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: EPR-Messungen im Flash-gefrorene Lungengewebe. Mäuse mit einer Einzeldosis von intratrachealen Bleomycin (IT Bleo) behandelt wurden (100 µL bei 1 U/mL) oder PBS Fahrzeug. 7 Tage waren mit kaltem PBS, Blut und Flash in flüssigem Stickstoff eingefroren zu entfernen die Lunge gespült. 5-15 mg Blitz eingefroren Lungengewebe war mit 0,2 mM CMH in KHB mit 100 µM in 200 µL Gesamtvolumen für 1 h bei 37° C. Überstand wurde gesammelt und in PTFE Schlauch inkubiert und laufen bei 77 K in den Finger Dewar. (A) Nitroxid-Konzentration (µM Nitroxid normiert auf 1 mg des Gewebes). Daten sind Mittelwerte von 2-3 Messungen für jede Lunge. Daten ausgedrückt als meine ± SEM (B) repräsentative Spektren von Nitroxid im Lungengewebe von PBS und Bleo-behandelten Mäusen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6: EPR-Messungen im Lungengewebe in Saccharose Puffer erhalten. Mäuse wurden mit einer Einzeldosis von intratrachealen Bleomycin (100 µL bei 1 U/mL) behandelt. 7 Tage nach der Behandlung der Lunge wurden gespült mit kaltem PBS, Blut zu entfernen und frische Lungengewebe war im Tris-EDTA Puffer mit 0,25 mM Saccharose im Verhältnis 1:6 Lunge Gewicht/Puffer Volumen (mg/µL) homogenisiert. 50 µL der Lunge Homogenat wurde mit KHB preincubated, mit oder ohne die folgenden Inhibitoren für 20 min bei 37 ° C: SOD (100 U/mL), Deferoxamin (DFO; 800 µM) und Diphenyliodonium Chlorid (DIP; 100 μM) gefolgt von Inkubation mit 0,2 mM CMH in KHB mit 100 µM DTPA für 20 min bei 37 ° C. Daten wurden bei RT ermittelt mit EPR Kapillarröhrchen. (A) Nitroxid Konzentration in Lungen von PBS und Bleo-behandelten Mäusen. (B) Nitroxid-Konzentration im Bleo Lungen in die Abwesenheit oder das Vorhandensein von Inhibitoren (n = 3). Daten ausgedrückt als Mittelwert ± SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 7: EPR-Messungen im Lungengewebe von Mäusen injiziert mit CPH Spin Sonde. 100 µL der CPH war verabreicht über Retroorbital Injektion für eine Endkonzentration von 20 mg der CPH pro kg Körpergewicht. Nach 1 h der Zirkulation Mäuse wurden eingeschläfert, Lunge wurden mit 10 mL kaltem PBS über den rechten Ventrikel gespült und Lungengewebe flash war gefroren. 20 bis 30 mg von Lungengewebe in Gewebe Zelle gelegt wurde und EPR-Messungen bei RT (A) Daten, ausgedrückt als Drehungen / mg (B) repräsentative Spektren von Nitroxid-signal in PBS und Bleo Lungengewebe (* zeigt die Überlappung mit Ascorbinsäure radikale). Daten ausgedrückt als Mittelwert ± SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.
| Inhibitoren | Arten |
| Superoxid-Dismutase (SOD) | Extrazelluläre Superoxid |
| Superoxid Dismutase-Polyethylenglykol (PEG-SOD) | Intrazelluläre Superoxid |
| Katalase | Wasserstoff-Peroxid Basis radikale |
| Urat | Peroxynitrate |
| Ethanol und DMSO | Hydroxyl-radikal |
| Metall Chelatoren | Metall-Ionen (Eisen und Kupfer) |
Tabelle 1. Gemeinsamen Inhibitoren verwendet, um Arten verantwortlich für Spin Sonde Oxidation zu unterscheiden.
Diskussion
Die Bewertung der Produktion freier Radikale in den biologischen Einstellungen ist wichtig im Verständnis Redox geregelt Signalisierung in Gesundheit und Krankheit, aber das Maß dieser Arten ist sehr schwierig wegen der kurzen Halbwertszeit von freien Radikalen Arten und technische Einschränkungen mit häufig verwendeten Methoden. EPR ist eine wertvolle und mächtige Werkzeug in der Redox-Biologie, wie es die einzige eindeutige Methode zur Erkennung von freien Radikalen. In diesem Projekt zeigen wir praktische EPR Methoden der Versuchsplanung und Probenvorbereitung, ROS mit Spin-Sonden in verschiedenen zellulären Kompartimenten in Vitro und verschiedene Gewebe Fächer zu erkennen in-vivo. Wir bieten auch praktische Methoden zum Behandeln von biologischer Proben und Proben zur Verbesserung der Effizienz zu speichern.
Spin-Sonden reagieren effizient mit ROS und erzeugen eine stabile Nitroxid-radikalen, die mit EPR erkannt werden können. Verschiedene Derivate des Prüfpunkts Spin (zyklische Hydroxylamin) wurden mit unterschiedlichen Durchlässigkeit Eigenschaften synthetisiert macht sie geeignet für die Produktion freier Radikale in verschiedenen zellulären Kompartimenten10zu erkennen. Dieses Protokoll verwendet die Zelle durchlässig Spin-Sonde, CMH; jedoch kann die undurchlässigen Spin Sonde 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium Chlorid HCl (CAT1H) zur extrazellulären Superoxid eingesetzt. Ähnlich wie bei unserer vorherigen Studie im menschlichen Lymphoblast Zelle Linien18, konnten wir validieren Verwendung der durchlässigen CMH Spin Sonde mit undurchlässigen SOD und Handy durchlässiges PEG-SOD in RAW264.7 Zellen (eine Maus Lunge Makrophagen Zelllinie) stimuliert mit PMA unterscheiden Sie zwischen extrazellulären und intrazellulären Superoxid.
Wir überprüft auch die schnelle Gleichgewichtherstellung CMH zwischen Intra und extra zellulare Fächer, und wir fanden auch, dass das Superoxid-Signal in Tropfen deutlich nach dem Waschen der Zellen nur einmal mit KHB (Daten nicht gezeigt) Zellen. Wir bestätigt nutzen die mitochondriale bestimmten Spin Sonde Mito-TEMPO-H in RAW 264,7 Zellen, um die erhöhten mitochondrialen Superoxid generiert nach Stimulation mit mitochondrialen Elektronentransport-Kette Inhibitor Antimycin A. Messen Der spezifische Beitrag der mitochondrialen Superoxid Produktion auf die Mito-TEMPO-H zuvor nachgewiesen und in Experimenten mit isolierten frische Mitochondrien oder Systeme mit mitochondrialen Superoxid-Dismutase MnSOD (SOD2) überprüft werden können Überexpression10.
Die Beurteilung der ROS Produktion in Vivo ist besonders anspruchsvoll, aber die Fähigkeit zur Produktion von spezifischen ROS Erkennung finden Sie wichtige Informationen bei Verhören die Rolle des oxidativen Stress oder Redox geregelt in biologisches Signalisierung Einstellungen. Der angemessene Umgang mit Gewebe beim Dreh mit Sonden und EPR ist unerlässlich, um reproduzierbare und aussagekräftige Ergebnisse zu generieren. Die Verwendung von Spin Sonden mit Gewebe wird nicht wahrscheinlich Maßnahme Superoxid Radikale präsentieren zum Zeitpunkt der Ernte Gewebe durch eine kurze Halbwertszeit, aber stattdessen erkennt es Superoxid produziert durch Enzyme wie NAPDH Oxidase, abgekoppelt endotheliale Stickstoffmonoxid-synthase , oder Xanthin-Oxidase wenn Lungengewebe oder Homogenates mit der Spin-Sonde bei 37 ° c inkubiert werden Die Verwendung von tiefgefrorenem Gewebe enthalten keine Superoxid durch Mitochondrien, da Einfrieren Schäden mitochondriale Elektronentransport-Kette Tätigkeit erzeugt. Um mitochondrialen Superoxid zu testen, müssen Forscher isolieren frische Mitochondrien oder Verwendung mitochondriale spezifische Sonden in Vivo oder in frischem Gewebe.
Mehrere verschiedene Protokolle, Gewebe zu bewahren wurden in der Literatur14,15veröffentlicht. Wir haben drei veröffentlichte Methoden für EPR-Messungen im Lungengewebe verglichen: (1) Blitz Gewebe beim Einfrieren in flüssigem Stickstoff, 2) Gewebe in Saccharose Puffer homogenisieren und (3) Behandlung von Mäusen in Vivo mit einem Spin Sonde 1 Stunde vor der Ernte Gewebe. Wir verglichen Kontroll-Mäusen Mäusen mit schweren Entzündungen und oxidativen Stress induziert durch Bleomycin testen Sie jede Methode Fähigkeit, durchgängigen Unterschiede in Nitroxid Signale in geschädigten Lungen zu zeigen. Alle drei Methoden zeigten einen ähnlichen relativen Anstieg Nitroxid-Signal in den Lungen von Bleomycin behandelten Mäusen. Die Verwendung von Flash-gefrorenes Gewebe wäre wahrscheinlich der einfachste Ansatz, Gewebe für die meisten Labore, negiert die Notwendigkeit Gewebe in der Saccharose-Puffer zum Zeitpunkt der Ernte verarbeiten zu sammeln. Die Injektion von CPH, freie Radikale in Vivo zu erfassen ist mächtig, aber um die spezifischen Arten zu bestätigen, dies erfordert eine Behandlungsgruppe einschließlich der entsprechenden Antioxidans.
Eine Herausforderung mit Spin Sonden ist, dass die Oxidation von Spin Sonden Nitroxid ein ähnliches dreizeilige EPR Spektrum unabhängig von der Spezies für die Oxidation verantwortlich erzeugt; so unterscheidet er nicht zwischen verschiedenen Arten von ROS. Darüber hinaus wurde berichtet, dass es mögliche Reaktionen von Hydroxylamin-Sonden mit photosynthetischen Elektronentransport-Kette und Cytochrom C Oxidase19,20 gibt. Diese Beobachtungen sollten bei der Interpretation der Ergebnisse berücksichtigt werden. In diesem Protokoll die photosynthetische System ist nicht vorhanden und die Einbeziehung von DTPA mit dem Puffer verhindert mögliche Verschmutzung von freien ferric und geladene Ionen10 . Wir gezeigt, wie man eine Reihe von spezifischen Enzymen oder Chelatoren im Lungengewebe zu verwenden, um den Beitrag der besonderen ROS oder Enzyminhibitoren, die Quelle von ROS bestimmen herzustellen. Dieser Ansatz wurde zuvor mit EPR verwendet, um den Beitrag der ROS aufgrund abgekoppelt eNOS13,15bestimmen. Wir stellen eine Liste der gemeinsamen Inhibitoren verwendet, um Arten verantwortlich für Spin Sonde Oxidation (Tabelle 1) zu unterscheiden.
Wir zeigten auch die Bedeutung der Optimierung der Inkubationszeit für jede experimentelle Bedingung. Beim Vergleich von Spin-Sonden fallen drehen, erzeugen Spin Traps einzigartige Spektren je nach Edukt die Spezifität der radikalische Spezies ermöglicht; jedoch auch zeigen langsame Kinetik für Superoxid drehen auffangen und sind anfällig für biologischen Abbau. Die Behandlung von Lungengewebe mit dem EPR Sonde ex Vivo wird auch durch die Unfähigkeit, angemessen extrazelluläre von intrazellulären Superoxid durch die Unterbrechung der Zellmembranen während der Verarbeitung des Gewebes unterscheiden begrenzt (Einfrieren oder Homogenisieren). Verwendung des injizierten Spin Sonde in Vivo in Verbindung mit SOD oder Zelle durchlässig PEG-SOD kann dieses Problem zu beheben.
Ein Ziel war, ein Protokoll zur effizienten Proben sammeln und aufbewahren bei-80 ° C vor dem EPR-Messungen zu etablieren. Wir entwickelten daher eine praktische Methode um PTFE Schläuche zu verwenden, für die Abhaltung der Proben. Dieser Schlauch wird direkt in den Finger gelegt Dewar für EPR-Analyse bei 77 K ohne die Notwendigkeit, die Dewar zwischen Proben zu reinigen. Dies ist eine Alternative zu der kürzlich veröffentlichte Methode, die das Einfrieren der Proben in 1 mL Spritzen. Die Messungen in gefrorenen Proben gespeichert in PTFE Schlauch können über mehrere Tage, um die Stabilität des Signals zeigen wiederholt werden. Dieser Ansatz ermöglicht eine Batchverarbeitung die EPR-Messungen und erleichtert die Übertragung der Proben zwischen Labors, damit ein remote EPR-Standort Proben ausgeführt werden kann.
Insgesamt bieten diese Protokolle ein einfaches Verfahren zur Vorbereitung von Zellen und Geweben für EPR-Messungen in biologischen Systemen. Die Protokolle können auf andere Modelle mit oxidativen Stress verbunden und mit der Verwendung von anderen Spin-Sonden angepasst werden. Das Timing und die Konzentration der Spin-Sonde werden für jede experimentelle Bedingung angepasst werden müssen. Die Fähigkeit des EPR, eindeutig festzustellen, das Vorhandensein und die Produktion von freien Radikalen Spezies bietet strenge experimentelle Ansätze im Bereich der Redox-Biologie.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde von der University of Colorado School of Medicine Dean strategische Forschungsinfrastruktur Award, R01 HL086680-09 und 1R35HL139726-01, zu eng und UCD CFReT Fellowship Award (er) unterstützt. Die Autoren danken Dr. Sandra Eaton und Dr. Gareth Eaton (University of Denver), Dr. Gerald Rosen und Dr. Joseph P. Kao (University of Maryland), und Dr. Sujatha Venkataraman (University of Colorado Denver) für hilfreiche Diskussionen und Joanne Maltzahn, Ashley Trumpie und Ivy McDermott (University of Colorado Denver) für den technischen Support.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID | NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
Referenzen
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten