Method Article
Vorbereitung und
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Herstellung und Charakterisierung eines dendrimeren Magnetresonanztomographie (MRI), die Kontrastmittel trägt cyclen basierenden makrocyclischen Chelate paramagnetischen Ionen Gadolinium- koordinieren. In einer Reihe von MRI - Experimente in vitro produzierte dieses Mittel ein verstärktes MRI - Signal , wenn an dem handelsüblichen monomeren Analogon verglichen.
Zusammenfassung
Paramagnetische Komplexe von Gadolinium (III) mit acyclischen oder makrocyclischen Chelate sind die am häufigsten verwendeten Kontrastmittel (CAs) für die Magnetresonanztomographie (MRI). Ihr Zweck ist es, die Relaxationsrate von Wasserprotonen in Gewebe zu verbessern, wodurch die MR Bildkontrast und die Spezifität der MRI-Messungen. Strom klinisch zugelassenen Kontrastmittel sind niedermolekulare Moleküle, die vom Körper rasch gelöscht werden. Die Verwendung von Dendrimere als Träger von paramagnetischem Chelatoren kann eine wichtige Rolle bei der zukünftigen Entwicklung von effizienteren MRI-Kontrastmittel spielen. Insbesondere die Erhöhung der lokalen Konzentration der paramagnetischen Spezies führt zu einem höheren Signalkontrast. Darüber hinaus liefert diese CA eine längere Geweberetentionszeit aufgrund seines hohen Molekulargewicht und -größe. Hier zeigen wir, ein praktikables Verfahren zur Herstellung von hochmolekularen MRI-Kontrastmittel auf Basis von Poly (amidoamin) (PAMAM) Dendrimere mit monomacrozyklischen DOTA-Typ Chelatoren (DOTA - 1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraacetate). Die chelatbildende Einheit wurde durch Ausnutzen der Reaktivität des Isothiocyanat (NCS) Gruppe in Richtung der Aminoberflächengruppen des PAMAM Dendrimer beigefügten Thioharnstoff Brücken zu bilden. Dendrimeren Produkte wurden mittels Kernresonanzspektroskopie, Massenspektrometrie gereinigt und analysiert, und die Elementaranalyse. Schließlich wurden hochaufgelöste MR-Bilder aufgenommen und die Signal Kontraste aus dem vorbereiteten dendrimeren und den im Handel erhältlichen monomeren Mittel verglichen wurden erhalten.
Einleitung
Die Magnetresonanztomographie (MRT) ist ein leistungsfähiges und nichtionisierende Bildgebungstechnik weit verbreitet in der biomedizinischen Forschung und der klinischen Diagnostik aufgrund seiner nicht-invasiven Natur und ausgezeichnete Eigenweichteilkontrast. Die am häufigsten verwendeten MRI Verfahren verwenden das Signal von Wasserprotonen erhalten wird, Bilder mit hoher Auflösung und die Bereitstellung detaillierter Informationen innerhalb der von Unterschieden in der Dichte der Wassersignale basierend Geweben. Die Signalintensität und die Spezifität der MRI-Experimente weiter verbessert werden kann unter Verwendung von Kontrastmitteln (CAs). Diese sind paramagnetische oder super Spezies , die die longitudinale (T 1) und Querrichtung (T 2) Relaxationszeiten beeinflussen bzw. 1,2.
Komplexe der Lanthanid - Ion Gadolinium mit Polyaminogruppen Polycarbonsäure Liganden sind die am häufigsten verwendeten T 1 CAs. Gadolinium (III) verkürzt die T 1 EntspannungsZeit von Wasserprotonen zu erhöhen, so dass die Signalkontrast in der MRT - Experimente 3. Jedoch ionische Gadolinium ist giftig; dessen Größe etwa derjenigen von Calcium (II), und es wirkt sich stark Calcium-assisted in Zellen signalisieren. Daher Chelate azyklisch und makrocyclischen werden verwendet, um diese Toxizität zu neutralisieren. Verschiedene mehrzähnigen Liganden wurden bisher 1, was zu Gadolinium (III) -Komplexe mit hoher thermodynamischer Stabilität und kinetische Inertheit entwickelt. Diejenigen, auf der Basis der 12-glied azamacrocycle cyclen, insbesondere seine Tetra Derivat DOTA (1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraacetate) sind die am besten untersuchten und angewandte Komplexe dieser CA-Klasse.
Dennoch GdDOTA-Typ CAs sind niedermolekulare Systeme und zeigt gewisse Nachteile wie geringe Kontrast Effizienz und schnelle renale Ausscheidung. Makromolekulare und mehrwertige CAs kann eine gute Lösung für diese Probleme 4 sein. Da CA biodistribution wird vor allem durch ihre Größe bestimmt, hochmolekularen CAs Anzeige viel längere Retentionszeiten innerhalb von Geweben. Ebenso wichtig ist , die Multivalenz dieser Mittel führt zu einer erhöhten lokalen Konzentration des monomeren MR - Sonde (beispielsweise GdDOTA complex), im wesentlichen den erfassten MR - Signals und die Messqualität zu verbessern.
Dendrimere sind unter den am meisten bevorzugten Gerüste für die Herstellung von mehrwertigen CAs für MRI 4,5. Diese hochverzweigten Makromoleküle mit definierter Größen sind anfällig für verschiedene Kopplungsreaktionen auf ihrer Oberfläche. In dieser Arbeit berichten wir über die Herstellung, Reinigung und Charakterisierung eines dendrimeren CA für die MRT, bestehend aus einer Generation 4 (G4) Poly (Amidoamin) (PAMAM) Dendrimer gekoppelt GdDOTA artigen Chelate (DCA). Wir beschreiben die Synthese des reaktiven DOTA-Derivat und dessen Kopplung an das PAMAM-Dendrimer. Folge der Komplexbildung mit Gd (III), die Standard-physikochemische Charakterisierung procedure von DCA durchgeführt wurde. Schließlich wurden MRI-Experimente ausgeführt, um die Fähigkeit von DCA zu erzeugen MR-Bilder mit einem stärkeren Kontrast als die von niedermolekularen CAs erhalten zu demonstrieren.
Protokoll
1. Herstellung von DCA
- Synthese der monomeren Einheit 4 6.
- Synthese von 4- (4-nitrophenyl) -2- (4,7,10-tris- tert - butoxycarbonylmethyl-1,4,7,10-tetraazacyclododec-1-yl) buttersäure - tert-butylester (2).
- Auflösen (4,7-bis- tert - butoxycarbonylmethyl-1,4,7,10-tetraaza-cyclododec-1-yl) -essigsäure-tert-butylester 1 (1,00 g, 1,94 mmol) in N, N - Dimethylformamid ( DMF, 5 ml), Kaliumcarbonat (0,67 g, 4,86 mmol, 2,5 equiv.) und rühren der Mischung bei Raumtemperatur für 45 min hinzu.
HINWEIS: Der Makrocyclus 1 wurde aus cyclen hergestellt und tert-Butylbromacetat gemäß dem zuvor veröffentlichten Verfahren 7. - Hinzufügen , tert - Butyl-2-brom-4- (4-nitrophenyl) butanoat (0,87 g, 2,53 mmol, 1,3 Äquiv.) Portionsweise über 1 Std. Weiter die Mischung unter Rühren ter denselben Reaktionsbedingungen für die folgenden 18 Stunden.
Hinweis: tert - Butyl-2-brom-4- (4-nitrophenyl) butanoat wurde aus 4- (4-nitrophenyl) -buttersäure, Thionylchlorid und Brom nach dem zuvor veröffentlichten Verfahren 8. - Entfernen DMF mittels bulb-to-bulb Vakuumdestillation bei 40-60 ° C 9.
- Reinige den Rückstand durch Säulenchromatographie (Kieselgel, 7% Methanol / Dichlormethan) Produkt 2 als brauner amorpher Feststoff (1,09 g, 72%) zu erhalten 10.
- Auflösen (4,7-bis- tert - butoxycarbonylmethyl-1,4,7,10-tetraaza-cyclododec-1-yl) -essigsäure-tert-butylester 1 (1,00 g, 1,94 mmol) in N, N - Dimethylformamid ( DMF, 5 ml), Kaliumcarbonat (0,67 g, 4,86 mmol, 2,5 equiv.) und rühren der Mischung bei Raumtemperatur für 45 min hinzu.
- Synthese von 4- (4-aminophenyl) -2- (4,7,10-tris- tert - butoxycarbonylmethyl-1,4,7,10-tetraazacyclododec-1-yl) buttersäure - tert-butylester (3).
- Man löst das Nitrobenzolderivat 2 (1,00 g, 1,28 mmol) in Ethanol (10 ml) und 7 N Ammoniak - Lösung in Methanol (150 ul). Hinzufügen, Palladium auf Aktivkohle als Katalysator (Pd / C, 150 mg, 15 wt%) mit dem solutiauf.
- Schütteln die heterogene Mischung 16 h unter Wasserstoffatmosphäre (2,5 bar) in der Parr-Hydriervorrichtung Vorrichtung.
- Bereiten einen Kuchen aus Diatomeenerde, indem sie in Ethanol suspendiert und Filtrieren der Suspension durch einen gesinterten Glastrichter. Gießen Sie die Suspension von 1.1.2.2 über den vorbereiteten Kuchen des Pd / C-Katalysator durch Filtration zu entfernen.
- Entfernen des Lösungsmittels durch schonende Destillation am Rotationsverdampfer (Wasserbadtemperatur ~ 40 ° C) Verbindung 3 als brauner amorpher Feststoff (0,91 g, 95%) zu erhalten.
- Synthese von 4- (4-isothiocyanatophenyl) -2- (4,7,10-tris- tert - butoxycarbonylmethyl-1,4,7,10 tetraazacyclododec-1-yl) buttersäure - tert-butylester (4).
- Hinzufügen Thiophosgen (0,124 ml, 1,58 mmol, 1,3 equiv.) Zu einer Mischung von 3 (0,91 g, 1,22 mmol) und Triethylamin (0,685 ml, 4,87 mmol, 4 Äquiv.) In Dichlormethan (15 ml).
- Kräftig rühren die Reaktions mixture mit einem Magnetrührer bei Raumtemperatur für 16 Stunden.
- Entfernen des Lösungsmittels durch schonende Destillation am Rotationsverdampfer (Wasserbadtemperatur ~ 40 ° C) und reinigt dann das Rohprodukt durch Säulenchromatographie (Kieselgel, 5% Methanol / Dichlormethan) , um das Produkt 4 als hellbraunen amorphen Feststoff zu erhalten (0,51 g, 53%).
- Synthese von 4- (4-nitrophenyl) -2- (4,7,10-tris- tert - butoxycarbonylmethyl-1,4,7,10-tetraazacyclododec-1-yl) buttersäure - tert-butylester (2).
- Synthese des Dendrimers DCA.
- Synthese des Dendrimers 5.
- Nehmen G4-PAMAM-Dendrimer (667 mg, 10% Dendrimer-Lösung in Methanol, 4,67 umol), verdampfe das Methanol durch schonende Destillation am Rotationsverdampfer (Wasserbadtemperatur ~ 40 ° C) und löst den Rückstand in DMF (4 ml) .
- Hinzufügen Triethylamin (0,105 ml, 0,75 mmol, 160 equiv.), Unter Rühren für 45 min bei 60 ° C, und fügen Isothiocyanat 4 (354 mg, 0,45 mmol, 1,5 equiv. , Bezogen auf die Amino - Oberflächengruppen des Dendrimers) portionen Over 1 Std.
- Rühre das Reaktionsgemisch mit einem Magnetrührer bei 45 ° C für 48 Stunden.
- Entfernen des Lösungsmittels mittels bulb-to-bulb Vakuumdestillation bei 40-60 ° C.
- Reinige den Rückstand durch Grßenausschlußchromatographie einen lipophilen Gelfiltrationsmedium und Methanol als Elutionsmittel verwendet wird. Um die Spalte packen, schwellen die Filtrationsmedien in Methanol für mindestens 3 Stunden bei Raumtemperatur (> 4 ml Methanol pro 1 g Pulver), ohne Druck auszuüben. Führen Schwerkrafttrennung durch das Sammeln von 1-ml-Fraktionen.
- Analysieren Sie die gesammelten Fraktionen mit Dünnschichtchromatographie (TLC). Entwickeln Sie die DC-Platte in 15% Methanol / Dichlormethan (nur die meisten polaren Fleck auf der Basislinie befindet sich von dendrimeren Produkt abgeleitet). Man dampft die gesammelten Fraktionen , die durch schonende Destillation auf einem Rotationsverdampfer (Wasserbad Temperatur ~ 40 ° C) zur Produkt 5 (270 mg, 91%) zu erhalten.
- Synthese des Dendrimers 6.
- Man löst den geschützten dendrimeren Chelator 5 (270 mg, 4,23 umol) in Ameisensäure (5 ml) und rührt die Mischung bei 60 ° C für 24 Std.
- Dampfe das Ameisensäure durch Destillation auf einem Rotationsverdampfer (~ 15 mbar Druck, Wasserbadtemperatur ~ 40 ° C) und Gefriertrocknungs das Produkt erhalten wurde 6 (Druck ~ 0,2 mbar) 9.
- Die Synthese des dendrimeren Kontrastmittel (DCA)
- Man löst den dendrimeren Chelator 6 (4,35 & mgr; mol) in Wasser und den pH - Wert auf 7,0 mit 0,1 M Natriumhydroxid.
- Löse GdCl 3 · 6 H 2 O (113 mg, 304 & mgr; mol) in Wasser (1 ml) und fügen Sie die Lösung von Chelator 6 über einen Zeitraum von 4 Stunden zugetropft; Aufrechterhaltung des pH-Wertes auf 7,0 mit wässriger Natriumhydroxidlösung (0,05 M) von pH-Wert mit einem pH-Meter gemessen wird.
- Rühren Sie die Mischung mit einem Magnetrührer bei Raum temperatur für 24 Stunden.
- Hinzufügen, Ethylendiamintetraessigsäure (EDTA, 158 mg, 426 umol) der Lösung portionsweise über 4 Stunden den Überschuß an Gd (III) zu entfernen, während der pH auf 7,0 mit wässriger Natriumhydroxidlösung aufrechterhalten (0,05 M). Rühren Sie die Mischung bei Raumtemperatur für 24 Std.
- Führen Grßenausschlußchromatographie die Mehrheit der GdEDTA und den Überschuß an EDTA zu entfernen. Verwenden Sie ein hydrophiles Gel Filtrationsmedium in Wasser gequollen um die Säule zu packen. Reduzieren Sie die Mischung auf ein geeignetes Volumen und die Säule geladen. Eluieren der Säule mit VE-Wasser ohne Druck auszuüben.
- Zentrifugieren Sie die Probe mit einem 3 kDa Zentrifugalfiltereinheit 30 min bei Zentrifugalkraft 1800 xg die Reste von GdEDTA und EDTA zu entfernen. Wiederholen Sie diesen Schritt (rund fünf Mal), bis das Filtrat, das das Fehlen von EDTA und GdEDTA zeigt. Übertragen Sie die Probe in einen Kolben, verdampfen, und dann gefriertrocknen das Lösungsmittel ein weißliches Produkt als letzte DCA (186 mg, 71% zu erhalten).
HINWEIS: Überprüfen Sie Abwesenheit von EDTA und GdEDTA durch ESI-MS. - Bestätigen Sie die Abwesenheit von Gd (III) als freies Ion der Xylenolorangelösung Test. Man löst das Filtrat (0,5 ml) in einem Acetatpuffer-Lösung (pH 5,8). Fügen Sie ein paar Tropfen einer Xylenolorangelösung Lösung und verfolgen die Farbänderung (gelb oder violette Farbe zeigt die Abwesenheit oder Anwesenheit von freiem Gd (III) -Ionen in Lösung, jeweils) 11.
- Synthese des Dendrimers 5.
2. In - vitro - Charakterisierung der Dendrimere Produkte
- Abschätzung der Anzahl von makrocyclischen DOTA-units mit dem PAMAM - Dendrimer (Beladung des Dendrimers mit DOTA-Makrocyclen wie)
- Schätzung mit 1 H NMR (NMR - kernmagnetische Resonanzspektroskopie).
Hinweis: Dieses Verfahren ist möglich , auf Dendrimere 5 und 6, aber nicht auf DCA.- Notieren Sie die 1 H - NMR - Spektrum 12.
- Integrieren der aromatischen Region und die beiden getrennten aliphatischen Bereiche (1 Signale des aliphatischen Dendrimer und makrocyclischen Protonen, 2. Signale der t - Bu - Gruppen) oder eine aliphatische Region für Dendrimere 5 bzw. 6.
Hinweis: Es gibt kein separates Signal in der aliphatischen Region von den t - Bu - Gruppen in Dendrimer 6 entstanden , da sie hydrolysiert worden sind. - Verwenden Sie Gl. 1 oder Gl. 2 die Anzahl der makrocyclischen Einheiten (n) zu schätzen, wobei R das Verhältnis der Integrale = (aliphatisch / aromatisch in Eq. 1 oder aliphatisch-Dendrimer / aliphatisch- t- Bu in Gl. 2), H = dende die Anzahl der Protonen in Dendrimer, = H Ar die Anzahl an aromatischen Protonen, H t Bu die Anzahl der Protonen in t - Bu - Gruppen und H mac = die Anzahl der Protonen in einem Makrocyclus =.
Hinweis: Entweder Gl. 1 oder Gl. 2 kann fo verwendet werdenr Dendrimer 5, während nur Gl. 1 kann für Dendrimer 6 verwendet werden. Da austauschbare Protonen (auf Amine, Amide, Thioharnstoffen oder Carboxylate) sind typischerweise mit Deuterium ersetzt sind, wurden sie in den Berechnungen nicht übernommen. Hier H dende = 1,128 (5) oder 1000 (6), H Ar = 4 und H mac = 27 verwendet wurden. (1)
(1)  (2)
(2)
- Schätzung aus der Elementaranalyse, indem das Verhältnis von Stickstoff zu Schwefel verwendet wird.
- Führen Sie die Elementaranalyse auf der festen dendrimeren Probe (DCA in dieser Arbeit).
- Verwenden Sie Gl. 3 die Anzahl an makrocyclischen Einheiten (n) zu schätzen, wobei R das Verhältnis der ermittelten% N und% S, N oder S dende dende = = die Anzahl derStickstoff- oder Schwefelatome in dem Dendrimer und N mac oder S mac = die Anzahl von Stickstoff- oder Schwefelatome in einem makrocyclischen Einheit.
Anmerkung: Der Faktor 2,29 wird aus dem Verhältnis in Atommassen von Schwefel und Stickstoff erhalten. In dieser Arbeit, N dend = 250, S dend = 2, N mac = 5 und S mac = 1 verwendet wurden. (3)
(3)
- Schätzung mit matrixunterstützter Laser-Desorptions / Ionisations-Flugzeit (MALDI-TOF).
- Führen Sie die MALDI-TOF - MS - Analyse 13.
- Berechnen der Anzahl von makrocyclischen Einheiten (n) nach Gl. 4, wobei M z = die beobachtete Masse (m / z), z = die Ladung der Spezies, M dende = die Masse des dendrimeren seits und M mac die Masse eines makrocyclischen Einheit =.
NEINTE: M dend = 14.306 und M mac = 719 wurden in dieser Arbeit verwendet.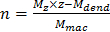 (4)
(4)
- Schätzung mit 1 H NMR (NMR - kernmagnetische Resonanzspektroskopie).
- Bestimmung der DCA - Konzentration ([DCA]): Bulk magnetische Suszeptibilität Messung (BMS)
- Auflösen DCA (5-10 mg) in Wasser (360 ul) in einem Kunststoffröhrchen Rohr ([DCA] ~ 5-10 mM).
HINWEIS: [DCA] sollte im Bereich von 5 bis 10 mM sein , um eine mögliche Überlappung von t- BuOH Resonanzen bei Probenkonzentrationen> 15 mm, wobei die Resonanz von Wasser bei δ = 4,7 ppm. - Werden 60 & mgr; l D 2 O: t- BuOH - Mischung (2: 1 v / v) zu der wässrigen Lösung von DCA und Mischen der erhaltenen Lösung (420 & mgr; l) mit einem Vortex - Mischer.
- Transfer 400 ul der Probe in eine äußere Röhre NMR und legen eine koaxiale NMR Einsatzrohr mit einer t- BuOH: H 2 O - Gemisch (10:90 v / v) in das Probenröhrchen.
- Aufzeichnendas 1 H - NMR - Spektrum und Messen der Frequenzverschiebung zwischen Signalen Resonanz t- BuOH in den inneren und äußeren Röhren NMR (Referenz) 12 abzuleiten.
- Verwenden Sie Gl. 5 die [DCA] zu bestimmen, wobei T die absolute Temperatur =, = Δχ die aufgezeichnete Verschiebung, & mgr; eff = die effektive magnetische Moment für ein Lanthanidenion (μ eff = 7,94 für Gd (III) 14 und s = eine abhängige Konstante von der Form der Probe und ihre Position im Magnetfeld (0, 1/3 und 1/6 in dem Fall einer Kugel, eines Zylinders parallel und Zylinder senkrecht zu dem Magnetfeld, respectively).
HINWEIS: Der berechnete Wert für die [DCA] erhalten sollte aufgrund der Zugabe des D 2 O auf die ursprüngliche Konzentration korrigiert werden: t- BuOH - Lösung (60 ul).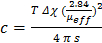 (5)
(5)
- Auflösen DCA (5-10 mg) in Wasser (360 ul) in einem Kunststoffröhrchen Rohr ([DCA] ~ 5-10 mM).
- Dynamisches LichtStreuung (DLS) Messungen.
- Bereiten Sie eine gefilterte DCA-Lösung (0,2 & mgr; m Polytetrafluorethylen / PTFE-Filter, 0,75 mM pro Gd (III)) in 4- (2-Hydroxyethyl) -1-piperazinethansulfonsäure (HEPES) Puffer (25 mM, pH 7,4) und gibt sie in eine Küvette für die DLS-Messung.
- Setzen Sie die Küvette in die DLS Gerät und stellen Sie die folgenden Parameter: 5 Wiederholungen von 15 Scans (1 scan = 12 sec, Brechungsindex = 1,345, Absorption = 1%) ohne Verzögerungen zwischen den Scans und mit Temperaturausgleich 30 Sekunden vor der Aufnahme .
- Exportieren Sie die erfassten Daten und erhalten die Größenverteilung Histogramm Bevölkerung durch Auftragen (%) in Abhängigkeit von der Größe (hydrodynamischen Durchmesser).
- Messung der longitudinalen und transversalen Relaxivitäten.
HINWEIS: Ein ähnliches Verfahren wurde bereits beschrieben die Relaxationszeit Analysator 15 verwendet wird ; Dieses Verfahren wurde unter Verwendung eines 300 MHz NMR-Spektrometer mit Topspin durchgeführtSoftware.- Einen Satz von DCA - Lösungen in H 2 O: D 2 O (500 & mgr; l, 10% D 2 O in H 2 O, [DCA] = 2,0, 2,5, 3,0, 3,5, 4,0, 4,5 und 5,0 mM [HEPES ] = 25 mM) von der DCA Lager Probe (Abschnitt 2.2) zu sehen.
- Übertragen Sie 450 ul Lösung in einem NMR-Röhrchen und legen Sie sie in das Gerät.
- Optimieren Sie die Aufnahmeparameter (90 ° Anregungspulsdauer (p1) und Bestrahlung Frequenz - Offset (O 1)) und dann die T 1 und T 2 Experimente durchführen unter Verwendung der Inversion - Recovery (IR) und Car-Purcell-Meiboom-Gill (CPMG ) Pulssequenzen, respectively.
- Bestimmung von T 1 und T 2 Relaxationszeiten.
- Wählen Sie die aufgezeichneten Mess, Prozess das 2D-Spektrum in der F2-Dimension, und führen Sie die interaktive Phasenkorrektur.
- Wählen Sie die entsprechende Scheibe (Peak mit einer maximalen Intensität) in der Analyse / T 1 / T 2 Entspannung Fenster integrieren, und die Region zur Entspannung Modul exportieren.
- Wählen Sie die entsprechende Anpassungsfunktion (invrec oder uxnmrt2 für IR und CPMG Experimente, beziehungsweise) die T 1 oder T 2 Relaxationszeiten zu erhalten.
- Wiederholen Sie die Schritte 2.4.4.2-2.4.4.4 für alle verbleibenden [DCA] Lösungen.
- Berechnen Sie die Relaxationsgeschwindigkeit (R 1 und R 2) aus den erhaltenen T 1 - Werte (R 1,2 = 1 / T 1,2).
- Plot R 1 und R 2 (s -1) in Abhängigkeit von Gd (III) Konzentration in mM.
- Bestimmung der longitudinalen und transversalen Relaxivitäten, r 1 und r 2 (mm -1 sec -1), aus der Steigung der angepassten Linie, wie durch Gl. 6 ist , wobei R i, obs = der Längs (i = 1) oder quer (i = 2) diamagnetischen RelaxationsgeschwindigkeitWasser in der Abwesenheit von paramagnetischen Spezies und [Gd] = die Konzentration von Gd (III) in dem Experiment verwendet.
 (6)
(6)
3. In - vitro - MRT; Vergleich zwischen DCA und GdDOTA
- Herstellung von Rohr Phantome
- Bereiten wäßriger Lösungen von DCA (4 x 350 ul) und GdDOTA (4 x 350 ul) sowie Wasserproben (4 x 350 ul) für zwei Sätze von Experimenten, bei denen die Konzentration der Kontrastmittel berechnet wird: (3.1.1.1) pro Gd (III) oder (3.1.1.2) pro Molekül.
- Bereiten Sie zwei DCA Proben und zwei GdDOTA Proben mit Konzentrationen von 0,5 und 1,0 mM pro Gd (III), respectively. Zusätzlich bereiten zwei Wasserproben (als Kontrollröhrchen).
- Bereiten zwei DCA Proben (2,5 und 5,0 mM pro Gd (III) oder 0,05 und 0,1 mm pro Molekül dendrimeren), zwei GdDOTA Proben (0,25, 0,5 mM) und zwei Wasserproben (control Röhren).
HINWEIS: Die entsprechenden DCA und GdDOTA Konzentrationen sollten durch Verdünnen der jeweiligen Aktien Proben mit Konzentrationen über den BMS-Methode bestimmt, hergestellt werden mit HEPES-Puffer (pH 7,4) (siehe Abschnitt 2.2). Um die Berechnungen zu vereinfachen, n = 50 wurde für die durchschnittliche Anzahl von makrocyclischen Einheiten pro Dendrimermolekül angenommen. Daher ist das Verhältnis von DCA: GdDOTA war 1: 5, berechnet auf einer Basis pro Molekül.
- Platzieren Sie die Proben in 300 & mgr; l-Kunststoffröhrchen Röhrchen, das Vorhandensein von Luftblasen in der Lösung vermieden wird.
HINWEIS: Die Größe der Kunststoffröhrchen Rohre hängt von der Art und der Größe der Hochfrequenzspule verwendet wird (hier wird ein Beispiel mit der Volumenspule gegeben ist). - Legen Sie die Proben in einer Spritze (60 ml Volumen), füllen Sie es mit 1 mM GdDOTA Lösung, und legen Sie sie in den Scanner.
HINWEIS: Die Proben wurden in der wässrigen Lösung des GdDOTA platziert Suszeptibilitätseffekte (Variationen im Magnetfeld s vermeidentrength, die in der Nähe von Schnittstellen zwischen Substanzen unterschiedlicher magnetischer Suszeptibilität auftreten).
- Bereiten wäßriger Lösungen von DCA (4 x 350 ul) und GdDOTA (4 x 350 ul) sowie Wasserproben (4 x 350 ul) für zwei Sätze von Experimenten, bei denen die Konzentration der Kontrastmittel berechnet wird: (3.1.1.1) pro Gd (III) oder (3.1.1.2) pro Molekül.
- Parameteroptimierung und Bildgebung.
- Verwenden Sie den anatomischen Scan (Localizer / TriPilot) die Spritze mit den Proben im Isozentrum des Magneten zu positionieren.
- Drücken Sie die Ampel (Einstellung Scan) durchzuführen Anpassungen für Shim (Anpassung der Magnetfeldhomogenität) des gesamten Volumens, die Mittenfrequenz (O 1), die Empfängerverstärkung (RG) und die Sendeverstärkung (TX0 und TX1).
- Für T 1 -gewichteten (T 1W) Bildgebung, wählen Sie den schnellen low angle shot (FLASH) Methode.
- Wählen Sie koronare Schicht für die Proben vertikal angeordnet (Spritze horizontal) in der Scanner den Localizer-Scan verwenden.
- Verwenden Sie Gl. 7 für die Optimierung des Kontrastes-Rausch (CNR) Erfassungsparameter 16, wobei α = der Flipwinkel, TE die Echozeit =, TR =die Wiederholungszeit, und T 1, A, T 1, B T 1 mal der Probe A (T 1, A) und Probe B (T 1, B) , für die = sollte das CNR maximiert werden (das gleiche gilt für T 2 mal: T 2, A und T 2, B).
HINWEIS: T 1 und T 2 Relaxationszeiten sollte aus den Messungen der Längs- und Quer Relaxivität (Abschnitt 2.4), während TE, TR, und α sollte von der CNR Optimierungsberechnung erhalten werden , erhalten auf Werte eingestellt werden.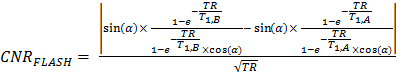 (7)
(7) - Erwerben Sie das Bild mithilfe der im vorherigen Schritt erhaltenen Parameter (3.2.5).
- Berechnen des Signal-zu-Rausch-Verhältnis (SNR).
- Laden Sie die erworbenen T 1w Bild (Scan) in die Bildanzeige und VerarbeitungFenster, und klicken Sie auf Region of Interest (ROI) zu definieren.
- Wählen Sie einen kreisförmigen ROI und es an der Probenposition und Hintergrund zeichnen. Anschließend klicken Sie auf dem Display die durchschnittliche Signalamplitude (S - Signal) und Standardabweichung des Hintergrunds (S Rauschen) zu erhalten.
- Wiederholen Sie Schritt 3.2.7.2 für die DCA, GdDOTA und Wasserproben.
- Berechnen Sie die SNR unter Verwendung der Formel: SNR = Signal S / S Rauschen.
- Nach einem leicht modifizierten Verfahren, führen T 2 -gewichteten (T 2W) Bildgebung die schnelle Erfassung mit Relaxationserhöhung (RARE) Methode verwendet wird . Zur Optimierung der CNR Erfassungsparameter verwenden Gl. 8.
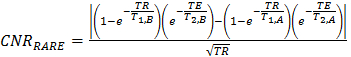 (8)
(8)
Ergebnisse
Die Herstellung von DCA bestand aus zwei Stufen: 1) Synthese des monomeren DOTA-Typ - Chelator (Abbildung 1) und 2) Kopplung des Chelators mit dem G4 PAMAM Dendrimer und anschließende Herstellung der dendrimeren Gd (III) -Komplex (Figur 2) . In der ersten Stufe wird ein cyclen Basis DOTA-Typ Chelator vier Carbonsäuren und eine orthogonale Gruppe geeignet für die weitere synthetische Modifikationen enthielt, wurde hergestellt. Die Herstellung begann von 1 (DO3A- tert-butylester) 7, das mit tert - Butyl - 2-brom-4- (4-nitrophenyl) butanoat 8 alkyliert bereitzustellen DOTA-Derivat 2. Die Palladium-katalysierte Hydrierung reduziert die aromatische Nitrogruppe in 2 das Anilin 3 zu ergeben. Die Umwandlung von 3 mit Thiophosgen in das Isothiocyanat ergab 4 which wurde zuvor als ein Amin-reaktives Mittel zur Herstellung von dendrimeren CAs 17 verwendet.
In der folgenden Stufe wurde der Makrocyclus 4 als Grund Monomereinheit in einer Kupplungsreaktion mit dem im Handel erhältlichen G4 PAMAM Dendrimer verwendet. Die Aminoberflächengruppen des Dendrimers reagieren mit den Isothiocyanat - Gruppen des Monomers 4 in Gegenwart einer Base. Der Überschuß an 4 wurde durch Grßenausschlußchromatographie entfernt , wobei ein lipophiler Gelfiltrationsmedium mit Methanol als Elutionsmittel verwendet wird . Die tert - Butyl - Ester auf dem erhaltenen Dendrimer-Konjugat makrocyclischen 5 wurden mit Ameisensäure hydrolysiert 6 zu ergeben, die dann in dem nächsten Schritt ohne Reinigung lyophilisiert und verwendet. Die Bildung von Gd (III) -Komplexe von DOTA-Makrocyclen Typ wurde durch Zugabe von GdCl 3 durchgeführt · 6H 2 O zu einer wßrigen Lösung of 6 unter Beibehaltung des pH - Wertes auf etwa 7. Der Überschuß an Gd (III) mit einem gemeinsamen Chelator Ethylendiamintetraessigsäure (EDTA) komplexiert wurde. mit einem hydrophilen Gel Filtrationsmedium mit Wasser als Eluent Der GdEDTA Komplex und überschüssiges EDTA wurden aus dem System durch Grßenausschlußchromatographie entfernt. Die verbleibenden kleinen Abmessungen Verunreinigungen wurden aus der Lösung durch Zentrifugation entfernt unter Verwendung von 3 kDa zentrifugalen Filtrationseinheiten.
Nach der Synthese der Dendrimer-Konjugate Makrocyclus, einem kombinierten analytischen Ansatz wurde die Produkte zu charakterisieren, verwendet. Um die Oberfläche-amin Belegung von 5 und 6, 1 H - NMR - Spektren wurden , bestimmen , analysiert. Die Ergebnisse wurden verglichen und mit dem Endprodukt (DCA) bestätigt, wo die Beladung des Dendrimers mit Makrocyclen Elementaranalyse und MALDI-TOF Massenspektrometrie (Abbildung geschätzt wurde ,3). Eine Kombination dieser drei Verfahren führte zu einem Durchschnitt von 49 makrocyclischen Einheiten an die G4-Dendrimer konjugiert ist, die 75% Amingruppe Oberflächenbelegung auf ~ entspricht.
Weitere Charakterisierung der dendrimeren Komplex enthalten Bestimmung der Relaxivity Werte in 6,2 ± 0,1 mM resultierende -1 sec -1 pro Gd (III) (oder ungefähr etwa 300 mM -1 s -1 pro Dendrimer) für die Längs Relaxivität und 30,5 ± 0,6 mM -1 s -1 pro Gd (III) (fast 1500 mM -1 s -1 pro Dendrimer) für die Quer Relaxivität. DLS - Messungen zeigten einen hydrodynamischen Durchmesser von 7,2 ± 0,2 nm für DCA (Abbildung 4).
Schließlich wird die Wirkung des dendrimeren MRI-Kontrastmittel zu demonstrieren, wurde der MR-Bildgebung auf zwei Sätze von Phantomen mit DCA und der Klinik durchgeführtVerbündeter verfügbar GdDOTA zum Vergleich (Abbildung 5). Der erste Satz von Schemen wurden zum Zweck hergestellt, diese beiden Kontrastmittel bei identischen Gd (III) -Konzentrationen zu vergleichen, während der zweite Satz konzipiert wurde die Wirkung bei vergleichbarem Molekülkonzentrationen der dendrimeren und monomeren Kontrastmittel zu demonstrieren, respectively.
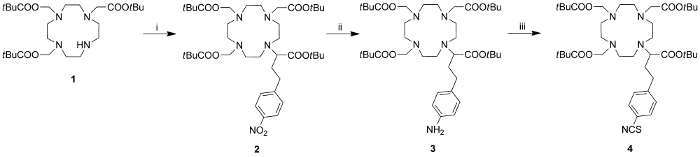
Abbildung 1: Die Synthese der makrocyclischen DOTA-Typ - Chelator 4. Reagenzien, Bedingungen und isolierten Ausbeuten: (i) tert - Butyl - 2-brom-4- (4-nitrophenyl) butanoat, K 2 CO 3, DMF, 45 ° C 16 h, 72%; (ii) H 2, Pd / C, EtOH, RT, 16 h, 95%; (iii) CSCl 2, Et 3 N, RT, 2 h, 53%. Bitte hier klicken , um eine größere Version dieses fi anzuzeigen Abbildung.
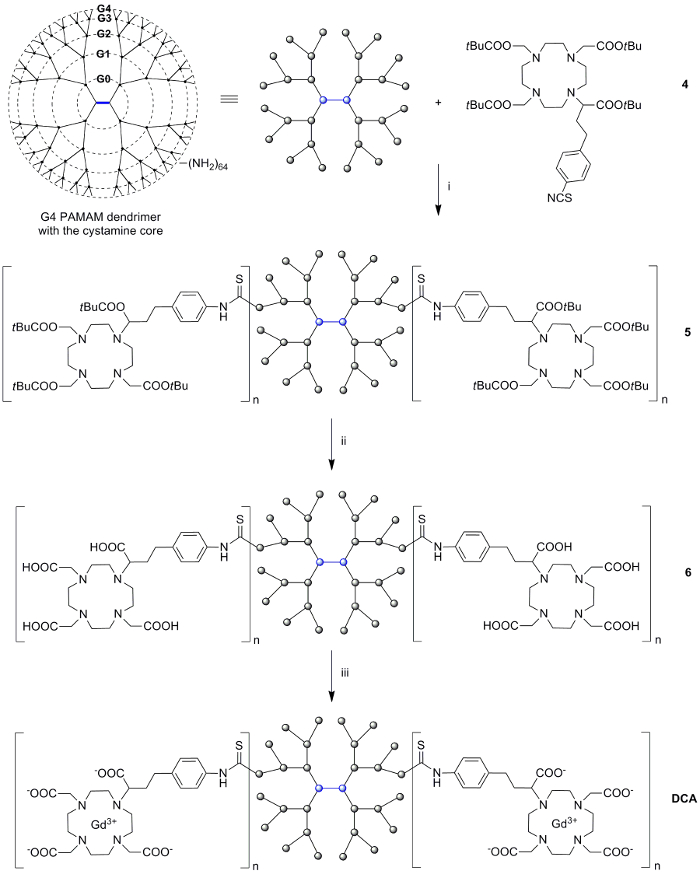
Abbildung 2: Die Synthese des dendrimeren MRT - Kontrastmittel DCA Reagenzien und Bedingungen: (i) 4, Et 3 N, DMF, 45 ° C, 48 h, 91%;. (Ii) Ameisensäure, 60 ° C, 24 h, quant; (iii) GdCl 3 ∙ 6 H 2 O, pH 7,0, RT, 24 h, 71%. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
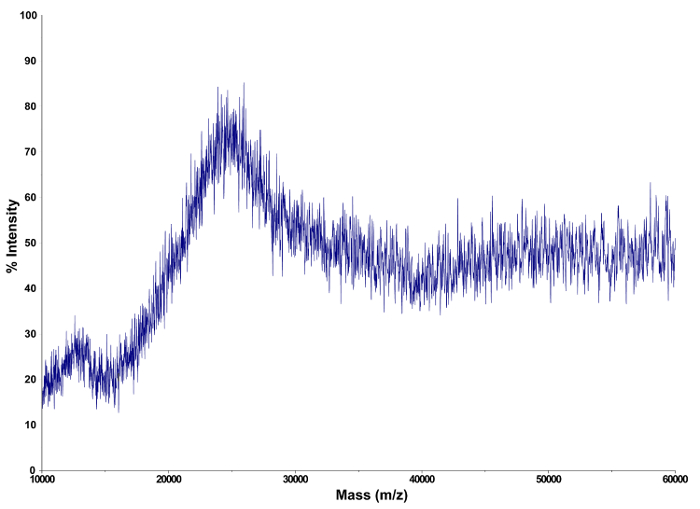
Abb . 3: Charakterisierung des dendrimeren Produkt mittels MALDI-TOF - Massenspektrometrie Ein typisches MALDI-TOF - Massenspektrum für DCA erhalten.rget = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abb . 4:. Charakterisierung des dendrimeren Produkt mittels dynamischer Lichtstreuung (DLS) DLS Messung von DCA (HEPES, pH 7,4) Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
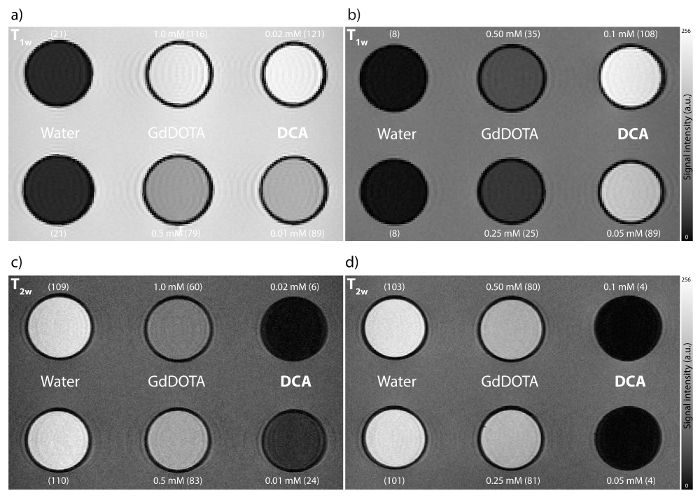
Abbildung 5: In vitro MRI Experimente an Rohr Phantome bei 7 T Magnetfeld (a, b) T 1 -gewichteten und (c, d) T 2 -gewichteten MRI von DCA und GdDOTA.. Jede MRI-Experiment wurde durchgeführt, mit zwei verschiedene Konzentrationen des Kontrastmittels: (a, c) mit vergleichbaren Gd (III) -Konzentrationen (HEPES, pH 7,4); (B, d) mit einem DCA: GdDOTA Konzentrationsverhältnis von 1: 5 (HEPES, pH 7,4). Die Konzentrationen werden pro Molekül exprimiert und die SNR-Werte sind in Klammern dargestellt. Die Parameter in diesen Experimenten verwendet wurden , waren: Field-of-View (FOV) = 40 x 40 mm 2, Schichtdicke = 0,5 mm, die Anzahl der Anregungen (NEX) = 30; (A) Matrixgröße (MTX) = 256 x 256, Wiederholungszeit (TR) = 100 ms, Echozeit (TE) = 2,95 ms, Flipwinkel (FA) = 90 °, Erfassungszeit (TA) = 12 min 48 sec ; (B) MTX = 256 x 256, TR / TE = 20 / 2,95 ms, FA = 90 °, TA = 2 min 34 sec; (C) MTX = 512 x 512, TR / TE = 10.000 / 130 ms, Rare Faktor (RF) = 16, TA = 26 min 40 sec; (D) MTX = 512 x 512, TR / TE = 10.000 / 100 msec, RF = 16, TA = 26 min 40 sec.776fig5large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Diskussion
Herstellung der dendrimeren MRI Kontrastmittels erfordert eine geeignete Auswahl der monomeren Einheit (dh der Chelator für Gd (III)). Sie reduzieren die Toxizität dieses paramagnetischen Ion und bis heute eine große Auswahl an azyklisch und makrocyclischen Chelatbildnern diesem Zweck dienen 1-3. Unter diesen makrocyclischen DOTA-Typ - Chelatoren besitzen die höchste Stabilität thermodynamischen und kinetischen Inertheit und damit sind die bevorzugte Wahl zur Herstellung von inerten MRI - Kontrastmittel 1,18. Darüber hinaus sind sie anfällig für verschiedene synthetische Transformationen, die in bifunktionellen Chelatoren führen, der fähig ist die Anbindung an verschiedene funktionelle Moleküle (zB Targeting - Vektoren oder Nanoträger) , während immer noch stabil Gd bilden (III) -Komplexe 19. Zu diesem Zweck wurde der DOTA-Typ monomerer Einheit in diesem Verfahren beschrieben von DO3A- tert-butylester hergestellt, die gemeinsame und leicht verfügbar Vorläufers und dem Bromid - Derivat derdas 4- (4-nitrophenyl) butansäure. Dieses Molekül wird von DOTA abgeleiteten und besitzt eine ähnliche Struktur Gd (III) zu koordinieren. Die synthetische Modifikation soll Kupplungsreaktionen auf verschiedene funktionelle Moleküle und Träger dieser Chelator anfällig zu machen. Nämlich die Herstellung der DOTA-modifizierten Moleküls führt zu einem Chelator noch mit vier Carboxygruppen für die Koordination zu Gd (III) zu einem inerten Komplex bilden und eine orthogonale Nitrophenylgruppe, die bei der Umwandlung dieser Chelator Oberfläche mit dem Dendrimer befestigt. Dieses Verfahren ermöglicht auch eine Flexibilität bei der Auswahl der orthogonalen reaktiven Gruppe (beispielsweise COOH oder NH 2), die das Gd (III) Chelator zu kuppeln auf einen gewünschten Träger in bevorzugter Weise dienen kann.
Das erhaltene bifunktionelle Chelator kann auf zwei unterschiedliche Arten (dh synthetische Verfahren) an andere Moleküle gekoppelt werden. Wenn die Nitrogruppe zu einer Aminogruppe reduziert wird, kann die resultierende Anilin untergehen , um eine Kondensationsreaktion mit der Carbonsäuregruppe des anderen Moleküls 8. Darüber hinaus kann ein aromatisches primäres Amin - funktionellen Gruppe in Gegenwart von Thiophosgen leicht in ein Isothiocyanat umgewandelt werden, eine Gruppe , die mit Aminen in polaren organischen Lösungsmitteln sowie Wasser und bietet mehr Reaktionsmöglichkeiten für die Kopplung von Monomereinheiten an Dendrimere leicht reagiert 17 , 20,21.
Zum Koppeln des bifunktionellen Chelators zur dendrimeren Träger, ein geeignetes dendrimeren Gerüst ausgewählt werden. Verschiedene Faktoren tragen zu der endgültigen Dendrimerkonjugat Struktur und der gewünschten Anwendung sollte in diesem Schritt berücksichtigt werden verwandt. Aufgrund breiten kommerziellen Verfügbarkeit von dendrimeren Träger, Produkte mit unterschiedlichen Kernstrukturen, oberflächenreaktive Gruppen oder Generationen gewählt werden. Folglich wird die Konjugationsreaktion auf der Oberfläche des Dendrimers Gruppe und die orthogonale Gruppe des Chelators abhängen, während dieendgültige Konjugat kann neutral, berechnet sein oder unterschiedliche Größen aufweisen (bis zu 15-20 nm, auf Dendrimer Generation je) 22. All diese Aspekte berücksichtigt werden, bevor die dendrimeren CA Herstellung, da sie die Löslichkeit beeinflussen können, Relaxivität (MRI-Signalverstärkung), Diffusion und andere pharmakokinetische Eigenschaften des Kontrastmittels, die möglicherweise seine Anwendung in MRI gefährden. Zum Beispiel können kationische Dendrimere Toxizität in biologischen Systemen aufweisen. Jedoch kann diese Wirkung durch die Konjugation von negativ geladenen Gruppen auf dem Dendrimer Oberfläche verringert werden, wodurch die positive Gesamtladung Reduktions 23.
In diesem Protokoll haben wir den dendrimeren Kontrastmittel DCA unter Verwendung des Verfahrens , in dem die Isothiocyanatgruppe des monomeren Makrocyclus 4 hergestellt mit einem handelsüblichen Cystamin-Core - G4-PAMAM mit 64 primären Aminoberflächengruppen ausgestattet gekoppelt wurde. Die anfängliche Reinigung der hydrophobic dendrimeren Produkt 5 wurde durch Gelchromatographie durchgeführt , eine Säule , die mit einem lipophilen Gelfiltrationsmedium und Methanol als Elutionsmittel gereinigt , um unter Verwendung von den meisten der nicht umgesetzten monomeren Einheiten zu entfernen. Die Hydrolyse von t - Butyl - Ester mit Ameisensäure ist einfach, was zu einem wasserlöslichen Produkt , das dendrimere mit Größenausschluss - Chromatographie unter Verwendung eines hydrophilen Gelfiltrationsmedium gereinigt werden kann. Die Komplexierung des multimeren und dendrimeren Chelatoren mit Gd (III) wurde bei einem neutralen pH, um unter Beibehaltung der Lösung durchgeführt, die Komplexbildung zu erleichtern. Ansonsten verringert der Komplexierung von Gd (III) (zugegeben als Chloridsalz), um den pH-Wert, verlangsamt sich die Reaktion. Schließlich ist es erwähnenswert, dass Amingruppen in dem Dendrimer Kern neigen auch dazu, mit Gd (III) koordinieren, aber nur mit dem Überschuß, der nicht mit den DOTA Einheiten chelatisiert werden. Die Vermeidung der Anwesenheit von Gd (III) außerhalb des DOTA Chelator ist von wesentlicher Bedeutung, da leAkage von Gd (III) von der CA kann unerwünschte Auswirkungen haben; Es kann nämlich die Toxizität in vivo 18 induzieren. Der Überschuß an Gd (III) kann effektiv durch Komplexierung mit durch Ultrafiltration von GdEDTA und freie EDTA unter Verwendung von 3 kDa Molekulargewicht cut-off (MWCO) Filter gefolgt EDTA entfernt werden. Lower MWCO Filter könnten verwendet werden, wenn die dendrimeren Konjugate niedrigere Molekulargewichte aufweisen.
Es gibt zwei große Problemfragen zur Vorbereitung der DCA zusammen. Aufgrund der großen Verbreiterungseffekt von Gd (III) auf NMR-Signale, ist die Analyse von DCA mittels NMR-Spektroskopie nicht informativ. Stattdessen sollten diese Analyse in früheren Schritten (Verbindungen 5 und 6) durchgeführt werden. Als nächstes wird die Konjugation von monomacrocyclic Einheiten an das Dendrimer Oberfläche nie mit 100% Umsatz erreicht, aber es ist wahrscheinlich, zwischen 50-90% (siehe unten) zu sein. Typischerweise kann die Reaktionsausbeuten durch Zugabe eines zweiten Teils des monomeri erhöht werdenc reaktive Einheit nach der ersten Konjugation von Dendrimer und monomeren Einheit 24 abgeschlossen. Doch alle Vorbereitung Batch Ergebnisse in etwas unterschiedlichen Anzahl von Chelatoren auf der Dendrimer-Oberfläche konjugiert, selbst wenn identische Dendrimer und DOTA-Einheiten werden als Materialien für die Kopplung verwendet. Obwohl die endgültige Menge an Gd (III) in DCA können unabhängig voneinander über den BMS-Methode bestimmt werden, für eine bessere Charakterisierung von dendrimeren-Konjugate (siehe Abschnitt 2.2), ist es notwendig, die Schätzung von gebundenen Monomereinheiten jedesmal, wenn eine neue Charge ausführen DCA vorbereitet (siehe 2.1 und Diskussion unten).
Die analytische Charakterisierung der isolierten dendrimeren Produkte können mittels 1 H NMR - Spektroskopie (nur auf Produkte 5 und 6), Elementaranalyse und MALDI-TOF - MS durchgeführt werden. Typische Ausbeuten für die Umwandlung der Amino-Oberflächengruppen liegen zwischen 50-90%, abhängig von dem Dendrimer Generatiauf, der Art des Chelators und den verwendeten Reaktionsbedingungen (Lösungsmittel, Temperatur) 6,20,24,25. In diesem besonderen Fall die berechneten Massen aus den kombinierten Analysen erhaltenen entsprechen einem Mittelwert aus 49 monomeren Chelate an das Dendrimer gekoppelt ist (dh ~ 75% Belegung der Dendrimeroberfläche Amine). Obwohl eine leichte Fehlanpassung in der endgültigen Anzahl von umgesetzten Aminogruppen zwischen diesen Methodologien 25 erwartet werden konnte, deren direkten Vergleich liefert angemessenen Beweis für die Bildung des gewünschten DCA mit einer bestimmten durchschnittlichen Anzahl der chelatbildenden Einheiten gebunden.
Die in vitro - Charakterisierung das Potential von DCA zur Beurteilung Ziel , den Kontrast in der MRI - Experimente zur Verbesserung bestand aus DLS, relaxometrischen und MRI - Experimente. Die hydrodynamischen Durchmesser von DCA wurde 7,2 ± 0,2 nm von DLS-Messungen bestimmt, die mit zuvor berichteten Konjugate dieser Art einverstanden istmit G4 Generation 4 PAMAM - Dendrimere 26. Bestimmung der longitudinalen Relaxivität von DCA folgte dem zuvor beschriebenen Verfahren 15 und ergab den Wert von 6,2 ± 0,1 mM -1 s -1 pro Gd (III). Etwa 50% der Verbesserung in der R 1 aus paramagnetischem Gd (III) in DCA relativ zu kleinformatigen Molekülen eines ähnlichen Typs (beispielsweise GdDOTA) mit der Zwischengröße des dendrimeren Kontrastmittels erläutert. Nämlich befestigt die reduzierte Bewegung der Gd-Chelaten an das Dendrimer Oberfläche erhöht die Rotationskorrelationszeit und daher r 1 ist ; kann dieser Effekt noch bei hohen Magnetfeldern für kleinere Nano-Größe Agenten beobachtet werden. Andernfalls trägt die Erhöhung der Rotationskorrelationszeit dominierend zu r 1 Verstärkung bei niedrigen magnetischen Feldern 27. Auf der anderen Seite hatte die Größe des dendrimeren Kontrastmittel eine ausgeprägte Wirkung auf die Quer relaxivity 28, was zu dem Wert von 30,5 ± 0,6 mM -1 s -1 pro Gd (III). Zusammenfassend sind die Methoden für die in vitro - Bewertung der DCA einfach und erfordern nur eine sorgfältige Probenvorbereitung, so werden keine Schwierigkeiten zu erwarten , wenn der Datenerfassung und der Analyse der Ergebnisse.
Um die Leistung des dendrimeren Kontrastmittel und seine Leistung zeigen, den Bildkontrast zu beeinflussen, führten wir MRI Experimente an Rohr Phantome mit dem neu hergestellten Kontrastmittel DCA. Wir haben auch eine Lösung eines im Handel erhältlichen und klinisch MRI-Kontrastmittel zugelassen, GdDOTA, als Vergleich und Röhren mit Wasser als Kontrolle. In der ersten T 1 -gewichteten MRI Experiment, wenn gleiche Gd (III) Konzentrationen verwendet wurden (0,5 bzw. 1 mM Gd (III) in DCA oder GdDOTA) war das SNR in den Rohren mit DCA bereits bis zu 12% höher , da zu einer Steigerung von etwa 50% in Längs Relaxivität von DCA Vergleich zu GdDOTA (Fild 5a). Das zweite T 1 -gewichteten MRI Experiment wurde entworfen , um die Wirkung von DCA zu demonstrieren , wenn die Konzentrationen pro Molekül berechnet. Obwohl 5-mal weniger DCA angewendet wurde im Vergleich zu GdDOTA (50 vs. 250 uM oder 100 vs. 500 uM DCA vs. GdDOTA, respectively), eine hohe Beladung an DCA mit Gd (III) in einem signifikanten Zuwachs in der Bildkontrast ergab, die wiederum in Folge die beobachteten Werte SNR mindestens dreimal höher in den Phantomröhrchen mit DCA gefüllt. Expectedly, die beide T 2 -gewichtete MRI Experimente zeigten große (3-20 mal) Unterschiede in der SNR zwischen den Phantom Röhren gefüllt mit DCA und GdDOTA.
Abschließend beschreibt dieses Protokoll eine bequeme Vorbereitung eines dendrimeren CA für MRI gemeinsamen Syntheseverfahren unter Verwendung von DCA zu schaffen, mit verbesserten Eigenschaften im Vergleich zu kleinforma CAs. DCA zeigt thermodynamische Stabilität und kinetische Inertheit bevorzugt im Vergleichzu seiner monomeren CA-Analoga. Dennoch ist die Multivalenz von DCA und damit die hohe lokale Konzentration der paramagnetischen Spezies in der Zielregion induziert einen hohen Kontrast in den MR-Bildern. Angesichts der oft vorzuziehen pharmakokinetischen Eigenschaften (zB Retentionszeit länger Gewebe) im Vergleich zu ihrem monomeren CA Analoga, oder die Fähigkeit , weitere Funktionalitäten zu tragen (beispielsweise gezielte Vektoren), diese dendrimeren-Makrocyclus Konjugate stellen eine vielversprechende und wertvolle Klasse von Kontrastmitteln für verschiedene Zukunft MRI und molekularen Bildgebungsanwendungen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The financial support of the Max-Planck Society, the Turkish Ministry of National Education (PhD fellowship to S. G.), and the German Exchange Academic Service (DAAD, PhD fellowship to T. S.) are gratefully acknowledged.
Materialien
| Name | Company | Catalog Number | Comments |
| Cyclen | CheMatech | C002 | |
| tert-Butyl bromoacetate | Alfa Aesar | A14917 | |
| N,N-Dimethylformamide | Fluka | 40248 | |
| Potassium carbonate | Sigma-Aldrich | 209619 | |
| 4-(4-Nitrophenyl)butryic acid | Aldrich | 335339 | |
| Thionyl chloride | Acros Organics | 382662500 | Note: Corrosive substance; toxic if inhaled |
| Bromine | Acros Organics | 402841000 | Note: causes severe skin burns, fatal if inhaled |
| Diethyl ether | any source | ||
| Sodium sulphate | Acros Organics | 196640010 | |
| Chloroform | VWR Chemicals | 22711.29 | |
| tert-Butyl 2,2,2-trichloroacetimidate | Aldrich | 364789 | Note: flammable substance; irritrant to skin and eyes |
| Boron trifluoride etherate | Acros Organics | 174560250 | 48% BF3. Note: Flammable substance; causes skin burns, fatal if inhaled |
| Sodium bicarbonate | Acros Organics | 424270010 | |
| Ethyl-acetate | any source | For column chromatography | |
| n-Hexane | any source | For column chromatography | |
| Bulb-to-bulb (Kugelrohr) distillation apparatus | Büchi | Model type: Glass oven B-585 | |
| Silicagel | Carl Roth GmbH | P090.2 | |
| Methanol | any source | For column chromatography | |
| Dichloromethane | any source | For column chromatography | |
| Ethanol | VWR Chemicals | 20821.296 | |
| Ammonia | Acros Organics | 428381000 | 7 N Solution in Methanol |
| Palladium | Aldrich | 643181 | 15% wet |
| Hydrogenation apparatus PARR | PARR Instrument Company | ||
| Celite 503 | Aldrich | 22151 | |
| Sintered glass funnel | any source | ||
| Thiophosgen | Aldrich | 115150 | Note: irritrant to skin; toxic if inhaled |
| Triethylamine | Alfa Aesar | A12646 | |
| Dichloromethane | Acros Organics | 348460010 | Extra dry |
| Magnetic stirrer | any source | ||
| PAMAM G4 Dendrimer | Andrews ChemService | AuCS - 297 | 10% wt. solution in MeOH |
| Lipophylic Sephadex LH-20 | Sigma | LH20100 | |
| Thin-layer chromatography plates | Merck Millipore | 1.05554.0001 | |
| Formic acid | VWR Chemicals | 20318.297 | |
| Lophylizer | any source | ||
| Gadollinium(III) chloride hexahydrate | Aldrich | G7532 | |
| Sodium hydroxide | Acros Organics | 134070010 | |
| pH meter | any source | ||
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Aldrich | E5134 | |
| Mass spectrometer (ESI) | Agilent | Ion trap SL 1100 | |
| Acetate buffer | any source | pH 5.8 | |
| Xylenol orange | Aldrich | 52097 | 20 μM in acetate buffer |
| Hydrophylic Sephadex G-15 | GE Healthcare | 17-0020-01 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Merck Millipore | UFC900324 | Ultracel-3 membrane (MWCO 3000) |
| Centrifuge | any source | ||
| NMR spectrometer | Bruker | Avance III 300 MHz | |
| Topspin | Bruker | Version 2.1 | |
| Combustion analysis instrument | EuroVector SpA | EuroEA 3000 Elemental Analyser | |
| MALDI-ToF MS instrument | Applied Biosystems | Voyager-STR | |
| Deuteriumoxid | Carl Roth GmbH | 6672.3 | |
| tert-Butyl alcohol | Carl Roth GmbH | AE16.1 | |
| Vortex mixer | any source | ||
| Norell NMR tubes | Deutero GmbH | 507-HP-7 | |
| NMR coaxial tube | Deutero GmbH | coaxialb-5-7 | |
| DLS instrument | Malvern | Zetasizer Nano ZS | |
| 0.20 μm PTFE filter | Carl Roth GmbH | KC94.1 | |
| HEPES | Fisher BioReagents | BP310 | |
| Plastic tube vials | any source | ||
| Dotarem | Guerbet | NDC 67684-2000-1 | |
| MRI scanner | Bruker | BioSpec 70/30 USR magnet (7 T). Note: potential hazards related to high magnetic fields | |
| RF coil | Bruker | Dual frequency volume coil (RF RES 300 1H/19F 075/040 LIN/LIN TR) | |
| Paravision (software) | Bruker | Version 5.1 |
Referenzen
- Merbach, A. E., Helm, L., Tóth, É The chemistry of contrast agents in medical magnetic resonance imaging. 2nd ed. , Wiley. (2013).
- Geraldes, C. F. G. C., Laurent, S. Classification and basic properties of contrast agents for magnetic resonance imaging. Contrast Media Mol. Imaging. 4 (1), 1-23 (2009).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: Structure, dynamics, and applications. Chem. Rev. 99 (9), 2293-2352 (1999).
- Villaraza, A. J. L., Bumb, A., Brechbiel, M. W. Macromolecules, Dendrimers, and Nanomaterials in Magnetic Resonance Imaging: The Interplay between Size, Function, and Pharmacokinetics. Chem. Rev. 110 (5), 2921-2959 (2010).
- Langereis, S., Dirksen, A., Hackeng, T. M., van Genderen, M. H. P., Meijer, E. W. Dendrimers and magnetic resonance imaging. New J. Chem. 31 (7), 1152-1160 (2007).
- Gündüz, S., Power, A., Maier, M. E., Logothetis, N. K., Angelovski, G. Synthesis and Characterization of a Biotinylated Multivalent Targeted Contrast Agent. ChemPlusChem. 80 (3), 612-622 (2015).
- Pope, S. J. A., Kenwright, A. M., Heath, S. L., Faulkner, S. Synthesis and luminescence properties of a kinetically stable dinuclear ytterbium complex with differentiated binding sites. Chem. Commun. (13), 1550-1551 (2003).
- Vibhute, S. M., et al. Synthesis and characterization of pH-sensitive, biotinylated MRI contrast agents and their conjugates with avidin. Org. Biomol. Chem. 11 (8), 1294-1305 (2013).
- Vogel, A. I., Furniss, B. S. Vogel's textbook of practical organic chemistry. 5th ed. , Longman. (1989).
- Lundanes, E., Reubsaet, L., Greibrokk, T. Chromatography : basic principles, sample preparations and related methods. , Wiley-VCH. (2013).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Media Mol. Imaging. 1 (5), 184-188 (2006).
- Keeler, J. Understanding NMR spectroscopy. 2nd ed. , Wiley. (2010).
- Hillenkamp, F., Peter-Katalinić, J. MALDI MS : a practical guide to instrumentation, methods and applications. , Wiley-VCH. (2007).
- Peters, J. A., Huskens, J., Raber, D. J. Lanthanide induced shifts and relaxation rate enhancements. Prog. Nucl. Magn. Reson. Spectrosc. 28, 283-350 (1996).
- Averill, D. J., Garcia, J., Siriwardena-Mahanama, B. N., Vithanarachchi, S. M., Allen, M. J. Preparation, Purification, and Characterization of Lanthanide Complexes for Use as Contrast Agents for Magnetic Resonance Imaging. J. Vis. Exp. (53), e2844(2011).
- Hagberg, G. E., Scheffler, K. Effect of r1 and r2 relaxivity of gadolinium-based contrast agents on the T1-weighted MR signal at increasing magnetic field strengths. Contrast Media Mol. Imaging. 8 (6), 456-465 (2013).
- Boswell, C. A., et al. Synthesis, characterization, and biological evaluation of integrin alpha(v)beta(3)-targeted PAMAM dendrimers. Mol. Pharmaceut. 5 (4), 527-539 (2008).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. Primer on Gadolinium Chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Cakić, N., Gündüz, S., Rengarasu, R., Angelovski, G. Synthetic strategies for preparation of cyclen-based MRI contrast agents. Tetrahedron Lett. 56 (6), 759-765 (2015).
- Polasek, M., Hermann, P., Peters, J. A., Geraldes, C. F. G. C., Lukes, I. PAMAM Dendrimers Conjugated with an Uncharged Gadolinium(III) Chelate with a Fast Water Exchange: The Influence of Chelate Charge on Rotational Dynamics. Bioconjugate Chem. 20 (11), 2142-2153 (2009).
- Ali, M. M., et al. Synthesis and relaxometric studies of a dendrimer-based pH-responsive MRI contrast agent. Chem. Eur. J. 14 (24), 7250-7258 (2008).
- Jackson, C. L., et al. Visualization of dendrimer molecules by transmission electron microscopy (TEM): Staining methods and Cryo-TEM of vitrified solutions. Macromolecules. 31 (18), 6259-6265 (1998).
- Jain, K., Kesharwani, P., Gupta, U., Jain, N. K. Dendrimer toxicity: Let's meet the challenge. Int. J. Pharm. 394 (1-2), 122-142 (2010).
- Rudovsky, J., et al. PAMAM dendrimeric conjugates with a Gd-DOTA phosphinate derivative and their adducts with polyaminoacids: The interplay of global motion, internal rotation, and fast water exchange. Bioconjugate Chem. 17 (4), 975-987 (2006).
- Xu, H., et al. Toward improved syntheses of dendrimer-based magnetic resonance imaging contrast agents: New bifunctional diethylenetriaminepentaacetic acid ligands and nonaqueous conjugation chemistry. J. Med. Chem. 50 (14), 3185-3193 (2007).
- Nwe, K., Bryant, L. H., Brechbiel, M. W. Poly(amidoamine) Dendrimer Based MRI Contrast Agents Exhibiting Enhanced Relaxivities Derived via Metal Preligation Techniques. Bioconjugate Chem. 21 (6), 1014-1017 (2010).
- Livramento, J. B., et al. First in vivo MRI assessment of a self-assembled metallostar compound endowed with a remarkable high field relaxivity. Contrast Media Mol. Imaging. 1 (1), 30-39 (2006).
- Norek, M., Kampert, E., Zeitler, U., Peters, J. A. Tuning of the Size of Dy2O3 Nanoparticles for Optimal Performance as an MRI Contrast Agent. J. Am. Chem. Soc. 130 (15), 5335-5340 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten