Method Article
Influenza Virus Vermehrung in embryonierten Hühnereiern
In diesem Artikel
Zusammenfassung
Fertile chicken eggs are widely used to produce large amounts of human influenza A virus as they provide a convenient and cost-effective system to prove high yields of virus.
Zusammenfassung
Influenza-Infektion ist mit rund 36.000 Tote und mehr als 200.000 Krankenhauseinweisungen pro Jahr in den Vereinigten Staaten verbunden. Die kontinuierliche Entstehung neuer Influenza-Virus-Stämme aufgrund von Mutation und Wiederzusammenstellung erschwert die Kontrolle des Virus und die ständige Entwicklung neuer Arzneimittel und Impfstoffe. Die Laboruntersuchung von Influenza erfordert ein zuverlässiges und kostengünstiges Verfahren für die Vermehrung des Virus. Hier wird ein umfassendes Protokoll für Influenza-A-Virusvermehrung in fruchtbare Hühnereiern, die konsequent liefert hohen Titer Virusbeständen. 11 Tage - Kurz gesagt, werden Serum pathogenfreien (SPF) befruchtete Hühnereier bei 37 ° C und 55-60% Luftfeuchtigkeit für 10 inkubiert. In diesem Zeitraum können die Entwicklung des Embryos einfach mit ein Ei candler überwacht werden. Virusinokulation erfolgt durch Injektion von Virusstocks in die Allantois-Höhle unter Verwendung einer Nadel durchgeführt. Nach 2 Tagen Inkubation bei 37 ° C, sind die Eiergekühlt für mindestens 4 Stunden bei 4 ° C. Die Eischale oberhalb der Luftsack und die Chorioallantoismembran werden dann vorsichtig geöffnet und die Allantoisflüssigkeit, die das Virus geerntet. Das Fluid wird von Bruchstücken durch Zentrifugation geklärt, in Aliquote aufgeteilt und bis -80 ° C zur Langzeitlagerung transferiert. Die große Menge (5-10 ml des virushaltigen Fluids pro Ei) und hoher Virustiter in der Regel mit diesem Protokoll erreicht hat die Verwendung von Eiern für die Viruspräparation unserer günstiges Verfahren zur in vitro-Studien, die größere Mengen, insbesondere des Virus in denen hohe Dosierungen des gleichen Virusstock erforderlich.
Einleitung
Influenza A weiterhin eine große Bedrohung für die menschliche Gesundheit sein. Es ist eine potenziell verheerenden Erkrankung der Atemwege mit einem großen globalen Belastung verursacht bis zu 500.000 Todesfälle weltweit pro Jahr 1. Influenza-Viren sind in der Familie Orthomyxoviridae und führen 8 Minus-Sense einzelsträngige RNA in ihrem Genom 1,2. Die hohe Veränderlichkeit (dh antigene "Drift") des Virusgenoms verhindert Langzeitimmunität. Außerdem ist Influenza zunehmend resistent gegen antivirale Medikamente 3.
Das H1N1 2009-Grippe-Pandemie markiert alle herausfordernden Fragen mit dem Influenzaerkrankung (Pandemie-Stamm, anti-virale Resistenz, verzögert Impfstoffproduktion) verbunden. Die Impfstoff-Formulierung wird jährlich von der Weltgesundheitsorganisation für die wahrscheinlichste pathogenen Influenza-Stämme (je eine für H1N1, H3N2 und Influenza B) 4 bestimmt. Da diese Methode beruht auf Annahmen basierte Influenza-Stamms, pathogenen Stämmen werden gelegentlich falsch identifiziert und die Wirksamkeit des Impfstoffes sinkt dramatisch. Darüber hinaus kann das Auftreten von neuen Influenza-Stämme diese präventive Programme verursachen Pandemien 2 zu umgehen.
Die Schaffung eines universellen Influenza-Impfstoff ist schwer 5. Daher müssen Erforschung Verständnis der Pathogenese der Lungenschädigung weiter. Um die Anlage der Laborforschung wurden verschiedene Verfahren für die virale Isolation und Vermehrung 6 entwickelt. Menschlichen Influenza-Viren können in einer Vielzahl von Säugetierzellsubstraten verstärkt werden. Jedoch werden die Erzeugung hoher Titer von Viren in großen Mengen am besten in embryonierten Eiern erreicht. Das folgende Protokoll beschreibt eine Technik für die Influenza A-Virusvermehrung und Speicherung von vorhandenen Virusstocks.
Protokoll
HINWEIS: Allgemeine Hinweise: Führen Sie alle Verfahren, die Manipulation des Ei unter sterilen Bedingungen und steriler Technik sollte entsprechend verwendet werden. Vorreinigen gesamte Ausrüstung mit 70% Ethanol vor dem Gebrauch. Im allgemeinen sollte Influenza Virusinokulation und Ernte in einem BSL-2 Labor durchgeführt werden. Allerdings, wenn dieses Protokoll wird verwendet, um zu verbreiten viel mehr pathogenen Influenzaviren (zB Pandemie und Pre-Pandemiestämme, Stämme, die eine Gefahr für Geflügel und Vieh, hoch pathogenen aviären Influenza-Stämme, die 1918 H1N1-Stamm darstellen), höhere Biosicherheitsstufen und in einigen Fällen werden Biosicherheitsmaßnahmen und Genehmigungen erforderlich. Der lokale Institutional Biosafety Committee sollte alle Forschung mit Influenza-Virus zu genehmigen.
1. Vorbereitung der Eier für Impfung
- Erhalten Serum pathogenfreien (SPF) frisch befruchteten Hühnerkeimen aus einem geeigneten Anbieter. Typischerweise sind Hühnereier verwendet. Eier sollten unsed sofort nach Ankunft.
- Nach der Ankunft statt Eier in einem befeuchteten Brutkasten mit einem automatischen Ei Turner, Eier regelmäßig zu drehen. Ist ein automatischer Ei Turner nicht verfügbar ist, von Hand drehen Eier mindestens 2-3 mal pro Tag (stellen Sie sicher, Handschuhe zu tragen und halten alles so steril wie möglich).
- Eiern bei 37 ° C und 55-60% Luftfeuchtigkeit für 10-11 Tage.
2. Eierkerzen
- Verwenden Sie ein Ei candler, um das Ei vor einem hellen Licht in einem dunklen Raum zu untersuchen, um Eier für Unfruchtbarkeit, die durch Durchleuchten nach ca. 7 oder 8 Tagen Inkubation zu überprüfen.
- Wischen Sie die Eierdurchleuchter mit 70% Ethanol. Handschuhe häufig wechseln und Desinfektion mit 70% Ethanol, um das Risiko einer Kontamination mit Krankheitserregern zu minimieren.
- Entfernen Sie die Eier aus dem Inkubator und sie in leeren Eierkartons.
- Schalten Sie das Licht in den Raum.
- Halten Sie das große Ende jedes Ei einzeln nacheinander gegen die candler.
- Beobachten Sie das Ei zu determine, wenn es fruchtbar oder unfruchtbar.
HINWEIS: Dünne Blutgefäße, die zu einer bohnenförmigen Embryos muss deutlich sichtbar sein. Unbefruchteten Eiern wird als kleiner Blutfleck mit einem sichtbaren Eigelb angezeigt.
- Werfen Sie unbefruchtete Eier, die sind, und gibt die lebensfähige Eier in den Inkubator. Lassen Sie keine Eier außerhalb des Inkubators für mehr als 30 min. Wenn der Status eines Eies nicht bestätigt werden kann, markieren Sie ihn und später beobachten sie.
3. Herstellung von Virus Inoculum
- Verdünne Influenzavirusbestand zu etwa 3. Oktober-4. Oktober pfu / ml in sterilem PBS, enthaltend 10 mM HEPES (pH 7,4). Critical Schritt: Verdünnen Sie die Virusstamm unmittelbar vor der Anwendung und halten die verdünnten Virus auf dem Eis die ganze Zeit.
4. Influenza Virus Impfung über die Allantois Routen
- Am Tag der Virusinokulation (Tag 10 oder 11), Kerze die Eier wieder und beseitigen tote Embryonen. Unterscheiden Sie Live-EmbryonenSuche nach Bewegung in das Ei.
- Entfernen Sie drei Eier aus dem Inkubator, und ordnen Sie die Eier in einem separaten Halter mit dem Luftsack auf.
- Markieren Sie den Luftraum der Eier mit einem wasserfesten Stift.
- Oberhalb des Luftraums mit 70% Ethanol waschen die Eierschale.
- Die Eier mit dem Luftraum in einem Eierkarton und in einen biologischen Sicherheit Haube (BSL-2).
- Verwenden Sie eine sterile 18G Nadel ein kleines Loch in der Schale auf den Luftsack jedes Ei zu stanzen. Achten Sie darauf, um die Nadel zu tief einfügen, um zu vermeiden, stech den Embryo oder Eigelb.
- Erstellung des verdünnten Influenza-Virus in eine sterile 1 ml-Spritze und fügen Sie eine 22G-Nadel.
- Die Spritze mit Nadel vorsichtig voran in einem Winkel von 45 ° in die Allantoishöhle.
- Injizieren 0,2 ml der verdünnten Influenza-Virus.
- Wiederholen Sie die Injektion mit den anderen zwei Eier, und dann werfen Sie die Spritze und Nadel.
- Dichten Sie das Loch mit einem Tropfen Klebstoff aus einer Klebepistole (oder geschmolzene Paraffinwachs). Be Achten Sie darauf, dass Kleber nicht im Inneren des Eis lecken.
- Legen Sie die Eier in die Brutkasten mit der Luftraum deutete nach oben.
- Wiederholen Sie die Schritte 4,2 bis 4,12, bis alle Eier wurden geimpft.
5. Inkubationszeit
- Die infizierten Eiern Inkubieren ohne Drehen bei 37 ° C und ca. 60% Luftfeuchtigkeit.
- Wählen optimale Inkubationszeit in Abhängigkeit von der Influenza-Virus-Typ. Inkubieren Influenza A 48 h; inkubieren Influenza B und C für 72 Stunden.
6. Influenza Virus-Ernte
- Nach Inkubationszeit Chill die Eier bei 4 ° C für mindestens 4 Stunden (oder O / N), um den Embryo zu töten und verengen die Blutgefäße, um das Risiko einer Verunreinigung des infizierten Allantoisflüssigkeit mit Blut zu verringern. Tun dies, um die roten Blutzellen absorbieren das Virus, was die Ausbeute verringert verhindern. Alternativ Chill Eier für 30 min bei -20 ° C; aber dies erhöht die Gefahr einer Kontamination des Blutes.
- Nachdem die Eier ausreichend gekühlt wurde, übertragen Sie die Eier auf einem Bio-Sicherheitshaube. Legen Sie das Ei in eine feste Halterung mit der Luftsack nach oben zeigt. Reinigen Sie das Ei Oberfläche mit 70% Ethanol.
- Verwenden einer sterilen Schere, um die Eierschale über dem Luftsack zu öffnen. Entfernen Sie die Hülle um den Luftsack, während man aufpassen, nicht die Chorioallantoismembran zerstören.
- Öffnen Sie die Chorioallantoismembran mit sterilem stumpfen Pinzette. Vorsichtig zur Seite legen den Embryo und der Dottersack mit einem kleinen Spatel oder Löffel. Darauf achten, dass das Eigelb bersten.
- Mit einer 1 ml-Eppendorf-Pipette vorsichtig sammeln die Allantoisflüssigkeit. Wenn nötig, kippen Sie das Ei ein wenig zur Seite, um so viel Flüssigkeit wie möglich zu sammeln.
- Kombinieren Sie die Allantoisflüssigkeit aller Eier in einen 50-ml-Kunststoff konischen Rohr. Während der Virusernte halten Röhrchen auf Eis zu allen Zeiten. Ein Ei Ausbeuten 5-10 ml eines leicht gelblichen Flüssigkeit.
- Drehe das virushaltige Allantoisflüssigkeit bei 1.000 × g für 10 min bei 46; C bis Trümmer zu pelletieren. Übertragen Sie die klare Flüssigkeit in eine neue 50-ml-Röhrchen auf Eis gehalten. Entsorgen Sie Eier in eine BSL-2 Abfallbehälter.
7. Lagerung
- Die geklärt Allantoisflüssigkeit (zB 50, 100 oder 500 ul Aliquote) sofort aliquotiert und Snap-freeze in flüssigem Stickstoff. Übertragen gefrorenen Virusstocks bis -80 ° C Gefrierschrank für langfristige Lagerung.
Ergebnisse
Mehrere Verfahren sind entwickelt worden, um Influenza-Virus zu titrieren. Eine Überlegung bei der Auswahl eines geeigneten Verfahrens ist, dass einige zu bestimmen Gesamtpartikel unabhängig von Lebensfähigkeit (zB Hämagglutinin-Assay), während andere auf die Infektiosität der Basis, die lebensfähigen Virionen bewertet wird (zB Plaque-Test) 6. Hier wurde der Virustiter von Allantoisflüssigkeit aus Hühnereiern mit einer Maus-adaptierten Influenzavirus (A / PR / 8/34) beimpft gesammelt durch Plaque-Assay (Figur 1) und Hämagglutinations-Assay (Figur 2) bestimmt.
Influenza-Virus-Infektion verursacht einen cytopathischen Effekt, der Plaques führen (circular Zonen lysierten Zellen), die auf einer Monoschicht von Zellen zu bilden. Plaques wurden durch Färbung der Zellen mit Kristallviolett sichtbar gemacht, und 65 Plaques wurden in der gut mit dem 10 -12 Virusverdünnung (Abbildung 1) gezählt. Da 500 l verdünnte virale Stamm wwie auf die Zellen gegeben, die endgültige Titer 1,3 x 10 14 PFU / ml.
Die Hämagglutinationstest ist ein Verfahren zur Influenzavirus basiert auf der Fähigkeit des Virus, an die Oberfläche der roten Blutzellen zu befestigen titrieren. Eine Virussuspension werden die roten Blutkörperchen agglutiniert und somit verhindern, dass sie das Absetzen aus der Suspension. Durch die Verwendung von seriellen Verdünnungen des Virus in einer 96-Well-Platte (entweder V- oder Rundboden) und Hinzufügen einer festen Anzahl von roten Blutzellen kann der Virustiter bestimmt werden. 2 10 Verdünnung des Virus in 50 ul (Bild 2): Ein klar negatives Ergebnis wurde mit dem 1 beobachtet. Daher ist der Endtiter 2,1 x 10 4 HAU / ml.
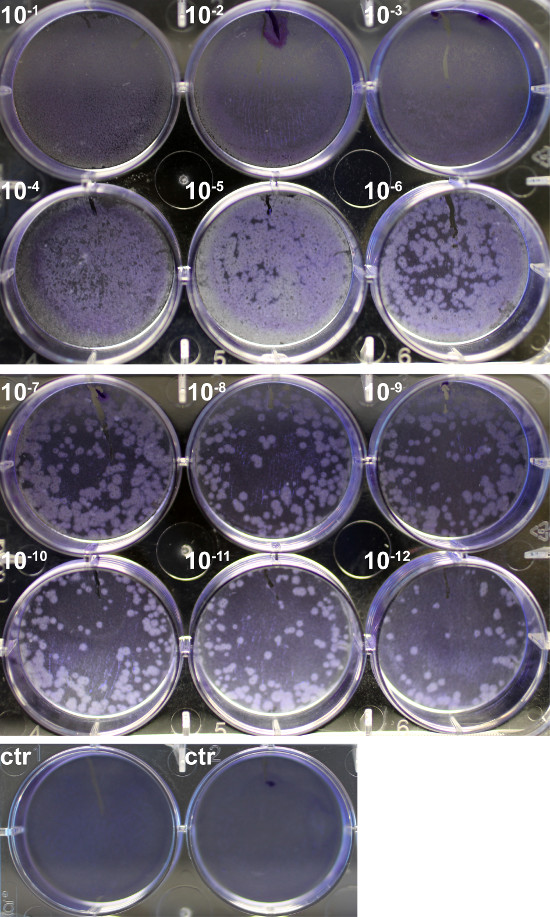
Abbildung 1. Quantifizierung der PR8 Virustiter durch Plaque-Assay. Eine Monoschicht von MDCK-Zellen wurden mit 10-facher seria infiziertl Verdünnungen PR8 (10 -1 - 10 -12) für 1 h, gewaschen und dann mit einem 0,6% Agarose-Lösung überschichtet. Nach Inkubation bei 37 ° C für 72 h wurde Agar sorgfältig entfernt, und die Zellen wurden fixiert und mit 0,25% Kristallviolett gefärbt. Plaquebildung wurde auf einem nicht infizierten Kontroll (ctr) zu vergleichen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
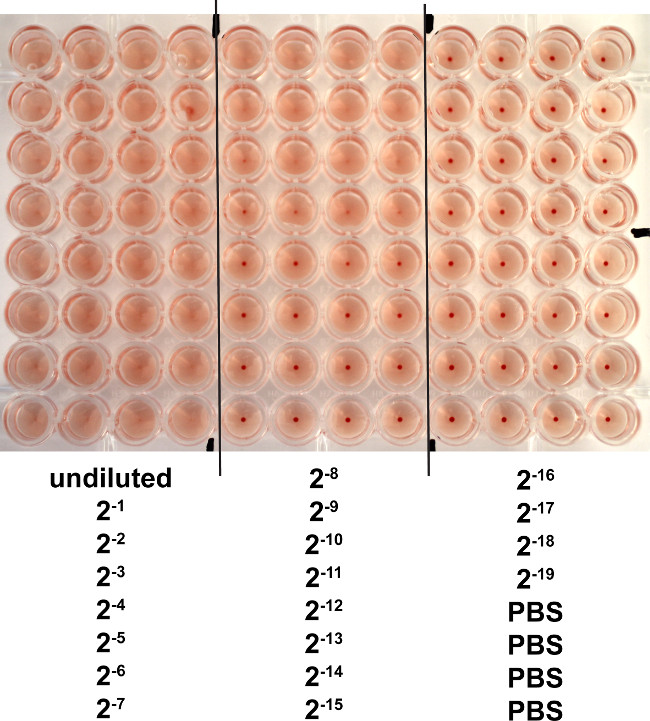
Abbildung 2. Hämagglutination (HA) Test zur Titer Egg stamm PR8 Influenza-Virus. PR8-Virus wurde seriell 2-fach verdünnt in PBS und mit 50 l von 0,5% Puten roten Blutkörperchen gemischt. Die Verdünnungen wurden vierfach vorbereitet, und Bilder wurden nach 1 Stunde Inkubation bei RT übernommen. Negative Ergebnisse werden als Punkte in der Mitte der Brunnen während positive Ergebnissebilden eine einheitliche rötliche Farbe in den Brunnen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Diskussion
Influenza verursacht einen großen globalen Krankheitslast, und die Arbeit geht weiter in das Verständnis der Pathogenese der Lungenschädigung 7. Erleichtert die Forschung in dieser tödlichen Krankheit, wurden verschiedene Verfahren entwickelt, um den Influenzavirus 6 ausbreiten. Hier beschreiben wir eine Technik, um Influenza-Virus in Hühnereiern produziert. Der Vorteil dieses Verfahrens ist, dass es in hohem Maße reproduzierbar ist und führt zu großen Mengen von hohem Titer Influenzavirusstämme, die oft für in vitro-Studien notwendig.
Die meisten Labore in der Lage, dieses Protokoll einfach und schnell mit minimaler Anlaufkosten zu entwickeln. Obwohl wir empfehlen, die Investition in ein Ei-Inkubator mit automatischer Wende kann dieses Protokoll ohne diese Geräte durchgeführt werden, wird aber aufwändiger sein. Wir empfehlen auch handelsübliche Forschungs Anbieter für den Kauf von befruchteten Eiern, um die Konsistenz und die Sterilität der Eier gewährleisten. Das Büro des Laboratory Tierschutz (OLAW) Interpretation des Public Health Service (PHS) Politik über humane Pflege und Verwendung von Labortieren heißt für die Forschung Verwendung von Live-embryonierten Hühnerkeimen, die die PHS Politik ist nur nach dem Schlüpfen anwendbar. Daher werden die meisten Institutionen nicht verlangen IACUC Genehmigung für dieses Protokoll. Allerdings Bedingungen ändern sich zwischen den Institutionen und vor der Einleitung dieses Protokoll wird die Genehmigung Institutional Biosafety Committee erforderlich.
Bei der Arbeit mit dem Virus, ist es von größter Bedeutung, das Virus bei 4ºC nach der Ernte der Allantoisflüssigkeit von infizierten bebrüteten Eier zu halten. Jedes Ei wird voraussichtlich zwischen 5-10 ml Allantoisflüssigkeit erzeugen, und der Titer abhängig von dem Stamm des Influenza-Virus. Unser Labor hat routinemäßig verwendet diese Methode, um eine Maus-adaptierten H1N1 Influenzastamm (A / PR / 8/34) zu verbreiten. Dieses Protokoll kann auch für klinische Proben aufgrund der p verwendet werden, aber in diesem Fall kann der Inokulation der Amnionhöhle bevorzugt seinresence 2,6-verknüpften Sialinsäuren notwendig für die Bindung innerhalb der Fruchtfutter 8,9. Eine weitere Überlegung ist, daß dieses Verfahren nicht ideal für die Vermehrung Geflügelpest-Viren (zB H5N1 Stämme) aufgrund der Pathogenität für den Embryo sein.
Verschiedene Verfahren zum Titrieren das Influenzavirus haben alle davon mit ihren Vor- und Nachteilen entwickelt. Tatsächlich können virale Quantifizierung sein Proteinbasis (beispielsweise Hämagglutinin-Assay, ELISA), Nukleinsäure-Basis (zB quantitative PCR) oder funktionellen (beispielsweise viralen Plaque-Assay) 6. Nicht-funktionale Tests wird insgesamt Virustiter unabhängig davon, ob sie leben oder tot Viruspartikel zu bestimmen. Deshalb testet für die Infektions Aktivität der Influenza-Virus misst lebenden Viren und ermöglichen eine vergleichbare funktionale Äquivalenz von Charge zu Charge. Die Plaque-bildenden Assay ist ein häufig verwendeter Test, der Titer lebender Influenza vir einschätzen können,us, aber umständlich und langsam bis 10 durchzuführen. Im Vergleich dazu ist das Hämagglutinin-Test einfach und unkompliziert, aber Lebensfähigkeit nicht bewerten und ermittelt alle Influenza-Partikel.
Hier bieten wir eine relativ einfache Methode, um hohe Titer Influenza-Virus zu verbreiten. Die de novo Initiation der diesem Protokoll in einem Labor ist unkompliziert, und die Ausgangsmaterialien und Ausrüstung sind relativ preiswert.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The present study was supported by the NIH grants HL120947 (P.C.), HL103868 (P.C.), and the American Heart Association Grant-in-Aid (P.C.)
Materialien
| Name | Company | Catalog Number | Comments |
| Phosphate buffered saline (PBS) | Cellgro | 21-040-CV | |
| serum pathogen-free (SPF) fertilized chicken eggs | VALO BioMedia | ||
| humidified egg incubator | FARM iNNOVATORS | Model 2100 | |
| automatic egg turner | FARM iNNOVATORS | Model 3200 | |
| egg candler | FARM iNNOVATORS | Model 3300 | |
| 1 ml syringe | BD Bioscience | 309659 | |
| 18G needle | BD Bioscience | 305196 | |
| 20G / 22G needle | BD Bioscience | 305176 / 305156 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Ethanol>99.5% | Sigma-Aldrich | 459844 | diluted to 70% using water |
| glue gun "Ad tech Hi Temp Project Pro" | Ad tech, Adhesive Technologies, Inc. | Model 1105 | |
| glue "Ad tech MINI SIZE, Multi Temp" | Ad tech, Adhesive Technologies, Inc. | 220-34ZIP30 | |
| MDCK cells | ATCC | CRL-2935 | |
| Washed Pooled Turkey Red Blood Cells, 10% | Lampire Biological Laboratories | 724908 |
Referenzen
- Centers for Disease Control and Prevention (CDC). Estimates of deaths associated with seasonal influenza --- United States, 1976-2007. MMWR. Morbidity and mortality weekly report. 59 (33), 1057-1062 (2010).
- Neumann, G., Noda, T., Kawaoka, Y. Emergence and pandemic potential of swine-origin H1N1 influenza virus. Nature. 459 (7249), 931-939 (2009).
- Tumpey, T. M., Garcia-Sastre, A., et al. Pathogenicity of Influenza Viruses with Genes from the 1918 Pandemic Virus: Functional Roles of Alveolar Macrophages and Neutrophils in Limiting Virus Replication and Mortality in Mice. J Virol. 79 (23), 14933-14944 (2005).
- Doherty, P. C., Turner, S. J., Webby, R. G., Thomas, P. G. Influenza and the challenge for immunology. Nat Immu. 7 (5), 449-455 (2006).
- Webster, R. G., Govorkova, E. A. Continuing challenges in influenza. Ann N Y Acad Sci. 1323 (1), 115-139 (2014).
- Szretter, K. J., Balish, A. L., Katz, J. M. Unit 15G.1 Influenza: propagation, quantification, and storage. . Current protocols in microbiology. , (2006).
- Short, K. R., Kroeze, E. J. B. V., Fouchier, R. A. M., Kuiken, T. Pathogenesis of influenza-induced acute respiratory distress syndrome. Lancet Infect Dis. 14 (4), 57-69 (2014).
- Ito, T., Suzuki, Y., et al. Differences in sialic acid-galactose linkages in the chicken egg amnion and allantois influence human influenza virus receptor specificity and variant selection. J Virol. 71 (4), 3357-3362 (1997).
- Robertson, J. S., Nicolson, C., Major, D., Robertson, E. W., Wood, J. M. The role of amniotic passage in the egg-adaptation of human influenza virus is revealed by haemagglutinin sequence analyses. J Gen Virol. 74 (Pt 10), 2047-2051 (1993).
- Gaush, C. R., Smith, T. F. Replication and plaque assay of influenza virus in an established line of canine kidney cells). Appl Microbiol. 16 (4), 588-594 (1968).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten