Method Article
在鸡胚的流感病毒传播
摘要
Fertile chicken eggs are widely used to produce large amounts of human influenza A virus as they provide a convenient and cost-effective system to prove high yields of virus.
摘要
流感与约36000人死亡,每年有超过20万的住院在美国的关联。新的流感病毒株引起的突变,并重新分类连续出现复杂的病毒控制,并有必要的新颖的药物和疫苗的永久发展。流感的实验室为基础的研究中,需要对病毒的传播有可靠和具有成本效益的方法。在这里,一个全面的协议是为A型流感病毒的传播在肥沃的鸡蛋,它始终产生高滴度的病毒股票。简言之,血清的无病原体(SPF)的受精鸡蛋孵育在37℃和55-60%湿度下10 - 11天。在此期间,胚胎发育,可以很容易地用一个鸡蛋烛台监测。病毒接种是通过注射病毒原液的成使用的针的尿囊腔。后在37℃下孵育2天,将蛋冷冻至少4小时,在4℃。上方的空气囊和尿囊膜蛋壳然后小心地打开,并含有病毒的尿囊液收获。流体从碎屑清除通过离心,等分并转移至-80℃长期储存。大量(5-10毫升的病毒含有每蛋流体)和高病毒效价通常与该协议实现作出了鸡蛋的病毒制备我们的有利方法的使用,特别是用于在体外研究需要大量病毒在其中需要同样的病毒股票的高剂量。
引言
甲型流感仍然是一个重大威胁人类健康。这是一个潜在的破坏性呼吸系统疾病有大型的全球性负担造成了全球每年1 500,000人死亡。流感病毒是在家庭正粘病毒和携带8负义单链RNA在它们的基因组1,2。病毒基因组的高可变性( 即抗原"漂移")防止长期免疫力。此外,流感是抗病毒的药物3日益抗性。
2009年甲型H1N1流感大流行强调所有流感病(流感病毒,抗病毒性,推迟疫苗的生产)相关的具有挑战性的问题。该疫苗配方是每年由世界卫生组织为最有可能致病的流感病毒株(分别为H1N1,H3N2和乙型流感)4确定。因为这种方法是基于预测流感病毒株S,致病菌株偶尔错误地标识和疫苗的有效性急剧下降。此外,新型流感病毒株的出现可以绕开造成流行病2这些预防计划。
一个通用流感疫苗的创作一直难以捉摸5。因此,研究必须继续为了解肺损伤的发病机制。到设施的实验室研究,几种方法已经被开发用于病毒分离和传播6。人流感病毒可以在多种哺乳动物细胞基质进行放大。然而,在大批量生成高滴度病毒最好在胚卵实现。以下协议描述的技术为A型流感病毒的传播和存储,从现有的病毒股票。
研究方案
注:总论:执行涉及操纵在无菌条件下的蛋的所有程序,和无菌技术应相应地使用。预清洁所有的设备用70%乙醇后再使用。在一般情况下,流感病毒接种和收获应在BSL-2实验室中进行。但是,如果该协议被用于传播更多的致病性流感病毒( 例如 ,流感大流行和大流行前的菌株,即危及家禽和牲畜,人感染高致病性禽流感毒株,1918年的H1N1病毒株),更高的生物安全水平,在某些情况下,生物安全防范措施和授权是必需的。当地生物安全委员会应批准涉及流感病毒的所有研究工作。
1.准备鸡蛋的接种
- 从合适的供应商处获得的血清的无病原体(SPF)的新鲜受精禽卵。通常情况下,鸡卵被使用。鸡蛋应该是我们ED抵达后立即。
- 抵达后的地方鸡蛋一个鸡蛋加湿孵化器与自动鸡蛋特纳经常转动鸡蛋。如果自动鸡蛋特纳不可用,手动旋转鸡蛋一天(一定要戴上手套并保留一切无菌地)至少2-3次。
- 孵化卵在37℃和55-60%湿度为10-11天。
2.鸡蛋烛
- 用一个鸡蛋烛台检查对着明亮光线的鸡蛋在一个黑暗的房间通过后约7或8天的潜伏期烛检查鸡蛋不育。
- 擦蛋烛台,用70%的乙醇。经常更换手套和用70%乙醇消毒,以减少污染的病原体的风险。
- 从孵化器中取出卵子,并将它们放在空的鸡蛋盒。
- 关灯的房间。
- 保持每个鸡蛋一体的大型月底在对烛台时间。
- 观察蛋determinË如果是肥沃还是贫瘠。
注:细血管导致豆形胚应清晰可见。未受精的卵子会出现一个小血点有明显的蛋黄。
- 丢弃卵是受精,并返回可行蛋的孵化器。不要让鸡蛋孵化器外超过30分钟。如果一个鸡蛋的状态不能得到证实,将其标记,后来观察它。
3.编写病毒的接种
- 稀释的流感病毒原液至约10 3 -在无菌PBS中含有10mM HEPES(pH 7.4)中10 4 PFU / ml的。关键的一步:在使用前稀释病毒的股票,并保持病毒稀释冰上所有的时间。
通过尿囊路线4.流感病毒接种
- 在病毒接种(10天或11)的一天,再次蜡烛鸡蛋和消除任何死胚。区分活胚胎通过找蛋内运动。
- 从培养箱中取出三个鸡蛋,并安排在鸡蛋中与空气囊一个单独的支架。
- 纪念鸡蛋用永久性记号笔的领空。
- 洗蛋壳,用70%的乙醇的空气空间的上方。
- 把鸡蛋与空气的空间在一个鸡蛋纸箱和成生物安全罩(BSL-2)。
- 使用无菌18G针头打一个小孔,在外壳上每个鸡蛋的空气囊。要注意不要插入针过深,以免刺伤胚胎或蛋黄。
- 拟定稀释流感病毒进入无菌1ml注射器,并附加一个22G针头。
- 认真推进针注射器以45°角插入尿囊腔。
- 注入0.2毫升稀释的流感病毒。
- 重复注射与其他两个鸡蛋,然后丢弃的注射器和针头。
- 密封带从胶枪(或熔融石蜡)一滴粘结剂的孔。 BË小心,胶水不漏蛋内。
- 将鸡蛋放回蛋孵化器与空气空间指向向上。
- 重复步骤4.2 - 4.12,直到所有的鸡蛋都已经接种。
5.孵化时间
- 孵育感染鸡蛋无需转动,在37℃和〜60%的湿度。
- 选择最佳孵育时间取决于流感病毒的类型。孵化甲型流感48小时;孵育流感B和C为72小时。
6.流感病毒收获
- 经过潜伏期,寒意鸡蛋在4℃最少4小时(或O / N)杀死胚胎和收缩血管,减少污染的血液被感染的尿囊液的风险。这样做是为了防止红血细胞从吸收的病毒,从而降低了产率。可替代地,寒意鸡蛋30分钟在-20℃;然而,这会增加血液污染的风险。
- 之后的鸡蛋被充分冷却,卵转移到生物安全罩。将蛋与气囊朝上牢固夹持。清洁蛋表面用70%的乙醇。
- 用无菌剪刀打开上方的空气囊的蛋壳。周围的空气囊去掉外壳,注意不要破坏绒毛尿囊膜。
- 打开绒毛尿囊膜,用无菌钝钳。轻轻移动胚胎和卵黄囊用小刮刀或汤匙放在一边。小心不要破裂的蛋黄。
- 用1毫升的Eppendorf移液器,仔细收集尿囊液。如果需要的话,倾斜鸡蛋有点一边收集尽可能多的流体越好。
- 组合来自所有鸡蛋尿囊液到50ml的塑料离心管中。保持病毒收获期间冰在任何时候都管。一个鸡蛋产量5 - 10毫升一个淡黄色的液体。
- 旋转含有病毒的尿囊液在1000×g离心,在4 10分钟6℃到沉淀杂物。转移透明流体到一个新的50ml管中保持在冰上。配置鸡蛋放入一个BSL-2的废弃物容器。
7.储存
- 立即等分澄清尿囊液( 例如,50,100或500微升等分试样)和单元冷冻在液氮中。传输冻病毒储存至-80℃冰箱长期保存。
结果
多种方法已经发展到滴定流感病毒。当选择适当的方法之一的考虑是,某些确定总颗粒无论活力( 例如 ,血凝素测定法),而其他人都基于感染性的,这将评估存活的病毒颗粒( 例如 ,空斑测定)6。此处,尿囊液的病毒滴度从接种小鼠-适应的流感病毒(A / PR / 8/34)鸡卵收集空斑测定( 图1)和血凝试验( 图2)进行测定。
流感病毒感染会导致导致斑块病变效应(裂解的细胞的圆形区域),以形成对细胞单层。噬斑通过用结晶紫染色的细胞可视化,和65噬菌斑计数,在很好地与10 -12稀释病毒的( 图1)。由于500升稀释病毒原料瓦特作为放置在电池中,最终的滴度是1.3×10 14 PFU / ml的。
的血细胞凝集测定法是一种方法,以滴定流感病毒碱基对病毒附着于红血细胞的表面上的能力。以病毒悬浮液将凝集红细胞,从而防止它们沉淀出来停牌。通过使用病毒的系列稀释液在96孔平板(或者V形或圆形底部)和加入的红血细胞的固定量,病毒滴度可以被确定。甲明显的负面结果,观察与1:2 10稀释的病毒在50μl( 图2)。因此,最终的滴度是2.1×10 4 HAU / ml的。
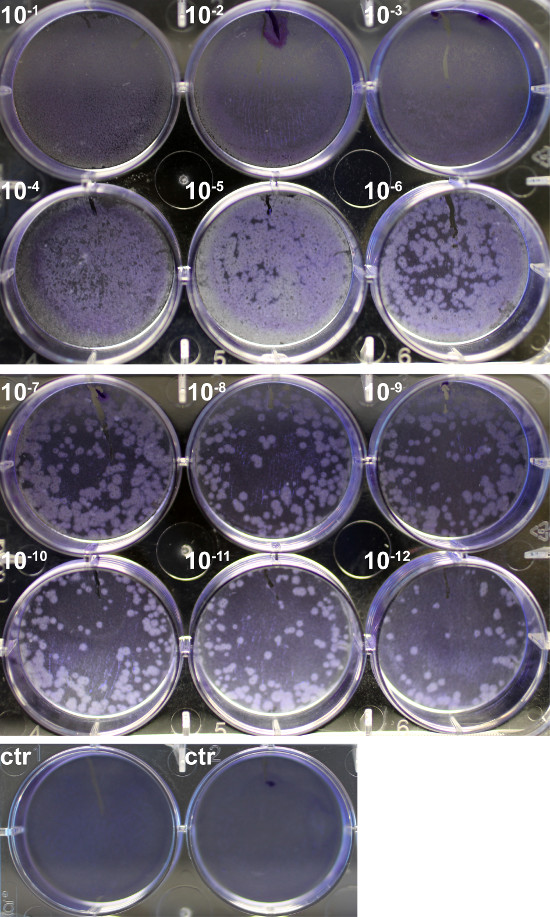
图1.通过空斑测定PR8病毒滴度进行定量。MDCK细胞单层感染了10倍赛瑞亚PR8的升稀释液(10 -1 - 10 -12)1小时,洗涤,然后覆盖有0.6%的琼脂糖溶液。孵育在37℃下72小时后,琼脂,小心地除去,将细胞固定并用0.25%结晶紫。斑块形成是比较未受感染的控制(CTR)。 请点击此处查看该图的放大版本。
图2.血凝(HA)测定法来滴定蛋衍生PR8流感病毒。PR8病毒被连续稀释2倍的PBS中,并用50微升0.5%火鸡红细胞混合。稀释液一式四份准备,经过1小时的潜伏期在室温下的照片拍摄。阴性结果显示为孔,而阳性结果的中心点形成跨越以及统一的颜色偏红。 请点击此处查看该图的放大版本。
讨论
流感导致疾病的一个大的全球负担,工作持续到了解肺损伤7的发病机制。以促进研究在这种致命的疾病,各种方法已经被开发来传播的流感病毒6。这里,我们描述了一种技术,以产生流感病毒在鸡卵。这种方法的优点是,它是高度可重复的,并导致大量的高滴度流感病毒的股票,这往往是必需的体外研究。
大多数实验室将能够快速,轻松地开发该协议以最少的启动成本。尽管我们建议投资于一个鸡蛋孵化器自动车工,该协议可没有这样的设备来完成,但会更费力。我们还建议使用商业研究供应商的报价受精卵以保证鸡蛋的一致性和不育。实验室及其他实验室办公室在人文关怀和使用实验动物的公共卫生服务(PHS)政策ORY动物福利(OLAW)解释规定为研究用活胚鸟蛋的是,小灵通的政策只适用孵化后。因此,多数机构将不需要IACUC批准该协议。然而,政策制度各不相同,而且生物安全委员会批准,将需要启动该协议之前。
当带有病毒的工作,这是最重要的,保持病毒在4℃收获从感染鸡胚尿囊液后。每个蛋预计5-10毫升尿囊液之间产生,和滴度取决于流感病毒的毒株。我们实验室已经经常使用这种方法来传播鼠标适应H1N1流感病毒株(A / PR / 8/34)。该协议也可以用于临床样品,但在这种情况下,接种羊膜腔的可能是优选的,由于在p2,6-联唾液酸resence所需的羊膜衬里8,9内结合。另一个要考虑的是,这种方法可能并不理想传播禽流感病毒( 例如 H5N1毒株)由于病原性的胚胎。
滴定流感病毒的各种方法已经开发都具有各自的优点和缺点。实际上,病毒定量可以是基于蛋白质( 例如 ,血凝素测定法,ELISA),核酸类( 例如 ,定量PCR),或功能( 例如 ,病毒噬菌斑测定)6。不管它们是活的或死的病毒颗粒的非功能性测定法将测定总病毒滴度。因此,测试的流感病毒的感染活性将测量活病毒,并允许媲美的功能等同的很多很多。该噬斑形成测定法是一种常用的测定法,可以评估活流感VIR滴度我们,但也可以是缓慢和麻烦来执行10。相比较而言,血凝素测定法是简单明了的,但不评估存活力,并确定所有流感颗粒。
这里,我们提供了一个相对简单的方法来传播的高滴度的流感病毒。 从头开始该协议在一个实验室的是直接的,而原料和设备相对便宜。
披露声明
The authors have nothing to disclose.
致谢
The present study was supported by the NIH grants HL120947 (P.C.), HL103868 (P.C.), and the American Heart Association Grant-in-Aid (P.C.)
材料
| Name | Company | Catalog Number | Comments |
| Phosphate buffered saline (PBS) | Cellgro | 21-040-CV | |
| serum pathogen-free (SPF) fertilized chicken eggs | VALO BioMedia | ||
| humidified egg incubator | FARM iNNOVATORS | Model 2100 | |
| automatic egg turner | FARM iNNOVATORS | Model 3200 | |
| egg candler | FARM iNNOVATORS | Model 3300 | |
| 1 ml syringe | BD Bioscience | 309659 | |
| 18G needle | BD Bioscience | 305196 | |
| 20G / 22G needle | BD Bioscience | 305176 / 305156 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Ethanol>99.5% | Sigma-Aldrich | 459844 | diluted to 70% using water |
| glue gun "Ad tech Hi Temp Project Pro" | Ad tech, Adhesive Technologies, Inc. | Model 1105 | |
| glue "Ad tech MINI SIZE, Multi Temp" | Ad tech, Adhesive Technologies, Inc. | 220-34ZIP30 | |
| MDCK cells | ATCC | CRL-2935 | |
| Washed Pooled Turkey Red Blood Cells, 10% | Lampire Biological Laboratories | 724908 |
参考文献
- Centers for Disease Control and Prevention (CDC). Estimates of deaths associated with seasonal influenza --- United States, 1976-2007. MMWR. Morbidity and mortality weekly report. 59 (33), 1057-1062 (2010).
- Neumann, G., Noda, T., Kawaoka, Y. Emergence and pandemic potential of swine-origin H1N1 influenza virus. Nature. 459 (7249), 931-939 (2009).
- Tumpey, T. M., Garcia-Sastre, A., et al. Pathogenicity of Influenza Viruses with Genes from the 1918 Pandemic Virus: Functional Roles of Alveolar Macrophages and Neutrophils in Limiting Virus Replication and Mortality in Mice. J Virol. 79 (23), 14933-14944 (2005).
- Doherty, P. C., Turner, S. J., Webby, R. G., Thomas, P. G. Influenza and the challenge for immunology. Nat Immu. 7 (5), 449-455 (2006).
- Webster, R. G., Govorkova, E. A. Continuing challenges in influenza. Ann N Y Acad Sci. 1323 (1), 115-139 (2014).
- Szretter, K. J., Balish, A. L., Katz, J. M. Unit 15G.1 Influenza: propagation, quantification, and storage. . Current protocols in microbiology. , (2006).
- Short, K. R., Kroeze, E. J. B. V., Fouchier, R. A. M., Kuiken, T. Pathogenesis of influenza-induced acute respiratory distress syndrome. Lancet Infect Dis. 14 (4), 57-69 (2014).
- Ito, T., Suzuki, Y., et al. Differences in sialic acid-galactose linkages in the chicken egg amnion and allantois influence human influenza virus receptor specificity and variant selection. J Virol. 71 (4), 3357-3362 (1997).
- Robertson, J. S., Nicolson, C., Major, D., Robertson, E. W., Wood, J. M. The role of amniotic passage in the egg-adaptation of human influenza virus is revealed by haemagglutinin sequence analyses. J Gen Virol. 74 (Pt 10), 2047-2051 (1993).
- Gaush, C. R., Smith, T. F. Replication and plaque assay of influenza virus in an established line of canine kidney cells). Appl Microbiol. 16 (4), 588-594 (1968).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。