Method Article
Elektroporation von Functional bakterielle Effektoren in Säugerzellen
In diesem Artikel
Zusammenfassung
Electroporation was used to insert purified bacterial virulence effector proteins directly into living eukaryotic cells. Protein localization was monitored by confocal immunofluorescence microscopy. This method allows for studies on trafficking, function, and protein-protein interactions using active exogenous proteins, avoiding the need for heterologous expression in eukaryotic cells.
Zusammenfassung
Die Untersuchung von Protein-Interaktionen in Zusammenhang mit lebenden Zellen können wichtige Informationen über die Lokalisierung, Dynamik und Interaktionspartner zu erzeugen. Diese Informationen sind im Rahmen der Wirt-Pathogen-Interaktionen besonders wertvoll. Viele Erregerproteine Funktion innerhalb von Wirtszellen in einer Vielzahl von Art und Weise, wie ermöglichen Umgehung des Immunsystems des Wirts und das Überleben in der intrazellulären Umgebung. Um diese Pathogen-Protein-Host-Zell-Wechselwirkungen zu untersuchen, werden verschiedene Ansätze häufig verwendet, unter anderem: in vivo-Infektion mit einem Stamm ein markiertes oder mutierte Protein, oder Einführung von Pathogen-Gene mittels Transfektion oder Transduktion exprimieren. Jeder dieser Ansätze hat Vorteile und Nachteile. Wir suchten ein Mittel, um exogene Proteine direkt in die Zellen einzuführen. Die Elektroporation wird üblicherweise verwendet, um Nukleinsäuren in Zellen einzuführen, wurde jedoch seltener auf Proteine angewandt, obwohl die biophysikalischen Basis ist genau die gleiche.Ein Standard Elektroporator wurde verwendet, um affinitätsmarkierten bakterielle Effektoren in Säugetierzellen einzuführen. Humanen epithelialen und Maus-Makrophagen-Zellen wurden durch traditionelle Methoden kultiviert, freistehend, und in 0,4 cm Abstand Elektroporationsküvetten mit einem exogenen bakteriellen Erreger Protein von Interesse (zB Salmonella Typhimurium GtgE) platziert. Nach der Elektroporation (0,3 kV) und einem kurzen (4 h) Erholungsperiode wurde die intrazelluläre Protein durch Fluoreszenzmarkierung, die das Protein über seine Affinitätsmarkierung und, die räumliche und zeitliche Verteilung von konfokaler Mikroskopie verifiziert. Die elektroporierten Protein wurde auch gezeigt funktionellen innerhalb der Zelle und in der Lage, korrekte subzelluläre Handel und Protein-Protein-Wechselwirkung zu sein. Während die exogenen Proteine eher auf der Oberfläche der Zellen zu akkumulieren, war die elektroporierten Proben große Erhöhungen der intrazellulären Effektors Konzentration bezogen auf allein Inkubation. Das Protokoll ist einfach und schnell genug, um in ap geschehenarallel Mode, so dass für Hochdurchsatz-Charakterisierung der Erreger Proteine in Wirtszellen einschließlich subzelluläre Targeting und Funktion Virulenzproteine.
Einleitung
Viele Gram-negative Bakterien zu verwenden spezialisierte Sekretionssysteme zur Virulenz-verwandte Proteine (die als Effektoren bezeichnet) direkt in die Wirtszellen 1-5 injizieren. Diese Effektoren haben eine breite Palette von biologischen Funktionen, einschließlich: Unterdrückung der Wirtsimmunität, Zytoskelett-Änderungen, Änderung der intrazellulären Transport und Signalisierung, Transkriptionsänderungen und Gastgeber Proteasom Änderungen 9.6. Die Funktionen einiger Effektoren sind bekannt, aber die Wirts Ziele und biochemische Wirkung (en) von vielen anderen noch bestimmt werden. Beim Vergleich Wildtyp und rekombinante bakterielle Infektionen ist ein gültiger Ansatz für die intrazelluläre Effektor Virulenzmechanismen studieren, ist es oft von Vorteil, ein individuelles Effektor in die Wirtszelle einzuführen. Somit ist eine einfache Verfahren zum Einbringen und zur Charakterisierung bakterieller Effektor-Proteine im Rahmen von Wirtszellen sehr wünschenswert.
Die Vereinfachung des experimentellen Analyse with eine einzige Effektor ist kritisch, da andere Effektoren können gegnerische oder redundante Funktionen haben. Um diese Vereinfachung zu erreichen, haben die Forscher bereits vorgestellten Makromolekülen in Zellen durch viele verschiedene Methoden, einschließlich der Virusübertragung 10, die Mikroinjektion 11, kratzen Laden 12,13, Zellfusion mit chemisch induzierten Mikroinjektion 14, proprietären Protein "Transfektion" Reagenzien 15, Calciumphosphat Niederschläge 16, 17-20 und Elektroporation. Die eingeführten Moleküle reichen von Nukleinsäuren, einschließlich DNA, RNA, & RNAi-Spezies auf Proteine, zellundurchlässigen Farbstoffen und Antikörpern für die intrazelluläre Targets 21,22. Einige Methoden haben ihre Grenzen, einschließlich der Art von Makromolekülen, die eingeführt werden können, und insbesondere Downstream-Analysen können durch hohe Zelltoxizität, schädlichen Wirkungsmechanismen, geringe Wirksamkeit oder Einführung Effizienz beschränkt. Transfektion, eine often-Methode zur Expression bakterieller Gene in Säugerzellen, leidet auch die Einschränkung, dass einige wichtige Wirtszelltypen, wie beispielsweise Makrophagen und primäre Zellen, sind besonders resistent gegenüber der Transfektion. Darüber hinaus ist es schwierig, das Niveau der Bakterienprotein bei Einführung von Fremd-DNA hergestellt steuern.
Viel Arbeit wurde die Elektroporation von Nukleinsäuren in beiden bakteriellen und Säugerzellen als gemeinsame Labortechnik etablierten; jedoch gibt es ständige Suche nach der besten Methoden für die Bereitstellung Proteine in Zellen unter physiologischen Bedingungen. Berichte über Protein Transfektion sind vielversprechend, aber teure Reagenzien und Optimierung. Der Wunsch, die potentiell toxischen Bakterien Effektoren in eine Vielzahl von Zell Ziele mit minimalen Kosten einführen führte uns zur Elektroporation als Mittel zur Untersuchung dieser Proteine in vivo zu prüfen.
Protein Elektroporation 23-25 ist ein eingehaltenhod, Proteine in lebenden Zellen über Elektropermeabilisierung, auch als elektro-Transfektion oder elektro-Injektion 26 bekannt vor. Diese Technik verwendet hoher Intensität elektrischer Impulse an Poren in den Zellmembranen zu erstellen. Diese reversible Poren ermöglichen Makromoleküle, die normalerweise von intrazellulären Raum ausgeschlossen sind die Zelle zu gelangen. Nach dem Entfernen des äußeren elektrischen Feldes kann die Membran verschließen, so dass die Zelle auf Moleküle, die durch die Poren 27,28 geführt zu halten.
Ein Standard-Elektroporator in dieser Studie verwendet, um bakterielle Effektoren in beiden Maus Makrophagen-ähnlichen Zellen und humane Epithelzellen konsequent einzuführen. Das Verfahren ist schnell, effizient und kostengünstig ist, ohne nennenswerte Verringerung der zellulären Lebensfähigkeit. Die eingebrachten Proteine durch Immunfluoreszenzmikroskopie sichtbar oder für funktionelle Assays verwendet werden. Dies wurde unter Verwendung von grün fluoreszierendem Protein (GFP) als einen nicht-toxischen Standard gezeigt, sowiezwei Salmonella-Effektor-Proteine, SspH1 und GtgE. Wir schlagen Protein Elektroporation als zusätzliches Werkzeug in der Literatur für die Untersuchung der bakteriellen Virulenz-Proteine und ihre Funktionen in eukaryotischen Wirtszellen.
Protokoll
1. Bereiten Sie im Voraus
- Warme sterile phosphatgepufferte Salzlösung (PBS) auf 37 ° C.
- Warme Dulbecco modifiziertes Eagle-Medium (DMEM) und Minimal Essential Medium (MEM) mit 10% fötalem Rinderserum (FBS), 100 IU / ml Penicillin und 100 ug / ml Streptomycin und 37 ° C. Hinweis: Diese stellen das normale Wachstum Medien (NGM) für RAW und HeLa-Zellen auf.
2. Herstellung von Zellen
- Wachsen RAW 264.7 Zellen 70-90% Konfluenz in NGM.
- Pflegen Zellen bei 37 ° C in einer befeuchteten 95% Luft / 5% CO 2 Atmosphäre.
- Wachsen HeLa-Zellen zu 70-90% Konfluenz in NGM.
- Pflegen Zellen bei 37 ° C in einer befeuchteten 95% Luft / 5% CO 2 Atmosphäre.
- Vor der Sammlung, waschen Zellmonolayer einmal mit sterilem PBS.
- Sammeln vorge konfluenten Zellen in einem sterilen konischen Röhrchen.
- Sanft kratzen RAW-Zellenmit einem Gummischaber in PBS, mit wiederholtes Pipettieren zu Zellverbänden zu zerstreuen.
- Nehmen HeLa-Zellen mit 0,25% Trypsin-Lösung, bis die visuelle Untersuchung zeigt Distanzierung von Kulturoberfläche. Verwenden Sie beispielsweise 2 bis 3 ml für eine T-75-Kolben. Stellen Sie die Lautstärke entsprechend zu, um sicherzustellen, Trypsin-Lösung deckt gesamte Wachstumsoberfläche.
- Stillen Sie Dissoziationsreaktion mit NGM 10% FBS enthielt.
- Verwenden Sie mindestens zwei Mal die Lautstärke der NGM zu Trypsin, mit wiederholtes Pipettieren zu Zellverbänden zu zerstreuen.
- Leicht pelletisieren Zellen durch Zentrifugation bei 900 × g für 4 min.
- Resuspendieren in demselben Volumen wie Trypsin / Quench-Lösung mit sterilem PBS.
- Zählen von Zellen mit Hämozytometer oder Partikelzähler.
- Leicht pelletisieren Zellen durch Zentrifugation bei 900 × g für 4 min.
- Resuspendieren in ausreichenden Volumen PBS für 5,5 x 10 6 bis 6,0 × 10 6 Zellen / ml. Hinweis: Zum Beispiel wird eine T-75-Kolben approxim AusbeuteLICH 7,5 x 10 6 Zellen 29.
- Halten Zellsuspension auf Eis, bis die Elektroporation.
3. Vorbereitung für die Elektroporation
- Vorkühlung Elektroporationsküvetten (0,4 cm Abstand) auf Eis.
- Schalten Sie Elektroporationseinrichtung und stellen Sie die Spannung bis 0,3 kV.
HINWEIS: Die Kapazität und Widerstand nicht veränderbaren Einstellungen auf unserer Elektroporator (bei 10 & mgr; F und 600 Ω vom Hersteller festgelegt). - Füllen Erholung Platten mit NGM und äquilibrieren in befeuchteter 95% Luft / 5% CO 2 -Atmosphäre bei 37 ° C
4. Die Elektroporation
- Platzieren 400 ul Zellsuspension in vorgekühlte Küvetten überführen und 20 ug des ausgewählten Proteins zur Küvette (50 ug / ml).
- Flick Küvette vorsichtig ~ 10 Mal ohne Beschädigung Zellen mischen. Hinweis: Die Küvette kann auch mehrmals umgedreht werden, um gründlich zu mischen, aber nicht auf- und abpipettieren oder Wirbel zu beschädigen Zellen.
- Dry außerhalb der Küvette mit einem Papiertuch oder einem anderen Wischer um elektrische Überschläge in der Elektroporator vermeiden.
- Elektroporieren Probe bei 0,3 kV für 1,5 bis 1,7 ms. Hinweis: Das war typisch für diese Studie.
- Unmittelbar nach der Elektroporation Flick Küvette vorsichtig ~ 10-mal zu durchmischen.
5. Überzug von Zellen
- Shop Küvette mit elektroporierten Zellen auf Eis, bis Sie sie in stabile Seitenplatten zu platzieren.
- Für die meisten Downstream-Analysen, waschen Sie die Zellen 1x mit vorgewärmter NGM auf fremde Effektor-Protein zu entfernen.
- Entfernen Zellen für die Analyse und Aussetzung in 3-5 ml NGM.
- Pelle Zellen durch Zentrifugation bei 900 × g für 4 min.
- Resuspendieren in angemessenen Volumens NGM für gewünschte Plattengröße (zB 2 ml für 35-mm-Schale).
- Entfernen Sie entsprechende Menge an Zellen für nachfolgende Analyse.
- Beispiel 1: Platte in Glasbodenschalen für die Mikroskopie Analyse.
- Beispiel 2: Platte into Zellkultur-Kunststoff für die Proteinanalyse wie Affinitätsreinigungen.
- Sodass die Zellen im äquilibriertem Platten in befeuchteter 95% Luft / 5% CO 2 -Atmosphäre bei 37 ° C für mindestens 4 Stunden zu erholen.
6. Mikroskopie Analyse
6.1) Befestigung / Immunfluoreszenzfärbungen
- Waschen Sie die Zellen 1x mit sterilem PBS nach 4 Stunden Erholungsphase.
- Fix-Zellen in 100% Methanol für 2 min bei Raumtemperatur. Verwenden Sie ausreichend Methanol vollständig zu bedecken Zellen (zB 2 ml für 35-mm-Schale).
- Jeweils 3x mit sterilem PBS.
- Permeabilisieren Zellen mit 0,4% Triton X-100 in PBS für 15 min. Verwenden Sie beispielsweise 1 ml für eine 35 mm Durchmesser Teller.
- Einzustellen Länge Permeabilisierung und Stärke von Triton X-100 nach Epitop und Lage des Zielproteins. Hinweis: Die besten Ergebnisse müssen empirisch für jedes Ziel festgelegt werden, aber die oben genannten Bedingungen sollte für die meisten c seinytosolic Ziele.
- Blockieren mit 5% Rinderserumalbumin (BSA) in PBS für 1 h bei RT. Verwenden Sie beispielsweise 1 ml für eine 35 mm Durchmesser Teller.
- Jeweils 3x mit PBS.
- Inkubieren primären Antikörper in Antikörperbindungslösung (0,1% Triton X-100 und 1% BSA in PBS) über Nacht bei 4 ° C unter leichtem Schütteln. Verwenden Sie beispielsweise 0,5 ml für eine 35 mm Durchmesser Teller.
- Folgen Sie den Empfehlungen des Herstellers für die Antikörperverdünnung. Anmerkung: Beispielsweise wurde die Streptavidin-Bindungspeptid-Tag (SBP-tag) Antikörper in einer 1: 1000 Verdünnung, während die PKN1 Antikörper wurde in 1: 200-Verdünnung.
- Waschen Sie 4x mit PBS.
- Inkubieren mit entsprechenden fluoreszenz konjugierten sekundären Antikörpers in Antikörper-Bindungslösung für 1 h bei Raumtemperatur und vor Licht geschützt.
- Beispielsweise verwenden Alexa 488 oder Alexa 647 für 1 h bei Raumtemperatur.
- Folgen Sie den Empfehlungen des Herstellers für antibody Verdünnung. (Beispielsweise etwa 1: 1.000 für diese Studie).
- Andere Verschmutzungen wie erforderlich, beispielsweise 5 & mgr; M Wheat germ agglutinnin (WGA) Alexa 647 oder DAPI konjugiert gemäß der Empfehlung des Herstellers, für 1 Stunde bei Raumtemperatur.
- Beispielsweise verwenden Alexa 488 oder Alexa 647 für 1 h bei Raumtemperatur.
- Wash 5x mit PBS und bei 4 ° C, vor Licht geschützt, bis Sie sie Bild.
6.2) Die konfokale Mikroskopie und Bildanalyse
- Bild Proben auf einem invertierten konfokalen Mikroskop mit einem 63x Ölimmersionsobjektiv.
- Bild Grün-Kanal mit dem 488 nm-Linie eines Argon-Laser, mit einer Bandbreite von 492 bis 542 nm Emission zwischen.
- Bild Rot-Kanal mit einem 633 nm Diodenlaser, mit einer Bandbreite von 640 bis 718 nm Emission zwischen.
- Bild Blau-Kanal mit einem 405 nm Diodenlaser, mit einer Bandbreite von 407 bis 453 nm Emission zwischen.
- Sicherstellen, dass die Mehrkanal-Z-Stapel umfassen die Gesamtheit der Zellvolumen.
- Prozessbilder mit entsprechenden Bildbearbeitungssoftware.
7. Affinitätsreinigung
- Nach 4 Stunden Erholungsphase waschen elektroporierten Zellen zweimal mit 4 ° C PBS.
- Lyse mit ~ 1,0 ml Lysepuffer (1% Triton X-100 mit einem Protease-Inhibitor-Cocktail und Phosphatase-Inhibitor in PBS) auf Eis. Verwenden Inhibitoren gemäß Herstellerangaben. Hinweis: Zum Beispiel können sowohl die Phosphatase und Protease-Inhibitoren in dieser Studie verwendet wurden 100x zugeführt wird, aber auch andere Formulierungen sollten gleich gut funktionieren.
- Prompt kratzen Zellen mit Gummiwischer und sammeln in konische Röhrchen.
- Lyse durch kräftiges Vortexen und Ultraschall. Hinweis: Andere Lyse-Verfahren kann genauso gut funktionieren, aber die Effizienz müssen empirisch über die Eignung der Testanforderungen bestimmt werden.
- Beschallen 3 x 30 sec mit intermittierendem Vortexen.
- Zentrifuge bei 10.000 g für 10 min bei 4 ° C zu sammelnZelltrümmer und unlösliche Aggregate; speichern Sie den Überstand.
- Kombinieren gleicher Volumina (~ 1,0 ml) von elektroporiert Zelllysats mit 50 ul Streptavidin-Agarose-Harz Suspension bei 4 ° C über Nacht mit end-over-end-Rotation. Hinweis: Dieses Harz fängt die elektroporierten Protein (und die damit verbundenen Komplexe) über seine Streptavidin-Bindungspeptid Affinitätstag.
- Zentrifugieren bei 2.500 g für 2 min und Überstand verwerfen.
- Zweimal waschen mit 40 Bettvolumen (~ 1 ml) PBS.
- Zugabe von 30 & mgr; l 4x LDS-Ladepuffer (141 mM Tris-Base, 2% LDS, 10% Glycerol, 0,51 mM EDTA, 0,22 mM SERVA Blau G, 0.175 mM Phenolrot, pH 8,5), 20 ul DIH 2 O und 1 ul 0,5 M Tris (2-carboxyethyl) phosphin (TCEP), gleichzeitig für eine gewisse Volumen in Kügelchen bleiben.
- Wärme bei 95 ° C für 10 Minuten und kühle auf Eis.
- Spin> 10,000 × g bei 4 ° C für 5 min.
- Sammeln Stand.
- Führen Sie eine Western-Blot unter Verwendung geeigneter Antikörper Hinweis: Erre, Anti-PKN1 primären Antikörper verwendet.
Ergebnisse
Als ersten Beweis des Konzeptes wurde gereinigtes grün fluoreszierende Protein erfolgreich in Säugerzellen unter Verwendung Elektroporation eingeführt. GFP, eine ungefähre 27 kD ein Molekulargewicht Protein wird üblicherweise in Säugerzellen (in der Regel aus dem Plasmid DNA exprimiert) als Molekularbiologie Werkzeug ohne signifikante zelluläre Toxizität eingeführt. HeLa-Zellen wurden inkubiert (Figur 1A) oder durch Elektroporation (1B) mit 25 ug / ml GFP, gefolgt von Immunfluoreszenz konfokale Mikroskopie für fluoreszierende GFP-Signal zu überprüfen. Um zu demonstrieren, dass die GFP war innerhalb des zellulären Cytosol wurden die Zellen auch mit Weizenkeim-Agglutinin (WGA), das cytosolische Grenze (rot) abzugrenzen, sowie eine Nukleinsäurefarbstoff DAPI (blau) gefärbt, um den Kern zeigen. Intrazellulären GFP-Signal wurde nur nach der Elektroporation beobachtet, während keine intrazelluläre Protein in Zellen, die mit GFP inkubiert wurden. Ähnliche Ergebnisse wurden mit RAW264.7 Maus beobachtetMakrophagen-ähnliche Zellen (1C und 1D). Man beachte, dass WGA ein Lectin bindet vorzugsweise an den Resten in der Plasmamembran und damit kann gepunktetes Färbungs basierend auf der Länge der Inkubation zeigt. Vergleichen 1A und 2A, wobei 2A wurde für eine längere Dauer als 1A inkubiert.
Die Elektroporation wurde dann auf einem markierten, gereinigten Salmonellen Effektor, GtgE erweitert. GtgE, eine bekannte Virulenzfaktoren 30, wurde von unserer Gruppe entdeckt, in Wirtszellen 31 ausgeschieden werden, und wurde vor kurzem gezeigt, dass eine Cysteinprotease 32 sein. HeLa-Zellen wurden inkubiert und mit 50 & mgr; g / ml GtgE elektroporiert. Für die Immunfluoreszenzanalyse wurden die Zellen mit einem Antikörper gegen das Streptavidin-Bindungspeptid Affinitätstag auf GtgE gefärbt. Die Zellen wurden auch mit WGA und DAPI gefärbt. In HeLa-Zellen inkubiert (FiguWieder 2A), gibt es keine intrazelluläre GtgE wie durch einen Mangel an green fluorescent Foci sichtbar gemacht. Demgegenüber elektroporiert HeLa-Zellen (2B) zeigen signifikante Fluoreszenzintrazellulären Signal anzeigt Effektorprotein hatten die Zellen infolge der Elektroporation eingegeben. RAW-Zellen zeigte eine leicht erhöhte Neigung zu Protein auf der Zelloberfläche bei der Inkubation (2C) zu akkumulieren, aber intrazelluläre Signal wurde nur nach der Elektroporation (2D) gesehen.
Die Bestimmung der Nachweisgrenzen für die Visualisierung subzellulärer Lokalisierung über die konfokale Mikroskopie war darauf zu achten, genügend Protein in die Zelle, bei gleichzeitiger Vermeidung Überlastung der Zelle mit möglicherweise giftigen bakteriellen Effektoren. In Figur 3 wurde GtgE in RAW-Makrophagen-ähnliche Zellen bei 2,5, 25 elektroporiert, und 50 ug / ml. Die Zellen wurden dann fixiert und mit einem Antikörper gegen das Tag auf GtgE gefärbt. Only eine sehr kleine Anzahl von Foci wurden bei 2,5 & mgr; g / ml GtgE (3A) bei 25 ug / ml, (3B) beobachtet, wobei eine erhöhte Anzahl von Foci offensichtlich, aber die größten Anzahl unterschiedlicher Foci wurden bei der maximalen Protein gesehen getestete Konzentration 50 & mgr; g / ml (Figur 3C). Ähnliche Färbungsmuster wurden zwischen den Proben zeigt bei diesen Proteinkonzentrationen intrazelluläre Protein leicht durch konfokale Mikroskopie überprüft werden beobachtet. Proteinkonzentrationen oberhalb von 50 ug / ml waren nicht, weil, wie der Konzentration des Proteins erhöht getestet, so hat die Neigung für das Zielprotein zu werden an die Oberfläche der Zellen adsorbiert. Um diese Aggregate von membranassoziierten Protein zu vermeiden, wurde es notwendig, zwei Elektroporationsküvetten bündeln, um genug Host interagierende Protein auf einem Western-Blot (Abbildung 6, ganz rechte Spur) visualisieren zu erhalten.
Um weiter zu zeigen, dass der introduced Protein wurde nicht nur auf die Oberfläche der Zelle adsorbiert, wurden aufeinanderfolgende optische Abschnitte an Brennebenen alle 0,35-0,43 Mikrometer (Z-Stapel) mittels konfokaler Mikroskopie abgebildet. RAW-Zellen wurden mit 50 ug / ml GtgE elektroporiert und gefärbt, wie oben beschrieben (Figur 4 A und B) beschrieben. Die Z-Stapel gezeigt, dass GtgE tatsächlich intrazellulär und die Brennpunkte erstrecken sich vom Boden (4A, Ebene 6 von 36) mit dem oberen Ende der Zelle (4B, Ebene 26 von 36). Ähnliche Ergebnisse wurden für alle elektroporiert Proteinen erhalten. Die intrinsische Fluoreszenzprofil von Kontroll-Zellpopulationen mit und ohne Effektorprotein oder Elektroporation wurde durch Fluoreszenz konfokaler Mikroskopie untersucht, und man fand, zu vernachlässigen.
Zusätzlich wurde die elektroporierten Protein untersucht, um festzustellen, ob es für den Abbau über endozytischen Systemen ausgerichtet. Die Zellen wurden mit Ras verwandten Protein 5A (Rab5) gefärbt, einMarker für frühe Endosomen (4C) oder Lysosomen-assoziiertes Membranprotein 1 (Lamp1), einem Marker für die späten Endosomen und Lysosomen (4D). Co-Lokalisation zwischen dem Protein und elektroporiert dieser zellulären Marker würde eine enge physikalische Wechselwirkung zwischen ihnen (dh, dass das Protein wurde durch Elektroporation in den Endosomen / Lysosomen). Die konfokale Mikroskopie zeigte, dass die elektroporierten Protein (GFP oder GtgE) nicht zusammen lokalisieren mit LAMP1 oder Rab5. Daraus wurde das Protein eingeführt wurde nicht direkt in die Zellen durch Endozytose oder den endozytotischen Weg innerhalb von vier Stunden nach der Behandlung gezielt abgeleitet.
Exogenen Proteins Einleitung kann zelluläre Effekte über den Verlauf von mehreren Stunden oder Tagen, und somit ist es oft von Vorteil, um die Persistenz des eingeführten Proteine zu untersuchen. Um zu bestimmen, wie lange ein elektroporiert Protein würde ohne Abbau nach der Elektroporation anhalten. Basierend on Visualisierung der Anlage und Zellausbreitung, 4 h war entschlossen, die ungefähre minimale Erholungszeit für elektroporierten Zellen sein. Um zeitlich beobachten Protein Persistenz ein Zeitverlaufsexperiment durchgeführt, Färbung der Zellen 4, 24, oder 96 Stunden nach der Elektroporation. Nach 4 Stunden (5A), wenn die Zellmorphologie vorgeschlagenen Rückgewinnung, eine nicht unbedeutende Menge an intrazellulärem Protein. Nach 24 Stunden (Figur 5B), gab es noch erhebliche elektroporiertem Proteins in den Zellen. Auch wenn die Zeit nach der Elektroporation wurde, bevor die Fixierung und Färbung (5C) gab es beobachtbare Herde wenn auch zu einem reduzierten scheinbaren Überfluss, was zeigt, Protein Persistenz Tage nach der Erstbehandlung auf 96 Stunden verlängert.
Zwei wichtige Einschränkungen wurden im Laufe dieser Versuche angegeben. RAW-Zellen zeigten eine größere Neigung als HeLa-Zellen gegenüber exogenen Proteinen auf der Zelloberfläche unab akkumulierenjeweiligen Inkubation (6A) oder Elektroporation (6B). Trotzdem waren alle Proben elektroporiert inneren Protein (Figuren 1, 2, 5B) erhöht. Zusätzlich verschwanden die Membran-assoziiertes Protein mit der Zeit. Eine zweite Einschränkung, war eine kleine Population von Zellen, die einen Phänotyp aus kleineren, abgerundete Zellen mit hohen Mengen von exogenen Proteinen in sowohl Steuerung geladen (inkubiert) und behandelten (elektroporierten Zellen) (Abbildung 6 C und D, gezeigt Inkubationsproben). Die Kerne dieser Zellen zeigten kondensierten Chromatin anhand von DAPI-Färbung und erfüllte die Gesamtheit der Zellvolumen, andeutend Apoptose. Es ist daher möglich, dass apoptotische Zellen (die als ein normaler Teil des Zellzyklus oder wegen der Ernte / Behandlung) haben die Neigung, Protein aus dem Puffer zu absorbieren.
Um zu zeigen, dass Proteine elektroporiert waren funktional und könnte ent lokalisierenctly innerhalb der Wirtszelle, die Co-Lokalisierung und Protein-Protein-Wechselwirkung zwischen dem Salmon Effektorprotein SspH1 und seiner bekannten Wirtszielproteinkinase N1 (PKN1) 33 gezeigt. Nach der Elektroporation wurde die physikalische Wechselwirkung zwischen SspH1 und PKN1 durch eine Affinität basierend Immunpräzipitation, gefolgt von Western-Blot (7A) verifiziert. Co-Lokalisation wurde durch konfokale Mikroskopie, die angibt, die Fluorophore nahe genug räumlich überlappen 34 beobachtet. Nach Elektroporation mit 50 ug / ml SspH1 wurden HeLa-Zellen (7B) fixiert und für SspH1 (grün) und PKN1 (rot) gefärbt. Bei niedrigen Laserleistung verschiedene Brennpunkte (gelb) wurden im Zellkern beobachtet, was SspH1 und PKN1 wurden physikalisch nahe genug zu interagieren. Diese Interaktion ist in der Literatur etabliert; aber diese Studie ist die erste, die Co-Lokalisierung im Zellkern zu zeigen.
= "Always"> 
Abbildung 1: Elektroporation von GFP - HeLa oder RAW 264.7 Zellen Zellen inkubiert und mit 25 ug / ml gereinigtes grünes Fluoreszenzprotein (GFP) elektroporiert wurden und gefärbt mit Anti-GFP-Antikörper (grün), DAPI, einem kernspezifische Sonde (blau. ) und WGA (Rot), um die cytosolische Grenzabzugrenzen. Inkubiert (A) HeLa-Zellen zeigt eine Abwesenheit der grünen Fluoreszenz, was auf fehlende Internalisierung von GFP. (B) zeigt eine repräsentative Mikrophotographie von elektroporiert GFP. Beachten Sie die Darstellung von intrazellulärem Foci anzeigt GFP hatten die Zellen eingegeben werden. (C) und (D) sind repräsentative Bilder von RAW-Zellen inkubiert (C), oder durch Elektroporation (D) mit 25 ug / ml gereinigtes grünes Fluoreszenzprotein.
es / ftp_upload / 52.296 / 52296fig2highres.jpg "/>
Fig. 2: Elektroporation von Salmon Effektor GtgE - HeLa-Zellen Die Zellen wurden mit 50 ug / ml eines Affinitäts inkubiert (A) oder durch Elektroporation (B) markierten Salmon Effektors GtgE und mit einem Anti-Effektor-Tag-Antikörper (grün) angefärbt, DAPI, ein Kernmaske (Blau) und WGA (Rot), um die cytosolische Grenzabzugrenzen. In (A), inkubiert HeLa-Zellen zeigen eine Abwesenheit der grünen Fluoreszenz, was auf fehlende Internalisierung GtgE. (B) zeigt eine repräsentative Mikrophotographie von elektroporiert GtgE, welche intrazelluläre elektroporiert Effektorprotein. (C) und (D) sind repräsentative Bilder von RAW-Zellen, die entweder inkubiert wurden oder elektroporiert, die jeweils in der gleichen Weise mit 50 ug / ml Salmon GtgE. Hellblau ist die Kombination oder Überlagerung der roten Fluoreszenz von der WGA undgrüne Fluoreszenz von dem sekundären Antikörper.
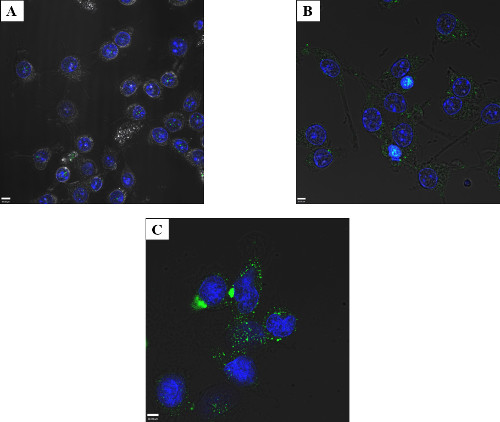
Abbildung 3: Titration von elektroporiert Protein - RAW makrophagenähnliche Zellen Die Zellen wurden mit 2,5 ug / ml (A), 25 ug / ml (B) oder 50 ug / ml (C) Salmon Effektor GtgE elektroporiert und für erholen. 4 Std. Die Zellen wurden fixiert und mit einem Anti-SBP-tag-Antikörper (grün) und der Kerne Maske, DAPI (blau) gefärbt. Es ist möglich, Fluoreszenz Foci anzeigt intrazellulärem GtgE bei 2,5 ug / ml über konfokale Mikroskopie sichtbar zu machen, obwohl sich auch bessere Ergebnisse erhalten werden, wenn höhere Ausgangsmenge an Protein verwendet wurden. Zufriedenstellende Ergebnisse (einschließlich intrazelluläre Protein ohne übermäßige Membran assoziiert Aggregate leicht durch konfokale Mikroskopie beobachtet) wurden bei 50 & mgr; g / ml für GtgE erhalten und somit no größere Konzentrationen wurden getestet.

Abb. 4: Protein Internalisierung und der Mangel an Co-Lokalisierung mit Endosomen Marker konsekutiv optische Scheiben (z-Stapel) durch konfokale Mikroskopie erhalten, zu visualisieren, wenn die elektroporierten Protein interne. RAW-Zellen wurden mit 50 ug / ml GtgE elektroporiert. (A) zeigt optische Scheibe 6 der 36 wird die Z-Stapel (2,1 Mikrometer) über dem Boden der Schale. (B) zeigt das gleiche Sichtfeld aber Scheibe 26 36. Die intrazellulären Foci erstrecken sich über die Zelle anzeigt, daß das Protein tatsächlich intrazellulär und nicht auf der Oberfläche der Zelle aggregiert. Hellblau ist die Kombination von rot WGA, grün sekundären Antikörper und DAPI blau. Co-Lokalisation Assay mit Markern der Endosomen / Lysosomen, Rab5, (C) oder ein Lysosom Marker, LAMP1 (D). Der Effektor-Protein wurde grün gefärbt, die Markierungen (Rab5 oder LAMP1) rot gefärbt, und die Kerne mit DAPI, blau abgegrenzt. Es gibt keinen Beweis für die Co-Lokalisierung mit entweder LAMP1 oder Rab5 anzeigt, dass das Protein nicht phagozytiert.

Abbildung 5: Protein Persistenz nach der Elektroporation konfokale Mikroskopaufnahme, die das Fortbestehen der elektroporierten GtgE im Laufe der Zeit.. 50 ug / ml GtgE wurde in HeLa-Zellen elektroporiert. Die Zellen wurden dann fixiert und mit einem Anti-SBP-tag-Antikörper (grün) und der Kerne Maske, DAPI (blau) gefärbt. 4 h (A) war entschlossen, den Mindestzeitraum, sodass die Zellen sich zu erholen, und wie erwartet, zeigt die maximale intrazelluläre Protein. Nach 24 h (B) und 96 h (C), Grün Foci sowohl intrazelluläre als auch auf der celzellulären Oberfläche, zeigen Effektor Beharrlichkeit darauf hinweist, dass das Protein nicht abgebaut Tage nach der ersten Behandlung. Die hellblaue Farbe in diesem Bild ist die Überlagerung der blauen und der grünen DAPI Antikörperfärbung.
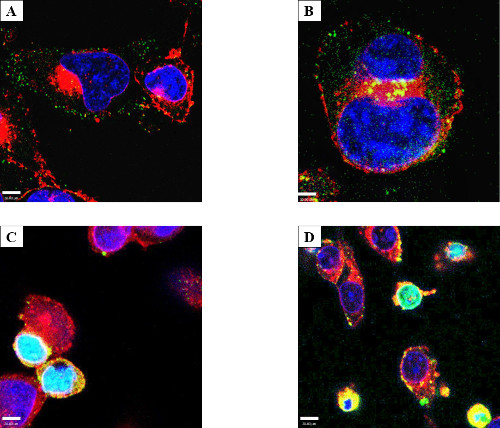
Fig. 6: Die Zelloberflächenproteinaggregation und eine Elektroporation Phänotyp RAW Makrophagen-ähnliche Zellen wurden entweder inkubiert (A) oder durch Elektroporation (B) mit 50 ug / ml GtgE und mit Anti-SBP-tag-Antikörper (grün), WGA gefärbt (Red ) und mit DAPI (blau). Sowohl RAW 264.7 und zu einem geringeren Grad HeLa-Zellen, eher zwischen an der Oberfläche der Zelle zu sammeln; Alle elektroporierten Zellen wurde gezeigt, dass interne Protein erhöht (HeLa nicht gezeigt). Gelb ist die Überlagerung der roten von WGA und grün aus Zielprotein. RAW (C) und HeLa (D) Zellen showing ein veränderter Phänotyp nach der Inkubation mit GtgE (dargestellt). Mehrere Experimente zeigten einen Phänotyp aus kleineren Zellen mit Differential DAPI-Färbung und einem Verlust von Cytoplasma. Hellblau ist die Überlagerung der roten WGA, grün sekundären Antikörper und DAPI blau. Konfokale Mikroskopie wurde verwendet, um das Zielprotein, der sich in den Kern zu zeigen. Seit dieser Phänotyp von exogenen Protein-beladenen Zellen erschien nach Inkubation und Elektroporation, könnte man diesen Phänotyp Hypothese suggestive der Apoptose zu sein.
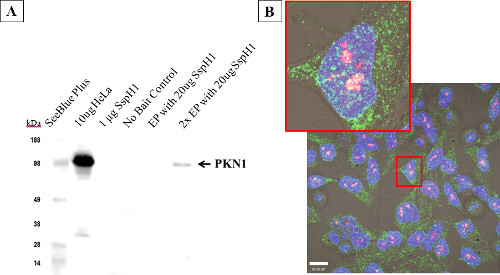
Abb. 7: Host-Protein-Interaktionen mit elektroporiert Salmonellen SspH1 - HeLa-Zellen Die Zellen wurden bei den angegebenen Konzentrationen mit SspH1 elektroporiert, ließ sie 4 h zu erholen, bevor Sie eine modifizierte Affinitätsreinigung gefolgt von Western-Blot (A), um zu bereichern underkennen die bekannten eukaryotischen Interaktionspartner: Serin / Threonin-Proteinkinase-N1 (PKN1). Beachten Sie, dass die ganz rechte Spur (2x EP) beinhaltet 2 gepoolten Küvetten, wie das Signal von einer Küvette in den Hintergrund gemischt, noch PKN1 wurde noch über den Mangel an Bindung, die in nicht-Köderkontrolle gesehen bereichert. Der Western-Blot wurde mit Mutter HeLa Lysat ausgeführt, gereinigt SspH1 und die Affinitätsreinigung Proben, bevor sie mit einem monoklonalen Antikörper gegen PKN1 sondiert. Zielerfassungs wurde über eine Meerrettich-Peroxidase konjugierten sekundären Antikörpers mit Reaktivität gegen das Isotyp des primären Antikörpers erhalten. HeLa-Zellen (B), die Co-Lokalisierung (gelb) zwischen PKN1 (rot) und SspH1 (grün) über durch konfokale Mikroskopie nach der Elektroporation mit 50 ug / ml SspH1. Dieses optische Überlappung angibt, dass der Effektor und das Wirtsprotein nahe genug sind, physisch zu interagieren. Die Tatsache, dass die Wechselwirkung in dem Kern zum ersten Mal gezeigt, bietet zusätzliche Unterstützung,das Protein, das von dem Host richtig gehandelt wurde.
Diskussion
Sezerniert Effektoren aus pathogenen Bakterien entwickelt haben, um innerhalb des Wirtszellenumgebung funktionieren und somit ist es hilfreich, sie in situ in dem Wirt zu detektieren. Einführung spezifischer Effektoren von Interesse in die Wirtszellen können die relevanten Pathogen-Wirt-Wechselwirkungen, in Isolation, ohne Störung von anderen bakteriellen Proteinen untersucht werden. Das Ziel war es, die Elektroporation als Mittel zur bakteriellen Effektorproteine in eukaryotische Wirtszellen einzubringen, wodurch einige der Probleme mit der Transfektion oder Transduktion zugeordnet Vermeidung erkunden. Das grün fluoreszierende Protein wurde als Kontrolle verwendet und Salmon Effektor-Proteine wurden getestet. Wegen des Interesses an bakterielle Krankheitserreger, die Host-Epithelzellen sowie Immun-Zielzellen wurden eine menschliche Epithel-ähnlichen Zelllinie (HeLa) und Maus-Makrophagen-ähnliche Zellen (RAW 264.7) verwendet. Die Elektroporation kann exogene Proteine ohne nennenswerte Abnahme der Zell viabili in Wirtszellen liefernty und die gelieferte Proteine nachweisbar in Zellen, die bis zu vier Tage.
Um die Auswirkungen der elektroporierten Protein zu isolieren, wird reines Protein erforderlich. In dieser Studie wurden die Proteine in E. ausgedrückt coli-Stamm BL21 mit N-terminalen Polyhistidin und Streptavidin-Bindungspeptid-Tags. Proteine wurden mit Ni-NTA-Harz gereinigt, Konzentration (in der Regel zwischen 5-25 mg / ml) und Reinheit untersucht und bei -80 ° C bis zur Elektroporation gespeichert. Kommerziell produzierte Proteine auch zur Elektroporation akzeptabel sein, da sie dazu neigen, von hoher Reinheit und gut charakterisiert sein.
Die Hauptschritte bei diesem Protokoll enthalten vollständiges Entfernen des Zellkulturmediums durch Waschen und Suspendieren der Zellen in proteinfreien Puffers. Dies stellt sicher, daß alle beobachteten abwärts Phänotypen aufgrund des exogenen Proteins von Interesse, nicht aber in dem Kulturmedium vorhandenen Proteine. Bessere Effizienz der Elektroporation wurde beobachtet, wenn die Zelldichtehöher (beispielsweise 6 x 10 6 vs. 1 x 10 6 Zellen), obwohl die besten Zellzahl wird mit der Zellgröße und Typ variieren. Ein weiterer entscheidender Schritt bei dem Versuch war, damit Zellen Zeit sich zu erholen und wieder anzubringen, um Gerichte; Dies war notwendig, weil adhärenten Zellen wurden in dieser Studie verwendet. Eine Erholungsphase sollte für Suspensionskulturen weniger wichtig zu sein, obwohl es notwendig sein kann, um Proteine für die richtige intrazellulären Transport von Protein-Protein-Wechselwirkungen oder enzymatische Aktivität vermitteln Zeit, abhängig von der Art der beabsichtigten Studie. Da geliefert Proteine innerhalb der Zellen für bis zu 96 Stunden beobachtet wird, gibt es viel Raum für die Anpassung an die Inkubationszeit vor der Visualisierung oder zellulären Assay Mikroskopie.
Mehrere Variablen in diesem Protokoll kann für verschiedene Zelltypen, Proteinzielen oder nachgeschalteten Analysesysteme optimiert werden. Die Proteinmenge elektroporiert werden kann für das gewünschte intrazelluläre Konzentration abgestimmt. For Visualisierung der Proteinlokalisierung, kann so wenig wie 1 & mgr; g verwendet werden. Für funktionelle Untersuchungen können höhere Ausgangsproteinmengen benötigt werden. Darüber hinaus kann die Zeitdauer für die Zeit nach der Elektroporation Zellgewinnung verkürzt oder verlängert werden. Labile Protein-Targets oder schnelle nachgelagerte Prozesse würde eine kürzere Inkubationszeit erforderlich. Auch kann die Menge des ausplattierten Zellen über die Vorschläge hier eingestellt werden. Die Zellen können mehr dünn plattiert werden, wenn die eingebrachte Protein durch Mikroskopie überwacht oder dichter plattiert, wenn die elektroporierten Protein für Anwendungen wie Western Blots gewonnen werden soll.
Während der Elektroporation ist eine einfache und direkte Methode zur Einführung von Proteinen in lebenden Zellen, gibt es einige Einschränkungen für die Technik. Das Verfahren erfordert hochreine Proteine in Mikrogramm-Mengen. So wenig wie 1 & mgr; wurde elektroporiert und mit der konfokalen Mikroskopie sichtbar gemacht, aber höheren Ausgangsproteinmengen gab better visuelle Ergebnisse. Während die Proteinfunktion nicht bei allen Konzentrationen nach der Elektroporation beurteilt wurden Proteinkonzentrationen gleich oder höher als 50 ug / ml für eine angemessene Signal für Western-Blot erforderlich. Auch aufgrund der Grßenbeschränkungen der Elektroporationsküvetten verbundene Übergang kann Verarbeitung mehrerer Küvetten von Zellen erfordern. Allerdings, wenn man bedenkt, dass die Elektroporation Vorgang dauert nur wenige Sekunden, sobald Zellen hergestellt werden, erfordert die parallele Verarbeitung wenig mehr Zeit und Mühe.
Wenn der eingebrachte Protein durch Western-Blot, Mikroskopie visualisiert werden oder für die Affinitätsreinigung verwendet wird, sollte das Protein ein mit einem Tag 35 für die Affinitätsreinigung oder einer verfügbaren Antikörper zur Detektion. Aus unbekannten Gründen wurden einige Wechselwirkungen aus der Literatur oder andere biochemische Verfahren (Daten nicht gezeigt) bekannt ist nicht in der Lage, nach der Elektroporation zu rekapitulieren. Es kann sein, dass der Host erkennt einige elektroporiert Proteine als foreign schnell und markiert sie für Proteasom Abbau.
Elektroporation besitzt mehrere Vorteile gegenüber anderen bestehenden Methoden zur Protein Lieferung. Im Vergleich zu Mikroinjektion, Elektroporation ist viel schneller und einfacher, und eine große Anzahl an Zellen auf einmal mit nahezu 100-prozentige Lebensfähigkeit der getesteten Bedingungen behandelt werden. Elektroporation ist auch billiger als Protein Transfektion mit im Handel erhältlichen Reagenzien. DNA-Transfektionen werden oft verwendet, um bakterielle Effektor-Proteine in Wirtszellen zu studieren; Jedoch verursacht dies die bakteriellen Proteine nicht ideal vom Host synthetisiert werden. Auf der anderen Seite, die Elektroporation von bakteriellen Proteinen beseitigt die Abhängigkeit von Säugerproteinexpressionsmaschinerie, die eine bessere Darstellung des infektiösen Prozess, bei dem Effektor-Proteine werden durch die Bakterien exprimiert.
Mehrere Anwendungen könnten Protein Elektroporation als Mittel bei der Untersuchung von Bakterienwirts intera verwendenctions. Erstens können Primärzellen, die oft schwer zu transfizieren sind zugänglicher für die Elektroporation für die Protein Lieferung. Dies wird für die Untersuchung der Effektorfunktion in biologisch relevanten Zelltypen ermöglichen. Elektroporation gibt auch die Möglichkeit des Multiplexens Proteine und / oder Behandlungen. Zum Beispiel können mehrere Proteine gleichzeitig eingebracht werden, oder Arzneimittel und andere kleine Moleküle können neben Proteinen geliefert. Zum Erhalten einer funktionellen Verständnis der Wirkung der eingebrachten Proteine könnten Protein Elektroporation mit Assays für Protein-Funktion und Wechselwirkungen wie Affinitätsreinigung Westernblots gegen bekannte Ziele, Ganzzell-Expressionsanalyse, und Mikroskopie gekoppelt werden, um zu bestimmen, subzellulären wichtigsten Lokalisation des Proteins eingeführt. Daher weist dieses Verfahren ein großes Potential als Werkzeug für die Aufklärung bakteriellen Pathogens biology neben anderen Zell- und Molekularbiologie-Techniken.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
This work was supported by NIGMS, National Institutes of Health (GM094623). Significant portions of this work were performed in the Environmental Molecular Sciences Laboratory, a DOE/BER national scientific user facility located at the Pacific Northwest National Laboratory (PNNL). PNNL is operated for the DOE by Battelle under Contract DE-AC05-76RLO1830.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA Solution | Cellgro | 25-050-Cl | |
| 0.4 cm Gap-disposable electroporation cuvettes | Bio-Rad | 165-2088 | |
| 100% Methanol | Any | N/A | Flammable, Toxic |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4919 | |
| Cell Counting Apparatus - Hemocytometer or Coulter Counter | Beckman Coulter | Model Z1 | |
| Cell Culture Incubator | Any | N/A | Humidified 95% air/5% CO2 atmosphere at 37 °C |
| Cell Culture Plastic | Any | N/A | Cell culture flasks/plates, pipets, tubes, rubber policeman |
| Dulbecco's Modification of Eagle’s Medium (DMEM) | Cellgro | 10-013 | Warm to 37 °C |
| Electroporator | Bio-Rad | E. coli Pulser | |
| Fetal Bovine Serum (FBS) | Cellgro | 35-016-CV | |
| Fluorescent confocal microscope | Ziess | Model LSM 710 | |
| Glass Bottom Dishes for Microscopy | Wilco Wells | HBSt-3522 | |
| HALT Protease Inhibitor Cocktail | Pierce | 78430 | Corrosive, Toxic |
| HeLa Cell Line | ATCC | ATCC CCL-2 | |
| LDS 4X Loading Buffer | Invitrogen | NP0007 | |
| Minimal Essential Medium (MEM) | Cellgro | 10-010 | Warm to 37 °C |
| Other fluorescent stains (WGA, DAPI) in conjunction with anti-fade reagent | Any | N/A | |
| Penicillin/Streptomycin | Cellgro | 30-002-Cl | |
| RAW 264.7 Cell line | ATCC | TIB-71 | |
| Primary Antibody Against Target of Interest | Any | N/A | |
| Secondary Antibody Conjugated to Fluorophore | Any | N/A | |
| Phosphate Buffered Saline | Any | N/A | Chill to 4 °C |
| Sterile Phosphate Buffered Saline | Any | N/A | Warm to 37 °C |
| [header] | |||
| Streptavidin Agarose Resin Suspension | Pierce | 20353 | |
| Table Top Centrifuge Capable of Accepting Conical Tubes (swinging bucket preferred) | Any | N/A | |
| TCEP | Sigma-Aldrich | 646547 | Corrosive, Toxic |
| Triton X-100 | Sigma-Aldrich | T8585 | Irritant, Toxic |
Referenzen
- Mota, L. J., Cornelis, G. R. The bacterial injection kit: type III secretion systems. Annals of Medicine. 37, 234-249 (2005).
- Galan, J. E., Collmer, A. Type III secretion machines: bacterial devices for protein delivery into host cells. Science. 284, 1322-1328 (1999).
- Hueck, C. J. Type III protein secretion systems in bacterial pathogens of animals and plants. Microbiology and molecular biology reviews : MMBR. 62, 379-433 (1998).
- Cornelis, G. R., Van Gijsegem, F. Assembly and function of type III secretory systems. Annual Review of Microbiology. 54, 735-774 (2000).
- He, S. Y. Type III protein secretion systems in plant and animal pathogenic bacteria. Annual Review of Phytopathology. 36, 363-392 (1998).
- Dean, P. Functional domains and motifs of bacterial type III effector proteins and their roles in infection. FEMS Microbiology Reviews. 35, 1100-1125 (2011).
- Espinosa, A., Alfano, J. R. Disabling surveillance: bacterial type III secretion system effectors that suppress innate immunity. Cellular Microbiology. 6, 1027-1040 (2004).
- Orchard, R. C., Alto, N. M. Mimicking GEFs: a common theme for bacterial pathogens. Cellular Microbiology. 14, 10-18 (2012).
- Galan, J. E. Common themes in the design and function of bacterial effectors. Cell Host Microbe. 5, 571-579 (2009).
- Ellis, B. L., et al. A survey of ex vivo/in vitro transduction efficiency of mammalian primary cells and cell lines with Nine natural adeno-associated virus (AAV1-9) and one engineered adeno-associated virus serotype. Virology Journal. 10, 74 (2013).
- Sreelatha, A., et al. Vibrio effector protein, VopQ, forms a lysosomal gated channel that disrupts host ion homeostasis and autophagic flux. Proceedings of the National Academy of Sciences of the United States of America. 110, 11559-11564 (2013).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. The Journal of Cell Biology. 98, 1556-1564 (1984).
- Lafon, M., Lafage, M. Antiviral activity of monoclonal antibodies specific for the internal proteins N and NS of rabies virus. The Journal of General Virology. 68 (Pt. 12), 3113-3123 (1987).
- Kriegler, M. P., Livingston, D. M. Chemically facilitated microinjection of proteins into intact monolayers of tissue culture cells). Somatic Cell Genetics. 3, 603-610 (1977).
- Nossa, C. W., et al. Activation of the abundant nuclear factor poly(ADP-ribose) polymerase-1 by Helicobacter pylori. Proceedings of the National Academy of Sciences of the United States of America. 106, 19998-20003 (2009).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting mammalian cells: Optimization of critical parameters affecting calcium-phosphate precipitate formation. Nucleic Acids Research. 24, 596-601 (1996).
- Winegar, R. A., Phillips, J. W., Youngblom, J. H., Morgan, W. F. Cell Electroporation Is a Highly Efficient Method for Introducing Restriction Endonucleases into Cells. Mutation Research. 225, 49-53 (1989).
- Cortes, F., Ortiz, T. Chromosome damage induced by restriction endonucleases recognizing thymine-rich DNA sequences in electroporated CHO cells. International Journal of Radiation Biology. 61, 323-328 (1992).
- Cortes, F., Ortiz, T. Induction of chromosomal aberrations in the CHO mutant EM9 and its parental line AA8 by EcoRI restriction endonuclease: electroporation experiments. Mutation Research. 246, 221-226 (1991).
- Baron, S., Poast, J., Rizzo, D., McFarland, E., Kieff, E. Electroporation of antibodies, DNA, and other macromolecules into cells: a highly efficient method. Journal of Immunological Methods. 242, 115-126 (2000).
- Lewis, R. Electroporation edges toward clinic for both gene therapy and drug delivery. Genetic Engineering and Biotechnology News. 17, (1997).
- Kotzamanis, G., et al. CFTR expression from a BAC carrying the complete human gene and associated regulatory elements. Journal of Cellular and Molecular Medicine. 13, 2938-2948 (2009).
- Chakrabarti, R., Wylie, D. E., Schuster, S. M. Transfer of monoclonal antibodies into mammalian cells by electroporation. The Journal of Biological Chemistry. 264, 15494-15500 (1989).
- Graziadei, L., Burfeind, P., Bar-Sagi, D. Introduction of unlabeled proteins into living cells by electroporation and isolation of viable protein-loaded cells using dextran-fluorescein isothiocyanate as a marker for protein uptake. Analytical Biochemistry. 194, 198-203 (1991).
- Wilson, A. K., Horwitz, J., De Lanerolle, P. Evaluation of the electroinjection method for introducing proteins into living cells. The American Journal of Physiology. 260, C355-C363 (1991).
- Prasanna, G. L., Panda, T. Electroporation: Basic principles, practical considerations and applications in molecular biology. Bioprocess Engineering. 16, 261-264 (1997).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41, 135-160 (1996).
- Weaver, J. C. Electroporation theory. Concepts and mechanisms. Methods in Molecular Biology. 55, 3-28 (1995).
- McAteer, J. A., Douglas, W. H. Monolayer culture techniques. Methods in Enzymology. 58, 132-140 (1979).
- Ho, T. D., et al. Identification of GtgE, a novel virulence factor encoded on the Gifsy-2 bacteriophage of Salmonella enterica serovar Typhimurium. Journal of Bacteriology. 184, 5234-5239 (2002).
- Niemann, G. S., et al. Discovery of novel secreted virulence factors from Salmonella enterica serovar Typhimurium by proteomic analysis of culture supernatants. Infection and Immunity. 79, 33-43 (2011).
- Spano, S., Liu, X., Galan, J. E. Proteolytic targeting of Rab29 by an effector protein distinguishes the intracellular compartments of human-adapted and broad-host Salmonella. Proceedings of the National Academy of Sciences of the United States of America. 108, 18418-18423 (2011).
- Haraga, A., Miller, S. I. A Salmonella type III secretion effector interacts with the mammalian serine/threonine protein kinase PKN1. Cellular Microbiology. 8, 837-846 (2006).
- Zinchuk, V., Grossenbacher-Zinchuk, O., et al. Quantitative colocalization analysis of confocal fluorescence microscopy images. Current Protocols in Cell Biology / Editorial Board, Juan S. Bonifacino ... [et al]. 4 (Unit 4.19), (2011).
- Kimple, M. E., Sondek, J., et al. Overview of affinity tags for protein purification. Current Protocols in Protein Science / Editorial Board, John E. Coligan ... [et al]. 9 (Unit 9.9), (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten