Method Article
Ein Funktionstest für Gap Junction-Prüfung; Elektroporation von adhärenten Zellen auf Indium-Zinn-Oxid
In diesem Artikel
Zusammenfassung
This presentation demonstrates a method whereby electroporation of adherent, cultured cells is used for the study of intercellular, junctional communication, while the cells grow on a slide coated with conductive and transparent indium-tin oxide.
Zusammenfassung
In this technique, cells are cultured on a glass slide that is partly coated with indium-tin oxide (ITO), a transparent, electrically conductive material. A variety of molecules, such as peptides or oligonucleotides can be introduced into essentially 100% of the cells in a non-traumatic manner. Here, we describe how it can be used to study intercellular, gap junctional communication. Lucifer yellow penetrates into the cells when an electric pulse, applied to the conductive surface on which they are growing, causes pores to form through the cell membrane. This is electroporation. Cells growing on the nonconductive glass surface immediately adjacent to the electroporated region do not take up Lucifer yellow by electroporation but do acquire the fluorescent dye as it is passed to them via gap junctions that link them to the electroporated cells. The results of the transfer of dye from cell to cell can be observed microscopically under fluorescence illumination. This technique allows for precise quantitation of gap junctional communication. In addition, it can be used for the introduction of peptides or other non-permeant molecules, and the transfer of small electroporated peptides via gap junctions to inhibit the signal in the adjacent, non-electroporated cells is a powerful demonstration of signal inhibition.
Einleitung
Das Anlegen von elektrischem Strom an eine Zelle die Bildung von Poren in der Zellmembran durch ein Verfahren, genannt Elektroporation. Die Poren ermöglichen den Durchgang von einer Vielzahl von nonpermeant Moleküle durch die Membran. Das elektrische Feld kann präzise gesteuert werden, so daß die gebildeten Poren sind sehr klein und schnell wieder zu schließen, mit minimaler Störung der Zellphysiologie. Interessanterweise können anhaftende Zellen auf einem Objektträger mit einer leitfähigen und transparenten Indium-Zinn-Oxid (ITO) beschichtet und in situ elektroporiert, die auf der Oberfläche, wo sie wachsen angebaut werden, ohne abgelöst zu Suspension elektroporiert werden. Zellen können sehr gut auf dieser Fläche wachsen und wie sie gebunden sind, und erweiterte detaillierte mikroskopische Beobachtung möglich ist. Mit dieser Technik können kleine Moleküle nonpermeant sofort und eingeführt werden, in im wesentlichen 100% der Zellen, die diese Technik besonders für Studien über die Aktivierung comp machtonents eines Weges folgenden Liganden Stimulation eines Rezeptors (Übersicht in 1).
Elektroporation wurde hauptsächlich für die Einführung von DNA (auch Elektrotransfektion) verwendet. Jedoch kann die Elektroporation in situ wertvoll für die Einführung einer großen Vielfalt von Molekülen, wie Peptiden 2-4, Oligonukleotide, wie Antisense-RNA, Doppelstrang-DNA-Decoy-Oligonukleotide zur Hemmung der Bindung von Transkriptionsfaktoren oder siRNA 3,5, 6, radioaktive Nukleotide 7-10, Proteine 11 12 oder 13 Pro-Drugs. Nach der Elektroporation können Zellen für biochemische Analysen lysiert oder fixiert und mit Antikörpern gefärbt.
Die leitfähige ITO-Beschichtung ist sehr dünn, 800-1,000Å, so dass das Zellwachstum wird durch die Höhendifferenz der beiden Oberflächen gestört, da die Zellen wachsen über die Kante der leitenden Beschichtung. Dies bietet den Vorteil, dass nicht-electroporated Zellen elektroporiert mit denen gezüchtet werden Seite an Seite, um als Kontrollen dienen. Der gleiche Ansatz kann für die Prüfung von Gap Junction, interzelluläre Kommunikation (GJIC) verwendet werden, wie im Video beschrieben.
Gap junctions sind Kanäle, welche die Innenräume von benachbarten Zellen 14. Gap Junction, spielt der interzellulären Kommunikation eine wichtige Rolle bei der Tumorentstehung und Metastasierung, während Onkogene wie Src unterdrücken GJIC 15,16. Zu prüfen GJIC einen fluoreszierenden Farbstoff, wie Lucifer Gelb (Ly) wird oft in kultivierte Zellen durch Mikroinjektion eingeführt oder kratzen Lade 17 und der Diffusion des Farbstoffs in die benachbarte Zellen mikroskopisch unter Fluoreszenzbeleuchtung beobachtet. Diese Techniken führen jedoch unweigerlich Zellschäden. Wir beschreiben nun ein Verfahren, bei dem Zellen auf einem Objektträger, der teilweise mit ITO beschichtet 18 gewachsen. Ein elektrischer Impuls wurde in Gegenwart von LY (oder anderen Farbstoffen) eingesetzt camit ihr Eindringen in die Zellen wachsen auf dem leitfähigen Teil des Schlittens, während die Farbstoffwanderung zu den benachbarten, nicht-elektroporierten Zellen wurde mikroskopisch durch Fluoreszenz-Beleuchtung beobachtet. Um störende empfindlichen Zellen, die dazu neigen, von der Monoschicht trennen zu vermeiden, um eine Anordnung entworfen, die nicht eine Elektrode erforderlich war oben auf die Zellen, um den elektrischen Strom 19 gelten platziert werden. Dieser Ansatz bietet die Möglichkeit, GJIC in einer großen Anzahl von Zellen zu quantifizieren, ohne nachweisbare Störungen der Zellstoffwechsel, da durch das Fehlen einer Wirkung auf die Länge der G1-Phase nach der Serumstimulation 12 angedeutet, Erhöhung des Niveaus der fos Protoonkogen Protein (Raptis, unveröffentlicht) oder zwei Kinasen mit zellulären Stress, der p38-Schwein oder JNK / SAPK-Kinase-1 verbunden. Dieser Ansatz ermöglicht die Untersuchung des Zusammenhangs zwischen den Ebenen der Onkogenexpression, Transformation und GJIC 18, sowie die Wirkung von Src und STAT3 auf GJIC in einer Vielzahl von Zelltypen, einschließlich Zellen aus Lungentumorproben 20-23 frisch kultiviert. Zusätzlich wird in situ Elektroporation mit dem beschriebenen Aufbau, der eine obere Elektrode wurde erfolgreich für den Nachweis der Gap-junction-Verschluss auf Adipozyten Differentiation eingesetzt fehlt, wobei die Zellanhaftung an das Substrat ist in diesem Stadium 19,24 verringert.
Protokoll
1. Ausplattieren der Zellen in der Elektroporation Chambers
- In einer Laminar-Flow-Haube, trypsinieren die Zellen unter Verwendung von sterilen Technik wie gewohnt.
HINWEIS: Es ist sehr wichtig, um durch Zentrifugation beseitigt alle Spuren von Trypsin, weil sie verhindern Ausbreitung der Zellen auf dem Glas, damit die Bildung von adherens und Gap Junctions. - Pipette 1 ml der Zellsuspension in sterilen Kammern Elektroporation mit dem in-situ-Elektroporator (Figur 1), und in ein 37 ° C, CO 2-Inkubator gestellt.
HINWEIS: Die Zelladhäsion durch Plattieren auf Fibronektin, Kollagen, Poly-Lysin oder Zell-und Gewebekleber (siehe Materialien Table) verbessert werden. - Wenn die Zellen eine konfluente Schicht gebildet sie sind bereit für GJIC Prüfung.
2. Verfahren der Elektroporation
Elektroporation für GJIC Prüfung kann außerhalb einer Laminar-Flow-Haube durchgeführt werden,da es dauert nur ein paar Minuten. Wenn längere Inkubationszeiten für ein bestimmtes Experiment erforderlich ist, dann kann es vollständig in einem Abzug mit laminarer Strömung durchgeführt werden. In allen Fällen müssen die Kammern, in denen die Zellen gezüchtet steril sein.
- Bereiten Sie eine 5 mg / ml Lucifer gelb Lösung: 10 mg LY-Pulver (mit dem Elektroporator vorgesehen) in 2 ml calciumfreien Wachstumsmedium. Für Experimente, die längere Inkubationszeiten erfordert, Filter-Lösung sterilisieren und bei 4 o C
- Saugen Sie das Wachstumsmedium und waschen Sie die Zellen mit Calcium-freiem Medium, man aufpassen, nicht auf die Monoschicht zerkratzen oder trocknen die Zellen. Wenn die Zellen getrocknet haben sie meist dunkler Kerne und abholen LY ohne Elektroporation. Die Wirkung ist stärker ausgeprägt in der Mitte des Schiebers das mehr Luftzug (4F) ausgesetzt ist.
- Mit einer Eppendorf-Pipette pipettiert die Farbstofflösung auf die Zellen (400 ul für die ganze Kammer), am Rand der Kammer, being darauf, nicht die Zellschicht zu berühren.
- Legen Sie die Kammer, in der mit dem mitgelieferten Halter Elektroporator und wenden Sie einen Impuls von der entsprechenden Stärke (siehe Diskussion).
- Sorgfältig absaugen einige der LY-Lösung. Es kann ein zweites Mal für weniger wichtige Experimente verwendet werden.
- Zusatz von Calcium-freiem DMEM mit 10% dialysierten Serum.
- Die Zellen für 3-5 min im Brutschrank inkubieren, um die Farbstoffübertragung durch Gap Junctions ermöglichen.
HINWEIS: Die Einbeziehung der dialysierten Serum an dieser Stelle hilft Porenverschluss. - Mit Calcium-freiem DMEM für Live Cell Beobachtung waschen Sie die nicht rechtsfähige Farbstoff. Alternativ können die Zellen in diesem Stadium durch Zugabe von 4% Formaldehyd zu der gut fixiert werden kann, und dann mit PBS (Phosphat-gepufferte Salzlösung) gewaschen. In allen Fällen muss die Wasch alle Hintergrund zu entfernen.
HINWEIS: In Vorversuchen die optimalen Bedingungen zu bestimmen, wenn die Spannung zu niedrig ist, dann ist es möglich, die Zellen zu gewinnen in der incubato zu lassenr für ein paar Minuten und elektroporieren derselben Folie ein zweites Mal, um in den Kosten der Folien zu speichern.
3. Die mikroskopische Untersuchung
- Beachten Sie die Zellen unter Fluoreszenzbeleuchtung mit einem inversen Mikroskop mit dem geeigneten Filter für die verwendeten Farbstoffs ausgestattet. Lucifer gelb, Anregung 423nm, 555nm Emissions, WBV Filter für eine Nikon IX70 Mikroskop.
- Beseitigen Meniskus Effekte, indem Sie ein Glas Deckglas auf der Oberseite des Kunststoff Nun, nach an die Spitze mit Flüssigkeit zu füllen, um die Zellmorphologie unter dem Phasenkontrast zu untersuchen. Für bessere Bilder kann das auch von der Folie abgenommen werden, und das Deckglas auf dem Rahmen angeordnet. Für feste Zellen, die gut mit Glycerin zur mikroskopischen Beobachtung gefüllt werden, während für lebende Zellen ist es mit Wachstumsmedium gefüllt werden.
HINWEIS: Waschen und Fotografieren ist einfacher, wenn die Zellen mit Formaldehyd nach der Übertragung des Farbstoffes (Schritt 2.7 oben) festgelegt. Wenn die Zellen nichtt festgelegt ist, die Fluoreszenz von den Zellen innerhalb von etwa 60 min, je nach Zelltyp, die Spannung und den LY eingeführt, während in fixierten Zellen Fluoreszenz wird für mehrere Stunden beibehalten eliminiert. Allerdings verblasst oder Fluoreszenz verliert sich nach O / N Inkubation, auch in fixierten Zellen. Aus diesem Grund muss Fotografien bald nach der Elektroporation (Figur 2) entnommen werden.
4. Quantifizierung der interzellulären Kommunikation
- Fotografieren Sie die Zellen mit einem 20x-Objektiv unter Fluoreszenz-und Phasenkontrast (Abbildung 3).
- Identifizieren und markieren mit einem Sternchen die elektroporiert Zellen an der Grenze zu den nicht-elektroporiert Bereich (Abbildung 2, Pfeil, Elektroporation Flanke).
- Identifizieren und Markieren mit einem Punkt auf der fluoreszierenden Zellen nicht elektroporiert Seite, wo der Farbstoff durch Gap Junctions übertragen (3A und 3B).
- Teilen Sie die Gesamtzahl derfluoreszierenden Zellen auf der nicht elektroporiert Bereich durch die Anzahl der elektroporierten Zellen entlang der Kante (3A und 3B).
HINWEIS: Der Transfer von mindestens 200 zusammenhängenden elektroporiert Grenzzellen für jedes Experiment berechnet. Die erhaltene Zahl ist der Wert GJIC.
Ergebnisse
Abbildung 2 zeigt Rattenleberzellen epithelialen T51B 22, mit LY elektroporiert und unter Fluoreszenz (Panel A und B) fotografiert oder Phasenkontrast-(C) Beleuchtung, nach Fixierung und Waschen. In Abbildung A ist die Kante des elektroporiert Bereich rot markiert. Die Steigung der Fluoreszenz rechts von der roten Linie zeigt Übertragung über Gap Junctions. In 3A und 3B ist die Quantifizierung von Gap Junction-Kommunikation gezeigt: Die Zellen auf den Rand des elektroporierten Bereich identifiziert und mit einem Stern markiert, während die Zellen, in denen der Farbstoff übertragen waren, wurden mit einem Punkt markiert. Das Verhältnis zeigt die durchschnittliche Anzahl von Zellen, die den Farbstoff in über pro elektroporiert Grenzzelle. In diesem Beispiel gibt es 57 Punkte und 10 Sternen, dh GJIC = 5,7.
In C und D, der Signalgeber und Aktivator der Transkription-3 (Stat3) in T51B Zellen herunterreguliert worden turch stabile siRNA Ausdruck mit einem lentiviralen Vektor, und dies bewirkt eine Verringerung GJIC, wie durch die Abwesenheit von Über 22 gezeigt.

Abbildung 1. Die Elektroporation Elektrode und Schlittenanordnung. (A) Draufsicht: Die Zellen werden auf einem Glasträger aufgewachsen, mit leitfähigen und transparenten Indium-Zinn-Oxid (ITO) beschichtet ist. Ein Kunststoffkammer auf dem Objektträger verbunden ist, um einen Behälter für die Zellen und LY bilden. Der Überzug ist Laser-geätzt in einer geraden Linie in der Mitte, im wesentlichen zwei Elektroden bildet. Ein Damm wird verwendet, um die aktuellen nach oben umzuleiten, wodurch ein scharfer Übergang der elektrischen Feldstärke. Nicht-leitende Bereiche bereitzustellen, wird die ITO auch in zwei Rechtecke geätzt. Strom (rote Pfeile) von dem Impulsgenerator fließt von jedem Kontaktpunkt zum anderen, über eine leitende Autobahn zwischen den Rechtecken, die Verbreitung in einer direktenIonen parallel zu der Mittelbarriere, dann über den Damm durch das Medium zu der anderen Seite, Elektroporation der Zellen in Bereichen parallel zum Damm. Aus Gründen der Übersichtlichkeit ist das vordere Teil der Kammer entfernt wird (B) Seitenansicht.: Der Objektträger mit den Zellen wachsen auf der ITO-beschichtete (hellgrün) und geätzt, blanke Glas Regionen gezeigt. (-), Und die Zellen, die in diesem Bereich gebildet wird, wenn das Medium, das LY Elektroporation in die Kammer bis zu einem Niveau oberhalb der Höhe des Dammes dann ein elektrischer Pfad zwischen den Elektroden (+) und zugegeben. Beachten Sie, dass die ITO-Schicht mit übertriebener Dicke der Deutlichkeit halber gezeigt, obwohl seine tatsächliche Dicke (800 A) ist viel geringer als die Dicke der Zellen. (C) Der Bereich der Elektroporation und nicht elektroporierten Zellen vergrößert dargestellt. Der Farbstoff ist dicht in der Nähe der Staumauer, wo alle Zellen wurden durch Elektroporation und blendet über die elektroporiert Kante als die Konzentration schwächt durch mehrere Gap Junction transfERS. Großen Pfeile zeigen die Richtung der Farbübertragungs durch gap junctions. Beachten Sie, dass die Größe und Dicke der Zellen werden zur Verdeutlichung übertrieben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Elektroporation von T51B, Rattenleber Epithelzellen. LY wurde in T51B Rattenleber Epithelzellen (mild, 12 Volt) elektroporiert. Nach einer 5 min. Inkubation wurden die Zellen unter Fluoreszenz (A, B) oder Phasenkontrast (C) Beleuchtung fotografiert. Beachten Sie die umfangreiche Übertragung durch Gap Junctions, durch den Gradienten der Fluoreszenz zeigt, die sich von der Kante des elektroporierten Bereich (Pfeile, rote Linie A). Zur gleichen Zeit gibt es keine sichtbare Schädigung der Zellen, ein s unter Phasenkontrast (C) zu sehen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. Die Quantifizierung von Gap Junction Übertragung. Die Zellen an der Kante der Fläche, die elektroporiert LY durch Elektroporation (Spender von LY den nicht elektroporierten Zellen) aufgenommen wurden mit einem Stern markiert. Zellen, in denen in LY durch gap junctions übertragen wurden mit einem Punkt markiert. In (A) und (B), gibt es 57 Punkte und 10 Sternen, dh GJIC = 5,7. Zellen (C) und (D) nicht über Gap Junctions, wie durch die Abwesenheit eines Gradienten von Fluoreszenz gezeigt. Pfeile zeigen auf die Kante der Fläche elektroporiert. Bar = 100 um.es / ftp_upload / 51710 / 51710fig3highres.jpg "target =" _blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
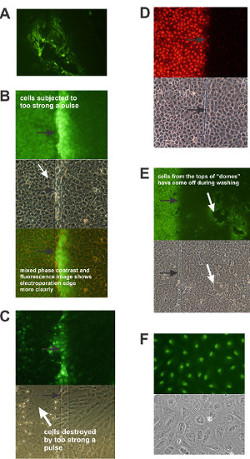
Figur 4 (A) T51B Zellen, die durch Schaben während der Handhabung beschädigt wurden. Diese Zellen können abholen LY auch ohne Elektroporation und kann sie auf ihre Nachbarn durch gap junctions übertragen. (B) und (C) Zellen, die durch einen Impuls, der zu stark beschädigt ist. (B) T51B Rattenleber Epithelzellen wurden bei milden Einstellung elektroporiert , 20 Volt. Die Zellen auf der linken Seite des geätzten Linie (Pfeil) durch Elektroporation beschädigt. In diesem Fall haben sich die Zellen nicht zu lösen, aber ein Blick auf die Phasenkontrastaufnahme (Mitteltafel, weißer Pfeil) zeigt die Zellen, um dunkle Kerne haben, während sie fluoreszieren sehr schwach, wenn überhaupt (oben). Allerdings übertragen thGrob Gap Junctions offensichtlich ist, zu den Zellen auf der rechten Seite, die nicht elektroporiert werden. Die untere Foto wurde durch die Kombination von UV-und Phasenkontrast-Beleuchtung, um die Betrachtung des Randes der Elektroporation erleichtern. (C) T51B Rattenleber Epithelzellen bei mittlerer Einstellung, 30 Volt elektroporiert. Die Zellen auf der linken Seite des geätzten Linie wurden stark von der Puls beschädigt. Beachten Sie, wie die Zellen sich lösen und fluoreszieren nicht. Einige Überlebende um den Rand haben LY (D) T51B Zellen mit 10 ug / ml Propidiumiodid elektroporiert abgeholt und angezeigt werden, auf der Übergabe an ihre Nachbarn auf der rechten Seite über Gap Junctions.. Beachten Sie die intensive Färbung der Kerne. (E) Kuppeln der Epithelzellen. T51B Zellen bei milden Einstellung, 15 Volt elektroporiert. Beachten Sie auch die Elektroporation von Zellen auf der linken Seite. Allerdings, wenn konfluent, T51B Zellen bilden Kuppeln, die während Manipulation und Waschen kommen können, und die umliegenden Zellen kann take bis LY. Beachten Sie die umfangreichen Farbübertragungs. (F) Zellen, die getrocknet sind können abholen LY ohne electroporation.The Wachstumsmedium wurde von T51B Zellen und Zellen entfernt wurden in einer Laminar-Flow-Haube für 30 Minuten verlassen. LY wurde anschließend zu den Zellen für 1 min zugegeben und die Zellen wurden anschließend fixiert, gewaschen und unter dem Fluoreszenz (oben) oder Phasenkontrast-(unten) fotografiert Beleuchtung. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5. Der Grb2-SH2 blocking peptide hemmt EGF-vermittelte ERK-Aktivierung in intakten, lebenden Zellen. Kombination GJIC und Signaltransduktion Studien. Nach Ligandenbindung, eine Anzahl von Wachstumsfaktor-Rezeptoren, wie den epidermalen Wachstumsfaktor Receptor (EGFR) sind trans-phosphoryliert zu spezifischen Tyrosin-Reste. Diese bilden Andockstellen für die Src-Homologie-2-Domänen von Signalgebern, wie Grb2, die den GTP / GDP-Austauschfaktor SOS, die so auf die Membran gebracht wird, und aktiviert Ras gebunden ist. Dies führt zur Aktivierung der Raf / MEK / ERK Kaskade, und die Phosphorylierung von Erk einem P TE P Y Sequenz. Daher Sondieren mit spezifischen Phospho-Erk-Antikörper können ein Maß für die Aktivierung des EGF-Rezeptors. Nach der Fixierung werden die Zellen mit einem Anti-Antikörper Perk (Cell Signaling) sondiert, gefolgt von einem Biotin-gekoppelten sekundären Antikörper, Streptavidin-Horse-Rettich-Peroxidase und Diaminobenzidin-Substrat, das eine braune Farbe 29 gibt. In diesem Experiment wurde ein Phosphopeptid Blockierung der Grb2-SH2-Domäne (PVPE p Y IEQ) durch in situ Elektroporation into NIH 3T3 Zellen, die in Kammern und Elektroporation in verbrauchten Medium wachstums verhaftet. 5 min nach der Impuls Anwendung wurden die Zellen mit EGF für 5 min stimuliert, fixiert, für aktivierte phospho-ERK1 / 2 durch Immunoperoxidase stainingand Zellen aus dem gleichen Gebiet unter Hell (oben) oder Phasenkontrast (unten) fotografiert Beleuchtung sondiert. Beachten Sie, dass die Grb2-SH2 blocking peptide den EGF-Signal drastisch reduziert, dh, Erk-Phosphorylierung (Bereich A). Die Hemmung des Signals erstreckt sich in ~ 3-4 Reihen von benachbarten Zellen in der nicht-elektroporiert Bereich (Zickzackwinkel), wahrscheinlich aufgrund der Bewegung des 1123 Da-Peptid durch gap junctions. Diese Feststellung bildet zwingende Beweise dafür, daß die beobachtete Hemmung muss aufgrund des Peptids, sondern als ein Artefakt der Elektroporation, da Zellen, die in diesem Bereich hat keinen Strom empfangen, aber das Peptid von ihren Nachbarn erfasst. Zur gleichen Zeit gibt es keine nachweisbare Wirkung auf die Zellmorphologievon Phasenkontrast gezeigt. Der Pfeil zeigt auf die Kante der Fläche elektroporiert. Vergrößerung: 240x. Für mehr Details und Kontrollen siehe Referenz 29. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Kritische Schritte in dem Protokoll
Elektroporiert Material
Die Reinheit des Materials, elektroporiert werden, ist sehr wichtig. Wenn die Zellen sehr flach sind, müssen dann höhere Konzentrationen des Tracking-Farbstoff verwendet werden (bis zu 20 mg / ml für LY) und in solchen Fällen ist die Reinheit noch wichtiger als in Zellen, die mit einer kugelförmigen Form 1. Neben LY eine große Vielzahl von anderen Farbstoffen oder nonpermeant Moleküle eingesetzt wurden, wie beispielsweise eine Reihe von Alexa-Farbstoffe, um als Sonden für die Kanäle, die aus verschiedenen Connexine 25 verwenden. Jedoch sind Farbstoffe wie Ethidiumbromid oder Propidiumiodid in der DNA interkaliert, so dass die Kerne fluoresziert sehr stark, was die Quantifizierung der Farbstoffübertragung erschwert (4D) ist. Die Tracking-Farbstoffe müssen vorbereitet werden und Waschungen in calciumfreien Wachstumsmedium durchgeführt, weil ein Calcium-Einstrom kann Junction-Kommunikation zu unterbrechen, sowie die Senkung cell Lebensfähigkeit. Alle Lösungen sind bei 37 o C vor der Elektroporation, der Porenverschluss erleichtert und Lebensfähigkeit 1 gehalten werden.
Bestimmung der optimalen Spannung und Kapazität
Elektrische Feldstärke ist ein kritischer Parameter für die Zelldurchlässigkeit, sowie Lebensfähigkeit. Die Anwendung von Mehrfachimpulsen hat sich gezeigt, bessere Ergebnisse hinsichtlich der Durchlässigkeit und die Lebensfähigkeit der Zellen als eine Einzelimpuls bieten. Die Insitu Porator Vorrichtung Zell Projekte verfügt über drei Einstellungen für Kapazität und Pulszahl: Mild (10 Impulse, 10 us auseinander, 0,1 Sekunden zwischen den Impulsen), Medium (20 Impulse, 80 us auseinander, 0,2 Sekunden zwischen den Impulsen) und Strong (50 Impulse , 120 us auseinander, 0,5 s zwischen den Impulsen), während die Spannung fein unabhängig (2-45V gesteuert werden). In der Tat, flachen Zellen erfordern niedrigere Spannungen als diejenigen verwandelt, Zellen in einem Klumpen oder Zellen mit einem kleinen Klebefläche auf dem Untergrund (zB Sf9-Insektenzellen), Möglicherweise aufgrund der großen Strommengen, die durch einen längeren Zelle, die in Kontakt mit einem leitfähigen Bereich größer ist. Für weitere Details zu diesem Thema finden Sie in 1.
Mögliche Probleme und Fehlerbehebung
Wenn die Zellen während der Manipulationen abgeschabt wurden, können sie holen die Farbstoff fluoresziert und ohne Elektroporation (4A). Die Menge an Energie an die Zellen geliefert beeinflusst die Effizienz der Elektroporation. Wenn der Impuls zu schwach ist (das heißt, zu niedrige Spannung und Pulseinstellungen), dann erscheinen die Zellen unter dem Phasenkontrast normal, aber sie nicht fluoreszieren, außer vielleicht für bestimmte Zellen tot sind oder während der Handhabung abgeschabt worden ist, kann (4A) . Wenn der Puls zu stark ist, unter dem Phasenkontrast Zellen scheinen sehr dunklen Kernen (4B), aber kann einige LY behalten und sogar erlauben, einige Farbstoffübertragung auf benachbarte Zellen. Am Vorabendn höhere Impulse werden die Zellen zerstört (4C). Solche Zellen werden lysiert, deshalb sind sie nicht LY zurückbehalten und fluoreszieren sehr schwach, wenn überhaupt. Bestimmten epithelialen Zelllinien wie T51B Kalotten Strukturen während Mediumwechsel kommen kann. Die umliegenden Zellen können dann fluoreszieren als der Farbstoff durch Gap Junctions (4E) übertragen werden. Beispiele für optimale Bedingungen für die Elektroporation repräsentativen Linien sind in Tabelle 1 gezeigt.
Vorteile gegenüber anderen Techniken und Bedeutung
DNA-Einführung
Es gibt eine Vielzahl von Transfektions-Protokolle, wie beispielsweise Calcium-Phosphat-Kopräzipitation oder 26 verschiedene Arten von Liposomen. Jedoch kann sie die Zelle in subtiler Weise, die sehr wichtig sein kann, insbesondere für die Signaltransduktion Studien betreffen. Zum Beispiel kann die Tyr-705-Phosphorylierung von dem Signalwandler und Aktivator TranskriptIonen-3 (STAT3), die mit Transkriptions-Aktivität korreliert wird dramatisch durch das Verfahren des Calcium-Phosphat-Transfektion, auch in Abwesenheit von DNA erhöht. Dies könnte aufgrund der Tatsache, daß der Niederschlag verändert Zelle Zelladhäsion und Eingriffs Cadherin, ein bekannter Aktivator Stat3 27 sein. Bestimmte Liposomen hatte eine ähnliche, aber weniger ausgeprägte Wirkung, während Elektroporation oder retrovirale Infektion hatte keinen Einfluss auf Stat3 Stufen 6.
Die Einführung von Peptiden
Ein übliches Verfahren ist die Konstruktion eines Fusionspeptids mit Sequenzen, die die Zellmembran durchqueren, wie aus der HIV-tat-Gen abgeleitet ist. Jedoch ist die Übertragung durch die Membran ein relativ langsamer Prozess und Signal Inhibierung nicht so wirksam ist. Für die Untersuchung der Sequenz von Ereignissen, die auftreten, Rezeptoraktivierung durch einen Liganden, der die Fähigkeit zur sofortigen Einleitung eines Peptids, bietet Peptidomimetikum oder andere Verbindung eine wichtige Advantage. Elektroporation einer Zelle durchlässigen Peptid auf seine Aufnahme zu beschleunigen, ist nicht möglich, wahrscheinlich, weil die lipophilen Peptid wird in die Zellmembran eingebettet ist, wie mit FITC-gekoppelten Peptide (Raptis, unveröffentlicht) offenbart. Es ist interessant zu bemerken, dass die Hemmung von ERK-Aktivierung durch EGF durch die Verwendung einer Zelle durchlässigen Peptid blockiert die Grb2-SH2-Domäne beispielsweise nur teilweise 28, während der Elektroporation des gleichen Peptids erreicht eine vollständige Hemmung des Signals 29 ( Abbildung 5). Andere Techniken, basierend auf Liposomen sind in der Existenz. Aber sie erlauben nicht die Prüfung von unbehandelten Zellen Seite an Seite mit Behandelten in Verbindung mit Gap Junction Studien, die die stärkste Beweis dafür, dass das Signal Hemmung muss fällig bieten können, um das Material eingeführt (Abbildung 5, verschnörkelten Halterung , c).
Gap Junction-Studien
Mikroinjektionvon Farbstoffen oder Kratzen Lade werden üblicherweise verwendet, aber sie sind immer Zellschäden einzuführen. Eine andere Technik, fluorescence recovery after photo nicht invasive aber teure Ausrüstung erfordert, und einige Zellen können zu einem Zeitpunkt untersucht werden, während die Bildung von phototoxischen Substanzen kann ein Problem sein. Der Fallschirm-Assay besteht aus Vorspann Zellen mit dem Farbstoff Calcein AM (grün), dann lassen sich die Zellen anhaften, auf einer Zellschicht, wie Gap Junctions bilden innerhalb von 15 min 3 Stunden. Eine große Anzahl von Zellen kann in dieser Weise behandelt werden, aber die Fähigkeit der Zellen, die Gap Junctions in diesem Assay bilden sehr unterschiedlich mit der Zelle 30 ein.
Begrenztheit
Die erforderliche Spannung ist höher für die Einführung von Molekülen mit großer Größe und elektrische Ladungen. Bei den hohen Spannungen für die Einführung von großen Plasmiden erforderlich ist, kann es einige Zelltod. Die relativen Spannungen für verschiedene Moleküle erforderlichzuvor 9,12 beschrieben. Obwohl wir mit einer bestimmten Elektroporationseinrichtung beschreiben die Elektroporation, ist es möglich, dass jemand erlebt mit Elektrogeräten, um sie mit Hilfe der detaillierten Beschreibung zu machen in 19, oder einen einfacheren Aufbau mit einem Top-Elektrode oberhalb der Zellen, und ätzen mit Säuren 1.
Zukünftige Richtungen
Software wurden entwickelt, um genau zu quantifizieren GJIC 31. Eine weitere Verbesserung ist die Entwicklung von Quantenpunkten, die fluoreszieren, wenn sie nur in der Zelle, so dass es keine Notwendigkeit, die Personen Farbstoff waschen. Dies vermeidet die Belastung der Wasch, während der Prozess in lebenden, nicht fixierten Zellen in Echtzeit beobachtet werden. Die Einführung von Peptiden an Signalwege unterbrechen ist eine leistungsfähige Methode für die In-vivo-Bewertung der Relevanz der Wechselwirkungen identifiziert unter Verwendung von gereinigten Komponenten. Die Prüfung der Topfrenz verschiedener Peptide, eine spezifische inhibieren ist der erste wichtige Schritt in der Entwicklung der peptidomimetische Arzneimittel, die für die rationelle Behandlung von Neoplasie.
Andere Kommentare
Die Folien können mit Extran-1000-Lösung mit einer kleinen Pinsel, um die ITO-Oberfläche in der Vertiefung erreichen gewaschen und mit Wasser gespült. Wenn die Zellen auf dem Objektträger fixiert worden ist, kann es notwendig werden, Spuren von Protein mit Trypsin oder anderen proteolytischen Enzymen zunächst zu entfernen. Natriumdodecylsulfat enthaltenden Waschmittel zu vermeiden. Gewaschen Dias können mit Peroxid Gas sterilisiert werden. Es ist jedoch sehr wichtig, um zu vermeiden, das Siegel der auch auf den Objektträger, denn wenn alle LY Lösung Lecks in der Halterung kann es einen Kurzschluss verursachen.
Offenlegungen
The corresponding author is the inventor in a patent held by Queen’s University, which has been licensed to Cell Projects Inc. The company or the University had no influence upon the contents of the paper.
Danksagungen
We thank Lowell Cochran for expert videography assistance. The financial assistance of the Canadian Institutes of Health Research (CIHR), the Canadian Breast Cancer Foundation (CBCF, Ontario Chapter), the Natural Sciences and Engineering Research Council of Canada (NSERC), the Canadian Breast Cancer Research Alliance, the Ontario Centers of Excellence, the Breast Cancer Action Kingston and the Clare Nelson bequest fund through grants to LR is gratefully acknowledged. SG was the recipient of an NSERC studentship. MG was supported by a postdoctoral fellowship from the US Army Breast Cancer Program, the Ministry of Research and Innovation of the Province of Ontario and the Advisory Research Committee of Queen’s University.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Cellgro http://www.cellgro.com/ | 50-013-PB | |
| DMEM without Calcium | Hyclone (Thermo scientific: http://www.thermoscientific.com) | SH30319-01 | |
| Donor Calf Serum | PAA: http://www.paa.com/ | Cat.# B15-008 | |
| Fetal Bovine Serum | PAA: http://www.paa.com/ | Cat.# A15-751 | |
| Electroporation apparatus | Cell Projects Ltd UK: http://www.cellprojects.com/ | ACE-100 | |
| Chambers | Cell Projects Ltd UK | ACE-04-CC | 4-wells |
| Chambers | Cell Projects Ltd UK | ACE-08-CC | 8-wells |
| Lucifer Yellow | Cell Projects Ltd UK | ACE-25-LY | High purity |
| CelTak | BD Biosciences | 354240 | Cell and tissue adhesive |
| Fibronectin | Sigma Aldrich | F1141 | |
| Collagen | BD Biosciences | 354236 | |
| Poly-Lysine | Sigma Aldrich | P8920 |
Referenzen
- Raptis, L., et al. Electroporation of Adherent Cells in Situ for the Study of Signal Transduction and Gap Junctional Communication. Electroporation protocols. , 167-183 (2008).
- Giorgetti-Peraldi, S., Ottinger, E., Wolf, G., Ye, B., Burke, T. R., Shoelson, S. E. Cellular effects of phosphotyrosine-binding domain inhibitors on insulin receptor signalling and trafficking. Mol Cell Biol. 17, 1180-1188 (1997).
- Boccaccio, C., Ando, M., Tamagnone, L., Bardelli, A., Michielli, P., Battistini, C., Comoglio, P. M. Induction of epithelial tubules by growth factor HGF depends on the STAT pathway. Nature. 391, 285-288 (1998).
- Bardelli, A., Longati, P., Gramaglia, D., Basilico, C., Tamagnone, L., Giordano, S., Ballinari, D., Michieli, P., Comoglio, P. M. Uncoupling signal transducers from oncogenic MET mutants abrogates cell transformation and inhibits invasive growth. Proc Nat Acad Sci USA. 95, 14379-14383 (1998).
- Gambarotta, G., Boccaccio, C., Giordano, S., Ando, M., Stella, M. C., Comoglio, P. M. Ets up-regulates met transcription. Oncogene. 13, 1911-1917 (1996).
- Arulanandam, R., Vultur, A., Raptis, L. Transfection techniques affecting Stat3 activity levels. Anal Biochem. 338 (1), 83-89 (2005).
- Boussiotis, V. A., Freeman, G. J., Berezovskaya, A., Barber, D. L., Nadler, L. M. Maintenance of human T cell anergy: blocking of IL-2 gene transcription by activated Rap1. Science. 278 (5335), 124-128 (1997).
- Brownell, H. L., Firth, K. L., Kawauchi, K., Delovitch, T. L., Raptis, L. A novel technique for the study of Ras activation; electroporation of [alpha-32]GTP. DNA Cell Biol. 16, 103-110 (1997).
- Tomai, E., Vultur, A., Balboa, V., Hsu, T., Brownell, H. L., Firth, K. L., Raptis, L. In situ electroporation of radioactive compounds into adherent cells. DNA Cell Biol. 22, 339-346 (2003).
- Raptis, L., Vultur, A., Tomai, E., Brownell, H. L., Firth, K. L. In situ electroporation of radioactive nucleotides: assessment of Ras activity and 32P-labelling of cellular proteins. Cell Biology A Laboratory Handbook, Celis, Ed. 43, 329-339 (2006).
- Nakashima, N., Rose, D., Xiao, S., Egawa, K., Martin, S., Haruta, T., Saltiel, A. R., Olefsky, J. M. The functional role of crk II in actin cytoskeleton organization and mitogenesis. J Biol Chem. 274, 3001-3008 (1999).
- Raptis, L., Firth, K. L. Electroporation of adherent cells in situ. DNA Cell Biol. 9, 615-621 (1990).
- Marais, R., Spooner, R. A., Stribbling, S. M., Light, Y., Martin, J., Springer, C. J. A cell surface tethered enzyme improves efficiency in gene-directed enzyme prodrug therapy. Nat Biotechnol. 15, 1373-1377 (1997).
- Nielsen, M. S., Nygaard, A. L., Sorgen, P. L., Verma, V., Delmar, M., Holstein-Rathlou, N. H. Gap junctions. Compr Physiol. 2 (3), 1981-2035 (2012).
- Geletu, M., Trotman-Grant, A., Raptis, L. Mind the gap; regulation of gap junctional, intercellular communication by the SRC oncogene product and its effectors. Anticancer Res. 32 (10), 4245-4250 (2012).
- Vinken, M., Vanhaecke, T., Papeleu, P., Snykers, S., Henkens, T., Rogiers, V. Connexins and their channels in cell growth and cell death. Cell Signal. 18 (5), 592-600 (2006).
- Fouly, M. H., Trosko, J. E., Chang, C. C. Scrape-loading and dye transfer: A rapid and simple technique to study gap junctional intercellular communication. Exp Cell Res. 168, 430-442 (1987).
- Raptis, L., Brownell, H. L., Firth, K. L., MacKenzie, L. W. A novel technique for the study of intercellular, junctional communication; electroporation of adherent cells on a partly conductive slide. DNA & Cell Biol. 13, 963-975 (1994).
- Anagnostopoulou, A., Cao, J., Vultur, A., Firth, K. L., Raptis, L. Examination of gap junctional, intercellular communication by in situ electroporation on two co-planar indium-tin oxide electrodes. Mol Oncol. 1, 226-231 (2007).
- Tomai, E., Brownell, H. L., Tufescu, T., Reid, K., Raptis, S., Campling, B. G., Raptis, L. A functional assay for intercellular, junctional communication in cultured human lung carcinoma cells. Lab Invest. 78, 639-640 (1998).
- Tomai, E., Brownell, H. L., Tufescu, T., Reid, K., Raptis, L. Gap junctional communication in lung carcinoma cells. Lung Cancer. 23, 223-231 (1999).
- Geletu, M., Chaize, C., Arulanandam, R., Vultur, A., Kowolik, C., Anagnostopoulou, A., Jove, R., Raptis, L. Stat3 activity is required for gap junctional permeability in normal epithelial cells and fibroblasts. DNA Cell Biol. 28, 319-327 (2009).
- Geletu, M., Arulanandam, R., Greer, S., Trotman-Grant, A., Tomai, E., Raptis, L. Stat3 is a positive regulator of gap junctional intercellular communication in cultured, human lung carcinoma cells. BMC Cancer. 12, 605 (2012).
- Brownell, H. L., Narsimhan, R., Corbley, M. J., Mann, V. M., Whitfield, J. F., Raptis, L. Ras is involved in gap junction closure in mouse fibroblasts or preadipocytes but not in differentiated adipocytes. DNA & Cell Biol. 15, 443-451 (1996).
- Weber, P. A., Chang, H. C., Spaeth, K. E., Nitsche, J. M., Nicholson, B. J. The permeability of gap junction channels to probes of different size is dependent on connexin composition and permeant-pore affinities. Biophys J. 87 (2), 958-973 (2004).
- Graham, F. L., vander Eb, A. J. A new technique for the assay of infectivity of human Adenovirus 5 DNA. Virology. 52, 456-467 (1973).
- Arulanandam, R., Vultur, A., Cao, J., Carefoot, E., Truesdell, P., Elliott, B., Larue, L., Feracci, H., Raptis, L. Cadherin-cadherin engagement promotes survival via Rac/Cdc42 and Stat3. Mol Cancer Res 7. , 1310-1327 (2009).
- Williams, E. J., Dunican, D. J., Green, P. J., Howell, F. V., Derossi, D., Walsh, F. S., Doherty, P. Selective inhibition of growth factor-stimulated mitogenesis by a cell-permeable Grb2-binding peptide. J. Biol. Chem. 272, 22349-22354 (1997).
- Raptis, L., Brownell, H. L., Vultur, A. M., Ross, G., Tremblay, E., Elliott, B. E. Specific inhibition of Growth Factor-stimulated ERK1/2 activation in intact cells by electroporation of a Grb2-SH2 binding peptide. Cell Growth Differ. 11, 293-303 (2000).
- Meda, P. Assaying the molecular permeability of connexin channels. Methods Mol Biol. 154, 201-224 (2001).
- Hofgaard, J. P., Mollerup, S., Holstein-Rathlou, N. H., Nielsen, M. S. Quantification of gap junctional intercellular communication based on digital image analysis. Am J Physiol Regul Integr Comp Physiol. 297 (2), R243-R247 (2009).
- Raptis, L., Lamfrom, H., Benjamin, T. L. Regulation of cellular phenotype and expression of polyomavirus middle T antigen in rat fibroblasts. Mol Cell Biol. 5, 2476-2486 (1985).
- Raptis, L., Marcellus, R. C., Whitfield, J. F. High membrane-associated protein kinase C activity correlates to tumorigenicity but not anchorage-independence in a clone of mouse NIH 3T3 cells. Exp Cell Res. 207, 152-154 (1993).
- Vultur, A., Cao, J., Arulanandam, R., Turkson, J., Jove, R., Greer, P., Craig, A., Elliott, B. E., Raptis, L. Cell to cell adhesion modulates Stat3 activity in normal and breast carcinoma cells. Oncogene. 23, 2600-2616 (2004).
- Vultur, A., Arulanandam, R., Turkson, J., Niu, G., Jove, R., Raptis, L. Stat3 is required for full neoplastic transformation by the Simian Virus 40 Large Tumor antigen. Mol Biol Cell. 16, 3832-3846 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten