Method Article
Herstellung von Tissue Microarrays, Immunhistochemie Färbung und Digitalisierung Innerhalb des Human Protein Atlas
In diesem Artikel
Zusammenfassung
Tissue Microarrays ermöglicht eine effiziente Methode zur gleichzeitigen Informationen aus einer Vielzahl von Geweben zu gewinnen. Repräsentative Teile von Geweben in einem einzigen Paraffinblock montiert. Abschnitte aus dem Block für die Immunhistochemie und Analyse der Proteinexpression Muster verwendet. Digitale Abtastung erzeugt entsprechende Bilder für die Verteilung der Daten.
Zusammenfassung
Die Gewebe-Mikroarray (TMA)-Technologie stellt die Mittel für das Hochdurchsatz-Analyse von mehreren Geweben und Zellen. Die Technik wird im Projekt Human Protein Atlas für die globale Analyse von Protein-Expressionsmuster in normalen menschlichen Geweben, Krebs und Zelllinien verwendet. Hier präsentieren wir die Montage von 1 mm-Kerne, aus mikroskopisch ausgewählten repräsentativen Gewebe abgerufen, in einer einzigen Empfänger TMA-Block. Die Anzahl und Größe von Kernen in einer TMA Block von etwa vierzig 2 mm-Kerne zu Hunderten von 0,6 mm-Kerne variiert werden. Der Vorteil der Verwendung von TMA-Technologie ist, dass große Menge von Daten schnell kann mit Hilfe eines einzigen Immunfärbung Protokoll zu experimentellen Variabilität zu vermeiden. Wichtig ist, dass nur eine begrenzte Menge von knappen Gewebeproben erforderlich, die ermöglicht die Analyse von vielen Patienten 1 2. Ungefähr 250 aufeinanderfolgende Abschnitte (4 um dick) kann von einem TMA-Block geschnitten werden und für immunhistochemische staining zu spezifischen Protein-Expressionsmuster für 250 verschiedene Antikörper zu bestimmen. Im Projekt Human Protein Atlas werden Antikörper gegen alle menschlichen Proteinen erzeugt und verwendet werden, um entsprechende Protein-Profile in beiden normalen menschlichen Geweben zu erwerben von 144 Einzelpersonen und Krebsgewebe aus 216 verschiedenen Patienten, die die 20 häufigsten Formen von Krebs beim Menschen. Immunhistochemisch gefärbten Abschnitte TMA auf Glasobjektträgern werden abgetastet, um Bilder mit hoher Auflösung von dem Pathologen interpretieren und können Anmerkungen zu dem Ergebnis der Immunhistochemie erstellen. Bilder zusammen mit entsprechenden Pathologie-basierte Annotation Daten sind öffentlich zugänglich gemacht für die Forschungsgemeinschaft durch die Human Protein Atlas-Portal ( www.proteinatlas.org ) (Abbildung 1) 3 4. Das humane Protein Atlas stellt eine Straßenkarte, die die Verteilung und die relative Häufigkeit von Proteinen im menschlichen Körper. Die aktuelle Versionsion enthält über 11 Millionen Bilder mit Proteinexpression Daten für einzigartige 12,238 Proteine, das entspricht mehr als 61% aller Proteine vom menschlichen Genom kodiert.
Protokoll
1. Wie man Gewebe für Tissue Microarray Produktion vorzubereiten (Animation 1)
- Wählen Sie relevanten Formalin-fixierten Paraffin eingebetteten Material (Gewebe-oder Zellproben) einschließlich entsprechender Hämatoxylin gefärbter Gewebeschnitt.
- Markieren Sie relevanten Bereich auf dem Gewebeschnitt. Es wird empfohlen, einen frisch geschnittenen Hämatoxylin Schnitt entsprechend der Paraffin-Block haben.
- Gestalten Sie die Vorlage für die TMA-Produktion verwendet. Randomize die Proben in der Vorlage, um Artefakte durch technische Probleme wie zum Beispiel Abdeckung des Antikörpers über den gesamten Abschnitt TMA und Schneiden Probleme zu vermeiden. Fügen Sie zusätzliche Marker Orientierung an der Vorlage zur Orientierung.
- Organisieren Sie die Gewebe nach der Vorlage.
2. Manuelle Gewebe-Mikroarray Produktion (wesentlich für Dreharbeiten)
- Um eine einheitliche Länge der Gewebe-Kerne zu erhalten, markieren Sie den Mandrin zB 4,5 mm (Abbildung 2). GuidelInes für Abstand zwischen Probe-Zentren:
Kerngröße 0,6 mm - 0,8 bis 1,0 mm
Kerngröße 1,0 mm - 1,8 bis 2,0 mm
Kerngröße 1,5 mm - 2,0 bis 3,0 mm
Kerngröße 2,0 mm - 2,5 bis 4,0 mm
Es wird empfohlen, 2,5 bis 3,0 mm-Rändern auf jeder Seite des Paraffin-Blocks verlassen, um Rissbildung des Paraffins. - Montieren Sie die ausgewählten Schläge verwendet werden. Starten Sie durch Lösen der Innensechskant Schrauben, die den Stempel in Position hält. Der Stempel korrekt positioniert ist, wenn die Nut des Stempels Nabe fest gegen die Metallstange in der Kunststoff-V-Block angeordnet. Ziehen Sie die Schrauben und stellen Sie sicher, dass der Rand des Metall-Clip horizontal ist.
- Der Empfänger Punsch (grün markiert und rot, die spezifisch für Händler) sollte auf der linken Seite platziert werden. Die Spenderstanze (markiert mit Grün und Blau, die spezifisch für Distributor), die einen geringfügig größeren Durchmesser hat, sollte auf der rechten Seite platziert werden (Abb. 3).
- Verschieben Sie die Schläge entlang der x-und y-Achsen mit Hilfe der XY-Einstellknöpfe. Die richtige Ausrichtung Knopf bewegt die Stempel entlang der x-Achse und der linke Verstellknopf bewegt die Stempel entlang der y-Achse.
Es gibt ein digitales Mikrometer Anzeige auf beiden Einstellknöpfe. Diese werden aktiviert, wenn die Knöpfe bewegen. - Zurücksetzen → drücken Sie die ZERO / ABS-Taste.
Umschalttaste zwischen Zoll und mm → Drücken Sie die IN / mm drücken.
Der Raum zwischen den Löchern sollte 2,0 mm (gemessen zwischen den Zentren der Löcher) bei Verwendung einer 1 mm Stempels für einen 9x8-Vorlage.
- Verschieben Sie die Schläge entlang der x-und y-Achsen mit Hilfe der XY-Einstellknöpfe. Die richtige Ausrichtung Knopf bewegt die Stempel entlang der x-Achse und der linke Verstellknopf bewegt die Stempel entlang der y-Achse.
- Um sicherzustellen, dass Sie nicht drücken Sie den Stempel zu weit nach unten in den Block, Schlagen Sie die Kassette und die Zerstörung der Punsch, lege eine Kassette ohne Paraffin in der Halterung und stellen Sie die untere Position des Empfängers Punsch bis 1 mm über dem Boden der Kassette mit der Tiefe an der Anschlagschraubeoberen linken Ecke des Z-Führung (Abbildung 3).
- Legen Sie die Empfänger-Block in der Halterung und verwenden Sie den kleinsten Schraubendreher, um die Schrauben zu befestigen. Sind die Schrauben nicht zu eng oder das Paraffin könnte ausbrechen aus der Kassette.
- Schieben Sie den Empfänger Punsch nach unten ca. 5 mm in den Empfänger-Block und mit dem Handgriff in der Stanze, um den Stempel hin und her drehen, einmal (Abbildung 3). Das Loch wird 5 mm tief beim Schieben des Stempels so weit unten in den Block wie möglich.
- Entlasten Sie den Druck langsam nach unten schieben, so dass die Federn kann der Stempel nach oben. Verwenden Sie den Führungsstab der Locherabfall und entsorgen Sie die Paraffin-Kern.
- Bewegen Sie den Revolver in der Spenderstanze (Abbildung 3) zu wechseln.
- Platzieren Sie die Donorblock Brücke mit dem Donorblock über dem Empfängerblock (Abb. 3).
- Schieben Sie den Spender punch in den ausgewählten Bereich des Donorblocks. Verwenden Sie einen entsprechenden Hämatoxylin und Eosin gefärbten Objektträger, wo die Region von Interesse markiert wurde, um das Gewebe, die zu beproben als es zu lokalisieren. Manuelles Halten Sie die Donorblock in Position mit der linken Hand und drücken Sie den Stempel mit der rechten Hand. Beachten Sie, dass Sie sollten nicht auf dem Stilett zu schieben. Der Tiefenanschlag blockiert nicht den Stempel Bewegung an der richtigen Position für den Spender-Block, so ist es wichtig, dass Sie aufhören zu drängen, wenn das zweite Zeichen ist sichtbar auf dem Stilett.
- Drehen Sie den Griff auf dem Stempel einmal (Abbildung 3). Langsam den Druck nach unten während Sie die Halterung auf der Donorblock Donorblock Brücke.
- Das Spendergewebe wird vorzugsweise 0,5 mm kürzer als der Empfänger Kern ausgestanzt. Dieser Prozess wird eine einstellbare Ausrichtung der Kerne auf dem Empfängerblock Oberfläche zu gewährleisten, zu vermeiden Verlust wertvoller repräsentativen Gewebe.
- Entfernen Sie die Brücke und die Donorblock. Machensicher, dass die Spenderstanze mit dem Loch, das früher gemacht wurde (Punkt 4) ausgerichtet ist. Sie müssen passen Sie die Lochposition mit den Stellschrauben, wenn der Spender Punsch und das Loch in der Empfänger-Block nicht ausgerichtet sind.
- Schieben Sie den Stempel nach unten, bis seine Spitze erreicht die Spitze des Loches in dem Empfänger-Block. Halten Sie diese Position, verwenden Sie den Mandrin, um das Gewebe Kern in das Loch zu leeren. Die Kernoberfläche sollte in Ausrichtung mit dem Block Fläche sein.
- Bewegen Sie den Revolver zurück an den Empfänger Punsch.
- Bewegen Sie die nächste Position mit den XY-Einstellknöpfe.
- Wiederholen von Punkt 4c oben, bis das Array abgeschlossen ist.
- Wenn die ganze Rezipientenblock beendet ist, lösen Sie die Schrauben in den Empfänger-Halter. Backen Sie den Block in 42 ° C für 40 Minuten. Legen Sie den Block mit dem Schneiden Bereich nach unten auf einen Objektträger aus Glas. Legen Sie den Objektträger aus Glas mit dem Block auf der Spitze eines Probenröhrchenhalter (oder andere geeignete Konstruktion) und in ter Ofen. Nach dem Backen, entfernen Sie das Reagenzglas Halter aus dem Ofen und glätten die Oberfläche des Blocks durch sanftes Streicheln der Objektträger aus Glas.
- Den Block mit dem Glasträger auf einer Kühlplatte für 10 Minuten.
Um repräsentative Gewebe während der TMA gewährleisten eine Qualitätskontrolle auf jeder 50-jährigen Abschnitt durchgeführt wird.
3. Wie in Abschnitt TMAs (Animation 2)
- Schneiden Sie 4 um dicke Schnitte mit Hilfe eines Mikrotoms mit Abschnitt Transfer System (HM 355S, Microm). Das System kann mit allen gängigen Rotationsmikrotome verwendet werden. Das System besteht aus einem Schlitten mit integrierter Überladebrücke, einem erwärmten Wasserbad und einer Steuereinheit. Von der Klinge gleiten die Abschnitte auf der nassen Oberfläche Übertragung über einen Transfer Brücke in das Wasserbad.
- Die Abschnitte sollen aus dem Wasserbad genommen werden unmittelbar nach ihrer ausgestreckt, um das Schmelzen von empfindlichem Gewebe Flecken (zB fetthaltiges Gewebe wie Brust und Gehirn) zu vermeiden. Place der Abschnitt auf einem SuperFrost Objektträger aus Glas. Die Zeit, die Abschnitte im Wasser verbleiben kann, hängt von der Art des Paraffin gewachst verwendet und die Wassertemperatur. Unser Labor Verwendung von Paraffin Histolab Products AB, das einen Schmelzpunkt von 56-58 ° C und wir empfehlen eine Wasserbadtemperatur von 37-39 ° C haben
- Legen Sie die Folien in einer Diahalter für die Trocknung bei Raumtemperatur (RT) über Nacht.
- Die Objektträger werden bei 50 ° C für 12-24 Stunden gebacken. Mit einem Mikrotom ohne STS müssen Sie den Abschnitt von der Klinge in ein Wasserbad manuell mit zB einer Bürste zu transportieren.
4. Test-und Titrationsverfahren zur Immunhistochemie (Animation 3)
Jeder Antikörper an einem standardisierten Testverfahren unter Verwendung speziell gestalteter TMA, die eine Mischung von Geweben und Zelltypen unterzogen. Das Ziel ist es, eine individuelle und optimierte Immunfärbung Protokoll für jeden Antikörper zu bewerten. Zunächst eine Verdünnung, auf Basis von Ameiseibody Stoffkonzentration der dem primären Antikörper getestet. Das Ergebnis dieses Tests Färbung wird verwendet, um weitere Verdünnungen und Optimierung des Protokolls zu führen.
- Entparaffinierung und Rehydrierung in Xylol und abgestuften Ethanol zu destilliertem Wasser vor der Immunfärbung durchgeführt.
- Eine Sperrung Schritt, um endogene Peroxidase zu stillen wird in 0,3% H 2 O 2 in 95% Ethanol für 5 Minuten durchgeführt.
- Hitze Induzierte Epitop Wiedergewinnung (HIER) ist in einem Retrieval-Puffer pH 6 durchgeführt, mit einem Druckkessel (enttarnen Kammer Biocare Medical) als Wärmequelle für 4 Minuten bei 125 ° C Nach Abschluss Kochen, bleiben Folien in der Druck-Kessel und dürfen bis 90 ° C abkühlen Die gesamte Bearbeitungszeit für das HIER ist ca. 45 Minuten.
- Wenn kein schlüssiges Ergebnis im ersten Test erhalten wird, werden weitere Tests auf der Basis der beobachteten Färbemuster 5 6 getan. Eine Pilotstudie, in der HPA High-Throughput-Set-up, zeigte, die die nützlichsten Antigen-Retrieval, wo HIER pH 6, aber auch andere Suchverfahren wie Pre-Inkubation mit Proteinase, Mikrowelle und siedet in Puffer mit höheren oder niedrigeren pH natürlich verwendet werden. Durch die Änderung der IHC Bedingung zB Wechsel Antikörper Inkubationszeiten, Antikörperverdünnungen und Diaminobenzidin (DAB) Inkubationszeiten das Färbungsmuster geben kann mehr schlüssige Ergebnisse.
5. Färbung Programm, Autostainer 480 (Thermo Fisher Scientific)
Alle Inkubationen werden bei RT durchgeführt und dieses Protokoll kann auch in ein manuelles Setup mit den gleichen Reagenzien verwendet werden.
- Spülen in Waschpuffer.
- Die Inkubation mit Ultra-V-Block für 5 Minuten.
- Spülen in Waschpuffer.
- Inkubation mit dem primären Antikörper für 30 Minuten.
- Spülen in Waschpuffer (x2).
- Inkubation mit Meerrettich-Peroxidase markierten-Polymer für 30 Minuten.
- Spülen in Waschpuffer (x2).
- Die Entwicklung in DAB-Lösungfür 10 Minuten.
- Spülen in Waschpuffer (x2).
- Gegenfärbung in Mayers Hämatoxylin für 5 Minuten *. Bei Verwendung eines progressiven Färbemethode (zB Mayers Hämatoxylin) Die Intensität hängt von Zeit und keine Differenzierung erforderlich ist. Eine regressive Färbemethode z. B. Harris Hämatoxylin erfordert Differenzierung, um überschüssige Farbstoff aus dem Gewebe zu entfernen, um eine Struktur akzentuieren.
- Spülen in Leitungswasser *.
- Spülen Sie in Lithiumcarbonat Wasser 1:5 verdünnt aus gesättigten Lösung für 1 Minute *.
- Spülen in Leitungswasser für 5 Minuten *.
- Die Folien sind dehydriert in abgestuften Ethanol und Dias werden mit einem Deckglas (PERTEX, Histolab)
Alle Reagenzien werden bei einem Volumen von 300 ul pro Objektträger aufgetragen.
* Die Schritte 10-14 werden in einem histostaining Instrument (Autostainer XL, Leica) getan und Eindecken ist zusätzlich in einem Eindecker-System (Automated Glas-Eindecker CV5030, Leica) durchgeführt.
6. Vorgehensweise beim Scannena Schieben
Das Verfahren Scannen von Dias ist abhängig von der digitalen Scanner ausgenutzt wurde dieses Protokoll nur definiert, wie eine Folie über das automatisierte Scannen System Aperio XT (Aperio Technologies) zu scannen. In der Human Protein Atlas Aufbau 20-facher Vergrößerung für das Gewebe und 40x für die Zellen verwendet werden. Automatisiertes Scannen könnte auftreten Fokus-Probleme aufgrund der Heterogenität des Gewebes und die Anzahl der verschiedenen Geweben in einem TMA enthalten.
- Reinigen Sie den Objektträger aus Glas von Schmutz, Kleber und prüfen Sie, ob Luftblasen zwischen dem Deckglas und dem Abschnitt. Im Falle von Luftblasen remount der Schieber.
- Legen Sie die Folie in einem Rack und legen die Zahnstange in der digitalen Scanner. Die Zeit, um einen TMA bei 20-facher Vergrößerung zu scannen beträgt ca. 6 Minuten. Eine Software von Aperio wird verwendet, um Interessengebiet auszuwählen. Fokuspunkt Auswahl wird automatisch in der Software gemacht. Manuelles Auswahl des Scan-Bereichs und Schwerpunkte ist ebenfalls möglich.
- Nachdem das Bild hso generiert wurde, kann für die Auswertung und Kommentierung der IHC-Färbung verwendet werden. Die Bilder bleiben als Ergebnis des Experiments Datei und kann den Kollegen für Gespräche verteilt werden und weitere für die Veröffentlichung der Daten verwendet wird. Die Bilder können in einem frei verfügbaren Software durch Aperio angesehen werden.
7. Wie Sie für Ihre Lieblings-Protein in der Human Protein Atlas Suche
- Navigieren Sie zu www.proteinatlas.org.
- Geben Sie den Namen Ihres Lieblings-Protein, Ensembl id, UniProt Zugangsnummer oder HGNC Namen zB Insulin.
- Geben Sie die Übersichtsseite und scrollen Sie zum normalen Gewebe-und Organersatz Zusammenfassung. Die Übersicht zeigt die Proteinexpression in der Bauchspeicheldrüse.
- Klicken Sie auf "mehr Gewebe Daten". Sie betreten das normale Gewebe sehen, wo Sie sehen können alle Gewebe durch Orgel gehörten sortiert.
- Klicken Sie auf Bauchspeicheldrüse, um die Ergebnisse für IHC 3-Antikörper auf das gleiche Protein gerichtet zu sehen. Um einen hallo ansehenGH-Auflösung von Pankreas Klick auf das Bild.
- Zusätzliche Hinweise zur Proteinexpression in Krebsgewebe, Zellen und eine weitere Validierung von Daten innerhalb des Human Protein Atlas kann durch Durchsuchen des Human Protein Atlas Website gefunden werden.
8. Repräsentative Ergebnisse
Animation 1. Wie man Gewebe für Gewebe-Mikroarray Produktion vorzubereiten. Klicken Sie hier um Animation 1 sehen .
Animation 2. Wie Abschnitt TMAs. Klicken Sie hier um Animation 2 anzuzeigen .
Animation 3. Die Immunhistochemie Technik beschrieben wird. Klicken Sie hier, um die Animation 3 sehen .

Abbildung 1. Allgemeine Systematik des Prozesses innerhalb des Human Protein Atlas Uppsala.

Abbildung 2. Donor Mandrin für standardisierte Länge von Gewebe Kerne markiert zB 4,5 mm.

Abbildung 3. Manuelle Gewebe Microarrayer.
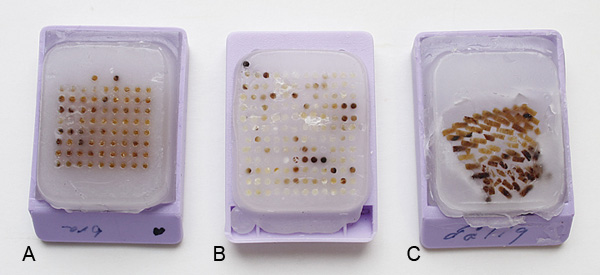
Abbildung 4. Beispiele für unterschiedliche Qualität der produzierten TMAs. (A) eine gerade übereinander TMA mit ausreichend Platz zwischen den Zeilen und Spalten als auch an den Rand des Paraffins. (B) einer TMA mit einigen der Kerne zu nahe am Rand was wahrscheinlich Schwierigkeiten beim Schneiden zu schließen. (C) eine TMA, die seit t gebackenoo lange was zu einer eingestürzten TMA ohne die richtige Vorlage.

Abbildung 5. Hämatoxylin und Eosin gefärbt TMAs. (A) Ein richtig geschnitten mit geradem Schnitt und ausgerichtet Spalten und Zeilen. Mit einem schlecht oder schmutzig Klinge konnte in Splitting (B) oder komprimierte Abschnitte (C) führen.

Abbildung 6. Titration von Antikörpern. (A) Reaktionszentrum Zellen in Lymphknoten zeigt eine optimal titriert Antikörper, was zu einer spezifischen zytoplasmatische (gezeigt in braun) ohne Hintergrund. (B) Der Gewebeschnitt zeigt schwache Färbung. Negative oder eine schwache Färbung gefunden wird, wenn die Konzentration des primären Antikörpers zu niedrig ist oder das Zielprotein nicht in den immunogefärbten Gewebe. (C) der Gewebeschnitt ist überfärbt aufgrund einer zu hohen Konzentration des primären Antikörpers zu verwenden. Das dArche Farbe führt zu Schwierigkeiten Bestimmung der subzellulären Ort durch überschwappen, Kreuzreaktivität und falsche Positivität.
Diskussion
Immunhistochemie ist bei weitem am häufigsten verwendeten Anwendung für TMA. Die Kombination von IHC und TMA kann auf verschiedene Einstellungen verwendet werden, zB das Hochdurchsatz-Screening von Protein-Expressionsmuster in den Geweben und Zellen 7 8 9 10, die Entdeckung neuer Biomarker-Studien an Gewebeproben von vielen Patienten 11 12 und mehr grundlegende Tumorbiologie Studien, darunter verschiedene Phänotypen / Genotypen, Differenzierungsstadien, Progression und Metastasierung 13. Ein Vorteil der Verwendung TMAs ist, dass Material aus großen Kohorten auf einmal analysiert werden, beide spart wertvolle biologische Material und die Sicherstellung reproduzierbarer Experimente. Darüber hinaus spart der Einsatz von TMA-Technologie auf Kosten für Reagenzien und Laborgeräte Verarbeitungszeit. Als TMA enthält nur eine begrenzte Menge an Gewebe ist Gewebe Heterogenität ein Problem. Je nach der Art des Gewebes und Fragen beantwortet werden, können mehrere Proben aus der gleichen specime erforderlichn. Für Tumorgewebe ist die Verwendung von zwei bis vier Kerne aus jeder Probe zu empfehlen, da gezeigt wurde, dass in einem hohen Maß an Genauigkeit in der Darstellung der gesamten Gewebeschnitte 13 14 führen. Je nach Zusammensetzung des Gewebes der Durchmesser der Stempel (im Bereich von 0,6 mm bis 2 mm) einstellbar ist. Die Gewebe sind komplex und besteht aus den beiden verschiedenen Zelltypen, Strukturen und extrazelluläre Matrix. Zusammensetzung nach jedem unterschiedlichen Gewebetyp, die variable Menge an Fett, wird Blutgefäße, Bindegewebe, Knorpel, etc., auf die Druck zum Stanzen und zur getrennten Kernen benötigt. Es ist daher wichtig, alle Schritte in dem Verfahren auf Material, das nicht von Wert zu praktizieren, vor der Erstellung eines TMA mit definierten Gewebe für die Experimente bestimmt.
Beim Schneiden einer Vielzahl von verschiedenen Geweben innerhalb eines TMA-Block die Zusammensetzung des Blocks beeinflussen könnte die Fähigkeit, qualitativ hochwertige Abschnitte zu erwerben. Certain Gewebe, zB Haut, Knochenmark-, Fett-, Hirn und Brust, machen der TMA-Block schwierig aufgrund der Auswirkungen von Unterschieden in der Textur zu bewirken, wie Abschnitte ausstrecken im Wasserbad Schneiden und wie unterschiedliche Härte wird durch die Klinge geschnitten usw. Es wird daher zur Gruppe Geweben mit ähnlichen Eigenschaften empfohlen zB Lipid-reiche Gewebe in ein TMA, wenn anwendbar. Die Mehrheit der Krebsgewebe sind in diesem Sinne homogen, erleichtert das Schneiden von Krebs TMAs. Eine alternative Schneiden Verfahren zur Stabilisierung der Mikroarray Kerne bei der Handhabung eines TMA mit heterogenen Arten von Geweben werden. Die Verwendung eines Klebebandes kann hilfreich sein, um den Verlust von Kernen und Fall-out in der Schnittdarstellung TMA zu vermeiden. Die Verwendung von Klebeband mit Vorsicht verwendet werden, da das Band der Dicke geschnittene Kerne beeinflussen können und anschließend auch das Ergebnis der immunhistochemischen Färbung 15. In der Human Protein Atlas Set-up eine TMA-Vorlage von 9x8 (ohne Markierungen) Kerne are verwendet. Es ist wichtig, um eine maximale Anzahl von Abschnitten zu erhalten und behalten alle Gewebe im gesamten Block dargestellt. Zum Scannen von Reagenzien und Zeit zu sparen, sind 2 Abschnitte auf einer Glasplatte mit einer maximalen Vorlage von 9x8 platziert.
Der große Protein-Repository für Informationen, beinhaltet Universal-Protein-Ressourcen-16 etwa 20,300 bewertet menschlichen Protein-Einträge, von denen nur etwa 66% haben Hinweise auf Protein-Ebene. Auch für einen Großteil der Gene, für die es Beweise des Daseins auf der Protein-Ebene gibt es kaum oder keine Informationen über die Funktion des Proteins und die Verteilung des Ausdrucks. Eine wichtige Herausforderung für die Zukunft ist es, das Verteilungsmuster und die relative Häufigkeit dieser unbekannte Proteine in verschiedenen Arten von menschlichem Gewebe zu analysieren. Die Informationen aus Datenbanken wie Uniprot, ENSEMBL veröffentlichte Daten von PubMed kann als Richtlinie verwendet werden, um festzustellen, ob immunhistochemische Färbung Muster mit Hilfe von Antikörpern zuStationen unbekannte Proteine repräsentieren tatsächliche Protein-Profile der beabsichtigten Zielprotein. Darüber hinaus werden verschiedene andere Validierung Strategien benötigt, um Antikörper-Funktionalität zu gewährleisten, zum Beispiel Antikörper-Funktionalität in Protein-Arrays, Western Blot, Immunfluoreszenz, Immunpräzipitation und Pull-down Experimenten. Vielleicht das wichtigste Werkzeug zur Validierung von Antikörper-Funktionalität gepaart ist, um Antikörper zu verwenden, dh zwei verschiedene Antikörper gegen separate, nicht überlappende Epitope auf dem gleichen Zielprotein angehoben, um Assay-spezifische Ergebnis 17 zu vergleichen.
Basierend auf den gesammelten Informationen werden Antikörper getestet und nach IHC-Standards und der Erfahrung aus der Testung und Validierung über 35.000 Antikörpern im Projekt Human Protein Atlas titriert. Seit mehr als 20% aller Gene mit Protein-Profile wurden die Daten aus Doppelbestimmungen Antikörper (2 oder mehr Antikörper gegen nicht-überlappende Epitope auf dem gleichen Protein) wurde verwendet, um eine bestmögliche Schätzung zu bestimmenKumpel des entsprechenden Proteins Expressionsmuster. Gepaart Antikörper bieten eine ultimative Strategie für die Validierung von spezifischen Immunhistochemie-basierten Protein-Expressionsmuster. Diese Strategie ist wertvoll, weil die Vielzahl unterschiedlicher Gewebe in der Basis-Screening enthalten erhöht das Risiko für Kreuzreaktivität. Es ist auch anzumerken, dass bestimmte Gewebe im Allgemeinen anfälliger sind, um die Hintergrundfärbung zB Makrophagen, glatte Muskelzellen, distalen Tubuli in der Niere und Leber in Hepatozyten zeigen werden. Zusätzliche Probleme zu berücksichtigen sind Schwankungen in Gewebe Verarbeitungstechniken im Laufe der Zeit für die Gewebe von Archivgut übernommen, die zu falsch negativen oder unangemessen positive IHC-Färbungsmuster führen kann. Dieses Phänomen wird auch in großen Abschnitt Analyse gestoßen. Sowohl negative als auch positive Kontrollen sind unerlässlich und sollte verwendet werden, wann immer möglich sein. Für tiefere Studien mit funktionellen Analysen, Zelllinien mit forcierter Expression und spezifische Knock-down von entsprechenden transcripts (siRNA-Technologie) können verwendet werden, um Kontrollen zu schaffen. Für optimale Ergebnisse in IHC, ist es wichtig zu testen und zu nutzen Antigen-Retrieval-Systeme, da die Formalinfixierung induziert verschiedene chemische Modifikationen wie zB die Vernetzung, die Hydrolyse von Schiff-Basen Maskierung des Antigens 18.
Zusammenfassend ist Antikörper-basierten Proteomik beschäftigt TMA-Technologie und IHC eine leistungsfähige Strategie zur Erzeugung von Protein-Expression Daten im großen Maßstab. Das Projekt Human Protein Atlas wurde eingerichtet, um eine Landkarte des menschlichen Protein-Expression in normalen menschlichen Geweben und Krebs erzeugen gesetzt. Das Ziel dieses Projektes ist es, einen ersten Entwurf eines umfassenden Human Protein Atlas bis zum Jahr 2015 zu präsentieren. Neben der Bereitstellung von Protein-Profilen in normalen Organen und Geweben, diese Anstrengung auch einen Ausgangspunkt für die biomedizinische Forschung Projekte, einschließlich der klinischen Biomarker-Entdeckung Bemühungen. Das ultimative Ziel ist es, eine Information nächsten Schicht über die menschliche Genomsequenz hinzufügen, dass wiwerde entscheidend sein für ein tieferes Verständnis der zugrunde liegenden Biologie verschiedenen Krankheitszuständen, und eine Grundlage für die Entwicklung neuer diagnostischer und therapeutischer Werkzeuge.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch Zuschüsse aus dem Knut und Alice Wallenberg-Stiftung unterstützt. Das gesamte Personal der Human Protein Atlas-Zentren in Uppsala, Stockholm und Indien sind für ihre Bemühungen, das Human Protein Atlas erzeugen anerkannt. Die Autoren möchten besonders danken Frank Hammar und Sofie Gustafsson für die Unterstützung bei der Fotos und Elene Karlberg für die Unterstützung bei der TMA-Produktion beim Filmen.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Waschpuffer | Thermo Fisher Scientific | TA-999-TT | |
| Citratpuffer pH 6 | Thermo Fisher Scientific | TA-250-Pm1X | |
| Antikörperverdünnung | Thermo Fisher Scientific | TA-125-UD | |
| UltraVision LP HRP Polymer | Thermo Fisher Scientific | TL-125-HL | |
| DAB Plus-Substrat-System | Thermo Fisher Scientific | TA-125-HDX | |
| Ultra-V-Block | Thermo Fisher Scientific | TA-125-UB | |
| Primary Antibody Enhancer | Thermo Fisher Scientific | TL-125-PB | |
| Mayers Hämatoxylin | HistolAB | 01820 | |
| PERTEX | Histolab | 00871.0500 | |
| Bezeichnung des Geräts | Firma | Katalog-Nummer | |
| Manuelle Tissue Micro Arrayer | Estigen, Beecher Instruments | MTA-1 | |
| Wasserfall Mikrotom | Thermo Fisher Scientific | Microm HM 355S | |
| Automatisierte Bildscanner | Aperio Technologies | XT | |
| Automatisierte Objektträgerfärbung System | Thermo Fisher Scientific | Autostainer 480S-2D | |
| Automatisiertes System für Objektträgerfärbung deparafinization und Dehydration | Leica Biosystems | Autostainer XL | |
| Automatisierte Glas-Eindecker | Leica Biosysteme | CV5030 | |
| Enttarnen Kammer | Biocare Medical | DC2008INTEL | |
Referenzen
- Battifora, H. The multitumor (sausage) tissue block: novel method for immunohistochemical antibody testing. Lab Invest. 55, 244-244 (1986).
- Kononen, J., Bubendorf, L., Kallioniemi, A. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat. Med. 4, 844-844 (1998).
- Berglund, L., Bjorling, E., Oksvold, P. A genecentric Human Protein Atlas for expression profiles based on antibodies. Mol. Cell Proteomics. 7, 2019(2008).
- Uhlen, M., Bjorling, E., Agaton, C. A human protein atlas for normal and cancer tissues based on antibody proteomics. Mol. Cell Proteomics. 4, 1920(2005).
- Paavilainen, L., Edvinsson, A., Asplund, A. The impact of tissue fixatives on morphology and antibody-based protein profiling in tissues and cells. J. Histochem. Cytochem. 58, 237-237 (2010).
- Paavilainen, L., Wernerus, H., Nilsson, P. Evaluation of monospecific antibodies: a comparison study with commercial analogs using immunohistochemistry on tissue microarrays. Appl. Immunohistochem. Mol. Morphol. 16, 493-493 (2008).
- Kampf, C., Andersson, A. C., Wester, K. Antibody-based tissue profiling as a tool for clinical proteomics. Clinical Proteomics. 1, 285-285 (2004).
- Ponten, F., Jirstrom, K., Uhlen, M. The Human Protein Atlas - a tool for pathology. J. Pathol. 216, 387-387 (2008).
- Andersson, A. C., Stromberg, S., Backvall, H. Analysis of protein expression in cell microarrays: a tool for antibody-based proteomics. J. Histochem. Cytochem. 54, 1413-14 (2006).
- Stromberg, S., Bjorklund, M. G., Asplund, C. A high-throughput strategy for protein profiling in cell microarrays using automated image analysis. Proteomics. 7, 2142(2007).
- Jogi, A., Brennan, D. J., Ryden, L. Nuclear expression of the RNA-binding protein RBM3 is associated with an improved clinical outcome in breast cancer. Mod. Pathol. 22, 1564(2009).
- Magnusson, K., De Wit, M., Brennan, D. J. SATB2 in combination with cytokeratin 20 identifies over 95% of all colorectal carcinomas. Am. J. Surg. Pathol. 35, 937(2011).
- Nocito, A., Kononen, J., Kallioniemi, O. P. Tissue microarrays (TMAs) for high-throughput molecular pathology research. Int. J. Cancer. 94, 1(2001).
- Rimm, D. L., Camp, R. L., Charette, L. A. Tissue microarray: a new technology for amplification of tissue resources. Cancer J. 7, 24(2001).
- Catchpoole, D., Mackie, N., McIver, S. Tape transfer sectioning of tissue microarrays introduces nonspecific immunohistochemical staining artifacts. Biotech. Histochem. , (2010).
- UniProt. Nucleic acids research. 39, D214(2011).
- Uhlen, M., Oksvold, P., Fagerberg, L. Towards a knowledge-based Human Protein Atlas. Nature Biotechnol. 28, 1248(2010).
- Leong, A. S., Leong, T. Y. Standardization in immunohistology. Method Mol. Cell Biol. 724, 37(2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten