Method Article
体外研究 Er、Cr:YSGG 和二极管激光器对钛柱面的影响评价
摘要
在这项研究中,Er,Cr:YSGG 和二极管激光器分别应用于总共 96 个专门设计的钛圆柱体的平面。将热电偶放置在另一个表面上并测量温度。通过轮廓仪、SEM 和 AFM 分析表面粗糙度。
摘要
种植体周围疾病是与种植牙相关的重大问题。本研究的目的是评估将二极管和铒、铬掺杂钇-钇-镓-石榴石 (Er,Cr:YSGG) 激光器应用于钛圆柱体治疗非手术种植体周围疾病时的表面粗糙度和温度变化。包括对照组在内,用 940 nm 二极管 (0.8 W-1.3 W-1.8 W) 和 Er,Cr:YSGG (1.5 W-2.5 W-3.5 W) 激光器在 20s/W 和 40 s/W 6 种不同功率模式下形成 13 组,每组处理 8 个钛圆柱体。在此过程中,使用放置在圆柱体顶端槽中的热电偶记录初始和最终温度。应用后,通过轮廓仪测量所有圆盘的粗糙度 (Ra)。用扫描电子显微镜 (SEM) 和原子力显微镜 (AFM) 扫描表面,进行二维和三维表面检查。当评估钛圆柱体在辐照过程中的温度变化时,用二极管激光照射 40 s 的圆柱体显著高于照射 20 s 的圆柱体。在 Er,Cr:YSGG 处理的圆柱体中,一些样品的温度降低,而一些样品的温度升高幅度最小。就所有组的粗糙度而言,轮廓仪值 (Ra) 均无统计学意义。然而,SEM 图像显示处理过的表面上会熔化并且微孔数量增加。由于这项 体外 研究的局限性,Er、Cr:YSGG 和二极管的应用可以被视为治疗种植体周围炎的安全方法,尤其是在热安全性方面。虽然表面粗糙度保持不变,但使用这些激光器会导致 Ti 圆柱形形貌上的熔化变化和微孔。为了确定这些激光设置如何影响细菌减少和骨整合,需要额外的研究。
引言
种植牙是替代丢失牙齿的普遍接受的治疗选择1,2。种植体周围粘膜炎和种植体周围炎被归类为种植体周围疾病。种植体周围粘膜炎仅限于软组织,除生理性骨重塑外,没有骨丢失的证据。种植体周围炎是一种与牙菌斑相关的病理状况,会影响种植牙周围的组织。它的特点是种植体周围粘膜的炎症和随之而来的支撑骨损失的增加3。疾病开始和进展的主要病因是种植体周围斑块生物膜的破坏4。大量关于种植体周围疾病的研究表明,种植体周围粘膜炎 (PIM) 的患病率为 9.7% 至 64.6%,而种植体周围炎 (P) 的患病率为 4.7% 至 45%5。
虽然斑块积聚是导致种植体周围炎的主要病因因素,但由于种植体的地形特征不同,其治疗变得复杂。非手术种植体周围炎治疗的基础是通过种植体表面的清创和消除粘附的生物膜来减少细菌载量低于致病阈值 6,7 进行感染管理。钛界面和骨缺损解剖结构的复杂微观和宏观地形限制了表面去污。已经综合评估了不同机械(刮擦、超声波装置、空气粉末磨损、钛刷)、化学(柠檬酸、洗必泰、抗菌剂)和物理(激光、光动力疗法)净化技术的功效8。目前的研究表明,联合使用非手术干预技术治疗种植体周围炎比单独清创更有效9。将化学抗菌剂或局部/全身抗生素纳入机械治疗已显示出显著的疗效;然而,这些干预措施可能会导致可能的不良后果10。随着激光技术的进步,牙科激光因其对种植体表面的抗感染、解毒和用户友好作用而越来越受欢迎10,11。
吸收峰、设备的工作模式和组织特性会影响激光照射过程中的热量增加。一项关键的临床前调查显示,温度升高到 50 °C 持续 1 分钟会导致血管损伤,而升高到 60 °C 会导致血流停止和随后的骨坏死12。 一项体外 研究发现,仅经过 10 秒的二极管激光照射后,植入物表面的温度就可能高于骨骼安全阈值 (10 °C)。仅升高 10 °C 就可能影响骨骼活力13。
最近的许多研究都集中在检查激光在该领域的有益影响 14,15,16,17,18。当应用适当的参数时,各种激光波长对植入物表面显示出显着的抗菌效果和安全性。许多变量,包括强度、频率和波长,都会影响激光治疗的疗效。多项研究表明,各种激光波长的杀菌作用,包括 CO2、Er:YAG、Er、Cr:YSGG 和各种二极管激光器,这使我们能够确定不同激光在治疗种植体周围炎中的有益作用。Aoki 等人 19,20,21。从他们的审查中得出结论,激光应用有助于非手术和手术种植体周围治疗(包括再生疗法)中的表面清洁,并通过激活周围的组织细胞促进愈合22。
二极管激光器能够在不影响植入物表面图案的情况下对植入物表面产生杀菌作用。在治疗种植体周围炎时,二极管激光器可能是必经之路,因为它可以促进牙周组织的愈合 23,24,25。
掺铒、铬掺杂:钇、钪、镓、石榴石 (Er,Cr:YSGG) 激光器在消除生物膜和去除植入物表面污秽方面表现出有效的特性11。铒激光器表现出强大的杀菌作用和骨再生特性,由于其水动力特性,而不会造成机械损伤11,14。
关于激光照射对钛植入物造成的改变的数据不足。此外,尚未确定钛表面照射的明确方法,包括激光参数,例如功率和应用时间。以前的研究表明,Er,Cr:YSGG 激光16 的应用对温度变化没有影响,然而,二极管激光研究超过了 13 并且没有超过临界值16,26。激光处理对钛表面 Ra 值影响的不同结果可在文献18,27 中找到。该研究的零假设是 Er,Cr:YSGG 激光器和二极管激光器在使用钛表面的温度和粗糙度变化方面没有差异。本研究旨在通过使用 Er、Cr:YSGG 和二极管激光器在不同时间和功率设置下监测钛材料的表面粗糙度和温度变化来确定安全作参数。使用热电偶评估温度变化,使用轮廓仪评估表面粗糙度,并通过 SEM 和 AFM 技术分析表面变化。
研究方案
注意:钛圆柱体采用与传统植入物相同的材料制成,旨在通过 SLA 技术复制植入物表面,高度为 10 毫米,直径为 5 毫米。一个深 7 毫米、宽 3 毫米的空腔位于圆柱体的中心(图 2)。3 毫米的宽度在最深处减少到 1 毫米。使用轮廓仪测量标准植入物的表面粗糙度是不可行的。可以使用与模拟植入物表面相同的材料,评估将激光应用于制造商设计的钛圆柱体顶部直径为 5 mm 的平面的有效性。此外,为了测量从圆柱体中心开始的温度变化,从钛圆柱体的底面中心向圆柱体深度开了一个 7 mm 深、3 mm 宽的凹槽,热电偶尖端将放置在该凹槽中。该凹槽允许从圆柱体内部评估处理表面的温度变化,而不是依赖于外表面。通过使用原子力显微镜 (AFM) 分析特制钛圆柱体的平面,获得三维视觉效果。根据公司推荐,使用三种不同瓦数的 940 nm 二极管(0.8 W28、1.3 W29、1.8 W30)和 2.780 nm Er,Cr:YSGG(1.5 W31、2.5 W31、3.5 W32)激光器,形成 12 组,每组应用 20 s 和 40 s。应用后,添加了一个对照组进行粗糙度评估。使用 3D 打印机打印带有手指支撑的支架,以在应用过程中保持 Ti 圆柱体稳定(材料表)。
1.样本量
- 使用 G*Power 程序的功效分析计算样本量。将每组的最小样品数确定为 n=8 个温度变化样品,效应量 d:0.6906,标准差 16.8,功效:0.80,α:0.05。
注意:在本研究中,配备 940 nm 二极管激光器的 Er,Cr:YSGG 激光器具有 300 μm 直径尖端(e3 尖端)和 360° 发射弹性 RFPT5-14 尖端(直径 580 μm,长度 14 mm)用作激光系统(图 1)。
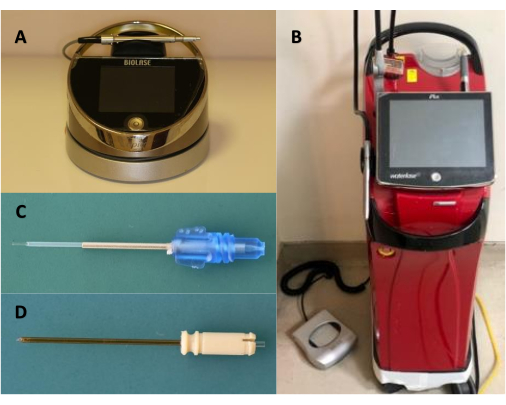
图 1:使用的仪器和设备。 (A) 二极管激光器,(B) Er,Cr:YSGG 激光器,(C) E3 尖端,(D) RPTF5-14 尖端。 请单击此处查看此图的较大版本。
2. 工作组的确定
- 以种植体周围粘膜炎袋内应用的推荐激光瓦特作为理想的使用条件。此外,在研究组中包括一个相对于推荐瓦特的较低值和一个较高值。此处使用的值为 Er,Cr:YSGG 的 1.5 W 和 3.5 W,二极管激光器的值为 0.8 W 和 1.8 W。
- 将应用时间确定为 20 秒和 40 秒,以评估工作时间对温度变化的影响。研究组如 表 1 所示。
| 组名称 | 激光类型 | 样本数 (n) | 瓦特 (W) | 时间 (s) |
| E1 系列 | 呃,Cr:YSGG | 8 | 1.5 瓦 | 20 |
| E2 系列 | 8 | 2.5 瓦 | 20 | |
| E3 系列 | 8 | 3.5 瓦 | 20 | |
| E4 系列 | 8 | 1.5 瓦 | 40 | |
| E5 系列 | 8 | 2.5 瓦 | 40 | |
| E6 系列 | 8 | 3.5 瓦 | 40 | |
| 第一天 | 二极管 | 8 | 0.8 瓦 | 20 |
| D2 | 8 | 1.3 瓦 | 20 | |
| D3 | 8 | 1.8 瓦 | 20 | |
| D4 | 8 | 0.8 瓦 | 40 | |
| D5 | 8 | 1.3 瓦 | 40 | |
| D6 系列 | 8 | 1.8 瓦 | 40 | |
| C | 控制 | 8 |
表 1:研究组信息。
3. 实验装置的准备
- 使用 Rhinoceros (3D graphics and design) 程序,设计一个 3D 圆柱体支架,其空腔直径为 10 mm,厚度为 5 mm。
- 打开应用程序。画一个直径为 10 mm 的圆。将圆从一个轴减少 50% 以创建椭圆。按 Extuder 并提升三维中的椭圆。
- 再次画一个圆圈以支撑手指。使用挤出机键在第三个维度中浮起第二个圆。使高度小于第一个圆。
- 使用 Boolean 命令在椭圆绘图中钻一个 10 mm 的孔。对于热电偶支撑,使用 Sweep 1 命令绘制一条 L 形线并创建第 3 个维度。
- 绘制一个正方形,使用 extruder 命令在第 3 维中将其放大,然后创建底座。打印设计后,在 Ti 圆柱体将要出现的孔周围涂抹硅胶并干燥。这将在应用激光时将圆柱体保持在原位。
- 将装有空调的密闭房间的温度调至 27 °C。 用双面胶带将气瓶固定在塑料桶中间的支架上。
注意: 插入 Ti 圆柱体,将空气挤到表面上。 - 将温度计的热电偶放在支架上插槽中的 Ti 圆柱体的中空部分。
- 准备一个天文台表来跟踪申请时间。记录第 3 个观察者的度数,并使用秒表跟踪时间。
4. 实验程序
- 在激光应用期间,为了从业者的安全,请戴上防护眼镜。插入 RPTF5-14 尖端,用于 Er,Cr:YSGG 激光器。插入二极管激光器的尖端 E3。
- 打开 Er,Cr:YSGG 激光器。选择 Perio Closed Mode(牙周封闭模式)。应用 1.5 W、2.5 W 和 3.5 W 激光器,分别持续 20 秒和 40 秒。有 96 个 Ti 圆柱体,应用了激光。仅用一种激光类型、1 瓦特和 1 次照射 Ti 圆柱体。
- 打开二极管激光器。选择 Perio Pocket Mode(牙周袖珍模式)。应用 0.8 W、1.3 W 和 1.8 W 激光,分别持续 20 秒和 40 秒。
- 让第 3 个观察者在激光启动时启动计时器。时间到了时警告他/她。
- 将激光尖端以 15° 角应用于表面,接触,在计划时间内在整个表面上呈之字形。
- 请注意应用过程中的初始和最终温度值。从结束温度值中减去起始温度值。计算温度变化。
注意:请注意总共 12 组、6 个 Er、Cr:YSGG 和 6 个二极管激光器组的温度变化值。 - 将样品放在写有组号的透明袋中。
5.材料的二维和三维成像
- 进行扫描电子显微镜 (SEM) 和原子力显微镜 (AFM) 分析,以评估和展示 Ti 圆柱体表面形态的变化。
注:使用了 FEI Quanta FEG 250 仪器。 - 在将样品放入 SEM 之前,请勿涂覆样品。共有 13 组,包括 1 个对照组、6 个二极管激光器组和 6 个 Er,Cr:YSGG 激光器组。对于对照组,不进行处理,仅通过 AFM 和 SEM 拍摄表面图像。
- 从 13 个研究组中随机选择一个圆柱体。将它们插入 SEM 设备中。请注意平台上的位置和示例代码,以避免混合示例。
- 将 Ti 圆柱体放入 SEM 设备中,平面朝上。使用低真空模式执行分析。在分析过程中,将腔室压力设置为 60 Pa。
- 设备完全准备就绪后,从平面上的随机点以 250 倍、1000 倍和 5000 倍的放大倍率录制图像。对所有样品重复此过程。
注意:当 SEM 设备完成吸尘后,即可进行图像采集。 - 对于 AFM 测量,从每个研究组中随机选择一个 Ti 圆柱体。在轻敲模式下执行测量。
- 将 Ti 圆柱体放入 AFM 仪器中。放置顶盖,使仪器的尖端盖在样品上。检查仪器窗口发出的红光是否位于要成像的表面上。
- 将电压设置为 2。使用 Auto land(自动着陆)按钮将尖端移近样品。按 Start Scan (开始扫描) 按钮开始扫描。
- 为每个样品拍摄 5 μm x 5 μm 的数字图像,并以慢速扫描速率 (1 Hz) 记录。记录使用 AFM 仪器从 Ti 圆柱体的平面拍摄的图像。AFM 仪器可视化 25 μm2 区域。
6. 表面粗糙度的测量
注意:这里使用了 Surftest SJ 201,日本东京三丰设备。
- 将轮廓仪的分辨率设置为 0.01 毫米,横向长度设置为 3.0 毫米,金刚石记录针尖的直径为 5 μm。将测量速度设置为 0.5 mm/s 以确定 Ra 值。
- 用支架固定 Ti 圆柱体,使用预sel,然后从侧面握住Ti圆柱体来固定Ti圆柱体。将轮廓仪的针头与 Ti 表面接触。
- 按 Start 按钮。保存找到的 Ra 值。在每个圆柱体的平面上沿不同方向重复测量 5 次(图 2)。为了实现各个方向,请在预售的帮助下将 Ti 圆柱体围绕自身移动。对 Ti 圆柱体的整个长度重复此作。
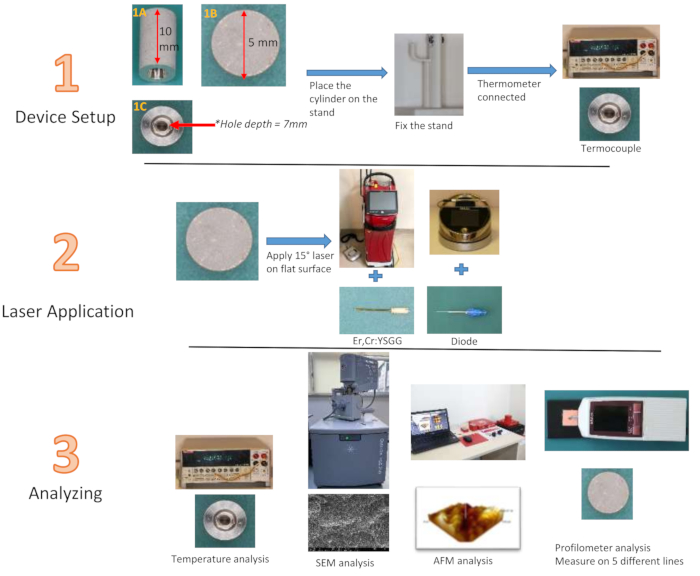
图 2:研究组流程图。 (1A) Ti 圆柱体侧视图,(1B) 顶视图,(1C) 底视图 请单击此处查看此图的较大版本。
7. 统计分析
- 使用 SPSS-Windows 统计软件包程序执行统计分析,并应用 Kruskal-Wallis 和 Mann-Whitney 检验。将统计置信水平设置为 95% (α = 0.05)。
结果
根据 20 秒和 40 秒的应用时间进行评估,观察到统计学上的显着差异。观察到 40 s 激光施加的 Ti 柱面表面的温度变化大于施加的 20 s 激光上的温度变化 (p=0.037; 图 3)。

图 3:所有样品的温度随时间变化。 从框上下排列的线条显示数据的最小值和最大值。框内的水平线表示数据的中位数。舍入标记是异常值。
a=与 40 s 组相比差异有统计学意义。(第 0<5 页)
请单击此处查看此图的较大版本。
我们通过根据激光类型 (Er、Cr:YSGG 和二极管) 将它们分为两组来分析温度变化。观察到使用二极管激光器的 Ti 圆柱体中的温度变化大于使用 Er,Cr:YSGG 激光器的圆柱体中的温度变化。结果具有统计学意义 (p=0.001;见 图 4)。在仅针对二极管激光器应用进行测试的 Ti 圆柱体的评估中,结果表明,与 20 s 应用相比,40 s 二极管激光器应用在所有瓦特值中产生的结果明显更高 (p < 0.001; 图 4)。图中框内的红线表示中位数。顶部和底部的条形表示最高和最低温度值。

图 4:所有样品的激光类型和时间的温度变化。 从框上下排列的线条显示数据的最小值和最大值。框内的水平线表示数据的中位数。舍入标记是异常值。
a=与二极管组相比具有统计学意义的差异。(第 0<5 页)
b = 与二极管激光器 40 秒相比的统计学显着差异 (p<0.05)
请单击此处查看此图的较大版本。
温度变化的最新统计评估是根据瓦特值进行的。在仅使用 Er,Cr:YSGG 激光器的组中仅研究瓦特值 (p < 0.001) 和瓦特时间 (p < 0.001) 参数时观察到显着差异。在 Er,Cr:YSGG 激光器的应用中,观察到时间本身对温度变化没有显着影响 (p = 0.959)。在评估暴露于二极管激光器的所有 Ti 圆柱体中的温度变化后,考虑到瓦特、时间和瓦特时间变量,观察到统计学上的显着差异 (p < 0.05)。施加 1.8 瓦的二极管激光器组对 Ti 柱面的温度范围明显大于施加 0.8 瓦的二极管激光器组的温度范围 (p = 0.006; 图 5)。
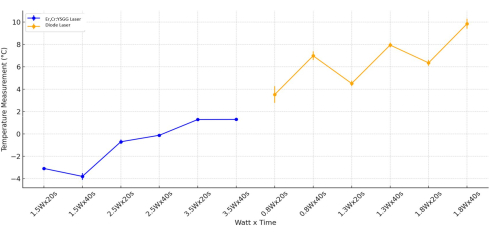
图 5:组合温度分析。 通过瓦特和时间对 Er、Cr:YSGG 和二极管激光器类型进行分析。 请单击此处查看此图的较大版本。
影像学分析
在 SEM 图像中,在所有组中都观察到微米级多孔结构,这是喷砂、酸粗糙植入物表面的预期外观。在 5000 倍放大倍率下,与对照组相比,激光处理的钛表面显示出微米级孔隙的明显扩大(红色圆圈)。在 250 倍和 1000 倍放大倍率下,用 Er、Cr:YSGG 和二极管激光器处理 40 秒的钛表面比处理 20 秒的钛表面显示出更多的熔化 (图 6)。在 AFM 图像中,对照组的表面压痕分布比激光处理组更均匀 (图 7、 图 8)。由于 AFM 图像只能看到钛圆柱体平面的 25μm2 的非常小的区域,因此我们无法获得有关整个表面的详细结果。

图 6:所有研究组的 SEM 图像。 6 个二极管激光组标记为 D1-D6,而 6 个 Er,Cr:YSGG 激光组标记为 E1-E6。图像以 250 倍、1000 倍、5000 倍的放大倍率拍摄。 请单击此处查看此图的较大版本。

图 7:对照组的 AFM 图像。请单击此处查看此图的较大版本。

图 8:所有研究组的 AFM 图像。 6 个二极管激光组标记为 D1-D6,而 6 个 Er,Cr:YSGG 激光组标记为 E1-E6。 请单击此处查看此图的较大版本。
表面粗糙度结果
粗糙度参数在变量激光类型 (p = 0.841)、瓦特 (p = 0.900)、时间 (p = 0.399) 以及激光类型、瓦特和时间变量的评估中未显示统计学上的显着差异 (p = 0.924; 图 9)。

图 9:按激光类型、瓦特和时间进行的粗糙度分析。请单击此处查看此图的较大版本。
考虑到这些结果,我们可以得出结论,Er,Cr:YSGG 和二极管激光器对于种植体周围疾病中的钛表面净化是安全的。温度变化低于 10 °C,表明参数在安全范围内。同时,轮廓仪值没有显着变化,表明在表面粗糙度方面没有缺点。在成像分析中检测到面部变化,但粗糙度分析无法支持这一点。研究结果支持所使用的激光参数在安全范围内。
a=与二极管组相比具有统计学意义的差异。(第 0<5 页)
b = 与二极管激光器 40 秒相比的统计学显着差异 (p<0.05)
讨论
关于治疗种植体周围炎的种植体表面净化的最佳方法,正在进行一场重要的讨论。以前的出版物提出了局部或全身药物的使用、激光应用、机械和/或化学清洁以及种植体成形术。我们的研究结果表明,所有测得的温度都上升到 10 °C 的临界安全阈值以下13。然而,请记住,这是一项 体外 研究,不能总是复制临床条件,据观察,使用 Er,Cr:YSGG 激光器和二极管激光器会导致植入物地形中的熔化变化和微孔,而表面粗糙度没有改变。
由于表面效应,使用 Ho:YAG 和 Nd:YAG33 激光器进行净化被报告为不合适;然而,发现 Er,Cr:YSGG 激光器34 和二极管激光器18 对此有效。二极管激光器通过 TGF-β 1 信号刺激的 HBD-2 表达增强周围组织的愈合。该研究显示,在钛表面以锯齿形运动应用 Er,Cr:YSGG 激光后,表面粗糙度和牙龈卟啉单胞菌定植减少,同时成纤维细胞活力和成骨细胞分化增加35。这项研究的结果表明,Er,Cr:YSGG 激光器在高达 3.5 W 的能量设置下长达 40 s 不会对钛表面造成任何热损伤。这一发现与 Smeo 等人发表的文献综述相关36,该文献综述确定,当与正确的激光参数一起使用时,铒激光器可以在不超过临界温度阈值的情况下发挥抗菌作用。
本研究中的 940 nm 二极管激光器参数为 0.8 W、1.3W 和 1.8 W,其中包括不同的功率输出和 20 s 和 40 s 的照射时间13。在评估二极管激光器在钛表面使用的两项不同研究中,使用 20 s37 和 40 s38 作为应用时间。同样,使用应用于钛和齿表面的 Er,Cr:YSGG 激光器,应用时间为 20 s39 和 40 s40。在一项研究中,二极管激光器在 18 秒内超过临界温度13。在半导体激光器应用中,建议避免长时间暴露在根部表面,以防止对牙髓造成热损伤(临界阈值 5.6 °C)28,41。一项评估使用各种激光器对钛表面温度变化影响的研究报告称,Er:YAG、CO2、Nd:YAG 和二极管激光器在水箱中不超过 10°C 的临界温度变化42。同样,在这项研究中,940 nm 二极管激光器组产生的温升明显更快;然而,最终温度值低于临界阈值。在 940 nm 二极管激光器的应用中,可以通过选择降低的功率输出并最大限度地减少照射时间来减少温度的升高。这些结果表明,在没有水冷的情况下,增加的功率/能量密度 13,43,44 与高温之间存在正相关关系,强调了 Er,Cr:YSGG 激光器 16,45 等照射过程中水冷却的重要性。
机械和 3D 光学(接触式和非接触式)轮廓测量法是定量测量牙科材料纳米形貌和种植体表面粗糙度的最流行的体外方法,而 SEM 图像是定性评估的黄金标准31。使用接触式轮廓仪测量粗糙度可能会对表面造成损坏,并导致测量不准确46.虽然 SEM 成像无法促进样品的定量和定性分析,但 AFM 图像可以提供表面粗糙度和 3D 深度方面的定量信息47。激光治疗后植入物表面出现形态学变化,其特征是与对照组相比,微孔直径增加、形态熔化和凹陷微孔的患病率增加。在这些实验条件下,SEM 分析期间 Ti 圆柱体的表面揭示了表面变化。此外,这些改变受激光类型、使用的功率和激光照射所花费的时间的影响。作者同意二极管18 和 Er,Cr:YSGG21,48 激光器的表面损伤水平和时间水平与功率增加相关。进一步的研究应检查这些修饰是否具有治疗意义。
种植牙表面粗糙度,也称为微地形图,是影响骨结合的关键因素。在最近的一项研究中,钛表面用四种不同的方案处理。钛表面和间充质干细胞保留在激光处理的表面上,干细胞粘附结果优于其他技术(Ti-Ni 刷、气流和牙科车针)49。在激光照射过程中,所检查的 Ti 圆柱体的所有 Ra 值均降低;然而,照射前后没有观察到统计学上的显着差异。当使用更高的功率水平时,二极管激光照射通过熔化 Ti 表面来降低表面粗糙度。这些发现与 Stübinger 等人 50 之前的一项研究一致,其中使用 810 nm 二极管激光器对植入物表面进行净化,对表面没有显着影响,同时与 Kim 等人51 和 Rezeka 等人进行的研究结果相矛盾17,使用 940 nm 波长处理 2 W 和 3 W 功率,并观察到激光应用增加了表面粗糙度。
这项研究因缺乏细胞和微生物测试而受到限制。本研究旨在评估半导体和 Er,Cr:YSGG 激光照射后 Ti 圆柱体的形貌变化;然而,各种治疗的生物学意义需要进一步的 体外 和 体内 研究。另一个限制是,本研究中对表面粗糙度进行的统计分析仅涉及轮廓仪数据。AFM 方法被证明可以有效地评估牙科中经常使用的两种激光类型的功效。
结论
在我们的调查中,没有温度升高超过 10 °C 的生理阈值。 因此,统计学上显着的温差被认为在临床上无关紧要。激光类型和功率对 RA 没有显着影响;因此,用 0.8、1.3 和 1.8 W 的二极管激光器和 1.5 W、2.5 W 和 3.5 W 的 Er,Cr:YSGG 激光器照射 20 s 和 40 s 可以清洁 Ti 表面而不会损坏。尽管如此,这些发现是在体外进行的,需要临床试验来验证这项研究的结果。目前的研究调查了模拟种植体清创临床场景的各种技术。
披露声明
作者没有需要披露的利益冲突。
致谢
研究中使用的钛圆柱体由 Naxis Implant 生产。
材料
| Name | Company | Catalog Number | Comments |
| Atomic Force Microscopy | ezAFM | Compact AFM Model | |
| Diode | Biolase | Epic 10, 940 nm Wavelength | |
| E3 Tip | Fiber Diameter: 300 µm, Fiber Length: 9 mm | ||
| Er,Cr:YSGG Laser | Iplus | 2780 nm Wavelength | |
| Profilometer | Mitutoyo | Surftest SJ-201 Model | |
| RFPT-14 Tip | Outer Tip Diameter: 580 µm, Tip Length: 14 mm | ||
| Scanning Electron Microscope | FEI | Quanta FEG 250 Model | |
| Stand | Custom Design | Rhinoceros application, Flamix PLA filament, Bambulab X1C Device | |
| Thermometer | Keithley | 2000 Series Model, K tip termokulp | |
| Titanium Cylinder | Naxis | 10 mm height, 5 mm diameter, SLA Surface, Titanium |
参考文献
- Guillaume, B. Dental implants: A review. Morphologie. 100 (331), 189-198 (2016).
- Henry, P. J. Tooth loss and implant replacement. Aust Dent J. 45 (3), 150-172 (2000).
- Berglundh, T., Armitage, G., Araujo, M. G., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 89 (1), S313-S318 (2018).
- Herrera, D., Berglundh, T., Schwarz, F., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Guarnieri, R., Reda, R., Di Nardo, D., Pagnoni, F., Zanza, A., Testarelli, L. Prevalence of Peri-Implant Mucositis, Peri-Implantitis and Associated Risk Indicators of Implants with and without Laser-Microgrooved Collar Surface: A Long-Term (≥20 Years) Retrospective Study. J Pers Med. 14 (4), (2024).
- Figuero, E., Graziani, F., Sanz, I., Herrera, D., Sanz, M. Management of peri‐implant mucositis and peri‐implantitis. Periodontology 2000. 66 (1), 255-273 (2014).
- Tomasi, C., Wennström, J. L. Full-mouth treatment vs. the conventional staged approach for periodontal infection control. Periodontology 2000. 51 (1), 45-62 (2009).
- Baima, G., Citterio, F., Romandini, M., et al. Surface decontamination protocols for surgical treatment of peri‐implantitis: A systematic review with meta‐analysis. Clin Oral Implants Res. 33 (11), 1069-1086 (2022).
- Subramani, K., Wismeijer, D. Decontamination of titanium implant surface and re-osseointegration to treat peri-implantitis: a literature review. Int J Oral Maxillofac Implants. , Accessed August 4, 2024 (2012).
- Świder, K., Dominiak, M., Grzech-Leśniak, K., Matys, J. Effect of different laser wavelengths on periodontopathogens in peri-implantitis: A review of in vivo studies. Microorganisms. 7 (7), 189(2019).
- Mizutani, K., Aoki, A., Coluzzi, D., Yukna, R., Wang, C. Y., Pavlic, V., Izumi, Y. Lasers in minimally invasive periodontal and peri‐implant therapy. Periodontology 2000. 71 (1), 185-212 (2016).
- Eriksson, R. A., Albrektsson, T. The effect of heat on bone regeneration: An experimental study in the rabbit using the bone growth chamber. J Oral Maxillofac Surg. 42 (11), 705-711 (1984).
- Geminiani, A., Caton, J. G., Romanos, G. E. Temperature change during non-contact diode laser irradiation of implant surfaces. Lasers Med Sci. 27 (2), 339-342 (2012).
- Alpaslan Yayli, N. Z., Talmac, A. C., Keskin Tunc, S., Akbal, D., Altindal, D., Ertugrul, A. S. Erbium, chromium-doped: yttrium, scandium, gallium, garnet and diode lasers in the treatment of peri‐implantitis: Clinical and biochemical outcomes in a randomized-controlled clinical trial. Lasers Med Sci. 37 (1), 665-674 (2022).
- Peters, N., Tawse-Smith, A., Leichter, J., Tompkins, G. Laser therapy: The future of peri-implantitis management. J Periodontol. 22 (1), 1(2012).
- Alhaidary, D., Franzen, R., Hilgers, R. D., Gutknecht, N. First investigation of dual-wavelength lasers (2780 nm Er,Cr:YSGG and 940 nm diode) on implants in a simulating peri-implantitis situation regarding temperature changes in an in vitro pocket model. Photobiomodul Photomed Laser Surg. 37 (8), 508-514 (2019).
- Rezeka, M. A., Metwally, N. A., Abd El Rehim, S. S., Khamis, M. M. Evaluation of the effect of diode laser application on the hydrophilicity, surface topography, and chemical composition of titanium dental implant surface. J Prosthodont. 2024, 1-8 (2025).
- Khalil, M. I., Sakr, H. Implant surface topography following different laser treatments: An in vitro study. Cureus. 15 (5), e38731(2023).
- Tosun, E., Tasar, F., Strauss, R., Kivanc, D. G., Ungor, C. Comparative evaluation of antimicrobial effects of Er:YAG, diode, and CO2 on titanium discs: An experimental study. J Oral Maxillofac Surg. 70 (5), 1064-1069 (2012).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Park, J., Heo, S., Koak, J., Kim, S. K., Han, C. H., Lee, J. H. Effects of laser irradiation on machined and anodized titanium disks. Int J Oral Maxillofac Implants. 27 (6), Accessed September 22, 2024 1215-1221 (2012).
- Aoki, A., Mizutani, K., Schwarz, F., et al. Periodontal and peri-implant wound healing following laser therapy. Periodontol 2000. 68 (1), 217-269 (2015).
- Roncati, M., Lucchese, A., Carinci, F. Non-surgical treatment of peri-implantitis with the adjunctive use of an 810-nm diode laser. J Indian Soc Periodontol. 17 (6), 812-817 (2013).
- Romanos, G. E., Gutknecht, N., Dieter, S., Schwarz, F., Crespi, R., Sculean, A. Laser wavelengths and oral implantology. Lasers Med Sci. 24 (6), 961-970 (2009).
- Hauser-Gerspach, I., Stübinger, S., Meyer, J. Bactericidal effects of different laser systems on bacteria adhered to dental implant surfaces: An in vitro study comparing zirconia with titanium. Clin Oral Implants Res. 21 (3), 277-283 (2010).
- Hafeez, M., Calce, L., Hong, H., Hou, W., Romanos, G. E. Thermal effects of diode laser-irradiation on titanium implants in different room temperatures in vitro. Photobiomodul Photomed Laser Surg. 40 (8), 554-558 (2022).
- Koopaie, M., Kia Darbandsari, A., Hakimiha, N., Kolahdooz, S. Er,Cr:YSGG laser surface treatment of gamma titanium aluminide: Scanning electron microscopy-energy-dispersive X-ray spectrometer analysis, wettability and Eikenella corrodens and Aggregatibacter actinomycetemcomitans bacteria count - in vitro study. Proc Inst Mech Eng H. 234 (8), 769-783 (2020).
- Kayar, N. A., Hatipoǧlu, M. Could we set a convenient irradiation time to reduce the possibility of thermal pulp damage during diode laser as an adjunct to periodontal treatment? An in vitro analysis. Photobiomodul Photomed Laser Surg. 39 (7), 480-485 (2021).
- Barrak, H., Mahdi, S. S., Alkurtas, S. A., Size, P. Clinical applications of a 940 nm diode laser for laser troughing versus conventional method: A preliminary study. Iraqi J Laser. 23 (2), (2024).
- Beer, F., Körpert, W., Passow, H., et al. Reduction of collateral thermal impact of diode laser irradiation on soft tissue due to modified application parameters. Lasers Med Sci. 27 (5), 917-921 (2012).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an erbium, chromium-doped yttrium, scandium, gallium, and garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Al-Omari, W. M., Palamara, J. E. The effect of Nd:YAG and Er,Cr:YSGG lasers on the microhardness of human dentin. Lasers Med Sci. 28 (1), 151-156 (2013).
- Kreisler, M., Götz, H., Duschner, H., d’Hoedt, B. Effect of Nd:YAG, Ho:YAG, Er:YAG, CO2, and GaAlAs laser irradiation on surface properties of endosseous dental implants. Int J Oral Maxillofac Implants. 17 (5), 202-209 (2002).
- Kottmann, L., Franzen, R., Conrads, G., Wolfart, S., Marotti, J. Effect of Er,Cr:YSGG laser with a side-firing tip on decontamination of titanium disc surface: An in vitro and in vivo study. Int J Implant Dent. 9 (1), 7(2023).
- Yao, W. L., Lin, J. C. Y., Salamanca, E., et al. Er,Cr:YSGG laser performance improves biological response on titanium surfaces. Materials. 13 (3), 756(2020).
- Smeo, K., Nasher, R., Gutknecht, N. Antibacterial effect of Er,Cr:YSGG laser in the treatment of peri-implantitis and their effect on implant surfaces: A literature review. Lasers Dent Sci. 2 (2), 63-71 (2018).
- Fletcher, P., Linden, E., Cobb, C., Zhao, D., Rubin, J., Planzos, P. Efficacy of removal of residual dental cement by laser, ultrasonic scalers, and titanium curette: An in vitro study. Compend Contin Educ Dent. , (2025).
- Lollobrigida, M., Fortunato, L., Serafini, G., et al. The prevention of implant surface alterations in the treatment of peri-implantitis: Comparison of three different mechanical and physical treatments. Int J Environ Res Public Health. 17 (8), 2624(2020).
- Arora, S., Lamba, A. K., Faraz, F., Tandon, S., Ahad, A. Evaluation of the effects of Er,Cr:YSGG laser, ultrasonic scaler and curette on root surface profile using surface analyser and scanning electron microscope: An in vitro study. J Lasers Med Sci. 7 (4), 243-249 (2016).
- Jin, S. H., Lee, E. M., Park, J. B., Kim, K. K., Ko, Y. Decontamination methods to restore the biocompatibility of contaminated titanium surfaces. J Periodontal Implant Sci. 49 (3), 193-204 (2019).
- Kayar, N. A., Hatipoǧlu, M. Can we determine an appropriate timing to avoid thermal pulp hazard during gingivectomy procedure? An in vitro study with diode laser. Photobiomodul Photomed Laser Surg. 39 (2), 94-99 (2021).
- Monzavi, A., Fekrazad, R., Chinipardaz, Z., Shahabi, S., Behruzi, R., Chiniforush, N. Effect of various laser wavelengths on temperature changes during peri-implantitis treatment: An in vitro study. Implant Dent. 27 (3), 311-316 (2018).
- Valente, N. A., Calascibetta, A., Patianna, G., Mang, T., Hatton, M., Andreana, S. Thermodynamic effects of 3 different diode lasers on an implant-bone interface: An ex-vivo study with review of the literature. J Oral Implantol. 43 (2), 94-99 (2017).
- Leja, C., Geminiani, A., Caton, J., Romanos, G. E. Thermodynamic effects of laser irradiation of implants placed in bone: An in vitro study. Lasers Med Sci. 28 (6), 1435-1440 (2013).
- Strever, J. M., Lee, J., Ealick, W., et al. Erbium, chromium:yttrium-scandium-gallium-garnet laser effectively ablates single-species biofilms on titanium disks without detectable surface damage. J Periodontol. 88 (5), 484-492 (2017).
- Bourauel, C., Fries, T., Drescher, D., Plietsch, R. Surface roughness of orthodontic wires via atomic force microscope, laser specular reflectance, and profilometry. Eur J Orthod. 20 (1), Accessed February 13, 2025 79-92 (1998).
- Choi, S., Kim, J. H., Kim, N. J., et al. Morphological investigation of various orthodontic lingual bracket slots using scanning electron microscopy and atomic force microscopy. Microsc Res Tech. 79 (12), 1193-1199 (2016).
- Huang, H. H., Chuang, Y. C., Chen, Z. H., Lee, T. L., Chen, C. C. Improving the initial biocompatibility of a titanium surface using an Er,Cr:YSGG laser-powered hydrokinetic system. Dent Mater. 23 (4), 410-414 (2007).
- Furtsev, T. V., Koshmanova, A. A., Zeer, G. M., et al. Laser cleaning improves stem cell adhesion on the dental implant surface during peri-implantitis treatment. Dent J. 11 (2), 30(2023).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Kim, H. K., Park, S. Y., Son, K., et al. Alterations in surface roughness and chemical characteristics of sandblasted and acid-etched titanium implants after irradiation with different diode lasers. Appl Sci. 10 (12), 4167(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。