Method Article
使用纵向 MicroPET/MicroCT 图像治疗心血管钙化进展的新型量化方案
摘要
这种新颖的方案需要从小型研究动物的连续微正电子发射断层扫描 (PET)/微型计算机断层扫描 (CT) 图像中量化心血管钙化进展。
摘要
微正电子发射断层扫描 (PET) 和显微计算机断层扫描 (CT) 成像是跟踪心血管钙化进展的强大、理想的研究工具。由于其非侵入性,小型研究动物可以在多个时间点成像。挑战在于心血管钙化的准确量化。在这里,我们提供了一个协议,使用疾病晚期的图像作为模板,以准确量化纵向研究中心血管钙化的进展。该协议包括 1) 作为第一步,在纵向研究期间,从同一只动物的多个图像中对齐胸部区域,2) 定义位于心脏和主动脉内较大钙沉积物部位的感兴趣区域 (ROI),这些钙沉积物在以后的图像中变得明显,以及 3) 同时分割和量化纵向研究期间获取的所有图像中的钙沉积物。这种简化的方法通过提高 ROI 定义的精度并减少与独立分析单个扫描的早期技术相关的可变性,提高了跟踪心血管钙化进展的图像分析的准确性。
引言
心血管疾病是导致全球发病率和死亡率的主要原因,需要进行严格的探索以揭示其机制并制定有效的预防和治疗策略。冠状动脉钙化 (CAC) 被该领域的专家广泛认为是心血管疾病的预测因素,显着增加了心血管死亡的风险 1,2,3,4,5。微观钙化被认为是钙化性动脉粥样硬化的最早阶段,术语"微钙化"已用于指代直径在 0.5 至 50 μm 6,7,8,9 之间的钙沉积物。这些小的钙化物被认为会聚结形成更大的钙沉积物,从而促进钙化斑块的进展 6,7。
正电子发射断层扫描 (PET) 和计算机断层扫描 (CT) 是有价值的研究工具,经常用于体内心血管钙化的无创评估 5,10,11,12,13,14,15,16,17,18,19 .这些成像方式被证明特别有利于在涉及小型研究动物的纵向研究中跟踪血管钙化进展 11,12,13,19。MicroCT 成像已证明在提供相对较大的钙沉积物的解剖图像方面有效11、12、13、19、20。 然而,它对活体动物体内小钙沉积物成像的效用受到其 ~100 μm 的空间分辨率 8,14 的限制,这使得在其初始阶段研究钙化具有挑战性。
一个显着的进步是采用 microPET/microCT 成像与 PET 示踪剂氟化物-18 标记的氟化钠 (18F-NaF) 相结合,作为基于钙化与矿物表面区域的结合检测钙化的标准方法。这种方法使用放射性标记的 18F-NaF,当氟离子与羟基磷灰石共价结合时,可以识别钙矿物表面10,13,取代羟基形成氟磷灰石21。与 18F 的放射性衰变(半衰期 ~110 分钟)和示踪剂通过肾脏的清除率22 一致,Irkle 及其同事13 发现 18F-NaF 与钙化颈动脉标本的结合在检测时仅限于表面。因此,示踪剂的吸收应与矿物表面积直接相关,当一定量的矿物出现在多个小焦点或多孔形式时,示踪剂表面积大于存在于少数大型固体矿床中时。通过以高灵敏度突出矿化的早期阶段,18F-NaF PET 成像可以为疾病的早期阶段提供有价值的见解,使其在研究预防和治疗策略方面特别有用 13,14,15。
即使血管钙化的 microPET/microCT 联合成像最近取得了进展,也有机会提高纵向心血管钙化研究中图像分析的准确性。传统方法在整个纵向研究的每个单独时间点使用劳动密集型的手动描绘每只小鼠每个可见钙化区域周围的感兴趣区域 (ROI)。这种方法降低了精度,尤其是在疾病早期阶段,当钙沉积物的大小接近扫描仪的检测限时,可能会使一些沉积物密度低的区域变得不可见。
在成像领域,对齐通常是指一系列图像的空间对齐。引入对齐作为现有挑战的新解决方案,我们提出的方法允许研究人员使用一致的位置来跟踪整个纵向研究中单个受试者的连续图像中钙化的进展。鉴于已知组织钙化是由纳米级基质囊泡 (50-150 nm) 引起的,这些囊泡聚结形成微观的、宏观的羟基磷灰石矿物23,人们可以回顾性地确定微钙化在早期图像中的位置,然后才能被识别出来。
通过图像对齐可以随着时间的推移跟踪相同的位置,这是此方法的基础。它消除了直接识别最早钙化阶段的需要,因为投资回报率是根据容易识别矿化的最新阶段分配的。在该协议中,我们提出了一种改进的、简化的数据分析方法,该方法将时间序列图像的对齐作为重要步骤,增强了纵向、联合、microPET/microCT 成像研究中钙沉积的准确定量(图 1)。虽然我们以 PET/CT 数据分析为例,但这种方法可以应用于其他纵向成像数据的分析,包括单光子发射计算机断层扫描 (SPECT)、磁共振成像 (MRI) 和光学成像24。
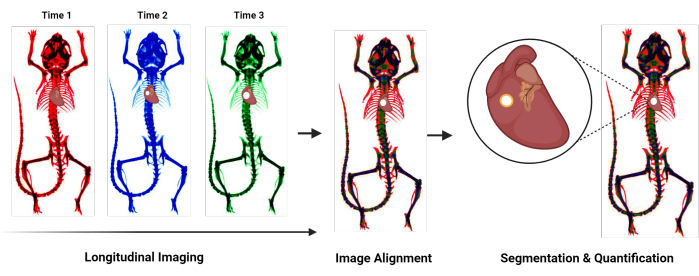
图 1:协议概述流程图。 总结量化心血管钙化的新方案的流程图。一般步骤包括纵向成像、对齐在不同时间点采集的图像以及钙化区域的分割和量化。 请单击此处查看此图的较大版本。
研究方案
代表性图像显示了一只雌性载脂蛋白 E 缺陷 (Apoe-/-) 小鼠。实验方案由加州大学洛杉矶分校机构动物护理和使用委员会审查和批准。
1. 动物扫描
- 在两次图像采集之间,用标准饮食喂养小鼠,无需任何干预。然而,在 15 个月大时首次成像之前,从 12 至 14 个月大时改用西方饮食(21% 脂肪,0.2% 胆固醇)以诱导基线主动脉钙化。
- 确保 microPET/CT 扫描仪经过常规校准,以实现最佳 PET 数据采集和 CT 共配准。根据制造商的说明执行校准。
- 成像前,使用 2% 异氟醚气体在腔室中麻醉小鼠 10 分钟。通过捏动物的脚趾而没有反应来确认麻醉。
- 在静脉注射 3.7 MBq 的 18F-NaF 后 60 分钟,在组合的 microPET/CT 扫描仪中获取 microPET(350-650 keV,10 分钟扫描时间)和 100 μm microCT(80 kVp,150 μA,720 投影,1 分钟扫描时间)图像。在 microPET 扫描后立即获取 microCT 扫描。
注意:扫描仪床将动物从 PET 模态移动到 CT 模态,而动物仍处于麻醉状态并处于相同位置。 - 使用 3D 有序子集期望最大化算法(24 个子集和 3 次迭代)重建 microPET 图像,并进行随机、衰减和衰减校正。使用修改后的 Feldkamp 算法重建 CT 图像。
注意:成像后,监测小鼠,直到它恢复足够的意识以维持胸骨卧位。在纵向研究结束时,所有小鼠均被安乐死。
2. 在 DICOM 查看器软件中导入 DICOM 文件
注意:虽然该代表性协议在非商业许可下使用 ORS Dragonfly 软件,但其灵活性扩展到其他 DICOM 查看器软件选项。
- 双击应用程序启动 DICOM 查看器软件。
- 导航到左上角的 File 。在下拉菜单中,选择 Import DICOM Images...(导入 DICOM 图像... )以提示出现 Manage DICOM Images(管理 DICOM 图像 )窗口(补充文件 1 - 补充图 S1A)。
- 在 Manage DICOM Images 窗口中,单击 Folder Contents 选项卡。在右侧,选择 Open Folder...(打开文件夹... )以选择包含纵向研究中感兴趣的 DICOM 文件的文件夹(补充文件 1 - 补充图 S1B)。
- 确定包含 DICOM 文件的文件夹。单击 选择文件夹 ,将第一个文件夹导入到 管理 DICOM 图像 窗口(补充文件 1 - 补充图 S1C)。
- 在 "管理 DICOM 图像 "窗口中选择 PET ("PT") 和 CT ("CT") DICOM 文件。随后,单击右侧的 View Study 以打开所有导入的 DICOM 图像(补充文件 1 - 补充图 S1D)。
- 对包含与纵向研究中同一单个主题相关的 DICOM 图像的每个文件夹重复步骤 2.4 和 2.5。
3. 调整 DICOM 查看器设置以优化图像可视化
- 更改布局以显示四个视图(3D、横向、冠状、矢状),如 补充文件 1 - 补充图 S2 所示。在左侧的 Layout 下拉列表中,找到 Views(在所选场景中) 并选择显示四个视图的布局。
- 重命名图像以指示时间点以及它们是 PET 还是 CT 图像。选择映像名称,然后 双击 以重命名每个映像。
- 通过访问 数据属性和设置 右侧的下拉列表。单击每个图像名称左侧的 眼睛图标 以切换可见性(补充文件 1 - 补充图 S2)
- 单独调整每个 CT 图像的亮度和对比度。
注意:最佳 CT 亮度和对比度范围可能因受试者、成像方案、扫描仪和重建参数而异25,26;但是,纵向研究中单个受试者的所有调整都应保持一致。- 通过单击 数据属性和设置 (补充文件 1 - 补充图 S2)下的图像名称,选择并打开一个 CT 图像。
- 在显示屏幕左侧 Main 选项卡的 Window Leveling 下拉列表中找到直方图。激活直方图上方的 LogY;然后,继续单击并滑动黄色范围指示符以完全包含直方图中的第二个峰(补充文件 1 - 补充图 S3A)。稍作调整,直至达到最佳亮度/对比度;参考图 2B 是亮度/对比度调整的 CT 图像的示例。
- 在窗口调平直方图(补充文件 1 - 补充图 S3B)下找到 Selected Range 框。记下 Selected Range 值,以便在后续步骤中使用。
- 选择并打开第二个 CT 图像(补充文件 1 - 补充图 S3C)。将第一个 CT 图像的选定范围值输入到第二个 CT 图像的 选定范围 框中(补充文件 1 - 补充图 S3B-S3D)。对所有连续图像重复上述步骤。
- 通过单独调整 Lookup Table 过滤器来优化每个 PET 图像。
注意:最佳 PET 色标范围可能因主题、成像方案、扫描仪和重建参数而异27;但是,纵向研究中单个受试者的所有调整都应保持一致。- 通过单击 "数据属性和设置 "(补充文件 1 - 补充图 S2)下的图像名称,选择并打开一个 PET 图像。
- 在"主要"选项卡的"窗口调平"下拉列表下,找到查找表 (LUT) 并滚动以在 LUT 下拉列表下找到 PET,然后选择 PET 过滤器(补充文件 1 - 补充图 S4A)。
- 使用 Window Leveling 下拉菜单下的直方图微调所选范围,以实现最佳可视化效果。激活直方图上方的 LogY;然后,继续单击并滑动黄色范围指示器,使其滑向补充图 S4B(补充文件 1)中所示的位置。稍作调整,直到达到 PET 图像可视化的最佳选定范围;参考图 2D,为最佳选择范围调整的 PET/CT 图像示例。
- 在窗口调平直方图(补充文件 1 - 补充图 S4B)下找到 Selected Range 下拉列表。记下要在后续步骤中使用的选定范围值。
- 选择并打开第二个 PET 图像(补充文件 1 - 图 S4C)。对第二个映像重复步骤 3.5.2。
- 将第一个 PET 图像中的选定范围值输入到第二个 PET 图像的 选定范围 框中(补充文件 1 - 图 S4B-S4D)。对所有连续图像重复上述步骤。
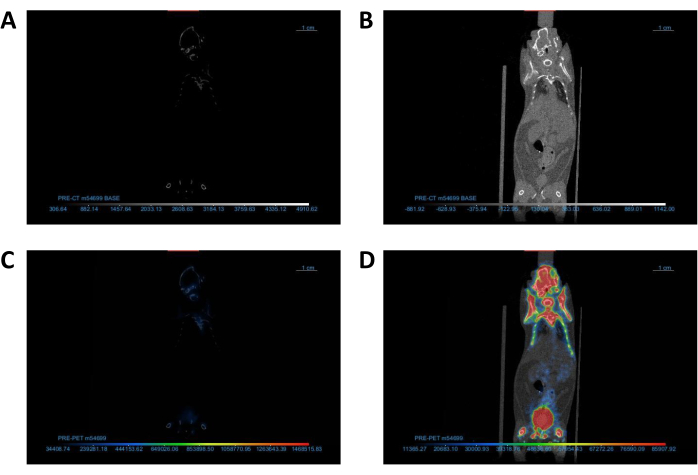
图 2:调整 DICOM 查看器设置以优化图像可视化。 (A,B)对比度/亮度调整前和 (B) 后的 CT 图像冠状视图。(C,D)查找表调整前和 (D) 后 PET/CT 图像的冠状视图。缩写:CT = 计算机断层扫描;PET = 正电子发射断层扫描。请单击此处查看此图的较大版本。
4. 在 CT 图像中对齐胸部区域
注意:为简单起见,一个 CT 图像将用作"基础"图像,不会被平移或旋转。第二个 CT 图像(以及最终随后的系列图像)将被平移和/或旋转以与基础图像对齐;出于演示目的,这将称为 "overlay" 图像。在整个对齐过程中,区分基础图像和所有其他叠加图像非常重要。
- 通过单击 Data Properties and Settings 下拉列表下每个图像名称左侧的眼睛图标,关闭所有 PET 图像并打开基本 CT 图像。
- 将 CT 图像的不透明度更改为 ~50%。单击其中一个 2D 视图。在 Window Leveling 框下,找到 Opacity Mapping 下拉菜单并将 Opacity scale 滑动到中心(补充文件 1 - 图 S5)。
- 打开叠加 CT 图像并重复步骤 4.2。
- 更改叠加 CT 图像的滤镜,以区分基础 CT 图像和叠加 CT 图像。在 Main 选项卡的 Window Leveling 下拉列表下,找到 Lookup Table (LUT)。在 LUT 下拉菜单下,滚动并单击红色过滤器。
注意:现在每个视图中应该有两个 CT 图像,如 补充图 S5 (补充文件 1)所示。 - 在 2D 视图中使用 平移/旋转 工具,使叠加图像中的胸部区域尽可能接近基础图像中的胸部区域。在 CT 图像中,将胸廓、上脊柱和胸骨作为胸部对线指标。
注意:以下操作只能在 2D 视图(横向、冠状或矢状)中执行(补充文件 1 - 补充图 S1)。为了获得最佳结果,请在所有三个 2D 视图之间切换,并使用平移/旋转工具对齐每个视图中的胸部区域。- 在 Data Properties and Settings 下拉列表中选择叠加图像,然后单击一次以选择其中一个 2D 视图。
- 找到 Translate/Rotate 下拉菜单 Main 选项卡,然后单击 Displace 图标(补充文件 1- 图 S6A)。
- 单击并拖动左下角的 平移框 ,然后旋转所选 2D 视图中心的 枢轴点 ,以移动叠加图像以与基本图像大致对齐(补充文件 1 - 补充图 S6B)。有关对齐的参考,请参阅骨骼结构。
- 在 Manipulate 下拉菜单中找到 Track 工具,然后单击并拖动轴的中心,将轴移动到胸部区域。通过单击计算机鼠标上的中间滚动按钮并将鼠标拖离屏幕来放大胸部区域(补充文件 1 - 补充图 S6C)。
- 通过进一步的平移和旋转调整,微调对齐方式,以便与胸廓、上脊柱和胸骨等胸部结构进行精确定位。在 2D 视图之间切换并重复步骤 4.5.3-4.5.4,直到两个图像对齐以类似于 图 3。
- 对齐基础和第一个叠加 CT 图像后,在 LUT 下拉列表下将叠加 CT 图像的过滤器改回 灰度 。使用恒定的基础图像对来自同一动物的所有叠加 CT 图像重复第 4 节。

图 3:所有 CT 图像的对齐。 (A,B)对齐前和对齐后 (B) 的基础(灰色)和叠加(红色)CT 图像 (A) 的冠状视图。(C,D)对齐前 (C) 和 (D) 后的 CT 图像矢状面。蓝色箭头表示小鼠 (1) 胸廓、(2) 脊柱和 (3) 胸骨。缩写:CT = 计算机断层扫描。 请单击此处查看此图的较大版本。
5. 将 PET 图像与相应的 CT 图像共同配准
注意:叠加 CT 图像和基础 CT 图像的对齐最初会导致叠加 CT 图像与 图 4 中所示的相应 PET 图像错位。PET 图像需要再次与其相应的 CT 图像进行共同配准。
- 通过单击每个图像名称左侧的 眼睛图标 ,打开叠加 CT 图像及其相应的 PET 图像。
- 将 PET 和 CT 图像的不透明度更改为 ~50%。在 Window Leveling 下拉菜单下,找到 Opacity Mapping 下拉菜单,然后将 Opacity scale 滑动到中心(补充文件 1 - 补充图 S5)。
- 使用 2D 视图中的 平移/旋转 工具,根据 CT 图像中的骨骼结构和 PET 图像中的 18F-NaF 骨表面,将 PET 图像与其相应的 CT 图像对齐。
- 在 "数据属性和设置 "下拉列表中选择与叠加 CT 图像对应的 PET 图像,然后单击一次以选择其中一个 2D 视图。
- 在 Main 选项卡下找到 Translate/Rotate 下拉菜单,然后单击 Displace 图标(补充文件 1 - 补充图 S6A)。
- 单击并拖动左下角的平移框,然后旋转所选 2D 视图(补充文件 1 - 补充图 S6B)中心的枢轴点,以移动 PET 图像以与 CT 图像共同配准。
- 对所有未与其 CT 图像共配准的叠加 PET 和 CT 图像重复第 5 部分。
注意:如果共同配准完成,相应的 PET/CT 图像应沿身体的整个长度对齐,如图 4 所示。
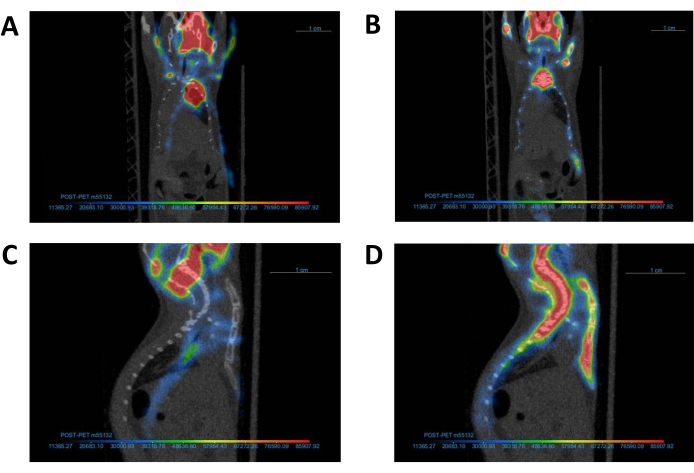
图 4:PET 图像与相应 CT 图像的对齐。 共同配准前和共配准后 (B, D) 的代表性 PET 图像及其相应的 CT 图像 (A, C)。完成共同配准后,PET 和 CT 图像应对齐,如图 B 所示。缩写:CT = 计算机断层扫描;PET = 正电子发射断层扫描。请单击此处查看此图的较大版本。
6. 识别心血管钙化
- 确定纵向研究中预测钙化区域最大的时间点(即,晚期钙化时间点或预处理的受试者)。选择与此时间点对应的图像作为"参考"图像,强调最明显可见的钙化。然后,这个选定的图像将用作模板,与在不同时间点包含较小钙化区域的所有其他图像进行比较。
- 通过单击图像左侧的眼睛图标打开参考 CT 图像。在 Manipulate 下拉菜单下选择 Track (跟踪) 工具,然后围绕心脏区域移动轴中心。
- 放大以发现叠加在胸廓、胸骨和脊柱之间的心脏轮廓上的钙化区域(小而明亮、致密的部位)(图 5)。如果钙化区域不能立即看到,请通过选择 2D 视图并使用鼠标滚动来滚动每个图像的图层。
- 移动 Track 轴以将鼠标悬停在钙化区域上,确保其在所有 2D 视图中可见。有关小鼠 CT 图像中钙化区域的视觉参考,请参阅 图 5。
- 打开相应的 PET 图像以验证是否存在钙化。
注意:如果 PET 图像设置和共同配准进行了适当调整,则 PET 图像应显示钙化区域周围的活动,如图 5D 所示。

图 5:识别心脏中的钙化区域。 代表性 (A) 矢状位、(B) 横向和 (C) 冠状位 CT 图像以及 (D) 冠状位 PET/CT 图像中描述的钙化区域。黄色箭头表示钙沉积。蓝色箭头标识用于确定钙化位置的参考结构。缩写:CT = 计算机断层扫描;PET = 正电子发射断层扫描。 请单击此处查看此图的较大版本。
7. 在钙化区域周围绘制 ROI
- 关闭 PET 参考图像。通过单击图像左侧的 眼睛图标 ,仅打开 CT 参考图像。
- 找到 Shapes(形状) 下拉菜单,然后选择 Sphere(球体 )形状(补充文件 1 - 补充图 S7)。通过单击并拖动球体的边缘来调整球体的尺寸以修改大小。通过单击并拖动中心方块来重新定位球体。
- 在 2D 视图中导航以仔细定位球体。球体应封装整个已识别的钙化区域和一些周围区域,但避免任何周围的骨骼。有关最佳球体绘制的视觉指南,请参阅 补充图 S7 (补充文件 1)以正确放置球体。
- 在 Data Properties and Settings 下拉列表中,右键单击球体名称,然后选择 Add to ROI... (补充文件 1 - 补充图 S8A),然后选择 New ROI (补充文件 1 - 补充图 S8B)。
- 为新创建的 ROI 分配适当的名称。在 几何图形下,选择要为其生成 ROI 的 CT 图像(补充文件 1 - 补充图 S8C)。
- 单击 ROI 名称左侧的 眼睛图标 打开 ROI,并观察与先前绘制的球体大小相对应的彩色 ROI,如 补充图 S8D (补充文件 1)所示。
- 在显示屏左侧的主选项卡旁边找到 Segment 选项卡(图 6A)。的 Segment 选项卡允许创建和编辑 ROI。
注意:以下三个步骤旨在创建 ROI,其精度仅突出显示指定球体内的钙化区域。- 在 Data Properties and Settings 中选择参考 ROI,然后找到 Range 下的下拉列表 Segment 选项卡。单击以检查 定义范围 (图 6A)。
- 使用 "选定范围 "框更改定义的范围(图 6A)。确保定义的范围封装了 Hounsfield 单位 (胡) 值低于钙阈值的所有非钙化像素。此演示对钙使用 300 胡 的阈值,此图像中的最低密度像素为 -2,626;因此,所选范围为 -2,626-300 胡。
- 配置所选范围后,单击 "删除 "(图 6A)以从球体 ROI 中消除低于指定阈值的所有像素。
注意:此操作会产生新的 ROI,该 ROI 仅突出显示球体内的钙化区域,从而简化了进一步分析的关注点。完成的 ROI 应类似于 图 6B 中描述的 ROI。
- 对所有连续的 CT 图像重复步骤 7.3-7.4,以使用公共参考球创建独特的新 ROI。命名每个 ROI 以与其特定 CT 图像的识别相对应,确保分析简洁有序。
注意:没有必要为每个图像的 ROI 分析创建一个新球体,因为参考球体应该封装所有图像中最大的钙化区域,假设对齐是准确的。
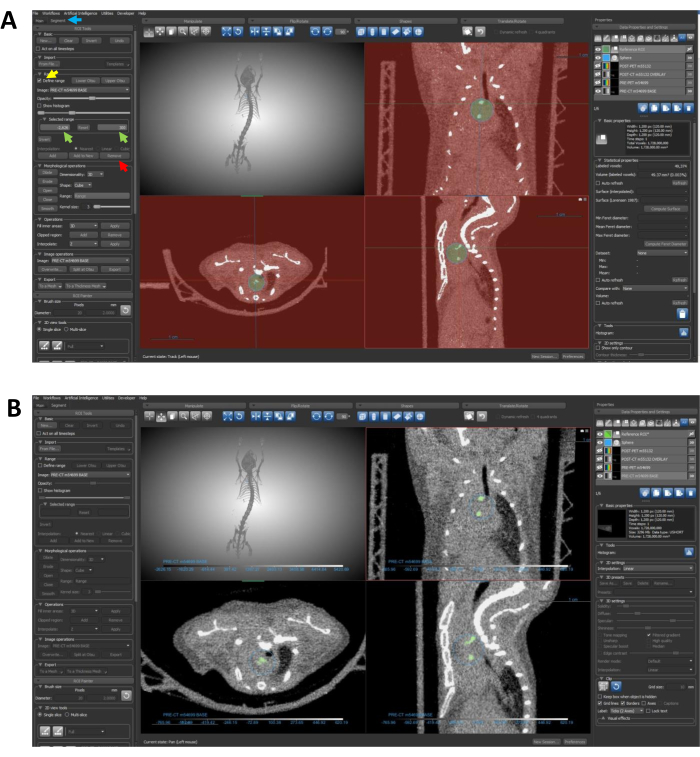
图 6:使用分割将 ROI 限制在钙化区域。 (A) 箭头指导完成从 ROI 中消除不需要的密度数据所需的步骤。蓝色箭头指向 Segment 选项卡;黄色箭头突出显示 Define Range 功能;绿色箭头表示选定的范围输入;,红色箭头指向 Remove 按钮。(B) 完成方案步骤 7.4-7.4.3 后,ROI 应具体划定钙化区域,如本面板所示。缩写:ROI = 感兴趣区域。 请单击此处查看此图的较大版本。
8. 量化每张图片的 ROI
- 在 Data Properties and Settings 下拉菜单。
- 在 Basic Properties 下拉列表下方的右侧找到 Statistical properties 下拉列表(图 7)。
- 在 Statistical Properties (统计属性) 下找到 Dataset 表。使用右侧的下拉菜单,选择与要量化的 ROI 相关的适当成像数据集(图 7)。
- 在 ROI 中量化 CT 数据时,请选择与 ROI 相关的 CT 图像名称。
- 量化 ROI 中的 PET 数据时,请选择与 ROI 对应的 PET 图像名称。
- 单击 Refresh 以获取所选钙化区域的量化值。根据数据集表记下 Min、Max 和 Mean 值。使用 平均值 进行定量(图 7)。
- 在 Statistical Properties 框的顶部找到体积计算。使用此体积进行定量(图 7)。
- 对于 CT 数据集,这些值以 胡 为单位报告。使用 平均 ROI 值 (胡) 和 ROI 体积 (mm3) 的乘积计算体积钙含量 (vHU) 12。
- 对于 PET 数据集,这些值以贝克勒尔 (Bq) 为单位报告,这与每秒的衰减数相对应。通过将平均 ROI 值 (Bq) 除以 ROI 的体积 (mm3) 转换为 Bq/mm3,用于示踪剂摄取浓度。

图 7:ROI 量化。 所选 ROI 的 Statistical Properties 选项卡。红色箭头说明了根据 ROI 获取数据集的统计信息所需的步骤。红色框标识体积和平均 Hounsfield 单位值,这对于进一步的分析计算至关重要。缩写:ROI = 感兴趣区域。 请单击此处查看此图的较大版本。
结果
分析方法
本节通过代表性结果说明成功利用。在这里,我们展示了在 15 个月和 18 个月大时扫描的单只小鼠的 microPET/microCT 组合图像,该图像在 12 至 14 个月大时接受西方饮食(21% 脂肪,0.2% 胆固醇)后。按照钙化定量的方案第 2-8 节,四名独立研究人员使用在 15 个月和 18 个月时间点获得的相同代表性 microPET/microCT 图像分别测量了体积钙含量和 18F-NaF PET 活性。计算统计分析,包括平均值、标准差、组内相关系数 (ICC)28,29,以确定方案的评分者间可靠性和可重复性。ICC 估计值及其 95% 置信区间使用 IBM SPSS 统计包计算,基于均值评级 (k = 4)、一致性、2 因子随机效应模型 (ICC(C,1))(补充文件 1-补充表 S1)。
结果
在15个月(平均值= 876.08 vHU,标准差= 27.18 vHU)和18个月(平均值= 1253.13 vHU,标准差= 7.61 vHU)图像时间点之间,一只小鼠的体积钙含量(源自钙化区域的体积和密度)增加(图8)。相比之下,测量钙化区域表面积的 18F-NaF PET 活性在同一只小鼠中在 15 个月(平均值 = 24173.90 Bq/mm3,标准偏差 = 1426.60 Bq/mm3)和 18 个月(平均值 = 13849.94 Bq/mm3,标准偏差 = 1524.67 Bq/mm3)图像时间点之间降低(图 8)。
这些结果与以前的发现一致,即 18F-NaF PET 和 CT 成像提供了有关动脉粥样硬化斑块的不同信息似乎 12,13,14。一项关于钙化的纵向研究显示了类似的趋势,表明 18F-NaF 信号的降低可能是由于小钙沉积物的聚结,最终尽管含量增加,但表面积减小12。

图 8:代表性的 microPET/CT 图像。 横视图(左)、冠状面(中)和矢状面(右)视图显示了 15 个月内氟化物-18 (F-18) 的摄取情况,而 18 个月具有代表性的 microPET 图像。白色箭头表示钙化区域。缩写:CT = 计算机断层扫描;PET = 正电子发射断层扫描。 请单击此处查看此图的较大版本。
在我们的结果中观察到的小标准差表明不同研究人员获得的测量值之间存在高度的一致性和一致性。此外,在我们的研究中获得的 ICC(C,1) 值为 0.997,95% 置信区间 = 0.983-1.000(补充文件 1-补充表 S1)表明不同研究人员所做的测量之间具有极好的一致性。这种一致性水平表明研究人员的测量结果可靠且一致,表明这种新型定量方案具有高度的重现性。
讨论
这种新颖的方案是量化心血管钙化的改进方法。由于成像的非侵入性,可以获取纵向 microCT 图像以跟踪小动物心血管钙化的进展。虽然单独的 microCT 图像可以显示钙含量的进展,但 microPET 图像(如果可用)可以提供额外的信息,尤其是由于示踪剂与表面积结合而增强了对小钙沉积的检测。为了进一步提高该方法的准确性和可重复性,建议结合对比增强心脏门控 CT 成像。对比增强 CT 成像简化了该方案在大型动物和临床研究中的应用,其中使用 18F-NaF PET 成像的低分辨率对比增强 CT 是量化心血管钙化的标准30,31。此外,心脏门控 PET 和心脏门控 CT 使用心电图 (ECG) 数据减少了运动伪影,从而获得更清晰、更高质量的心脏图像32,33。我们的图像分析方法可应用于纵向研究中的心脏门控 PET 和心脏门控 CT 数据。
DICOM 查看器普遍提供该协议所必需的功能。基本功能,包括 2D 和 3D 图像查看、直方图、窗口控制、查找表、易位、旋转、叠加和导航工具,是大多数 DICOM 查看软件34,35 的标准配置,允许精确对齐图像和精确定位钙化。更高级的功能,如分割,也是大多数 DICOM 查看软件 34,35,36 的通用功能,能够精确描述 ROI 并准确量化选定的 ROI。总体而言,这种适应性强的协议确保了跨 DICOM 观察平台的兼容性,使研究人员能够在不影响方法的情况下使用他们喜欢的软件。
虽然该协议通常很简单,但成功利用和可靠的结果取决于几个关键考虑因素。在图像重建和分析之前,必须在 DICOM 文件中包括衰减校正的注射剂量及其 18F-NaF PET 示踪剂单位,以确保量化的准确性。此外,在扫描仪孔内保持鼠标的一致和稳定位置极大地促进了图像的数字对齐——这是在纵向研究中保持序列图像分析一致性的基础过程。
其他关键步骤嵌入在协议中。应仔细选择 ROI,以排除骨骼和上胸部的其他钙化结构(如甲状软骨)。在开始绘制 ROI 之前,一个关键步骤是仔细选择具有最大可见钙化的时间点作为"参考"图像(参见协议步骤 6.1)。为了进一步提高 ROI 的准确性,最好将球体尺寸扩展到可见的钙化边界之外,同时排除任何相邻的骨骼,如 补充图 S7(补充文件 1)所示。这些策略选择确保 ROI 的边界全面包含所有后续扫描中的钙化区域。同样关键的步骤是选择体素密度的阈值,该值将识别钙矿物(参见协议步骤 7.4);这可能会因特定研究的规格而异,例如使用的成像设备和 DICOM 查看器软件。在说明性示例中,根据我们的 microPET/microCT 经验,ROI 的最小 microCT 密度阈值定义为 300 胡。
此协议的故障排除主要涉及验证是否在每个步骤中选择了正确的图像、对象和 ROI 或适当地打开/关闭了正确的图像、对象和 ROI。ROI 量化中的常见错误包括用户错误地选择了图像而不是 ROI,或者在统计属性下拉菜单下选择了与所选 ROI 不一致的数据集。图像可视化可能会带来另一个挑战。例如,如果不使用合适的色标,图像可能会过于暗或亮,从而掩盖钙沉积物。微调可视化设置至关重要,因为最佳配置可能与本协议中采用的配置不同。可能被证明有益的另一种协议修改涉及在 ROI 绘制步骤中探索各种形状,以最好地包围钙化区域。根据研究的要求,其他形状(例如圆柱体或胶囊)可能比示例方案中使用的标准球体更有效。有关解决 DICOM 查看软件特定错误的更详细帮助,建议咨询软件的技术支持。
虽然该协议简化了啮齿动物心血管钙化的分析,但存在一定的局限性。尽管 18F-NaF PET 成像是检测心血管钙化的极好方法,但由于分辨率限制和部分体积效应,在捕获最小的钙沉积物方面可能面临挑战,可能导致低估 PET 信号 8,27。在 CT 图像中,噪声的存在可能会影响检测37。虽然可以通过设置更高的 胡 阈值来减轻噪声,但权衡是排除最小的低密度沉积物。当通常密度的钙矿物矿床小于体素尺寸时,部分体积效应会导致它们看起来比实际密度更低,尺寸更大38,39。因此,在为研究设定最小密度阈值时存在微妙的平衡,需要在噪声导致的潜在高估和由于排除小矿床而可能低估之间进行权衡。
许多成熟的方法已经通过 CT 成像量化了钙化 11,12,20,40,41,42。这通常包括按照 Agatston 评分方案43 确定研究对象和患者的 CAC 评分。然而,由于数据的采集后截断、重新分配和阈值化,Agatston 评分的严重局限性使其非常不可靠39。此外,Agatston 评分协议只能识别扫描仪检测限 100-200 μm以上的区域 8。认识到钙化作为心血管疾病的危险因素的重要性日益增加,必须开发准确量化钙化的方法。18F-NAF PET/CT 成像的进步改善了心血管钙化的可视化;然而,为纵向研究开发准确的数据分析方法仍然存在挑战。目前的钙化量化方法涉及在纵向研究中的每个单独时间点在每个受试者的每个可见钙化区域周围手动绘制投资回报率 11,12,15。这些当前方法可能会影响准确性,尤其是当沉积物接近扫描仪的检测限时。如果不与显示最大钙化的时间点对齐,则在钙化较小的图像中定义 ROI 将变得具有挑战性。在我们的新协议中,我们提出了一种整合图像对齐和 ROI 一致性的精细数据分析方法,以提高连续图像中数据分析的一致性,从而提高纵向 PET/CT 研究中钙化评估的有效性。这种方法不仅解决了数据分析中的挑战,而且还可能提供对心血管钙化进展过程的见解。
披露声明
作者没有需要声明的利益冲突。
致谢
我们感谢加州大学洛杉矶分校 Crump 临床前成像技术中心的所有成员在数据采集和处理以及设备和基础设施维护方面的帮助。我们感谢 Jeffrey Collins 在回旋加速器操作和 18F-NaF 合成方面的帮助。我们感谢加州大学洛杉矶分校统计咨询小组在统计分析方面的帮助。这项工作得到了 NIH 癌症中心支持补助金(2 P30 CA016042-44 至 MT)和美国国立卫生研究院、心脏、肺和血液研究所(HL137647 和 HL151391 至 YT 和 LLD)的支持。GNEXT PET/CT 扫描仪由 NIH S10 动物研究共享仪器资助(1S10OD026917-01A1 至 Arion Chatziioannou)资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 cc Sterile Insulin Syringes | Exel International | #26028 | Used for IV injection of 18F-NaF PET Tracer |
| 18F-NaF PET Tracer | CNSI Cyclotron | ||
| Biorender | Biorender | Used for figure 1 | |
| Female Apoe-/- mouse | Jackson Laboratories | #002052 | B6.129P2-Apoetm1Unc/J |
| GNEXT PET/CT | Sofie Biosciences, Dulles, Virginia | ||
| Isoflurane | Piramal Critical Care | Used as anesthesia for mouse imaging | |
| ORS Dragonfly | Comet Technologies Canada Inc. | ||
| SPSS Statistics | IBM | ||
| Western diet for mice | Envigo | #TD88139 | 21% fat, 0.2% cholesterol |
参考文献
- Rennenberg, R. J. M. W., et al. Vascular calcifications as a marker of increased cardiovascular risk: A meta-analysis. Vasc Health Risk Man. 5, 185-197 (2009).
- Budoff, M. J., et al. Long-term prognosis associated with coronary calcification - observations from a registry of 25,253 patients. J Am Coll Cardiol. 49 (18), 1860-1870 (2007).
- Polonsky, T. S., et al. Coronary artery calcium score and risk classification for coronary heart disease prediction. JAMA. 303 (16), 1610-1616 (2010).
- Gepner, A. D., et al. Comparison of coronary artery calcium presence, carotid plaque presence, and carotid intima-media thickness for cardiovascular disease prediction in the multi-ethnic study of atherosclerosis. Circ Cardiovasc Imaging. 8 (1), e002262(2015).
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232.e5 (2017).
- Mori, H., et al. Coronary artery calcification and its progression: What does it really mean. JACC Cardiovasc Imaging. 11 (1), 127-142 (2018).
- Mohan, J., Bhatti, K., Tawney, A., Zeltser, R. StatPearls [Internet]. , Treasure Island (FL). (2023).
- Wang, Y., Osborne, M. T., Tung, B., Li, M., Li, Y. Imaging cardiovascular calcification. J Am Heart Assoc. 7 (13), e008564(2018).
- Fletcher, A. J., et al. Quantifying microcalcification activity in the thoracic aorta. J Nucl Cardiol. 29 (3), 1372-1385 (2022).
- Derlin, T., et al. Feasibility of 18F-sodium fluoride PET/CT for imaging of atherosclerotic plaque. J Nucl Med. 51 (6), 862-865 (2010).
- Hsu, J. J., et al. Changes in microarchitecture of atherosclerotic calcification assessed by 18F-NaF PET and CT after a progressive exercise regimen in hyperlipidemic mice. J Nucl Cardiol. 28 (5), 2207-2214 (2021).
- Hsu, J. J., et al. Effects of teriparatide on morphology of aortic calcification in aged hyperlipidemic mice. Am J Physiol Heart Circ Physiol. 314 (6), H1203-H1213 (2018).
- Irkle, A., et al. Identifying active vascular microcalcification by 18F-sodium fluoride positron emission tomography. Nat Commun. 6, 7495(2015).
- Syed, M. B. J., Doris, M., Dweck, M., Forsythe, R., Newby, D. E. Chapter 9 - Imaging vascular calcification: Where are we headed. Coronary Calcium: A Comprehensive Understanding of Its Biology, Use in Screening, and Interventional Management. , (2019).
- Joshi, N. V., et al. 18F-fluoride positron emission tomography for identification of ruptured and high-risk coronary atherosclerotic plaques: A prospective clinical trial. Lancet. 383 (9918), 705-713 (2014).
- Fiz, F., et al. 18F-NaF uptake by atherosclerotic plaque on PET/CT imaging: Inverse correlation between calcification density and mineral metabolic activity. J Nucl Med. 56 (7), 1019-1023 (2015).
- Kruithof, B. P., et al. An in vivo map of bone morphogenetic protein 2 post-transcriptional repression in the heart. Genesis. 49 (11), 841-850 (2011).
- Sheen, C. R., et al. Pathophysiological role of vascular smooth muscle alkaline phosphatase in medial artery calcification. J Bone Miner Res. 30 (5), 824-836 (2015).
- Tsai, M. T., Chen, Y. Y., Chang, W. J., Li, S. Y. Warfarin accelerated vascular calcification and worsened cardiac dysfunction in remnant kidney mice. J Chin Med Assoc. 81 (4), 324-330 (2018).
- Wait, J. M., et al. Detection of aortic arch calcification in apolipoprotein e-null mice using carbon nanotube-based micro-ct system. J Am Heart Assoc. 2 (1), e003358(2013).
- White, D. J., et al. 19F MAS-NMR and solution chemical characterization of the reactions of fluoride with hydroxyapatite and powdered enamel. Acta Odontol Scand. 46 (6), 375-389 (1988).
- Czernin, J., Satyamurthy, N., Schiepers, C. Molecular mechanisms of bone 18F-NaF deposition. J Nucl Med. 51 (12), 1826-1829 (2010).
- Chen, N. X., O'neill, K. D., Dominguez, J. M. 2nd, Moe, S. M. Regulation of reactive oxygen species in the pathogenesis of matrix vesicles induced calcification of recipient vascular smooth muscle cells. Vasc Med. 26 (6), 585-594 (2021).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262(2018).
- Chen-Mayer, H. H., et al. Standardizing ct lung density measure across scanner manufacturers. Med Phys. 44 (3), 974-985 (2017).
- Coxson, H. O. Sources of variation in quantitative computed tomography of the lung. J Thorac Imaging. 28 (5), 272-279 (2013).
- Rogasch, J. M. M., et al. Influences on pet quantification and interpretation. Diagnostics (Basel). 12 (2), 451(2022).
- Liljequist, D., Elfving, B., Skavberg Roaldsen, K. Intraclass correlation - a discussion and demonstration of basic features. PLoS One. 14 (7), e0219854(2019).
- Koo, T. K., Li, M. Y. A guideline of selecting and reporting intraclass correlation coefficients for reliability research. J Chiropr Med. 15 (2), 155-163 (2016).
- Moss, A. J., et al. Molecular coronary plaque imaging using (18)f-fluoride. Circ Cardiovasc Imaging. 12 (18), e008574(2019).
- Moss, A., et al. Coronary atherosclerotic plaque activity and future coronary events. JAMA Cardiol. 8 (8), 755-764 (2023).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-ct with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Yang, Y., Rendig, S., Siegel, S., Newport, D. F., Cherry, S. R. Cardiac pet imaging in mice with simultaneous cardiac and respiratory gating. Phys Med Biol. 50 (13), 2979-2989 (2005).
- Liao, W., Deserno, T. M., Spitzer, K. Evaluation of free non-diagnostic dicom software tools. Proc Spie. 6919, (2008).
- Haak, D., Page, C. E., Deserno, T. M. A survey of dicom viewer software to integrate clinical research and medical imaging. J Digit Imaging. 29 (2), 206-215 (2016).
- Aiello, M., et al. How does dicom support big data management? Investigating its use in medical imaging community. Insights Imaging. 12 (1), 164(2021).
- Kristanto, W., Van Ooijen, P. M., Groen, J. M., Vliegenthart, R., Oudkerk, M. Small calcified coronary atherosclerotic plaque simulation model: Minimal size and attenuation detectable by 64-MDCT and microCT. Int J Cardiovasc Imaging. 28 (4), 843-853 (2012).
- Dehmeshki, J., et al. Volumetric quantification of atherosclerotic plaque in ct considering partial volume effect. IEEE Trans Med Imaging. 26 (3), 273-282 (2007).
- Demer, L. L., Tintut, Y., Nguyen, K. L., Hsiai, T., Lee, J. T. Rigor and reproducibility in analysis of vascular calcification. Circ Res. 120 (8), 1240-1242 (2017).
- Alluri, K., et al. Scoring of coronary artery calcium scans: History, assumptions, current limitations, and future directions. Atherosclerosis. 239 (1), 109-117 (2015).
- Zhang, L., et al. Advances in CT techniques in vascular calcification. Front Cardiovasc Med. 8, 716822(2021).
- Achenbach, S., Raggi, P. Imaging of coronary atherosclerosis by computed tomography. Eur Heart J. 31 (12), 1442-1448 (2010).
- Agatston, A. S., et al. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 15 (4), 827-832 (1990).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。