Method Article
通过高维单细胞质谱流式细胞术鉴定和分析急性骨骼肌损伤过程中体内肌源性祖细胞
摘要
此处介绍的方案能够通过单细胞质谱流式细胞术鉴定和对肌肉干细胞和祖细胞进行高维分析,并通过 FACS 纯化它们,以深入研究其功能。这种方法可用于研究疾病模型中的再生动力学并测试药物干预的疗效。
摘要
骨骼肌再生是由成体肌肉干细胞及其后代驱动的动态过程。成体肌肉干细胞大多处于静止状态,在肌肉受伤时被激活。激活后,它们增殖,大多数后代分化产生具有融合能力的肌肉细胞,而其余的自我更新以补充干细胞库。虽然肌肉干细胞的身份是在十多年前定义的,但基于细胞表面标志物的共表达,直到最近才使用高维单细胞方法鉴定出肌源性祖细胞。在这里,我们提出了一种单细胞质谱流式细胞术 (飞行时间流式细胞术 [CyTOF])方法,用于分析急性肌肉损伤中的干细胞和祖细胞,以解决肌肉再生过程中展开的细胞和分子动力学。该方法基于同时检测新的细胞表面标志物和关键的肌原转录因子,其动态表达能够识别代表肌发生标志的活化干细胞和祖细胞群。重要的是,描述了一种基于检测细胞表面标志物 CD9 和 CD104 的分选策略,能够使用荧光激活细胞分选 (FACS) 前瞻性分离肌肉干细胞和祖细胞,以深入研究它们的功能。肌肉祖细胞为研究肌肉干细胞命运的控制、确定肌肉疾病的新治疗靶点以及开发再生医学的细胞治疗应用提供了一个关键的缺失环节。这里介绍的方法可用于研究 体内 肌肉干细胞和祖细胞响应扰动,例如针对特定信号通路的药物干预。它还可用于研究肌肉疾病动物模型中肌肉干细胞和祖细胞的动力学,促进我们对干细胞疾病的理解并加速疗法的开发。
引言
骨骼肌是人体质量最大的组织,调节从视力到呼吸、从姿势到运动以及新陈代谢的多种功能1。因此,保持骨骼肌的完整性和功能对健康至关重要。骨骼肌组织由紧密堆积的多核肌纤维束组成,周围环绕着复杂的神经和血管网络,表现出非凡的再生潜力 1,2。
骨骼肌再生的主要驱动力是成体肌肉干细胞 (MuSCs)。也称为卫星细胞,由于其独特的解剖位置靠近肌纤维质膜和基底层下方,它们于 1961 年首次被发现3。MuSC 表达一种独特的分子标志物,即转录因子配对盒 7 (Pax7)4。它们在健康成年人中大多处于静止状态,在肌肉受伤时被激活并增殖产生后代,这些后代将 (i) 分化为具有融合能力的肌肉细胞,这些细胞将形成新的肌纤维以修复肌肉损伤或 (ii) 自我更新以补充干细胞库5。
在细胞和分子水平上,再生过程是相当动态的,涉及细胞状态转换,其特征是关键肌原转录因子的协调表达,也称为肌原调节因子 (MRF)6,7。先前的体内发育研究、谱系追踪实验和使用成肌细胞的细胞培养工作表明,这些转录因子的顺序表达驱动肌生成,生肌因子 5 (Myf5) 在激活时表达,生肌分化 1 (MyoD1) 表达标记对生肌程序的承诺,肌生成素 (MyoG) 表达标记分化 8,9,10,11, 12,13,14。尽管有这些知识并且发现了纯化 MuSCs 的细胞表面标志物,但一直缺乏沿肌原分化途径识别和分离离散种群并解决体内肌原进展的策略和工具 15,16,17,18。
在这里,我们提出了一种基于最近发表的研究的新方法,该方法能够识别骨骼肌中的干细胞和祖细胞,并分析它们在急性肌肉损伤背景下的细胞、分子和增殖动力学19。这种方法依赖于单细胞质谱流式细胞术(也称为飞行时间流式细胞术 [CyTOF])来同时检测关键细胞表面标志物(α7 整合素、CD9、CD44、CD98 和 CD104)、细胞内肌原转录因子(Pax7、Myf5、MyoD 和 MyoG)和核苷类似物(5-碘-2′-脱氧尿嘧啶,IdU),以监测 S 期细胞19,20, 21,22,23。此外,该方案提出了一种基于检测两种细胞表面标志物 CD9 和 CD104 的策略,通过荧光激活细胞分选 (FACS) 纯化这些细胞群,从而能够在未来深入研究它们在损伤和肌肉疾病背景下的功能。虽然原代成肌细胞过去被广泛用于研究体外成肌分化的晚期阶段,但尚不清楚它们是否概括了体内发现的肌肉祖细胞的分子状态 24、25、26、27、28、29、30.成肌细胞的产生既费力又耗时,并且这种原代培养物的分子状态在传代后迅速变化31。因此,用这种方法纯化的新鲜分离的生肌祖细胞将提供一个更生理的系统来研究肌发生和体外遗传或药理学操作的影响。
这里介绍的方案可用于解决各种研究问题,例如,研究肌肉疾病动物模型中体内肌源区室的动力学,以响应急性遗传操作或药物干预,从而加深我们对不同生物学背景下肌肉干细胞功能障碍的理解,并促进新型治疗干预的开发。
研究方案
动物程序已获得丹麦动物实验检查局(协议 # 2022-15-0201-01293)的批准,实验按照奥胡斯大学的机构指南进行。在受伤前 24 小时在饮用水中提供镇痛剂(丁丙诺啡),以使小鼠适应味道。受伤后持续在饮用水中供应丁丙诺啡 24 小时。在急性肌肉损伤时皮下 (s.c.) 注射丁丙诺啡,注音欣注射后饮用水中的丁丙诺啡将减轻与损伤相关的疼痛。虽然建议在急性肌肉损伤时皮下注射丁丙诺啡,然后在饮用水中注射丁丙诺啡,但在受伤前在饮用水中注射丁丙诺啡是可选的。但是,研究人员必须遵守相关监管机构制定的动物福利标准和指南。
注意:对于受伤后肢肌肉的单细胞质谱流式细胞术 (CyTOF) 实验,从第 1 部分开始:肌肉损伤前 24 小时至受伤后 24 小时在水中镇痛。为了从未受伤小鼠中分选肌肉干细胞和祖细胞,执行第 5 节和第 6 节:安乐死 + 骨骼肌解剖和解离,并继续进行第 11 节:用荧光团偶联抗体对 FACS 进行染色。 实验装置和协议的概述如图 1 所示。
1. 肌肉损伤前 24 小时至受伤后 24 小时水中镇痛
- 向深色或铝箔包裹的饮水瓶中加入 3 mL 丁丙诺啡 (0.3 mg/mL),并用过滤水填充至 100 mL,以达到受伤前 24 小时的 0.009 mg/mL 终浓度。连接到鼠标笼。
- 受伤后 24 小时取下饮水瓶,并将小鼠笼重新连接到饮水阀系统。
2. 准备急性损伤手术
注意:使用 70% 乙醇对工作台、鼻锥装置和感应箱进行消毒。
- 用稀释的 notexin in PBS (5 μg/mL) 制备一根 1.5 mL 试管。在无菌 0.9% 盐水中稀释丁丙诺啡 (0.3 mg/mL) 至 0.015 mg/mL,装在光安全的 1.5 mL 试管中。保持在冰上。准备用于丁丙诺啡 (28 G, 0.5 mL) 和 notexin 注射 (29 G, 0.3 mL) 的胰岛素注射器。
- 配置基于异氟醚的麻醉装置:
- 对于感应箱中的麻醉,使用 3% 异氟醚,流量为 1.5 L/min(50% O 2,50% 大气)。
- 对于使用鼻锥设置的维护,使用 1.5% 异氟醚,流量为 0.6 L/min(50% O 2,50% 大气)。
3. notexin 注射引起的急性损伤
注意:Notexin 具有磷脂酶 A2 活性,是澳大利亚虎蛇 (Notechis scutatus) 毒液的主要成分,小鼠静脉注射 LD50 为 5-17 mg notexin/kg32,33。在本方案中,用 10 μL 5 mg/mL notexin 注射每个后肢的胫骨前肌 (TA) 肌肉,用 15 μL 5 mg/mL notexin 注射每个后肢的腓肠肌 (GA) 肌肉两次(一次进入每个头部肌肉)。正确进行肌内 (i-m.) 注射以限制损伤并经常检查注射的动物以确保将疼痛降至最低,这一点很重要。
- 在诱导箱中麻醉小鼠(3% 异氟醚)。当小鼠失去知觉时,将感应箱中的异氟醚水平降低至 1.5%。
- 根据机构批准的程序对小鼠进行称重和单独标记。在鼻锥设置下,用修剪器剃掉后肢,然后转移回感应盒。
- 计算每只小鼠的丁丙诺啡体积:
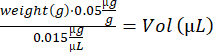
- 通过上下移液混合 notexin 溶液。准备 2 个胰岛素注射器(29 G,0.3 mL),装有 10 μL notexin 溶液 (5 μg/mL) 用于 TA 注射,4 个胰岛素注射器装有 15 μL notexin 溶液 (5 μg/mL) 用于 GA 注射。
注意:胫骨前肌 (TA) 位于小鼠小腿的前侧,从膝盖延伸到脚踝。腓肠肌 (GA) 是位于小腿后部、比目鱼肌浅表的双头肌肉。它从膝盖上方的两个头(内侧和外侧)延伸到脚后跟,延伸到总共三个关节(膝盖、踝关节和距下关节)。 - 进行肌肉注射
- TA 注射液(共 2 次注射)
- 将鼠标仰卧在鼻锥设置下,并用无菌酒精湿巾(70% 乙醇或异丙醇)对注射部位进行消毒。将针头向下斜向插入 TA 的腹部(中腹部远端)成 30° 角。沿着肌肉推进针头,平行于胫骨移动,到达 TA 的中腹部。缓慢连续地注射 notexin,将针头留在原位 10 秒后再取出。最初不要将针头插入太深(以避免将 TA 下方的 notexin 注射到趾长伸肌中),并且在推进针头时不要靠近近端(以避免注射得太靠近膝盖)。
- GA 注射液(共 4 次注射)
- 将针头向下斜切,以 ~45° 角插入 GA 侧头的中腹部。缓慢连续地注射 notexin,将针头留在原位 10 秒,然后再取出。如上所述,旋转后肢并在 GA 肌肉的内侧头注射 notexin。应注意不要将针头插入太深。
- TA 注射液(共 2 次注射)
- 将鼠标转过来,使用胰岛素注射器 (28 G, 0.5 mL) 注射丁丙诺啡 s.c.。将鼠标转移到加热板上的空恢复笼中。只有一半的笼底应放在加热板上,以允许鼠标在恢复过程中进行体温调节34。对其余小鼠重复步骤 3.3-3.6。
- 当恢复笼中的鼠标完全唤醒时,将其移回原来的笼子中。将其放回马厩,并补充湿粮。注射后 24 小时取出丁丙诺啡饮水瓶。
- 注射 notexin 后监测小鼠 6 小时,然后每 12 小时监测 2 天是否有疼痛、活动能力受损和食物消耗减少的迹象35,36。
4. 5-碘-2'-脱氧尿嘧啶注射液
注意:5-碘-2'-脱氧尿嘧啶 (IdU) 被怀疑会导致遗传缺陷并损害生育能力或未出生的孩子。处理前请阅读安全数据表 (SDS)。处理时应穿戴个人防护装备。称量 IdU 粉末时使用通风橱。应根据当地安全法规丢弃与 IdU 接触的材料。
注: 体内 IdU 标记用于监测损伤时间过程中的细胞分裂,因为 IdU 是一种碘化胸苷类似物,可掺入 S 期细胞的 DNA 中。在处死小鼠前8小时以20mg / kg体重腹膜内(ip)注射IdU。
- 使用 37 °C 的超声仪在无菌 PBS 中制备 2 mg/mL 的 IdU 储备液。IdU 对光敏感;当天使用或在 -20 °C 下冷冻长达 3 个月。如果使用冷冻的 IdU:解冻、涡旋、以 10,000 x g 离心 30 秒,并使用上清液进行以下注射。
- 在诱导箱中麻醉小鼠(3% 异氟醚)。记下指定标记,称量小鼠,并计算 IdU 溶液的体积:

- 使用胰岛素注射器(28 G,0.5 mL)进行腹腔注射,并将鼠标转移到加热板上的空恢复笼中。唤醒时,将鼠标移回其原始笼子。对剩余的小鼠重复步骤 4.2-4.3,并将它们放回稳定室。
5. 安乐死
注:缓冲液配方见 表 1 。准备洗涤培养基(营养混合物 F-10 (Ham's)、10% 马血清、1x Pen/Strep)并通过聚醚砜 (PES) 膜过滤到聚苯乙烯容器中。准备解离缓冲液(补充有 650 U/mL 胶原酶 II 型的洗涤培养基)并保持在冰上。CyTOF 质谱流式细胞术测量对污染物非常敏感。因此,必须使用最高分析级的试剂进行样品处理。为防止金属污染,强烈建议使用无菌塑料器皿和从未用清洁剂清洗过的新玻璃器皿,因为许多实验室肥皂含有高浓度的钡。建议使用双过滤蒸馏去离子水进行试剂制备。磷酸盐缓冲盐水 (PBS) 在内部制备。将 10x 原液稀释至 1x 并用 0.2 μm 过滤器过滤 1x PBS。在每个实验开始时再次过滤 1x PBS。由于存在钡,不得用清洁剂清洁解剖工具。
- 用感应箱准备体重秤、容器和基于异氟醚的麻醉装置。对适当的解剖工具进行消毒。
- 为每只小鼠准备 50 mL 试管并用 5 mL 解离缓冲液和培养皿标记。将解离缓冲液保存在冰上。
- 在诱导箱中麻醉小鼠(3% 异氟醚,失去知觉时增加到 5%)并进行颈椎脱位。
6. 骨骼肌解剖和分离
- 从两个后肢解剖 TA 和 GA 肌肉,并转移到培养皿的盖子中。用剪刀将组织切成碎浆(~1 毫米3 块)。转移至含有 5 mL 冰冷解离缓冲液的 50 mL 试管中。保持在冰上。
- 重复安乐死程序(步骤 5.3)和骨骼肌解剖和解离程序(步骤 6.1),直到所有小鼠都处理完毕。
- 在 37 °C 水浴中预热所有样品管(2 分钟),并在培养箱 (37 °C) 中旋转孵育 45 分钟。
- 加入 10 mL 洗涤培养基涡旋和洗涤。离心(380 x g,10 分钟,室温 [RT]),并吸出至 4 mL。
- 添加 0.5 mL 胶原酶 (1000 U/mL) 和 0.5 mL 分散酶 (11 U/mL)。涡旋并在 37 °C 下旋转孵育 20 分钟(例如,在培养箱中)。离心(380 x g,1 分钟,RT)并用 5 mL 移液器重悬。
- 向 50 mL 试管中加入 40 μm 细胞过滤器,并用 5 mL 洗涤培养基预湿。使用带有 20 G 针头的 5 mL 注射器吸出并弹出细胞悬液 10 次。通过预润湿的 40 μm 细胞过滤器过滤。用 10 mL 洗涤培养基洗涤 50 mL 试管,将其转移到 40 μm 细胞过滤器中,然后离心(380 x g ,10 分钟,4 °C)细胞悬液。
7. 顺铂和多聚甲醛固定活/死染色
注意:顺铂和多聚甲醛 (PFA) 具有致癌性。处理前请阅读 SDS。多聚甲醛 (PFA;16%) 是一种皮肤、眼睛和呼吸道刺激物。穿戴个人防护装备并在通风橱下处理这些物质。在固定细胞期间,PFA 的最终浓度为 1.6%。应采取正确的保护措施,并应根据当地法规处理废物。
注意:制备冷 (4 °C) 和温 (37 °C) 无血清 DMEM。准备补充有 10% FBS 的 DMEM,通过 PES 膜过滤到聚苯乙烯容器中,并保持在冰上。制备 PBS 和细胞染色培养基 (CSM;PBS、0.5% BSA、0.02% 叠氮化钠)装在 CyTOF 专用玻璃瓶中,并通过 PES 膜过滤。CSM 可在 4 °C 下储存长达 6 个月。
- 吸出上清液,轻弹沉淀,然后重悬于 1 mL 无血清冷 DMEM 中。对细胞进行计数,并在无血清 DMEM 中将细胞密度调节至 1 x 106 个细胞/mL。
- 加入顺铂原液 (25 mM) 至终浓度为 25 μM。涡旋 10 秒并孵育 1 分钟(反应对时间非常敏感)。用冰冷的 DMEM+10% FBS(样品体积的 3 倍)淬灭反应物,并将其保存在冰上。离心(380 x g ,10 分钟,4 °C),吸出上清液并彻底重悬沉淀(在 CSM 中高达 10 x 106 个细胞/mL)。通过 35 μm 细胞过滤器过滤悬浮液。
- 用过滤后的 PFA 储备液 (16%) 固定细胞悬液,并上下移液(在通风橱下进行)以达到最终的 PFA 浓度 (1.6%)(例如,向 900 μL 细胞悬液中加入 100 μL 16% PFA)。涡旋 30 秒,在冰上孵育 10 分钟,然后离心用 2 mL CSM 洗涤两次(800 x g,5 分钟,RT)。
注:此时,样品可以在干冰上快速冷冻并储存在 -80 °C 下,或直接用于抗体染色。如果要冷冻细胞,请将细胞转移到 5 mL 聚丙烯管中,因为聚苯乙烯在低温下会破裂。如果使用新鲜固定的细胞进行染色,请继续执行步骤 8.2。
8. 用金属偶联抗体染色
注意:甲醇 (MeOH) 高度易燃,对呼吸道有腐蚀性。处理前请阅读 SDS。穿戴个人防护装备并在通风橱下处理该物质。根据当地法规处理废物。
注:靶向表面标志物和细胞内标志物的抗体 (Ab) 列表见 表 2。
抗体偶联:该方案中使用的大多数抗体都是在内部偶联的,因为它们没有市售。抗体的金属偶联方案之前已经发布,偶联试剂盒现已上市37,38。G 型免疫球蛋白 (IgG) 与可用的偶联方案兼容。用于金属偶联的抗体制剂不含含半胱氨酸的载体蛋白(例如牛血清白蛋白 (BSA)),这一点非常重要,这些载体蛋白会通过竞争聚合物的游离马来酰亚胺基团来影响偶联效率,并可能干扰金属偶联抗体的定量。明胶的半胱氨酸含量远低于 BSA。但是,如果抗体制剂包含载体蛋白,建议在偶联前去除此类蛋白质。现在可以向制造商索取不含 BSA 和明胶的抗体。小分子防腐剂(例如叠氮化钠、甘油和海藻糖)与金属偶联方案兼容37,38。
抗体滴定:每次金属偶联后,应滴定抗体以确定提供最大信噪比的最佳抗体浓度。对于抗体滴定,进行 6 步 2 倍连续稀释,并对已知表达(例如肌肉细胞、阳性对照)和缺乏(阴性对照)目标蛋白 19,21,37,38 的样品进行染色。
通过将储备液稀释至 0.1 μM的 PBS/1.6% PFA 溶液,制备新鲜的 Cell-ID Intercalator-Ir(原液 = 500 μM;Intercadator-Ir 溶液)工作溶液。
- 在 RT 下解冻冷冻样品 5 分钟并离心(800 x g,1 分钟,RT)。用 2 mL CSM 离心洗涤(800 x g,5 分钟,RT)。
- 在 CSM 中制备 2.5x 表面抗体 (Ab) 染色混合物。将上清液吸出至 ~60 μL 并彻底重悬沉淀。通过添加 40 μL 表面抗体染色混合物并在 RT 下孵育 1 小时来对细胞进行染色。
- 每 20 分钟轻弹一次样品以混合。通过离心(800 x g,5 分钟,RT)用 1 mL CSM 洗涤两次。吸出上清液并轻弹沉淀。
注:如果不需要细胞内染色,则不需要甲醇透化。然而,如果仅进行表面染色,则必须在含有透化剂(例如 Maxpar 固定和透化缓冲液)的缓冲液中稀释嵌入剂 - IR 溶液以穿透核膜。继续执行步骤 8.5,在含有透化剂和 1.6% PFA 的缓冲液中稀释 Cell-ID Intercalator-Ir。否则,请继续进行下面的细胞内染色。
注意: 铱是危险的,必须采取安全处理的预防措施。铱是易燃的,对眼睛/皮肤有刺激性。避免产生和吸入灰尘或烟雾。避免接触皮肤和眼睛。然而,插层-IR 溶液混合物在水中以 <1% 的浓度提供,根据化学品分类和标签的全球统一制度 (GHS),这被认为是无害的。处理前从 Standard Biotools 读取 SDS。处理时应穿戴个人防护装备。应根据当地安全法规丢弃与插层 IR 溶液接触的材料。 - 要透化细胞,涡旋时滴加 0.5 mL 冰冷的 MeOH。在通风橱下的冰上孵育 15 分钟。离心(800 x g,5 分钟,RT),然后通过离心(800 x g,5 分钟,RT)用 1 mL CSM 洗涤两次。最后一次洗涤后,将上清液吸出至 ~60 μL 并彻底重悬沉淀。
- 在 CSM 中制备 2.5x 细胞内 Ab 染色混合物。加入 40 μL 细胞内 Ab 染色混合物并在室温下孵育 1 小时,对细胞进行染色。每 20 分钟轻弹一次样品以混合。
- 通过离心(800 x g,5 分钟,RT)用 1 mL CSM 洗涤两次。吸出上清液并轻弹沉淀。将样品重悬于 0.5 mL 插层铱溶液(表 1)中并涡旋。将样品在 RT 下孵育 1 小时或在 4 °C 下过夜 (O/N)(见下面的注释)。
注意:样品可以在 4 °C 的插层铱溶液中储存长达 48 小时。本研究中使用的染色方案是根据 Nolan 实验室{C}23 的开创性工作开发的。它与标准 Biotools 方案不同,因为 (i) 使用内部制备的缓冲液进行洗涤和染色,(ii) 在表面染色前固定细胞,以及 (iii) 用甲醇透化细胞,用转录因子或信号分子抗体进行细胞内染色。开发新方案的研究人员必须彻底测试其抗体组合与甲醇作为透化剂的相容性。向检测组合添加新抗体时,建议在金属偶联和滴定之前使用阳性和阴性对照样品通过流式细胞术测试抗体特异性。
9. 上样到质谱流式细胞仪的样品制备
注:当细胞沉淀在 CAS 缓冲液中时非常松散(材料表)。在用 CAS 缓冲液洗涤期间,不要吸出至干燥。相反,请按照以下说明保留残差体积。
- 涡旋并离心(800 x g ,10 分钟,RT)样品。倒出上清液(作为 PFA 废物处理)并涡旋。
- 用 1 mL CSM 离心洗涤(800 x g,10 分钟,RT)。 吸出上清液并轻弹沉淀。
- 用 1 mL CAS 缓冲液离心洗涤(800 x g,10 分钟,RT)。吸出至 ~200 μL。涡旋并加入 1 mL CAS 缓冲液。取出 5 μL 等分试样进行细胞计数。离心(800 x g,10 分钟,RT)并小心吸出至 ≤50 μL。不要打扰颗粒。
- 在 CAS 缓冲液中将沉淀重悬至 1–2 x 106 个细胞/mL,并添加校准微珠 (1x; 材料表)至终浓度为 0.1x(例如,将 100 μL 1x 校准珠添加到 900 μL 细胞悬液中)。
- 将样品上样到质谱流式细胞仪中,并使用 400–500 个细胞/秒的流速收集数据。
- 使用 CyTOF 软件或先前开发的标准化工具对 FCS 文件进行数据标准化39。
注意:CyTOF 质谱流式细胞仪的操作是特定于仪器的40,41。建议在操作前查阅 CyTOF 用户手册。校准微珠是金属包埋的聚苯乙烯归一化微珠标准品,含有已知浓度的金属同位素铈 (140/142Ce)、铕 (151/153Eu)、钬 (165Ho) 和镥 (175/176Lu)。校准微球可以控制机器灵敏度,机器灵敏度会随时间而变化,这主要是由于生物材料的积累和血浆电离随时间的变化。
10. CyTOF 数据分析
注:对于下游分析,标准化的 FCS 文件可以在本地分析或上传到基于云的软件解决方案,例如 Cytobank、Cell Engine、OMIQ 或 FCS Express42。
- 如有必要,将每个样品的单个 FCS 文件连接到一个文件中。
- 通过设门铱插层阳性事件来识别单细胞,从而能够区分单核细胞与碎片或双峰。
- 通过选择顺铂阴性事件对活细胞进行设门。顺铂与细胞蛋白共价结合,并比活细胞更大程度地标记膜受损的垂死细胞和死细胞43。
- 对感兴趣的群体进行门控,例如,生肌区室(Live/CD45 - / CD31 - / Sca1 - /α7整合素+ / CD9 + )(图2A)并量化干细胞和祖细胞的相对比例。这种方法需要事先了解细胞表面或细胞内标志物表达,以定义单个群体。
- 为了执行高维分析,以便能够识别复杂群体中以前未识别的稀有细胞亚群,导出感兴趣的群体,并使用专为 CyTOF 数据分析开发的聚类算法44。
注意:以前的工作采用了 X-shift 算法,该算法在高维空间中使用加权 k 最近邻密度估计 (kNN-DE) 来执行基于定义参数的无监督聚类19。X-shift 已被证明在识别稀有细胞群方面非常有效45。 - 对于 X 偏移分析,请下载 vortex 软件包(来自 Nolan 实验室 GitHub 页面 [https://github.com/nolanlab/vortex])和 Java 64 位46。说明可在此处找到:https://github.com/nolanlab/vortex/wiki/Getting-Started。
- 将导出的细胞群上传到本地数据库并定义聚类参数。用户定义的参数包括 (i) 用于聚类的标记,(ii) k 值的范围(例如,5 到 150),以及 (iii) 聚类步骤的数量。
注:以前的工作使用已知在肌肉干细胞中表达的表面标志物、在肌肉细胞和成肌细胞的高通量流式细胞术筛选中鉴定的新型表面标志物以及已知定义肌生成不同阶段的肌原转录因子 (TFs) 的组合作为聚类标志物。这种方法能够识别两种细胞表面标志物 CD9 和 CD104,它们的共表达模式区分了以前未识别的祖细胞群19。 仔细选择聚类标记将使研究人员能够回答特定的研究问题。例如,如果需要随时间识别和分析分裂的细胞子集,建议将 IdU 作为聚类标记之一。X-shift 可以在多个 k 值处执行聚类,并通过计算"弯头点"自动识别产生最佳聚类数的 k 值,从而避免聚类不足或过度碎片化。建议计算弯头点,并使用由最佳 k 值定义的聚类分析,用于数据可视化和下游应用程序。 - 为了可视化 X 移位簇内细胞群之间的空间关系,请执行力导向布局,这将生成一个 2D 图,其中簇之间的距离表明它们在高维表型空间中标记表达的相似性。通过一次使用一个标记为图谱着色,可以发现新的细胞群并跟踪它们的动态。建议通过在 Cytobank 和 Cell Engine 等软件中手动设门进行后续定量。
- 执行热图分析,以量化整个时间过程中多种表面和细胞内蛋白的动态表达,并揭示新趋势。
注意:在执行受伤时间过程时,可以将所有时间点的数据聚集在一起,以生成再生图。此外,可以将这种映射剖析为各个时间点,以跟踪随着时间的推移再生的细胞和分子动力学19。
11. 用荧光团偶联抗体对 FACS 进行染色
注:用于未染色的单色对照和荧光减一 (FMO) 对照的细胞可以来自额外小鼠的 TA 和 GA 组(如果可用)。或者,可以按照与上述 TA+GA 相同的程序将股四头肌(大腿前部上部肌肉)解剖并消化成单细胞悬液,并用于对照。准备 FACS 缓冲液(PBS、2.5% 山羊血清、2 mM EDTA),通过 PES 膜过滤到聚苯乙烯容器中,并保持在冰上。FACS 缓冲液可在 4 °C 下储存长达 1 个月。用于 FACS 的抗体列表见 表 3。
- 准备谱系混合物。在 50 μL(包含约 3–5 x 105 个细胞)中对每个对照进行染色。计算所需的世系混合量。使体积超出 20%–30%。用于谱系混合物的抗体储备浓度为 0.2 mg/mL。
- 在 0.5 mL 试管中,加入抗 CD45 APC-Cy7、抗 CD31 APC-Cy7、抗 Sca1 APC-Cy7 和抗 CD11b APC-Cy7,以达到分别达到 1 μg/mL、2.5 μg/mL、2.5 μg/mL 和 0.63 μg/mL 的最终浓度。
- 准备全染色混合物。用 500 μL(包含约 3–5 x 106 个细胞)对每个全染色样品进行染色。制作 10% 体积过量的全染色混合物。
- 在 1.5 mL 试管中,添加上述谱系混合抗体 + 抗 α7 整合素 PE、抗 CD9 APC 和抗 CD104 FITC,以分别达到 2 μg/mL、1.2 μg/mL 和 3 μg/mL 的最终浓度。
- 制备 FACS 缓冲液 + DAPI:对于 10 mL FACS 缓冲液,添加 1 μL DAPI(原液 = 1 mg/mL)以达到 100 ng/mL 的最终 DAPI 浓度。
注意:DAPI(4',6-二脒基-2-苯基吲哚二盐酸盐)被归类为可能的皮肤和呼吸道刺激物。然而,根据 GHS 的说法,浓度为 <1% 的 DAPI 溶液被认为是无害的。处理前请阅读 SDS。处理时应穿戴个人防护装备。应根据当地安全法规丢弃与 DAPI 接触的材料。 - 重悬第 6 部分的细胞:骨骼肌解剖和解离:
- 对于全染色样品,将单只小鼠的 TA 和 GA 组重悬于 500 μL FACS 缓冲液中,并将其转移到 15 mL 试管中进行染色。
- 对于控件,请使用 TA 和 GA 集或 quadricep 集。如果使用 1 只鼠标作为对照,将细胞重悬于 750 μL FACS 缓冲液中。如果多只小鼠,将每个 TA 和 GA 或股四头肌组重悬于 500 μL FACS 缓冲液中,并从每个样品中取馏分,将这些组合并为单个 1 mL 样品。将 50 μL 对照细胞(3–5 x 105 个细胞)添加到 5 mL 聚丙烯管中进行染色。
- 如 表 4 所述染色,在 4 °C 下在黑暗中染色 45 分钟。
- 通过添加 5 mL FACS 缓冲液洗涤所有染色的样品。通过加入 1 mL FACS 缓冲液并离心(380 x g ,10 分钟,4 °C)洗涤对照。
- 将所有染色的样品重悬于 1 mL FACS 缓冲液 + DAPI 中。将对照重悬于 300 μL FACS 缓冲液中,含或不含 DAPI。
- 将细胞保持在 4 °C 黑暗中,直到在带有 4 个激光器(405 nm、488 nm、561 nm、633 nm)的流式细胞仪上分选。
- 在分拣机上运行对照和样品,并使用相关软件创建分拣门。对于未染色/单色对照和 FMO 对照,分别记录 1 x 104 和 0.3–1 x 105 个事件。对于全染色样品,最多可记录 1 x 106 个事件。根据下游检测要求对所有全染色样品或根据需要分选。对于此处使用的流式细胞仪 (FACSAria III),使用 70 mm 喷嘴在 纯度模式下 分选。
- 有关门控策略,请参见 图 4 。
- 使用未染色和单色对照设置所有检测器的电压。
- 使用单色控件设置补偿矩阵。
- 使用 FMO 控件建立排序门。
- 将不同的肌肉干和祖细胞群分选到冰冷的 FACS 缓冲液中。
- 离心(380 x g ,10 分钟,4 °C)细胞群。在适当的缓冲液中重悬,计数并继续下游分析。
结果
在这里,我们概述了使用这种组合方法的实验设置,其中包括 (i) 通过 notexin 注射对急性损伤时间过程进行高维 CyTOF 分析,以研究骨骼肌中干细胞和祖细胞的细胞和分子动力学(图 1,上图);(ii) 使用两种细胞表面标志物 CD9 和 CD104 对干细胞和祖细胞进行 FACS,以分离这些细胞群并对其功能进行深入研究(图 1,下图)。8-10 周龄雌性 C57BL/6 小鼠用于下述实验。
骨骼肌的 CyTOF 分析,用于识别干细胞和祖细胞,并研究它们在急性损伤过程中的细胞和分子动力学
我们重新分析了公开可用的、先前发表的 CyTOF 数据集,该数据集来自 notexin 注射的急性损伤时间过程,其中骨骼肌样本用一组 21 种金属偶联的 CyTOF 兼容抗体19 染色(图 2 和 图 3)。在这里,我们介绍了用于在骨骼肌 中识别体内 干细胞和祖细胞的分层门控策略(图 2A)。这种方法可识别 4 个群体、干细胞 (SC) 和祖细胞群 1-3 (P1、P2、P3) 的序列。祖细胞群 P1 和 P2 对应于越来越成熟的祖细胞。P3 先前已被鉴定,但由于其丰度低而未表征。
我们首先通过设门 Ir191/Ir193 双阳性事件来识别细胞,由于该试剂的核酸嵌入特性,这使我们能够区分单核细胞与碎片或双峰47。然后,我们通过对顺铂阴性事件进行门控来识别活细胞,因为顺铂是一种与细胞蛋白共价结合的化学物质,并且比活细胞更大程度地标记细胞膜受损的细胞(垂死细胞和死细胞)43。我们通过排除免疫细胞 (CD45 +、CD11b +)、内皮细胞 (CD31 +) 和间充质细胞 (Sca1 +),并α7 个整合素 + / CD9 + 生肌细胞设门,进一步富集生肌细胞16,19。然后通过使用 CD9(y 轴)通过 CD104(x 轴)双轴点图可视化 CD9 和 CD104 在 α7 整合素+/CD9 + 肌源细胞门内的表达来鉴定干细胞和祖细胞。干细胞 (SC) 表达中等水平的 CD9 而缺乏 CD104 的表达 (左下象限);P1 祖细胞表达高水平的 CD9 而缺乏 CD104 的表达 (左上象限);P2 祖细胞表达高水平的 CD9 和 CD104 (右上象限),P3 祖细胞表达中等水平的 CD9 和中等至高水平的 CD104 (右下象限) (图 2A)。此处介绍的实验中使用的 CyTOF 面板包括针对细胞表面标志物、细胞内肌原转录因子和信号分子的抗体(图 2B)。
为了可视化不同干细胞和祖细胞群中生肌转录因子的表达,我们通过来自未受伤肌肉样本的 CD104 双轴点图显示了代表性 CD9,通过表达 Pax7、Myf5、MyoD 和 MyoG 以及 CD9 和 CD104 在三维中着色,以突出它们在不同群体中的差异表达(图 2C)。
为了可视化急性损伤期间干细胞和祖细胞群的细胞、分子和增殖动力学,我们通过不同损伤时间点(第 0 天、第 3 天、第 6 天)的 CD104 双轴点图显示代表性 CD9,通过掺入 IdU 在第三维着色(左),从而能够识别 S 期的细胞, 或 MyoD 的表达(右),MyoD 是一种在进入细胞周期的活化干细胞中上调的转录因子(图 3A)。如前所述,干细胞群 (SC) 在受伤后第 3 天按比例增加(红色箭头),表明扩增,IdU 掺入量的大幅增加证实了这一点,表明细胞增殖(图 3A,左)。IdU 掺入的增加伴随着 MyoD 表达的增加(图 3A,右)。
鉴于活化肌肉干细胞 (MuSCs;高度增殖和 MyoD高) 的成熟分子定义,肌肉细胞的高维 CyTOF 分析研究了已知和新型细胞表面标志物、肌原转录因子和 S 期标志物的表达,能够仅根据细胞表面标志物鉴定活化干细胞特征19, 48,49,50。这种基于细胞表面标志物 CD98 和 CD44 共表达的特征,现在可以在受伤后第 3 天识别和前瞻性分离这种瞬时 MuSC 亚群,为干细胞自我更新的研究打开了大门,这在以前是不可行的19。为了可视化活化干细胞的亚群,我们通过CD44(x轴)双轴点图显示不同损伤时间点(第0天、第3天、第6天)SC群体的代表性CD98(y轴),在第三维上通过IdU掺入着色(左)或MyoD的表达(右)。活化干细胞由高水平细胞表面标志物 CD98 和 CD44 的共表达以及高 MyoD 表达和高 IdU 掺入定义,由红色箭头表示(图 3B)。这些数据突出了 MuSCs 在受伤后第 3 天的高增殖状态和激活表型。
FACS 纯化干细胞和祖细胞
用于通过 FACS 分离肌肉干细胞和祖细胞群的门控策略如图 4 所示。主门用于排除碎屑。单峰门允许排除双峰51。活细胞设门排除了用 DAPI 染色的垂死细胞和死细胞,谱系阴性设门排除了免疫细胞 (CD45+/CD11b+)、内皮细胞 (CD31+) 和间充质细胞 (Sca1+),这些细胞用相同荧光基团 APC-Cy7 标记的单个抗体染色。肌原区室内的细胞根据 α7 整合素的表达和 CD9 的中高表达水平进行门控。根据 CD9 和 CD104 的差异表达鉴定肌肉干细胞和祖细胞群(图 4A),并量化它们的相对比例(图 4B)。每个门都是使用适当的 FMO 对照建立的,这些对照考虑到该对照中使用的荧光团偶联抗体组合产生的背景信号(图 4C)。SC 群体是根据 CD9 中间水平的表达和 CD104 表达的缺乏 (CD9int/CD104-) 定义的。虽然 P1 和 P2 表达高水平的 CD9,但 CD104 在 P1 祖细胞中不表达 (CD9高/CD104-),但在 P2 祖细胞中高表达 (CD9高/CD104高)。

图 1:在急性肌肉损伤的情况下分析和纯化肌肉干细胞和祖细胞的联合方法。 协议方案。(上部方案)在急性损伤背景下,通过骨骼肌的高维 CyTOF 分析研究干细胞和祖细胞动力学。伤病时间实验设置需要在组织收获前 6 (第 -6 天) 或 3 (第 -3 天) 在小鼠的胫骨前肌 (TA) 和腓肠肌 (GA) 肌肉中肌肉注射 (im.) 注意辛。在组织收获前 8 小时 (-8 小时) 腹膜内 (ip) 进行 IdU 注射以检测增殖细胞。TA 和 GA 肌肉被解剖,组织通过机械解离和酶消化的组合被解离。然后将细胞与顺铂一起孵育以检测垂死和死细胞,用多聚甲醛固定以保持标志物表达,用金属偶联抗体染色,并用甲醇透化以进行细胞内染色。最后在 CyTOF 仪器上分析细胞。在 CyTOF 分析和事件采集之后,使用 Cytobank 或 Cell Engine42 等服务器对数据进行归一化、连接和存储。可以使用 (i) 传统的双轴图和 (ii) 高维聚类算法来分析数据,例如 X-shift,一种基于 k 最近邻的算法47。如前所述19 所示,可以通过单细胞力导向布局可视化来可视化细胞簇。(下限方案)干细胞和祖细胞的 FACS。如上所述解剖和解离来自未受伤小鼠 (稳态) 的 TA 和 GA 肌肉。用谱系标志物(CD45、CD11b、CD31 和 Sca1)、用于定义肌肉干细胞和祖细胞群(α7 整合素、CD9 和 CD104)的细胞表面标志物以及 DAPI 抗体对细胞进行染色,以确定活力。在 FACS 仪器上分析细胞以建立分选策略,并根据细胞表面标志物 CD9 和 CD104 的差异表达分为不同的肌肉干细胞和祖细胞群。 请单击此处查看此图的较大版本。
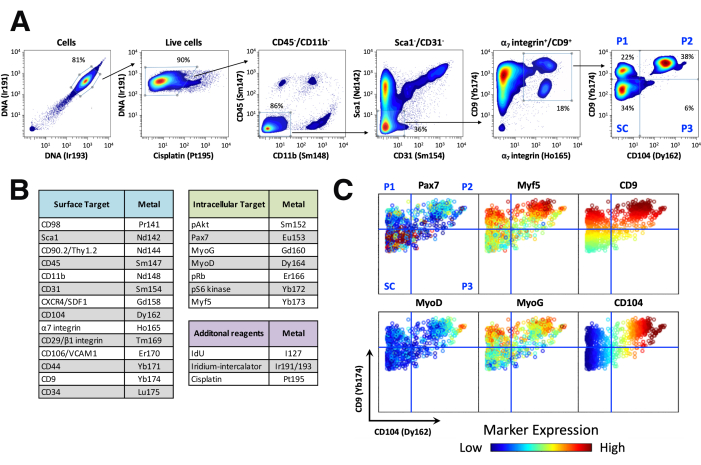
图 2:使用单细胞质谱流式细胞术 (CyTOF) 鉴定干细胞和祖细胞。 (A) 识别肌肉干细胞和祖细胞的 CyTOF 设门策略。通过用阳离子核酸嵌入剂 (Cell-ID Intercalator-Ir) 染色并在 Ir191/Ir193 双阳性事件上设门,将细胞与碎片和双峰区分开来。然后根据缺乏顺铂染色来识别活细胞,顺铂染色比活细胞更大程度地标记细胞膜受损的细胞 (垂死细胞和死细胞)。免疫细胞 (CD45 + 和 CD11b + ),内皮细胞 (CD31 + )和间充质细胞 (Sca1 + )根据相应标志物的表达被排除。通过 α7 整合素和 CD9 的共表达来鉴定肌原区室。干细胞和祖细胞是通过 CD9 和 CD104 在 CD9 (y 轴) 中的差异表达来区分的 α7 个整合素 + / CD9 + 细胞的 CD104 (x 轴) 双轴点图。(B) CyTOF 标志物组摘要,显示针对细胞表面标志物、细胞内转录因子、磷酸化信号分子的抗体以及用于 DNA 染色(细胞 ID 嵌入剂-Ir)、活力染色(顺铂)和细胞增殖 (IdU) 的试剂。(C) 通过未受伤小鼠的 CD104(x 轴)双轴点图表示 CD9(y 轴),由转录因子 Pax7、Myf5、MyoD 和 MyoG 以及细胞表面标志物 CD9 和 CD104 的表达着色α7 个整合素+/CD9 + 细胞)。茎和祖细胞群中单个标志物的表达揭示了肌源性进展。 请单击此处查看此图的较大版本。

图 3:在急性损伤时间过程中解析肌肉干细胞和祖细胞的细胞和分子动力学。 (A) 在损伤时间进程(第 0 天、第 3 天、第 6 天)中,用 CD104(x 轴)表示 CD9(y 轴)生肌区室(α7 个整合素+/CD9+ 细胞)的双轴点图,由 IdU 掺入(左图)和 MyoD 表达(右图)着色。茎和祖细胞群中单个标志物的表达揭示了肌源性进展。红色箭头表示受伤后第 3 天干细胞 (SC) 群体的扩增。(B)(左)肌肉干细胞 (SC) 群体在用 CD104(x 轴)双轴图描绘 CD9(y 轴)的方案中以红色突出显示。(右)在损伤时间过程(第 0 天、第 3 天、第 6 天)中干细胞 (SC) 群体的 CD44(x 轴)双轴点图表示 CD98(y 轴),由 IdU 掺入(左图)和 MyoD 表达(右图)着色。细胞表面标志物 CD98 和 CD44 的共表达在损伤后第 3 天识别活化干细胞亚群(红色箭头),其特征是 IdU 掺入量高(左图)和 MyoD 表达增加(右图)。 请单击此处查看此图的较大版本。
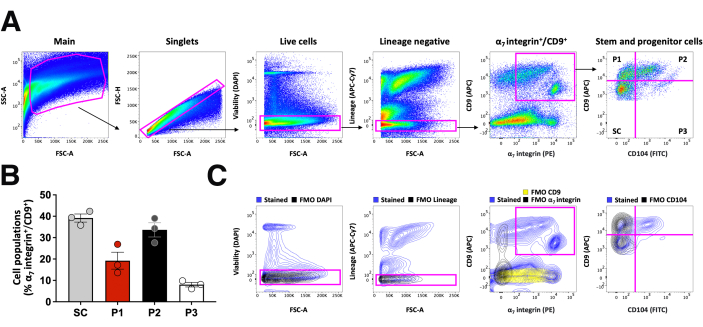
图 4:使用由细胞表面标志物 CD9 和 CD104 定义的独特策略对干细胞和祖细胞进行分选以进行下游检测。 (A) 在分选过程中用于识别干细胞和祖细胞的分层设门策略。基于 FSC 和 SSC 的主闸门不包括碎屑。基于 FSC-Area 和 FSC-Height 的单峰门用于排除双峰。谱系门用于排除免疫细胞(CD45 + 和 CD11b + )、内皮细胞 (CD31 +) 和间充质细胞 (Sca1 + ),这些细胞用与相同荧光团 APC-Cy7 偶联的抗体染色。α7 整合素+/CD9 + 门用于定义肌原区室内的细胞。根据细胞表面标志物 CD9 和 CD104 的差异表达来区分生肌区室内的干细胞和祖细胞。(B) 将干细胞和祖细胞定量为α7 个整合素+/CD9+ 细胞的分数。(C) 荧光减一 (FMO) 对照用于为分层门控策略 (A) 中的不同群体建立阳性门控。 请单击此处查看此图的较大版本。
表 1:缓冲液配方表。 缓冲液类型、内容和制备说明。 请点击此处下载此表格。
表 2:用于 CyTOF 分析的抗体和试剂。 另请参见 图 2B。用于 CyTOF 的大多数抗体都是在内部与指定的金属偶联的。 请点击此处下载此表格。
表 3:用于干细胞和祖细胞 FACS 的抗体。请点击此处下载此表格。
表 4:用于 FACS 的染色方案。 样品分为未染色、单染颜色对照 (single)、FMO 对照 (FMO) 和全染色样品。给出了当前实验中使用的抗体浓度。需要注意的是,DAPI的添加是在最终细胞重悬期间进行的。 请点击此处下载此表格。
讨论
骨骼肌再生是一个动态过程,依赖于成体干细胞的功能。虽然以前的研究集中在肌肉干细胞在再生过程中的作用,但它们在体内的后代研究不足,主要是由于缺乏识别和分离这些细胞群的工具 15,16,17,18。在这里,我们提出了一种方法,可以在骨骼肌中同时识别和分离体内的肌肉干细胞和祖细胞,并在急性肌肉损伤的背景下解决它们的细胞和分子动力学19。
这里介绍的方法将高维 CyTOF 分析与细胞分选相结合,为获得细胞状态转换如何驱动有效组织再生的机制见解提供了工具,并揭示了衰老和肌肉疾病期间干细胞功能的改变52。遗传小鼠模型中或药物干预时不同群体相对比例的变化可以提供对肌发生过程的机制见解,并阐明单个分子和下游信号通路在干细胞自我更新或分化中的作用。需要仔细评估这些变化,因为它们可能源于静止、细胞存活、从干细胞到祖细胞的进程时间的改变,或者由于分化阻断而导致一个亚群在另一个亚群上的积累,这是癌细胞的特征 53,54,55,56。CyTOF 分析的强大之处在于能够在单个细胞基础上同时检测多达 40 种不同的细胞表面和细胞内蛋白质,从而可以研究细胞周期状态、DNA 损伤和翻译后修饰等21 种。重要的是,CyTOF 分析可以轻松检测 IdU,而无需细胞内染色,这可能会影响表面抗原的检测19,20。因此,这种方法为区分干细胞功能受损伤或疾病调节的不同机制提供了机会,因为它能够通过同时基于抗体的多种蛋白质检测来研究新鲜分离的肌肉组织中的细胞功能和分子改变,例如细胞存活、细胞周期状态、细胞内信号传导和表观遗传修饰57.因此,肌肉干细胞及其后代的分子和功能分析可以在各种生物学环境或药物治疗中进行。重要的是,同时纯化干细胞和祖细胞的能力允许在体外对其特性进行深入的功能研究。
该协议包含关键步骤,应仔细规划执行这些步骤,以确保高质量的数据和结果的可重复性。为了获得可重复的结果,必须以高精度进行 Notexin 注射。此外,出于可重复性目的,重要的是使用相同批次的 notexin 并在每次实验之前测试毒素效力58。除了注射肌毒素(notexin 或心脏毒素)外,机械(离心收缩)、化学(例如氯化钡 (BaCl2))和冻结损伤 58,59,60,61,62,63,64,65 可诱导急性骨骼肌损伤。应该注意的是,BaCl2 注射不是 CyTOF 实验的理想损伤方法,因为它会在一些样品中引入高水平的钡,这可能 (i) 导致相邻通道中的信号溢出,(ii) 在 M+16 通道中产生氧化物,以及 (iii) 长期损坏 CyTOF 检测器66。肌毒性损伤通常是首选,因为它是微创的,不需要开放手术(例如,冻结损伤),并且可以应用于多块肌肉。骨骼肌解离采用机械和酶消化成单细胞悬液,也是一个关键步骤,如果不按照方案进行,可能会导致肌肉组织消化不足或过度,从而影响产量。解离过程中的关键因素是酶的纯度和活性、组织切割的程度和孵育时间18,67。
重要的是,对于 CyTOF 分析,仔细的样品制备和处理对于获得高质量数据至关重要。采用顺铂染色确定活力的染色程序对时间非常敏感,需要在 1 分钟内完成43。高质量的单细胞悬液是防止固定和下游加工过程中形成聚集体的关键。透化也是一个关键步骤,甲醇(此处使用的透化试剂)可能与本协议中未描述的细胞内蛋白的检测不兼容 19,23,68,69,70,71,72。因此,在向检测组合添加新抗体以检测细胞内蛋白时,测试几种透化试剂非常重要。
CyTOF 分析的局限性包括 (i) 无法同时分析和前瞻性分离细胞群;(ii) 需要开发和测试内部金属偶联抗体的面板,因为本协议中使用的一些抗体没有金属偶联形式的商业信息(表 2);(iii) 仪器和试剂的高成本 19,66,73。它的几个优点包括:(i) 能够同时分析多达 40 个标记物,从而能够对稀有生物样品进行深入研究;(ii) 由于使用稀土元素进行抗体偶联而导致低背景;(iii) 由于质量分辨率的高精度,通道之间的重叠最小;(iv) 通过 IdU 掺入研究细胞增殖的便利性,无需细胞内染色74。
因此,该技术提供了以此处介绍的抗体组合为基础的机会(例如,通过包含针对其他细胞内标志物的抗体),以研究干细胞和祖细胞的分子特性 20,23,75。在开发更新的 CyTOF 检测组合以检测其他表面和/或细胞内蛋白时,为了获得高质量的数据,确定抗体特异性并研究交叉反应性(可能是组织特异性的)非常重要。因此,将新型抗体添加到检测组合中需要使用阳性(例如,过表达)和阴性(例如,敲除)肌肉组织样本通过流式细胞术进行广泛测试19,76。此外,为了最大限度地提高信号并最大限度地减少信号溢出,选择高灵敏度范围 (153-176 Da) 的金属同位素来检测低丰度目标非常重要,同时考虑到应选择用于检测高丰度目标的较轻同位素可能发生氧化。最后,一旦抗体经过测试和金属偶联,就必须进行滴定以确定提供最佳信噪比的抗体浓度21,66。虽然构建 CyTOF 检测组合可能很耗时,但一旦建立,新的 CyTOF 检测组合可以提供前所未有的见解。
为了降低成本并避免对 CyTOF 仪器和内部抗体偶联的需求,CyTOF 分析的替代方案将涉及设计多个较小的市售荧光团偶联抗体面板,以较小规模进行传统流式细胞术分析。然而,这种方法不适用于分析可用性有限的珍贵样品(例如,稀有的基因敲除或转基因动物)。
在进行多参数流式细胞术或细胞分选时,关键是要包括用于建立补偿矩阵的单色对照和用于建立单个群体和/或亚群背景的 FMO 对照 77,78,79(图 4C)。除了自发荧光外,FMO 对照还表现出所有其他荧光团偶联抗体产生的背景信号,对于建立在分层门控策略中定义细胞群的阳性门至关重要。旨在纯化多个群体的分选实验应包括不重叠的门,并且应进行纯度检查以确保富集感兴趣的群体80。使用细胞表面标志物 CD9 和 CD104 对干细胞和祖细胞群进行细胞分选可用于体外对这些亚群进行深入研究,例如 (i) 响应扰动(例如,遗传操作、药物干预)的 RNA-seq 或基于蛋白质的分析;(ii) 药物筛选以确定保持干性(例如,改善再生 - 干细胞疗法)或诱导分化(例如,抑制癌细胞生长)的靶点;(iii) 功能测定(例如,离体基因操作或药物干预后的细胞移植)。
总之,这里介绍的方法结合了 CyTOF 分析和细胞分选,以实现肌肉干细胞和祖细胞响应遗传操作或药物干预的细胞和分子动力学的 体内 研究,以及旨在调查前瞻性分离的细胞群在培养中的反应的研究。这种方法可用于开发药物筛选策略,旨在识别推动细胞分化以靶向癌细胞的化合物,或增强干细胞治疗应用的干性。这样的离体平台将成为深入了解干细胞功能并开发靶向治疗干预措施的有力工具。最后,仅根据细胞表面标志物表达(CD98高/CD44高)识别和前瞻性分离响应损伤的活化干细胞群的能力,可以为以前不可行的研究打开大门,例如旨在了解干细胞恢复静止或揭示衰老中损害肌肉干细胞再生功能的分子缺陷的研究, 和肌肉疾病。
披露声明
作者声明没有利益冲突。
致谢
我们感谢奥胡斯大学生物医学系 FACS 核心设施的成员提供的技术支持。我们感谢生物医学系质谱流式细胞术部门经理 Alexander Schmitz 的讨论和支持。Scientific Illustrations 是使用 Biorender.com 创建的。这项工作由奥胡斯大学 Forskningsfond (AUFF) 启动资助和诺和诺德基金会向 EP 提供的启动包资助 (0071113)。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Fisher Scientific | 07-200-886 | |
| 20 G needle | KDM | KD-fine 900123 | |
| 28 G, 0.5 mL insulin syringe | BD | 329461 | |
| 29 G, 0.3 mL insulin syringe | BD | 324702 | |
| 3 mL syringes | Terumo medical | MDSS03SE | |
| 40 µm cell strainers | Fisher Scientific | 11587522 | |
| 5 mL polypropylene tubes | Fisher Scientific | 352002 | |
| 5 mL polystyrene test tubes with 35 µm cell strainer | Falcon | 352235 | |
| 5 mL syringes | Terumo medical | SS05LE1 | |
| 50 mL centrifuge tube | Fisher Scientific | 05-539-13 | |
| 5-Iodo-2-deoxyuridine (IdU) | Merck | I7125-5g | |
| anti-CD104 FITC (clone: 346-11A) | Biolegend | 123605 | Stock = 0.5 mg/mL |
| anti-CD11b APC-Cy7 (Clone: M1/70) | Biolegend | 101226 | Stock = 0.2 mg/mL |
| anti-CD31 APC-Cy7 (clone: 390) | Biolegend | 102440 | Stock = 0.2 mg/mL |
| anti-CD45 APC-Cy7 (Clone: 30-F11) | Biolegend | 103116 | Stock = 0.2 mg/mL |
| anti-CD9 APC (clone: KMC8) | ThermoFisher Scientific | 17-0091-82 | Stock = 0.2 mg/mL |
| anti-Sca1 (Ly6A/E) APC-Cy7 (clone: D7) | Biolegend | 108126 | Stock = 0.2 mg/mL |
| anti-α7 integrin PE (clone: R2F2)) | UBC AbLab | 67-0010-05 | Stock = 1 mg/mL |
| BD FACS Aria III (4 laser) instrument | BD Biosciences | N/A | 405, 488, 561, and 633 nm laser |
| Bovine Serum Albumin | Sigma Aldrich | A7030-50G | |
| Buprenorphine 0.3 mg/mL | Ceva | Vnr 054594 | |
| CD104 (Clone: 346-11A) | BD Biosciences | 553745 | Dy162; In-house conjugated |
| CD106/VCAM-1 (Clone: 429 MVCAM.A) | Biolegend | 105701 | Er170; In-house conjugated |
| CD11b (Clone: M1/70) | BD Biosciences | 553308 | Nd148; In-house conjugated |
| CD29/Integrin β1 (Clone: 9EG7) | BD Biosciences | 553715 | Tm169; In-house conjugated |
| CD31 (Clone: MEC 13.3) | BD Biosciences | 557355 | Sm154; In-house conjugated |
| CD34 (Clone: RAM34) | BD Biosciences | 551387 | Lu175; In-house conjugated |
| CD44 (Clone: IM7) | BD Biosciences | 550538 | Yb171; In-house conjugated |
| CD45 (Clone: MEC 30-F11) | BD Biosciences | 550539 | Sm147; In-house conjugated |
| CD9 (Clone: KMC8) | Thermo Fisher Scientific | 14-0091-85 | Yb174; In-house conjugated |
| CD90.2/Thy1.2 (Clone: 30-H12) | BD Biosciences | 553009 | Nd144; In-house conjugated |
| CD98 (Clone: H202-141) | BD Biosciences | 557479 | Pr141; In-house conjugated |
| Cell Acquisition Solution/Maxpar CAS-buffer | Standard Biotools | 201240 | |
| Cell-ID Intercalator-Iridium | Standard Biotools | 201192B | cationic nucleic acid intercalator |
| Cisplatin | Merck | P4394 | Pt195 |
| Cisplatin (cis-Diammineplatinum(II) dichloride) | Merck | P4394 | |
| Clear 1.5 mL tube | Fisher Scientific | 11926955 | |
| Collagenase, Type II | Worthington Biochemical Corporation | LS004177 | |
| Counting chamber | Merck | BR718620-1EA | |
| CXCR4/SDF1 (Clone: 2B11/CXCR4 ) | BD Biosciences | 551852 | Gd158; In-house conjugated |
| DAPI (1 mg/mL) | BD Biosciences | 564907 | |
| Dark 1.5 mL tube | Fisher Scientific | 15386548 | |
| Dispase II | Thermo Fisher Scientific | 17105041 | |
| Dissection Scissors | Fine Science Tools | 14568-09 | |
| DMEM (low glucose, with pyruvate) | Thermo Fisher Scientific | 11885-092 | |
| EDTA (Ethylenediaminetetraacetic acid disodium salt) | Merck | E5134 | Na2EDTA-2H20 |
| EQ Four Element Calibration Beads (EQ beads) | Standard Biotools | 201078 | Calibration beads |
| Fetal Bovine Serum, qualified, Brazil origin | Thermo Fisher Scientific | 10270106 | |
| Forceps Dumont #5SF | Fine Science Tools | 11252-00 | |
| Forceps Dumont #7 | Hounisen.com | 1606.3350 | |
| Goat serum | Thermo Fisher Scientific | 16210-072 | |
| Helios CyTOF system | Standard Biotools | N/A | |
| Horse Serum, heat inactivated, New Zealand origin | Thermo Fisher Scientific | 26-050-088 | |
| IdU | Merck | I7125 | I127 |
| Iridium-Intercalator | Standard Biotools | 201240 | Ir191/193 |
| Isoflurane/Attane Vet | ScanVet | Vnr 055226 | |
| Methanol | Fisher Scientific | M/3900/17 | |
| Myf5 (Clone: C-20) | Santa Cruz Biotechnology | Sc-302 | Yb173; In-house conjugated |
| MyoD (Clone: 5.8A) | BD Biosciences | 554130 | Dy164; In-house conjugated |
| MyoG (Clone: F5D) | BD Biosciences | 556358 | Gd160; In-house conjugated |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top 0.20 μM PES Filters | Thermo Fisher Scientific | 595-4520 | |
| Notexin | Latoxan | L8104 | Resuspend to 50 µg/ml in sterile PBS. Keep stocks (e.g. 50 µl) at -20 °C |
| Nutrient mixture F-10 (Ham's) | Thermo Fisher Scientific | 31550031 | |
| pAkt (Clone: D9E) | Standard Biotools | 3152005A | Sm152 |
| Pax7 (Clone: PAX7) | Santa Cruz Biotechnology | Sc-81648 | Eu153; In-house conjugated |
| Penicillin-Streptomycin (10,000 U/mL) (Pen/Strep) | Thermo Fisher Scientific | 15140122 | |
| PES Filter Units 0.20 μM | Fisher Scientific | 15913307 | |
| PES Syringe Filter | Fisher Scientific | 15206869 | |
| Petri dish | Sarstedt | 82.1472.001 | |
| PFA 16% EM grade | MP Biomedicals | 219998320 | |
| Potassium chloride (KCl) | Fisher Scientific | 10375810 | |
| Potassium phosphate, monobasic, anhydrous (KH2PO4) | Fisher Scientific | 10573181 | |
| pRb (Clone: J112-906) | Standard Biotools | 3166011A | Er166 |
| pS6 kinase (Clone: N7-548) | Standard Biotools | 3172008A | Yb172 |
| Sca-1 (Clone: E13-161.7) | BD Biosciences | 553333 | Nd142; In-house conjugated |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | 10553515 | |
| Sodium phosphate, dibasic, heptahydrate (Na2HPO4-6H2O) | Merck | S9390 | |
| Sterile saline solution 0.9% | Fresenius | B306414/02 | |
| α7 integrin (Clone: 3C12) | MBL international | K0046-3 | Ho165; In-house conjugated |
参考文献
- Mukund, K., Subramaniam, S. Skeletal muscle: A review of molecular structure and function in health and disease. Wiley Interdiscip Rev Syst Biol Med. 12 (1), e1462 (2020).
- Feige, P., Brun, C. E., Ritso, M., Rudnicki, M. A. Orienting muscle stem cells for regeneration in homeostasis, aging, and disease. Cell Stem Cell. 23 (5), 653-664 (2018).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9 (2), 493-495 (1961).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Fuchs, E., Blau, H. M. Tissue stem cells: Architects of their niches. Cell Stem Cell. 27 (4), 532-556 (2020).
- Hernández-hernández, J. M., et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Semin Cell Dev Biol. 72, 10-18 (2017).
- Zammit, P. S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis. Semin Cell Dev Biol. 72, 19-32 (2017).
- Sabourin, L. A. The molecular regulation of myogenesis. Clin Genet. 57 (1), 16-25 (2000).
- Cooper, R. N., et al. In vivo satellite cell activation via Myf5 and MyoD in regenerating mouse skeletal muscle. J Cell Sci. 112 (17), 2895-2901 (1999).
- Rudnicki, M. A., Jaenisch, R. The MyoD family of transcription factors and skeletal myogenesis. Bioessays. 17 (3), 203-209 (1995).
- Braun, T., Arnold, H. H. Inactivation of Myf-6 and Myf-5 genes in mice leads to alterations in skeletal muscle development. EMBO J. 14 (6), 1176-1186 (1995).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Braun, T., et al. MyoD expression marks the onset of skeletal myogenesis in Myf-5 mutant mice. Development. 120 (11), 3083-3092 (1994).
- Rudnicki, M. A., et al. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell. 75 (7), 1351-1359 (1993).
- Montarras, D., et al. Developmental biology: Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Cerletti, M., et al. Highly efficient, functional engraftment of skeletal muscle stem cells in dystrophic muscles. Cell. 134 (1), 37-47 (2008).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Porpiglia, E., et al. High-resolution myogenic lineage mapping by single-cell mass cytometry. Nat Cell Biol. 19 (5), 558-567 (2017).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry Part A. 81 (7), 552-566 (2012).
- Hartmann, F. J., et al. . Mass Cytometry: Methods and Protocols. , (2019).
- Devine, R. D., Behbehani, G. K. Use of the pyrimidine analog, 5-iodo-2'-deoxyuridine (IdU) with cell cycle markers to establish cell cycle phases in a mass cytometry platform. J Vis Exp. (176), e60556 (2021).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Nag, A. C., Foster, J. D. Myogenesis in adult mammalian skeletal muscle in vitro. J Anat. 132, 1-18 (1981).
- Le Moigne, A., et al. Characterization of myogenesis from adult satellite cells cultured in vitro). Int J Dev Biol. 34, 171-180 (1990).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Chu, C., Cogswell, J., Kohtz, D. S. MyoD functions as a transcriptional repressor in proliferating myoblasts. J Biol Chem. 272 (6), 3145-3148 (1997).
- Shah, B., Hyde-Dunn, J., Jones, G. E. Proliferation of murine myoblasts as measured by bromodeoxyuridine incorporation. Methods in Mol Biol. 75, 349-355 (1997).
- Springer, M. L., Blau, H. M. High-efficiency retroviral infection of primary myoblasts. Somat Cell Mol Genet. 23 (3), 203-209 (1997).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J Cell Biol. 125 (6), 1275-1287 (1994).
- Springer, M. L., Rando, T. A., Blau, H. M. Gene delivery to muscle. Curr Protoc Hum Genet. , (2002).
- Cull-Candy, S. G., Fohlman, J., Gustavsson, D., Lullmann-Rauch, R., Thesleff, S. The effects of taipoxin and notexin on the function and fine structure of the murine neuromuscular junction. Neuroscience. 1 (3), 175-180 (1976).
- Francis, B., John, T. R., Seebart, C., Kaiser, I. I. New toxins from the venom of the common tiger snake (Notechis scutatus scutatus). Toxicon. 29 (1), 85-96 (1991).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse Anesthesia: The Art and Science. ILAR Journal. 62, 238-273 (2021).
- Langford, D., Bailey, A., Chanda, M., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447-449 (2010).
- Matsumiya, L. C., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wieskopf, J. S., Zaloum, A., King, O. D., Mogil, J. S. Using the Mouse Grimace Scale to reevaluate the efficacy of postoperative analgesics in laboratory mice. J Am Assoc Lab Anim Sci. 2012 (1), 42-49 (2012).
- Gonzalez, V. D., et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep. 36 (9), 109632 (2021).
- Delgado-Gonzalez, A., et al. Measuring trogocytosis between ovarian tumor and natural killer cells. STAR Protoc. 3 (2), 101425 (2022).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry Part A. 83 (5), 483-494 (2013).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. J Vis Exp. (69), e4398 (2012).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample preparation for mass cytometry analysis. J Vis Exp. (122), e54394 (2017).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Curr Protoc Cytom. , (2010).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry Part A. 81 (6), 467-475 (2012).
- Kimball, A. K., et al. A beginner's guide to analyzing and visualizing mass cytometry data. J Immunol. 200 (1), 3-22 (2018).
- Weber, L. M., Robinson, M. D. Comparison of clustering methods for high-dimensional single-cell flow and mass cytometry data. Cytometry Part A. 89 (12), 1084-1096 (2016).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nat Methods. 13 (6), 493-496 (2016).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Anal Chem. 80 (7), 2539-2547 (2008).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nat Commun. 12 (1), 692 (2021).
- de Morree, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proc Natl Acad Sci U S A. 114 (43), E8996-E9005 (2017).
- Luo, D., et al. Deltex2 represses MyoD expression and inhibits myogenic differentiation by acting as a negative regulator of Jmjd1c. Proc Natl Acad Sci U S A. 114 (15), E3071-E3080 (2017).
- Wersto, R. P., et al. Doublet discrimination in DNA cell-cycle analysis. Cytometry. 46 (5), 296-306 (2001).
- Porpiglia, E., Blau, H. M. Plasticity of muscle stem cells in homeostasis and aging. Curr Opin Genet Dev. 77, 101999 (2022).
- Porpiglia, E., et al. Elevated CD47 is a hallmark of dysfunctional aged muscle stem cells that can be targeted to augment regeneration. Cell Stem Cell. 29 (12), 1653-1668 (2022).
- Brunet, A., Goodell, M. A., Rando, T. A. Ageing and rejuvenation of tissue stem cells and their niches. Nat Rev Mol Cell Biol. 24 (1), 45-62 (2022).
- Danielli, S. G., et al. Single-cell profiling of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance. Sci Adv. 9 (6), (2023).
- de Morree, A., Rando, T. A. Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24 (5), 334-354 (2023).
- Yucel, N., et al. Glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell function. Cell Rep. 27 (13), 3939-3955 (2019).
- Tierney, M. T., Sacco, A. Inducing and evaluating skeletal muscle injury by notexin and barium chloride. Methods Mol Biol. 1460, 53-60 (2016).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198 (2016).
- Call, J. A., Lowe, D. A. Eccentric contraction-induced muscle injury: Reproducible, quantitative, physiological models to impair skeletal muscle's capacity to generate force. Methods Mol Biol. 1460, 3-18 (2016).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin Induced Injury and Skeletal Muscle Regeneration. Methods Mol Biol. 1460, 61-71 (2016).
- Le, G., Lowe, D. A., Kyba, M. Freeze injury of the tibialis anterior muscle. Methods Mol Biol. 1460, 33-41 (2016).
- Borok, M., et al. Progressive and coordinated mobilization of the skeletal muscle niche throughout tissue repair revealed by single-cell proteomic analysis. Cells. 10 (4), 744 (2021).
- Petrilli, L. L., et al. High-dimensional single-cell quantitative profiling of skeletal muscle cell population dynamics during regeneration. Cells. 9 (7), 1723 (2020).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Mol Cell. 74 (3), 609-621 (2019).
- Hartmann, F. J., et al. Scalable conjugation and characterization of immunoglobulins with stable mass isotope reporters for single-cell mass cytometry analysis. Methods Mol Biol. 1989, 55-81 (2019).
- Frimand, Z., Das Barman, S., Kjær, T. R., Porpiglia, E., de Morrée, A. Isolation of quiescent stem cell populations from individual skeletal muscles. J Vis Exp. (190), e64557 (2022).
- Krutzik, P. O., Nolan, G. P. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events. Cytometry A. 55 (2), 61-70 (2003).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol. 30 (9), 858-867 (2012).
- Schulz, K. R., Danna, E. A., Krutzik, P. O., Nolan, G. P. Single-cell phospho-protein analysis by flow cytometry. Curr Protoc Immunol. , 11-20 (2012).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. J Immunol. 175 (4), 2357-2365 (2005).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Han, G., Spitzer, M. H., Bendall, S. C., Fantl, W. J., Nolan, G. P. Metal-isotope-tagged monoclonal antibodies for high-dimensional mass cytometry. Nat Protoc. 13 (10), 2121-2148 (2018).
- Chevrier, S., et al. Compensation of signal spillover in suspension and imaging mass cytometry. Cell Syst. 6 (5), 612-620 (2018).
- Bjornson, Z. B., Nolan, G. P., Fantl, W. J. Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol. 25 (4), 484-494 (2013).
- Kalina, T., Lundsten, K., Engel, P. Relevance of antibody validation for flow cytometry. Cytometry A. 97 (2), 126-136 (2020).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J Immunol Methods. 243 (1-2), 77-97 (2000).
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110 (3), 277-283 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。