Method Article
一种新生儿BALB/c坏死性小肠结肠炎小鼠模型
Erratum Notice
摘要
坏死性小肠结肠炎 (NEC) 是最严重的胃肠道 (GI) 疾病,常发生于早产儿,尤其是出生体重极低的婴儿,死亡率高且发病机制不明。NEC的病因可能与炎症性免疫调节系统异常有关。NEC动物模型是NEC疾病免疫研究不可或缺的工具。NEC动物模型通常使用C57BL / 6J新生小鼠;BALB / c新生小鼠很少使用。相关研究表明,当小鼠被感染时,与C57BL / 6J小鼠相比,BalB / c小鼠的Th2细胞分化占主导地位。研究表明,NEC的发生和发展与T辅助2型(Th2)细胞的增加有关,并且通常伴有感染。因此,本研究使用新生BALB / c小鼠诱导NEC模型,其临床特征和肠道病理变化与NEC患儿相似的NEC模型。需要进一步的研究来确定该动物模型是否可用于研究NEC中的Th2细胞反应。
摘要
坏死性小肠结肠炎 (NEC) 是最严重的胃肠道 (GI) 疾病,常发生于早产儿,尤其是出生体重极低的婴儿,死亡率高且发病机制不明。NEC的病因可能与炎症性免疫调节系统异常有关。NEC动物模型是NEC疾病免疫研究不可或缺的工具。NEC动物模型通常使用C57BL / 6J新生小鼠;BALB / c新生小鼠很少使用。相关研究表明,当小鼠被感染时,与C57BL / 6J小鼠相比,BalB / c小鼠的Th2细胞分化占主导地位。研究表明,NEC的发生和发展与T辅助2型(Th2)细胞的增加有关,并且通常伴有感染。因此,本研究使用新生BALB / c小鼠诱导NEC模型,其临床特征和肠道病理变化与NEC患儿相似的NEC模型。需要进一步的研究来确定该动物模型是否可用于研究NEC中的Th2细胞反应。
引言
坏死性小肠结肠炎 (NEC) 是最严重的胃肠道 (GI) 疾病,见于大多数早产儿 (>90%),尤其是出生体重极低 (VLBW) 的早产儿 1。在VLBW婴儿中,该疾病的发病率范围为10%至12%,被诊断患有NEC的儿童的死亡率在20%至30%之间2,3。NEC的病因可能与黏膜损伤、致病菌侵袭和肠道进食有关,可导致易感宿主出现炎症反应和肠道损伤诱导3。NEC的发病机制尚不清楚。相关研究表明,患儿的免疫反应异常,遗传易感性、微血管张力、肠道细菌变化可能在疾病中发挥重要作用3。
NEC动物模型是NEC发病机制研究不可或缺的工具。用于NEC模型的动物种类是猪,大鼠和小鼠。然而,由于妊娠期长、生长周期长、成本高,近年来,猪一直不是NEC模型的首选,已被大鼠或小鼠取代4。由于不同小鼠品系的免疫背景存在差异5,不同的研究需要使用不同的小鼠品系来建立NEC动物模型。BALB / C小鼠具有重要特征;当它们被感染或应对外部损伤时,小鼠感染期间TH2细胞的极化明显强于其他小鼠品系6,7,8。T辅助细胞在NEC的发生和进展中起着至关重要的作用,特别是TH2细胞的发育3,9,10,11。因此,本研究使用BALB/ c小鼠建立了NEC模型,这可能对T细胞的NEC疾病研究有所帮助。
研究方案
本研究获得广州市妇女儿童医学中心医学伦理委员会(编号:174A01)和广州恒源生物科学实验动物中心动物伦理委员会(IACUC-G160100)的批准。所有动物都在同一房间内在特定的无病原体(SPF)环境中繁殖,并在常规环境中进行实验。用于繁殖的小鼠年龄为7-8周龄;第4天将诱导NEC(n = 72)的小鼠与大坝分离,将大坝(n = 14)保存在原始笼中并护理对照(Cont.)组小鼠(n = 24)。
1. 试剂和设备的制备
- 以相应的比例制备BALB / c小鼠的牛奶替代品(早产儿奶粉:山羊奶粉= 2:1)。
注:配方奶的最终营养成分12 如 表1所示。 - LPS溶液(2.5毫克/毫升)
- 将总共10mgLPS粉末溶解在4mL无菌双蒸馏水中,充分混合,并在等分后储存在-20°C的冰箱中。
注意:LPS溶液在2-8°C的黑暗中储存以立即使用,或在-20°C下长期储存。
- 将总共10mgLPS粉末溶解在4mL无菌双蒸馏水中,充分混合,并在等分后储存在-20°C的冰箱中。
2.诱导新生儿BALB / c小鼠坏死性小肠结肠炎
- 喂养新生小鼠。
- 将新生小鼠与大坝放在同一个笼子里,在第0-4天由大坝喂养。
- 在第4天的晚上(当新生小鼠称重2.5-3g时),将NEC组中的新生小鼠从大坝中分离出来诱导NEC,将它们保存在动物培养箱中,并用配方奶粉喂养它们。但是,Cont.组被允许留在大坝上并由大坝喂养。
注意:与大坝分离的新生小鼠必须在培养箱中饲养,因为它们的体温调节较弱。
- 将强饲管浸泡在75%酒精容器中1-2分钟,然后在干净的双蒸馏水中洗涤两次,以准备强饲管。
注意:为了避免小鼠之间的交叉污染,必须在喂食每只小鼠后进行上述过程。 - 诱导 NEC 模型。
- 第4天将新生小鼠从大坝中取出,禁食一晚。
- 用LPS(一次20-30μL)饲化小鼠,并在第5天用配方奶粉喂养它们(一次40-50μL)。
- 从第5天开始,将小鼠置于缺氧 - 再氧 - 冷 - 休克循环中,每天两次,持续5天。将小鼠置于5%O2 的缺氧装置中90秒,然后重新氧合3分钟;重复此过程五次。接下来,将小鼠置于4°C环境中15分钟,然后将其转移到培养箱中。感应过程见 图1A、B 。
注意:缺氧 - 再氧合 - 冷刺激的循环在早上进行一次,下午进行一次。在容器中制备5%O2 和95%N2 的混合物,并用氧检测器测量浓度。
- 密切观察所有小鼠,每天称量,记录诱导期间小鼠的存活情况,并记录粪便特征(有或没有粘性粪便/血便)。
注:已建立的 NEC 型号持续 5 天。 - 在第10天或更早的时候,当小鼠表现出NEC症状(肠梗阻,便血,腹泻)13时,通过用异氟醚吸入麻醉对小鼠实施安乐死,然后立即收集肠道组织。不要从自发死亡的小鼠身上收集组织。
注意:在这项研究中,当小鼠显示全身的便血和发绀时,小鼠安乐死的终点是合适的。
3. 加瓦老鼠
- 固定鼠标头,右手握住胃管。从小鼠嘴的左角插入胃管。
注意:将头部用食指固定在鼠标头上,并轻轻地向后和向下按压,以防止鼠标在操作过程中向前弯曲并影响胃管的插入。 - 慢慢地将管子移动到嘴的中心。将试管插入约2-3厘米后,将40-50μL配方奶粉或20-30μLLPS推入消化道。有关强饲,请参见 图2A,B 。
注意:一般情况下,胃管顺利插入消化道。如果小鼠具有很强的呕吐反射,则胃管被错误地插入气管。必须轻轻地将胃管拔出,让鼠标休息一段时间,然后再尝试强饲。此外,强饲程序用于在小鼠安乐死之前诱导NEC模型。
4. 收集新鲜肠道组织标本进行苏木精和曙红(H&E)染色
- 将来自小鼠的新鲜回肠组织浸入10%福尔马林中24小时。
- 将组织嵌入石蜡中,并将其切成4μm切片。
- 在二甲苯中解蜡化切片,然后依次在无水乙醇,95%乙醇,80%乙醇,70%乙醇和蒸馏水中再水化,每步浸泡5分钟。用苏木精溶液染色切片5分钟,并在75%酒精中的1%盐酸中区分它们5秒。最后,用曙红溶液染色1分钟。
注意:用苏木精溶液染色后,必须用乙醇中的1%盐酸分化,以除去过度结合的苏木素溶液和细胞质苏木素染料。1%盐酸的浓度适用于肠道组织。 - 以40倍放大镜检查肠道组织的组织病理学。
结果
BALB/c小鼠NEC模型由配方奶粉喂养、LPS喂养、缺氧和冷刺激诱导。在诱导期间,观察小鼠的肠道病理学,粪便特征,体重变化和每日生存率。NEC诱导期间小肠的代表性图像;图片中的数字表示肠道病理学评分从0(正常上皮)到4(最严重)(图3A)。NEC组的肠道病理学评分显著高于Cont.组(图3B)。图片中的数字表示从0(形成良好的颗粒)到3(液体粪便)的粪便评分(图3C)。第10天,NEC组的粪便评分在NEC组中显着较高,表明NEC组的肠功能障碍更严重(图3D)。在NEC模型诱导的第5天,两组之间的体型差异不显著。然而,在第10天,NEC组中的小鼠比Cont.组中的小鼠从头到尾明显更薄,更小(图4A)。
在建立模型的5天内,NEC组小鼠的体重缓慢增加甚至呈负增长,与Cont.组相比,NEC组小鼠的存活率逐渐下降(图4B,C)。此外,另一批小鼠用于诱导NEC模型,但不收集组织;到第13天,该NEC组的所有小鼠都已死亡,存活曲线显着降低(补充图S1)。 图5A 显示了该医院NEC患者切除的肠组织回盲区的形态和病理结果(肠粘膜组织坏死)。在这项研究中,NEC组(1/13)中的小鼠发生了回盲出血和坏死(图5B)。

图1:BALB / c NEC模型过程的诱导(A)NEC组中的小鼠在出生时与大坝分离,直到它们4天大(第4天)并在当晚禁食。NEC模型从出生后第5天开始诱导,持续5天。在第10天或更早收集肠组织标本。Cont.组中的小鼠被安置在大坝上并由大坝喂养。(B)诱导NEC模型后每天的操作顺序。缩写: 续 = 控制;NEC =坏死性小肠结肠炎;LPS = 脂多糖。请点击此处查看此图的放大版本。

图2:胃饲饲。 (A)本研究使用了专门的强饲装置,该装置与塑料管和注射器相结合。(B)强饲管从嘴角以45°角进入垂直线。(C)将管子缓慢移动到小鼠嘴的中心,以确保胃管和食道处于相同的垂直水平。缩写:D=直径。 请点击此处查看此图的放大版本。

图3:BALB / c小鼠NEC模型(A)两组肠道病理学评分的显微照片,例如,在Cont.组中显示完整和正常的粘膜(评分0),两组轻度粘膜下或皮层固有肿胀分离(评分1),NEC组中中度粘膜下和/或层固有分离(评分2),NEC组中重度粘膜下和/或层固有分离(评分3), NEC组肠绒毛消失伴肠坏死(评分4)。(B)NEC诱导后小鼠的肠道病理学评分高于Cont.组(Cont.组n = 9,NEC组n = 35,*** P <0.001与学生t检验)。(C)两组粪便评分的显微照片,例如,显示Cont.组(评分0),两组形成的粪便(评分1),NEC组的半形粪便(评分2)和NEC组的液体粪便(评分3)。(D)NEC组的粪便评分明显高于Cont.组(Cont.组n = 6,NEC组n = 13,*** P <0.001,学生t检验)。红色三角形代表粘膜和固有层的分离,黑色箭头指向小鼠粪便。比例尺 = 50 μm. 缩写: 续 = 控制;NEC =坏死性小肠结肠炎;HE = 苏木精和曙红。请点击此处查看此图的放大版本。

图4:Cont.组和NEC组之间小鼠体型和存活率的比较 (A)第5天和第10天两组小鼠的出现。(B)本节显示了两组小鼠随时间变化的体重变化;x轴代表小鼠出生后的天数,y轴代表小鼠的体重变化;**P < 0.01, ***P < 0.001 与学生 t 检验进行比较,以比较 Cont. 组 (n = 10) 和 NEC 组 (n = 27) (C) 本节显示了对照组 (n = 10) 和 NEC 组 (n = 25) 中小鼠的生存曲线。缩写: 续 = 控制;NEC = 坏死性小肠结肠炎。 请点击此处查看此图的放大版本。
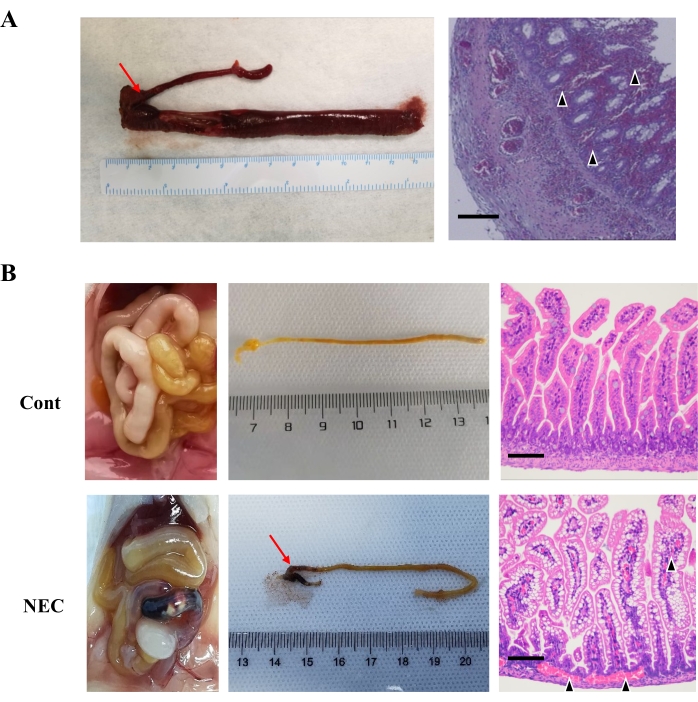
图5:NEC患儿和NEC小鼠 的回盲出血(A)NEC患儿回盲区出血和坏死。(B)NEC小鼠回盲区出血和坏死(1/13);然而,Cont.组中小鼠的肠道正常,没有出血和坏死。黑色三角形是指肠道出血和坏死,红色箭头表示回盲区的出血和坏死。比例尺 = 50 μm. 缩写: 续 = 控制;NEC = 坏死性小肠结肠炎。 请点击此处查看此图的放大版本。
| 组成 | 鼠标(克/升) | 牛奶替代品(克/升) |
| 蛋白 | 69-118 | 100 |
| 脂肪 | 93-175 | 100 |
| 碳水化合物 | 28-37 | 50 |
| 钙 | 0.97-6.2 | 2.84 |
| 磷 | 1.6-2.72 | 1.62 |
| 钠 | 0.66-1.4 | 1 |
| 钾 | 1.08-1.7 | 1.2 |
| 氯化物 | 1.17-1.76 | 1.76 |
| 镁 | 0.0001-0.3 | >0.12 |
| 锌 | 0.009-0.055 | 0.018 |
| 铁 | 0.004-0.007 | 0.017 |
| 铜 | 0.0017-0.007 | 0.0018 |
表 1: 乳制品配方奶粉配料。
补充图S1: NEC组的生存曲线显着降低,因此所有小鼠都自发死亡(Cont.组n = 5,NEC组n = 10)。缩写: 续 = 控制;NEC = 坏死性小肠结肠炎。 请点击此处下载此文件。
讨论
NEC是新生儿最常见的胃肠道系统急症,发病率和死亡率高,尤其是早产儿1,2,3。然而,其发病机制尚不清楚。目前认为,黏膜损伤、病原体侵袭和肠内喂养是 NEC3 的高危因素。迄今为止,用于NEC模型的动物主要是猪,大鼠和小鼠。大多数研究使用新生儿C57BL / 6小鼠诱导NEC13,14,15,16,很少有研究使用BALB / c新生小鼠诱导NEC。然而,BALB / c小鼠具有Th细胞极化6,7,8的优势,这需要进一步研究以确定它们是否可以成为Th细胞研究该疾病的良好NEC模型。
我们参考了NEC model17 的纳德勒病理评分标准,发现NEC组的评分明显高于对照组。得分≥2表示NEC,诱导NEC的成功率为38-50%,低于Caplan等人研究中NEC建模成功率的77%(DOI:10.3109/15513819409037698)。我们还评估了两组小鼠的粪便评分18 ,发现NEC组的评分高于对照组。分数越高,肠道功能障碍越严重。所有这些数据表明,NEC模型的建立是成功的。此外,令人鼓舞的是,NEC的新生儿BALB/c小鼠模型可以在一定程度上模拟人类NEC。出血和坏死发生在NEC3,19的儿童的肠道中;在该模型中观察到类似的病理状况。
饲化是诱导小鼠模型中NEC的关键步骤。如果不能熟练掌握强饲手术,很容易错误地将胃管放入气管并导致小鼠死亡。在胃强饲过程中,使用左拇指,中指和无名指夹住小鼠躯干的两侧,并将食指放在头上以将鼠标固定到位。这是为了防止小鼠四处移动并导致胃管损坏食道。胃管从小鼠嘴的左角插入。只有当胃管顺利进入食道而没有阻力时,我们才能继续插入它。LPS或配方奶粉只有在将胃管插入距小鼠下唇2-3厘米后才应注射。
应仔细监测缺氧的长度。在这项研究中,缺氧每次持续90秒。如果缺氧时间过长,小鼠将无法忍受它并会死亡。该模型可用于研究NEC相关的免疫细胞,特别是TH1和TH2细胞3,9,10,11,20。在未来,我们计划研究该模型是否有助于研究NEC中的Th2细胞反应。此外,这项研究还引入了一种新的粪便评分方法,以评估NEC18小鼠的肠道功能障碍。但是,本研究存在一些局限性。例如,该模型的成功率不是很高。如前所述,正在努力改进BALB / c NEC建模方法,通过将缺氧水平从5%O2 调整为1%O2来提高成功率15。
披露声明
作者没有利益冲突需要披露。
致谢
作者感谢广州市妇幼医学中心临床生物资源库提供的临床样本,感谢广州恒源生物科学实验动物中心提供的小鼠。本研究得到了中国国家自然科学基金81770510(R.Z.)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Sinopharm Chemical Reagent Co., LTD. | 100092683 | |
| Goat Milk powder | Petag | 71795558417 | |
| HE dye solution | Sinopharm Chemical Reagent Co., LTD. | G1003 | |
| Isoflurane | RWD, Shenzhen Reward Life Technology Co., LTD. | R510 | |
| LPS | Sigma-Adrich | L2880 | |
| Medical oxygen | various | various | |
| Microscope | NIKON | NIKON imaging system (DS-Ri2) | |
| Neutral resin | Sinopharm Chemical Reagent Co., LTD. | 10004160 | |
| Paraffin | various | various | |
| Premature baby milk powder | Abbott | 57430 | |
| Xylene | Sinopharm Chemical Reagent Co., LTD. | 10023418 | |
| 1% Hydrochloric acid | various | various | |
| 10% Formalin | LEAGENE | DF0110 |
参考文献
- Horbar, J. D., et al. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 129 (6), 1019-1026 (2012).
- Stoll, B. J., et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 126 (3), 443-456 (2010).
- Neu, J., Walker, W. A. Necrotizing enterocolitis. New England Journal of Medicine. 364 (3), 255-264 (2011).
- Sangild, P. T., et al. Invited Review: The preterm pig as a model in pediatric gastroenterology. Journal of Animal Science. 91 (10), 4713-4729 (2013).
- Cancro, M. P., Sigal, N. H., Klinman, N. R. Differential expression of an equivalent clonotype among BALB/c and C57BL/6 mice. Journal of Experimental Medicine. 147 (1), 1-12 (1978).
- Kuroda, E., Yamashita, U. Mechanisms of enhanced macrophage-mediated prostaglandin E2 production and its suppressive role in Th1 activation in Th2-dominant BALB/c mice. Journal of Immunology. 170 (2), 757-764 (2003).
- Fornefett, J., et al. Comparative analysis of clinics, pathologies and immune responses in BALB/c and C57BL/6 mice infected with Streptobacillus moniliformis. Microbes and Infection. 20 (2), 101-110 (2018).
- Rosas, L. E., et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. International Immunology. 17 (10), 1347-1357 (2005).
- Sproat, T., Payne, R. P., Embleton, N. D., Berrington, J., Hambleton, S. T cells in preterm infants and the influence of milk diet. Frontiers in Immunology. 11, 1035 (2020).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: an immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Afrazi, A., et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond. Pediatric Research. 69 (3), 183-188 (2011).
- Auestad, N., Korsak, R. A., Bergstrom, J. D., Edmond, J. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat. British Journal of Nutrition. 61 (3), 495-518 (1989).
- Liu, Y., et al. Lactoferrin-induced myeloid-derived suppressor cell therapy attenuates pathologic inflammatory conditions in newborn mice. Journal of Clinical Investigation. 129 (10), 4261-4275 (2019).
- MohanKumar, K., et al. A murine neonatal model of necrotizing enterocolitis caused by anemia and red blood cell transfusions. Nature Communications. 10 (1), 3494 (2019).
- He, Y. M., et al. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nature Medicine. 24 (2), 224-231 (2018).
- Cho, S. X., et al. Characterization of the pathoimmunology of necrotizing enterocolitis reveals novel therapeutic opportunities. Nature Communications. 11 (1), 5794 (2020).
- Halpern, M. D., et al. Decreased development of necrotizing enterocolitis in IL-18-deficient mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 294 (1), 20-26 (2007).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Nino, D. F., Sodhi, C. P., Hackam, D. J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nature Reviews. Gastroenterology & Hepatology. 13 (10), 590-600 (2016).
- Chuang, S. L., et al. Cow's milk protein-specific T-helper type I/II cytokine responses in infants with necrotizing enterocolitis. Pediatric Allergy & Immunology. 20 (1), 45-52 (2009).
Erratum
Formal Correction: Erratum: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis
Posted by JoVE Editors on 3/07/2022. Citeable Link.
An erratum was issued for: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis. The Representative Results section was updated.
Figure 1 was updated from:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
to:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。