Method Article
定量实时反转录 PCR 技术对猕猴猴血浆 MicroRNA 水平的绝对量化
摘要
本报告描述了一种测量血浆 miRNA 绝对水平的协议, 使用定量的实时反向转录 PCR 或不预放大。该议定书对血浆 miRNAs 的数量有了更好的了解, 并允许对来自不同研究或实验室的相应数据进行定性评估。
摘要
qPCR 是评估个体目标 miRNAs 的最常用方法之一。MiRNAs 水平通常是相对于参考样本进行测量的。这种方法适用于检查目标基因表达水平的生理变化。然而, 使用更好的统计分析进行绝对量化, 对基因表达水平的综合评估是可取的。绝对量化仍然没有共同使用。本报告描述了一种用于测量血浆 miRNA 绝对水平的协议, 使用的是带有或不具有预放大的 qPCR。
从有意识猕猴猴股静脉收集的血液中制备了一定量 (200 µL) EDTA 血浆 (n = 50)。利用商用系统提取总 RNA。以探针为基础的 qPCR 检测方法对血浆 miRNAs 进行量化, 其中含有 miRNA 特异的正向/反向 PCR 底漆和探针。利用商用合成 RNA 寡核苷酸生成绝对量化的标准曲线。合成 cel-miR-238 被用作标准化和质量评估的外部控制。在 qPCR 步骤之前, 显示量化周期 (miRNAs) 值超过35的数据是预放大的。
在检查的 8 miRNAs 中, miR-122、miR-133a 和 miR-192 没有预放大, 而 miR-1、miR-206 和 miR-499a 需要预放大, 因为它们的表达水平较低。MiR-208a 和 miR-208b 在预扩后都无法检测到。用尖刺 cel-miR-238 的取值评价样品的加工效率。在这种检测方法中, 技术变异估计小于3倍, 量化的下限 (LLOQ) 为 102拷贝/µL, 对于大多数被检查的 miRNAs。
该协议提供了一个更好的估计血浆 miRNAs 的数量, 并允许质量评估的相应数据从不同的研究。考虑到体液中 miRNAs 的数量较少, 预扩有助于提高对表达不良 miRNAs 的检测。
引言
越来越多的研究一直在探索 microRNAs (miRNAs) 作为癌症诊断和预后的标志物, 或监测和检测其他疾病的有意和临床研究1,2,3.定量实时反向转录 PCR (RT qPCR) 是评估单个目标 miRNAs 最常用的方法之一, 因为该技术比微阵列4和基于 RNA 排序的平台5更敏感。通常, miRNA 表达式是使用ΔCq 方法6来相对于引用示例进行度量的。这种方法适合于研究目标基因表达水平的生理变化。然而, 相对量化的循环 miRNAs 的效用有限, 因为它们的数量很小。此外, 技术的变化使得很难比较不同研究的结果, 因为不同的实验室对 RT qPCR 实验协议进行了不同的定制, 从而导致不一致甚至矛盾的结果从不同的研究7。
鉴于上述关注, 绝对量化可能更适合于评估体液中微量的 miRNAs。绝对量化方法使用由已知的合成 RNA 寡核苷酸所产生的标准曲线, 其顺序与相应的目标 miRNA8相同。卫生和环境科学研究所 (何思) 基因组学技术委员会最近进行了综合研究, 以比较在多个试验场的等离子 miRNAs 的绝对测量结果。结果表明, 使用标准协议进行绝对定量的 miRNAs 在多个测试站点9中产生了可比较的结果。本研究所描述的 RT qPCR 法与何思的标准协议几乎相同, 包括多 miRNA 靶的复用分析和预放大, 以帮助检测低表达 miRNAs。
在本研究中, 从有意识的猕猴猴 (n = 50) 的股静脉收集的血液中制备的 EDTA 等离子体固定容积 (200 µL) 使用了10。下面的协议描述了制备血浆样品、提取 miRNA 和 qPCR 的过程, 包括预放大。更重要的是, 还包括了有关该协议的其他技术信息, 以使样品中的目标 miRNAs 数量能够与一个合格的流程相结合来验证。首先, 在生物样品定量化之前, 对每个 miRNA 的标准曲线进行了验证。其次, 利用外部控制 (cel-miR-238) 的值对当前方法的质量进行综合评价。因此, 这个平台提供了更多的信息和可靠的数据, 以比较不同的研究或实验室的结果。
本文介绍了 8 miRNAs 的概况, 作为本报告所述化验方法的代表性结果。这些 miRNAs 被建议作为潜在的安全生物标志物与组织损伤的肝脏 (miR-122 和 miR-192), 心脏 (miR-1, miR-208a, miR-208b 和 miR-499a), 骨骼肌肉 (miR-133a 和 miR-206) 在啮齿目动物和人3, 11,12,13。
研究方案
所有实验均由第一惠州市三协有限公司机构动物护理和使用委员会批准。
1. 样品准备
- 收集血液 (至少0.5 毫升) 从猕猴猴的股静脉进入 EDTA 2 含钾管。
注: 柠檬酸和肝素是不可接受的, 因为这些抗凝剂抑制后续 PCR14,15。 - 将收集的样品立即放在冰上, 并在收集2小时内等离子隔离过程。
- 离心样品在 1万 x g 在4°c 为5分钟。
- 将上清液转移到2毫升微细, 然后离心 1.6万 x 克, 4 摄氏度, 以去除细胞碎片和残余血小板。
注: 血小板污染可显著影响 miRNAs 的量化16。 - 放置200µL 整除数到新鲜2毫升-管内, 并存储在-80 °c, 直到使用。
注: 每个样品的固定体积用于 RNA 提取;因此, 整除的体积必须准确。
2. RNA 提取
- 在冰上解冻冰冻样品 (从步骤 1.5)。
- 在 RNA 提取过程中, 将样品冷藏在冰上。冷却裂解试剂和氯仿在冰使用之前。
- 加入5卷 (1000 µL) 的裂解试剂, 含有苯酚和异硫氰酸胍的单相溶液, 对样品 (200 µL), 并积极混合涡流1分钟。
- 添加5µL 5 nM 合成秀丽线虫miRNA (Syn-cel-miR-238-3p)。
- 添加1体积 (200 µL) 氯仿, 并大力混合涡流1分钟。
- 在冰上保持2到3分钟, 然后离心样品在 1.2万 x g 在4°c 为15分钟。
- 小心地将水相转移到新的微细。
注意: 不要转移任何有机相 (红色) 或界面 (白色)。所收集的水相的体积应均匀, 以避免处理不一致, 从而增加技术变化。该协议中通常的水相转移量为650µL。 - 添加1.5 卷 (975 µL) 的乙醇, 并混合良好的吹打上下。
- 将样品转移到相应的列和适配器中, 然后用真空流形进行真空干燥3分钟。如果示例卷超过700µL, 请重复此步骤以处理剩余的解决方案。
注意: 基于柱的 RNA 隔离与真空和离心法是相容的。 - 在柱上加200µL 乙醇, 然后真空干燥1分钟。
- 添加800µL 的 RWT 缓冲柱, 其次是真空干燥2分钟。
- 将800µL 的 RPE 缓冲器添加到柱上, 然后真空干燥2分钟。
- 重复步骤2.11。
- 在柱上加300µL 乙醇, 然后真空干燥1分钟。
- 将该列置于新的微细上, 并在室温下 (15 至25°c) 的离心机在 1.2万 x g 处进行1分钟。
- 将该列转移到新的微细, 并添加50µL 的核酸酶水。
- 在室温下 (15 至25°c) 站立3分钟, 离心机在室温下 (15 至25°c) 为1分钟。
- 将洗脱液重新应用于该列。
- 重复步骤 2.16, 并存储洗脱液在-80 °c, 直到使用。
3. cDNA 合成
- 解冻冷冻样品 (从步骤 2.18)。
-
准备已知与靶 miRNAs 相对应的合成 RNA 寡核苷酸的浓度。
- 使用合成 RNA 寡核苷酸在 qPCR 中生成标准曲线。为存储目的准备了 1 x 108复制/µL 浓度的库存解决方案。
- 稀释库存解决方案10倍, 以获得 1 x 107复制/µL (不预放大的样本) 或 1 x 105复制/µL (预放大的样本) 工作解决方案作为最集中的构造标准曲线。一般而言, 标准曲线浓度的建议范围为 1 x 107到 1 x 102复制/µL (不预放大样本) 或 1 x 105到 1 x 100复制/µL (预放大的样本)。
- 为目标 miRNAs 混合等量的 20x rt 底漆, 制备复合 rt 引物池。
注意: 如图 2所示, 可以通过混合池中每个 miRNAs 的 20x RT 底漆来进行包含多达4个目标 miRNAs 的池。Cel-miR-238 (外部控制) 必须包括在每管的目标 miRNAs 之一。如果目标 miRNAs 少于 4, 则添加等量的 1/10 TE 缓冲器, 而不是 20x RT 底漆。 - 准备 rt 反应组合: 3 µL 的 rt 底漆池 (从步骤 3.3), 0.15 µL 100 毫米 dNTPs 与 dTTP, 1 µL 逆转录酶 (50 U/µL), 1.5 µL 10x RT 缓冲器, 0.19 µL RNase 抑制剂 (20 U/µL), 4.16 µL 无核酸酶水。
- 混合10µL 的 RT 反应混合与5µL RNA 样品 (从步骤 3.1) 或寡核苷酸 (从步骤 3.2) 吹打, 并在冰上孵化5分钟。
- 在热循环仪装置上运行反向转录:16 °c 为30分钟, 42 摄氏度为30分钟, 其次为85°c 的最终逆转录酶失活步骤5摄氏度, 直到使用。
4. 前置放大 (可选)
注意: 在后续 qPCR 中显示 miRNAs 值超过35或更多的数据被预放大。
- 解冻冷冻样品 (从步骤 3.6)。
- 用合成 RNA 寡核苷酸制作10倍稀释的 RT 产品;1 x 105到 1 x 100复制/µL 生成标准曲线。
- 用20x 检测引物的等量容积 (5 µL) 混合等体积的方法制备靶 miRNAs, 并将每种测定底漆的最终浓度稀释200倍, 最后体积为1000µL。
注: 检测底漆的靶 miRNAs 可以在随后的 qPCR, 而不预先放大, 而那些 cel-miR-238 (外部控制) 不包括在底漆池。 - 准备预放大反应组合: 12.5 µL 2x 准备使用的前置放大试剂, 3.75 µL 的化验底漆池 (从步骤 4.3), 6.25 µL 核酸酶水。
- 混合22.5 µL 预放大反应混合与2.5 µL 的反向转录样品 (从步骤 4.1) 或寡核苷酸 (从步骤 4.2) 吹打, 并在冰上孵化5分钟。
- 在热循环仪装置上运行反应:95 °c 为10分钟;其次是12周期95°c 为十五年代和60°c 为4分钟. 在-80 摄氏度之前存储预放大的样品, 直到使用。
5. 定量实时 PCR (qPCR)
- 解冻冷冻样品 (从步骤3.6 或步骤 4.6)。
- 用无菌水稀释样品5倍。
- 制备由合成 RNA 寡核苷酸衍生的 RT 产品的10倍串行稀释;1 x 107到 1 x 102复制/µL (不预放大的样本) 或 1 x 105到 1 x 100复制/µL (预放大的样本), 用于生成标准曲线。
- 准备 qPCR 反应组合:10 µL 的2x 准备使用的扩增试剂, 1 µL 20x 化验试剂, 含有前/反 PCR 底漆和探针对应的目标 miRNA, 7 µL 无核酸酶水。
- 将18µL 从 qPCR 反应混合到快速光学96阱反应板, 并将稀释后的样品的2µL (从步骤5.2 或步骤 5.3) 添加到油井中。
注: qPCR 的样品和标准以重复的方法设置。 - 用胶膜密封板材, 并简要地进行离心。
- 在实时热循环仪上运行反应:95 °c 二十年代, 其次45周期95°c 为 1 s 和60°c 为二十年代。
6. 数据分析
- 使用与相应实时热循环仪对应的数据分析软件计算每个示例的原始副本数。
注: 在研究中, 所有板块的阈值线被手动设置为 "1.0", 以确认其重现性。截止级别设置在重庆 > 40 周期。 - 计算每个样本的原始副本数与重复项的平均值。
- 通过将每个样本中的 cel-miR-238 的拷贝数除以相应管中所有样本的 cel-miR-238 的平均值来计算校正因子。
注意: 如图 2所示, 每个管都包含多达4个目标 miRNAs, 包括 cel-miR-238 (外部控件)。因此, 用相应的 cel-miR-238 值计算各管的校正系数。 - 通过将每个样本的平均原始副本编号 (从步骤 6.2) 除以每个样本的修正因子 (从步骤 6.3) 来计算调整后的副本编号。
- 通过将每个样本的调整原始副本编号 (从步骤 6.4) 乘以每个样本的稀释系数来计算绝对副本数。
注: 该协议中的稀释系数为 "5", 这是从步骤5.2 派生的。 - 计算每种序列稀释对测井 cDNA 浓度的预测, 提高 PCR 放大值的效率。
注: 计算效率的公式;E = (10(-1/斜率) -1) x 100%。 - 使用公式 E = (2 x 放大效果)ΔCt (最大 (cel-miR-238) Min (重庆)), 用所有样本中的值计算技术变化。
注: 步骤6.5 和6.7 用于质量评估程序。
结果
miRNA 检测工作流 qPCR 和质量 assessment
图 1显示了使用 qPCR10的血液样本 miRNA 检测的工作流。实验的质量可以通过将 cel-miR-238 作为外部控制来验证。这将揭示 RNA 提取和随后的 qPCR 过程的技术变化。在本研究中, 由50个样本计算出的重庆值的平均值为 21.0 0.4 (表 1)。如果 cel-miR-238 由于预放大步骤而被稀释, 则该值为24.2 到 0.4 (表 1)。在本文所描述的分析方法中, 根据其值的差异估计技术变异的程度小于3倍。即使额外的预放大步骤必须包括在内, 变化的程度仍然保持一致。这些值与来自不同动物种类的其他样本 (如老鼠、大鼠和在本实验室进行的人类) 的样品兼容 (未显示数据)。
目标 miRNA 标准曲线的可探测范围
无预放大样品
在随后的 qPCR 之前, 在 1 x 107拷贝/µL 浓度的合成 RNA 寡核苷酸上的反向转录 (RT) 产品被连续稀释。这些系列被用于生成标准曲线, 确保所有生物样品的一致覆盖, 没有预放大步骤的检测。标准样本在 1 x 102复制/µL 集中的抽取值通常接近每个目标 miRNA 的截止级别。因此, 检测限制估计为 1 x 102复制/µL (图 3)。
预放大样品
为了确定需要预放大的样品的检测范围, 比较了两组不同的稀释样品, 如图 4所示。为生成标准曲线 A, 在预放大步骤前, 对 RT 产品的串行稀释进行了制备。然后, 将一系列预放大标准用于后续 qPCR。对于生成标准曲线 B, 第一次稀释由预放大的样品制成, 浓度为 1 x 105拷贝/µL。这些标准曲线显示了明显不同的检测限制 (图 5)。虽然标准曲线 B 显示线性范围的增加到1拷贝/µL, 标准曲线 A 不能用于特定 amplicons 在浓度小于 102或 103复制/µL (图 5)。这一结果表明, 即使有预放大步骤, 也无法评估极少量的 miRNAs。此外, 当抽取值为 > 30 时, 应仔细解释预放大的样本, 因为预放大样本的检测限制接近此值。因此, 作为一条规则, 在这里描述的方法中使用标准曲线 B, 在确定检测范围后, 只为了避免使用标准地块数量不足的情况。
因此, 在大多数 miRNAs (图 3和图 5) 中, 量化的下限 (LLOQ) 是 102复制/µL。只有 miR-1 显示了更高的 LLOQ (103复制/µL) (图 5)。平均放大效率约为 90%, 标准曲线的相关系数 (R2) 从0.998 到1.000 不等。精确的 RT qPCR 检测的特征被认为是等于或大于0.98 的线性 R2 , PCR 放大效率为90到 110%17。从而验证了试验中标准曲线的质量。
预扩增对小批量 miRNAs 的影响
在随后的 qPCR 中显示的 miRNAs 值高于35或更高的结果被预放大。该程序提高了小批量 miRNAs 的检测。例如, 非预扩 miR-206 的 miR-206 值为37.9 到 1.9, 而预放大的数值下降到 27.0 @ 2.2。在高抽取值的非预放大样本中观察到重复测量对的显著差异 (图 6)。相比之下, 预放大的示例在重复项中显示几乎相等的值 (图 6)。这些结果表明, 在少量样品的情况下, 预扩能有效地提供更准确可靠的数据。
猕猴猴血浆 miRNAs 的分析
利用建立的检测平台, 对 50 miR-192 猴的 8 miRNAs (miR-1、miR-122、miR-133a、miR-206、miR-208a、miR-208b、miR-499a 和猕猴) 的血浆水平进行了分析 (图 7)10。在这种化验中, miR-122、miR-133a 和 miR-192 都是可检测的, 没有预放大, 而 miR-1, miR-206 和 miR-499a 要求预扩增, 因为其低表达水平。然而, 无论是 miR-208a 还是 miR-208b 都无法检测到预放大。数据通常不分布;因此, 对其平均值和标准差进行了对数变换计算。在检查的 miRNAs 中, miR-122 显示了最高平均等离子水平 (5.71 x 104拷贝/µL), 具有一个小的动态范围 (20 倍)。相比之下, miR-1 (581 倍)、miR-133a (971 倍) 和 miR-206 (426 倍) 的大动态范围被观察到。
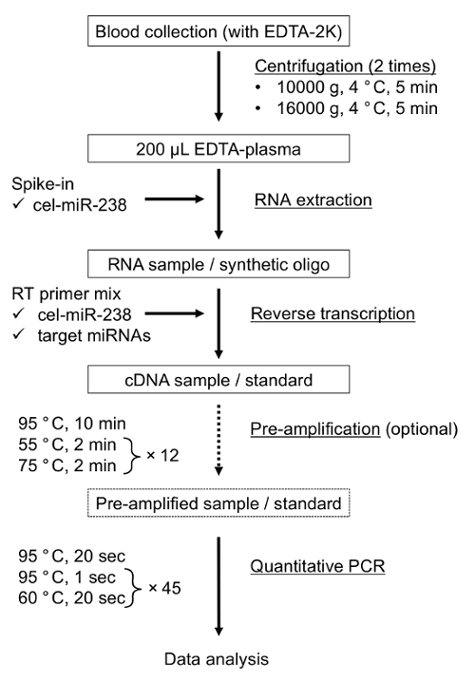
图 1: miRNA 检测的示意图工作流 qPCR.请单击此处查看此图的较大版本.

图 2: miRNA 检测的反向转录的示意图工作流.一个包含多达4个目标 miRNAs 的池可以通过混合池中每个 miRNAs 的 20x RT 引物来进行。Cel-miR-238 (外部控制) 必须包括在每管的目标 miRNAs 之一。请单击此处查看此图的较大版本.
| miR-238 数据分析 | ||
| 没有 预放大 | 与 预放大 | |
| n | 50 | 50 |
| 意思 | 21。0 | 24。2 |
| sd | 0。4 | 0。4 |
| 最大重庆 | 21。8 | 25。3 |
| 闽重庆 | 20。3 | 23。5 |
| 平均 | 21。0 | 24。2 |
| 最大分钟 | 1。3 | 1。8 |
| 放大效果 | 89 | 89 |
| 变化 | 2。4 | 2。8 |
表 1: 使用 cel-miR-238 的量化周期 (重庆) 值进行质量评估.从 miR-238 在每种检测中的值进行了技术变异的评价。五十样本分为两组 (右) 或无 (左) 预放大步骤。使用公式 E = (2 x 放大效果)ΔCt (最大值 (重庆)-Min (重庆))计算变体。从标准曲线的斜率计算出放大效果。需要预放大步骤的样品在预放大步骤中被稀释 (miR-238 本身没有预放大)。此数字已从我们的报表10中进行了修改。
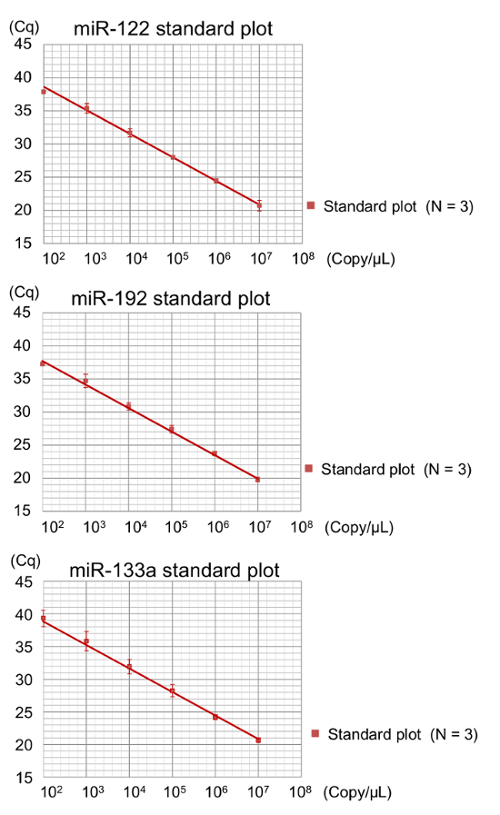
图 3:未预放大的示例的标准曲线的绘制.标准曲线 (N = 3, 重复) 是通过绘制日志集中度与重庆进行的. 计算了线性回归分析来确定斜率, 对应于放大效率。miR-122 (上部)、miR-192 (中间) 和 miR-133a (下部) 的标准曲线显示了在测试范围内的重庆和浓度之间的线性关系. 在标准曲线中, 误差线代表一个标准偏差从三独立化验。请单击此处查看此图的较大版本.
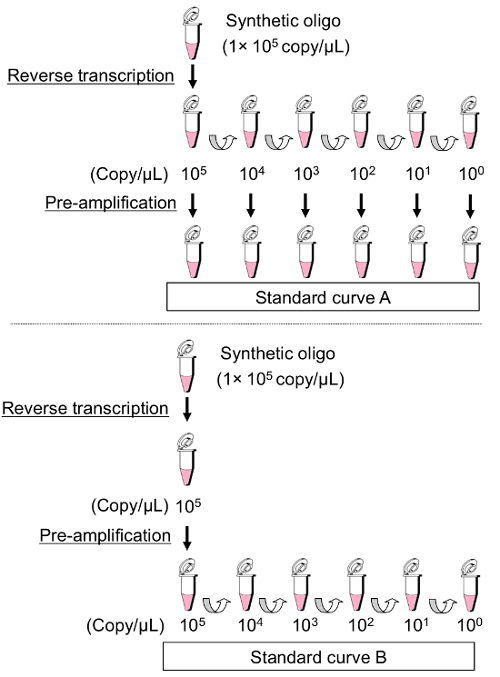
图 4: 为预放大的示例生成标准曲线的过程.(标准曲线 A)对合成寡核苷酸 (1 x 105拷贝/µL) 的代表性浓度进行反向转录, 然后编写标准样品的10倍系列稀释序列。这些预先放大的标准用于随后的 qPCR。(标准曲线 B)合成寡聚 (1 x 105拷贝/µL) 的代表性浓度为反向转录和预放大。然后, 在随后的 qPCR 之前, 制备了10倍系列的标准样品稀释序列。请单击此处查看此图的较大版本.
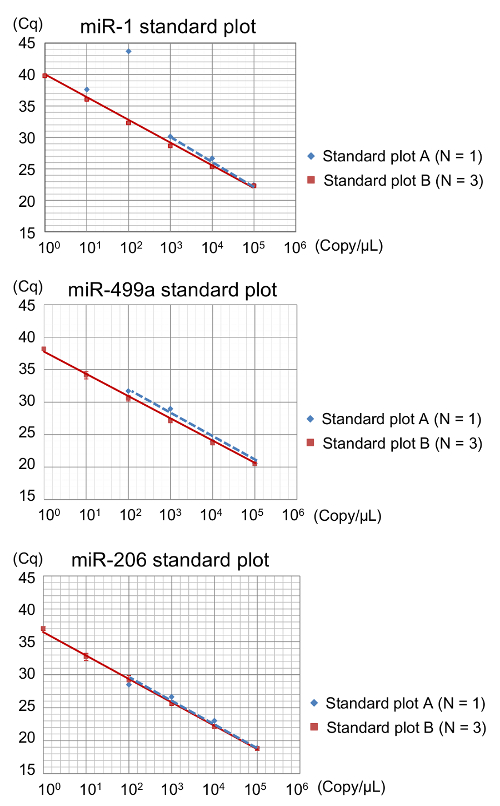
图 5: 为预放大的示例绘制标准曲线 A 和 B 的图.标准曲线 A (n = 1, 重复) 和标准曲线 B (n = 3, 重复) 是通过绘制日志集中度与重庆的结果来计算的. 用线性回归分析法确定边坡, 对应于放大效率。(上部)标准曲线 A (虚线) 在 1 x 102拷贝/µL 上显示了明显的非特定扩增子, 而标准曲线 B(实心线) 显示了在 miR-1 测试范围内的与浓度之间的线性关系。(中间和下)标准曲线 A (虚线) 在 1 x 102拷贝/µL 或更低的浓度下没有显示扩增子, 而标准曲线 B(实心线) 显示了在 miR-499a 测试范围内的重庆和浓度之间的线性关系, 并miR-206。在标准曲线 B 中, 误差线代表一个标准偏差从三独立化验。请单击此处查看此图的较大版本.

图 6:非预放大和预放大样本的放大图。(上部)在代表性样本 (A、B、C) 中 miR-206 的放大图, 不带 (上), 或预放大 (较低)。测量是以重复的方法设置的。在非预扩样本中, 两个样本之间存在着差异, 特别是在高样本 (A 和 B) 中。请单击此处查看此图的较大版本.

图 7: 猕猴猴血浆 microRNAs (miRNAs) 的绝对值.miRNAs 的表达水平由点地块表示。平均值, 以及两个标准偏差的平均值 (在灰色框中显示), 在对数变换后确定。此数字已从我们的报表10中进行了修改。请单击此处查看此图的较大版本.
讨论
我们的综合评估对动态范围的范围提供了更严格的统计分析, 这清楚地表明, 在 miRNAs 测试中, 单个样品之间的变化幅度极不相同。虽然这些变化可能是由于其体液中的少量, 但应该指出, 这些数据不仅反映了生物的变化, 而且还体现了技术上的变化。大多数技术变化可以通过外部控制 (cel-miR-238) 的值来评估, 在其他检测平台18中使用。由于 miRNA 分析中没有标准化的内部控制, 因此在分析中应包括技术变异信息, 以确定化验结果19的质量。在本报告所述方法中, 技术变化估计不到3倍。虽然无法确定此程序的质量水平, 因为其他研究中缺乏可比较的技术信息, 包括此类信息有助于提高可靠性并确保不同的研究。
最近的一些论文报告说, 处理前的各种预分析变量, 如采样处理、存储条件和存储时间, 都可能影响循环 miRNA 测量的可靠性和重现性20,21. 虽然这项研究没有考虑到预分析变量的影响, 但在样品准备过程中仔细地遵循了以下步骤, 以尽量减少变化。首先, 等离子处理尽可能快 (收集后2小时内), 以尽量减少 miRNAs 稳定性的影响, 在等离子8,22。虽然 miRNAs 被认为在室温下稳定 (15 到25摄氏度), 但仍不清楚血浆或血清的采集和处理之间的间隔是否影响 miRNA 水平。其次, 每种等离子样品都经过目视检查, 以消除 hemolyzed 红细胞污染引起的分析偏倚, 这是可能影响循环 miRNAs23水平的混杂因素之一。
在不引入检测偏差24的情况下, 预放大对于提高 biofluids 中极少量 miRNAs 的检测非常有用。在本研究中, 用预扩合成寡核苷酸构建的标准曲线的取值在实验中表现出较高的重现性。这允许使用预放大的样本进行绝对定量, 从而能够检测到少量的 miRNAs。另一方面, 低拷贝数标准 (1 x 102或 103拷贝/µL) 不显示特定的 amplicons, 并与预放大相结合。Mestdagh et al。24报告说, 由于反向转录效率较低, 因此, 在预放大过程后, 低拷贝数 miRNAs 的测量显示出较高的变化, 而 miRNAs 的中度或高拷贝数也可能是 miRNA序列特征。因此, 必须在量化生物样品之前验证每个 miRNA 标准曲线的检测范围, 特别是对预扩 miRNAs, 以消除假阳性结果。更重要的是, 必须指出的是, 不同处理的 miRNAs 的绝对级别, 如预放大和非预放大的样本不能直接比较, 因为在每个 miRNA 中未指定预放大样本的数量。
本报告描述了用 RT-qPCR 测定血浆样品中绝对 miRNA 水平的程序。一些 miRNAs 在预放大后还没有被检测到。为了检测这种低表达式 miRNAs, 可能需要使用不同的方法。虽然使用较大的样本数量可能会绕过这个问题作为一个简单的解决方案, 但大量的样本并不总是可用的。到目前为止, 技术进步已经使开发各种平台 miRNA 分析25,26。液滴数字 PCR 技术 (ddPCR) 近年来得到了发展, 为 qPCR 的绝对量化提供了一种替代方法。据报道, 这种创新技术是一种精确、可重现和敏感的方法, 可以检测到1拷贝/µL27,28级别的目标 miRNA。如果 ddPCR 能检测到低浓度的 miRNAs 没有预放大的步骤, 这将是一个很大的优势, 因为多 miRNAs 的水平可以比较。萃取过程的改变和随后的 qPCR、分子平台和试剂的变化将不可避免地产生可变的结果。但是, 如果提供了外部控件的透明结果和单个 miRNAs 的绝对级别, 则可以解决这些变化。适当的质量评估方法是提高 miRNA 分析研究中生物变化识别的关键。
披露声明
提交人没有任何利益冲突可供披露。
致谢
这项研究没有得到公共、商业或非营利部门的资助机构的任何具体补助金。
材料
| Name | Company | Catalog Number | Comments |
| BD Microtainer tube (K2EDTA) | Becton, Dickinson and Company | 365974 | For blood collection |
| Eppendorf PCR Tubes, 0.2 mL | Eppendorf | 0030124359 | |
| Eppendorf Safe-Lock micro test tubes 1.5 mL | Eppendorf | 0030120086 | |
| Eppendorf Safe-Lock micro test tubes 2.0 mL | Eppendorf | 0030120094 | |
| Synthetic oligonucleotide | Hokkaido System Science | - | Individual miRNA (0.2 μmol,HPLC grade) |
| Tris-EDTA Buffer (pH 8.0) | Nippon Gene | 314-90021 | TE buffer |
| Buffer RPE | QIAGEN | - | Contents in miRNeasy mini kit |
| Buffer RWT | QIAGEN | - | Contents in miRNeasy mini kit |
| miRNeasy Mini Kit | QIAGEN | 217004 | |
| Nuclease-Free Water | QIAGEN | 129114 | |
| QIAzol Lysis Reagent | QIAGEN | - | Contents in miRNeasy mini kit |
| Syn-cel-miR-238-3p miScript miRNA Mimic | QIAGEN | 219600 | ID:MSY0000293, 5 nmol |
| SC Adapters | TAIGEN Bioscience Corporation | S0120 | For RNA extraction |
| VacEZor 36 Complete System | TAIGEN Bioscience Corporation | M3610 | For RNA extraction |
| 7900HT Fast Real-Time PCR System | Thermo Fisher Scientific Inc. | 4351405 | Fast 96-Well Block |
| GeneAmp PCR System 9700 | Thermo Fisher Scientific Inc. | 9700 | |
| MicroAmp Fast Optical 96-Well Reaction Plate | Thermo Fisher Scientific Inc. | 4346907 | |
| MicroAmp Optical Adhesive Film | Thermo Fisher Scientific Inc. | 4311971 | |
| TaqMan Fast Advanced Master Mix | Thermo Fisher Scientific Inc. | 4444557 | |
| TaqMan MicroRNA Assays (cel-miR-238-3p) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 000248 |
| TaqMan MicroRNA Assays (hsa-miR-122-5p) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 002245 |
| TaqMan MicroRNA Assays (hsa-miR-133a-3p) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 002246 |
| TaqMan MicroRNA Assays (hsa-miR-1-3p) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 002222 |
| TaqMan MicroRNA Assays (hsa-miR-192-5p) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 000491 |
| TaqMan MicroRNA Assays (hsa-miR-206) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 000510 |
| TaqMan MicroRNA Assays (hsa-miR-208a-3p) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 000511 |
| TaqMan MicroRNA Assays (hsa-miR-208b-3p) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 002290 |
| TaqMan MicroRNA Assays (hsa-miR-499a-5p) | Thermo Fisher Scientific Inc. | 4427975 | Assay ID: 001352 |
| TaqMan MicroRNA Reverse Transcription Kit | Thermo Fisher Scientific Inc. | 4366597 | |
| TaqMan PreAmp Master Mix (2×) | Thermo Fisher Scientific Inc. | 4391128 | |
| Chloroform | Wako Pure Chemicals | 035-02616 | |
| Ethanol (99.5) | Wako Pure Chemicals | 057-00456 |
参考文献
- Schöler, N., Langer, C., Döhner, H., Buske, C., Kuchenbauer, F. Serum microRNAs as a novel class of biomarkers: a comprehensive review of the literature. Exp. Hematol. 38, 1126-1130 (2010).
- Viereck, J., Thum, T. Circulating Noncoding RNAs as Biomarkers of Cardiovascular Disease and Injury. Circ. Res. 120 (2), 381-399 (2017).
- D'Alessandra, Y., et al. Circulating microRNAs are new and sensitive biomarkers of myocardial infarction. Eur Heart J. 31 (22), 2765-2773 (2010).
- Chen, Y., Gelfond, J. A., McManus, L. M., Shireman, P. K. Reproducibility of quantitative RT-PCR array in miRNA expression profiling and comparison with microarray analysis. BMC Genomics. 10, 407 (2009).
- Nassirpour, R., et al. Identification of tubular injury microRNA biomarkers in urine: comparison of next-generation sequencing and qPCR-based profiling platforms. BMC Genomics. 15, 485 (2014).
- Derveaux, S., Vandesompele, J., Hellemans, J. How to do successful gene expression analysis using real-time PCR. Methods. 50 (4), 227-230 (2010).
- Bustin, S. A. Why the need for qPCR publication guidelines?--The case for MIQE. Methods. 50 (4), 217-226 (2010).
- Kroh, E. M., Parkin, R. K., Mitchell, P. S., Tewari, M. Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR (qRT-PCR). Methods. 50 (4), 298-301 (2010).
- Thompson, K. L., et al. Absolute Measurement of Cardiac Injury-Induced microRNAs in Biofluids across Multiple Test Sites. Toxicol Sci. 154 (1), 115-125 (2016).
- Iguchi, T., Niino, N., Tamai, S., Sakurai, K., Mori, K. Comprehensive Analysis of Circulating microRNA Specific to the Liver, Heart, and Skeletal Muscle of Cynomolgus Monkeys. Int. J. Toxicol. 36 (3), 220-228 (2017).
- Matsuzaka, Y., et al. Three novel serum biomarkers, miR-1, miR-133a, and miR-206 for Limb-girdle muscular dystrophy, Facioscapulohumeral muscular dystrophy, and Becker muscular dystrophy. Environ. Health. Prev. Med. 19 (6), 452-458 (2014).
- Starkey Lewis, P. J., et al. Circulating microRNAs as potential markers of human drug-induced liver injury. Hepatology. 54 (5), 1767-1776 (2011).
- Wang, K., et al. Circulating microRNAs, potential biomarkers for drug-induced liver injury. Proc. Natl. Acad. Sci. U. S. A. 106 (11), 4402-4407 (2009).
- Moldovan, L., Batte, K., Wang, Y., Wisler, J., Piper, M. Analyzing the Circulating MicroRNAs in Exosomes/Extracellular Vesicles from Serum or Plasma by qRT-PCR. Methods Mol. Biol. 1024, 129-145 (2013).
- Li, S., Chen, H., Song, J., Lee, C., Geng, Q. Avoiding heparin inhibition in circulating MicroRNAs amplification. Int. J. Cardiol. 207, 92-93 (2016).
- Cheng, H. H., et al. Plasma processing conditions substantially influence circulating microRNA biomarker levels. PLoS One. 8 (6), e64795 (2013).
- Serafin, A., et al. Identification of a set of endogenous reference genes for miRNA expression studies in Parkinson's disease blood samples. BMC Res. Notes. 7, 715 (2014).
- Akiyama, H., et al. A set of external reference controls/probes that enable quality assurance between different microarray platforms. Anal. Biochem. 472, 75-83 (2015).
- Kirschner, M. B., van Zandwijk, N., Reid, G. Cell-free microRNAs: potential biomarkers in need of standardized reporting. Front Genet. 4, 56 (2013).
- Malentacchi, F., et al. SPIDIA-RNA: second external quality assessment for the pre-analytical phase of blood samples used for RNA based analyses. PLoS One. 9 (11), e112293 (2014).
- Sourvinou, I. S., Markou, A., Lianidou, E. S. Quantification of circulating miRNAs in plasma: effect of preanalytical and analytical parameters on their isolation and stability. J Mol Diagn. 15 (6), 827-834 (2013).
- Yamaura, Y., Nakajima, M., Takagi, S., Fukami, T., Tsuneyama, K., Yokoi, T. Plasma microRNA profiles in rat models of hepatocellular injury, cholestasis, and steatosis. PLoS One. 7 (2), e30250 (2012).
- Kirschner, M. B., Edelman, J. J., Kao, S. C., Vallely, M. P., van Zandwijk, N., Reid, G. The Impact of Hemolysis on Cell-Free microRNA Biomarkers. Front Genet. 4, 94 (2013).
- Mestdagh, P., et al. High-throughput stem-loop RT-qPCR miRNA expression profiling using minute amounts of input RNA. Nucleic Acids Res. 36 (21), e143 (2008).
- Pritchard, C. C., Cheng, H. H., Tewari, M. MicroRNA profiling: approaches and considerations. Nat. Rev. Genet. 13 (5), 358-369 (2012).
- Moldovan, L., Batte, K. E., Trgovcich, J., Wisler, J., Marsh, C. B., Piper, M. Methodological challenges in utilizing miRNAs as circulating biomarkers. J. Cell. Mol. Med. 18 (3), 371-390 (2014).
- Mangolini, A., et al. Diagnostic and prognostic microRNAs in the serum of breast cancer patients measured by droplet digital PCR. Biomark. Res. 3, 12 (2015).
- Miotto, E., Saccenti, E., Lupini, L., Callegari, E., Negrini, M., Ferracin, M. Quantification of circulating miRNAs by droplet digital PCR: comparison of EvaGreen- and TaqMan-based chemistries. Cancer Epidemiol. Biomarkers Prev. 23 (12), 2638-2642 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。