Method Article
内含肽介导的人工蛋白水凝胶的合成
摘要
我们提出了一个分裂内含肽介导的蛋白水凝胶的合成。这种水凝胶的组成部分是各含有作为拆分内含肽的交联剂,和一个半三聚体蛋白质的一个亚单位2蛋白共聚物。两个蛋白共聚物的混合触发一个内含肽转拼反应,产生的多肽单元,其自组装成水凝胶。此水凝胶是高度的pH和温度稳定,与有机溶剂相容的,并且很容易地集成功能的球状蛋白。
摘要
我们提出了一个高度稳定的蛋白水凝胶由一个分裂蛋白-蛋白催化的转拼反应介导的合成。这种水凝胶的组成部分有两个蛋白嵌段共聚物各自包含有作为拆分内含肽的交联剂,和一个半三聚体蛋白质的一个亚单位。一种高度亲水性的无规卷曲插入嵌段共聚物用于水保持量为1。两个蛋白的嵌段共聚物的混合触发一个内含肽转拼反应,产生具有交联剂的多肽单元在任一端,可以快速自组装成水凝胶。此水凝胶是非常稳定的酸性和碱性条件下,在温度高达50℃,并在有机溶剂中。剪切诱导破裂后的水凝胶迅速改革。成立一个“基座肽”到水凝胶积木使“对接蛋白”标记的靶蛋白的方便结合。所述水凝胶是用组织培养的生长培养基兼容,支持的20kDa的分子的扩散,并且使生物活性的球状蛋白质的固定化。内含肽介导的蛋白水凝胶作为有机溶剂相容的生物催化剂的应用证明了包封的辣根过氧化物酶和确证其活性。
引言
蛋白质完全由水凝胶携带可能显著推进领域等不同的组织工程,药物输送和biofabrication 1。它们比传统的合成聚合物水凝胶的优点,包括生物相容性和非侵入性地支持生物活性的球状蛋白的结合的可能性。
在这项工作中,我们描述了通过拆分内含肽介导的蛋白转拼反应及其应用作为蛋白质固定支架( 图1)形成一种新的蛋白质凝胶的发展。此水凝胶的积木两种蛋白嵌段共聚物各自包含一个分裂的内含肽(IN和IC)和多聚体交联蛋白质的亚单位的N-或C-末端片段。该DnaE内含肽自念珠藻punctiforme(NPU)用作分割内含肽2,3和一个小的三聚体蛋白(12 kDa)的来自激烈热 CUTA horikoshii </ em>的用作交联剂蛋白4,5。不同的交联剂,通过内含肽催化的转拼反应结合,导致了高交联的蛋白网络(水凝胶)的形成。 NPU内含肽的选择,因为它的快速反应动力学(T 1/2 = 63秒)和高反式剪接率(接近80%)2,3。该CUTA蛋白被选为由于其高稳定性的交联剂。 CUTA三聚物具有接近150℃的变性温度,并保持三聚体四级结构中含有多达5个M盐酸胍4,6的解决方案。由于不同的交联剂亚基之间交换的物理水凝胶表面糜烂7的主要贡献者,在CUTA很强的亚基间相互作用应该阻止这种亚基的交流,从而导致更稳定的水凝胶。一这些积木还含有高度亲水的肽的S-片段作为中间嵌段,以促进水保留8。
两种水凝胶积木混合发起内含肽片段的IN和集成电路之间的转拼反应,生成一个较长的多肽链中与交联剂在两个终端。由多个这样的分子单元的交联剂彼此相互作用,从而形成高度交联的水凝胶网络( 图1A)。一个具体的“基座肽”(DSP)掺入水凝胶的基石之一,以促进一个“对接蛋白”(DP)-标记的目标蛋白质为水凝胶的稳定固定。使用一个分裂内含肽介导的水凝胶组件不仅提供了用于蛋白质合成的水凝胶的额外的灵活性,但也可以使目标蛋白质的高密度,均匀的载荷在整个水凝胶,作为目标蛋白质前的水凝胶形成的装载。
内含肽介导的蛋白的水凝胶是高度站ble在水溶液中有小到没有3个月室温后检测的侵蚀。稳定性被保持在一个宽范围的pH(6-10)和温度(4-50℃),并在水凝胶也与有机溶剂相容。这样的水凝胶可用于双球状蛋白质的固定化:绿色荧光蛋白(GFP)和辣根过氧化物酶(HRP)。水凝胶包埋后者蛋白用于在有机溶剂中进行生物催化。
研究方案
1。质粒的构建
注意:所有的基因都在使用每制造商的规格的Phusion高保真DNA聚合酶的标准PCR反应扩增。用于克隆的引物已经预先9所述。所有结构都列在表1中 。
- 要生成CUTA-NpuN(N,表1):
- PCR扩增来自质粒PET30-CUTA-提示1 10和KanR表-IntRBS-NpuNC-CFN 11,分别CUTA和NpuN基因,使用适当的引物。
- 消化这些片段与适当的限制性内切酶,并依次将这些片段插入T7启动子和一个C-末端6xHistidine标签以产生N个( 图2A)之间的pET26b载体中。
- 以产生NpuC-S-CUTA(C,表1):
- PCR扩增NpuC,CUTA和S fragmen吨[AG 3(PEG)] 10从质粒KanR表-IntRBS-NpuNC-CFN 11,PET30-CUTA-提示1 10和pQE9 AC 10 ATRP 12,分别使用相应的引物。
- 消化这些片段与适当的限制性内切酶,并依次将这些片段插入T7启动子和一个C-末端6xHistidine生成C(图2B)之间的pET26b载体中。
- 要生成NpuC-S-SH3 LIG-CUTA(C-SH3 LIG, 表1):
- PCR扩增CUTA使用含SH3 的LIG(PPPALPPKRRR)和柔性接头(GGGGS)2,以产生片段SH3 LIG-CUTA引物。
- 在C与片段SH3 LIG-CUTA更换CUTA基因。
- 以产生SH3-GFP( 表1):
- 利用质粒pJD757 13放大SH3结构基因适当的引物。
- 此融合片段的GFP基因并将其插入到T7启动子( 图2C)和一个C-末端6xHistidine标签之间的pET26b载体中。
2。蛋白表达
- 变换50μl的化学感受态大肠杆菌 BL21(DE3)中与适当的表达质粒。
- 转化后,连续稀释这些细胞,并镀上他们LB培养基(LB)/含有50微克/毫升卡那霉素的琼脂平板上。
- 含孵育转化细胞在37℃〜15小时板。
- 培养后,挑包含50-100个菌落的平板,重悬的所有殖民地的5毫升LB培养液中。
- 转让悬浮到1升的LB肉汤含有卡那霉素(50微克/毫升)和生长的细胞,在37℃下用250rpm振荡。监测吸光度在600nm(OD 600)。成长的文化,直到OD 600〜0.8。
- C和C-SH3 LIG,诱导蛋白表达,加入异丙基β-D-1-硫代半乳糖苷(IPTG)诱导的培养物(1mM的终浓度)孵育的培养在37℃下搅拌4小时以250rpm一边摇动。
- 对于N和SH3-GFP,冷却文化〜18℃下浸泡在培养瓶中在冰水浴〜5分钟。诱导蛋白表达,加入IPTG至文化(1mM的终浓度)和孵化培养在18℃,14〜18小时,在250转一阵晃动。
- 蛋白表达后,离心培养在6000×g离心20分钟,在4℃下,以收集沉淀。店铺细胞沉淀在-80℃直至使用。
3。蛋白质纯化
- 氮净化(变性 条件)
- 以10毫升/克的湿颗粒重悬细胞沉淀物在缓冲液A( 表2)。
- IMMERSe为丸粒悬浮液在冰水浴中,并通过超声处理裂解细胞(放大器10中,用1秒脉冲和6秒的暂停1分钟)。
- 离心溶胞产物以16,000×g离心20分钟,在4℃下
- 弃上清。重新悬浮在缓冲液DA颗粒(含有8M尿素),并离心悬浮液以16,000 xg离心20分钟,在4℃下
- 通过5ml的镍 - 次氮基三乙酸(NTA)柱预先用缓冲液平衡过的DA传递上清液。
- 用30毫升缓冲液的DA辅以45毫米咪唑洗柱。用20 ml缓冲液的DA辅以150 mM咪唑洗脱纯化蛋白。
- 降低尿素浓度的蛋白样品<1毫在由任一个在3.1.7.1或3.1.7.2给出的下列方法:
- 在使用管与<20 kDa的截止4℃过夜透析蛋白在DPBS缓冲液( 表2)。
- 离心纯化的蛋白质在30&#160; kDa的超滤离心柱于2800×g离心,4℃,直至体积小于1毫升加14毫升DPBS缓冲到列稀释的蛋白样品。重复离心/稀释步骤3次以上。
- 缓冲液置换后,加入二硫苏糖醇(DTT)对纯化的蛋白质(终2毫摩尔),并通过一个30 kDa的超滤离心柱于2800×g离心,4℃下离心浓缩蛋白到约100毫克/毫升
- 分装浓缩的蛋白质并储存于-80℃直至使用。
- 的C和C-SH3 LIG净化(自然条件)
- 重悬细胞沉淀物在缓冲液B(pH 6.0)中( 表2)以10毫升/克的湿颗粒补充有1X蛋白酶抑制剂混合物。用酸性缓冲液以最小化目标蛋白的蛋白水解降解。
- 如3.1.2所述,超声破坏细胞悬液。离心LYS吃在16000×g离心20分钟,在4℃,并保持上清液。
- 通过预先用缓冲液B平衡过的5毫升的Ni-NTA柱通过可溶性裂解物
- 用缓冲液B洗柱补充有45 mM咪唑,和洗脱目标蛋白在20毫升缓冲液B补充有150mM的咪唑。
- 对于C,跳到步骤3.2.6。对于C-SH3 LIG,进行额外的离子交换纯化步骤,如步骤以消除部分降解的蛋白质3.2.5.1 3.2.5.3到
- 降低C-SH3 LIG NaCl浓度<1毫米以下的3.1.7中描述的过程。
- 目标蛋白质加载到5毫升的阴离子交换珠状琼脂糖基质预先用磷酸钠缓冲液(50mM,pH值7.0)平衡柱。
- 从由含10mM的Tris-HCl pH 8.0的buffe溶液运行梯度柱洗脱目标蛋白r以含有补充了1M NaCl的相同缓冲液中的溶液。取样品中蛋白质的洗脱和样品池与基于十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)的最高纯度。
- 缓冲交换纯化的蛋白质转化为DPBS缓冲液中,如在3.1.7中描述。
- 添加DTT至纯化的蛋白(终浓度2mM),将浓缩的蛋白质〜100毫克/毫升使用30kDa的超滤离心柱如在3.1.8中描述。分装和储存在-80°C,直到使用浓缩蛋白。
- SH3-GFP的纯化
- 用缓冲液A以10毫升/克湿重悬浮颗粒细胞沉淀。
- 如在3.1.2描述的超声破坏颗粒的悬浮液。
- 离心溶胞产物以16,000×g离心20分钟,在4℃,并收集上清液。
- 通过预先用平衡有5毫升的Ni-NTA柱通过将上清液(可溶性裂解物)缓冲液A
- 用30毫升缓冲液A洗柱辅以45 mM咪唑。用20 mL缓冲液A的补充与150 mM咪唑洗脱纯化蛋白。
- 缓冲液使用类似于在3.1.7中描述的方法交换纯化的蛋白质转化为DPBS缓冲液和浓缩的蛋白至〜150毫克/毫升使用30kDa的超滤离心柱如在3.1.8中描述。
- 分装和储存纯化蛋白质在-80℃备用。
- 含CUTA纯化样品的SDS-PAGE分析
- 稀释的每种纯化的蛋白在双蒸水,以减少氯化钠至〜1 mM的浓度。在此NaCl浓度,大多数CUTA三聚体蛋白质的运行如在SDS-PAGE凝胶的单体。
- 混合样品与2×SDS样品缓冲液(0.5M Tris-盐酸,pH为6.8,20%甘油,10%w / v的SDS,0.1%w / v的溴酚蓝,2%β-巯基乙醇),孵育在95℃下5分钟。
- 加载SAM普莱斯到12%SDS-PAGE凝胶。进行电泳,在200 V为〜50分钟的恒定电压。
- 按照标准协议( 图1C)染色用考马斯亮蓝R250观察蛋白质的凝胶。
4。水凝胶形成
注:在本研究中制备的样品水凝胶含有1.6 mM的每个水凝胶构建块,除非另有说明。这种蛋白质浓度产生一个软而稳定的水凝胶。注意:将叠氮化钠(NaN 3的)被加入到水凝胶为0.5%w / v的终浓度,以防止细菌污染。 NaN 3的是剧毒的,必须特别小心处理,因为在材料安全数据表所示。
- 计算每个以实现在一个100μl的样品水凝胶为1.6mm的最终浓度所需的浓缩的蛋白质的量。例如:
氮浓度:100毫克/毫升
的N分子量:26.3 kDa的( 见表1)
所需体积:100微升所需浓度:1.6毫米 - 为了使100微升水凝胶(1.6毫米),混合C(X微升,按4.1计算量)用5%的NaN 3(10微升),按照100毫米DTT(5微升)和N(Y微升,体积计算4.1)2毫升的玻璃小瓶中。
- 加DPBS缓冲液((85 - X - Y)微升)到小瓶实现100μl的终体积,并通过使用吸管尖涡流运动手动混合所有成分。注意:溶液变成混合时非常粘稠。
- 2分钟离心混合物以8,000×g离心以除去气泡。
- 孵育在室温混合物下放置过夜,以允许内含肽转拼反应达到完全。通过转动管倒置确认水凝胶的形成。该蛋白不会流动,如果形成的水凝胶。
- 通过检查步骤4.2之前和在SDS-PAGE凝胶步骤4.5后收集的样品(各0.5微升),如在3.4( 图1C)中所述判断的内含肽转拼收率。
5。通过对接蛋白(DP)和扩展坞绿色荧光蛋白的固定化肽(DSP)互动
- 为了使50微升GFP的官能水凝胶(1.2毫米),结合了C-SH3 LIG(倍微升,按照4.1计算)和SH3-GFP(Y微升,按4.1计算)在1.7摩尔比为1:1毫升微量离心管中,并在室温下搅拌30分钟,温育混合物中。
- 添加5%的NaN 3(5微升),100毫米的DTT(2.5微升),(42.5 - X - Y)微升DPBS到同一管内。添加N(Y微升,按照4.1计算的)来实现的N和C-SH3 LIG摩尔比为1:1。通过使用移液管尖端由涡流运动混合样本。
- 在8000×g离心2分钟,离心分离该混合物,在室温下孵育混合物过夜在黑暗中。水凝胶孵化期间封装SH3-GFP的形式。
6。使用1.6毫米水凝胶作为固定支架在有机溶剂酶促反应
- 使用HRP作为模型酶。制备HRP(28毫克/毫升或0.63毫摩尔)的DPBS中的贮备液。
- 使30微升的水凝胶(1.6毫米)截留HRP,组合Ç内A(X微升,按照4.1计算)与HRP(2微升),5%的NaN 3(3微升)和DTT(1.5微升的100mM的) 1.7毫升离心管中。
- 加入N(Y </ em>的微升,按4.1计算),并DPBS(23.5 - X - Y)微升。混合用枪头带有旋转运动。
- 在8000×g离心2分钟,离心反应混合物,并在室温下孵育过夜。
注意:用于以下活性测定的试剂有剧毒。通过相应的材料安全数据表使用特定的安全建议。 - 对酶反应,淹没在水凝胶在1ml反应鸡尾酒的含N,N-二甲基- 对苯二胺(5.8毫米),苯酚(5.8毫摩尔)和叔丁基氢过氧化物(2.9毫摩尔)在正庚烷14用移液管尖,以增加水凝胶与溶剂接触的表面积手动破坏凝胶。
- 检测HRP的产品,靛酚型染料,通过测量在不同时间在读板器( 图5)取在546 nm的样品的光学吸收率。
结果
示意图为内含肽介导的蛋白质凝胶的形成是在图1A。水凝胶的基石是蛋白质共聚物CUTA-NpuN(N)和NpuC-S-CUTA(C)( 图1A,表1)。 NpuN / C是自然分割DnaE的N-/C-fragments内含肽从发菜punctiforme(NPU)。 CUTA是来自激烈horikoshii 4,5稳定的三聚体蛋白质。纯化的N和C中的还原剂DTT存在下的混合导致形成三分之一蛋白-连接产物(j:CUTA-S-CUTA)( 图1A和1C)。单独地,将水凝胶结构单元N和C存在作为粘性流体( 图1B)。 N和C的混合产生了将被保留在玻璃小瓶的底部反转后的透明的半固体材料,表明水凝胶15,16( 图1B)的形成18,19。
此内含肽介导的蛋白水凝胶(1.6毫米)显示出高的溶液稳定性。有小到没有经过在DPBS缓冲液21天,在22℃下损耗的交联水凝胶支架,作为蛋白质释放到DPBS缓冲总量仅略微超过的剪接内含肽从水凝胶中的理论量(假设100 %内含肽转拼的效率)( 图3A)。光密度测定表明,在水凝胶的形成, 反式剪接反应是〜80% 的效率( 图1C)。 SDS-PAGE凝胶分析显示,只有微量的反式剪接产物的量存在于水凝胶的周围的缓冲区( 图3B,带j),证实了交联水凝胶支架的损失糜烂是最小的。主要的蛋白质存在于水凝胶的周围缓冲液的剪接掉内含肽。糜烂没有明显的迹象观察不受干扰的水凝胶浸在室温水溶液中超过3个月( 图3A入口)。所述水凝胶也非常稳定,在37℃( 图3C),并在酸性和碱性缓冲剂( 图3D)。
为了便于蛋白质固定,一对蛋白质和肽配体被用来停靠感兴趣的蛋白质进入水凝胶支架。我们选择了SH3的蛋白质,从适配器蛋白CRK一个Src同源3结构域,作为对接蛋白(DP)为融合到感兴趣的蛋白质,和其配体(SH3 LIG)作为基座肽(DSP),用于掺入水凝胶支架。这种互动对的选择,因为相对较小的分子尺寸(56 AA为SH3和11机管局SH3 LIG)和高亲和力(K D = 0.1微米)17,18。 SH3 LIG插入NpuC和CUTA之间形成C-SH3 LIG( 表1)。 SH3结构蛋白融合到一个模型目标的球状蛋白,绿色荧光蛋白(GFP)的N-末端,以形成SH3-GFP。在协议中(第5, 图4A)中描述的过程产生含1.2 mM的反式剪接的水凝胶骨干积木和1.2 mM的绿色荧光蛋白水凝胶。含绿色荧光蛋白的水凝胶表现出了类似的稳定后在DPBS缓冲21天缺乏GFP( 图4B)与〜35%的总蛋白质损失的水凝胶。大部分存在于糜烂缓冲区中的蛋白质是裂解的内含子。 SH3-GFP的从含SH3 的LIG水凝胶的浸出率是〜3周后的30%,比由水凝胶缺乏SH3 LIG(> 70%的蛋白质损失的时间, 图4C同期)显著小。在紫外光下的固定SH3-GFP在水凝胶发光。就像在图4D中 ,包含基座pepti水凝去SH3 LIG保留了大部分的GFP荧光的3周后,而缺乏SH3 LIG水凝变得基本上无荧光。因此预计,使用了更高亲和力的DP / DSP对可进一步减少固定化蛋白的浸出率。
在该实验中,绿色荧光蛋白作为靶蛋白,但是,任何的DP-标记的蛋白可以很方便地固定到该水凝胶。因此,内含肽介导的蛋白质凝胶应该提供一个一般的脚手架蛋白质固定。固定化绿色荧光蛋白的密度显示出这项工作是〜33%(摩尔)的水凝胶。当多个DSP掺入水凝胶积木较高的固定化密度可以潜在地实现。
接下来,HRP酶被并入蛋白质凝胶证实其有能力支持生物催化在有机溶剂中的能力。酶活性通过监测氧化偶合测定 N,N-二甲基对苯二胺和苯酚与叔丁基过氧化氢 随时间推移14。的假设是,水凝胶的水合环境将保护连接酶从有机溶剂的变性作用。含0.042毫HRP水凝胶浸渍在含有底物的正庚烷。浸渍于有机溶剂后,将含有HRP-水凝胶手动打乱成小簇,以增加亲水性-疏水界面区( 图5B)。水凝胶的结合HRP催化的有效快速的氧化反应,在比色产物( 图5C,三角形)而产生。该产品累积如下的线性斜率,在实验过程中,指示小到无酶失活。直接在有机反应鸡尾酒溶解用HRP控制反应表现出微不足道的催化活性,由于酶的变性(数据未示出)。 HRP溶于DPBS第一,随后加入到有机溶剂是能够催化转换,但在一个大大减小反应速率( 图5C中 ,圆圈)。酶溶解在DPBS中的低转化率可能是由于在DPBS和有机溶剂,这限制了底物/产物的扩散速率之间的小的界面面积。团的亲水性高的对S片段在凝胶骨干,从而有效地“锁定”在水凝胶内,并防止有机溶剂进入水凝胶内部,使得能够在水凝胶经受有机溶剂的变性作用。这些结果表明,该内含肽介导的蛋白水凝胶可以成为一种有效的支架为在有机溶剂中的酶反应。
_upload/51202/51202fig1.jpg“/>
图1。内含肽介导的蛋白质凝胶 。 ( 一 )示意图内蛋白反式剪接反应的触发与蛋白质交联在两端形成一个扩展的蛋白质链(J)的。从将多个J蛋白链非共价准,一经内含肽介导的蛋白质连接的交联剂蛋白,诱导一种高度交联的蛋白网络与水凝胶性质的形成。 NpuN / C:内含肽N-/C-fragment。 (B)的纯化的N和 C混合(8.3%重量/体积)将导致一个高度交联的水凝胶网络(1.6毫j)的形成。前混合后纯化的N和C积木(C)SDS-PAGE分析。 “N + C”相当于直接从1.6毫米的水凝胶中抽取的样本。 “*”表示一个内含肽的C-末端切割位SI德反应产物。使用“跟踪模块中的”数量一号“软件的每个波段的强度进行了量化。谱带强度除以蛋白质分子量,得到的摩尔当量。 反式剪接效率(〜80%)从产品J和未反应的N / C在同一车道的量进行了计算。转载需经期刊美国化学学会的许可。(DOI:10.1021/ja401075s) 点击此处查看大图。

图2。蛋白质结构的质粒图谱 。 ( 一)CUTA-NpuN,(B)NpuC-S-CUTA和(C)SH3-GFP(<STRONG>表1)T7启动子的控制下克隆到pET26b载体。 点击这里查看大图。

图3。 1.6毫米的水凝胶在22°C 的内含肽介导的蛋白质凝胶在DPBS稳定性(A)侵蚀简介虚线表示切割的内含子的理论质量。入口显示3个月室温后在DPBS中不受干扰的水凝胶。 (B)的SDS-PAGE凝胶的周边缓冲区分析。缓冲区的所有在该水凝胶浸渍于(A)的样品合并(总7.5ml)中,并通过超滤通过一个10kD的浓缩75倍前凝胶上样膜吉姆 :内含肽反式剪接产物N:。未反应的CUTA-NpuN NpuN:拼接出的N-内含子片段。未反应的 C和剪接掉NpuC是不可见的凝胶由于小的量和小尺寸(4 kDa)的分别。星号表示不明身份的乐队。水凝胶的温育在不同温度(C) 的侵蚀曲线。水凝胶的温育在两个不同的pH值(D)的侵蚀曲线。转载需经期刊美国化学学会的许可。(DOI:10.1021/ja401075s) 点击此处查看大图。
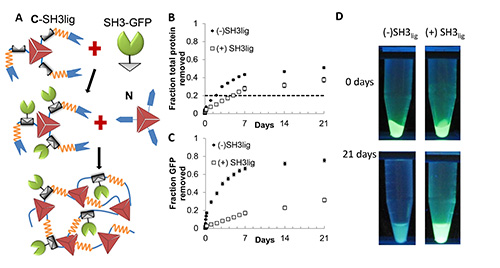
图4。蛋白-介导的水凝胶支持的功能球状蛋白质的固定化。采用GFP作为模型球状蛋白质蛋白质固定的( 一 )示意图。含DSP的水凝积木先与DP融合靶蛋白为靶蛋白加载到积木混合。内含肽片段含有的水凝胶积木互补添加到产生的水凝胶固定化绿色荧光蛋白的混合物。 (B)的总蛋白冲蚀截面含SH3-GFP的摩尔比为1:1的水凝胶。虚线代表剪接掉内含子的理论质量。误差棒代表的2次独立实验的标准偏差。 ( 三)从浸出水凝胶使用和不使用DSP配置SH3-GFP的。后水凝胶的形成和后21天含在紫外线照射下的水凝胶的GFP(D)图像。转载需经许可杂志美国化学学会(DOI:10.1021/ja401075s) 点击此处查看大图。

图5。辣根过氧化物酶(HRP)包埋蛋白-蛋白触发水凝利于在有机溶剂正庚烷的HRP-催化的反应由辣根过氧化物酶在有机溶剂中催化(A) 的模型反应。 (B)含有被破坏成小的碎片和培养在一个反应鸡尾酒为10分钟和30分钟(左)和对照实验未固定的HRP在DPBS缓冲液相同量的(右)后包封HRP水凝胶的照片。 (C)产品的形成是由吸光度在546 nm处监测。改编自中国AMERI许可可以化学学会(DOI:10.1021/ja401075s) 点击此处查看大图。
表1中。在本研究中使用的蛋白质的结构。
| 简称 | 蛋白质序列 | 分子量(kDa的) |
| CUTA-NpuN(N) | CUTA-EAC-(GGGGS)2-AS-NpuN-HHHHHH | 26.3 |
| NpuC-S-CUTA(C) | NpuC-CFNKLYRDPMG-[(AG)3 PEG] 10 -ARMPYV-C UTA- HHHHHH | 26.1 |
| NpuC-S-SH3 LIG - CUTA(C-SH3 LIG) | NpuC-CFNKLYRDPMG-[(AG)3 PEG] 10 -ARMPYVGS- PPPALPPKRRR - (GGGGS)2-AS-CUTA-HHHHHH | 28.3 |
| SH3-GFP | SH3-KL-(GGGGS)2-AS-GFP-HHHHHH | 34.5 |
转载需经期刊美国化学学会的许可(DOI:10.1021/ja401075s)。
表2。缓冲区组成。
| 缓冲液A | 500 mM氯化钠,10mM的Tris-盐酸,pH为8.0 |
| 缓冲DA | 的500mM的NaCl,8M尿素,10mM的Tris-盐酸,pH为8.0 |
| 缓冲液B | 500 mM氯化钠,50mM的NaPOi,pH 6.0的 |
| DPBS | 的Dulbecco PBS,137.9 mM氯化钠,2.7 mM的氯化钾,1.5mM的KH 2 PO 4,8.1毫米的Na 2 HPO 4,pH 7.4的 |
转载需经期刊美国化学学会的许可(DOI:10.1021/ja401075s)。
讨论
在这项工作中,我们展示了一个高度稳定的内含肽介导的蛋白水凝胶的合成。使用一个分裂内蛋白使得能够有条件地形成响应于两个液相成分混合的水凝胶。具体而言,分割内含肽共价连接两个液相积木通过转拼反应,得到交联单元,反过来自我组装成水凝胶两侧的多肽单元。混合诱导形成水凝胶的旁路中的单组分蛋白质凝胶,其中的色谱纯化柱的凝胶介导的堵塞可能发生的合成技术困难。此外,生理条件,而不需要任何多余的化学诱导物和/或物理的触发下,水凝胶的形式。
内含肽介导的水凝胶保留稳定性高酸性和碱性缓冲剂,并在生理温度。水凝胶可形成无线个少至0.8mM的各个构建模块的(数据未显示),但较高的蛋白质浓度(〜1.6毫摩尔)收率水凝胶具有更好的机械稳定性。该水凝胶的高稳定性归因于使用1)非常稳定的三聚体蛋白,CUTA,作为交联剂,和2)内蛋白共价连接不同的交联剂。的SDS-PAGE凝胶的光密度分析表明〜80% 的输入蛋白成功地进行了分割内蛋白催化的转拼反应。
对于水凝胶的形成,从个人积木首先浓缩至〜100毫克/毫升。还原剂,如DTT,需要在蛋白质浓度的步骤是存在防止分子间二硫键的形成。在不存在还原剂的,浓缩的个别水凝胶构建块有时可形成水凝胶样物质。然而,当浸没在缓冲液和/或在存在这种凝胶状物质迅速溶解的还原剂。
以获得具有最大稳定性的水凝胶,以确保这两个水凝胶结构单元的摩尔比为1:1是非常重要的。任何多余的积木也不会交联,并能影响水凝胶的机械性能。浓缩蛋白需要被等分并单独储存避免重复冷冻 - 解冻循环。
我们还说明了如何使用内含肽介导的蛋白水凝胶作为有机溶剂相容的生物催化剂。具体地,结合了辣根过氧化物酶的酶浸在正庚烷中含有底物的底物和成功转化为产物的水凝胶进行了观察。蛋白质凝胶用作可能是由于从由水凝胶的高度水合的环境中提供有机溶剂介导的变性的保障一种有效的脚手架用于生物催化在有机溶剂中进行。
一个个的局限性是酶固定化技术是需要融合的靶蛋白与对接肽(DP)。该变形可能会影响某些靶蛋白的活性和溶解度,因此需要对DP-标记的蛋白构建体的情况下,逐案优化。此外,少量的标记蛋白的浸出坞站肽(DSP),含1周后的水凝胶的出。固定化的蛋白质的稳定性是由DSP / DP对的亲和力的影响。为了达到更好的固定化效率,较高的亲和力的DSP / DP的组合是必要的。最后,这种水凝胶表现出相对较弱,由于低高原的储能模量(100-200千帕)的机械性能9。高原的储能模量是由两个交联剂和中间嵌段19的结构的影响。在目前的水凝胶,三聚体蛋白被用作交联剂。具有较高的多聚体状态使用交联剂的蛋白质有可能增加水凝胶高原圣ORAGE模量和它的力学性能。
综上所述,我们提出一个新的蛋白质凝胶的形成条件后,两液相蛋白积木,每片含二分之一的分割内含肽混合的合成与表征。内含肽介导的蛋白水凝胶的表示与在合成的酶反应,有机合成,可注射的药物递送和组织工程的潜在应用的有前途的新材料。
披露声明
没有竞争的经济利益存在。
致谢
作者要感谢大卫·蒂雷尔博士(加州理工学院)的盛情质粒的礼物pQE9交流10 ATRP 12,汤姆·缪尔博士(普林斯顿大学)的盛情质粒KanR表- IntRBS-NpuNC-CFN 11的礼物,松田武久博士(技术,白山市,石川,日本金泽大学)的盛情质粒PET30-CUTA -提示1 10,博士和杰伊·D·基斯林(加州大学伯克利)的盛情质粒的礼物pJD757 13的礼物。这项工作是由美国国家科学基金会职业,美国空军叶和诺曼·哈克曼高级研究计划中的一部分支持。
材料
| Name | Company | Catalog Number | Comments |
| Phusion High Fidelity DNA polymerase | New England BioLabs | M0530S | |
| Competent Escherichia coli BL21 (DE3) | New England BioLabs | C2527I | |
| Luria Bertani | VWR | 90003-350 | |
| Bacto Agar Media | VWR | ||
Kanamycin sulfate | VWR | ||
| IPTG | VWR | EM-5820 | |
| Imidazole | VWR | EM-5720 | |
| Urea | VWR | EM-9510 | |
| Dithiothreitol (DTT) | Fisher | BP172-5 | |
| Protease Inhibitor cocktail | Roche Applied Science | 11836153001 | |
| DPBS | VWR | 82020-066 | |
| Brilliant Blue R | Acros Organics | A0297990 | |
| Sodium Azide | Fisher | AC190380050 | Caution, highly toxic |
| Horseradish peroxidase | Sigma | P8125-5KU | |
N,N-dimethyl-p-phenylene diamine | Fisher | AC408460250 | Caution, highly toxic |
| phenol | Fisher | AC149340500 | Caution, highly toxic |
tert-butyl hydroperoxide | Fisher | AC180340050 | Caution, highly toxic |
| n-heptane | Acros Organics | 120340010 | |
| [header] | |||
| Shaker/Incubator | Fisher Scientific | Max Q 6000 | |
| Centrifuge | Sorvall | RC 6 | |
| Sonicator | QSonica | Misonix 200 | |
| Ultrafiltration Tubes | Amicon Ultra | UFC903024 | |
| Ni Sepharose High Performance HisTrap column | GE Healthcare Life Sciences | 17-5248-01 | |
| HiTrap SP Sepharose FF ion exchange column | GE Healthcare Life Sciences | 17-5156-01 | |
| Plate reader | Molecular Devices | SpectraMax Gemini EM | |
参考文献
- Banta, S., Wheeldon, I. R., Blenner, M. Protein Engineering in the Development of Functional Hydrogels. Ann. Rev. Biomed. Eng. 12, 167-186 (2010).
- Iwai, H., Zuger, S., Jin, J., Tam, P. H. Highly efficient protein trans-splicing by a naturally split DnaE intein from Nostoc punctiforme. FEBS Lett. 580, 1853-1858 (2006).
- Zettler, J., Schutz, V., Mootz, H. D. The naturally split Npu DnaE intein exhibits an extraordinarily high rate in the protein trans-splicing reaction. FEBS Lett. 583, 909-914 (2009).
- Tanaka, Y., et al. Structural implications for heavy metal-induced reversible assembly and aggregation of a protein: the case of Pyrococcus horikoshii CutA. FEBS Lett. 556, 167-174 (2004).
- Sawano, M., et al. Thermodynamic basis for the stabilities of three CutA1s from Pyrococcus horikoshii,Thermus thermophilus, and Oryza sativa, with unusually high denaturation temperatures. Biochemistry. 47, 721-730 (2008).
- Tanaka, T., et al. Hyper-thermostability of CutA1 protein, with a denaturation temperature of nearly 150 degrees C.. FEBS Lett. 580, 4224-4230 (2006).
- Shen, W., Zhang, K., Kornfield, J. A., Tirrell, D. A. Tuning the erosion rate of artificial protein hydrogels through control of network topology. Nat. Mater. 5, 153-158 (2006).
- McGrath, K. P., Fournier, M. J., Mason, T. L., Tirrell, D. A. Genetically directed syntheses of new polymeric materials. Expression of artificial genes encoding proteins with repeating -(AlaGly)3ProGluGly- elements. J. Am. Chem. Soc. 114, 727-733 (1992).
- Ramirez, M., Guan, D., Ugaz, V., Chen, Z. Intein-triggered artificial protein hydrogels that support the immobilization of bioactive proteins. J. Am. Chem. Soc. 135, 5290-5293 (2013).
- Ito, F., et al. Reversible hydrogel formation driven by protein-peptide-specific interaction and chondrocyte entrapment. Biomaterials. 31, 58-66 (2010).
- Lockless, S. W., Muir, T. W. Traceless protein splicing utilizing evolved split inteins. Proc. Natl. Acad. Sci. U.S.A. 106, 10999-11004 (2009).
- Shen, W., Lammertink, R. G. H., Sakata, J. K., Kornfield, J. A., Tirrell, D. A. Assembly of an artificial protein hydrogel through leucine zipper aggregation and disulfide bond formation. Macromolecules. 38, 3909-3916 (2005).
- Dueber, J. E., et al. Synthetic protein scaffolds provide modular control over metabolic flux. Nat. Biotechnol. 27, (2009).
- Bruns, N., Tiller, J. C. Amphiphilic network as nanoreactor for enzymes in organic solvents. Nano Lett. 5, 45-48 (2005).
- Das, D., et al. Water gelation of an amino acid-based amphiphile. Chem. Eur. J. 12, 5068-5074 (2006).
- Cao, Y., Li, H. Engineering tandem modular protein based reversible hydrogels. Chem. Commun. , 4144-4146 (2008).
- Wu, X., et al. Structural basis for the specific interaction of lysine-containing proline-rich peptides with the N-terminal SH3 domain of c-Crk. Structure. 3, 215-226 (1995).
- Nguyen, J. T., Turck, C. W., Cohen, F. E., Zuckermann, R. N., Lim, W. A. Exploiting the basis of proline recognition by SH3 and WW domains: Design of n-substituted inhibitors. Science. 282, 2088-2092 (1998).
- Olsen, B. D., Kornfield, J. A., Tirrell, D. A. Yielding Behavior in Injectable Hydrogels from Telechelic Proteins. Macromolecules. 43, 9094-9099 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。