Method Article
漂白实验(FRAP和FLIP)来衡量生活胚胎干细胞的染色质的蛋白质动力学
摘要
我们描述漂白方法,包括荧光漂白后恢复(FRAP)和荧光漂白(翻转)监测胚胎干细胞(ES细胞)的染色质的蛋白质动力学的损失。染色质蛋白的动态,这被认为是研究染色质可塑性的手段之一,是增强多能干细胞。
摘要
漂白后荧光恢复(FRAP)和漂白荧光丢失(FLIP),使具有良好的空间和时间分辨率的活细胞中的蛋白质动力学研究。在这里,我们描述了如何执行FRAP翻转检测和染色质蛋白,其中包括H1和HP1,在小鼠胚胎干细胞(ES)。在一个FRAP实验中,细胞转染,无论是瞬时或稳定,与一个融合绿色荧光蛋白(GFP)及其衍生物(YFP,CFP,樱桃等)的利益的蛋白质。在转染,荧光的细胞,强烈聚焦的激光束漂白剂的利益相对较小的区域(ROI)。选择的激光波长是根据荧光蛋白融合使用。激光光的投资回报率不可逆的漂白剂分子的荧光信号后,立即漂白,漂白面积的荧光信号的恢复 - 更换漂白漂白分子的分子介导的 - 监测使用时间的推移成像。产生的荧光恢复曲线对蛋白质的流动性提供了信息。如果荧光分子不动,无荧光的复苏将是观察。互补的方法,在漂白荧光丢失(FLIP),激光束的漂白剂在同一地点反复和信号强度测量荧光细胞。因此,翻转实验测量信号衰减而不是荧光恢复,并有助于确定蛋白质的流动性以及蛋白质,细胞车厢之间穿梭。瞬态约束力的染色质相关蛋白的共同财产。虽然每个染色质蛋白的主要部分是在任何给定时刻处于稳定状态的约束染色,绑定是暂时性的,最染色质蛋白对染色质高价成交,停留时间在几秒钟的顺序。这些属性1基因的表达产生的高可塑性的关键。漂白实验,因此特别有用,以确定染色质的可塑性,尤其是在胚胎干细胞,使用的染色质结构蛋白GFP融合版本是较高的染色质蛋白(包括异染色质蛋白1(HP1),连接器的组蛋白H1和核心组蛋白)的动态交换比2,3分化的细胞。
研究方案
1。电镀ES细胞
T = 0小时
MEF的电镀
- 大衣实时成像8以及μ-幻灯片(德国ibidi;慕尼黑),明胶(实验室TEK;罗切斯特,纽约州)在墓室盖眼镜或玻璃底培养皿(MatTek;阿什兰,马萨诸塞州)。离开5-30分钟,吸了免费的明胶。
- 22000种MEFs / 250μLDMEM总量10%胎牛血清(FBS),补充]。让细胞生长在一个组织培养箱培养(37℃,5%CO2)。
T = 6小时
ES细胞的电镀
- 吸的DMEM。
- 种子/ ES细胞介质的总体积250μL涂15000 R1的细胞以及每个MEF [辅以10%ESC级小牛血清(FBS),丙酮酸钠1毫米,0.1毫米非必需氨基酸,0.1毫米的β-巯基乙醇,和1000 U / ml的白血病抑制因子(LIF)],以获得30%至50%汇合翌日。
2。转染ES细胞
T = 24小时
瞬时转染
- 替换ES细胞介质与250μL/孔新鲜胚胎干细胞的媒体。
- 在1.5毫升的无菌试管中,加100μL无血清介质[OPTI - MEM(GIBCO)],然后直接添加到无血清媒体10μL过境LT1转染试剂(Mirus)。轻轻吹打混合,在室温下孵育5-20分钟。
- 添加1.5微克GFP融合的质粒DNA(H1e,H1o或HP1)稀释过境LT1试剂。轻柔吹打混匀,室温孵育15-30分钟。
- 加入13.5μL/孔的转染混合物。 8漩涡以及μ-幻灯片,以确保即使疏散。经过24小时的250μL新鲜的胚胎干细胞媒体取代旧的ES细胞的媒体。
3。执行FRAP和FLIP
T = 48-72小时
- 实验可以在任何激光扫描共聚焦显微镜(CLSM),但因为在一个正常的FRAP /翻盖实验,获得了许多连续的影像,这是推荐使用一个旋转的磁盘共聚焦显微镜,使采集速度,并确保没有不受欢迎的样品漂白会发生以下初始故意漂白事件。在这里,我们推荐使用旋转盘共聚焦系统(www.Andor.com)的革命,与横河电机CSU - X的旋转盘头。该系统具有光漂白点扫描系统使用一个专门的FRAPPA模块的双重身份,和快速切换的光背,采集图像,使用旋转盘。用于漂白实验的3个最常见的荧光蛋白质GFP,YFP和樱桃。如果使用GFP或YFP,一个〜488 nm激光是必需的。樱花,使用一个〜560纳米的激光。在所有情况下,我们建议使用固态激光器。一个自动化的阶段,是非常有用的,但不是必需的。由于活细胞成像,它是必不可少的使用环境室(我们使用LIS之一,瑞士),控制氧气,湿度,CO 2和温度。 FRAP是使用最大的激光强度,而成像所需的最小激光功率(通常在10%的面积,当荧光水平是足够的)。
细胞,并用适当波长的荧光光观察,选择一个单元格,使用60X油浸镜头表达GFP。确保正确的亚细胞分布。有时,表达水平过高时,蛋白质的本地化可能“外溢”到其他车厢,如核仁。这种细胞不应该被选中。 - 现在设置的成像协议:收集的漂白前3-5帧,然后在常染色质或异(简明GFP的疫源地浏览)的光漂白和收集的光漂白后90-120帧250-1000毫秒的时间间隔,H1e - GFP,1000 MS,H1o和HP1 - GFP,250毫秒(根据蛋白质动力学,极具活力的蛋白质,需要较短的时间间隔时间间隔时间的变化)。我们通常使用漂白用20-40μseconds(1-2迭代)的激光脉冲的80-100%的激光强度,但据分析蛋白质的表达水平,这些数字可以改变。当漂白是合适的,你应该遵守一个“黑洞”在你的绿色荧光。黑洞是逐步重新充满荧光以下恢复。虽然旋转盘,可取得最多约每秒60图像(具有良好的荧光强度和单个细胞在缩放时),我们不建议使用在这样低的图像质量和增加光毒性潜力的高速系统。
- 对于一个翻转实验,设置了不同的的成像协议:收集前漂白3-5帧,然后开始反复漂白,而在同一地点采集图像。 H1e - GFP H1o - GFP,漂白剂,漂白剂,每隔5秒,每2秒,HP1 - GFP漂白每1秒。死神一个ð重复采集图像,整个实验。
- 对于这两种技术,重复20-30细胞的过程。用于统计目的的,重复实验3次或以上,最好是在不同的日子。在同质人口和正确的设置,标准偏差通常较低(<5%)。
对于这两个FRAP和FLIP,漂白区域的大小和形状会影响经济复苏动力,必须保持在一个实验常数。此外,当两个单元格进行比较,相同的协议必须使用和细胞必须按顺序在同一天功率激光和其他条件可能出现波动,可能会影响实验的结果进行分析。
4。 FRAP和分析翻转数据
- 在所有FRAP帧收集,测量的荧光强度,投资回报率(ROI b =漂白区),背景区域(BG的投资回报率),和非漂白的核面积作为时间的函数之前,漂白后(投资回报率,NB) 。当漂白地区是微不足道的,整个核可以选择正常化的目的。
- 对于每一个时间点,正常化数据根据公式:(投资回报率B -投资回报率BG)/(NB的投资回报率-投资回报率BG)/(pbROI B - pbROI BG)/(pbROI NB - pbROI BG),PB表示预漂白。漂白前的图像,你应该得到的价值约1。漂白后的第一个图像将显示漂白的深度。减去实际漂白深度值的值从1。重复每一个细胞,每个实验的平均20-30细胞。
- 在收集到的所有翻转帧,测量荧光强度,在非漂白核领域和背景区(NB =非漂白领域的投资回报率,投资回报率BG =背景)。翻盖数据的计算是类似一个FRAP曲线,只有分析的ROI(投资回报率 NB)应比实际漂白的地区,这是不用于计算不同 :(NB的投资回报率- 投资回报率BG)/(pbROI NB - pbROI BG) 。正常化的目的,它也可以使用邻近细胞(投资回报率N =相邻小区):NB -投资回报率(ROI BG)/(投资回报率N -投资回报率BG)/(pbROI NB - pbROI BG)/(pbROI N - pbROI BG )。
以下数据收集,这是可能的,以适应计算机模拟实验数据。这允许计算,具有良好的接近,移动的一小部分,动弹不得的分数和半最大,。我们不会讨论FRAP分析的数学和统计方面和读者参考其他优秀出版物4-9。漂白深度是指预漂白剂(100%)的信号和漂白后的第一形象之间的距离(Y轴)移动的分数是指之间的漂白剂的深度和距离(y轴)恢复的信号时的动力学到达高原,不动的一小部分,是指恢复的信号和预漂白剂(100%)信号之间的距离(Y轴)(见图1B和2B)。除了这一分析,有良好的数学模型来拟合数据。对于一个单一的指数,该方程
其中t是时间,一个是移动的一小部分,1,一个是不动的分数和K过的解离常数,可用于数据拟合,并可以直接估计一个有约束力的帐率(K关闭 )获得,以及参数,可用于计算的关联率。
5。代表性的成果:
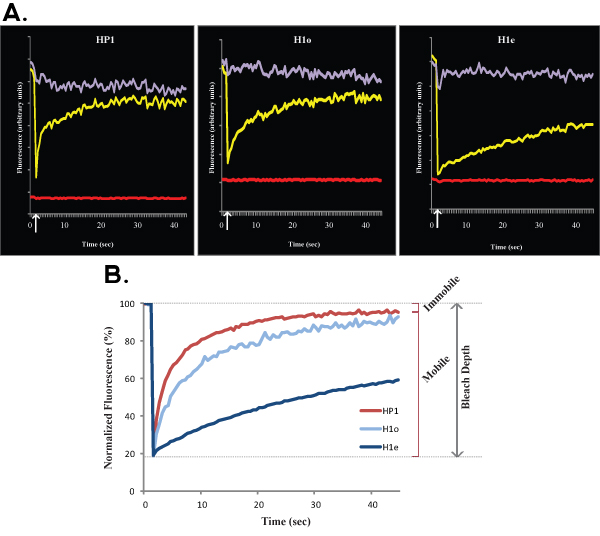
图1:A和B显示代表HP1(左),H1o(中)和H1e(右)在R1 ES细胞的FRAP曲线。对于简单和清晰图1A显示任何正常化和计算前的一个单细胞的原始数据。黄色曲线对应的漂白地区,紫色的曲线对应的非漂白的核区(漂白地区是微不足道的,整个核可以正常化的目的选择),红线对应的背景荧光,这是在这种情况下最小。垂直箭头代表漂白的时间。规范化和平均数据显示在图1B。注意H1(蓝色)HP1(红色)相比,恢复较慢。也H1e变种(深蓝色)是比H1o变种(浅蓝色)慢。移动和静止的分数和漂白剂深度为HP1表示。
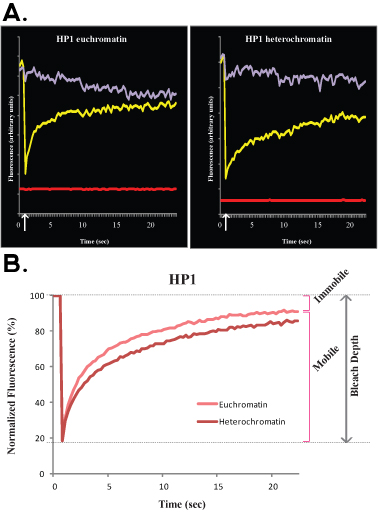
图2,A和B显示代表FRAP曲线比较常染色质(左异的HP1(右)在R1 ES细胞)。同样以图1,图2a显示了一个单细胞的原始数据,黄色曲线对应的漂白地区,紫色曲线对应的非漂白的核面积,红线对应的背景荧光。垂直箭头代表漂白的时间。规范化和平均数据,如图2b所示。注意异(暗红色)与常染色质(淡红色)相比,恢复较慢。移动和静止的分数和漂白剂深度表示为常染色质。

图3。一个典型的H1o R1 ES细胞的另一实验显示在图3A(原材料,联合国规范化的数据)和B(正常化和平均数据)。在这个实验中,紫色的曲线对应的非漂白的核领域,绿色线对应到邻近的细胞的细胞核和红线对应背景荧光。
讨论
与大多数可用的技术,涉及从细胞群或固定细胞,FRAP实验纯化染色按照在活细胞中染色质的蛋白质动力学变化。我们发现染色质蛋白的动态染色质可塑性的一个良好指标。然而,因为它需要融合的兴趣与绿色荧光蛋白基因,荧光标记除了可以干扰蛋白质的功能。因此,与FRAP出发之前,该融合蛋白,必须经过严格的测试,以确保它具有相同的属性和作为其原生对应的功能。金标准将在淘汰赛细胞系的GFP融合来补充内源性蛋白质的功能。然而,基因敲除细胞系并不总是可用的,并在许多情况下,蛋白质的情况下没有一个明确的表型。然而,一个可以测试的融合蛋白的亚细胞分布,其表达水平,其约束力的合作伙伴,所有与内源性蛋白,以确保适当的局部更换相比。
一旦查实,GFP融合蛋白,必须转成ES细胞。我们发现,地下工程与胚胎干细胞和转染效率达到50%以上。瞬时转染方便,因为它允许直接与实验出发,但往往优于稳定转染,确保长期利益的融合蛋白存在于细胞的生存,并导致降低和一个同质的表达水平。标签与GFP标记的蛋白质的其他方法包括使用 combineering 10或绿色荧光蛋白GFP / YFP的外显子11,12的内源性基因诱捕直接BAC的GFP基因标记这些方法是可取的,融合蛋白是由内源性启动子驱动的,但并不总是可用的。转染到ES细胞BAC的是可以使用标准的转染方法。最后,表达标签的染色质蛋白的转基因小鼠的胚胎干细胞也可以使用。虽然比较烦琐,此方法允许使用早期传代细胞,稳定转染的细胞,这需要长期的培养,以实现稳定整合纯选择不同。
一旦感兴趣的蛋白质已被选中,与GFP融合,核实,并转染ES细胞,也有必须完成一个成功的FRAP实验的几个基本条件:第一,要漂白的荧光信号,必须清楚地检测到的任何背景信号;第二,漂白必须快,相对的恢复期间,提供足够的时间恢复曲线分析决议,并允许半时间的恢复测量。因此,使用的激光漂白应该是强大到足以让这第三,监测束必须是低强度,以尽量减少漂白。旋转盘共聚焦显微镜,配有漂白功能(如安道尔革命制度),因此用于此目的的理想。最后,保持细胞在正常生长条件下的环境室必须安装在显微镜上,以确保适当的细胞稳态。
进行分析时,核心组蛋白的一个主要的限制是,他们紧紧地与DNA结合,因此,在FRAP实验中,他们出现几乎动弹不得。为了达到全面复苏的核心组蛋白,FRAP曲线应该达到几个小时。由于ES细胞具有高度文化的移动,它本质上是技术上无法执行小时长的FRAP实验。为了避免这种情况,可以进行到10分钟FRAP实验和动力学行为的推断从几分钟到几小时。在核心组蛋白相比,大多数DNA结合蛋白迅速联营公司及游离于染色质,在几秒钟秩序造成半衰期短的几分钟,在最 1 。在本文中,我们研究了两种DNA结合蛋白,H1和HP1,无论是在ES细胞的动态,但HP1是较H1(如图1所示)的动态。值得注意的是,这两种染色质蛋白的活力比常染色质少异,因此异漂白后荧光恢复较慢(在图2可以看出)。在异恢复较慢,可能反映了较高浓度的H1和HP1的结合位点,以及分子拥挤。
综上所述,漂白实验提供手段来研究活细胞中染色质的蛋白质动力学,反映了染色质的可塑性,这是夸张的多能干细胞。
披露声明
致谢
我们感谢Meshorer实验室的成员,尤其是晒Melcer,阿迪Alajem,Edupuganti Raghu RAM,巴迪斯里兰卡Sailaja,安娜Mattout和阿尔瓦必然的批评和故障排除漂白实验每天。 EM是约瑟夫H和Belle R.布朗在生命科学学院的高级讲师,是由以色列科学基金会(ISF 943/09),以色列卫生部(6007)欧洲联盟(IRG - 206872和238176)的支持,以色列癌症研究基金会,内部应用性的希伯来大学和以色列精神生物学研究所的医疗补助金。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
|---|---|---|---|
| DMEM培养液 | 西格玛 | D5671 | |
| 明胶 | 默克公司 | 1.04078 | |
| OPTI - MEM | Gibco公司 | 31985 | |
| 中转- LT1 | Mirus | MIR2300 | |
| 8以及μ-幻灯片 | ibidi | 80826 |
参考文献
- Phair, R. D. Global nature of dynamic protein-chromatin interactions in vivo: three-dimensional genome scanning and dynamic interaction networks of chromatin proteins. Mol Cell Biol. 24, 6393-6402 (2004).
- Meshorer, E., Girard, L. . Imaging chromatin in embyonic stem cells in StemBook. , (2008).
- Meshorer, E. Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev Cell. 10, 105-116 (2006).
- Bancaud, A., Huet, S., Rabut, G., Ellenberg, J. . Fluorescence perturbation techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, photoactivation, photo conversion, and FLIP. , (2009).
- Dundr, M., Misteli, T. Measuring dynamics of nuclear proteins by photobleaching. Curr Protoc Cell Biol. Chapter 13, Unit 13-Unit 13 (2003).
- Ellenberg, J. Nuclear membrane dynamics and reassembly in living cells: targeting of an inner nuclear membrane protein in interphase and mitosis. J Cell Biol. 138, 1193-1206 (1997).
- Lenser, T., Weisshart, K., Ulbricht, T., Klement, K., Hemmerich, P. Fluorescence fluctuation microscopy to reveal 3D architecture and function in the cell nucleus. Methods Cell Biol. 98, 2-33 (2010).
- Mueller, F., Mazza, D., Stasevich, T. J., McNally, J. G. FRAP and kinetic modeling in the analysis of nuclear protein dynamics: what do we really know. Curr Opin Cell Biol. 22, 403-411 (2010).
- Phair, R. D., Misteli, T. Kinetic modelling approaches to in vivo imaging. Nat Rev Mol Cell Biol. 2, 898-907 (2001).
- Poser, I. BAC TransgeneOmics: a high-throughput method for exploration of protein function in mammals. Nat Methods. 5, 409-415 (2008).
- Sigal, A. Generation of a fluorescently labeled endogenous protein library in living human cells. Nat Protoc. 2, 1515-1527 (2007).
- Cohen, A. A. Dynamic proteomics of individual cancer cells in response to a drug. Science. 322, 1511-1516 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。