Method Article
سير عمل سريع وبسيط للقياس الكمي لهياكل ذبابة الفاكهة الخارجية للبالغين
In This Article
Summary
هنا ، نقدم سير عمل سريع ومنخفض التكلفة للتصوير عالي الدقة لعيون ذبابة الفاكهة البالغة لتحديد عيوب الزخرفة والنمو. نصف بروتوكولنا لإعداد العينة عن طريق تركيب النقاط والحصول على الصور عالية الدقة وتحليل الصور.
Abstract
ذبابة الفاكهة العين المركبة هي نسيج منقوش بدقة كشف عن الآليات الجزيئية والعمليات البيولوجية التي تدفع التشكل. إنه هيكل بسيط لعيون الوحدة المتكررة ، والتي تسمى ommatidia ، والتي تستخدم لتوصيف التفاعلات الجينية ووظائف الجينات. يمكن اكتشاف الطفرات التي تؤثر على بنية العين وتحليلها بسهولة. ومن ثم، كثيرا ما يستخدم هذا النظام في المؤسسات التي تعاني من نقص الموارد. غالبا ما يتضمن المزيد من التحليل الظاهري المجهر الإلكتروني الماسح (SEM) لتوليد صور عالية التكبير مناسبة للتحليل الكمي. ومع ذلك ، فإن SEMs باهظة الثمن وتتطلب كواشف مكلفة. يمتد تحضير العينة لأيام ؛ وغالبا ما يحتاجون إلى موظفين بدوام كامل لإعداد العينات وصيانة الأدوات. وهذا يحد من فائدتها في المؤسسات التي تعاني من نقص الموارد أو أثناء التقشف في الميزانية. في علم الحشرات ، يعد استخدام تقنية التصوير الرقمي عالي الدقة ممارسة شائعة لتحديد الأنواع وتوصيفها. تصف هذه الورقة طريقة تجمع بين الاستراتيجيات وتسمح بالتصوير الرقمي عالي الدقة لهياكل ذبابة الفاكهة البالغة والتحليل الكمي باستخدام البرنامج المفتوح ImageJ. يعد سير العمل بديلا سريعا وصديقا للطلاب يعالج قيود المرافق البحثية التي تعاني من نقص التمويل ونقص الموارد من خلال نهج فعال من حيث التكلفة وسريع لتحليل النمط الظاهري الكمي.
Introduction
ذبابة الفاكهة السوداء هو كائن حي نموذجي وراثي قوي تم استخدامه لعقود لتوضيح مسارات الإشارات الجزيئية والسلوكيات الخلوية. تم تحديد العديد من مسارات الإشارات المحفوظة تطوريا والتي تعتبر ضرورية للتطور متعدد الخلايا لأول مرة وتحديد آلية عملها في ذبابة الفاكهة. حوالي 65-75٪ من جميع الجينات المرتبطة بالأمراض البشرية لديها أخصائيي تقويم العظام في ذبابة الفاكهة1،2. ذبابة الفاكهة البالغة العين هي نموذج مهم سمح بفحوصات جينية غير متحيزة سهلت اكتشاف الجينات المحفوظة المهمة المتورطة في الأمراض البشرية ، بما في ذلك السرطان3،4 ، والتنكس العصبي5 ، واضطرابات التمثيل الغذائي6.
تتكون عين ذبابة الفاكهة من ~ 800 وحدة عيون ، تسمى ommatidia ، والتي يتم تنظيمها بدقة في نمط سداسي عبر سطح العين البالغة7. يتكون كل أوماتيدييوم من ثمانية خلايا عصبية مستقبلة للضوء تحتل موقعا مميزا داخل شبه منحرف غير متماثل. يتم دعمها بواسطة أربع خلايا مخروطية غير عصبية وخليتين صبغيتين أساسيتين تفرزان العدسة والمخروط الزائف لتركيز الضوء على المخططات المستشعرة للضوء للخلايا العصبية المستقبلة للضوء. يتم فصل ommatidia المجاورة بصف واحد من الخلايا الشبكية interommatidial ، والتي تتكون من خلايا صبغية ثانوية ، وخلايا صبغية ثلاثية ، ومجمعات شعيرات حسية ميكانيكية8،9،10.
تظهر الاضطرابات في نمو العين في عيون البالغين على شكل زيادة أو نقصان حجم العين ، أو وفرة أو بنية غير طبيعية للعدسات أو الشعيرات ، أو "العين الخشنة" حيث يتعطل الزخرفة السداسية الثابتة عادة بحيث لا يمكن متابعة صف من ommatidia عبر سطح العين. يمكن تسجيل هذه الأنماط الظاهرية على مستوى الأنسجة الإجمالية باستخدام مجاهر التشريح. يتضمن التحليل التفصيلي للأنماط الظاهرية تقليديا الفحص المجهري الإلكتروني المتبوعا بالتحليل الكمي للصور11. ومع ذلك ، فإن الفحص المجهري الإلكتروني المسح يتطلب أجهزة باهظة الثمن ، وكواشف مكلفة ، وإعداد عينات تمتد لأيام ، وغالبا ما يكون موظفا بدوام كامل للحفاظ عليه.

الشكل 1: سير العمل لتصوير هياكل ذبابة الفاكهة البالغة. (أ) جمع ذبابة الفاكهة البالغة وإصلاحها في 70٪ من الإيثانول. (ب) إعداد عينات للتصوير عن طريق التركيب النقطي وتثبيته على المسامير. (ج) الحصول على صور عالية الدقة من خلال تكديس التركيز البؤري والتكامل. (د) تحديد الصور كميا باستخدام الفيجي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تقدم هذه الورقة سير عمل غير مكلف نسبيا ، وله وقت قصير لإعداد العينة ، ويمكن إعداده بسهولة على مقعد مختبر بطول 3 أقدام ، ولا يتطلب مواد خطرة ، ويمكن أن يكون إضافة طويلة العمر لمختبرات أبحاث ذبابة الفاكهة (الشكل 1). التثبيت النقطي هو تقنية حشرية تستخدم لتجفيف الحشرات الصغيرة الرخوة في الهواء والحفاظ عليها ، مثل ذبابة الفاكهة12. تعتمد هذه الطريقة على الجمع بين أهداف المجهر وكاميرات DSLR عالية الدقة لتكبير فعال من 10x إلى 1,000x. يتم التغلب على العمق المحدود للمجال المتأصل في التصوير الفوتوغرافي عن طريق تكديس التركيز: تجميع سلسلة من الصور معا مع تحرك المستوى البؤري عبر العينة ذات الأهمية13. تنتج هذه الطريقة صورا عالية الدقة مناسبة لقياس الأنماط الظاهرية ويمكن تكييفها بسهولة مع الهياكل الأخرى ذات الأهمية ، مثل الجناح والساق والصدر والبطن. يستخدم سير عمل تحليل الصور برنامج تحليل الصور المجاني FIJI (NIH ImageJ). تجعل هذه المنهجية إعداد العينات والتصوير عالي الدقة والتحليل في متناول الطلاب الجامعيين والعلماء في المؤسسات التي تعاني من نقص الموارد.
Protocol
1. جمع ذبابة الفاكهة البالغة وتثبيتها
- قم بإعداد صلبان ذبابة الفاكهة أو سلالات مختارة وضعها في قوارير تحتوي على طعام الذباب. احتضان القوارير عند درجة الحرارة المطلوبة (عادة 25 درجة مئوية) حتى يتطور الذباب ويحيط البالغون (~ 10-14 يوما عند 25 درجة مئوية).
- قم بتخدير الذباب ب CO2 وضعه على وسادة ثاني أكسيد الكربون2 .
- قم بفرز الذباب بالريشة وحدد الأفراد الذين لديهم النمط الظاهري المطلوب (على سبيل المثال ، الأجنحة المستقيمة). اصنع فارز ذبابة الريش عن طريق تقليم ريشة الإوزة لتناسب الطرف المدبب لماصة مصلية سعة 1 مل.
- قم بإعداد أنبوب طرد مركزي دقيق سعة 1.7 مل مع 1 مل من 70٪ إيثانول. ضع الذباب المحدد في أنبوب الطرد المركزي الدقيق وضعه على الثلج. قم بتخزين أنابيب الطرد المركزي الدقيقة عند 4 درجات مئوية طوال الليل (الشكل 2 أ).
ملاحظة: لا تحافظ على الذباب في الإيثانول لأكثر من 24 ساعة. سيؤدي التخزين طويل الأمد للذباب في 70٪ من الإيثانول إلى فقدان صبغة العين والجسم.
2. تحضير العينة عن طريق تركيب النقطة
ملاحظة: ذبابة الفاكهة هي حشرات ناعمة الجسم تصبح هشة وتنهار عند تجفيفها بالهواء. لذلك، يتطلب هذا البروتوكول تصوير العينات في نفس اليوم الذي يتم تركيبها فيه. اعمل في مجموعات صغيرة من ~ 5 ذباب في وقت واحد لمنع فقدان العينة. زيادة عدد العينات في مجموعة بناء على الكفاءة. يمكن تجفيف العينات التي تتطلب مزيدا من الوقت قبل التصوير من خلال سلسلة تركيز متزايدة من سداسي ميثيل ديسيلازان (HMDS)14.
- قم بقص النقاط المثلثة الصغيرة (7.1 مم × 2.7 مم) من البطاقات الأرشيفية التي يبلغ وزنها 65 رطلا باستخدام لكمة نقطية متخصصة. قم بإعداد النقاط عن طريق ثني الطرف (أضيق 25٪) بزاوية 90 درجة باستخدام ملقط Dumont # 5 ذو الطرف الدقيق (الشكل 2 ب).
- باستخدام ملقط Dumont # 5 ذو الطرف الدقيق ، قم بإزالة الذباب من أنابيب الطرد المركزي الدقيقة (الخطوة 1.4). امسح الذباب برفق بأنسجة مختبر خالية من النسالة لإزالة الإيثانول الزائد. ضع كل ذبابة على جانبها الأيسر على بطاقة فهرسة تحت مجهر تشريح.
ملاحظة: قم بإزالة الذباب من الأنبوب عن طريق التمسك بهيكل تشريحي ليس منطقة الاهتمام - عند تصوير الرأس ، نحتفظ بعينات من الجناح أو الساق. لا تمسك عينات من البطن ، حيث يتم استخدام هذا الهيكل للصق الذبابة على نقطة البطاقة. - تحضير الغراء المخفي ، وضبط اتساقه على اللزوجة المطلوبة. امزج 1-2 قطرات من غراء الجلد مع 1-2 قطرات من الماء منزوع الأيونات (DI) ، واخلطها مع ماصة نقل على بطاقة فهرسة. التقط نقطة بطاقة معدة في الطرف العريض باستخدام ملقط ، وضع كمية صغيرة من الغراء المخفف على الطرف المنحني للنقطة عن طريق وضعها في مزيج الغراء والماء (الشكل 2 ج).
ملاحظة: يجب أن يكون الغراء قابلا للدهن ولكن ليس سائلا. - ضع الطرف المنحني للنقطة على الجانب الأمامي من البطن الأيمن حول أجزاء البطن 2-3 (الشكل 2 ج). قبل أن يجف الغراء ، قم بإجراء تعديلات طفيفة على الذبابة بحيث يكون المحور الأمامي الخلفي للذبابة عموديا على الطرف المنحني للنقطة.
- أدخل دبوس التثبيت رقم 3 في الطرف العريض لنقطة البطاقة (الشكل 2 د) وثبته في كتلة تثبيت الحشرات (الشكل 2 ه). قم بتسمية كل دبوس أو صف من المسامير بالنمط الجيني المقابل.

الشكل 2: تحضير العينة. (أ) ذبابة الفاكهة البالغة يتم فرز بناء على علامات النمط الظاهري ويتم جمعها في أنابيب طرد مركزي دقيقة مصنفة تحتوي على 70٪ من الإيثانول على الجليد. يتم تخزين الذباب عند 4 درجات مئوية طوال الليل. (ب) يتم تحضير نقاط البطاقة الورقية عن طريق ثني الطرف الضيق بزاوية 90 درجة من باقي البطاقة باستخدام زوج من الملقط # 5. (ج) يتم استرداد الذباب من الأنابيب والسماح له بالجفاف في الهواء لفترة وجيزة. يتم تطبيق إخفاء الغراء على الطرف الصغير المطوي لنقطة البطاقة المعدة ويتم لصقه على الذبابة البالغة في أجزاء البطن 2-3. (د) يتم تثبيت العينات ، مع ملصق تعريف ، على دبوس حشرات من الفولاذ المقاوم للصدأ # 3. (ه) يتم تخزين العينات المثبتة على لوحة عينة حتى تصبح جاهزة للحصول على الصور. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. اكتساب تصوير تكديس التركيز عالي الدقة
- احصل على صور عالية الدقة لعيون الذبابة باستخدام نظام تصوير تكديس التركيز البؤري المجمع والمخصص الذي تم تجميعه وتخصيصه.
- التقط الصور الفوتوغرافية باستخدام هيكل كاميرا DSLR باستخدام عدسة تليفوتوغرافي مقاس 70-200 مم متصلة بهدف مجهر Apo 20x عبر محول عدسة مقاس 77 مم.
- تأكد من إضاءة العينة بفلاش من خلال موزع (الشكل 3).
- تحكم في تحديد موضع Z باستخدام وحدة تحكم Stackshot وسكة ماكرو.
- قم بتوصيل الكاميرا والفلاش والمرحلة الآلية بحامل ثلاثي القوائم من الألومنيوم المؤكسد شديد التحمل.
- ضع كل عينة مثبتة على نقطة على محور مسرح عالمي مع توجيه الرأس بحيث تكون العين متجهة نحو العدسة. قم بإجراء تعديلات على وضع الرأس عن طريق تحريك الرأس برفق باستخدام الملقط.
تنبيه: يمكن أن تؤدي التعديلات الكبيرة والسريعة إلى قطع الرأس عن طريق الخطأ. - مع ربط الكاميرا بجهاز كمبيوتر محمول ، اضبط إعدادات الاكتساب في البرنامج. صور العينات بتكبير 20x باستخدام الإعدادات التالية: قوة الفلاش 1/32 وسرعة الغالق 1/200 وفتحة العدسة F2.8 وISO 400. تأكد من إيقاف تشغيل أي من ميزات التركيز البؤري التلقائي وتثبيت الصورة.
ملاحظة: توازن هذه الإعدادات بين إضاءة الفلاش المثلى وسرعة الغالق وعمق المجال. ستحتاج إلى تعديلها للتكبيرات الأخرى و / أو مجموعات العدسات. - قم بتعيين موقع حفظ مكدس الصور الناتج (10-50 صورة) في مجلد الملفات المطلوب. تأكد من سعة تخزين كافية للصور (~ 8.5 ميجابايت لكل صورة).
- اضبط إعدادات مكدس التركيز البؤري على وحدة التحكم Stackshot في وضع المسافة التلقائية .
- اضبط حجم الخطوة على 5 ميكرومتر واحسب عدد الخطوات عن طريق تعيين موضعي البدء والإيقاف لمكدس التركيز البؤري.
- اعرض العينة في وضع LiveView ومع الكاميرا في وضع التصوير التلقائي لتحديد مواضع البدء والإيقاف.
- حرك السكة بحيث يكون أقرب جزء من العينة في بؤرة التركيز (تعيين موضع البدء ) ، ثم انتقل إلى حيث تكون أبعد ميزة محل الاهتمام في التركيز (تعيين موضع النهاية ).
- أعد الكاميرا إلى وضع التصوير اليدوي وابدأ الحصول على الصورة من وحدة التحكم Stackshot.
ملاحظة: يعتمد وقت الحصول على الصورة على حجم العينة. كلما زاد عمق المجال اللازم للعينات الكبيرة ، تم تضمين المزيد من الشرائح في مكدس الصور ، مما سيطيل وقت الاقتناء الإجمالي. - افتح الملفات في برنامج تكديس التركيز المشار إليه. إنشاء صورة مكدسة بالنقر على مكدس | محاذاة وتكديس الكل (PMax).
- احفظ الصورة النهائية على القرص الصلب للكمبيوتر كملف .tif بالنقر فوق ملف | حفظ صورة الإخراج.
ملاحظة: وفقا لدقة ملف الصورة المكدس وعدد العينات المصورة، قد تكون محركات الأقراص الصلبة الخارجية الكبيرة (1 تيرابايت) ضرورية للنسخ الاحتياطي للصور. في هذا البروتوكول ، يبلغ حجم الصور المكدسة حوالي 100 ميجابايت لكل منها قبل ضغطها.

الشكل 3: الحصول على الصور. (أ) جهاز تصوير بأجزاء تحمل علامة على النحو التالي: أ) جسم كاميرا DSLR؛ ب) عدسة تليفوتوغرافي. ج) هدف ومحول مجهر Apo 20x ؛ د) فلاش؛ ه) ناشرات العدسة والقبة ؛ و) وحدة تحكم Stackshot ، سكة حديد الماكرو ، والمرحلة الدوارة ؛ ز) المرحلة العالمية جيمبال ؛ ح) حامل ثلاثي القوائم. (ب) جهاز تصوير مع موزع ضوء في مكانه. (ج) لقطة مقربة للعينة المركبة في موضعها للتصوير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. سير عمل تحليل فيجي لحساب منطقة العين البالغة
- لتحليل الصور ، احصل على برنامج FIJI15 من موقع الويب ImageJ.net.
- اختر صورا للتحليل حيث تكون العين متمركزة ومحاذاة مع إضاءة كافية والحد الأدنى من الضبابية المحيطية، مما يشير إلى المحاذاة المناسبة مع الكاميرا.
- معايرة مقياس الصورة.
- قم بتنزيل صورة شريط المقياس للتكبير 20x الذي يرتبط ب 500 ميكرومتر. بالتناوب ، في وقت الحصول على الصورة ، قم بتصوير مسطرة باستخدام نفس الإعدادات. افتح الصورة في برنامج FIJI.
- قم بقياس طول شريط المقياس (الشكل 4 أ). استخدم أداة الخط المستقيم لتتبع الخط بالضبط. انقر فوق تحليل | قياس. مسافة البكسل هذه تعادل 500 ميكرومتر (الشكل 4 ب).
- احسب وحدات البكسل لكل ميكرون. استخدم هذا لتحويل قياسات البكسل إلى قياسات ميكرومتر.
- افتح ملف الصورة المكدسة في فيجي (الشكل 4C).
- حدد عدسة مكبرة من شريط الأدوات لتكبير منطقة التركيز. حاول ملء الشاشة بالعين وبشرة الرأس المحيطة مباشرة (الشكل 4 د).
- حدد أداة التحديد اليدوي من شريط الأدوات. حدد منطقة الشبكية بأكبر قدر ممكن ، باتباع ملامح الصف الخارجي من ommatidia (الشكل 4E). لإزالة جزء من التحديد، اضغط باستمرار على زر الخيار وحدد وحدات البكسل المراد إزالتها. للإضافة إلى التحديد، اضغط باستمرار على زري الخيار والتبديل وحدد وحدات البكسل المراد إضافتها.
- لحساب المساحة، حدد تحليل | قم بالقياس من القائمة العلوية (الشكل 4F). ستظهر نافذة جديدة تحتوي على معلمات المنطقة والمتوسط والحد الأدنى والحد الأقصى . انسخ هذه البيانات والصقها في جدول بيانات للتوثيق والتحويل من قياسات البكسل إلى الميكرومتر.
- إجراء التحليلات الإحصائية المناسبة.
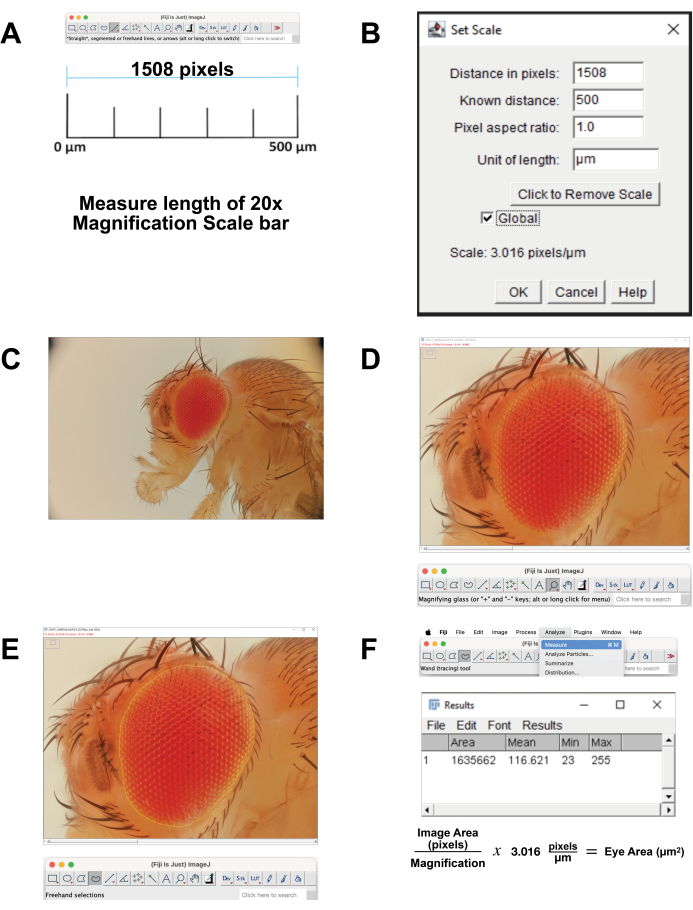
الشكل 4: تحليل الصور في فيجي. (أ) قياس الصورة الأصلية. قم بتنزيل صورة المعايرة وقم بقياس طول شريط 500 ميكرومتر. (ب) اضبط القياس باستخدام وظيفة ضبط المقياس . (ج) افتح الصورة المكدسة. (د) تكبير الصورة بحيث تكون العين في المنتصف وملء الشاشة تقريبا. (ه) استخدم أداة Freehand Select لتحديد العين عند الحد بين الصف الخارجي من ommatidia والبشرة المحيطة. (F) يتم حساب قياس المساحة داخل المنطقة المحددة بالنقر فوق تحليل | قياس | منطقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
ذبابة الفاكهة العين هي نظام نموذجي ممتاز لدراسة زخرفة الأنسجة والتحكم في النمو وموت الخلايا. نشرنا مؤخرا دراسة تبحث في كيفية تأثير الأس الهيدروجيني داخل الخلايا (pHi) على نمو الأنسجة. أولا ، أنشأنا نظاما وراثيا حيث يتسبب الإفراط في التعبير عن مبادل البروتون الصوديوم DNhe2 (تقويم العظام للثدييات NHE1) في العين النامية في حدوث عيوب في الزخرفة وزيادة التكاثر16. لوحظ زيادة التكاثر مع ارتفاع درجة الحموضة عبر الأنواع من الخمائر إلى الثدييات17. ومع ذلك ، لاحظنا أيضا أنه مع زيادة درجة الحموضة ، بدت العين البالغة أصغر حجما مقارنة بالضوابط.
تم إجراء تحليل كمي لمنطقة العين البالغة لتحديد كيف يقلل تعبير DNhe2 المرتفع من حجم الأنسجة في ذبابة الفاكهة . حصلنا أولا على صور منخفضة الدقة باستخدام مجهر إدراج العين (الشكل 5 أ) ، لكنها كانت ذات جودة غير كافية لإجراء القياسات الكمية. على وجه التحديد ، لا يتم التركيز على حواف العين ، مما يمنع القياس الدقيق لمنطقة العين.
قمنا بقياس مساحة كل عين في صور عالية الدقة لعيون ذبابة الفاكهة البالغة (الشكل 5 ب). كان للذباب الذي يعبر عن GMR>DNhe2 عيون أصغر بكثير (متوسط 74.28 ميكرومتر2) من التحكم في الخلفية الجينية مع1118 ذبابة (متوسط 125.83 ميكرومتر2) أو التحكم في السائق GMRGAL4 الذباب غير المتجانس (متوسط 142.49 ميكرومتر2) ، وهو انخفاض بنسبة 41٪ و 48٪ في المساحة ، على التوالي (الشكل 5 ج). يمكن أن يعزى هذا الانخفاض في حجم العين ، على الرغم من زيادة الانتشار ، إلى ارتفاع مستويات موت الخلايا.
تم استخدام جينات الالتهام الذاتي المعروفة ، بما في ذلك Atg1 ، التي تحفز تكوين البلعمة ، في دراسات التفاعل الجيني (الشكل 5). تم قياس التأثيرات على حجم العين البالغة باستخدام التصوير الفوتوغرافي عالي الدقة وتحليل المنطقة (الشكل 5 ب). تمت استعادة حجم العين (129.9 ميكرومتر2 مقابل 74.28 ميكرومتر2) في ذباب GMR>DNhe2 متغاير الزيجوت ل Atg13 مقارنة ب GMR>DNhe2 وحده وكان مشابها لعناصر التحكم (الشكل 5 ج). إلى جانب تحليل العلامات الجزيئية ، تدعم نتائجنا زيادة موت الخلايا الذاتية عند ارتفاع درجة الحموضة.

الشكل 5: إنقاذ انخفاض حجم الشبكية المرتبط بزيادة درجة الحموضة داخل الخلايا مع انخفاض الالتهام الذاتي. (أ) صور منخفضة الدقة لعيون ذبابة البالغين تم التقاطها بمجهر إدراج العين. (ب) صور عالية الدقة لعيون الذبابة البالغة تستخدم لقياس حجم العين للأنماط الجينية التالية: ث1118؛ GMRGAL4. GMR>DNhe2; GMRGAL4. ATG13; GMR>DNhe2; Atg13. (ج) كان متوسط أحجام عيون البالغين المقاسة: w1118 (125.83 μm2 ، N = 7) ؛ GMRGAL4 (142.49 ميكرومتر2 ، N = 9) ، و GMR>DNhe2 (74.28 ميكرومتر2 ، N = 6) ، GMRGAL4 ؛ Atg13 (146.4 ميكرومتر2 ، N = 15) ؛ GMR>DNhe2; Atg13 (129.9 ميكرومتر2 ، N = 19) ويشار إليه بإظهار القيم المتوسطة مع نطاقات الربيعية. تم تحديد الدلالة الإحصائية من خلال اختبارات t غير المزاوجة مع تصحيح ويلش. تم نشر البيانات في B و C سابقا18. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يتم تعزيز استنتاجاتنا من خلال إعداد العينة والتصوير عالي الدقة والتحليل الموصوف هنا. سمحت هذه الطرق بوصف دقيق وكمي لحجم عيون ذبابة الفاكهة البالغة ذات الأنماط الجينية المختلفة. نواصل استخدام هذا النهج لتقييم التفاعلات الجينية الأخرى التي من شأنها توضيح آليات التحكم في النمو المعتمد على الأس الهيدروجيني.
Discussion
نصف هنا طريقة لإعداد العينة والتصوير عالي الدقة وتحليل هياكل ذبابة الفاكهة البالغة. ذبابة الفاكهة هي نظام نموذجي قابل للتتبع وراثيا أسفر عن رؤى مهمة حول الآليات الجزيئية الكامنة وراء الأمراض بما في ذلك السرطان19 والتنكس العصبي20 وأمراض التمثيل الغذائي21. على وجه الخصوص ، يتم إنشاء "الصور الرمزية" لمرضى السرطان حيث يتم إنشاء ذبابة الفاكهة المعدلة وراثيا التي تحمل طفرات الأورام ويمكن استخدامها لفحص الأدوية عاليةالإنتاجية 22. على الرغم من أننا نركز على العين البالغة ، إلا أنه يمكن تكييف هذا البروتوكول لتحليل الهياكل الأخرى ذات الأهمية مثل الجناح والساق والصدر والبطن.
المهارات الحركية الدقيقة مطلوبة في عدة خطوات حاسمة من هذا البروتوكول. يتطلب تحضير عينة ذبابة الفاكهة البالغة عن طريق التثبيت على النقاط الصبر والممارسة. ننصح المبتدئين بممارسة تركيب النقاط قبل تحضير عينات نادرة أو ثمينة. هناك العديد من الخطوات الحاسمة التي تتطلب ممارسة المهارات الحركية الدقيقة والاهتمام الدقيق.
الخطوات الحاسمة الأولى في البروتوكول هي إعداد نقاط البطاقة وتطبيق الغراء للصق نقطة البطاقة على البطن (خطوة البروتوكول 2.4-2.5). من المهم تطبيق الكمية المناسبة من الغراء لأن الهياكل التشريحية المستهدفة (أي الرأس) قد تكون مغطاة بالغراء إذا تم تطبيق الكثير منها أو لم يكن الاتساق الصحيح. يجب أيضا لصق العينة في وضع مناسب ، مع وجود المحور الأمامي الخلفي عموديا على دبوس التثبيت. الخطوة الحاسمة الثانية هي وضع الرأس للتصوير عالي الدقة (خطوة البروتوكول 3.2). من الأهمية بمكان أن يكون الرأس موجها مع مواجهة العين لعدسة الكاميرا. لضبط الرأس ، يتم إجراء تعديلات صغيرة باستخدام ملقط. تعتبر الحركات اللطيفة والتدريجية أمرا بالغ الأهمية حيث قد يحدث قطع الرأس العرضي مع تعديلات كبيرة أو قوية. هناك خطوة إضافية تتطلب مهارات حركية دقيقة وهي استخدام أداة التحديد اليدوي من شريط أدوات فيجي (خطوة البروتوكول 4.6). هنا ، من الأهمية بمكان تتبع الصف الخارجي للعين قدر الإمكان. هذه الدقة هي المفتاح لقياسات منطقة العين الصارمة والقابلة للتكرار (الشكل 4E).
تظل طرق التصوير مثل الفحص المجهري الإلكتروني الماسح (SEM) هي النهج الأساسي لتصور وتحليل الهياكل الخارجية. ومع ذلك ، تتطلب بروتوكولات SEM من المستخدم التعامل مع المواد الكيميائية الخطرة وتشغيل أدوات متعددة ، بما في ذلك مجففات النقاط الحرجة وأجهزة طلاء الرش والتسويق عبر محرك البحث نفسه. يستغرق تحضير العينة عدة أيام ويتطلب تدريبا ومهارة مكثفة. يتمثل التحدي الكبير الذي تواجهه المؤسسات الأكاديمية في الاستثمار المالي والالتزام بصيانة الأداة ، وفي تجربتنا ، لا يتم دعم الموظفين ذوي الخبرة في صيانة وتشغيل هذه المعدات بشكل عام على المستوى المؤسسي. يخفف بروتوكولنا من التكلفة ويزيل التعرض للمواد الكيميائية الخطرة على حساب التصوير منخفض الدقة مقارنة بالتسويق عبر محرك البحث.
كان النظام الموصوف في هذه الدراسة عبارة عن حزمة مجمعة مسبقا ، لكن طبيعتها المعيارية تسمح بخفض التكلفة عن طريق استبدال المكونات الفردية بمعدات مصنعة داخليا (على سبيل المثال ، مراحل العينة ، أو ناشرات الفلاش) ، أو العلامات التجارية أو النماذج البديلة ، أو المعدات التي قد تكون موجودة بالفعل في المختبر. في حين أن ربط أهداف المجهر بكاميرات الماكرو تزداد شعبية بين الهواة والمصورين المحترفين ، فقد تكون هناك حاجة إلى بعض التجربة والخطأ لمجموعات مختلفة من الأهداف والعدسات. لتكرار النظام الموصوف هنا ، يجب توصيل هدف المجهر المصحح اللانهائي بعدسة أنبوبية (عدسة تليفوتوغرافي هنا) بمحول مترابط ملولب بشكل مناسب. هناك اعتبار آخر عند تبادل المكونات وهو التأكد من أن مسافة عمل العدسة متوافقة مع أبعاد حامل الكاميرا وحامل العينة وسكة التركيز البؤري الكلي. أخيرا ، يعد برنامج تكديس التركيز المحدد هنا تجاريا ، ولكن توجد العديد من حلول تكديس التركيز منخفضة التكلفة أو المجانية بعد المعالجة ، بما في ذلك مكونات ImageJ الإضافية.
في حين أن هذا البروتوكول يتطلب ممارسة لإتقان تقنيات معالجة العينات ، إلا أنه مصمم للحصول على صور عالية الدقة وتحليلها لتحليل النمط الظاهري التفصيلي. تشكل الإجراءات المعروضة هنا بديلا سريعا ومنخفض التكلفة لمنهجيات التصوير التقليدية. باستخدام تقنيات التصوير الرقمي المستندة إلى البرامج المجانية للتحليل الكمي، يمكن الوصول إلى منهجيتنا ولن تتطلب عمليات شراء أو تحديثات برامج مكلفة. يتطلب إعداد التصوير بعض التكلفة والجهد ولكن بمجرد إنشائه ، يجب أن يكون إضافة طويلة الأمد لمختبرات ذبابة الفاكهة . تنتج هذه الطريقة صورا عالية الدقة مناسبة لقياس الأنماط الظاهرية ويمكن تكييفها بسهولة مع الهياكل الأخرى ذات الأهمية ، مثل الجناح والساق والصدر والبطن. تجعل هذه المنهجية إعداد العينات والتصوير عالي الدقة والتحليل في متناول الطلاب الجامعيين والعلماء في المؤسسات التي تعاني من نقص الموارد.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
يود المؤلفون أن يشكروا أعضاء مختبر Grillo-Hill pHly على المناقشات والدعم. نشكر تيم أندريس وراندي كيرشنر وكيتي (نجوك هونغ) نجوين وماركو بارنت وجوني شالوب وليبرادو فيليز على الدعم الفني الممتاز. تم دعم هذا العمل من قبل جوائز المعاهد الوطنية للصحة SC3GM132049 و 1R16GM153640 (BKGH) ، وجائزة أبحاث أعضاء هيئة التدريس والطلاب في جامعة CSU للتكنولوجيا الحيوية (LM و BKGH) ، وأموال بدء التشغيل من كلية العلوم وقسم العلوم البيولوجية في جامعة ولاية سان خوسيه (FJL). تنويه خاص إلى بيرند بيكر لسعة حيلتهم ومساعدتهم خلال هذه العملية. نشكر مجتمع BioIcons (https://bioicons.com/) على توفير أيقونات عالية الجودة لشخصياتنا وخاصة Serviere لأيقونة الماصة ، و DBCLS لذبابة الفاكهة ، والملقط ، وأيقونات المجهر الإلكتروني المكتبي المستخدمة في الشكل 1 والشكل 2 ، والتي تم ترخيصها بموجب CC-BY 4.0 Unported. نشكر أيضا مجتمع SciDraw (https://scidraw.io/) على توفير أيقونات عالية الجودة لشخصياتنا ، وخاصة Diogo Losch De Oliveira (doi.org/10.5281/zenodo.3925953) ، المرخصة بموجب ترخيص المشاع الإبداعي 4.0 (CC-BY).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL serological pipette | ThermoFisher Scientific | 170353N | |
| 1.7 mL microcentrifuge tubes | Genesee Scientific | 24-282LR | |
| 20x Apo Microscope Objective | Mitutoyo Corp. | 378-804-3 | |
| Archival 65 lb cardstock | Neenah, Inc. | 91901 | |
| Canon EF 70-200 mm USM II telephoto lens | Canon | 3044C002 | |
| Canon EOS 6D Mark II DSLR Camera Body | Canon | 1897C002 | |
| Diffuser Dome | Macroscopic Solutions | PA-DIF-GIM-SM | |
| Diffuser for Mitutoyo M Plan APO Objectives | Macroscopic Solutions | mitutoyo-diffusers | |
| Drosophila vials and plugs | Genesee Scientific | 32-117BF | |
| Dumont #5 fine-tip forceps | Fisher Scientific | NC9889584 | |
| Goose feathers | Amazon | B01CMMJI6U | |
| Heavy-Duty Anodized Aluminum Tripod | Really Right Stuff, LLC | TFA-32G | |
| Kimwipes | Fisher Scientific | 06-666A | lint-free lab tissue |
| Levenhuk M1000 Plus Digital Camera | Levenhuk | 70358 | |
| No. 3 mounting pin | Indigo Instruments | 33414-3 | |
| Nutri-Fly Bloomington Drosophila media | Genesee Scientific | 66-113 | fly food |
| Point-Punch | M.C. Mieth Manufacturing, Inc. | 448Detail | |
| Screwknob Clamp | Really Right Stuff, LLC | SK-Clamp | For attaching the macro rail to the tripod |
| Stackshot Controller and Macro Rail | Cognisys Inc. | ST3X_100_BUNDLE | |
| Step-down Ring Adapter | RAF Camera | 763461174207 | Lens adapter to connect the microscope objective to the camera lens |
| Titebond Glue | Franklin International | 5013 | |
| Yongnuo YN-24-EX Macro Twin Lite Flash | Shenzhen Yongnuo Photographic Equipment Co. | YN-24EX | |
| Software | |||
| Canon EOS Utility (v. 3.16.1). | Canon | acquisition software | |
| FIJI | National Institutes of Health | Fiji is released as open source under the GNU General Public License. FIJI Version 2.14.0/1.54f | |
| GraphPad Prism | GraphPad Software, Boston, Massachusetts USA | Prism Version 10.3.1 | |
| Zerene Stacker (v.1.04) | Zerene Systems, LLC | Focus Stacking Software |
References
- Rubin, G. M., et al. Comparative genomics of the eukaryotes. Science. 287 (5461), 2204-2215 (2000).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9 (3), 235-244 (2016).
- Hodgson, J. A., Parvy, J. -. P., Yu, Y., Vidal, M., Cordero, J. B. Drosophila larval models of invasive tumorigenesis for in vivo studies on tumour/peripheral host tssue interactions during cancer cachexia. Int J Mol Sci. 22 (15), 8317 (2021).
- Lam Wong, K. K., Verheyen, E. M. Metabolic reprogramming in cancer: mechanistic insights from Drosophila. Dis Model Mech. 14 (7), dmm048934 (2021).
- Bonini, N. M. A perspective on Drosophila genetics and its insight into human neurodegenerative disease. Front Mol Biosci. 9, e1060796 (2022).
- Drummond-Barbosa, D., Tennessen, J. M. Reclaiming Warburg: using developmental biology to gain insight into human metabolic diseases. Development. 147 (11), dev189340 (2020).
- Ready, D. F., Hanson, T. E., Benzer, S. Development of the Drosophila retina, a neurocrystalline lattice. Dev Biol. 53 (2), 217-240 (1976).
- Johnson, R. I. Hexagonal patterning of the Drosophila eye. Dev Biol. 478, 173-182 (2021).
- Weasner, B. P., Kumar, J. P. The early history of the eye-antennal disc of Drosophila melanogaster. Genetics. 221 (1), iyac041 (2022).
- Pichaud, F., Casares, F. Shaping an optical dome: The size and shape of the insect compound eye. Semin Cell Dev Biol. 130, 37-44 (2022).
- Oster, I. I., Crang, R. E. Scanning electron microscopy of Drosophila mutant and wild type eyes. Trans Am Microsc Soc. 91 (4), 600-602 (1972).
- Gibb, T. J., Oseto, C. . Insect collection and identification: Techniques for the field and laboratory. , (2019).
- Mertens, J., Roie, M. V., Merckx, J., Dekoninck, W. The use of low cost compact cameras with focus stacking functionality in entomological digitization projects. ZooKeys. 712, 141-154 (2017).
- Brown, B. V. A further chemical alternative to critical-point-drying for preparing small (or large) flies. Fly Times. 11, 10 (1993).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Method. 9 (7), 676-682 (2012).
- Grillo-Hill, B. K., Choi, C., Jimenez-Vidal, M., Barber, D. L. Increased H+ efflux is sufficient to induce dysplasia and necessary for viability with oncogene expression. eLife. 4, e03270 (2015).
- White, K. A., Grillo-Hill, B. K., Barber, D. L. Cancer cell behaviors mediated by dysregulated pH dynamics at a glance. J Cell Sci. 130 (4), 663-669 (2017).
- Peralta, J., et al. Drosophila Nhe2 overexpression induces autophagic cell death. Mol Biol Cell. 35 (7), br13 (2024).
- Munnik, C., Xaba, M. P., Malindisa, S. T., Russell, B. L., Sooklal, S. A. Drosophila melanogaster: A platform for anticancer drug discovery and personalized therapies. Front Genet. 13, 949241 (2022).
- Nitta, Y., Sugie, A. Studies of neurodegenerative diseases using Drosophila and the development of novel approaches for their analysis. Fly. 16 (1), 275-298 (2022).
- Pletcher, R. C., et al. A genetic screen using the Drosophila melanogaster TRiP RNAi collection to identify metabolic enzymes required for eye development. G3: Genes|Genomes|Genetics. 9 (7), 2061-2070 (2019).
- Bangi, E., et al. A personalized platform identifies trametinib plus zoledronate for a patient with KRAS-mutant metastatic colorectal cancer. Sci Adv. 5 (5), eaav6528 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved