Method Article
استخدام الجسيمات النانوية الدهنية لتوصيل الرنا المرسال المعدل كيميائيا إلى خلايا الثدييات
In This Article
Summary
يقدم البروتوكول النسخ في المختبر (IVT) ل mRNA المعدل كيميائيا ، وإعداد الجسيمات الشحمية الموجبة ، والتحليل الوظيفي لتعداء mRNA التي تدعم الجسيمات الشحمية في خلايا الثدييات.
Abstract
في السنوات الأخيرة ، ظهر الحمض النووي الريبي المرسال المعدل كيميائيا (mRNA) كجزيء قوي للحمض النووي لتطوير مجموعة واسعة من التطبيقات العلاجية ، بما في ذلك فئة جديدة من اللقاحات وعلاجات بدائل البروتين والعلاجات المناعية. من بين ناقلات التوصيل ، وجد أن الجسيمات النانوية الدهنية أكثر أمانا وفعالية في توصيل جزيئات الحمض النووي الريبي (على سبيل المثال ، siRNA و miRNA و mRNA) وبعض المنتجات قيد الاستخدام السريري بالفعل. لإثبات توصيل mRNA بوساطة الجسيمات الدهنية النانوية ، نقدم بروتوكولا محسنا لتخليق mRNA الوظيفي المعدل eGFP ، وتحضير الجسيمات الشحمية الموجبة ، والتكوين المركب الكهروستاتيكي ل mRNA مع الجسيمات الشحمية الموجبة ، وتقييم كفاءات التعدي في خلايا الثدييات. توضح النتائج أن هذه التعديلات حسنت بكفاءة من استقرار mRNA عند تسليمها مع الجسيمات الشحمية الموجبة وزادت من كفاءة ترجمة eGFP mRNA واستقرارها في خلايا الثدييات. يمكن استخدام هذا البروتوكول لتصنيع mRNA المطلوب وtransfect مع الجسيمات الشحمية الموجبة للتعبير الجيني المستهدف في خلايا الثدييات.
Introduction
كجزيء علاجي ، يوفر mRNA العديد من المزايا نظرا لطبيعته غير التكاملية وقدرته على نقل الخلايا غير الانقسامية عند مقارنته بالحمض النووي البلازميدي (pDNA)1. على الرغم من أن توصيل mRNA قد تم إثباته في أوائل التسعينيات ، إلا أن التطبيقات العلاجية كانت محدودة بسبب افتقارها إلى الاستقرار ، وافتقارها إلى التنشيط المناعي ، وضعف كفاءةالترجمة 2. ساعدت التعديلات الكيميائية التي تم تحديدها مؤخرا ، مثل pseudouridine 5'-triphosphate (Ψ-UTP) وميثيل pseudouridine 5'-triphosphate (me1Ψ-UTP) على mRNA ، في التغلب على هذه القيود ، وأحدثت ثورة في أبحاث mRNA ، وبالتالي جعلت mRNA أداة واعدة في كل من البحوث الأساسية والتطبيقية. يغطي نطاق التطبيقات توليد iPSCs للتطعيم والعلاج الجيني 3,4.
بالتوازي مع التقدم في تقنية mRNA ، جعلت التطورات الكبيرة في أنظمة التوصيل غير الفيروسية توصيل mRNA فعالة ، مما يجعل هذه التكنولوجيا ممكنة للتطبيقات العلاجية المتعددة5. من بين النواقل غير الفيروسية ، وجد أن الجسيمات النانوية الدهنية فعالة في توصيل الأحماض النووية6،7. في الآونة الأخيرة ، حصلت Alnylam على موافقة إدارة الغذاء والدواء الأمريكية (FDA) على أدوية siRNA القائمة على الدهون لعلاج أمراض الكبد ، بما في ذلك Patisiran للداء النشواني بوساطة الترانسثيرتين الوراثي (hATTR amyloidosis) و Givosiran للبورفيريا الكبدية الحادة (AHP) 8. خلال جائحة COVID19 ، أثبتت اللقاحات القائمة على mRNA المغلفة بالدهون من Pfizer-BioNtech و Moderna فعاليتها وحصلت على موافقات إدارة الغذاء والدواءالأمريكية 9,10. وبالتالي ، فإن توصيل mRNA الذي يمكن للدهون له إمكانات علاجية كبيرة.
هنا ، نصف بروتوكولا مفصلا لإنتاج eGFP mRNA المعدل كيميائيا ، في المختبر ، وإعداد الجسيمات الشحمية الموجبة ، وتحسين مركب mRNA-lipid والتعدين في خلايا الثدييات (الشكل 1).
Protocol
1. إنتاج mRNA معدل me1 Ψ-UTP
- تحضير قالب الحمض النووي في المختبر (IVT)
ملاحظة: بالنسبة لإعداد قالب الحمض النووي IVT (محفز T7 - إطار القراءة المفتوح (ORF) للجين) ، قم بتصميم مجموعة تمهيدية خاصة بالجين محل الاهتمام. أضف تسلسل محفز T7 (5'-NNNNNNTAATACGACTCACTATAGGGNNNNNN-3') قبل التمهيدي الأمامي الخاص بالجين.- تحضير خليط تفاعل تفاعل البوليميراز المتسلسل كما هو موضح في الجدول 1.
ملاحظة: قم بتشغيل ما لا يقل عن أربعة تفاعلات تفاعل البوليميراز المتسلسل لزيادة تركيز وجودة قالب الحمض النووي IVT ل IVT. - امزج خليط التفاعل تماما مع ماصة دقيقة وقم بتدويرها باستخدام جهاز ميكروفوج.
- قم بتشغيل بروتوكول تدوير PCR الوارد في الجدول 2 على جهاز تدوير حراري.
- تحضير خليط تفاعل تفاعل البوليميراز المتسلسل كما هو موضح في الجدول 1.
- تنقية قالب الحمض النووي IVT عن طريق الاستخراج العضوي / ترسيب الإيثانول
- اضبط خليط تفاعل تفاعل البوليميراز المتسلسل المضخم إلى 200 ميكرولتر إجمالا باستخدام الماء المعالج ب DEPC في أنبوب ميكرو فوج سعة 1.5 مل (خال من النوكلياز).
- أضف 200 ميكرولتر من الفينول / الكلوروفورم المشبع ب TE ، الرقم الهيدروجيني 8.0. دوامة بقوة لمدة 10 ثوان.
- جهاز طرد مركزي عند 12,000 × جم لمدة 5 دقائق لفصلالمراحل ونقل المرحلة العليا المائية (حوالي 200 ميكرولتر) إلى أنبوب جديد 1.5 مل ميكرو فوج.
- أضف 1/10( 20 ميكرولتر) حجم من 3 M من أسيتات الصوديوم ، ودرجة الحموضة 5.5 ومجلدين (400 ميكرولتر) من 99-100٪ إيثانول. تخلط جيدا ثم تحتضن لمدة 30 دقيقة على الأقل عند -20 درجة مئوية.
- بيليه قالب الحمض النووي عن طريق الطرد المركزي عند 12,000 × جم لمدة 15 دقيقة عند 4 درجات مئوية.
- قم بإزالة المادة الطافية تماما دون إزعاج الحبيبات باستخدام ماصة دقيقة.
- أضف 0.5 مل من 75٪ من الإيثانول إلى الحبيبات واقلبها 5-10 مرات.
- جهاز طرد مركزي لمدة دقيقتين عند 12,000 × جم عند 4 درجات مئوية. ثم قم بإزالة الإيثانول تماما باستخدام ماصة دون إزعاج الحمض النووي.
- اترك الحبيبات تجف في درجة حرارة الغرفة حتى تصبح الحبيبات شفافة قليلا.
- أضف 20 ميكرولتر من الماء الخالي من النوكلياز وأعد تعليقه جيدا لبضع ثوان.
- مراقبة الجودة لقالب IVT DNA المنقى
- التحديد الكمي
- قم بقياس تركيز وجودة قالب الحمض النووي IVT المنقى باستخدام مقياس الطيف الضوئي الدقيق.
ملاحظة: سيكون تركيز الحمض النووي المتوقع حوالي 300-600 نانوغرام / ميكرولتر ، قم بتخزين قالب الحمض النووي IVT عند -20 درجة مئوية على المدى الطويل.
- قم بقياس تركيز وجودة قالب الحمض النووي IVT المنقى باستخدام مقياس الطيف الضوئي الدقيق.
- الرحلان الكهربائي لهلام الاغاروز الحمض النووي
ملاحظة: تهدف هذه التجربة إلى التحقق مما إذا كان قالب الحمض النووي IVT المنقى هو الحجم الصحيح وخالي من تلوث المنتج غير المحدد.- لتحضير جل الاغاروز بنسبة 1٪ ، أضف 0.5 جم من الاغاروز و 50 مل من 1x TAE في قارورة مخروطية الشكل. ضعه في الميكروويف حتى يذوب الاغاروز تماما. تبرد الاغاروز في درجة حرارة الغرفة لمدة 5 دقائق.
- أضف 1 ميكرولتر من صبغة الحمض النووي (صبغة SafeView) لمحلول الاغاروز سعة 50 مل.
- صب محلول الاغاروز في صينية صب الجل بمشط واتركه حتى يتجمد الجل.
- أخرج المشط من الجل واحتفظ بالجل في خزان 1x TAE المخزن مؤقتا.
- امزج 10 ميكرولتر من سلم الحمض النووي 100-10000 نقطة أساس و 100-200 نانوغرام من منتج القالب المنقى PCR مع 2 ميكرولتر من المخزن المؤقت لتحميل الحمض النووي 6x بحجم إجمالي قدره 12 ميكرولتر.
- قم بتحميل كل عينة على الآبار المعنية وقم بتشغيلها عند 100 فولت لمدة 45-60 دقيقة على الأقل.
- تصور نطاقات الحمض النووي على أداة توثيق الهلام (الشكل 2).
- التحديد الكمي
- تخليق الحمض النووي الريبي المعدل me1Ψ-UTP
ملاحظة: قبل البدء في هذه التجربة ، يجب تنظيف منطقة العمل (تدفق الهواء الرقائقي) بنسبة 70٪ من الإيثانول في المياه المعالجة ب DEPC. استخدم أنابيب معقمة خالية من النوكلياز والسموم الداخلية ومنخفضة الاحتجاز وأطراف حاجز المرشح. ضع 70٪ من الإيثانول بشكل متكرر على الأيدي التي ترتدي القفازات.- قم بإعداد خليط تفاعل IVT كما هو موضح في الجدول 3 في درجة حرارة الغرفة في أنبوب 0.2 مل واخلطه جيدا باستخدام ماصة دقيقة.
- قم بتدوير الأنبوب لمدة 10 ثوان في جهاز ميكروفوج.
- احتضن عند 37 درجة مئوية لمدة 3 ساعات في الدراجة الحرارية.
- تدهور قالب الحمض النووي IVT بواسطة علاج DNase 1
- أضف 1 ميكرولتر من 1 U / μL DNase 1 (خالي من RNase) إلى مزيج تفاعل IVT واحتضنه عند 37 درجة مئوية لمدة 30 دقيقة.
- تنقية الحمض النووي الريبي عن طريق الاستخراج العضوي / ترسيب أسيتات الأمونيوم
- اضبط حجم مزيج تفاعل IVT إلى 200 ميكرولتر مع 179 ميكرولتر من المياه المعالجة DEPC.
- أضف 200 ميكرولتر من الهيدروجيني المشبع بالفينول / الكلوروفورم 8.0. دوامة لمدة 10 ثوان.
- جهاز طرد مركزي عند 12,000 × جم لمدة 5 دقائق عند 25 درجة مئوية لفصل المرحلتين.
- انقل المرحلة العلوية المائية (200 ميكرولتر) إلى أنبوب 1.5 مل وأضف 200 ميكرولتر من أسيتات الأمونيوم 5 أم. تخلط جيدا ثم تحتضن لمدة 15 دقيقة على الجليد لتسريع الحمض النووي الريبي.
- قم بحبيبات الحمض النووي الريبي المترسب عن طريق الطرد المركزي عند 12,000 × جم لمدة 15 دقيقة عند 4 درجات مئوية وقم بإزالة المادة الطافية تماما باستخدام ماصة دقيقة.
- اغسل حبيبات الحمض النووي الريبي باستخدام 70٪ إيثانول واقلبها 5-10 مرات. جهاز طرد مركزي عند 12,000 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بإزالة المادة الطافية تماما باستخدام ماصة دقيقة دون إزعاج حبيبات الحمض النووي الريبي.
- اترك الحبيبات تجف في درجة حرارة الغرفة حتى تصبح الحبيبات شبه شفافة. ثم أعد تعليق الحبيبات في 60-75 ميكرولتر من الماء الخالي من RNase.
- مراقبة الجودة للحمض النووي الريبي المنقى
- التحديد الكمي
- قم بقياس تركيز الحمض النووي الريبي المنقى وجودته باستخدام مقياس الطيف الضوئي الدقيق.
ملاحظة: سيكون عائد الحمض النووي الريبي المتوقع 140-180 ميكروغرام للحمض النووي الريبي غير المعدل و 100-150 ميكروغرام للحمض النووي الريبي المعدل me1Ψ-UTP لكل تفاعل ، اعتمادا على حجم الجين محل الاهتمام وجودة قالب الحمض النووي IVT. وينبغي أن تكون النوعية المثلى نسبة OD260/OD280 حوالي 1.9-2.0 ونسبةOD 260/OD230 >2.0. قم بتخزين الحمض النووي الريبي عند -20 درجة مئوية لفترة قصيرة.
- قم بقياس تركيز الحمض النووي الريبي المنقى وجودته باستخدام مقياس الطيف الضوئي الدقيق.
- تغيير طبيعة الرحل الكهربائي لهلام الاغاروز الحمض النووي الريبي
ملاحظة: يتم إجراء هذه التجربة للتحقق مما إذا كان الحمض النووي الريبي المركب بالطول الصحيح وخاليا من تلوث المنتج الثانوي IVT.- لتحضير جل الاغاروز بنسبة 1٪ ، أضف 0.5 جم من الاغاروز و 50 مل من 1x TAE في قارورة مخروطية الشكل. ضعي المحلول في الميكروويف حتى يذوب الاغاروز تماما. احتفظ بمحلول الاغاروز في درجة حرارة الغرفة لمدة 5 دقائق حتى يبرد.
- أضف 1 ميكرولتر من صبغة الحمض النووي لمدة 50 مل من محلول الاغاروز 1٪.
- صب محلول الاغاروز في صينية صب الجل بمشط واتركه حتى يتجمد الجل.
- أخرج المشط من الجل واحتفظ بالجل في خزان 1x TAE المخزن مؤقتا.
- قم بإعداد عينة صبغة تحميل الحمض النووي الريبي كما هو موضح في الجدول 4.
- سخني العينات على حرارة 65 درجة مئوية لمدة 10 دقائق ثم احتفظي بالعينات على الثلج.
- قم بتحميل كل عينة على الآبار المعنية وقم بتشغيلها بسرعة 100 فولت لمدة 45-60 دقيقة على الأقل.
- تصور نطاقات الحمض النووي الريبي على أداة توثيق هلام (الشكل 3).
- التحديد الكمي
- تخليق mRNA المعدل me1Ψ-UTP عن طريق السد الأنزيمي ومخلفات poly-A
ملاحظة: كفاءة السد ل IVT RNA باستخدام الطريقة الأنزيمية هي 100٪. ومن ثم ، استخدمنا السد الأنزيمي ل Cap-1 في تخليق mRNA في هذا البروتوكول. أضفنا ذيول بولي أ بطول >150 قاعدة أمبير لكل جزيء لتحسين الكفاءة الانتقالية ل mRNA.- أضف 55-60 ميكروغرام من الحمض النووي الريبي IVT المنقى واجعله يصل إلى 72 ميكرولتر باستخدام الماء الخالي من RNase في أنبوب سعة 1.5 مل.
- قم بتغيير طبيعة الحمض النووي الريبي عند 65 درجة مئوية لمدة 10 دقائق في خلاط حراري ثم ضع الأنبوب على الفور على الجليد لمدة 5 دقائق.
- في هذه الأثناء ، قم بإعداد خليط تفاعل السد كما هو موضح في الجدول 5.
- أضف خليط تفاعل السد و 4 ميكرولتر من إنزيم السد إلى الحمض النووي الريبي المشوه واخلطه جيدا بواسطة الماصة الدقيقة. قم بتدوير الأنبوب لمدة 10 ثوان في جهاز ميكروفوج.
- احتضان خليط التفاعل عند 37 درجة مئوية لمدة ساعتين.
- بعد ساعتين ، احتفظ بالأنبوب على الجليد وقم بإعداد مزيج المخلفات الرئيسي Poly A كما هو موضح في الجدول 6.
- أضف مزيج المخلفات الرئيسي Poly A إلى محلول الحمض النووي الريبي المغطى واخلطه جيدا بواسطة الماصة الدقيقة. قم بتدوير الأنبوب لمدة 10 ثوان في جهاز ميكروفوج.
- احتضان خليط التفاعل عند 37 درجة مئوية لمدة ساعتين.
ملاحظة: يمكن إخضاع mRNA للتنقية على الفور ، أو يمكن تخزين mRNA الخام عند -20 درجة مئوية بين عشية وضحاها.
- تنقية IVT mRNA
- قم بتنقية mRNA عن طريق الاستخراج العضوي / ترسيب أسيتات الأمونيوم كما هو موضح في قسم البروتوكول 1.6.
- أعد تعليق حبيبات mRNA ب 60 ميكرولتر من الماء الخالي من RNase.
- مراقبة الجودة لل mRNA المنقى
- اتبع بروتوكول مراقبة الجودة كما هو موضح في القسم 1.7 من البروتوكول.
ملاحظة: يجب أن يظهر نطاق mRNA فوق نطاق الحمض النووي الريبي بسبب إضافة مخلفات Poly-A في الرحلان الكهربائي لهلام الاغاروز الحمض النووي الريبي المتغير (الشكل 3). أيضا ، يزيد مخلفات Poly-A من إنتاجية mRNA (يجب أن يكون > تركيز الحمض النووي الريبي). بعد القياس الكمي ، ضع حصصا متعددة من mRNA بتركيز 1 ميكروغرام / ميكرولتر وقم بتخزينها على الفور عند -80 درجة مئوية. تجنب دورات التجميد والذوبان المتعددة للحمض النووي الريبي لمنع تدهور الرنا المرسال المركب.
- اتبع بروتوكول مراقبة الجودة كما هو موضح في القسم 1.7 من البروتوكول.
2. تحضير الجسيمات الشحمية الموجبة وتقييم خصائص تعداء الحمض النووي الريبي المرسال في المختبر
- تحضير الجسيمات الشحمية
- لتحضير الجسيم الشحمي الكاتيوني 1 ملي مولار ، استخدم الدهون الكاتيونية: DOPE: الكوليسترول في النسبة المولية 1: 1: 0.5.
- قم بإذابة النسب المولية المناسبة للدهون الموجبة والكوليسترول و DOPE (1،2-dioleoyl-sn-glycerol-3-phosphoethanolamine) في الكلوروفورم (200 ميكرولتر) في قارورة زجاجية.
- استخدم تدفقا رقيقا من غاز النيتروجين الخالي من الرطوبة لإزالة المذيبات.
- احتفظ بالدهون المجففة تحت فراغ عالي لمزيد من التجفيف لمدة ساعتين.
- أضف 1 مل من الماء المعقم منزوع الأيونات إلى الدهون المجففة بعد التجفيف بالتفريغ واترك الخليط ينتفخ طوال الليل.
- دوامة القارورة في درجة حرارة الغرفة لعمل حويصلات متعددة الأحادية (MUVs).
- استخدام صوتنة الحمام متبوعا بصوتنة مسبار بقوة 25 واط لصنع حويصلات أحادية الصفيحة صغيرة (SUVs) من الحويصلات أحادية الصفيحة متعددة (MUVs).
ملاحظة: يجب أن تبدو سيارات الدفع الرباعي كمحلول جسيم شحمي شفاف. إذا لم يكن الأمر كذلك ، فقم بزيادة عدد النبضات التي تبلغ مدتها 30 ثانية وإيقاف تشغيلها بفاصل زمني قدره 1 دقيقة. يتم قياس الأقطار الهيدروديناميكية وإمكانات السطح (الشكل 4) في محلل حجم الجسيمات.
- تكوين مركب mRNA / الجسيمات الشحمية ومقايسة التخلف الهلامي
- لتحضير نسب شحنة حمض الريبي الدهني المختلفة من 1: 1 إلى 8: 1 ، قم بتخفيف mRNA والجسيم الشحمي الكاتيوني في الماء منزوع الأيونات بشكل منفصل كما هو موضح في الجدول 7.
- امزج الرنا المرسال المخفف بمحلول الجسيمات الشحمية كما هو موضح في الجدول 7 واحتضنه لمدة 10 دقائق في درجة حرارة الغرفة لتكوين lipoplex.
- أضف 20 ميكرولتر من صبغة تحميل الحمض النووي الريبي 2x إلى المركب وقم بتحميلها على البئر. يعمل mRNA وحده كعنصر تحكم.
- قم بتحميل العينات على جل الاغاروز 1٪ في 1x TAE عازلة وقم بتشغيلها عند 100 فولت لمدة 45 دقيقة.
- تصور نطاقات الحمض النووي الريبي على أداة توثيق هلام (الشكل 5).
- تعداء mRNA في المختبر
- قم بزرع 45,000 خلية ثدييات لكل بئر من 48 صفيحة بئر في وسائط كاملة ثم تحتضن عند 37 درجة مئوية لمدة 16 إلى 20 ساعة من التعدين.
- بعد 16 إلى 20 ساعة ، تحقق من كثافة الخلية. في وقت التعدي ، يجب أن يكون التقاء الخلية حوالي 80٪.
- إلى أنابيب 0.5 مل ، أضف 150 نانوغرام من مركب mRNA المشفر للبروتين GFP مع نسبة شحنة 1: 1 من الجسيمات الشحمية الموجبة و mRNA في وسط DMEM بدون مصل. الحجم الكلي يصل إلى 20 ميكرولتر.
- احتضن في درجة حرارة الغرفة لمدة 10 دقائق.
- أضف lipoplex إلى الخلايا واحتضانه لمدة 4 ساعات في حاضنة 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 .
- قم بإزالة الوسائط دون إزعاج الخلايا. أضف 250 ميكرولتر من الوسائط الكاملة مع 10٪ FBS (الجدول 8) في كل بئر.
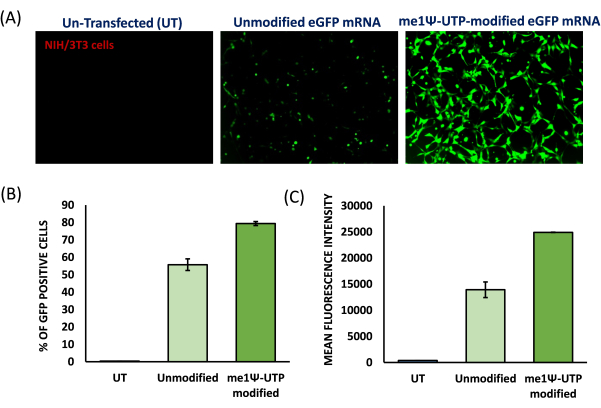
- بعد 72 ساعة من التعدي ، اعرض تعبير GFP تحت المجهر الفلوري (الشكل 6 ، 7).
- لتحديد تعبير GFP ، قم بمعالجة الخلايا لتحليل مقياس التدفق الخلوي.
- قم بإزالة الوسائط واغسلها باستخدام 1x PBS مرتين. قم بتربسين الخلايا ومعالجة الخلايا لتحديد النسبة المئوية للخلايا الموجبة ل GFP في مقياس التدفق الخلوي.
- احصل على الخلايا في مقياس التدفق الخلوي باستخدام الليزر 488. قم بإخراج السكان الأحياء من ذلك وتحليل النسبة المئوية للخلايا الإيجابية ل GFP. حدد متوسط شدة الفلورسنت (MFI) (الشكل 6 ، 7).
النتائج
قمنا بتحسين بروتوكول إنتاج mRNA المعدل me1Ψ-UTP ، وإعداد الجسيمات الشحمية ، وتجارب تعداء mRNA مع الجسيمات الشحمية الموجبة في خلايا ثدييات متعددة (الشكل 1). لتصنيع mRNA ، تم تضخيم قالب eGFP IVT المحسن لكودون الثدييات من متجه تعبير الثدييات mEGFP-N1 وتنقيته بطريقة الاستخراج العضوي / ترسيب الإيثانول (الشكل 2). في وقت لاحق ، تم إنتاج الحمض النووي الريبي و mRNA المعدل me1Ψ-UTP بواسطة عملية IVT. أظهرت بيانات الرحلان الكهربائي لهلام الحمض النووي الريبي المركب تغيير طبيعة الشمس أن هذه الحمض النووي الريبي المركب تتمتع بسلامة جيدة وطول صحيح (750 RNA أساسي ، و ~ 1000 mRNA أساسي فيما يتعلق بسلم الحمض النووي الريبي) (الشكل 3).
لإعداد الجسيمات الشحمية الموجبة ، تم استخدام طريقة ترطيب الأغشية الرقيقة والصوتنة لتشكيل حويصلات أحادية الصفيحة صغيرة (SUVs). كشف التوصيف الفيزيائي والكيميائي للجسيمات الشحمية أن الأقطار الهيدروديناميكية لوحظت حوالي 65 نانومتر وأن إمكانات السطح كانت حوالي +20 ميجا فولت (الشكل 4). تم إجراء فحص التخلف الهلامي باستخدام مجمعات الجسيمات الشحمية mRNA بنسب شحنة متفاوتة من الدهون / القاعدة من 1: 1 إلى 8: 1. أظهرت الجسيمات الشحمية الكاتيونية كفاءة ارتباط عالية ب mRNAs حتى عند نسبة شحن 1: 1 (الشكل 5). ومن ثم ، استخدمنا نسبة شحن 1: 1 لتجارب تعداء الرنا المرسال. تم إجراء تجارب تعداء eGFP mRNA بوساطة الجسيمات الشحمية في خطوط خلايا HEK-293T و NIH / 3T3. تم تحليل تعبير eGFP باستخدام قياس التدفق الخلوي. أظهر mRNA المعدل me1Ψ-UTP تعبيرا متفوقا ومستقرا عن بروتين eGFP عند مقارنته ب mRNA غير المعدل في خلايا HEK-293T و NIH / 3T3 في اليوم الثالث بعد التعدي (الشكل 6 ، 7).
الشكل 1: العرض التخطيطي لإنتاج mRNA المعدل me1Ψ-UTP ، وإعداد الجسيمات الشحمية وبروتوكول التعداد. يتم تضخيم قالب الحمض النووي IVT (T7 المحفز الجيني ORF) بواسطة تفاعل البوليميراز المتسلسل وتنقيته. يتم إنشاء mRNAs المعدلة me1Ψ-UTP بواسطة عملية IVT باستخدام قالب IVT DNA وتنقيتها. يتم تحضير الجسيم الشحمي الكاتيوني وتجميعه باستخدام mRNA المعدل me1Ψ-UTP (Lipoplex) ويمكن تحويله إلى خلايا الثدييات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحديد جودة قالب الحمض النووي IVT في الرحلان الكهربائي لهلام الاغاروز. تم تشغيل قالب الحمض النووي eGFP IVT DNA المنقى على هلام الاغاروز بنسبة 1٪ وتم تصوره بواسطة الجل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحليل حجم وجودة الحمض النووي الريبي IVT المعدل me1Ψ-UTP عن طريق تغيير طبيعة الرحلان الكهربائي للحمض النووي الريبي في هلام الاغاروز. تم تغيير طبيعة الحمض النووي الريبي المعدل me1Ψ-UTP المنقى وتحميله على هلام TAE-agarose بنسبة 1٪ ، وتم تحديد حجم وجودة الحمض النووي الريبي بواسطة الهلام. حارة 1: سلم ssRNA ، المسار 2: me1Ψ-UTP معدل IVT RNA ، حارة 3: me1Ψ-UTP معدل IVT RNA مع ذيل Cap1 و Poly A. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
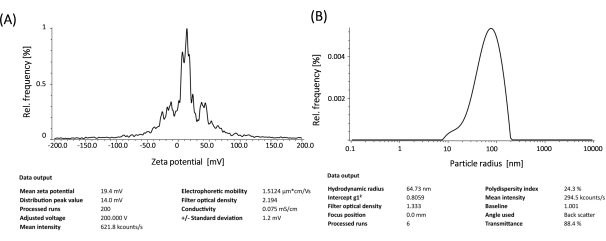
الشكل 4: التوصيف الفيزيائي والكيميائي للجسيمات الشحمية: الإمكانات السطحية (A) والأقطار الهيدروديناميكية (B). الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
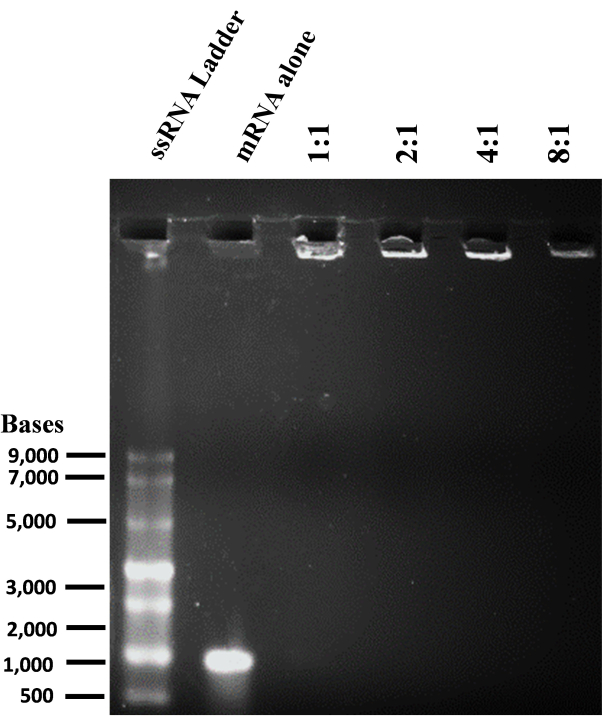
الشكل 5: تم تحديد قدرة ربط mRNA للجسيمات الشحمية عن طريق تغيير طبيعة مقايسة تأخر هلام الاغاروز. تم تحضير مجمعات الجسيمات الشحمية المرسال (Lipoplexes) بنسب شحنة دهنية / قاعدة مختلفة وتحميلها على هلام الاغاروز 1٪ وهلام موثق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: كفاءة التعبير عن البروتين ل me1Ψ-UTP معدل eGFP mRNA في خلايا HEK-293T البشرية. (أ) صور مضان ل eGFP mRNA غير المعدل و me1Ψ-UTP mRNA المعدل مع الجسيمات الشحمية الموجبة إلى خلايا HEK-293T التي تم الحصول عليها في 3أيام بعد التعدي (تكبير 100x). ٪ من تعبير بروتين eGFP (B) ومتوسط شدة الفلورسنت (MFI). (C) من الخلايا المنقولة تم تحليلها باستخدام قياس التدفق الخلوي. (ن = 3) الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 7: كفاءة ترجمة me1Ψ-UTP mRNA المعدل eGFP في خلايا NIH / 3T3 للفأر. (أ) صور مضان ل eGFP mRNA غير المعدل و me1Ψ-UTP mRNA المعدل إلى خلايا المعاهد الوطنية للصحة / 3T3 التي تم الحصول عليها في اليوم الثالث بعد التعدي (تكبير 100x). ٪ من تعبير بروتين eGFP (B) ومتوسط شدة الفلورسنت (MFI). (C) من الخلايا المنقولة تم تحليلها باستخدام قياس التدفق الخلوي. (ن = 3) الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مكونات | تفاعل 25 ميكرولتر | التركيز النهائي |
| 5x المخزن المؤقت Q5 | 5 ميكرولتر | 1x |
| 10 ملي مولار dNTP | 0.5 ميكرولتر | 200 ميكرومتر |
| 10 ميكرومتر برايمر أمامي | 1.25 ميكرولتر | 0.5 ميكرومتر |
| 10 ميكرومتر التمهيدي العكسي | 1.25 ميكرولتر | 0.5 ميكرومتر |
| البوليميراز Q5 | 0.25 ميكرولتر | 0.02 وحدة / ميكرولتر |
| الجين الفائق بالبلازميد (قالب) | 1-5 نانوغرام | متغير |
| ماء خال من النوكلياز | إلى 25 ميكرولتر |
الجدول 1: تحضير خليط تفاعل تفاعل البوليميراز المتسلسل
| الخطوات | مدة | درجة الحرارة | رقم الدورة |
| التمسخ الأولي | 30 ثانية | 98 درجة مئوية | 1 |
| التمسخ | 10 ثوان | 98 درجة مئوية | |
| الصلب | 20 ثانية | متغير | 18-25 |
| امتداد | متغير | 72 درجة مئوية | |
| التمديد النهائي | 2 دقائق | 72 درجة مئوية | 1 |
| مسك | ∞ | 1 5 درجة مئوية |
الجدول 2: ظروف ركوب الدراجات PCR
| مكونات | الحمض النووي الريبي غير المعدل | me1Ψ-UTPالحمض النووي الريبي المعدل |
| مياه خالية من RNase | متغير | متغير |
| الحمض النووي لقالب خطي مع مروج T7 RNAP | متغير (1 ميكروجرام) | متغير (1 ميكروجرام) |
| 10x T7 TranscriptionBuffer | 2 ميكرولتر | 2 ميكرولتر |
| 100 ملي مولار N1-ميثيل سودودوريدين | - | 1.5 ميكرولتر |
| 100 ملي متر ATP | 1.8 ميكرولتر | 1.8 ميكرولتر |
| 100 ملي متر UTP | 1.8 ميكرولتر | - |
| 100 ملي CTP | 1.8 ميكرولتر | 1.8 ميكرولتر |
| 100 ملي جي تي بي | 1.8 ميكرولتر | 1.8 ميكرولتر |
| 100 ملي ديت | 2 ميكرولتر | 2 ميكرولتر |
| 40 وحدة / ميكرولتر مثبط RNase | 0.5 ميكرولتر | 0.5 ميكرولتر |
| محلول الإنزيم T7 | 2 ميكرولتر | 2 ميكرولتر |
| إجمالي حجم التفاعل | 20 ميكرولتر | 20 ميكرولتر |
الجدول 3: تحضير خليط تفاعل IVT
| مكونات | سلم الحمض النووي الريبي | عينة الحمض النووي الريبي |
| 2x صبغة تحميل الحمض النووي الريبي (NEB) | 6 ميكرولتر | 6 ميكرولتر |
| حمض الريبونوكلييك (RNA) | 2 ميكرولتر | 1 ميكرولتر (0.5-1 ميكروغرام) |
| المياه المعالجة DEPC | 4 ميكرولتر | 5 ميكرولتر |
| الحجم الإجمالي | 12 ميكرولتر | 12 ميكرولتر |
الجدول 4: تحضير صبغة تحميل الحمض النووي الريبي
| مكونات | كم |
| 10x CappingBuffer | 10 ميكرولتر |
| 20 ملي جي تي بي | 5 ميكرولتر |
| 20 ملم SAM | 2.5 ميكرولتر |
| مثبط RNase | 2.5 ميكرولتر |
| 2'-O-ميثيل ترانسفيراز | 4 ميكرولتر |
| الحجم الإجمالي | 24 ميكرولتر |
الجدول 5: خليط تفاعل تخليق الغطاء الأنزيمي -1
| مكونات | كم |
| 5 'IVT RNA متوج | 100 ميكرولتر |
| مثبط RNase | 0.5 ميكرولتر |
| 10x A-PlusTailingBuffer | 12 ميكرولتر |
| 20 ملي متر ATP | 6 ميكرولتر |
| 4 U / μL A-Plus بولي (أ) بوليميراز | 5 ميكرولتر |
| الحجم الإجمالي | 123.5 ميكرولتر |
الجدول 6: خليط تفاعل المخلفات بولي
| نسبة الشحن | الجسيمات الشحمية | ماء DI | mRNA (500ng) | ماء DI |
| 1:1 | 1.5 ميكرولتر | 8.5 ميكرولتر | 1 ميكرولتر | 9 ميكرولتر |
| 2:1 | 3 ميكرولتر | 7 ميكرولتر | 1 ميكرولتر | 9 ميكرولتر |
| 4:1 | 6 ميكرولتر | 4 ميكرولتر | 1 ميكرولتر | 9 ميكرولتر |
| 8:1 | 12 ميكرولتر | - | 1 ميكرولتر | 9 ميكرولتر |
| الحجم الكلي (20 ميكرولتر) | 10 ميكرولتر | 10 ميكرولتر | ||
الجدول 7: تحضير lipoplex بناء على نسب الشحنة
| اسم | مكونات |
| 50x TAE المخزن المؤقت | قم بإذابة 50 ملي مولار ملح الصوديوم EDTA ، 2 م تريس ، 1 م حمض الخليك الجليدي في 1 لتر من الماء |
| HEK-293T و NIH / 3T3 وسط زراعة الخلايا | DMEM يحتوي على 4.5 جم / لتر من الجلوكوز ، L-glutamine ، 1٪ بنسلين / ستربتومايسين و 10٪ FBS |
الجدول 8: إعداد المخزن المؤقت والوسائط
Discussion
كانت التطبيقات العلاجية ل mRNAs غير المعدلة محدودة بسبب نصف عمرها الأقصر وقدرتها على تنشيط الاستجابات المناعية الفطرية داخل الخلايا ، مما يؤدي بدوره إلى ضعف التعبير عن البروتين في الخلايا المنقولة11. Katalin et al. أظهر أن الحمض النووي الريبي الذي يحتوي على نيوكليوسيدات معدلة مثل m5C و m6A و ΨU و me1Ψ-UTP يمكن أن يتجنب تنشيط TLR12. والأهم من ذلك ، أن دمج ΨU أو me1Ψ-UTP في IVT mRNA أظهر كفاءة انتقالية فائقة للبروتينات المستهدفة ، وتحسين الاستقرار في درجة حرارة الغرفة ، ومنع التحلل من نوكليازات13 ، 14.
في هذا الفيديو ، أظهرنا بروتوكول تمكين الدهون من توصيل mRNA المعدل me1Ψ-UTP إلى خلايا مستنبتة متعددة. يتضمن البروتوكول إنتاج mRNA المعدل me1Ψ-UTP ، وتحضير الجسيمات الشحمية الموجبة ، والتعدي في الخلايا ، وتقييم تعبير البروتين. استخدمنا جين مراسل eGFP المحسن لكودون الثدييات لتجارب التعدي لتحليل مستويات التعبير عن البروتين عن طريق قياس شدة الفلورسنت. تم تحضير الجسيمات الشحمية الموجبة لتركيب mRNA ، وتم تحليل تعقيدها الكهروستاتيكي بنسب شحنة دهنية / قاعدة متفاوتة من 1: 1 إلى 8: 1. نظرا لأنه عند 1: 1 ، يمكن للجسيمات الشحمية الموجبة أن تكون معقدة تماما mRNA ، استخدمنا نسبة شحن 1: 1 للتعداد. لقد أظهرنا أن تعداء mRNA باستخدام الجسيمات الشحمية الموجبة يمكن أن يوفر بكفاءة كلا من mRNAs eGFP المعدلة وغير المعدلة بكفاءة بكفاءة 90٪ من كفاءة التعداء في خلايا HEK-293T ، في حين كانت هناك كفاءة بنسبة 80٪ مع mRNAs المعدلة و 60٪ مع mRNAs غير المعدلة في خلايا NIH / 373. والأهم من ذلك ، أن mRNA المعدل me1Ψ-UTP أظهر تعبيرا متفوقا عن بروتين eGFP لمدة 3 أيام في خلايا الثدييات مقارنة ب mRNA غير المعدل (>6 أضعاف في HEK-293T و >2 ضعفا في خلايا المعاهد الوطنية للصحة / 3T3). أظهرت هذه الدراسات أن تعديل me1Ψ-UTP على mRNA يمكن أن يحسن ترجمة واستقرار mRNA في خلايا الثدييات.
تختلف كفاءة تعداء الجسيمات الشحمية الموجبة وكفاءة ترجمة mRNA المركب باختلاف أنواع الخلايا. وبالتالي ، من المهم تحسين تركيز mRNA لكل نوع مختلف من أنواع الخلايا. باستخدام البروتوكول ، قمنا بتصنيع mRNA المعدل الوظيفي me1Ψ-UTP ، بحجم يصل إلى 6 كيلو بايت ولكن يمكن تحسين تركيز قالب الحمض النووي IVT والوقت للحصول على عائد جيد من mRNA والطول الصحيح.
Disclosures
لا إفصاحات
Acknowledgements
يشكر MS قسم التكنولوجيا الحيوية ، الهند ، على الدعم المالي (BT / PR25841 / GET / 119/162/2017) ، والدكتور ألوك سريفاستافا ، رئيس CSCR ، Vellore ، على دعمه والدكتور سانديا ، المرافق الأساسية ل CSCR للتصوير وتجارب FACS. نشكر R. Harikrishna Reddy و Rajkumar Banerjee ، قسم علم الأحياء التطبيقي ، CSIR-المعهد الهندي للتكنولوجيا الكيميائية Uppal Road ، تارناكا ، حيدر أباد ، 500 007 ، TS ، الهند ، لمساعدتهم في تحليل البيانات الفيزيائية والكيميائية للجسيمات الشحمية. Vigneshwaran V ، و Joshua A ، CSCR لمساعدتهم في صنع الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Lonza | 50004 | |
| Bath sonicator | DNMANM Industries | USC-100 | |
| Cationic lipid | Synthesized in the lab | ||
| Chlorofrom | MP biomedicals | 67-66-3 | "Caution" |
| Cholesterol | Himedia | GRM335 | |
| DEPC water | SRL BioLit | 66886 | |
| DMEM | Lonza | 12-604F | |
| DNA Ladder | GeneDireX | DM010-R50C | |
| DOPE | TCI | D4251 | |
| EDTA sodium salt | MP biomedicals | 194822 | |
| Ethanol | Hayman | F204325 | "Caution" |
| Fetal bovine serum | Gibco | 10270 | |
| Flow cytometry | BD | FACS Celesta | |
| Fluroscence Microscope | Leica | MI6000B | |
| Gel documentation system | Cell Biosciences | Flurochem E | |
| Glacial acetic acid | Fisher Scientific | 85801 | "Caution" |
| mEGFP-N1, Mammalian expression vector | Addgene | 54767 | |
| N1-Methylpseudo-UTP | Jena Bioscience | NU-890 | |
| Phenol:chloroform:isoamyl alchol (25:24:1), pH 8.0 | SRL BioLit | 136112-00-0 | "Caution" |
| Phosphate Buffer Saline (PBS), pH 7.4 | CellClone | CC3041 | |
| Probe sonicator | Sonics Vibra Cells | VCX130 | |
| RNA ladder | NEB | N0362S | |
| RNase inhibitor | Thermo Scientific | N8080119 | |
| SafeView dye | abm | G108 | |
| Sodium acetate | Sigma | S7545 | |
| Thermocycler | Applied biosystems | 4375786 | |
| Thermomixer | Eppendrof | 22331 | |
| Tris buffer | SRL BioLit | 71033 | |
| Trypsin | Gibco | 25200056 |
References
- Sahin, U., Kariko, K., Tureci, O. mRNA-based therapeutics--developing a new class of drugs. Nature Reviews Drug Discovery. 13 (10), 759-780 (2014).
- Schlake, T., Thess, A., Fotin-Mleczek, M., Kallen, K. J. Developing mRNA-vaccine technologies. RNA Biology. 9 (11), 1319-1330 (2012).
- Carlile, T. M., et al. Pseudouridine profiling reveals regulated mRNA pseudouridylation in yeast and human cells. Nature. 515 (7525), 143-146 (2014).
- Kariko, K., Buckstein, M., Ni, H., Weissman, D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity. 23 (2), 165-175 (2005).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Srujan, M., et al. The influence of the structural orientation of amide linkers on the serum compatibility and lung transfection properties of cationic amphiphiles. Biomaterials. 32 (22), 5231-5240 (2011).
- Dharmalingam, P., et al. Transfection: Cationic Lipid Nanocarrier System Derivatized from Vegetable Fat, Palmstearin Enhances Nucleic Acid Transfections. ACS Omega. 2 (11), 7892-7903 (2017).
- Hoy, S. M. Patisiran: First Global Approval. Drugs. 78 (15), 1625-1631 (2018).
- Anderson, E. J., et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. New England Journal of Medicine. , (2020).
- Polack, F. P., et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. New England Journal of Medicine. , (2020).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid-sensing. Nature Reviews Immunology. 16 (9), 566-580 (2016).
- Kariko, K., Buckstein, M., Hi, H., Weissman, D. Suppression of RNA recognition by Toll-like receptors: The impact of nucleoside modification and evolutionary origin of RNA. Immunity. 23 (2), 165-175 (2005).
- Mauger, D. M., et al. mRNA structure regulates protein expression through changes in functional half-life. Proceedings of the National Academy of Sciences of the United States of America. 116 (48), 24075-24083 (2019).
- Vaidyanathan, S., et al. Uridine Depletion and Chemical Modification Increase Cas9 mRNA Activity and Reduce Immunogenicity without HPLC Purification. Molecular Therapy - Nucleic Acids. 12, 530-542 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved