Method Article
Kromatografik Hat İçi İzleme Kullanılarak mRNA Üretimi için İn vitro Transkripsiyon Reaksiyonunun Optimizasyonu
Bu Makalede
Özet
İn vitro transkripsiyonu (IVT) optimize etmek, uygun maliyetli mRNA üretimi için kritik öneme sahiptir. Bu protokol, IVT reaksiyonunun hat içi analizi, NTP tükenmesinin ve mRNA üretiminin kesikli veya beslemeli kesikli modlarda izlenmesi için çeşitli RNA modalitelerine uygulanabilen, üretkenliği artıran ve maliyetleri düşüren analitik bir kromatografik yöntemi detaylandırır.
Özet
İn vitro transkripsiyon reaksiyonu (IVT), bir RNA polimeraz, örneğin T7 tarafından katalize edilen, doğrusal bir DNA şablonundan mRNA'nın karmaşık, çok bileşenli bir enzimatik sentezidir. IVT reaktiflerinin yüksek maliyeti nedeniyle IVT, mRNA ilaç maddesi üretim sürecinde kritik bir adımdır ve bu alanda yoğun optimizasyonun odak noktası olmuştur. mRNA üretim maliyetini azaltmak için reaktiflerin en iyi şekilde kullanılması gerekir. Etkili optimizasyon, bireysel reaktiflerin reaksiyon kinetiği, yani nükleosit trifosfatların (NTP'ler) tüketimi ve mRNA üretimi üzerindeki etkisinin kapsamlı bir şekilde anlaşılmasını gerektirir. Geleneksel olarak, mRNA'nın analizi için düşük verimli, son nokta analitik teknikler kullanılmıştır. Bu tür yöntemler mRNA içeriği hakkında değerli bilgiler verse de, IVT reaksiyonunu tam olarak anlamak için çevrimiçi, neredeyse gerçek zamanlı analitiklere ihtiyaç vardır. NTP'lerin yanı sıra pDNA ve mRNA'yı ayıran bir sıvı kromatografi analitik yönteminin, IVT reaksiyon kinetiğini incelemek için neredeyse gerçek zamanlı olarak nasıl kullanılabileceğini gösteriyoruz. Farklı IVT bileşenlerinin kinetik ve verim üzerindeki etkisinin bilinmesiyle, kesikli IVT reaksiyonunu, üretkenliği daha da artıran ve reaksiyonun toplam maliyetini azaltan bir beslemeli kesikli moda dönüştürmek için hızlı kromatografik analiz kullanılabilir.
Giriş
COVID-19 salgını, biyotıpta benzeri görülmemiş bir devrimi katalize ederek hem Avrupa'da hem de ABD'de BioNTech/Pfizer'in Comirnaty'si ve Moderna'nın Spikevax'ı gibi mRNA bazlı aşıların hızla geliştirilmesine ve yetkilendirilmesine yol açtı 1,2,3. Bu aşıların etkileyici etkinliği ve hızlı gelişimi, mRNA teknolojisinin sadece bulaşıcı hastalıklar için değil, aynı zamanda kanser immünoterapileri, protein replasman tedavileri, rejeneratif tıp ve hücresel yeniden programlama için de muazzam terapötik potansiyelini vurgulamıştır 4,5. Genellikle mRNA devrimi olarak adlandırılan bu dönem, verimli ve uygun maliyetli mRNA üretim süreçlerine duyulan ihtiyacın altını çiziyor.
mRNA üretimi, in vitro transkripsiyon (IVT) reaksiyonu kritik ve en maliyet yoğun bir ünite operasyonu olmak üzere birden fazla ünite operasyonunu içerir 6,7,8. IVT reaksiyonu, magnezyum iyonlarının varlığında RNA polimeraz, tipik olarak T7 RNA polimeraz ve nükleosit trifosfatlar (NTP'ler) kullanarak bir DNA şablonundan mRNA'yı sentezler. İşlem nispeten basittir ve kısa bir zaman diliminde büyük miktarlarda mRNA üretimine izin verir, birkaç saat içinde 2-5 g/L'lik ve bazı raporlarda 14 g/L'ye kadar reaksiyon verimleri elde eder 9,10,11. Bununla birlikte, IVT reaksiyon veriminin optimizasyonu, üretim maliyetlerini azaltmak ve mRNA aşılarının ve terapötiklerinin12 ölçeklenebilirliğini sağlamak için çok önemlidir ve NTP tüketimini etkileyen dizi farklılıkları nedeniyle her yapı veya yapı ailesi için gerekli olabilir.
Reaksiyon genellikle bir kesikli işlem olarak gerçekleştirilir, ancak beslemeli kesikli işleme ve hat içi analitikteki son gelişmeler, mRNA üretimini optimize etmek için yeni yollar açmıştır 7,13. Bir bolus veya sürekli reaktif ilavesini içeren beslemeli kesikli reaksiyonlar, substrat inhibisyonunu ve kofaktöre bağlı ürün bozunmasını önleyerek reaksiyon sürelerini potansiyel olarak uzatabilir ve verimi artırabilir 14,15.
Hızlı hat içi analitiğin geliştirilmesi, IVT alanında önemli bir ilerleme olmuştur ve NTP'ler ve mRNA gibi temel reaksiyon bileşenlerinin minimum analitik gecikme ile izlenmesini sağlar 13,16 ve tipik olarak yalnızca mRNA konsantrasyonunaodaklanan IVT izlemeye ek bir boyut ekler 17. Geleneksel olarak mRNA'lar, poliakrilamid jel elektroforezi (PAGE), agaroz jel elektroforezi veya kılcal elektroforez gibi teknikler kullanılarak analiz edilmiştir. Bunlar uç nokta yöntemleridir ve bu nedenle gerçek zamanlı IVT izleme için kullanılamaz. Bu protokolde açıklanan analitiğe bir alternatif, ışıklı RNA aptamer ve floresan boya çiftlerini kullanan yöntemlerdir. Bu yöntemde, RNA aptamer RNA'ya etiketlenir ve ışıklı bir floresan boya ile inkübe edilir. Transkripsiyon aktivitesi daha sonra floresan yoğunluğu17 ile görselleştirilebilir. Bu, IVT 21 sırasında kopyalanan mRNA'nın miktarının ve kalitesinin gerçek zamanlı analizini sağlar, ancak diğer IVT bileşenlerinin, örneğin NTP'lerin eşzamanlı olarak izlenmesine izin vermez. NTP ve mRNA'nın gerçek zamanlı olarak ölçülmesini potansiyel olarak sağlayan başka bir alternatif Raman spektroskopisi18'dir, ancak bugüne kadar hiçbir rapor IVT izleme için kullanışlılığını göstermemiştir, bu da gerekli seçiciliği ve duyarlılığı elde etmek için yöntemin daha fazla optimizasyonunun hala gerekli olduğunu düşündürmektedir.
Daha hızlı ve daha seçici analitiğin sürekli geliştirilmesi, toplu ve beslemeli toplu modlarda daha yüksek verim için IVT'nin optimizasyonunu destekler. Reaksiyon, optimumun yapı türleri arasında farklılık gösterebileceği çoklu etkileşim faktörlerine sahip karmaşık, çok parametreli bir süreç olarak kalır (örneğin, mRNA ve saRNA). Mg2+ iyonlarının ve NTP'lerin konsantrasyonu ve oranı özellikle etkilidir ve doğuştan gelen bağışıklık sisteminin güçlü bir uyarıcısı olan çift sarmallı RNA (dsRNA) oluşumunu en aza indirirken mRNA verimini en üst düzeye çıkarmak için optimal seviyeleri dikkatli bir şekilde dengelenmelidir19,20. Son zamanlarda, UTP'nin kararlı durum seviyelerinde beslenmesi, dsRNA oluşumunu azaltmak için bir yaklaşım olarak bildirilmiştir21. UTP seviyelerinin neredeyse gerçek zamanlı olarak izlenmesi, ek bir süreç kontrolü düzeyi ekleyecektir.
Bu protokolde, IVT reaksiyonunun hat içi izlenmesinin kesikli ve beslemeli kesikli modda mRNA üretiminin verimini nasıl artırabileceğini gösteriyoruz.
Protokol
1. Tampon hazırlama
NOT: Tüm tamponlar RNaz içermeyen olarak hazırlanmalıdır, yani tüm kimyasallar ve cam eşyalar yalnızca RNaz içermeyen işler için kullanılmalı ve önlemli olarak kullanılmalıdır. Tampon hazırlama ve cam eşyaların temizlenmesi için kullanılan suyun nükleaz içermediği sertifikalandırılmalıdır. Bir deney yapmadan önce, tüm çalışma yüzeylerine ve cam eşyalara, RNazları ortadan kaldıran bir dekontaminasyon reaktifi püskürtülmelidir. Dekontaminasyon reaktifi, cam eşya/çalışma alanı kullanılmadan önce RNaz içermeyen su ile iyice yıkanmalıdır. Mümkünse steril ve tek kullanımlık sarf malzemeleri kullanın.
- IVT tamponlarının hazırlanması: 400 mM Tris, 10 mM DTT, 20 mM spermidin, pH 7.9 ekleyerek 10x IVT tamponu hazırlayın. 100 mM EDTA, pH 8 içeren bir söndürme tamponu hazırlayın. Her tamponu 0,22 μm PES filtresinden geçirin.
- Mobil fazların hazırlanması: 50 mM HEPES, pH 7.0 eklenerek mobil faz A (MPA), 50 mM HEPES eklenerek mobil faz B (MPB), 100 mM Na4P2O7, pH 8.3, 0.1 M NaOH, 1 M NaCl eklenerek mobil faz C (MPC), 0.5 M HEPES eklenerek mobil faz D (MPD) hazırlanır, pH 7.0'dır. Her tamponu 0,22 μm PES filtresinden geçirin.
2. İn vitro transkripsiyon reaksiyonunun (IVT) hazırlanması
NOT 1: IVT reaksiyonu, tüm reaktiflerin başlangıçta eklendiği ve NTP'ler tükendikten/mRNA üretimi bir platoya ulaştıktan sonra reaksiyonun durdurulduğu bir kesikli reaksiyon olabilir veya tükenmiş NTP'lerin ek NTP'lerle doldurulduğu ve bununla birlikte mRNA üretiminin ek olarak arttığı bir beslemeli kesikli reaksiyon olabilir. IVT reaksiyonunda kullanılan lineer pDNA şablonu, plazmid DNA'da poli(A) dizisinden hemen sonra parçalanan restriksiyon enzimi kullanılarak veya PCR reaksiyonu ile elde edilebilir. Her iki durumda da reaksiyonu, kromatografik veya ticari DNA saflaştırma kitleri kullanılarak saflaştırma takip etmelidir.
- Toplu IVT reaksiyonu
- Termobloku 37 °C ve 300 rpm'ye ayarlayın. Enzimler hariç Tablo 1'de listelenen tüm reaktifleri çözün ve termoblokta 37 °C'de önceden ısıtın. 100 mM ATP, CTP, UTP ve GTP stok çözeltisi kullanarak 25 mM NTP karışımı hazırlayın.
- Reaktifler çözülürken, zaman rotası deneyi için numune alikotları hazırlayın. 0,5 mL steril tüpler alın ve her tüpe 2 μL 100 mM EDTA pipetleyin. Her tüpü belirlenmiş bir IVT numarası (örneğin, IVT001, IVT002, vb.) ve zaman noktası (örneğin, 0 dk, 15 dk, 30 dk, 60 dk, vb.) ile işaretleyin.
- Reaktifler çözülüp 37 °C'de yaklaşık 15 dakika tutulduğunda, enzimleri (T7 RNA Polimeraz, Pirofosfataz, Rnaz İnhibitörü) -20 °C dondurucudan çıkarın ve tekrar dondurucuda saklanana kadar daha serin bir yerde saklayın.
- Tek tek IVT reaktiflerini (enzimler hariç) karıştırmak için bir girdap kullanın. Enzimleri hafifçe yukarı ve aşağı pipetleyerek karıştırın.
- IVT reaktiflerini deneysel tasarımda ayarlanan oranlarda karıştırın (örneğin, jenerik IVT protokolü Tablo 1'de gösterilmiştir) 1.5 mL'lik bir tüpte. IVT optimizasyonu yapılırken, nihai IVT hacmi 50-100 μL arasında değişebilir. Toplam IVT hacmini tasarlarken, zaman kursu deneyi sırasında reaksiyondan çıkarılacak 2 μL'lik numunelerin sayısını göz önünde bulundurun. Numunelerin toplam hacminin toplam IVT hacminin %50'sini aşmadığından emin olun (örneğin, 3 saat boyunca her 15 dakikada bir 2 μL numune alınıyorsa, alınan toplam alikot hacmi 30 μL'dir, yani toplam IVT hacmi minimum 60 μL olmalıdır).
- IVT'leri dikkatlice karıştırın, son reaktif olarak T7 RNA Polimeraz ekleyin. Tüm reaktifler eklendiğinde, IVT'yi yukarı ve aşağı pipetleyerek iyice karıştırın, vorteks kullanmayın.
- Tüm IVT reaktifleri eklendikten ve homojenize edildikten hemen sonra, tüpten 2 μL IVT karışımını çıkarın ve adım 2.1.2'de açıklanan 2 μL 100 mM EDTA içeren önceden hazırlanmış 0.5 mL tüplere pipetleyin (zaman noktası 0 dk).
- IVT reaksiyon karışımları içeren reaksiyon tüplerini bir termoblok içine koyun ve 37 °C'de inkübe edin.
- Zamanlayıcıyı istediğiniz zaman aralıklarına ayarlayın (örn. 15 dk/30 dk). Her zaman noktasında, hazırlanan her IVT reaksiyon karışımından 2 μL'lik bir IVT numunesi alın ve 2 μL 100 mM EDTA içeren önceden hazırlanmış tüpe (bkz. adım 2.1.2) pipetleyin. Bu aliquotelar kromatografik analiz için kullanılacaktır (bkz. adım 3).
- Kromatografik analiz, NTP'lerin tamamen tükendiğini doğruladıktan sonra, EDTA ile toplu IVT reaksiyonlarını 50 mM'lik bir nihai konsantrasyona kadar söndürün (ör. 30 μL IVT, 30 μL 100 mM EDTA ile inaktive edilir).
- Beslemeli kesikli IVT reaksiyonu
NOT: mRNA üretimi, NTP'ler tükendikten sonra NTP'ler ve Mg2+ iyonları eklenerek ek olarak artırılabilir.- Toplu IVT reaksiyonunu karıştırın ve adım 2.1'de açıklandığı gibi örnekleyin. Beslenen parti için NTP + MgCl2 beslemesini hazırlayın. Örneğin 500 μL NTP + MgCl2 karışımını hazırlamak için, her 200 mM NTP'den 106 μL, 76.25 μL 1 M MgCl2 ve 5.5 μL ddH2O karıştırın. Karışımdaki nihai konsantrasyonlar her NTP için 42.4 mM ve 152.5 mMMgCl2'dir.
- 3. adımda açıklanan çevrimiçi analizlerle NTP tüketimini izleyin. Hat içi analitik, NTP konsantrasyonunun başlangıç konsantrasyonunun %10'unun altına düştüğünü onayladığında, NTP + Mg2 + içeren beslemeyi toplu IVT'ye ekleyin.
- Analitik için tüm alikotlar alındıktan sonra 1.5 mL'lik bir tüpte kalan toplu IVT reaksiyonunun kesin hacmini ölçün/hesaplayın. Bir IVT'ye uygun hacimde NTP + MgCl2 karışımı ekleyin, böylece nihai konsantrasyon her NTP'nin 4 mM'si ve 12 mMMgCl2 olur. Örneğin, 1.5 mL'lik bir tüpte kalan 80 μL toplu IVT için 16.8 μL NTP + MgCl2 karışımı ekleyin.
- Adım 2.1'de yazıldığı gibi örneklemeye devam edin. NTP'ler tekrar tükendikten sonra, bölüm 2.2.2'yi tekrarlayın. İstenilen mRNA üretimi elde edilene kadar besleme ve numune alma işlemlerine devam edin.
- İstenilen mRNA üretimi sağlandıktan sonra, adım 2.1.10'daki gibi tüm reaksiyonu inaktive edin.
3. Kromatografik analizin hazırlanması
- Standart ve sistem uygunluk testi (SST) hazırlığı
- Kapatma reaktifi, NTP'ler, pDNA şablonu ve mRNA'yı birleştirerek SST'yi hazırlayın. Nihai konsantrasyonların kapatma reaktifi için yaklaşık 3 μM, her NTP için 5 μM, pDNA şablonu için 4 ng/μL ve mRNA için 10 ng/μL olduğundan emin olun. Son SST'nin 0.1 M NaCl içerdiğinden emin olun.
- Her analizden önce yeni bir kalibrasyon eğrisi hazırlayın. Bilinen konsantrasyona sahip saflaştırılmış bir mRNA örneğini MPA ile seyrelterek kalibrasyon standardını oluşturun. Kalibrasyon noktaları 0.5 ng/μL, 2 ng/μL, 5 ng/μL, 10 ng/μL, 15 ng/μL ve 20 ng/μL olmalı ve her biri 0.1 M NaCl nihai konsantrasyona sahip olmalıdır.
- Gerekirse, tüm NTP'ler için bir kalibrasyon eğrisi hazırlayın. Kalibrasyon standartlarındaki her NTP'nin nihai konsantrasyonlarının 0,5 μM, 2 μM, 5 μM, 10 μM, 15 μM ve 20 μM olduğundan emin olun.
- Kolon koşullandırma ve analiz için hazırlık
- Analizden önce 0.1 mL analitik sütunu oda sıcaklığında 12 saat dengeleyin. Kolonu kromatografik sisteme, kolon muhafazasında belirtilen yönde takın.
- Sütunu 1 mL / dak akış hızıyla yıkayın: önce 50 sütun hacmi (CV) ddH2O ile ve ardından 50 CV MPA ile.
- Taban çizgisini ayarlamak için analizden önce en az 3 boş örnek çalıştırın (yalnızca MPA enjekte edin). Skok ve ark.15'te açıklanan kromatografik yöntemi kullanın.
- Referans değer stabil hale geldiğinde ve iki ardışık boş ölçüm karşılaştırılabilir olduğunda (tekrarlanabilir referans değer), SST numunesini ve kalibrasyon eğrisi numunelerini çalıştırmaya devam edin.
- SST kriterleri karşılanıyorsa ve kapak reaktifi ile NTP'lerin ayrılması tatmin ediciyse, IVT numunelerinin analizine devam edin. Tüm IVT örneklerini analiz ettikten sonra, sistem koşullarının analiz boyunca sabit kaldığını doğrulamak için tekrar bir SST standardı enjekte edin.
- Numune hazırlama
NOT: Kromatografik analiz için numuneler, analizden hemen önce hazırlanır. Aksi takdirde, numuneler -20 °C (maksimum 24 saat) veya <-65 °C'de (24 saatten fazla) bir dondurucuda saklanır.- Kromatografik analiz için seyreltmeden önce, söndürülmüş IVT numunesini girdaplayın ve aşağı doğru döndürün. EDTA ile inaktive edilmiş tüm IVT örneklerini (bkz. adım 2.1.9) Skok ve ark.15'te açıklanan yöntemi kullanarak kromatografik analiz ile analiz edin.
- Analizden önce, kalibrasyon eğrisi içinde konsantrasyon elde etmek için IVT numunelerini seyreltin. Bir NTP'nin ne zaman tükendiğini belirlemek için NTP alanlarının karşılaştırılabilmesini sağlamak için zaman kursu deneyi boyunca aynı seyreltme faktörünü kullanın.
- IVT numuneleri için gereken minimum seyreltmeyi belirlemek için aşağıdaki formülü kullanın: Gerekli seyreltme = (beklenen son mRNA konsantrasyonu) / (inaktivasyon sırasında seyreltme) / (en yüksek kalibrasyon standardı)
Örneğin, IVT'de 8 mg/mL'lik bir mRNA üretimi bekleniyorsa, söndürülmüş numunedeki konsantrasyon 4 mg/mL olacaktır. Kalibrasyon eğrisi içinde konsantrasyon elde etmek için numuneyi 200 kat daha seyreltin.
Gerekli seyreltme = (8000 ng/μL]) / 2 / (20 ng/μL) = 200 - MPA ve 4 M NaCl'yi konik bir cam şişeye pipetleyin. Numunedeki nihai NaCl konsantrasyonunun 100 mM olduğundan emin olun. Son olarak, söndürülmüş IVT örneğini ekleyin.
- Vortex numuneyi hazırladı ve analiz için otomatik numune alma cihazına yerleştirdi. Otomatik numune alma cihazı sıcaklığını 4 °C'ye ayarlayın.
- Analitik kolona 100 μL seyreltilmiş numune enjekte edin. Her IVT numunesi için A260 ve A280 absorbansını ölçün.
- Bilinen konsantrasyonlara sahip numuneleri analiz etmek için veya alan farklılıklarına dayalı olarak NTP tüketiminin izlenmesi gerekli değilse, 10 ng/μL'lik bir hedef konsantrasyona ulaşmak için numuneleri seyreltin.
4. Numune ölçümü ve veri analizi
- Her IVT numunesinin entegrasyonundan önce, boş numuneyi numune kromatogramından çıkarın.
- Tüm NTP, pDNA ve mRNA zirvelerini A260'ta entegre edin ve IVT'deki NTP'lerin ve mRNA'nın konsantrasyonlarını hesaplamak için tepe alanlarını kullanın.
NOT: Alternatif olarak, seyreltme faktörünün tüm zaman noktalarında tutarlı olması koşuluyla, tepe alanları IVT reaksiyonunda kalan her bir NTP'nin yüzdesini karşılaştırmak için kullanılabilir. - Hat içi kromatografik analiz ile belirlenen mRNA/NTP konsantrasyonlarına dayanarak, IVT'nin inaktive edilip edilemeyeceğine veya IVT reaksiyonuna ek NTP'lerin beslenmesi gerekip gerekmediğine karar verin (bkz. adım 2).
Sonuçlar
Bu protokolde açıklanan kromatografik analiz, IVT optimizasyonu için veya bir kesikli IVT reaksiyonunu beslemeli kesikli reaksiyona dönüştürmek için kullanılabilir (Şekil 1).
Farklı tampon bileşimlerinin IVT reaksiyonunun kinetiği üzerindeki etkisini test etmek için, Tablo 2'de yazılan protokole göre üç farklı IVT reaksiyonu karıştırıldı. pH'ın HCl ile ayarlandığı Tris içeren tampon, pH'ın asetik asit ile ayarlandığı Tris tamponu ile karşılaştırıldı. Ayrıca, her iki Tris tamponu, pH'ın NaOH ile ayarlandığı HEPES tamponu ile karşılaştırıldı. Tüm 1x IVT tamponunun bileşimi 40 mM Tris/HEPES, 10 mM DTT, 2 mM spermidin ve pH 7.9 idi.
100 μL IVT reaksiyon karışımından, IVT reaksiyonundan 2 μL IVT numunesi alındı ve inkübasyonun ilk saatinde her 15 dakikada bir ve daha sonra 180 dakikalık inkübasyona kadar her 30 dakikada bir 2 μL 100 mM EDTA ile söndürüldü. Bu reaksiyon koşulu için beklenen nihai mRNA verimi 15 mg/mL idi, yani su vermeye bağlı 2 kat seyreltmeyi analiz için MPA+NaCl'de 400 kat seyreltme izledi. Numune toplamda 800 kat seyreltildi, yani 15 mg/mL üretimde bile analitik kromatografik kolona yüklenen mRNA konsantrasyonu hala kalibrasyon eğrisi konsantrasyonları içindeydi.
A260'taki NTP ve mRNA alanları, her bir zaman noktasında (tx) her bir numune için entegre edildi. Alanlar daha sonra, mRNA kalibrasyon eğrisi ve NTP'ler için tüketim yüzdesi kullanılarak, NTP'lerin A260 alanı kullanılarak 0 dk'da (t0) %100 olarak mRNA konsantrasyonlarına dönüştürüldü (aşağıdaki denkleme bakın).
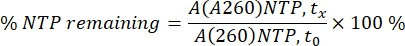
Sonuçlar, zamanın x ekseninde ve mRNA konsantrasyonunun gösterildiği ve kalan NTP'lerin y ekseninde gösterildiği her bir IVT reaksiyonu için grafikler olarak gösterilebilir (Şekil 2A). Zamana bağlı olarak mRNA konsantrasyonları anlamına gelen tüm IVT, tek bir grafikte birlikte çizilebilir ve mRNA üretim kinetiği incelenebilir ve optimal IVT koşulları seçilebilir (Şekil 2B).
Beslemeli toplu deney için IVT, Tablo 3'te yazıldığı gibi karıştırıldı. 300 μL IVT reaksiyon karışımından, IVT reaksiyonundan 2 μL IVT numunesi çıkarıldı ve her 30 dakikada bir 2 μL 100 mM EDTA ile söndürüldü. Ek olarak, numune her toplu NTP + MgCl2 ilavesinden hemen sonra alındı. Önceden her bir NTP'den 42.4 mM ve 152.5 mM MgCl2 içeren bir besleme çözeltisi hazırlandı ve her bir 200 mM NTP'den 106 μL, 76.2 μL 1 M MgCl2 ile karıştırıldı. Her saat bolus yeminin eklendiği bir besleme rejimi oluşturulmuştur (60 dakika, 120 dakika, 180 dakika ve 240 dakika inkübasyonda). Besleme rejimi Tablo 3'te açıklanmıştır: Numuneler, toplu IVT reaksiyonu için tarif edildiği gibi analitiklerle neredeyse gerçek zamanlı olarak analiz edildi. 300 dakikalık izlemeden sonra IVT reaksiyonu söndürüldü.
Sonuçlar, inkübasyon süresi boyunca kalan NTP'ler/mRNA üretimi olarak gösterilebilir. Bolus besleme ilaveleri aynı zamanda IVT reaksiyonunu da seyrelttiğinden, IVT'deki mRNA konsantrasyonu her yem ilavesinde düşer (Şekil 3A). mRNA kütlesindeki artış, zaman içinde mRNA üretiminde doğrusal bir artış gösteren transkripsiyon faktörleri (mmRNA/mpDNA olarak tanımlanır) ile de ölçülebilir ve sunulabilir (Şekil 3B).

Şekil 1: Şematik genel bakış (A) NTP'lerin ve mRNA'nın hat içi kromatografik analiz miktar tayini ile IVT optimizasyon iş akışının temsili. (B) (i) t0, (ii) orta nokta, (iii) son reaksiyon zaman noktalarında örneklenen bir toplu IVT reaksiyonunun temsili kromatogramları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Toplu IVT grafikleri. (A) Y ekseninde mRNA üretimi ve NTP tüketimi ile IVT reaksiyonunun temsili grafiği. Sınırlayıcı NTP (ATP) olarak NTP tüketimi ile ilişkili olan 120 - 180 dakikalık inkübasyonda görülebilen mRNA konsantrasyon platosu 120 dakikada tüketilir. (B) IVT tamponunun IVT kinetiği üzerindeki etkisini gösteren IVT grafiği. Tampon A (Tris+asetik asit) içeren IVT en hızlı mRNA üretimini gösterirken, bunu en yavaş olarak Tampon B (Tris+HCl) ve Tampon C (HEPES+NaOH) izledi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Fed-batch IVT grafiği. (A) NTP + MgCl2 beslemelerinin 60, 120, 180 ve 240 dakikada eklendiği IVT grafiği. IVT reaksiyonundaki mRNA konsantrasyonu, NTP + MgCl2 beslemesi ile seyreltme nedeniyle her besleme ilavesinde düşer. (B) Transkripsiyon faktörü ile gösterilen mRNA kütlesindeki artış, reaksiyon inkübasyonu boyunca doğrusaldır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Genel IVT protokolü. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Toplu IVT protokolü. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: Fed-batch IVT protokolü. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu yöntemde, IVT numuneleri, NTP'leri, pDNA'yı ve mRNA'yı ayıran analitik bir kromatografik multimodal kolon kullanılarak inkübasyon sırasında farklı zaman noktalarında analiz edilir, böylece NTP tüketiminin ve mRNA üretiminin yakından izlenmesine olanak tanır. Bu yöntem, NTP'leri ve mRNA konsantrasyonunu, belirlenen zaman noktalarında A260 alanlarındaki değişikliklere dayalı olarak kantitatif bir şekilde ölçer. Yöntem, NTP ve mRNA konsantrasyonu hakkında bilgi sağladığından, birincil hedefin genellikle mRNA verimini en üst düzeye çıkarmak ve reaksiyon süresini en aza indirmek olduğu IVT optimizasyonu için oldukça uygundur; bu nedenle, farklı IVT reaktiflerinin mRNA üretiminin kinetiği üzerindeki etkisini anlamak kritik öneme sahiptir22. Kesikli ve beslemeli kesikli modlarda IVT reaksiyonunu optimize etmek için hat içi izlemenin nasıl uygulanabileceğini gösteriyoruz.
Bu yöntemin ana avantajı, her numune 8 dakikanın altında analiz edildiğinden, IVT'nin neredeyse gerçek zamanlı olarak izlenmesine izin veren bir hat içi analizdir. Numunelerin analiz için hazırlanması basittir, çünkü önceden herhangi bir numune ön işlemi yapılmadan sadece MPA'da seyreltme gereklidir. Analiz için gereken numune hacmi çok düşüktür, örneğin 1 μL IVT. Bu küçük pipetleme hacmi, pipetleme hatalarından kaynaklanan analitik sapmalara neden olabilir. Bununla birlikte, analitik yaklaşımın yüksek verimi üçlü ölçümlere izin verdiğinden, aykırı değerler kolayca tanımlanabilir ve beklenen kinetik eğriden sapmaları tespit etmek zor değildir.
Yöntemin sınırlamalarından biri, UTP ve CTP'nin kromatografik ko-elyonudur. Bir mRNA dizisindeki sınırlayıcı NTP genellikle ATP veya GTP olduğundan, UTP ve CTP'nin kesin miktar tayini genellikle gerekli değildir. UTP ve CTP'nin ayrı ayrı miktar tayini gerekiyorsa, UTP ve CTP için 260 nm ve 280 nm'de UV absorbansındaki fark, kromatografik zirvedeki her NTP'nin nispi bolluğunu elde etmek için kullanılabilir.
Bu analitik yöntem, uzunluğu 100 nükleotidin üzerindeki RNA türlerini ayırmaz; bu nedenle, mRNA kalitesindeki farklılıkları tespit etmek için kullanılamaz, örneğin, poliadenillenmemiş ve poliadenillenmiş mRNA arasında, dsRNA veya abortif transkriptler ile ssRNA arasında ayrım yapmaz ve bozulmuş ve bozulmamış mRNA arasında ayrım yapamadığı için stabilite çalışmaları için uygun değildir. Bununla birlikte, yöntem, circRNA, tRNA ve saRNA gibi diğer RNA modalitelerinin nicelleştirilmesi için kullanılabilir. Bu moleküller boyut ve yapı bakımından farklılık gösterse de, bir IVT reaksiyonunda her birinin üretim verimini incelemek için aynı analitik yöntem kullanılabilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yazarlar, yararlı tartışmalar için Tomas Kostelec, Blaž Bakalar, Nejc Pavlin, Andreja Gramc Livk ve Anže Martinčič Celjar'a teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm PES membrane filter, e. g. Sartolab BT 500 | Sartorius | 180E14---------E | |
| 0.5 mL plastic tubes; e. g. e. g. DNA LoBind, PCR clean | Eppendorf | 30108035 | |
| 1.5 mL plastic tubes; e. g. DNA LoBind, PCR clean | Eppendorf | 30108051 | |
| ATP Solution | MEBEP BIOSCIENCE | R1331T2 | |
| Benchtop cooler -20 °C | Brand | 114935 | |
| CIMac PrimaS 0.1 mL Analytical Column (2 µm) | Sartorius BIA Separations | 110.5118-2, 2 µm channels | |
| CTP Solution | MEBEP BIOSCIENCE | R3331T2 | |
| DTT | Sigma | 10197777001 | |
| EDTA-Na2 x 2H2O | Kemika | e.g. 11368 08 | |
| GTP Solution | MEBEP BIOSCIENCE | R2331T2 | |
| HEPES | Merck | 1.10110.1000 | |
| HPLC high recovery vial | Macherey-Nagel | 702860 | |
| MgCl2 | Invitrogen | AM 9530G | |
| Microvolume spectrophotometer | Thermo Scientic | Nanodrop | |
| mRNA standard, mFix4, 4000 nt | Sartorius BIA Separations | BIA-mFix4.1.1 | |
| Na4P2O7 + 10 H2O | Sigma | S6422-500G | |
| NaCl | Fluka | 31434-1KG-M | |
| NaOH | Merck | 1064691000 | |
| PATfix mRNA analytical platform | Sartorius BIA Separations | PAT0021 | |
| Pipette 100 – 1000 μL | Eppendorf | Reference 2 | |
| Pipette 2 – 10 μL | Eppendorf | Reference 2 | |
| Pipette 20 – 200 μL | Eppendorf | Reference 2 | |
| Pyrophosphatase | MEBEP BIOSCIENCE | M2403L | |
| Rnase Away Decontamination Reagent | Thermo Scientic | 10328011 | |
| RNAse inhibitor | MEBEP BIOSCIENCE | RNK3501 | |
| Spermidine | Sigma | 85558-5G | |
| T7 mRNA polymerase | MEBEP BIOSCIENCE | TR01 | |
| Thermoblock | Thermo Scientic | EPPE5382000.015 | |
| Trizma Base | Sigma | T6066-1KG | |
| UTP Solution | MEBEP BIOSCIENCE | R5331T2 | |
| Vial caps | Macherey-Nagel | 70245 | |
| Vortex | IKA | V1900 |
Referanslar
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nat Biotechnol. 40, 840-854 (2022).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. 384 (5), 403 (2021).
- Lopez Bernal, J., et al. Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant. N Engl J Med. 385 (7), 585-594 (2021).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. mRNA-based therapeutics - developing a new class of drugs. Nat Rev Drug Discov. 13, 759-780 (2014).
- Baptista, B. R., Carapito, N., Pichon, C., Sousa, F. mRNA, a revolution in Biomedicine. Pharmaceutics. 13, 2090 (2021).
- Rosa, S. S., Prazeres, D. M. F., Azevedo, A. M., Marques, M. P. C. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 39, 2190 (2021).
- Whitley, J., et al. Development of mRNA manufacturing for vaccines and therapeutics: mRNA platform requirements and development of a scalable production process to support early phase clinical trials. Transl. Res. 242, 38-55 (2022).
- Kis, Z., Kontoravdi, C., Shattock, R., Shah, N. Resources, production scales and time required for producing RNA vaccines for the global pandemic demand. Vaccines. 9 (1), 3 (2021).
- Hengelbrock, A., Schmidt, A., Helgers, H., Vetter, F. L., Strube, J. Scalable mRNA machine for regulatory approval of variable scale between 1000 clinical doses to 10 million manufacturing scale doses. Processes. 11, 745 (2023).
- Rosa, S. S., et al. Maximizing mRNA vaccine production with Bayesian optimization. Biotechnol Bioeng. 119 (11), 3127-3139 (2022).
- Sari, Y., Sousa, S. S., Jeffries, J., Marques, M. P. C. Comprehensive evaluation of T7 promoter for enhanced yield and quality in mRNA production. Sci Rep. 14, 9655 (2024).
- Kumar, A., et al. The mRNA vaccine development landscape for infectious diseases. Nat Rev Drug Discov. 21 (5), 333-334 (2022).
- Pregeljc, D., et al. Increasing yield of in vitro transcription reaction with at-line high pressure liquid chromatography monitoring. Biotechnol Bioeng. 120 (3), 737-747 (2023).
- Kern, J. A., Davis, R. H. Application of a fed-batch system to produce RNA by in vitro transcription. Biotechnol Prog. 15 (2), 174-184 (1999).
- Skok, J., et al. Gram-Scale mRNA Production Using a 250-mL Single-Use Bioreactor. Chemie Ingenieur Technik. 94 (12), 1928-1935 (2022).
- Welbourne, E. N., et al. Anion exchange HPLC monitoring of mRNA in vitro transcription reactions to support mRNA manufacturing process development. Front Mol Biosci. 11, 1250833 (2024).
- Lee, K. H., Song, J., Kim, S., Han, S. R., Lee, S. W. Real-time monitoring strategies for optimization of in vitro transcription and quality control of RNA. Front Mol Biosci. 10, 1229246 (2023).
- Matuszczyk, J. C., et al. Raman spectroscopy provides valuable process insights for cell-derived and cellular products. Curr Opin Biotechnol. 81, 102937 (2023).
- Mu, X., Hur, S. Immunogenicity of in vitro-transcribed RNA. Acc Chem Res. 54 (21), 4012-4023 (2021).
- Cho, E., et al. Mesoporous silica particle as an RNA adsorbent for facile purification of in vitro-transcribed RNA. Int J Mol Sci. 24 (15), 12408 (2023).
- Ziegenhals, T., et al. Formation of dsRNA by-products during in vitro transcription can be reduced by using low steady-state levels of UTP. Front Mol Biosci. 10, 1291045 (2023).
- Höfer, K., Langejürgen, L. V., Jäschke, A. Universal aptamer-based real-time monitoring of enzymatic RNA synthesis. J Am Chem Soc. 135 (37), 13692-13694 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır