Method Article
Karaciğer segmentleri VII ve VIII'in hassas anatomik hepatektomisi için trans-arteriyel indosiyanin yeşili boyama
Bu Makalede
Özet
Laparoskopik anatomik hepatektomi, karaciğer cerrahisinde dünya çapında tanınırlık kazanmıştır. Bununla birlikte, karaciğer segmentleri VII ve VIII'deki tümör sınırlarının tanımlanması belirgin teknik zorluklar ortaya çıkarmaktadır. Bu protokol, karaciğer alt segmentlerini doğru bir şekilde tanımlamak için trans-arteriyel indosiyanin yeşili (ICG) boyamasını kullanır ve fonksiyonel karaciğer hacmini korurken tam tümör rezeksiyonunu kolaylaştırır.
Özet
Rezektabl hepatosellüler karsinom (HCC) için anatomik hepatektomi, karaciğer segmentlerini tanımlamak, cerrahi radikalliği artırmak ve karaciğer hacmini korumak için Glissonean sistemi, ultrason görüntüleme ve indosiyanin yeşili (ICG) floresan boyama kullanılarak hassas bir şekilde gerçekleştirilir. Bununla birlikte, karaciğer segmentleri VII ve VIII'deki derin yerleşimli tümörler için laparoskopik klempleme ve ultrason kılavuzluğunda ICG boyama, Glissoone kanallarının derinliği ve diğer teknik sınırlamalar nedeniyle zorluklar doğurur. Bu çalışma, karaciğer segmentleri VII ve VIII'in karmaşık anatomik hepatektomisi için özel olarak tasarlanmış bir teknik olan trans-arteriyel ICG boyamayı kullanan bir protokolü keşfederek bu engellerin üstesinden gelmeyi amaçladı. Bu yöntemde, bir girişimci sağ femoral artere erişti ve arteriyografi için çölyak gövdesine ilerledi, ardından cerrahi rezeksiyonu kolaylaştırmak için tümörün kan besleme damarına bir mikrokateterin stratejik olarak yerleştirildi. Ameliyat sırasında, tümörün karaciğer segmentini floresan olarak etiketlemek için mikrokateter yoluyla ICG enjekte edildi ve floresan rehberliğinde hassas anatomik rezeksiyon sağlandı. Bu trans-arteriyel ICG boyama yaklaşımı, tümör alt segmentlerinin doğru bir şekilde tanımlanmasına olanak tanır, tam rezeksiyonu kolaylaştırır ve karaciğer fonksiyonunun korunmasını optimize eder, sonuçta cerrahi komplikasyon oranlarını artırmadan onkolojik sonuçları iyileştirir.
Giriş
Hepatosellüler karsinom (HCC), sindirim sisteminin en yaygın malign tümörüdür ve Çin'de görülme sıklığında dördüncü, dünya çapında ise ilk sırada yer almaktadır. HCC, dünya çapında yıllık yeni vaka ve ölümlerin tahmini %50'sini oluşturmaktadır1. Laparoskopik anatomik hepatektomi, erken evre HCC2,3 hastaları için birincil radikal tedavilerden biridir. Glissonean sistemine göre, karaciğerin karmaşık mimarisi, her biri kendi kan kaynağına, safra kanalına ve vasküler drenaja sahip sekiz ayrı bölüme kesin olarak bölünmeye izin verir. Bu anatomik segmentasyon, her segmenti saran ve karaciğerin fonksiyonel ve cerrahi bölümleri için yapısal bir temel sağlayan Glisson kapsülüne dayanmaktadır4. Rezeksiyonun kapsamı karaciğer yüzeyinin iskemik alanlarına göre belirlenebilse de, segmentler arası anatomik planlar daha çok hepatik ven oryantasyonuna veya operatörün subjektif görsel değerlendirmesine dayanır5.
Teknolojik gelişmeler, hepatobiliyer cerrahların, spesifik karaciğer segmentlerini tanımlamak için ultrason rehberliği ve indosiyanin yeşili (ICG) floresan boyama kullanarak anatomik hepatektomi yapmalarını sağlamış, bu da radikal sonuçların iyileşmesine ve rezidüel karaciğer hacminin artmasına yol açmıştır 6,7. ICG boyama, derin hepatik rezeksiyon için düzlemin net bir şekilde sınırlandırılmasını sağlar ve pozitif ve negatif boyama8 olarak kategorize edilir. Bununla birlikte, segment VII ve VIII'de bulunan tümörler için, Glissonean kanalları karaciğer parankimine derinlemesine nüfuz ederek laparoskopik klemplemeyi ve ardından negatif boyamayı zorlaştırır9.
Konvansiyonel negatif boyama yönteminin ötesinde, ICG'nin ultrason rehberliğinde doğrudan hedef segmentin portal venine enjekte edilmesiyle pozitif boyama gerçekleştirilebilir ve karaciğer segmenti sınırları kesin olarak belirlenir. Bununla birlikte, bu teknik, ultrason rehberliğinin teknik sınırlamaları ve portal ven dallanma paternlerindeki varyasyonlar nedeniyle zorluklar ortaya çıkarmaktadır10,11. Ek olarak, hedeflenen pozitif boyama için belirli portal ven dallarına doğru bir şekilde erişmek genellikle karmaşıktır. Portal ven anatomisindeki değişkenlik, deneyimli cerrahlar için bile prosedürel doğruluğu etkileyebilecek belirsizliğe neden olur. Bu zorluklar göz önüne alındığında, karaciğer segmenti tanımlamasının hassasiyetini artırmak için yeni teknikler geliştirmek hepatobiliyer cerrahide kritik hale gelmiştir. Doğru pozitif boyama sonuçları elde etmek için karaciğerin karmaşık vasküler manzarasının verimli bir şekilde gezinmesini kolaylaştıran gelişmelere acilen ihtiyaç vardır.
Hepatik arteriyografi, bir kontrast maddenin stratejik enjeksiyonu ile birlikte hepatik arterin minimal invaziv kateterizasyonunu içeren son teknoloji bir tanı tekniğidir. Bu görüntüleme yöntemi, karaciğerin karmaşık vasküler ağının net bir görüntüsünü sağlar ve hepatoselüler karsinomun (HCC) kan akışını görselleştirmek ve haritalamak için çok önemli bir adımdır12. Ayrıca, hepatik arter kanın %90'ına kadarını HCC'lere sağlar. Sonuç olarak, hepatik arteriyografi, hassas trans-arteriyel kemoembolizasyon ve hepatik arter infüzyon kemoterapisi dahil olmak üzere kesin tümör tanımlaması ve hedefe yönelik tedavi planlarının formülasyonu için hayati bir araçtır13,14.
Bu çalışma, karaciğer segmentleri VII ve VIII'in karmaşık anatomik hepatektomisi için özel olarak tasarlanmış bir teknik olan trans-arteriyel indosiyanin yeşili (ICG) boyamayı kullanan bir protokolü araştırdı. Bu yöntem, ICG'nin hedeflenen hepatik vaskülatüre hassas bir şekilde enjekte edilmesini sağlayarak karaciğerin anatomik segmentlerinin canlı bir şekilde görüntülenmesine, hedef hepatik pedikülün doğru bir şekilde tanımlanmasına ve hepatik rezeksiyon düzleminin net bir şekilde sınırlandırılmasına olanak tanır. Etkilenen segmentleri besleyen spesifik kan damarlarının seçici ICG floresan boyaması, karaciğerin karmaşık yapısını etiketler ve cerrahlara karaciğer segmentlerinin gerçek zamanlı, yüksek çözünürlüklü bir haritasını sağlar. Bu hassasiyet seviyesi sadece tam tümör eksizyonunu sağlamakla kalmaz, aynı zamanda rezidüel karaciğer fonksiyonunun korunmasını optimize eder ve sonuçta postoperatif yaşam kalitesini iyileştirir. Bu ilerleme, etkili tümör çıkarılması ve karaciğer fonksiyonunun sürdürülmesi arasında bir denge sağlayarak onkolojik sonuçları önemli ölçüde artırır. Ayrıca, bu teknik ek cerrahi riskler veya komplikasyonlar getirmez. Son olarak, bu protokolün hepatik arteriyografiye entegre edilmesi, etkilenen hastaların en güvenli, en etkili ve en yenilikçi bakımı almasını sağlayarak HCC için cerrahi standartlarda bir evrimi temsil eder.
Protokol
Bu çalışma protokolü, insan deneyleri ile ilgili ilgili komite tarafından belirlenen etik yönergelere bağlı kalmış ve kurumsal ve ulusal standartlara uygun olup, ayrıca 1964 Helsinki Bildirgesi ve müteakip değişikliklerinde belirtilen ilkelere uygundur. Bu çalışma için etik onay, Guangdong İl Halk Hastanesi Etik Komitesi Kurumsal İnceleme Kurulu tarafından verilmiştir. Bu çalışmaya dahil edilen ve anonimleştirilmiş bilgilerin yayınlanması için yazılı onay veren hastadan bilgilendirilmiş onam alındı. Senkron girişimler için endikasyonlar ve kontrendikasyonlar, laparoskopik radikal hepatosellüler karsinom cerrahisi için olanlarla geniş ölçüde uyumludur, ancak özel hususları içerir. Dahil edilme kriterleri, özellikle segmental portal venin delinmesinin zor olduğu durumlarda, S4A, S8V ve S8D gibi karaciğer alt segmentlerinin havza rezeksiyonundan oluşuyordu; açıkça tanımlanmış bir vasküler besleme; ve aynı karaciğer segmenti veya lob ile sınırlı çoklu tümör nodülleri. Dışlama kriterleri, arteriyovenöz fistül, vasküler varyantlar veya vasküler tıkanıklık gibi karmaşık vasküler durumların yanı sıra kontrast maddeye karşı bilinen bir alerjiyi içeriyordu. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Ameliyat öncesi hazırlık
- Ameliyattan önce cerrahi aletleri sterilize edin ve ekipmanın işlevselliğini doğrulayın.
- Karın derisini temizleyin ve ameliyattan önce 6 saat boyunca içmediğinizden emin olun.
2. Transkateter hepatik arter embolizasyon prosedürü
- Sağ uyluğu sterilize edin ve cerrahi çarşafları düzenleyin.
- Hastayı% 2 lidokain ile uyuşturun ve sağ kasık ligamentinden yaklaşık 1.5 cm daha düşük bir bölgede arteriyel ponksiyon yapın.
- Tümör kan akışını görselleştirin. Segment VII ve VIII (sırasıyla A7 ve A8) içindeki sağ hepatik arterin dallarından kaynaklanan tümörün kan akışını tanımlayın15.
- ICG'yi (1:500 seyreltme, 3 mL) A7'ye (tümörün esas olarak segment VII'de bulunduğu yerde) enjekte edin, embolizasyon bobinini bir mikrokateter aracılığıyla A7'ye verin ve A716'ya kan akışını engellemek için embolizasyon bobinini serbest bırakın.
- İntraoperatif ICG enjeksiyonu için A8'e bir mikrokateter yerleştirin.
- Adım 2.2'de oluşturulan delinme bölgesine basınç uygulayın ve hemen laparoskopik anatomik hepatektomi aşamasına geçin.
3. Karaciğer segmentlerinin laparoskopik anatomik hepatektomisi VII/VIII
- Ultrason neşteri kullanarak karın boşluğu ile sağ karaciğer arasındaki yapışıklıkları ayırın.
- Normal laparoskopiden ICG floresan moduna geçtikten sonra segment S7'deki tümörün kenarındaki floresan lekelenmesini görselleştirin.
- Perihepatik ligamenti serbest bırakın ve tümör adezyonunu diyaframdan ayırın.
- A8'de önceden konumlandırılmış bir mikrokateter aracılığıyla A8'in intraoperatif ICG boyamasını (1:500 seyreltme, 3 mL) gerçekleştirin.
- Ultrason kullanarak tümör sınırlarını (S7 ve S8 segmentlerinde, yaklaşık 8 cm × 7 cm'de bulunur) yeniden doğrulayın.
- Floresan sınırı boyunca önceden kesilmiş bir çizgi yapın.
NOT: Tümör yaklaşık 8 cm × 7 cm olduğundan, onkolojik güvenliği korurken tam rezeksiyonu sağlamak için önceden kesilmiş çizgi tümör sınırlarından biraz daha büyük olmalıdır. - Ultrasonik bir neşter kullanarak karaciğer parankimini kesin.
NOT: Tümör yaklaşık 8 cm × 7 cm olduğundan, güvenli bir sınır sağlamak için karaciğer parankimi insizyonu floresan sınırının en az 1 cm ötesine uzanmalıdır. - Segmentler arası damarları S6 ve S7 segmentleri arasına sıkıştırın, ardından transeksiyon yapın.
- Sağ hepatik venin terminal ucunu ortaya çıkarın, kelepçeleyin ve transekt.
- Ekstrafasiyal yaklaşımı kullanarak Glisson'un pedikülünü ortaya çıkarın17.
- Hepatik kısa damarları kelepçeleyin ve kesin.
- Glisson'un segment 7 ve 8'in pediküllerini yeterince ortaya çıkarın (G7, G8).
- Bir kesme tıkayıcı kullanarak Glisson'un segment 7'deki pedikülünü kesin.
- Glisson'un segment 8 (G8) pedikülünü yeterince açığa çıkarın.
- 4-0 numara bir sütür atın ve Glisson'un segment 8 (G8) pedikülünü kesmek için bir kesme tıkayıcı kullanın.
- Sağ hepatik venin kökenini ortaya çıkarın.
- Bir kesme tıkayıcı kullanarak sağ hepatik venin kökenini kesin.
- Tümörü minimal invaziv bir subksifoid insizyondan çıkarın.
4. Ameliyat sonrası bakım ve izleme
- Kan basıncı, kalp atış hızı, oksijen satürasyonu ve idrar çıkışı dahil olmak üzere hayati belirtilerin yakından izlenmesi için hastayı yoğun bakım ünitesine (YBÜ) veya yüksek bağımlı bir üniteye aktarın.
- Kurumsal protokollere göre hasta kontrollü analjezi (PCA) veya intravenöz analjezikler kullanarak postoperatif ağrı yönetimini uygulayın.
- Cerrahi bölgeden drenaj çıkışını değerlendirerek ve düzenli aralıklarla hemoglobin seviyelerini kontrol ederek kanama veya kanama belirtilerini izleyin.
- Bulantı, kusma veya gastrointestinal rahatsızlık belirtilerini izlerken, berrak sıvılarla başlayarak ve tolere edildiği gibi düzenli bir diyete ilerleyerek oral alımı kademeli olarak yeniden başlatın.
- Görüntüleme ve kan testleri yoluyla karaciğer rejenerasyonunu, tümör nüksünü (varsa) ve genel iyileşmeyi izlemek için düzenli takip ziyaretleri planlayın.
NOT: Bu çalışma için ameliyattan sonraki ilk ay, ardından ameliyat sonrası 2 yıl boyunca her 3 ayda bir takip edildi.
Sonuçlar
Hastanın preoperatif üç boyutlu (3D) karaciğer rekonstrüksiyonu ve hepatik arteriyografisinde tümörün primer olarak hepatik arterin A7 ve A8 dalları tarafından vaskülarize olduğu görüldü (Şekil 1). A7 dalını tıkamak için bir embolizasyon bobini kullanıldı ve intraoperatif indosiyanin yeşili (ICG) enjeksiyonu için dal A8'e bir mikrokateter yerleştirildi (Şekil 2).
Transkateter hepatik arter embolizasyonunu takiben, A8 dalındaki mikrokateterden ICG enjekte edildi ve karaciğerin S8 segmentinde floresan boyanması elde edildi (Şekil 3). Daha sonra ICG eşliğinde laparoskopik tümör rezeksiyonu yapıldı. Şekil 4 , Glisson'un pedikülleri G7 ve G8'in devaskülarizasyonunu göstermektedir.
Cerrahi sonuçlar Tablo 1'de sunulmuştur. Bu çalışmada laparoskopik hepatektomi 3 saatin altında tamamlanmış olup, işlemin etkinliği gösterilmiştir. Tahmini kan kaybı yaklaşık 200 mL idi ve hepatik kan akışını kontrol etmek için kan transfüzyonu veya intraoperatif müdahalelere olan ihtiyacı ortadan kaldırdı. Ek olarak, önemli bir tümör belirteci olan serum alfa-fetoprotein seviyeleri, 17.878 ng/mL'den 6.09 ng/mL'ye önemli bir düşüş gösterdi ve bu da tedaviye olumlu bir tümör yanıtı olduğunu gösterdi. Hastanın postoperatif karaciğer fonksiyonu klinik olarak kabul edilebilir eşikler içinde kaldı ve bu da ölümcül karaciğer yetmezliği gibi ciddi komplikasyonların olmadığını düşündürdü. Son olarak, postoperatif patoloji, başarılı onkolojik cerrahinin ayırt edici özelliği olan negatif rezeksiyon sınırları ile kanıtlandığı gibi, hepatosellüler karsinomun (HCC) tam eksizyonunu doğruladı.

Şekil 1: Karaciğerin üç boyutlu rekonstrüksiyonu ve hepatik arterin anjiyografisi. (A) Karaciğerin üç boyutlu rekonstrüksiyonu. (B) Hepatik arter anjiyografisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
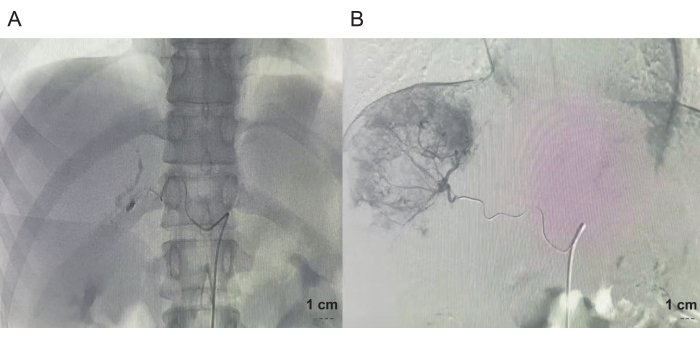
Şekil 2: Transkateter hepatik arter embolizasyon işlemi. (A) Sağ hepatik arterin A7 dalının embolizasyonu. (B) Sağ hepatik arterin A8 dalına mikrokateter yerleştirilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Karaciğer segmentleri S7 ve S8'in floresan lokalizasyonu. A8 dalına yerleştirilen bir mikrokateter yoluyla indosiyanin yeşili enjeksiyonunu takiben, karaciğer segmentleri S7 ve S8'in floresan boyanması gözlenir. Floresan modunda yakalanan görüntü, yeşil görünen S7 ve S8 segmentlerinin havza sınırlarını çiziyor. Buna karşılık, korunacak karaciğer dokularının su havzaları normal renklenmelerini korur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
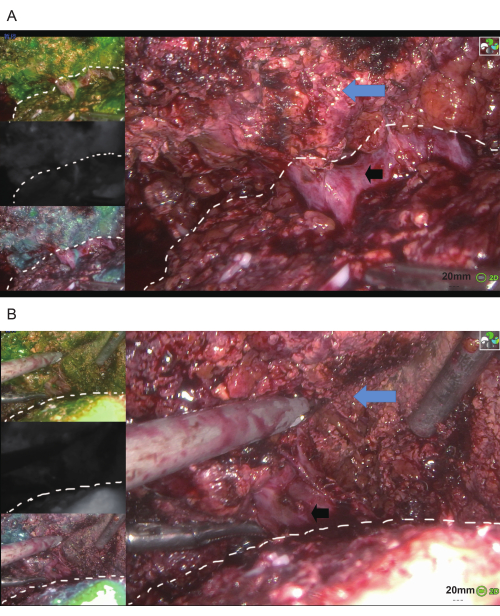
Şekil 4: İndosiyanin yeşili floresan ile yönlendirilen laparoskopik tümör rezeksiyonu. (A) Glisson pedikülü G7'nin devaskülarizasyonu. Soldaki üç resim G7'yi floresan, siyah-beyaz floresan ve sahte renkli floresan modlarında gösterirken, sağdaki resim G7'yi beyaz ışık altında gösteriyor. Mavi oklar karaciğeri, siyah oklar Glisson'un pedikülü G7'yi ve beyaz noktalı çizgi rezeksiyonun havzasını temsil eder ve rezeksiyon alanı çizginin üzerinde yer alır. (B) Glisson pedikülü G8'in devaskülarizasyonu. Soldaki üç görüntü G8'i floresan, siyah-beyaz floresan ve sahte renkli floresan modlarında gösterirken, sağdaki görüntü G8'i beyaz ışık altında sunar. Mavi oklar karaciğeri, siyah oklar Glisson'un pedikülü G8'i ve beyaz noktalı çizgi rezeksiyonun havzasını temsil eder ve rezeksiyon alanı çizginin üzerinde yer alır. Ölçek çubukları: 20 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Değişken | Sonuç -ları |
| Preoperatif | |
| AFP (ng/ml) | 17878 |
| İntraoperatif | |
| Operasyon süresi (saat) | 3 |
| Kan kaybı (ml) | 200 |
| Ameliyat sonrası-bir hafta | |
| Ameliyat sonrası hastanede kalış süresi (gün) | 5 |
| AFP (ng/ml) | 6.09 |
| Albümin (g/l) | 43.6 |
| Toplam bilirubin (μmol/L) | 11.9 |
| Ameliyat sonrası patolojik bulgular | Negatif kenarlı hepatosellüler karsinom. |
| Ameliyat sonrası bir ay | |
| ALT (u/l) | 47 |
| AFP (ng/ml) | 5.12 |
| Kreatinin (g/l) | 92.7 |
| Toplam bilirubin (μmol/L) | 18.4 |
| CT | Tekrarlayan lezyon tespit edilmedi. |
Tablo 1: Birincil cerrahi sonuçlar. Bu çalışmada tek bir hastada uygulanan yeni bir teknik olgu sunumu sunulmuştur.
Tartışmalar
Karaciğerin üst arka bölgeleri, özellikle segment VII ve VIII, anatomik sınırda önemli zorluklar ortaya çıkarmaktadır. Sonuç olarak, bu segmentlerin kesin olarak tanımlanması ve rezeke edilmesi, karaciğer cerrahisinin karmaşık ancak kritik yönleridir18,19. Anatomik hepatektomi sırasında trans-arteriyel indosiyanin yeşili (ICG) boyama yaklaşımı, bu segmentlerdeki tümörlerin tedavisinde belirgin avantajlar sağlar.
Segment VII ve VIII'deki tümörler diyaframın yakınında ve karın boşluğunun derinliklerinde bulunur. Sonuç olarak, hedef damarların hepatik hilum yaklaşımıyla diseksiyonu, intrahepatik kanallarda kasıtsız yaralanma riski taşır20. Ek olarak, sağ arka lobun pedikülünde önemli anatomik farklılıklar vardır21. Bu segmentlere karaciğer parankimi yoluyla yaklaşmak, intrahepatik damarların pozisyonunu ve seyrini tanımlamayı zorlaştırabilir ve yalnızca subjektif yargıya dayandığında rezeksiyon aralığının belirlenmesini zorlaştırabilir. Bu nedenle, ICG boyaması bu gibi durumlarda çok önemli bir rol oynar. Geleneksel ICG yardımlı anatomik hepatektomide, hassas floresan boyama, sağ arka lob22 içindeki pedikülün izole edilmesine veya ultrason eşliğinde delinmesine bağlıdır. Konvansiyonel ICG kılavuzluğunda laparoskopik hepatektomi ile karşılaştırıldığında, bu çalışmadaki teknik önemli bir adım içermektedir: ICG23,24'ün trans-arteriyel enjeksiyonu.
Bu protokol, tümörü içeren hepatik segmenti etkili bir şekilde boyayarak, Glisson pedikülünün laparoskopik klemplenmesi ve ultrason eşliğinde ponksiyon ile ilişkili teknik sınırlamaların üstesinden gelir. Bununla birlikte, konvansiyonel postoperatif komplikasyonlara ek olarak, bu teknik, kontrast alerjisi, kanama, enfeksiyon, vasküler yaralanma, tromboz, vazospazm, vasküler tıkanıklık, miyokard enfarktüsü ve inme gibi vasküler girişimlerle ilişkili potansiyel riskleri de beraberinde getirir. Bu riskler hastaya tam olarak iletilmelidir, ancak bu çalışmada böyle bir komplikasyon gözlenmemiştir. Sağ hepatik arter dallanma süperseleksiyonu prosedürü, kollateral teknikler konusunda deneyimli girişimciler tarafından gerçekleştirildi. Bu prosedür, iç çapı 0,038" olan bir 4-6 Fr kateter ve dış çapı 0,035" olan ultra pürüzsüz bir kılavuz telin kullanılmasını gerektirir. Bu teknik öncelikle, optimal kateter konumlandırmasını sağlamak için iyi zamanlanmış aşağı doğru çekme veya itme manevraları ile desteklenen kontrollü sağ el manevralarını içerir.
Hepatik arter embolizasyonu, kemoterapi ve laparoskopik parsiyel hepatektomi iyi bilinen tedavi seçenekleridir. Bununla birlikte, bu çalışmada kullanılan tekniğin yeniliği, girişimsel embolizasyonun indosiyanin yeşili (ICG) floresan boyama ile kombinasyonunda yatmaktadır, bu da S7 ve S8 segmentlerinin kapsamını kesin olarak tanımlar. Bu yaklaşım, normal karaciğer dokusunun korunmasını en üst düzeye çıkarırken doğru anatomik hepatik rezeksiyonu mümkün kılar.
Bu çalışmada, hastanın karaciğer fonksiyonu %70'te kaldı, transaminaz seviyelerinde sadece hafif bir yükselme oldu ve takip sırasında karaciğer yetmezliği olmadı. Ek olarak, aritmiler ve komplikasyonlar dahil olmak üzere postoperatif riskler önemli ölçüde azaldı. Hasta hastanede yatış sırasında herhangi bir enfeksiyon veya plevral efüzyon belirtisi göstermedi ve ameliyat sonrası ikinci güne kadar yürüyebildi, bu da iyileşmenin hızlandığını gösteriyor. Operasyon minimum kan kaybı (200 mL) içeriyordu ve 3 saatin altında tamamlandı. Hasta postoperatif iyileşme gösterdi, 5 gün hastanede kaldı ve negatif cerrahi sınırlar patoloji tarafından doğrulandı. Düzenli takip şu anda devam etmektedir.
Birden fazla damardan kan akışı olan tümörlerde, etkili intraoperatif ICG boyaması sağlamak için seçici embolizasyon çok önemlidir. Spesifik olarak, ICG enjeksiyonu için tek bir damarı korurken tümörün kan akışının bir kısmını embolize etmek, normal karaciğer dokusuna sızıntıyı önler, böylece yanlış pozitif sonuç riskini azaltır. Bu çalışmada, tümör A7 ve A8 dalları tarafından sağlandı. Dal A7 embolize edilirken, dal A8 intraoperatif ICG enjeksiyonu için saklandı. Bu strateji, hedef hepatik pedikülün hassas bir şekilde tanımlanmasını ve hepatik rezeksiyon düzleminin net bir şekilde sınırlandırılmasını kolaylaştıran optimal floresan boyama ile sonuçlandı.
Anatomik hepatektomi sırasında bu yenilikçi girişim destekli indosiyanin yeşili (ICG) boyama yöntemi çeşitli avantajlar sunsa da, bazı doğal sınırlamalar göz önünde bulundurulmalıdır. İlk olarak, bu prosedür vazospazmlar25,26 gibi vasküler müdahalelere kontrendikasyonu olan hastalar için uygun olmayabilir ve böylece uygulanabilirliğini sınırlar. İkincisi, ICG floresan boyama, sklerozan nodüller, fokal nodüler hiperplazi ve hepatik kistler27 gibi durumları teşhis ederken yüksek yanlış pozitif oranlar üretebilir ve boyama sonuçlarının dikkatli bir şekilde yorumlanması ihtiyacını vurgular.
Ek olarak, çalışmalar floresan boyama paternleri ile hepatosellüler karsinom (HCC) farklılaşmasının derecesi arasında bir ilişki olduğunu bildirmiştir. Spesifik olarak, zayıf diferansiye HCC dokuları, tümörü çevreleyen halka şeklinde floresan sergiler, orta derecede diferansiye HCC dokuları kısmi floresan ile mevcut ve yüksek derecede diferansiye HCC dokuları tam floresan gösterir28. Son olarak, bu çalışmaya senkron girişim ile karaciğer kanseri rezeksiyonu yapılan sadece bir hasta dahil edildi. Sınırlı örneklem büyüklüğü, segment VII ve VIII'in standart rezeksiyonları ile doğrudan bir karşılaştırmayı engelledi. Bu nedenle, bu çalışma, daha büyük, çok örneklemli çalışmalar yoluyla daha fazla doğrulama gerektiren bu tekniğin fizibilitesini gösteren bir ön araştırma görevi görmektedir.
Sonuç olarak, karaciğer segment VII ve VIII'in anatomik hepatektomisi sırasında transarteriyel ICG boyaması, tümör alt segmentlerini tanımlamak için kesin bir strateji olarak hizmet edebilir. Bu teknik, karaciğer fonksiyonunu korurken tam tümör rezeksiyonunu kolaylaştırır, böylece cerrahi komplikasyon oranlarını artırmadan onkolojik sonuçları iyileştirir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma, Guangzhou Bilim ve Teknoloji Planı Projesi (202201010944) ve Guangdong İl Halk Hastanesi (8220160353) Aktivasyon Projesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| B-scan ultrasonography | BK Medical | Pro Focus 2202 | |
| Curved Cutter Stapler | ETHICON | ECH45C | |
| FloNavi Endoscopic Fluorescence Imaging System | OptoMedic Group | FloNavi 2100 | |
| Microcatheter | Hengrui Pharmaceuticals Co., Ltd. | C2215045 |
Referanslar
- Vogel, A., Meyer, T., Sapisochin, G., Salem, R., Saborowski, A. Hepatocellular carcinoma. Lancet. 400 (10360), 1345-1362 (2022).
- Liao, K. et al. Laparoscopic anatomical versus non-anatomical hepatectomy in the treatment of hepatocellular carcinoma: A randomised controlled trial. Int J Surg. 102, 106652 (2022).
- Reig, M. et al. Bclc strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol. 76 (3), 681-693 (2022).
- Takasaki, K. Glissonean pedicle transection method for hepatic resection: A new concept of liver segmentation. J Hepatobiliary Pancreat Surg. 5 (3), 286-291 (1998).
- Yamamoto, M., Katagiri, S., Ariizumi, S., Kotera, Y., Takahashi, Y. Glissonean pedicle transection method for liver surgery (with video). J Hepatobiliary Pancreat Sci. 19 (1), 3-8 (2012).
- Ishizawa, T. et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer. 115 (11), 2491-2504 (2009).
- Minami, Y. Kudo, M. Review of dynamic contrast-enhanced ultrasound guidance in ablation therapy for hepatocellular carcinoma. World J Gastroenterol. 17 (45), 4952-4959 (2011).
- Wang, X. et al. Consensus guidelines for the use of fluorescence imaging in hepatobiliary surgery. Ann Surg. 274 (1), 97-106 (2021).
- Aoki, T. et al. Ultrasound-guided preoperative positive percutaneous indocyanine green fluorescence staining for laparoscopic anatomical liver resection. J Am Coll Surg. 230 (3), e7-e12 (2020).
- Procopio, F. et al. Icg-enhanced compression anatomical segment 7 segmentectomy in laparoscopic and robotic approach. Ann Surg Oncol. 31 (7), 4445-4446 (2024).
- Wang, X. et al. Approaches of laparoscopic anatomical liver resection of segment 8 for hepatocellular carcinoma: A retrospective cohort study of short-term results at multiple centers in China. Int J Surg. 109 (11), 3365-3374 (2023).
- Alfidi, R. J., Rastogi, H., Buonocore, E., Brown, C. H. Hepatic arteriography. Radiology. 90 (6), 1136-1142 (1968).
- Kudo, M. et al. Randomised, multicentre prospective trial of transarterial chemoembolisation (tace) plus sorafenib as compared with tace alone in patients with hepatocellular carcinoma: Tactics trial. Gut. 69 (8), 1492-1501 (2020).
- Li, Q. J. et al. Hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin versus transarterial chemoembolization for large hepatocellular carcinoma: A randomized phase III trial. J Clin Oncol. 40 (2), 150-160 (2022).
- Abdel-Misih, S. R. Bloomston, M. Liver anatomy. Surg Clin North Am. 90 (4), 643-653 (2010).
- Zhu, W. et al. Retrograde venous coil embolization prior to transarterial chemoembolization in hepatocellular carcinoma with arterio-hepatic venous shunts. Diagn Interv Radiol. 28 (6), 616-620 (2022).
- Yamamoto, M. Ariizumi, S. I. Glissonean pedicle approach in liver surgery. Ann Gastroenterol Surg. 2 (2), 124-128 (2018).
- Kaneko, H., Takagi, S., Shiba, T. Laparoscopic partial hepatectomy and left lateral segmentectomy: Technique and results of a clinical series. Surgery. 120 (3), 468-475 (1996).
- You, N., Wu, K., Li, J., Zheng, L. Laparoscopic liver resection of segment 8 via a hepatic parenchymal transection-first approach guided by the middle hepatic vein. BMC Gastroenterol. 22 (1), 224 (2022).
- Rhu, J. et al. Laparoscopic versus open right posterior sectionectomy for hepatocellular carcinoma in a high-volume center: A propensity score-matched analysis. World J Surg. 42 (9), 2930-2937 (2018).
- Ban, D. et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 21 (10), 745-753 (2014).
- Chen, H. et al. Cystic plate approach combined with ICG fluorescence in laparoscopic anatomical hepatectomy. Int J Surg. 110 (9), 5685-5695 (2024).
- Xie, Q. et al. Transhepatic arterial approaches for ICG injection to guide laparoscopic anatomical hepatectomy: A case series study. Asian J Surg. 47 (2), 916-922(2024).
- Liu, Y. et al. Meta-analysis of indocyanine green fluorescence imaging-guided laparoscopic hepatectomy. Photodiagnosis Photodyn Ther. 35, 102354 (2021).
- Guan, R. et al. Patients with hepatocellular carcinoma extrahepatic metastases can benefit from hepatic arterial infusion chemotherapy combined with lenvatinib plus programmed death-1 inhibitors. Int J Surg. 110 (7), 4062-4073 (2024).
- Zhao, M. et al. Arterial chemotherapy for hepatocellular carcinoma in China: Consensus recommendations. Hepatol Int. 18 (1), 4-31 (2024).
- Zhu, W. et al. Perioperative and disease-free survival outcomes after hepatectomy for centrally located hepatocellular carcinoma guided by augmented reality and indocyanine green fluorescence imaging: A single-center experience. J Am Coll Surg. 236 (2), 328-337 (2023).
- Kaneko, J., Kokudo, T., Inagaki, Y., Hasegawa, K. Innovative treatment for hepatocellular carcinoma (HCC). Transl Gastroenterol Hepatol. 3, 78 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır