Method Article
Tümör Hücrelerinin Farelerin Omuriliğine Cerrahi Nakli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mevcut protokol, tümör hücrelerinin intervertebral boşluğa enjekte edilmesiyle tekrarlanabilir bir murin spinal kord gliomu modelinin geliştirilmesini tanımlamakta ve araştırma ve terapötik geliştirme için daha etkili ve daha az invaziv bir yaklaşım sunmaktadır.
Özet
Omurilik gliomları genellikle omuriliğin kötü huylu tümörleridir ve yüksek oranda özürlülüğe yol açar. Bununla birlikte, tek tip tedavi kılavuzları ve omurilik gliomları ile ilgili kapsamlı veriler, uygun preklinik hayvan modellerinin olmaması nedeniyle sınırlı kalmaktadır. Basit ve tekrarlanabilir bir hayvan modeli geliştirmek, temel ve translasyonel araştırmaları ilerletmek için gerekli hale gelmiştir. Murin omuriliği, insan omuriliği ile yapısal benzerlikler paylaştığı için bir murin modeli idealdir. Bu protokol, yedinci servikal omurun dikenli sürecini bir kılavuz olarak kullanarak tümör hücrelerini doğrudan intervertebral boşluğa enjekte ederek tekrarlanabilir bir murin spinal kord glioma modelinin oluşturulmasını tanımlar. Diğer yöntemlerle karşılaştırıldığında, bu yaklaşım daha etkili ve kullanışlıdır, daha küçük bir kesi, daha az invazivlik ve kan kaybı, daha hızlı iyileşme ve daha stabil tümör oluşumunu içerir. Bu modelin hastalık mekanizmalarının anlaşılmasını ilerletmesi, cerrahi stratejileri optimize etmesi ve omurilik gliomları için terapötik ilaçların geliştirilmesini desteklemesi beklenmektedir.
Giriş
Spinal kord gliomları, kauda equina'nınkiler de dahil olmak üzere, genellikle omuriliğin malign neoplazmlarıdır ve% 20-40'ı astrositom ve geri kalanı ependimomlar1 olarak sınıflandırılır. Histolojik özelliklere dayanarak, spinal kord gliomları dört dereceye (I-IV) ayrılır. Derece I ve II tümörler düşük dereceli gliomlar olarak kabul edilirken, derece III ve IV tümörler yüksek dereceli gliomlar olarak sınıflandırılır. Omurilik gliomları omuriliğin herhangi bir segmentinde ortaya çıkabilmesine rağmen, en sık servikal bölgede bulunur (vakaların %33'ü) ve diğer bölgelerde nispeten nadirdir, vakaların %26'sı torasik bölgede ve %24'ü bel bölgesinde2.
Cerrahi, radyoterapi ve alkilleyici ajanlar, büyük ölçüde beyin gliomları 3 ile ilgili klinik çalışmalardan tahmin edilen spinal kord gliomları için birincil tedavi seçenekleridir. Bununla birlikte, önceki araştırmalar, omurilik gliomlarının histolojik profillerinin beyin gliomlarınınkine benzemesine rağmen, farklı moleküler imzaların varlığının onları serebral muadillerinden ayırdığını göstermiştir4. Kohortumuzda, spinal kord glioma hastaları adjuvan kemoterapi veya radyoterapiden anlamlı bir fayda elde etmedi, bu da mevcut tedavilerin sınırlı etkinliğinin ve yeni terapötik stratejilere duyulan ihtiyacın altını çizdi5. Bu nedenle, temel araştırmaları ve klinik öncesi çalışmaları ilerletmek için güvenilir ve bilgilendirici hayvan modelleri gereklidir.
Şu anda, Minru ve ark.6 tarafından tanımlanan yöntem de dahil olmak üzere birçok iyi bilinen spinal kord glioma modeli mevcuttur. Bu modeller öncelikle omuriliği ortaya çıkarmak için torasik omur çıkarma tekniklerini kullanır 6,7,8. Sıçan modelleri geçmişte kullanılmış olsa da, fare modellerine kıyasla daha yüksek maliyetler, daha küçük örneklem boyutları ve daha büyük yönetim zorlukları ile ilişkilidir. Ek olarak, sıçan modellerinden daha fazla genetik olarak değiştirilmiş deneysel fare modeli mevcuttur. Bağışıklığı yeterli bir fare modeli, omurga tümörü mikro çevresindeki bağışıklık tepkisini incelemek ve omurilik gliomları için immünoterapötik stratejiler geliştirmek için özellikle değerlidir. Ayrıca, bu yöntem omurilik gliomları için hasta kaynaklı ksenogreft modelleri oluşturmak için çok uygundur.
Bu protokol, farelerde bir omurilik glioma transplantasyon modeli oluşturmak için güvenli, teknik olarak basit ve hızlı bir şekilde tekrarlanabilir bir prosedür önermektedir. Modelin, glioma ilerlemesinin altında yatan büyük ölçüde keşfedilmemiş mekanizmalara yönelik araştırmaları ilerletmesi ve omurilik gliomları için terapötik ilaçların geliştirilmesini kolaylaştırması beklenmektedir.
Protokol
Bu protokol, Capital Medical University Biyomedikal Araştırmalarda Hayvan Bakımı ve Tedavisi Etiği Kurumsal Komitesi tarafından onaylanan yönergelere (AEEI-2021-187) uygun olarak yürütülmüştür. Bu çalışmada 8 haftalık ve 19-21 g ağırlığındaki dişi C57BL/6 fareler kullanıldı. Kullanılan reaktifler ve ekipman, Malzeme Tablosunda ayrıntılı olarak açıklanmıştır.
1. Ameliyat öncesi hazırlık
- Tüm cerrahi aletleri iyice temizleyin ve sterilize edin.
- Ameliyat masasına alkol püskürtün ve steril kağıt havlu kullanarak silerek temizleyin.
2. Nakil için GL261-luc ve B16-F10-luc hücrelerinin hazırlanması
NOT: GL261-luc GBM hücre hattı ticari olarak elde edilirken, B16-F10-luc melanom hücre hattı Profesör Wang Xi'nin bir hediyesiydi. Her iki hücre hattının da deney öncesi testlerle mikoplazma enfeksiyonu içermediği doğrulandı.
- % 10 fetal sığır serumu (FBS) ve% 1 penisilin (100 U / mL) -streptomisin (100 μg / mL) ile takviye ederek tam DMEM (Dulbecco'nun Modifiye Kartal Ortamı) hazırlayın.
- GL261-luc veya B16-F10-luc hücrelerini tam DMEM ortamında kültürleyin ve implantasyon için logaritmik büyüme fazı sırasında hücreleri toplayın.
- Hücreleri steril PBS ile iki kez yıkayın, daha sonra% 0.05 tripsin-EDTA çözeltisi ile 3 dakika inkübe edin.
- Elde edilen hücre süspansiyonunu bir tüpe aktarın ve oda sıcaklığında 5 dakika boyunca 500 × g'da santrifüjleyin.
- Santrifüjlemeden sonra, süpernatanı bir pipet kullanarak atın, hücreleri steril PBS'de yeniden süspanse edin ve bir kez daha santrifüjleyin.
- Hücreleri tripan mavisi ile boyayın ve bir hücre sayacı kullanarak canlı hücreleri sayın.
- Hücre süspansiyonunu GL261-luc hücreleri için 5 × 106 hücre/mL veya B16-F10-luc hücreleri için 5 ×10 5 hücre/mL konsantrasyonda hazırlayın ve kullanıma hazır hale getirin.
3. Hayvan hazırlama
- % 2.5 tribromoetanol çözeltisinin (10 μL / g) intraperitoneal enjeksiyonu ile fareleri tartın ve uyuşturun. Pedal refleksinin kaybını kontrol ederek anesteziyi onaylayın. Hazırlıktan dikişe kadar tüm prosedür yaklaşık 5-10 dakika sürmelidir.
NOT: İşlem boyunca vücut ısısını korumak için hayvanı bir ısıtma yastığı üzerine yerleştirin. - Cildi açığa çıkarın ve temiz bir cerrahi pencere hazırlayın (Şekil 1A). Sırt boynu bölgesinden ve orta hattan iki yana uzanan 2 cm'lik bir alandan saçları saç kesme makinesi kullanarak tıraş edin.
- Kalan tüyleri almak için, pamuklu çubuk kullanarak traş edilen bölgelere ince bir tabaka tüy dökücü krem uygulayın ve 1-2 dakika bekletin. Daha sonra tüy dökücü kremi sabunla nemlendirilmiş gazlı bezle silin.
- Cildi 30 saniye boyunca dairesel hareketlerle uygulanan iyot çözeltisi kullanarak dezenfekte edin, ardından deiyodinasyon için% 75 alkol ile silin.
4. Servikal omurganın açığa çıkması ve yerleştirme noktasının belirlenmesi
- Fareleri sırt tarafları yukarı bakacak şekilde konumlandırın ve tıbbi bant kullanarak uzuvlarını ameliyat masasına sabitleyin. Omuriliğe daha iyi erişim sağlamak için destek için boyun bölgesinin altına 1-2 cm kalınlığında bir gazlı bez yerleştirin.
- Cerrahi bir neşter ve bıçak kullanarak boyun derisi boyunca yaklaşık 1,5 cm'lik uzunlamasına bir kesi yapın (Şekil 1B). Boyun kaslarını künt diseksiyonla nazikçe ayırın ve herhangi bir kan damarına zarar vermemeye dikkat edin.
- Farelerde belirgin bir kemikli dönüm noktası olan yedinci servikal vertebral spinöz süreci ortaya çıkarmak için servikal omurlara bitişik kasları dikkatlice inceleyin (Şekil 1C ve Şekil 1G-I).
- Enjeksiyona devam etmeden önce steril pamuklu çubuklar kullanarak cerrahi bölgedeki kanı temizleyin.
- Delinme noktasını omurganın orta hattından 0,5-0,9 mm'ye ayarlayın, farelerin vücut ağırlığına (16-24 g) bağlı olarak enjeksiyon derinliğini 0,6-0,9 mm'ye ayarlayın.
NOT: Omurilik enjeksiyon derinliği 22-24 g ağırlığındaki fareler için 0,9 mm'dir.
5. Tümör hücrelerinin enjeksiyonu
- 10 μL'lik düz iğneli bir şırıngayı steril PBS solüsyonu ile 2-3 kez iyice durulayın.
- Hava kabarcığı olmadığından emin olarak 2 μL hücre süspansiyonunu şırıngaya çekin.
- Servikal vertebral spinöz süreci forseps ile nazikçe kavrayarak ve kaldırarak stabilize edin. Dura mater'i delmek için eğimli bir iğne (1.87 mm uzunluğunda ve 0.48 mm çapında) kullanın (Şekil 1D). Ardından, tümör hücrelerini enjekte etmek için düz bir iğneli şırıngaya (0.48 mm çapında) geçin (Şekil 1E).
NOT: İğne geçişi sırasında delinme bölgesi korunur ve doğru yerleştirme, sinir stimülasyonundan kaynaklanan alt ekstremite seğirmesi ile doğrulanır. - Bozulmayı önlemek için hücre süspansiyonunu yavaşça enjekte edin.
- Başarılı tümör implantasyonunu sağlamak için şırıngayı enjeksiyondan sonra 30 saniye boyunca yerinde tutun.
6. Ameliyat sonrası bakım
- Ameliyat bitiminde cilt kesisini 3-0 naylon dikiş ile dikilerek kapatın (Görsel 1F).
- Fareyi yan yatırın ve kafesteki anesteziden sonra iyileşme sırasında sıcaklığı korumak ve dengeli nefes almayı sağlamak için ısıtılmış bir matın üzerine yerleştirin.
- Ağrıyı hafifletmek için Buprenorfin (0.1 mg / kg) 3 gün boyunca günde iki kez deri altından uygulayın.
- Kanama veya yara yırtılması belirtisi olmadan ameliyat öncesi aktivitesini geri kazandığından emin olmak için fareyi izleyin.
NOT: Arka bacak zayıflığı da dahil olmak üzere geçici omurilik disfonksiyonu ameliyattan sonra yaygındır ve tipik olarak 3 saat içinde düzelir. Farelerin yaklaşık% 5'inde felç gelişebilir, ancak genellikle 3 gün içinde iyileşir. Bu fareler için, yeterli erişilebilirliği sağlamak için besleyici olarak eksiksiz bir diyet ve doğrudan kafes zemininde jel su sağlayın. Belden aşağısı felçli olan farelerin küçük bir yüzdesi (yaklaşık% 5) ötenazi gerektirebilir. - Farelerin suya ve yiyeceğe sürekli erişimi olduğundan emin olun.
NOT: Hayvanlar kilo kaybı veya felç belirtileri gösteriyorsa, ayrı ayrı barındırılmalıdırlar.
7. İn vivo biyolüminesans görüntüleme
- Farelere D-PBS'de çözünmüş 150 mg / kg D-lusiferin intraperitoneal enjeksiyonu uygulayın.
- Fareleri indüksiyon için izofluran içeren bir anestezi odasına yerleştirin.
- İşlem sırasında anesteziyi sürdürmek için fareleri entegre anestezik manifolduna aktarın.
- Önceki rapor9'da açıklandığı gibi in vivo biyolüminesan görüntüleme gerçekleştirin.
NOT: Küçük hayvanların canlı görüntülemesinde D-lusiferin için en uygun yanıt süresi enjeksiyondan 10 dakika sonradır. Görüntülemenin enjeksiyondan tam olarak 10 dakika sonra yapıldığından emin olun.
Sonuçlar
Spinal gliomun stabil ve güvenilir bir hayvan modelini oluşturmak için, C57BL / 6 farelerinde altıncı ve yedinci servikal omurlar arasındaki intervertebral boşluk, literatür taraması ve deneysel bulgulara dayanarak aşılama için ideal bölge olarak tanımlandı10. Yedinci servikal omur, enjeksiyon bölgesinin doğru bir şekilde konumlandırılmasına ve enjeksiyon işleminin stabilize edilmesine yardımcı olan belirgin bir kemikli dönüm noktası olan spinöz süreç (Şekil 1G-I) sağlar.
Farelerin boyun bölgesi, prosedürün karmaşıklığını artıran çok sayıda kas ve kan damarı içerir. Cerrahi travmayı en aza indirmek için, cilt insizyonu sonrası künt diseksiyon kullanılarak servikal vertebralar mümkün olduğunca geniş bir şekilde ortaya çıkarıldı (Şekil 1C). Yedinci servikal vertebranın belirgin spinöz süreci, omurga içinde net bir görsel belirteç görevi görür (Şekil 1G-I).
Enjeksiyon bölgesi tam olarak altıncı ve yedinci servikal vertebralar arasındaki intervertebral boşluğa yerleştirildi. İğneyi doğru bir şekilde konumlandırmak için keskin uçlu bir mikro şırınga kullanıldı (Şekil 1D), ardından sıvı sızıntısını önlemek için enjeksiyon için düz başlı bir mikro şırınga kullanıldı (Şekil 1E).
Ameliyattan yaklaşık 10 gün sonra, GL261-luc hücreleri ile aşılanan fareler, arka bacak zayıflığı gibi sinir hasarı belirtileri gösterdi, bunu önemli kilo kaybı (yaklaşık% 20, Şekil 2D) ve nihai olarak arka bacak felci izledi. Tümör hücrelerinin omuriliğe başarılı bir şekilde aşılanması, biyolüminesan görüntüleme kullanılarak doğrulandı (Şekil 2A). Arka bacak felci ile tanımlanan deneysel son noktada, fareler CO2 kullanılarak ötenazi yapıldı ve omurilikleri hasat edildi. Omurilik açığa çıkarıldığında tümörler açıkça görülebiliyordu (Şekil 2B). H&E boyaması ile yapılan histolojik incelemede spinal kord dokusunda glioma infiltrasyonu saptandı (Şekil 2E). Bir sağkalım analizi (Şekil 2C), GL261-luc hücreleri ile aşılanan farelerin 18 gün içinde hastalığa yenik düştüğünü, PBS ile aşılanmış farelerin ise hiçbir morbidite belirtisi göstermediğini ve tüm gözlem süresi boyunca hayatta kaldığını göstermiştir.
Potansiyel intratekal metastaz ile bilinen yaygın bir tümör olan melanom, omurilikteki tümör ilerlemesini daha belirgin bir şekilde gözlemlemek için B16-F10-luc hücreleri kullanılarak modellendi. Biyolüminesans ve gross görüntüleme, omurilikte B16-F10-luc melanom oluşumunu doğruladı (Şekil 3A,B). GL261 modeline benzer şekilde, B16-F10 tümörleri taşıyan fareler kilo kaybı sergiledi ve 18 gün içinde öldü, PBS ile aşılanmış fareler ise GL261 modelinin sonuçlarıyla uyumlu olarak hayatta kaldı ve kilo aldı (Şekil 3C, D).
Omurilik gliomlarının immün mikroçevresinin analizi, omurilik tümörleri içinde tümörle ilişkili makrofajların (TAM'ler), özellikle CD163+ ve CD86+ popülasyonlarının dağılımını gösterdi. İmmünofloresan boyama (Şekil 4), tümörler içindeki çoğu TAM'ın proinflamatuar M1 fenotipi ile ilişkili bir belirteç olan CD86'yı eksprese ettiğini gösterdi.
Farelerin çoğu, 1-3 saat süren geçici arka bacak zayıflığı ile kanıtlanan hafif omurilik yaralanmaları yaşadı ve bu da bir dereceye kadar omurilik hasarına işaret etti. 3 saat sonra, bu fareler ameliyat öncesi aktivite seviyelerini geri kazandılar. Prosedürün tekrarlanabilirliğini ve stabilitesini değerlendirmek için, her biri tümör hücreleri implante edilmiş 5 fareyi ve PBS enjekte edilmiş 5 fareyi içeren üç bağımsız deney yapıldı. Bu çalışmalar, omurilik yaralanmasına neden olma ve tümör oluşturmada prosedürün tekrarlanabilirliğini ve stabilitesini doğruladı. Deneyler sırasında toplam 60 fareye ameliyat edildi: 30'u PBS, 15'i GL261-luc tümör hücreleri ve 15'i B16-F10-luc tümör hücreleri ile implante edildi. PBS grubundan bir fare ameliyat sırasında ölürken, B16-F10-luc ve GL261-luc gruplarından birer fare ciddi komplikasyonlar nedeniyle ameliyattan sonraki 1-3 gün içinde öldü. Kalan 57 fare, sağkalım ve vücut ağırlığı analizlerine dahil edildi.
Bunlar arasında, 54 fare, 3 saat içinde düzelen hafif postoperatif omurilik disfonksiyonu sergilerken, 3 fare, 3 gün içinde düzelen geçici felç (orta derecede yaralanma) yaşadı (Şekil 2F ve Şekil 3E). Orta derecede yaralanmaları olan fareler, hafif yaralanmaları olanlara kıyasla daha önemli vücut ağırlığı kaybı gösterdi (Şekil 3F). Bununla birlikte, iki grup arasında sağkalım süresi veya tümör ilerlemesi açısından herhangi bir fark gözlenmedi. Bu bulgular, ameliyatın neden olduğu yaralanmaların tümör ilerlemesini etkilemediğini ve modelin güvenilirliğini ve tekrarlanabilirliğini vurguladığını göstermektedir.

Şekil 1: Farelerin omuriliğine tümör hücresi implantasyonu için cerrahi prosedür. (A) Tıraş ve epilasyon sonrası ameliyat alanı. (B) Cilt kesisi. (C) Servikal omurun maruz kalması. (D) Sivri uçlu bir mikroşırınga kullanılarak gerçekleştirilen delinme. (E) Düz başlı bir mikroşırınga kullanılarak hücre enjeksiyonu. (F) Cilde uygulanan dikişlerle yara kapatma. (G) Omurganın genel görünümü. (H,İ) Yedinci servikal omurun dikenli çıkıntısı netlik için vurgulandı. Ölçek çubuğu: 5 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: GL261-Luc spinal glioma modelinin temsili sonuçları. (A) İmplantasyondan sonraki 12. günde GL261-luc tümörlerini gösteren biyolüminesans görüntüleme. Ölçek çubuğu: 5 mm. (B) 14. günde GL261-luc ile implante edilen fare omuriliğinin brüt görüntüsü. Ölçek çubuğu: 5 mm. (C) PBS veya GL261-luc hücreleri implante edilen C57BL / 6 farelerinin hayatta kalma eğrisi (grup başına n = 14-15; üç deneyden toplanan veriler). (D) Farelerde zamanla vücut ağırlığı değişir. P değerlerini hesaplamak için iki yönlü varyans analizi (ANOVA) kullanılmıştır. Veriler ortalama ± SD olarak sunuldu (grup başına n = 14-15). (E) PBS veya GL261-luc ile implantasyondan sonraki 14. günde farelerden temsili H & E lekeli omurilik kesitleri. Sarı ana hatlar tümör alanlarını gösterir. Ölçek çubuğu: 500 μm. (F) Ameliyat sonrası farelerde omurilik disfonksiyonunun gözlenen şiddeti. Sağkalım verileri, grup karşılaştırması için log-rank testi ile Kaplan-Meier analizi kullanılarak analiz edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
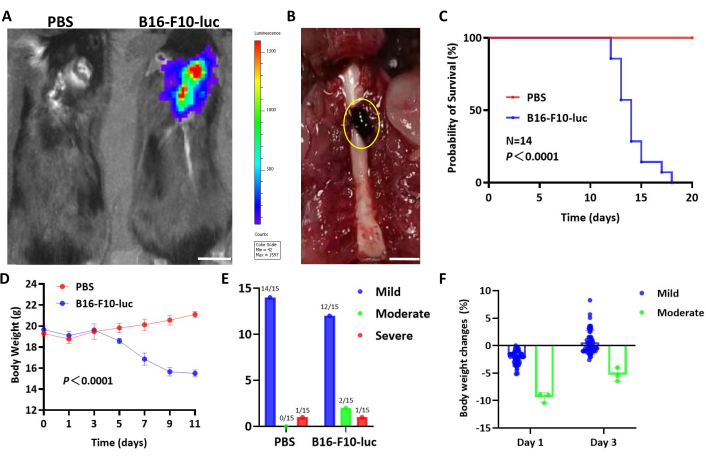
Şekil 3: B16-F10-Luc spinal glioma modelinin temsili sonuçları. (A) İmplantasyondan sonraki 12. günde B16-F10-luc tümörlerini gösteren biyolüminesans görüntüleme. Ölçek çubuğu: 5 mm. (B) 14. günde B16-F10-luc implante edilen fare omuriliklerinin brüt görüntüsü. Ölçek çubuğu: 5 mm. (C) PBS veya B16-F10-luc hücreleri implante edilmiş C57BL / 6 farelerin hayatta kalma eğrisi (grup başına n = 14; üç deneyden toplanan veriler). (D) Farelerde zamanla vücut ağırlığı değişir. İstatistiksel analiz için iki yönlü varyans analizi (ANOVA) kullanıldı. Veriler ortalama ± SD olarak sunulmuştur (grup başına n = 14). (E) Ameliyat sonrası farelerde omurilik disfonksiyonunun gözlenen şiddeti. (F) Hafif veya orta derecede disfonksiyon gösteren farelerde 1. ve 3. günlerde vücut ağırlığı değişiklikleri. Sağkalım verileri, grup karşılaştırması için log-rank testi ile Kaplan-Meier analizi kullanılarak analiz edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
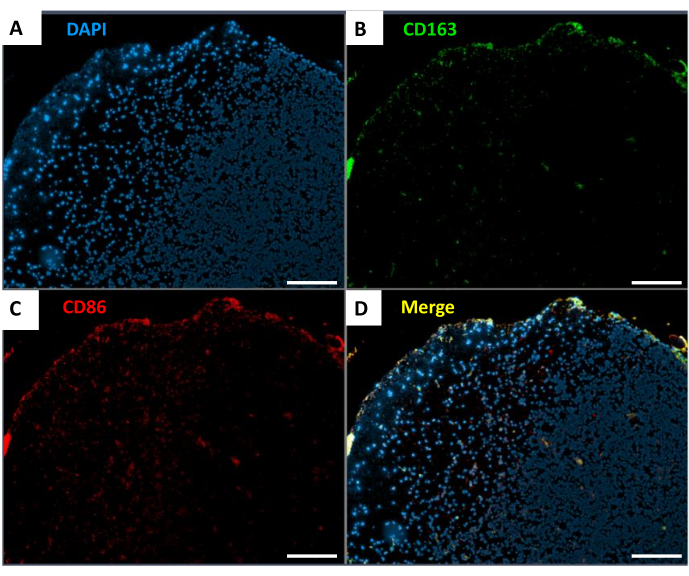
Şekil 4: Spinal kord gliomlarında TAM'lerin dağılımı. (A) DAPI boyama (mavi). (B) CD163 boyama (yeşil). (C) CD86 boyama (kırmızı). (D) İşaretçilerin birleştirilmiş görüntüsü. Ölçek çubuğu: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Omurilik gliomu, omurilikteki en sık görülen primer malign tümör türüdür ve intramedüller tümörlerin %80'inden fazlasını oluşturur. Patolojik olarak, spinal kord gliomları öncelikle ependimomlar veya astrositomlar olarak sınıflandırılır ve özellikle astrositomlar11'e odaklanır. Astrositomlar arasında, bazıları, kötü prognozlarla ilişkili olan diffüz orta hat gliomları (DMG'ler) olarak da bilinen H3K27M mutasyonlarını barındırır. Spinal kord gliomlarının tanımlayıcı bir özelliği, tümör ile çevresindeki sağlıklı doku arasında net sınırların olmaması nedeniyle tam cerrahi rezeksiyonu zorlaştıran infiltratif büyüme paternleridir. Ek olarak, omurilikteki yoğun şekilde paketlenmiş sinir lifleri, tümör ilerledikçe önemli duyusal ve motor işlev bozukluğuna yol açabilir.
Omurilik gliomu için mevcut tedaviler, beyin sapı gliomları için kullanılanlara benzer ve tipik olarak cerrahi ve radyoterapiyi içerir, Temozolomid (TMZ) gibi kemoterapi rejimleri ek tedaviler olarak hizmet eder 12,13. Bununla birlikte, omurilik gliomlarının immün mikroçevresi beyin gliomlarınınkinden farklıdır ve beyin gliomlarında immünoterapiden kazanılan deneyim, omurilik gliomları için sınırlı bilgiler sunar14. Santral sinir sistemi tümörleri için hedefe yönelik tedaviler ve immünoterapilerde devam eden gelişmelere rağmen, spinal kord gliomları için tedavi seçenekleri sınırlı kalmaktadır 15,16,17,18. Birincil zorluk, yeni terapötik stratejilerin geliştirilmesini engelleyen omurilik gliomu araştırmaları için hızlı, etkili ve tekrarlanabilir bir hayvan modelinin olmamasıdır.
Fare omuriliği deneyleri için enjeksiyon işlemi genellikle zaman alıcıdır. Tümör hücresi enjeksiyonu için perkütan, doğrudan posterolateral bir yaklaşım yaygın olarak kullanılır19. Bununla birlikte, bu modelin başarısı büyük ölçüde operatörün becerilerine ve deneyimine dayanır ve bu da kopyalanmasını zorlaştırır. Bazı durumlarda, enjeksiyon sırasında ekip işbirliği gereklidir ve bu da prosedür sürelerinin uzamasına neden olur20,21. Ek olarak, bazı araştırmacılar, tümör hücresi enjeksiyonu için omuriliği doğrudan açığa çıkarmak için bir veya iki omuru çıkarır, bu da farelerde yaralanma ve enfeksiyon riskini artırır. Feng'in deneysel modelinde, tümör hücresinin omuriliğe implantasyonunun hassasiyetini artırmak için omurun çıkarılmasını içeren cerrahi bir yaklaşım uygulandı22. Bu yöntem modelleme doğruluğunu artırırken, transplantasyon sırasında tümör hücresi sızıntısı, spinal instabilite ve daha yüksek postoperatif enfeksiyon riski ile ilgili endişeleri artırmaktadır. Ayrıca, fareler gibi küçük hayvan modelleri için bu yaklaşım, operatörden ileri düzeyde cerrahi uzmanlık gerektirir. Weng ve ark. sadece fare omurgasını açığa çıkararak ve tümör hücrelerini intervertebral boşluktan ileterek enjeksiyonları kolaylaştırmak için stereotaksik bir cihazın kullanımını tanıttı10. Bu teknik, iğnenin konumu ve derinliği üzerinde hassas kontrol sağlayarak prosedürel değişkenliği azaltır. Bununla birlikte, uygulanabilirliği, fare suşları ve yaşlarındaki farklılıklar nedeniyle sınırlı olabilir. Ek olarak, stereotaksik bir cihaz kullanmak enjeksiyon süresini uzatabilir, böylece mortalite ve enfeksiyon riskini artırabilir. Çalışmalar ayrıca, transplantasyon sonuçlarını iyileştirdiği gösterilen hücre sızıntısını önlemek için enjeksiyondan sonra iğnenin belirli bir süre yerinde tutulmasını önermektedir23. Bulgular, uygun bir enjeksiyon derinliği ve küçük bir enjeksiyon hacmi kullanılarak, iğne çıkarıldıktan sonra taşma gözlemlemeden gerekli bekleme süresinin azaltılabileceğini göstermektedir.
Bu çalışma, farelerde bir omurilik glioma modeli oluşturmak için hızlı ve etkili bir yöntem sunarak hassasiyeti ve azaltılmış işlem süresini vurgulamaktadır. Cerrahi işlem sırasında, omurgaya bağlı kasların nazikçe ayrılması aşırı kanamayı en aza indirerek omuriliğin daha net ve daha eksiksiz bir şekilde açığa çıkmasına neden olur. Yedinci servikal omur, belirgin kemik çıkıntısı ve altıncı ve yedinci servikal omurlar arasındaki nispeten daha geniş intervertebral boşluk nedeniyle optimal bir dönüm noktası olarak tanımlandı ve bu da onu iğne yerleştirme için ideal hale getirdi. Gliomların infiltratif büyüme karakteristiğini çoğaltmak için, tümör hücrelerinin beyaz cevhere doğru implantasyonu gerekliydi. Metilen mavisi enjeksiyonları kullanılarak, omuriliğe hücre inokülasyonu için 0.9 mm'lik optimal derinlik belirlendi. Geri dönüşü olmayan omurilik hasarını önlerken bu derinliği korumak için, mikroenjeksiyon iğnesinin üzerine bir kılcal hortum takıldı ve hassas enjeksiyon derinliği sağlamak için kontrollü bir mesafe bırakıldı. Bu yaklaşım, stereotaksik aletler kullanılarak elde edilenlerle karşılaştırılabilir sonuçlar elde etti, ancak fare başına enjeksiyon süresini önemli ölçüde azaltarak genel verimliliği artırdı.
Enjeksiyon iğnesi seçimi de çok önemli bir rol oynadı. Tek bir eğik iğne kullanmak omurilik dışında hücre sızıntısına ve aşılama başarısızlığına yol açarken, düz bir iğne tek başına dura materyale nüfuz etmek için yetersizdi ve potansiyel olarak omuriliğe zarar verdi. Bu zorlukların üstesinden gelmek için eğik ve düz iğnelerin bir kombinasyonu kullanıldı. Derinlik kontrolü için bir kılcal hortumla modifiye edilen eğik iğne, farelerde alt ekstremite seğirmesi ile dura materyali delmek için kullanıldı ve başarılı derinlik penetrasyonunu doğruladı. Düz iğne daha sonra omuriliğe hassas tümör hücresi enjeksiyonu için kullanıldı ve etkili ve tutarlı bir model oluşturulması sağlandı.
Çalışmanın kabul edilmesi gereken çeşitli sınırlılıkları vardır. Başlangıçta, tümör hücrelerini fare omurgasının torasik ve lomber bölgelerine enjekte etme çabaları, uzuv hareketliliği kaybına neden oldu, ancak omurilikte fark edilebilir bir tümör lezyonu gözlenmedi. Servikal omuriliğin nispeten yoğun yapısı ve konus medullaris ve filum sonlanmasına yakın lomber omuriliğin gevşek yapısı göz önüne alındığında, bu alanlar tümör hücresi bağlanması ve büyümesi için elverişli olmayabilir. Sonuç olarak, tümör hücrelerini servikal omuriliğe enjekte etmek için protokolü değiştirdik, burada tümörler maruz kaldıklarında açıkça görülebiliyordu. Bu, omuriliğin farklı bölgelerinin tümör büyümesini etkileyip etkilemediği konusunda önemli bir soruyu gündeme getirmektedir. Bu yönü daha ayrıntılı olarak araştırmak için daha fazla araştırmaya ihtiyaç vardır. Ek olarak, bu çalışmada kullanılan GL261 tümör hücre hattı, primer omurilik tümörlerinde bulunan karakteristik H3K27M mutasyonunu taşımamaktadır. Sonuç olarak, model, kötü prognoz ile ilişkili olan diffüz orta hat gliomu (DMG) koşullarını tam olarak kopyalayamayabilir. Bunu ele almak için, gelecek planları, H3K27M mutasyonunu taşıyan bir glioma hücre dizisinin geliştirilmesini içerir ve bu sürücü genin tümör ilerlemesini ve model özelliklerini nasıl etkilediğinin araştırılmasına izin verir.
Sonuç olarak, bu çalışmanın birincil amacı spinal kord gliomu için stabil, güvenilir ve verimli bir fare modeli geliştirmekti. Omurilik yapısını analiz ederek, optimal bir ponksiyon bölgesi belirlendi ve uygun ponksiyon derinliğinin belirlenmesi, modelin stabilitesini ve tekrarlanabilirliğini geliştirdi. Modelleme prosedürünün basitleştirilmesi, deneysel süreci önemli ölçüde hızlandırdı ve onu omurilik gliomunu incelemek için daha verimli bir araç haline getirdi. Bu yöntem, bu zorlu durum için potansiyel terapötik stratejiler üzerine araştırmaları ilerletmek için değerli bir kaynak sağlar.
Açıklamalar
Herhangi bir çıkar çatışması ilan edilmedi.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı Genel Programı (Fon No. 8207317) tarafından desteklenmiştir. Pekin Belediye Eğitim Komisyonu Ar-Ge Programı (Fon No. KZ202210025040). Çin Tıbbi Araştırma Enstitüleri, Pekin (Hibe No. CX24PY08).
Malzemeler
| Name | Company | Catalog Number | Comments |
| A nutritionally complete food and water gelled diet (Nutra-Gel) | Bio-Serv | N/A | |
| Adhesion microscope slides | CITOTEST | 188105 | |
| AffiniPure Fab Fragment Goat Anti-Mouse IgG (H+L) | Jacksonimmuno | 115-007-003 | |
| B16-F10-luc | Professor Wang Xi's laboratory | N/A | |
| Buprenorphine Related Compound A | Sigma-Aldrich | 457071-73-7 | |
| CD163 (ABT-CD163) mouse mAb | Immunoway | YM6146 | |
| CD86 rabbit pAb | Immunoway | YT7823 | |
| Cell counter | Bio-rad | 1450102 | |
| Cell Counting Slides | Biorad | 1450011 | |
| DAPI/Sealant Dual Solution (Anti-Quenching) | Immunoway | YS0014 | |
| Dilator | Jinzhong | D22178 | |
| D-Luciferin | PerkinElmer | 122799 | |
| DMEM | Gibco | C11995500BT | |
| D-PBS | Solarbio | D1040 | |
| Fetal Bovine Serum, qualified | Gibco | 10270-106 | |
| GL261-luc | Shanghai Zishi Biotechnology | N/A | |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A11029 | |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Life | A21244 | |
| Goat Serum | Beyotime | C0265 | |
| Hamilton microinjector 10 µL fixed 701N | Hamilton | 80383 | |
| In vivo bioluminescent imaging (IVIS Spectrum) | PerkinElmer | N/A | |
| Methanol | Fuyu Chemical | 67-56-1 | |
| Micro Scissors | Jinzhong | WAA320 | |
| Microliter Syringes (10 µL, pointed tip) | Shanghai Gaoge | N/A | |
| Microscope cover glass | CITOTEST | 10212440C | |
| needle holder 12.5 cm | Jinzhong | JCZ200 | |
| Ophthalmic Forceps 10 cm | Jinzhong | JD1060 | |
| Ophthalmic Scissors 10 cm | Jinzhong | Y00030 | |
| PBS, 10× | Solarbio | P1022 | |
| Penicillin-Streptomycin Liquid | Solarbio | P1400 | |
| Scalpel Blades | Jinzhong | J0B050 | |
| super pap pen | ZSGB-Bio | ZLI-9303 | |
| Surgical Knife Handle | Jinzhong | J11010 | |
| Surgical scissors 12.5cm straight tip | Jinzhong | J21010 | |
| Nylon Surgical Sutures with thread, size 3-0 | UNIFY | N/A | |
| Tissue-Tek O.C.T. Compound | SAKURA | 4583 | |
| Tribromoethanol | Sigma-Aldrich | T48402 | |
| Triton X-100 | Servicebio | GC204003 | |
| Trypan Blue Stain Solution, 0.4% | Solarbio | C0040 | |
| Trypsin Digestion solutions, 0.25% (without phenol red) | Solarbio | T1350 | |
| Tween-20 | Solarbio | T8220 |
Referanslar
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2015-2019. Neuro Oncol. 24 (Suppl 5), v1-v95 (2022).
- Kane, P. J., el-Mahdy, W., Singh, A., Powell, M. P., Crockard, H. A. Spinal intradural tumours: Part II--Intramedullary. Br J Neurosurg. 13 (6), 558-563 (1999).
- Horbinski, C., et al. NCCN guidelines insights: Central Nervous System Cancers, Version 2.2022. J Natl Compr Canc Netw. 21 (1), 12-20 (2023).
- Chai, R. C., et al. The molecular characteristics of spinal cord gliomas with or without H3 K27M mutation. Acta Neuropathol Commun. 8 (1), 40 (2020).
- Zhang, Y. W., et al. Clinicopathological characteristics and survival of spinal cord astrocytomas. Cancer Med. 9 (19), 6996-7006 (2020).
- Muir, D., et al. Assessment of laminin-mediated glioma invasion in vitro and by glioma tumors engrafted within rat spinal cord. J Neurooncol. 30 (3), 199-211 (1996).
- Ren, T. J., et al. Establishment of intramedullary spinal cord glioma model in rats. Chin Med J (Engl). 123 (18), 2580-2585 (2010).
- Hsu, W., et al. Animal model of intramedullary spinal cord glioma using human glioblastoma multiforme neurospheres. J Neurosurg Spine. 16 (3), 315-319 (2012).
- Lim, E., et al. In vivo bioluminescent imaging of mammary tumors using IVIS spectrum. J Vis Exp. (26), e1210 (2009).
- Weng, Z., et al. A reproduceable in situ xenograft model of spinal glioma. J Neurosci Methods. 346, 108928 (2020).
- Chamberlain, M. C., Tredway, T. L. Adult primary intradural spinal cord tumors: a review. Curr Neurol Neurosci Rep. 11 (3), 320-328 (2011).
- Watanabe, G., et al. Diffuse Midline H3K27-Altered Gliomas in the Spinal Cord: A Systematic Review. J Neurooncol. 166 (3), 379-394 (2024).
- Chalif, E. J., et al. Impact of extent of resection and adjuvant therapy in diffuse gliomas of the spine. Spine J. 23 (7), 1015-1027 (2023).
- Ellis, J. A., et al. Unique microenvironmental responses to PDGF stimulation in brain and spinal cord gliomas determine tumor phenotype. J Neurooncol. 123 (1), 27-33 (2015).
- Zhou, D., et al. Harnessing immunotherapy for brain metastases: insights into tumor-brain microenvironment interactions and emerging treatment modalities. J Hematol Oncol. 16 (1), 121 (2023).
- Sampson, J. H., Gunn, M. D., Fecci, P. E., Ashley, D. M. Brain immunology and immunotherapy in brain tumours. Nat Rev Cancer. 20 (1), 12-25 (2020).
- Jha, P., et al. Analysis of PD-L1 expression and T cell infiltration in different molecular subgroups of diffuse midline gliomas. Neuropathology. 39 (6), 413-424 (2019).
- Majzner, R. G., et al. GD2-CAR T cell therapy for H3K27M-mutated diffuse midline gliomas. Nature. 603 (7903), 934-941 (2022).
- Cossigny, D. A. F., Mouhtouris, E., Dushyanthen, S., Gonzalvo, A., Quan, G. M. Y. An in vivo mouse model of intraosseous spinal cancer causing evolving paraplegia. J Neurooncol. 115 (2), 189-196 (2013).
- Carbajal, K. S., Weinger, J. G., Whitman, L. M., Schaumburg, C. S., Lane, T. E. Surgical transplantation of mouse neural stem cells into the spinal cords of mice infected with neurotropic mouse hepatitis virus. J Vis Exp. (53), e2834 (2011).
- Minehan, K. J., Brown, P. D., Scheithauer, B. W., Krauss, W. E., Wright, M. P. Prognosis and treatment of spinal cord astrocytoma. Int J Radiat Oncol Biol Phys. 73 (3), 727-733 (2009).
- Feng, S., et al. Establishing a mouse contusion spinal cord injury model based on a minimally invasive technique. J Vis Exp. (187), e64538 (2022).
- Keirstead, H. S., et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. J Neurosci. 25 (19), 4694-4705 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır