Method Article
3 Boyutlu Beyin Organoidlerinde Çoklu Mitokondriyal Parametrelerin Ölçümü için Flow Sitometrik Analizin Uygulanması
Bu Makalede
Özet
Bu protokol, mitokondriyal hacimdeki değişiklikler, mitokondriyal solunum zinciri (MRC) kompleks alt birimlerinin miktarları ve mitokondriyal DNA (mtDNA) replikasyonu dahil olmak üzere çoklu mitokondriyal fonksiyonel parametrelerin eşzamanlı değerlendirmesi için bir akış sitometresi ve çoklu antikorların kullanılması için benzersiz bir yöntem bildirir.
Özet
Mitokondriyal disfonksiyon, birçok nörodejenerasyon tipine ortak bir birincil veya ikincil katkıda bulunur ve mitokondriyal kütle, mitokondriyal solunum zinciri (MRC) kompleksleri ve mitokondriyal DNA (mtDNA) kopya sayısındaki değişiklikler sıklıkla bu süreçlerde yer alır. İnsan kaynaklı pluripotent kök hücrelerden (iPSC'ler) türetilen insan beyni organoidleri, beynin üç boyutlu (3D) sitomimari düzenlemesini özetler ve karmaşık bir insan sisteminde hastalık mekanizmalarını inceleme ve yeni terapötikleri tarama imkanı sunar. Burada, iPSC'den türetilmiş kortikal organoidlerde çoklu mitokondriyal parametreleri ölçmek için benzersiz bir akış sitometrisi tabanlı yaklaşım bildiriyoruz. Bu rapor, iPSC'lerden kortikal beyin organoidleri üretmek, üretilen organoidlerin tek hücreli ayrışması, fiksasyon, boyama ve çoklu mitokondriyal parametreleri değerlendirmek için müteakip akış sitometrik analizi için bir protokolü detaylandırır. MRC kompleksi alt birimi NADH'ye karşı antikorlarla çift boyama: Ubikinon Oksidoredüktaz Alt Birimi B10 (NDUFB10) veya mitokondriyal transkripsiyon faktörü A (TFAM), voltaja bağlı anyon seçici kanal 1 (VDAC 1) ile birlikte mitokondri başına bu proteinlerin miktarının değerlendirilmesine izin verir. TFAM miktarı mtDNA miktarına karşılık geldiğinden, mitokondriyal içerik başına mtDNA kopyalarının sayısının dolaylı bir tahminini sağlar. Tüm bu prosedür 2-3 saat içinde tamamlanabilir. En önemlisi, mitokondriyal kütleye göre hem toplam hem de spesifik seviyeler dahil olmak üzere çoklu mitokondriyal parametrelerin eşzamanlı olarak ölçülmesine izin verir.
Giriş
Mitokondri, temel hücresel organellerdir ve adenozin trifosfat (ATP) üretiminin ana bölgesidir. Mitokondri, hücreler için enerji sağlamanın yanı sıra, hücre bilgi iletimi, hücre farklılaşması ve apoptoz dahil olmak üzere çoklu hücresel süreçlere katılır ve hücre büyümesini ve hücre döngüsünü düzenleme yeteneğine sahiptir. Parkinson hastalığı (PD)1,2, Alzheimer hastalığı (AD)3 ve amyotrofik lateral skleroz (ALS)4 dahil olmak üzere çeşitli nörodejeneratif hastalıklarda mitokondriyal fonksiyondaki değişiklikler tanımlanmıştır. Mitokondriyal disfonksiyon yaşlanma sürecinde, somatik mtDNA mutasyonlarının birikmesinde ve solunum zinciri fonksiyonunun azalmasında rol oynar5.
Nörodejenerasyonda çeşitli mitokondriyal disfonksiyon türleri ortaya çıkar ve bu tür değişiklikleri ölçme yeteneği, hastalık mekanizmalarını incelerken ve potansiyel tedavileri test ederken son derece yararlıdır. Ayrıca, insan beyin hücrelerinde hastalığı özetleyen uygun in vitro model sistemlerin kurulması, hastalık mekanizmalarının daha iyi anlaşılması ve yeni tedavilerin geliştirilmesi için hayati önem taşımaktadır. Nörodejeneratif hastalıkları olan hastalardan alınan iPSC'ler, mitokondriyal hasarı gösteren çeşitli beyin hücreleri üretmek için kullanılmıştır 6,7,8,9. iPSC'lerden türetilen 3D beyin organoidlerinin geliştirilmesi, hastalık modellemesinde önemli bir adımdır. Bu iPSC'den türetilmiş beyin organoidleri karmaşıklık sağlar ve hastanın kendi genetik geçmişini içerir, böylece hastanın beynindeki patolojiyi daha doğru yansıtan bir hastalık modeli sağlar.
iPSC'den türetilmiş beyin organoidleri10,11,12 kullanılarak mitokondriyal çalışmalar üzerine bazı araştırmalar yapılmış olsa da, iPSC'den türetilmiş beyin organoidlerinde çoklu mitokondriyal fonksiyonel parametreleri belirlemek için uygun ve güvenilir teknikler sınırlı kalmaktadır. Akış sitometrisi, daha önce gösterdiğimiz gibi, tek hücre düzeyinde mitokondriyal parametreleri ölçmek için güçlü bir araç sağlar13. Bu çalışma, mitokondriyal kütle, solunum zinciri kompleksi alt birimleri ve mtDNA kopya sayısı dahil olmak üzere birden fazla mitokondriyal parametreyi aynı anda ölçmek için yeni bir akış sitometrisi tabanlı yaklaşımla birlikte iPSC'lerden kortikal organoidler üretmek için ayrıntılı bir protokol sağlar (Şekil 1). Daha da önemlisi, mitokondriyal kütleyi bir payda olarak kullanarak, bu protokoller mitokondriyal birim başına hem toplam hem de spesifik seviyelerin ölçülmesine izin verir.
Protokol
1. iPSC'lerin kortikal organoidlere farklılaşması
- Matris kaplı plakaların hazırlanması
- Piyasada bulunan bazal membran matrisinin şişesini gece boyunca buz üzerinde çözdürün. Soğukta 1:100'e seyreltin Advanced Dulbecco'nun Modifiye Eagle's Medium/Ham's F12 DMEM/F12 (%1 nihai konsantrasyon). Alikotlar yapın ve -20 °C'de saklayın (Malzeme Tablosuna bakınız).
- Membran matris çözeltisini 4 ° C'de çözün (soğuk tutun) ve gerekli sayıda kuyucuk kaplayın (6 oyuklu bir plakada bir kuyucuk için 1 mL). 37 °C'de 1 saat inkübe edin.
- Plakayı inkübatörden alın ve oda sıcaklığına (RT) ulaşmasına izin verin (bir saat bekletin).
NOT: Plakalar buzdolabında 2 haftaya kadar saklanabilir (kullanmadan önce çıkarılacak kadar soğuk olmayana kadar RT'de o gün için gerekli olan kaplanmış kuyuları çıkarmayı ve ısıtmayı unutmayın). Plakların 3 gün içerisinde kullanılması tavsiye edilir. Uzun süreli saklama için, jelin kurumasını önlemek için kaplanmış plakaya 1 mL Essential 8 Medium ( Malzeme Tablosuna bakın) ekleyin.
2. iPSC kültürü için Hazırlık Temel 8 (E8) ortamı
- Steril bir ortamda, E8 bazal ortamını E8 takviyesi ile birleştirerek E8 Ortamını hazırlayın (Malzeme Tablosuna bakınız). Bu, 2 hafta boyunca 4 ° C'de saklanabilir.
NOT: Dondurulmuş E8 takviyesini, tüm ortamı hazırlamadan önce gece boyunca 4 °C'de çözün. Dondurulmuş takviyenin 37 °C'de çözülmesi önerilmez; E8 Medium'u 2 hafta boyunca kullanın. Kullanmadan önce, o gün için gerekli olan E8 Medium'u RT'de artık dokunulamayacak kadar soğuk olana kadar ısıtın.
3. iPSC'lerin alt kültürlenmesi
- Matris kaplı plakaları RT veya inkübatörde 37 °C'de 20-30 dakika önceden ısıtın. RT'de ihtiyaç duyulan E8 Medium miktarını önceden ısıtın.
- Kültür ortamını bir pipetle aspire edin.
- iPSC'leri (Malzeme Tablosuna bakınız) Dulbecco'nun Fosfat Tamponlu Tuzlu Suyu (Ca2 + / Mg2 + ücretsiz) (DPBS-/-) (6 oyuklu bir plakada bir kuyucuk için 4 mL) ile durulayın.
- Etilendiamintetraasetik asit (EDTA) (0.5 mM) (6 oyuklu bir plakada bir oyuk için 1 mL) ekleyin. Kolonilerin kenarları plakadan ayrılmaya başlayana kadar (genellikle 3-5 dakika) 37 °C'de inkübe edin.
- Ayrışma çözeltisini aspire edin.
- Önceden ısıtılmış E8 Medium (6 oyuklu bir plakada bir kuyucuk için 4 mL) ekleyin ve iPSC kolonilerini ayırmak için yüksek basınç kullanın.
- Matris kaplı 6 oyuklu bir plakada (6 oyuklu bir plakada bir kuyucuk için 2 mL) iki farklı kuyucuğa aktarın ve 37 °C'de inkübe edin.
NOT: Plakayı inkübatöre koymadan önce hafifçe çalkalayın. Bölme oranı 1: 2-1: 4 olabilir. - Koloniler iyi boyut ve bağlantılarla %80 birleşim elde edene kadar günlük olarak medya alışverişi yapın.
NOT: Tipik olarak iyi tanımlanmış, dairesel bir şekil ve 0,5 ila 1 mm arasında değişen bir çap ile karakterize edilen uygun büyüklükteki kolonileri izleyin. Koloniler, açıkça tanımlanmış, pürüzsüz sınırları olan yoğun, kompakt yapılar sergilemelidir.
4. Embriyoid cisim (EB) oluşumu ve nöral indüksiyon
- Malzeme Tablosunda listelenen bileşenleri birleştirerek nöral indüksiyon ortamı (NIM) hazırlayın.
- Ortamı aspire edin ve hücreleri DPBS -/- (6 oyuklu bir plakada oyuk başına 4 mL) ile durulayın.
- Kuyucuğa önceden ısıtılmış Accutase (6 oyuklu bir plakada oyuk başına 1 mL) ekleyin ( Malzeme Tablosuna bakınız) ve 37 ° C'de 10 dakika inkübe edin.
- 1000 μL'lik bir pipet ucu kullanarak çözeltiyi 3 ila 4 kez nazikçe yukarı ve aşağı pipetleyin.
- % 10 fetal sığır serumu (FBS) ile 2 mL DMEM ile nötralize edin ve hücreleri içeren 15 mL konik tüpü RT'de 5 dakika boyunca 600 x g'da santrifüjleyin.
- Tek hücreli paletler oluşana kadar hafifçe yukarı ve aşağı pipetleyerek hücre peletlerini yeniden süspanse edin.
- Otomatik bir hücre sayacında tripan mavisi14 kullanarak canlı hücre konsantrasyonunu sayın ve hesaplayın.
- Seyreltme oranını hesaplayın ve 60.000 canlı hücre / mL'lik nihai hücre konsantrasyonu elde etmek için hücreleri NIM'de seyreltin.
- Hücre süspansiyonuna Rho ile ilişkili protein kinaz (ROCK) inhibitörü Y-27632 (nihai konsantrasyon 50 μM) (Malzeme Tablosuna bakınız) ekleyin ve yavaşça karıştırın.
- Ultra düşük bağlantılı 96 oyuklu plakanın her bir oyuğuna 150 μL tek hücreli süspansiyon ekleyin (Malzeme Tablosuna bakınız) ve inkübatöre yerleştirin. Gün 0 olarak ayarlayın.
- 1. günde, her kuyucuktaki hücreleri ve EB formlarını kontrol edin.
NOT: Başarılı EB oluşumunu, mikroskop altında parlak, küresel ve yarı saydam görünümlerine, serbest yüzer ve ayrı kalma yeteneklerine ve koyu lekeler olarak görünen ölü hücrelerin yokluğuna göre değerlendirin. - 2. günde, her bir oyuktan 75 μL ortamı dikkatlice çıkarın ve her oyuğa 50 μM Y-27632 ile birlikte 150 μL NIM ekleyin.
- 4, 6 ve 8. günlerde, her oyuktan 100 μL besiyeri çıkarın ve her oyuğa 150 μL NIM ekleyin.
5. Kortikal organoidlerin oluşumu
- Malzeme Tablosunda listelenen bileşenleri birleştirerek nöral farklılaşma ortamı eksi A vitamini (NDM-) hazırlayın.
- 10. günde, EB'leri 5 mL'lik bir pipet kullanarak ultra düşük bağlantılı 96 oyuklu plakadan ultra düşük bağlantılı 6 oyuklu plakaya aktarın. Her kuyucuğa sekiz EB'yi dikkatli bir şekilde aktarın (Şekil 2). Her kuyucuğa 5 mL NDM- ekleyin.
- Plakayı inkübatörün içindeki orbital çalkalayıcıya yerleştirin ve 80 rpm'de dönmeye başlayın.
- 12, 14 ve 16. günlerde, 3 mL eski ortamı aspire ettikten sonra NDM-'yi 4 mL ile değiştirin.
6. Kortikal organoidlerin olgunlaşması ve uzun süreli kültürü
- A vitamini (NDM +) ve beyin kaynaklı nörotrofik faktör (BDNF) ile nöral farklılaşma ortamı hazırlayın. Ayrıntılar için Malzeme Tablosu'na bakın.
- 18. günde, 3 mL ortamı çıkarın ve 4 mL NDM + ekleyin.
- Plakayı eğirme kültürüne geri koyun.
- Her 4 günde bir besleyin ve farklılaşmış kortikal organoidleri kullanana kadar NDM + 'da tutun. Downstream analizi için 25-40 günlük kortikal organoidler kullanıldı.
NOT: Kortikal organoidler daha uzun süre korunabilir (3-4 aya kadar); Ancak beslenme alışverişi eksikliği nedeniyle hücre canlılığı düşecektir.
7. İmmünositokimya ve immünofloresan boyama ile hücre karakterizasyonu
- Organoidi ortamdan nazikçe toplamak için 1000 μL'lik bir pipet kullanın ve standart bir mikroskop lamı üzerinde minimum ortamlı bir ortama nazikçe yerleştirin.
- 30 dakika boyunca% 4 paraformaldehit (PFA) (numune başına 300 μL) ekleyin. PFA'yı çıkarın ve ardından PBS ile iki kez durulayın.
NOT: PFA toksiktir ve kanserojen olduğundan şüphelenilmektedir. Cilt ve gözlerle temasından kaçının ve kimyasal bir davlumbaz altında tutun. - Slaytlara %30 sükroz çözeltisi (numune başına 300 μL) ekleyin ve gece boyunca 4 °C'de inkübe edin.
- Organoidleri, RT'de 2 saat boyunca (veya gece boyunca 4 ° C'de) PBS (Ca2 + / Mg2 + ile),% 0.3 Triton X-100 ve% 10 normal keçi serumu içeren bloke edici tampon (BB) (numune başına 300 μL) ile bloke edin ve geçirgenleştirin. Tamponu slayt üzerinde tutmak için organoidleri hidrofobik bir bariyer kalemle ana hatlarıyla belirtin.
- Numuneleri bloke edici tamponda (numune başına 300 μL), anti-SRY (cinsiyet belirleyici bölge Y)-kutu 2'de (SOX2, 1:100) ve anti-nöral belirteç tüberin beta III'te (Tuj1, 1:1000) birincil antikor ile kaplayın ve gece boyunca karanlıkta 4 °C'de inkübe edin (bkz.
- Yumuşak bir sallanan platform üzerinde iki ila üç tampon değişikliği ile PBS'de 3 saat yıkayın.
- İkincil antikor (numune başına 300 μL), anti-Alexa Unu 488 (1:800) ve anti-Alexa Unu 594 (1:800) ile gece boyunca nemlendirilmiş bir karanlık odada 4 °C'de inkübe edin. Hoechst 33342 (1:5000) nükleer lekesini aynı anda ekleyin (bkz. Malzeme Tablosu).
- Antikoru aspire edin ve PBS ile hızlı bir şekilde durulayın, ardından kontaminasyonu önlemek için 4 ° C'de 1-2 gün boyunca% 0.01 NaAzid içeren PBS ekleyin.
- PBS'yi aspire edin ve fazla çözeltiyi çıkarın. Organoidleri montaj ortamıyla monte edin ( Malzeme Tablosuna bakın), ardından bir lamel ekleyin. Hava kabarcıklarının oluşmasını önleyin ve montajın tamamen polimerize olmasını sağlamak için en az 12 saat RT'de karanlık bir odaya koyun.
NOT: Numune artık bir floresan mikroskobu altında hayal edilmeye hazırdır.
8. Kortikal organoidlerin ayrışması
- 50 mL'lik bir santrifüj tüpüne 30 mL DPBS -/- ekleyin.
- 10 mL'lik bir pipet kullanarak beyin organoidlerini tüpte nazikçe toplayın. Bir boyama için en az 3 organoid kullanılır ve bunlar 25 günden fazla ancak 40 günden az olmalıdır.
- Yaklaşık 5 dakika boyunca tortu organoidleri. Santrifüj yapmayın.
- DPBS'yi aspire edin ve tüpe 2 mL önceden ısıtılmış Accutase ekleyin. Numuneyi su banyosunda 37 °C'de 5 dakika inkübe edin.
- Kabarcık oluşturmadan 1000 μL'lik bir pipet ucu kullanarak 15 kez hafifçe ezin. Numuneyi bir su banyosunda 37 °C'de 5 dakika daha inkübe edin.
- 1000 μL pipet uçları kullanılarak kabarcık oluşturmadan 15 kez nazikçe ayrışır (Şekil 3A).
NOT: Hala ayrılmamış hücreler varsa, ayrışmamış hücreleri yeni bir 50 mL santrifüj tüpüne aktarın ve ardından 37 ° C su banyosunda 5 dakika daha inkübe edin. Daha sonra 1000 μL pipet ucunu 20 kez kullanarak nazikçe ayrışın. - % 10 FBS ile 4 mL DMEM ile nötralize edin ve hücreleri içeren 15 mL konik tüpü 600 x g'da RT'de 5 dakika boyunca santrifüjleyin.
- Süpernatanı aspire edin ve kabarcık oluşturmadan 1000 μL pipet ucu kullanarak 10 kez 200 μL DPBS ile yeniden süspanse edin.
- DPBS'de toplam 400 μL hücre süspansiyonu hacmi yapmak için 200 μL DPBS ekleyin.
- Filtre veya filtre borusu ile filtreleyin (35 veya 40 μm filtreler kullanın ve filtreyi kullanmadan önce filtreyi DPBS ile durulayın).
- Çözeltinin yarısını bir tüpte ayırın ve lekelenmemiş numune olarak kullanın.
9. Sabit hücrelerde MRC kompleks alt birimlerinin ve TFAM'ın akış sitometrisi ölçümü
- Canlı ve Ölü (L/D) boyama boyası (1: 1000) ekleyin (Malzeme Tablosuna bakınız) (akış sitometrisi belirteçlerinin kurulumuna bağlı olarak Uzak Kırmızı veya Yakın kızılötesi ile).
NOT: L / D boya için yeni bir şişe açılırsa, sulandırmak için 50 μL DMSO ekleyin ve -20 ° C'de saklamak için 10 μL'lik bir alikot yapın. - 30 dakika boyunca RT'de ve karanlıkta tutun. 40 mL DPBS -/- ekleyin. 5 dakika boyunca 600 x g'da santrifüjleyin.
- Süpernatanı attıktan sonra tek hücreli süspansiyona yeniden süspansiyon edin.
- Hücreleri 1 mL buz gibi %90 metanol ile -20 ° C'de 20 dakika sabitleyin ve geçirgen hale getirin.
- Numuneleri PBS'de (Ca2 + / Mg2 + ile) 0.3 M glisin,% 5 keçi serumu ve% 1 sığır serum albümini (BSA) içeren 1 mL blok tamponunda bloke edin.
- % 0.2 BSA ile PBS içeren 20 mL akış tamponu (Ca2 + / Mg2 + ile) ile bir veya iki kez yıkayın.
- Alexa Fluor 405 (1:100) ile konjuge anti-NDUFB10, Alexa Fluor PE (1:100) ile konjuge anti-VDAC 1 ve Alexa Fluor 488 (1:200) ile konjuge anti-TFAM antikoru 30 dakika boyunca ekleyin (bkz.
- 20 mL akış tamponu ile yıkayınız.
- Yaklaşık 100 μL'yi aspire edin ve bırakın ve hücre peletlerini 300 μL'lik akış tamponuna yeniden sulandırın.
- Hücreleri 1,5 mL akış tüplerine aktarın. Karanlıkta ve buzda tutun.
- Akış sitometresinde analiz edin (Malzeme Tablosuna bakınız). Anti NDUFB10-Alexa 405 için sinyaller 450/50 bant geçiren filtre kullanılarak, TFAM-Alexa 488 530/30 bant geçiren filtre kullanılarak, VDAC 1-Alexa 647 için 670/14 bant geçiren filtre kullanılarak ve 780/60 bant geçiren filtrede L/D boya için sinyaller tespit edildi (Şekil 3B).
10. Akış sitometrisi edinimi ve analizi
- Sitometre ayarlarının voltajını ayarlamak için kontrol organoidinin boyanmamış ve tek lekeli örneklerini kullanın.
- Hücre popülasyonunun boyutuna ve ayrıntı düzeyine bağlı olarak ileri saçılma alanı (FSC-A) ve yan saçılma alanı (SSC-A) dağılım grafiklerini ayarlamak için boyanmamış kontrol tüpünü kullanın (Şekil 4A).
- FSC-A ve SSC-A grafiklerinden canlı hücreleri seçmek için kalıntıları kapatın. Yan saçılma yüksekliğini (SSC-H) kullanarak çiftleri dışarı çıkarın vs. SSC-A grafiği (Şekil 4B).
- APC-cy7'ye geçerek L/D boyanın boyanmasına dayalı olarak canlı hücreleri seçin. FSC-A grafiği (Şekil 4C).
- Her satırın boyanmamış örneklerini kullanarak, FSC-A vs.'deki olayların ana popülasyonunun üzerine bir kapı çizin. florokrom kanalları (FITC, APC, BV 421) grafikleri.
- Kurulum, akış sitometresi15 için kompanzasyonlar.
- Arka plan lekelenmesini gözlemlemek için negatif kontrol için izotip kontrolünü kullanın.
- Veri toplama işlemini gerçekleştirin.
- APC-cy7'ye geçerek L/D boyanın boyanmasına dayalı olarak canlı hücreleri seçin. FSC-A grafiği (Şekil 4C).
- Lekelenmemiş olanı negatif kontrol olarak kullanın. Ardından, FSC-A vs. florokrom kanallar (FITC, APC, BV 421) grafikleri, tek hücreli olayların ana popülasyonunun üzerinde bir kapı oluşturur (Şekil 4D-F).
- FlowJo yazılımını kullanarak veri analizi yapın (Malzeme Tablosuna bakın).
- Kapıların konumlarını lekeli hücre numuneleri üzerine çoğaltın. Pozitif lekelenme gösteren hücrelerin sayısını belgeleyin.
- Hedeflenen her popülasyon için, mitokondriyal sinyali tanımlamak için bir histogramın x ekseni üzerinde çizilen farklı kanalların (FITC, APC, BV 421) medyan floresan yoğunluğunu (MFI) değerlendirin. Kompleks I alt birim NDUFB10 ve TFAM için spesifik değerler, karmaşık ifadenin MFI'sinin veya TFAM'ın mitokondriyal kütle göstergesi VDAC 1'e bölünmesiyle belirlenebilir.
Sonuçlar
Şekil 1, farklılaşma sürecinin ve akış sitometrik analizi için kullanılan stratejilerin diyagramatik bir temsilini sağlar. İnsan iPSC'leri, EB'ler oluşturmak için yapışık olmayan 96 oyuklu plakalarda kültürlendi ve daha sonra tamamen büyümüş kortikal organoidler elde etmek için yapışık olmayan 6 oyuklu plakalara aktarıldı. Organoidlerin hücresel bileşimi, nöronal16 ve glial belirteçler17 ile immün boyamadan sonra konfokal mikroskopi kullanılarak doğrulandı. Organoidler, tek tek hücrelerde çoklu mitokondriyal parametrelerin akış sitometrisine dayalı ölçümünü kolaylaştırmak için tek hücrelere ayrıldı. Bu protokolde, mitokondriyal kütle parametrelerini, MRC kompleks I alt birimi ve TFAM miktarlarını elde etmek ve analiz etmek ve bağıl mtDNA kopya sayısının dolaylı bir ölçümünü yapmak için çoklu boyama stratejileri kullanılır. Bu protokol, organoidleri ayırmak ve akış sitometrik verilerini elde etmek için adımlar sağlar.
Park, I. H. ve ark.18'den önceki bir protokol kullanılarak, kortikal organoidler, ikili SMA ve MAD ile ilişkili protein (SMAD) inhibisyonu ve Kanatsız/Entegre (Wnt) inhibisyonu yoluyla anterior nöroektodermal kaderi indükleyerek iPSC'lerden üretildi. Şekil 2A'da gösterildiği gibi, insan iPSC'leri, bazal membran matris kaplı 6 oyuklu plakalar üzerinde bir iPSC kültür ortamına ekildi (Şekil 2B, a). Hücreler ~% 80 birleşmeye ulaştığında, koloniler tek hücrelere ayrıldı ve daha sonra NIM ile 96 oyuklu plakalara ekildi. EB'ler tohumlamadan 1 gün sonra oluşmuştur (Şekil 2B,b). 10. günde, EB'ler kortikal organoidlerin farklılaşmasına izin vermek için 6 oyuklu plakalara aktarıldı (Şekil 2B, c) ve NIM, BDNF, N2 takviyesi ve A vitamini içermeyen B27 ile desteklenmiş NDM ile değiştirildi. 18 günlük farklılaşmadan sonra, farklılaşmış kortikal organoidler NDM'de daha da olgunlaştı, askorbik asit ile dolduruldu ve B27 A vitamini ile dolduruldu. Bu aşamada, kortikal organoidler doku benzeri morfoloji gösterdi (Şekil 2B, d) ve en az 25 gün boyunca dönen bir döndürücü üzerinde büyümelerine izin verildi ve daha sonra mitokondriyal parametreleri incelemek için kullanıldı. Hücre kimliği, immünofloresan boyama kullanılarak farklılaşma sırasında karakterize edildi. Şekil 2C'de, immün boyama, iPSC'den türetilmiş kortikal organoidlerin spesifik nöral progenitör belirteç SOX219 ve nöral belirteç Tuj120'yi eksprese ettiğini doğruladı.
Kortikal organoidler, 3-4 aya ulaşan önemli süreler boyunca sürdürülebilir. Bununla birlikte, zaman içinde hücre canlılığında düşüş eğilimi olduğunu fark ettik. Bu azalma ağırlıklı olarak yetersiz besin değişiminden kaynaklanmaktadır. Sonuç olarak, sonraki analiz için, 25 ila 40 günlük yaş aralığındaki kortikal organoidler özel olarak seçildi. Bu aşamada, kortikal organoidler tek hücrelere ayrıldı ve daha sonra bir hücre sayacında tripan mavisi kullanılarak hücresel canlılık değerlendirildi. Organoidlerin önceden ısıtılmış Accutase içinde 37 ° C'de 10 dakika boyunca 5 dakikalık aralıklarla hafif öğütme ile inkübe edilmesi, optimum tek hücreli süspansiyon ve hücre canlılığı ile sonuçlanmıştır (Şekil 3A).
Bu farklılaşmış kortikal organoidlerde mitokondriyal fonksiyonu araştırmak için akış sitometrisi yapıldı. Hücreler boyandıktan sonra, Şekil 3B'de tarif edildiği gibi, veri toplama için bir akış sitometresi ve veri analizi için Flowjo Örnekleyici kullanıldı. Geçit stratejileri Şekil 4'te gösterilmiştir. FSC'de canlı hücreler için bir bölge belirlendi. Ölü hücreleri ve hücre kalıntılarını dışlamak için SSC grafiği (Şekil 4A). Hücre çiftleri, bir SSC-A vs yapılarak dışlandı. SSC-H grafiği (Şekil 4B). Voltaj, tek lekeli numuneler kullanılarak sitometre ayarları değiştirilerek her florofor için ayarlandı. Belirli bir hücre tipinin negatif popülasyonu, aynı hücre tipi içindeki pozitif popülasyon ile karşılaştırıldığında, arka plan floresansı yeterince değerlendirilir.
Bu yaklaşım, mtDNA polimeraz, POLG (W748S/W748S) mutasyonunu taşıyan insan iPSC'lerinden üretilen kortikal organoidleri, yaş ve cinsiyet eşleştirilmiş sağlıklı kontrolden üretilen hastalıksız örneklerle karşılaştırdı (Tablo 1). Şekil 5'te gösterildiği gibi, POLG organoidlerinde kontrollere kıyasla azalmış toplam ve spesifik kompleks I NDUFB10 ve TFAM seviyeleri gösterilmiştir. Bununla birlikte, POLG organoidlerinde mitokondriyal kütle açısından herhangi bir değişiklik olmamıştır.
Bu veriler, farklı mitokondriyal parametrelerin akış sitometrik analizinin, iPSC'den türetilmiş beyin organoidlerinde değerli olacak bir ilk adım yaklaşımı sağladığını göstermektedir.
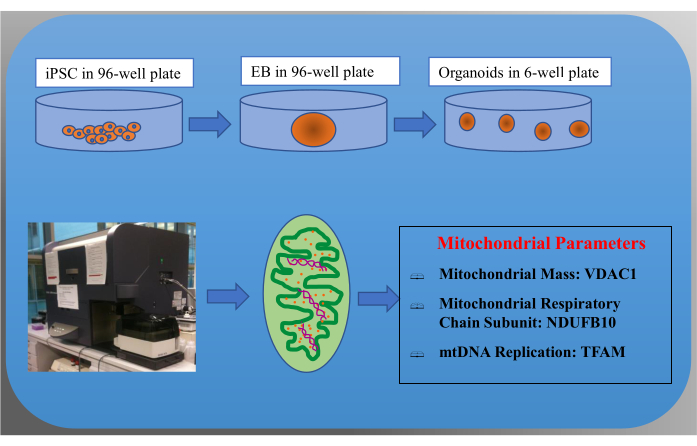
Şekil 1: Kortikal organoidlerin iPSC'lerden ayırt edilmesi için protokolün şematik gösterimi ve akış sitometrisi kullanılarak mitokondriyal ölçümün iş akışı. Bu protokol, iPSC'lerin %80 birleşmeye ulaşana kadar kültürlenmesiyle başlar. Bu hücreler daha sonra ayrışır ve EB'leri oluşturdukları 96 oyuklu plakalara aktarılır. EB'ler 6 oyuklu plakalara aktarılır ve yaklaşık 18 gün boyunca kortikal organoidlere farklılaşır. Organoidler daha sonra en az 25 gün olgunlaştırılır. Daha sonra, organoidler akış sitometrisi için tek hücrelere ayrılır. Hücreler, VDAC 1 ile ölçülen mitokondriyal kütle, MRC kompleks I alt birim NDUFB10 ve TFAM ile ölçülen mtDNA replikasyonu dahil olmak üzere çeşitli mitokondriyal parametreleri vurgulamak için spesifik belirteçlerle boyanır. Kısaltmalar: iPSC'ler: indüklenmiş pluripotent kök hücreler; EB'ler: embriyoid cisimler; MRC: mitokondriyal solunum zinciri; mtDNA: mitokondriyal DNA. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
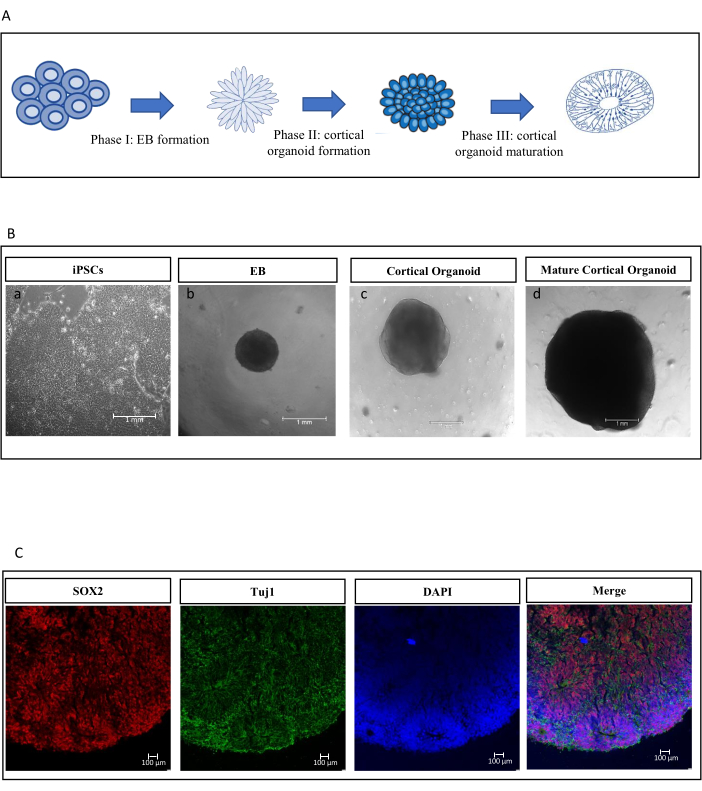
Şekil 2: iPSC'den türetilmiş kortikal organoidlerin farklılaşması ve karakterizasyonu sırasında farklı aşamalardan hücreler için iPSC farklılaşmasının akış şeması ve temsili görüntüler. (A) Bu farklılaşmanın adım adım ilerlemesini özetleyen bir akış şeması. Bu, iPSC'lerin yetiştirilmesiyle başlar ve ardından EB'lere dönüşmeleriyle devam eder. Bu EB'ler daha sonra erken evre kortikal organoidlere ve daha sonra NSC'lere farklılaşır. NSC'ler tamamen oluşmuş kortikal organoidlere olgunlaşır ve farklılaşma sürecini tamamlar. (B) Bu farklı aşamaların her birindeki hücrelerin temsili görüntüleri. Resim (a), tipik olarak pluripotent kök hücrelerin sıkıca paketlenmiş, koloni benzeri bir oluşum özelliği sergileyen iPSC'leri göstermektedir. Resim (b), iPSC'ler farklılaşmaya başladığında oluşan üç boyutlu hücre agregaları olan EB'leri göstermektedir. Resim (c), hücreler doku benzeri yapılar halinde örgütlenmeye başladığında daha karmaşık bir yapıya sahip olan erken evre kortikal organoidleri göstermektedir. Resim (d), nöronlara ve diğer sinir hücrelerine farklılaşabilen öncü hücreler olan NSC'leri vurgulamaktadır. Son olarak, resim (e) olgun kortikal organoidleri göstermektedir. Bu aşamada, organoidler, iyi gelişmiş bir nöral doku yapısını düşündüren oldukça karmaşık, doku benzeri bir morfoloji sergiler. Ölçek çubuğu 1 mm'dir. (C) iPSC'den türetilmiş organoidlerin konfokal mikroskopi görüntüleri. Bu görüntüler SOX2 ve Tuj1'in immün boyamalarını vurgulamaktadır. Kırmızı ile gösterilen SOX2, nöral soy hücreleri üretebilen hücrelerin varlığını gösteren nöral progenitör hücrelerin bir belirtecidir. Yeşil renkle gösterilen Tuj1, nöronlar için bir belirteçtir ve bazı hücrelerin nöronlara başarılı bir şekilde farklılaştığını ima eder. Çekirdekler DAPI ile boyanır. Ölçek çubuğu 100 μm'dir. Kısaltmalar: iPSC'ler: indüklenmiş pluripotent kök hücreler; EB'ler: embriyoid cisimler; NSC'ler: nöral kök hücreler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Akış sitometrik analizinde kurulan tek hücreli ayrışma ve numune boyama. (A) Kortikal organoidlerin ayrışmasından sonra elde edilen tek hücrelerin temsili görüntüsü. Büyütme 2.5x'tir. Bu prosedür, organoidlerin Accutase içinde 37 ° C'de 10 dakika boyunca inkübe edilmesini içerir, bu da organoidlerin tek tek hücrelere parçalanmasını kolaylaştırır. Akış sitometrisi, doğru analiz için tek hücreli süspansiyonlar gerektirdiğinden bu işlem kritik öneme sahiptir. (B) Akış sitometrisi kullanarak çoklu mitokondriyal parametreleri ölçmek için numune boyama kurulumu. Mitokondriyal özellikleri değerlendirmek için, hücrelerin bu parametreleri vurgulayan spesifik belirteçler veya boyalarla boyanması gerekir. Bunlar, negatif kontrol olarak boyanmamış numuneler, mitokondriyal kütle markörü VDAC 1 olan tek lekeli numuneler, kompleks I alt birim NDUFB10 ve mtDNA kopya sayısını dolaylı olarak ölçmek için kullanılan TFAM ve çoklu boyanmış numuneler olabilir. Kısaltmalar: MRC: mitokondriyal solunum zinciri; mtDNA: mitokondriyal DNA. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
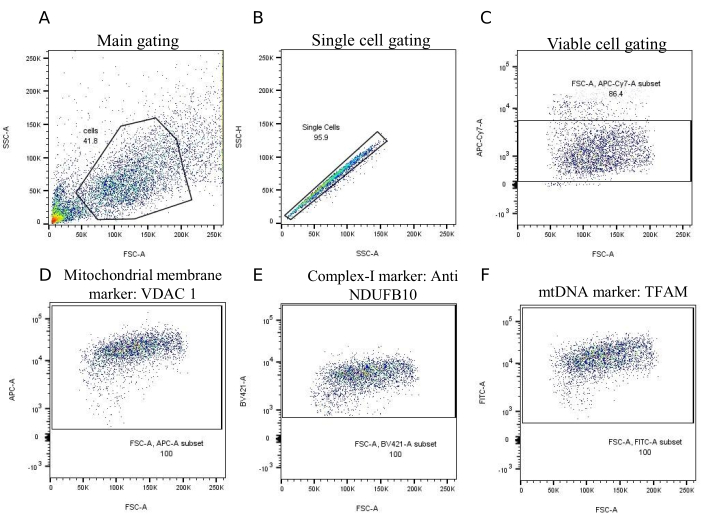
Şekil 4: Organoid hücrelerin akış sitometrik analizinde kullanılan geçit stratejileri ve veri toplama. (A) FSC-A ile karşılaştırmayı gösteren bir akış sitometrisi grafiği. SSC-A'dır. Bu tür bir çizim, hücre popülasyonlarını boyutlarına (FSC) ve tanecikliklerine veya karmaşıklıklarına (SSC) göre ayırt etmek için akış sitometrisinde yaygın olarak kullanılır. Bu çizimdeki ana kapı, genellikle enkaz veya diğer hücresel olmayan olaylar hariç, çoğu hücreyi içerecek şekilde çizilir. (B) SSC-H vs. SSC-A'dır. Bu strateji, verileri bozabileceğinden, hücre çiftlerini veya kümelerini analizden hariç tutar. Tek hücreler, böyle bir çizimde çapraz bir çizgi boyunca düşerken, hücre çiftleri veya kümeleri, aynı darbe yüksekliği için artan alan nedeniyle bu çizgiden sapar. (C) Canlı hücreler, bir L / D boyasının boyanmasına dayalı olarak kapılanır. Bu boya, canlı ve ölü hücreleri diferansiyel olarak boyayarak, APC-cy7 (L/D boyasının tespit edildiği kanal) ile karşılaştırıldığında ayırt edilmelerine izin verir. FSC-A'dır. (D-F) Bu görüntüler, farklı parametreler için geçit stratejilerini göstermektedir. Bu çizimler FSC-A parametresini kullanır vs. farklı floresan kanalları: (D)'de, VDAC 1, APC kanalında algılanır, (E), MRC Kompleksi I'in bir alt birimi olan NDUFB10'yi algılamak için BV421 kanalını kullanır ve son olarak, (F) FITC kanalında TFAM tespiti için geçitlemeyi gösterir. Kısaltmalar: FSC-A: İleri Saçılma; SSC-A: Yan Saçılma; FITC = Floresein izotiyosiyanat, APC = Allofikosiyanin, PE = Fikoeritrin, BV421 = Parlak menekşe 421, APC-cy7 = Allofikosiyanin-siyanin; MRC: mitokondriyal solunum zinciri; mtDNA: mitokondriyal DNA. L/D: Canlı/Ölü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
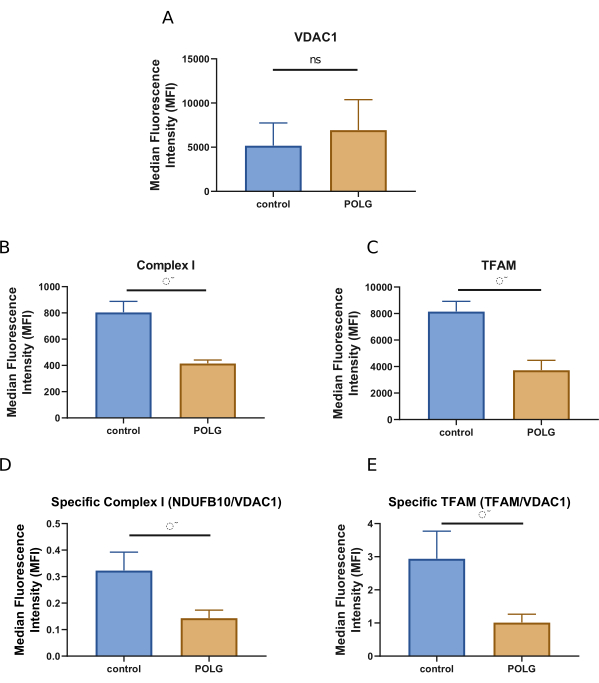
Şekil 5. POLG mutasyonu taşıyan bir hastanın iPSC'lerinden türetilen kortikal organoidlerin akış sitometrik analizinden ve sağlıklı kontrolden elde edilen sonuçlar. (A) toplam mitokondriyal kütlenin ölçümünü gösterir. Bu, dış mitokondriyal zardaki konumu nedeniyle mitokondriyal kütle için bir belirteç olarak yaygın olarak kullanılan bir protein olan VDAC 1'e karşı bir antikor ile boyanarak değerlendirilir. VDAC 1'in boyama yoğunluğu, kortikal organoidlerin hücreleri içindeki nispi mitokondri miktarını gösterir. Bu çizim, kontrolden üretilenlere kıyasla POLG'den türetilen organoidlerde benzer bir VDAC 1 seviyesini göstermektedir. (B), NDUFB10 için boyama ile ölçülen toplam Kompleks I seviyelerini sunar. Kompleks I, mitokondriyal solunum zincirinin önemli bir bileşenidir ve seviyesi mitokondriyal fonksiyonu gösterir. Bu çizim, kontrolden üretilenlere kıyasla POLG'den türetilen organoidlerdeki toplam NDUFB10 miktarında kayda değer bir azalmayı göstermektedir. (C) TFAM'ın toplam miktarını gösterir. TFAM, mtDNA'nın bakımı ve transkripsiyonu için çok önemlidir, bu nedenle seviyesi, hücrelerdeki mtDNA'nın durumu hakkında fikir verebilir. Bu çizim, kontrolden üretilenlere kıyasla POLG'den türetilen organoidlerdeki toplam TFAM miktarında kayda değer bir azalmayı göstermektedir. (D,E) Kompleks I'in spesifik seviyelerini gösterir ve TFAM sunulur. Bunlar, toplam NDUFB10 veya toplam TFAM'ın VDAC 1 seviyelerine oranları olarak hesaplanır. Bu oranlar, toplam mitokondriyal içerikteki olası değişiklikleri hesaba katan Kompleks I ve TFAM'ın normalleştirilmiş ölçümlerini sağlar. Bu çizim, kontrolden üretilenlere kıyasla POLG'den türetilen organoidlerdeki belirli NDUFB10 ve TFAM miktarlarında kayda değer bir azalmayı göstermektedir. Veriler, üç bağımsız örnek için SEM'± ortalama değerler olarak sunulmuştur (n = 6). Hasta kaynaklı ve sağlıklı kontrol organoidleri arasında gözlenen farklılıkların istatistiksel anlamlılığı Mann-Whitney U testi kullanılarak değerlendirildi. 0.05'ten küçük bir p değerinin istatistiksel anlamlılığı gösterdiği düşünülmüştür. Kısaltmalar: iPSC'ler: indüklenmiş pluripotent kök hücreler; SEM: ortalamanın standart hatası; NS: Önemli değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Satır | Kaynak | Mutasyon | Yaş (yıl) | Cinsiyet |
| Kontrol | AG05836 (RRID:CVCL_2B58) | Hayır | 44 | Dişi |
| Sabırlı | POLG hastası | C.2243G>C için POLG homozigot; sayfa W748S | 44 | Dişi |
Tablo 1: Bu çalışmada kullanılan iPSC'lerin mutasyonu, yaşı ve cinsiyeti ile ilgili bilgiler.
Tartışmalar
İnsan iPSC'lerinden kortikal beyin organoidleri üretmek ve bu organoidlerden izole edilen tek hücrelerde mitokondriyal parametrelerin akış sitometrik analizini gerçekleştirmek için bir protokol sunulmuştur. Organoidlerin hücresel bileşimi, nöronal ve glial hücre belirteçleri için immünohistokimyasal boyama ile konfokal mikroskopi ile doğrulandı. Anti-NDUFB10, VDAC 1 ve TFAM ile birlikte boyama akış sitometrisi tabanlı stratejinin, bir hücredeki mitokondri sayısına göre belirli kompleks I ve mtDNA seviyelerinin ölçülmesine izin verdiği gösterilmiştir. Bu protokol, her tür beyin benzeri hücrede mitokondriyi ölçmek için uygundur ve mitokondriyal disfonksiyon hastalıklarını incelemek için kullanılabilir.
Bu protokol, ikili SMAD ve Wnt inhibisyonunun bir kombinasyonunu kullanarak beyin organoidlerinin üretilmesine izin verir. Bu üçlü inhibisyon, ikili SMAD inhibisyonu21 ile karşılaştırıldığında daha düzgün bir kortikal NSC profili oluşturur. Bazı hücre hatları, FBS kullanılmamasına rağmen, NIM'de %10 ısıyla inaktive edilmiş FBS gerektirebilir. Başarılı bir farklılaşmayı sağlamak için, iPSC'ler, EB'ler oluşturmak üzere kaplamadan önce farklılaştırılmamalıdır.
Beyin organoidlerini canlı tek hücrelere izole etmek için kapsamlı bir protokol önemlidir, çünkü akış sitometrisi ve tek hücreli RNA dizilimi gibi prosedürlerden önce kritik bir adımdır. İki farklı reaktif (Accutase ve Organoid Tissue Dissociation Kit) ile deney yaptıktan sonra, organoidlerin Accutase içinde 10 dakika inkübe edilmesinin iyi hücre canlılığı ve tek hücreli bir süspansiyon ile sonuçlandığı bulundu. Onları düzgün bir şekilde ayırmak için gereken süre, organoidlerin boyutuna ve yaşına göre ayarlanabilirken, 20 dakikalık kuluçka süresinin aşılmaması tavsiye edilir. Ayrışması nispeten zor olan numuneler için, kalıntıları ve yetersiz ayrışmış hücreleri çıkarmak için 30-40 nm'lik bir filtre kullanılması önerilir.
Bu protokolün dikkate alınması gereken bazı önemli noktaları vardır. İlk olarak, kortikal organoidlerin kalitesi ve boyutu, başarılı bir akış sitometrisi prosedürü için yeterli canlı tek hücreleri sağlamak için kritik öneme sahiptir. İzole edilmiş hücrelerin iyi hücre canlılığını elde etmek için, 30-40 gün boyunca farklılaşmış organoidlerin kullanılması önerilir; 40 gün sonra organoidlerden ve büyük boyutlu organoidlerden kaçınılmalıdır. Farklılaşma sürecindeki belirli aşamalar için protokoller geliştirdik ve bunları yukarıda açıkladık. Yeterli sayıda hücre elde etmek için, bir dizi akış sitometrisi için 3-4 organoidin birleştirilmesi önerilir. Ek olarak, etkili alternatifler olabilecek birçok başka farklılaşma protokolü ve tanımlanmış ortam 22,23,24 mevcuttur, ancak bu konular mevcut çalışmada deneysel olarak ele alınmamıştır. iPSC hatlarındaki ortam bileşimi ve klonal farklılıklar, başlangıç hücresi popülasyonunun proliferasyonunu ve farklılaşma verimliliğini etkileyebileceğinden, bu stratejinin diğer bakım ortamlarına uyarlanması optimizasyon gerektirebilir.
Akış sitometrisi, diğer geleneksel mikroskop tabanlı tahlillere kıyasla hızlı ve tekrarlanabilir olmanın yanı sıra çok sayıda tek hücreyi analiz edebilme avantajına sahiptir. Akış sitometrisi analizi bir milyondan az hücre gerektirir ve numune analizi sadece birkaç dakika sürer, bu da düzinelerce numunenin 1-2 saat içinde analiz edilebileceği anlamına gelir. Ek olarak, mikroskop tabanlı analizlerde, araştırmacı yanlılığı, özellikle organoidler gibi 3D ve hücresel bileşimde büyük farklılıklar gösteren örneklerde sonuçları bozabilir. Akış sitometrisi analizi sadece mikroskop tabanlı analizlerin engellerini aşmakla kalmaz, aynı zamanda çeşitli göstergeler arasındaki küçük farkları daha doğru bir şekilde analiz edebilir. Strateji, nörodejeneratif hastalık hücreleri ve diğer beyin organoidleri de dahil olmak üzere çeşitli hücre tiplerine de uygulanabilir ve bu nedenle farklı nörodejeneratif hastalıklar için mekanizmaların anlaşılmasına ve potansiyel tedavilerin test edilmesine yardımcı olmalıdır.
Son yıllarda, organoidler çeşitli nörolojik hastalıkları modellemek için başarıyla kullanılmıştır. Yapısal olarak insan beynine benzer olmanın ek avantajı nedeniyle hayvan modellerinden üstündürler25. Bu teknolojinin, yüksek verimli ilaç taramasında ve yeni tedavilerin geliştirilmesinde devrim yaratması beklenmektedir26. Bu protokol, çeşitli mitokondriyal ilişkili hastalıkları ve PD gibi diğer nörodejeneratif hastalıkları modellemek için kullanılabilir ve ilaç taramasının yanı sıra yeni tedavileri test etmek ve çevresel toksinlerin insan beyni üzerindeki etkilerini değerlendirmek için kullanılabilir.
Kortikal organoidler de dahil olmak üzere organoidlerin gelişimi, hem deney partileri içinde hem de arasında önemli değişkenliğe tabidir27. Bu varyasyon, ilk hücre popülasyonu, kültür ortamındaki küçük farklılıklar ve farklılaşma ve olgunlaşma süreçleri sırasında rastgele oluşumlar gibi faktörlerden etkilenir. Sonuç olarak, farklı organoidler, kortikal gelişim ve fonksiyonun çeşitli aşamalarını veya özelliklerini modelleyebilir. Ek olarak, organoidler gelişim ve hastalığı anlamak için değerli modeller olsa da, insan beyninin yapısını veya hücre çeşitliliğini mükemmel bir şekilde yansıtmazlar. Örneğin, kan damarları ve bağışıklık hücreleri gibi temel beyin mikro çevre bileşenlerinden yoksundurlar27. Ayrıca, üretilen nöronların ve glial hücrelerin oranları ve türleri, insan beynindekileri doğru bir şekilde yansıtmayabilir.
Akış sitometrisi, hücre popülasyonlarını fiziksel ve kimyasal özelliklerine göre karakterize etmek ve numaralandırmak için güçlü bir araçtır. Ancak, kısıtlamaları vardır. Böyle bir kısıtlama, organoidlerin analiz için tek tek hücrelere ayrılması gerektiğidir. Bu ayrışma, hücre durumunu değiştirebilir ve mitokondriyal fonksiyonu etkileyebilir, böylece mitokondriyal parametrelerinölçümlerini etkileyebilir 28. Ayrışma süreci ayrıca hücre stresine neden olabilir ve özellikle daha hassas hücre tiplerinde hücre ölümüne yol açabilir. Ayrıca, akış sitometrisi verilerinin yorumlanması büyük ölçüde uygun geçit stratejilerine dayanır. Gürültü ile gerçek olayları doğru bir şekilde ayırt etmek ve kapıları ayarlamak uzman bilgisi gerektirir28. Tutarsız geçitleme, önemli önyargılara yol açabilir ve sonuçları etkileyebilir. Son olarak, akış sitometrisi hücresel alt popülasyonları analiz etmede usta olsa da, organoidler bağlamında çok önemli olabilecek hücreler arasındaki uzamsal bilgileri ve etkileşimleri yakalayamayabilir.
Bu çalışma, akış sitometrisi analizi için hücre süspansiyonlarının hazırlanması ile ilgili önemli bir sınırlama tanımlamıştır. İlk yaklaşımımız, filtrasyon olmaması, filtrasyon ile filtrelenmemiş numunenin daha sonra ayrışması ve doğrudan filtrasyon dahil olmak üzere farklı koşulların karşılaştırılmasını içeriyordu. Bir filtrenin kullanılmamasının akış sitometresi için uygun olmadığı bulundu, çünkü bu ekipman doğru analiz için tek hücreli bir süspansiyon gerektiriyordu. Ayrıca, filtrasyondan sonra numuneler yeniden ayrıştırılmaya çalışılırken %20'lik önemli ölçüde düşük bir hücre canlılığı gözlendi. Bu düşük canlılık seviyesi, güvenilir akış sitometrisi verileri elde etme yeteneğini tehlikeye attı ve bu yaklaşımı uygulanabilir bir yöntem olarak etkili bir şekilde dışladı. Sonuç olarak, 35 veya 40 μm'lik bir filtreden doğrudan filtrasyon yapılmasına karar verildi. Bu sınırlama, akış sitometrisine hazırlık sırasında hücre canlılığının korunmasındaki doğal zorlukların altını çizmektedir. Ayrıca, deneysel bir metodoloji tasarlarken ekipmana özel gereksinimlerin dikkate alınmasının önemini vurgulamaktadır. Bu zorlukların, hücre canlılığını en üst düzeye çıkarmak ve akış sitometrisi veri kalitesini artırmak için hücre hazırlama tekniklerini optimize etmek için gelecekteki çalışmalarda ele alınması önemlidir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Norveç Oslo Üniversitesi Temel Tıp Bilimleri Enstitüsü'nden Gareth John Sullivan'a bize AG05836 (RRID:CVCL_2B58) hücre hattını cömertçe sağladığı için en içten şükranlarımızı sunarız. Norveç'teki Bergen Üniversitesi'ndeki Moleküler Görüntüleme Merkezi, Akış Sitometrisi Çekirdek Tesisi'ne teşekkür ederiz. Bu çalışma aşağıdaki fonlarla desteklenmiştir: K.L, kısmen Bergen Üniversitesi Meltzers Høyskolefonds (proje numarası: 103517133) ve Gerda Meyer Nyquist Guldbrandson og Gerdt Meyer Nyquists legat (proje numarası: 103816102) tarafından desteklenmiştir. L.A.B, Norveç Araştırma Konseyi (proje numarası: 229652), Rakel og Otto Kr.Bruuns legat ve Gerda Meyer Nyquist Guldbrandson og Gerdt Meyer Nyquists legat tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibodies using in flow cytometry | |||
| anti-DUFB10 Alexa Fluor 405 | NOVUS biologicals | NBP2-72915AF405 | |
| anti-VDAC1 Alexa Fluor 647 | Santa cruz technology | sc-390996 | |
| anti-TFAM Alexa Fluor 488 | Abcam | ab198308 | |
| L/D fixable near-IR dead cell stain kit | Life technologies | L10119 | |
| Antibodies using in immunofluorence staining | |||
| anti-Tuj1 | Abcam | ab78078 | |
| anti-SOX2 | Abcam | ab97959 | |
| anti-Alexa Flour 488 | Thermo Fisher Scientific | A28175 | |
| anti-Alexa Flour 594 | Thermo Fisher Scientific | A-21442 | |
| Commercial cells | |||
| AG05836 (RRID:CVCL_2B58) | Provided by Gareth John Sullivan from the Institute of Basic Medical Sciences at the University of Oslo, Norway | ||
| Essential 8 Medium (iPSC culture medium) | |||
| Essential 8 Basal Medium | Thermo Fisher Scientific | A1516901 | |
| Essential 8 Supplement (50x) 2% (v/v) | Thermo Fisher Scientific | A1517101 | |
| Store at 4 °C and warm up to RT before use. | |||
| Instruments | |||
| Heracell 150i CO2 Incubators | Fisher Scientific, USA | ||
| Orbital shakers - SSM1, SSL1 | Stuart Equipment, UK | ||
| CCD Microscope Camera Leica DFC3000 G | Leica Microsystems, Germany | ||
| Water Bath Jb Academy Basic Jba5 JBA5 Grant Instruments | Grant Instruments, USA | ||
| Fluid aspiration system BVC control | Vacuubrand, Germany | ||
| Leica TCS SP8 STED confocal microscope | Leica Microsystems, Germany | ||
| 50 mL falcon tube | Sigma-Aldrich | CLS430828 | |
| BD LSR Fortessa | BD Biosciences, USA | ||
| Flowjo Sampler Analysis | FlowJo LLC, USA | ||
| 10 mL pipette | Sigma-Aldrich | SIAL1100 | |
| 1, 10, 100, 1000 mL pipette | Sigma-Aldrich | ||
| 40 µm Cell stariner | Sigma-Aldrich | CLS431750 | |
| ultra-low attachment 96-well plate | S-BIO | MS-9096UZ | |
| Countess II automated cell counter | Thermo Fisher Scientific | ||
| Neural differentiation medium (NDM+) | |||
| DMEM/F12 | Life technologies | 11330032 | |
| Neurobasal medium | Life technologies | 2110349 | |
| Glutamax supplement 1% (v/v) | Life technologies | 35050 | |
| N2 supplement 0.5% (v/v) | Life technologies | 17502-048 | |
| B27 supplement 1% (v/v) | Life technologies | 17504-044 | |
| β-Mercaptoethanol 50 µM | Sigma-aldrich | M3148 | |
| BDNF 20 ng/mL | Peprotech | 450-02 | |
| Ascorbic acid 200 µM | Sigma-Aldrich | A92902 | |
| Store at 4° C for upto 2 weeks | |||
| Neural differentiation medium minus viatmin A (NDM-) | |||
| DMEM/F12 | Life technologies | 11330032 | |
| Neurobasal medium | Life technologies | 2110349 | |
| Glutamax supplement 1% (v/v) | Life technologies | 35050 | |
| N2 supplement 0.5% (v/v) | Life technologies | 17502-048 | |
| B27 supplement W/O vit. A 1% (v/v) | Life technologies | 12587010 | |
| β-Mercaptoethanol 50 µM | Sigma-aldrich | M3148 | |
| Store at 4° C for upto 8 days | |||
| Neural Induction Medium (NIM) | |||
| DMEM/F12 | Life technologies | 11330032 | |
| Knockout serum replacement 15% (v/v) | Life technologies | 10828028 | |
| Glutamax supplement 1% (v/v) | Life technologies | 35050 | |
| β-Mercaptoethanol 100 µM | Sigma-Aldrich | M3148 | |
| LDN-193189 100 nM | Stemgent/Reprocell | 04-0074 | |
| SB431542 10 µM | Tocris | 1614 | |
| XAV939 2 µM | Sigma-Aldrich | X3004 | |
| Store at 4° C for upto 10 days | |||
| Neutralisation medium | |||
| IMDM | Life technologies | 21980032 | |
| FBS 10% | Sigma-Aldrich | 12103C | |
| Other reagents | |||
| DPBS (Ca2+/Mg2+ free) | Thermo Fisher Scientific | 14190250 | |
| Bovine Serum Albumin | Europa Bioproducts | EQBAH62-1000 | |
| Accutase | Life technologies | A11105-01 | |
| Geltrex | Life technologies | A1413302 | |
| EDTA | Life technologies | 15575038 | |
| Advanced DMEM / F12 | Life technologies | 12634010 | |
| Neural tissue dissociation kit | Miltenyi biotec | 130-092-628 | |
| Y-27632 dihydrochloride Rock Inhibitor | Biotechne Tocris | 1254 | |
| Fluoromount-G™ Mounting Medium | SouthernBiotech | 0100-20 | |
| PFA | Thermo Fisher Scientific | 28908 |
Referanslar
- Bindoff, L. A., Birch-Machin, M., Cartlidge, N. E., Parker, W. D. Jr, Turnbull, D. M. Mitochondrial function in Parkinson's disease. The Lancet. 2 (8653), 49(1989).
- Gonzalez-Rodriguez, P., et al. Disruption of mitochondrial complex I induces progressive parkinsonism. Nature. 599 (7886), 650-656 (2021).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer's disease: recent advances. Molecular Neurodegeneration. 15 (1), 30(2020).
- Wang, Y., Xu, E., Musich, P. R., Lin, F. Mitochondrial dysfunction in neurodegenerative diseases and the potential countermeasure. CNS Neuroscience & Therapeutics. 25 (7), 816-824 (2019).
- Trifunovic, A., Larsson, N. G. Mitochondrial dysfunction as a cause of ageing. Journal of Internal Medicine. 263 (2), 167-178 (2008).
- Liang, K. X., et al. Stem cell derived astrocytes with POLG mutations and mitochondrial dysfunction including abnormal NAD+ metabolism is toxic for neurons. bioRxiv. , (2020).
- Liang, K. X., et al. N-acetylcysteine amide ameliorates mitochondrial dysfunction and reduces oxidative stress in hiPSC-derived dopaminergic neurons with POLG mutation. Experimental Neurology. 337, 113536(2021).
- Kikuchi, T., et al. Human iPS cell-derived dopaminergic neurons function in a primate Parkinson's disease model. Nature. 548 (7669), 592-596 (2017).
- Juopperi, T. A., et al. Astrocytes generated from patient induced pluripotent stem cells recapitulate features of Huntington's disease patient cells. Molecular Brain. 5, 17(2012).
- Xu, L., et al. Abnormal mitochondria in Down syndrome iPSC-derived GABAergic interneurons and organoids. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1868 (6), 166388(2022).
- Liu, C., et al. Mitochondrial HSF1 triggers mitochondrial dysfunction and neurodegeneration in Huntington's disease. EMBO Molecular Medicine. 14 (7), e15851(2022).
- Kathuria, A., et al. Transcriptomic Landscape and functional characterization of induced pluripotent stem cell-derived cerebral organoids in schizophrenia. JAMA Psychiatry. 77 (7), 745-754 (2020).
- Liang, K. X., Chen, A., Kristiansen, C. K., Bindoff, L. A. Flow cytometric analysis of multiple mitochondrial parameters in human induced pluripotent stem cells and their neural and glial derivatives. The Journal of Visualized Experiments. 177, e63116(2021).
- Strober, W. Trypan Blue exclusion test of cell viability. Current Protocols in Immunology. 111, (2015).
- Roederer, M. Compensation in flow cytometry. Current Protocols in Cytometry. Chapter 1 (Unit 1), 14(2002).
- Dehmelt, L., Halpain, S. The MAP2/Tau family of microtubule-associated proteins. Genome Biology. 6 (1), 204(2005).
- Sofroniew, M. V., Vinters, H. V. Astrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 7-35 (2010).
- Xiang, Y., et al. Generation and fusion of human cortical and medial ganglionic eminence brain organoids. Current Protocols in Stem Cell Biology. 47 (1), e61(2018).
- Pevny, L., Placzek, M. SOX genes and neural progenitor identity. Current Opinion in Neurobiology. 15 (1), 7-13 (2005).
- Lee, M. K., Tuttle, J. B., Rebhun, L. I., Cleveland, D. W., Frankfurter, A. The expression and posttranslational modification of a neuron-specific beta-tubulin isotype during chick embryogenesis. Cytoskeleton and Cell Motility. 17 (2), 118-132 (1990).
- Rosebrock, D., et al. Enhanced cortical neural stem cell identity through short SMAD and WNT inhibition in human cerebral organoids facilitates emergence of outer radial glial cells. Nature Cell Biology. 24 (6), 981-995 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Pasca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nature Methods. 12 (7), 671-678 (2015).
- Yan, Y., Zhang, S. C. Generation of cerebral cortical neurons from human pluripotent stem cells in 3D culture. Methods in Molecular Biology. 2683, 1-11 (2023).
- Pamies, D., et al. Human IPSC 3D brain model as a tool to study chemical-induced dopaminergic neuronal toxicity. Neurobiology of Disease. 169, 105719(2022).
- Pamies, D., Hartung, T., Hogberg, H. T. Biological and medical applications of a brain-on-a-chip. Experimental biology and medicine (Maywood, N.J. : Online). 239 (9), 1096-1107 (2014).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nature Reviews Immunology. 4 (8), 648-655 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır