Method Article
İki Foton Holografik Mikroskopi Kullanılarak Nöral Aktivitenin Değerlendirilmesi ve Manipülasyonu
Bu Makalede
Özet
Anormal nöral aktivite ile ilişkili nöropsikiyatrik bozuklukların patogenezini aydınlatmak amacıyla, yüksek mekansal zamansal çözünürlük kullanarak nöral aktiviteyi görselleştirebilen, değerlendirebilen ve manipüle edebilen iki fotonlu bir holografik mikroskop geliştirdik.
Özet
Optik biyogörüntüleme ve optogenetikteki son gelişmeler, canlı hayvanlarda hücresel aktiviteler de dahil olmak üzere biyolojik olayların görselleştirilmesini ve manipüle edilmesini sağlamıştır. Sinirbilim alanında, öğrenme ve hafıza gibi beyin fonksiyonlarıyla ilgili ayrıntılı sinirsel aktivite şimdi ortaya çıkmıştır ve beyin fonksiyonlarını ifade etmek için bu aktiviteyi yapay olarak manipüle etmek mümkün hale gelmiştir. Bununla birlikte, nöral aktivitenin iki fotonluCa2+ görüntüleme ile geleneksel olarak değerlendirilmesi, düşük zamansal çözünürlük sorununa sahiptir. Ek olarak, nöral aktivitenin geleneksel optogenetik tarafından optik fiber yoluyla manipüle edilmesi, aynı genetik arka plana sahip nöronların aktivitesini yalnızca aynı anda düzenleyebilir ve bu da bireysel nöronların aktivitesini kontrol etmeyi zorlaştırır. Bu sorunu çözmek için, yakın zamanda optogenetiği femtosaniye kızılötesi lazer ışınlarını değiştirebilen dijital holografik teknoloji ile birleştirerek biyolojik uygulamalar için yüksek uzaysal zamansal çözünürlüğe sahip bir mikroskop geliştirdik. Burada, örneklerin hazırlanması ve iki fotonlu holografik mikroskobun çalışması da dahil olmak üzere nöral aktivitenin görselleştirilmesi, değerlendirilmesi ve manipülasyonu için protokolleri açıklıyoruz (Şekil 1). Bu protokoller, nöral aktivitede anormalliklere yol açan nöropsikiyatrik bozuklukların patogenezini aydınlatmak için yararlı olabilecek nöral aktivite hakkında doğru mekansal zamansal bilgi sağlar.
Giriş
İki fotonluCa2+ görüntüleme, nöral aktivitenin değerlendirilmesi için yararlı bir tekniktir. Sadece normal hayvanlarda davranış ve hafıza için gerekli olan nöral aktiviteyi tanımlamak için de kullanılabilir1,2 aynı zamanda nöropsikiyatrik bozuklukların fare modellerinde meydana gelen anormal bir nöronal aktivite 3,4. Bu teknik, beyin fonksiyonlarının nöral temelini aydınlatmak için kullanılmıştır. Bununla birlikte, yüksek çözünürlüklü ve yüksek kaliteli görüntüler sağlayabilmesine rağmen, zamansal çözünürlüğü elektrofizyolojik yöntem 1,3'ten daha düşüktür.
Optogenetik, sinirbilimcilerin beyin fonksiyonlarını anlama biçiminde yenilik yapmaya yardımcı olmuştur5. Teknik sınırlamalar göz önüne alındığında, optogenetik araştırmaların çoğunluğu düşük uzamsal çözünürlüğe sahip aktivasyon şemaları kullanmış, böylece buna göre gerçekleştirilebilecek nöral aktivitenin manipülasyon türlerini sınırlandırmıştır. Bununla birlikte, nöral aktiviteyi daha ince uzaysal zamansal ölçeklerde manipüle etmek, nöral hesaplamanın ve nöropsikiyatrik bozuklukların patogenezinin daha iyi anlaşılması için potansiyel olarak yararlı olabilir. Femtosaniyeye yakın kızılötesi lazer ışınlarını şekillendirebilen mekansal olarak hassas holografik teknoloji, bu zorluğun üstesinden gelmeyi vaat ediyor ve daha önce imkansız olan birkaç yeni deneysel sınıf açıyor 6,7. Bu teknoloji, sinirbilimcilerin ulaşılamayan duyusal, bilişsel ve davranışsal sinir kodlarının temel yönlerini ve patolojilerini ortaya çıkarmalarını sağlar.
Holografik projeksiyon, bireysel hücrelere ve fonksiyonel ağlara seçici olarak erişmek için istenen ışık modellerinin oluşturulmasını içerir. İn vivo deneyler, canlı beyindeki hedef hücrelere optimum ışık iletimi gerektirir. Kızılötesi ışık canlı dokuya daha derin nüfuz eder ve doğrusal olmayan iki foton uyarımı (2PE) için kullanılabilir8,9,10. Böylece, holografik projeksiyon ve 2PE'yi birleştiren iki foton holografik mikroskopi, in vivo hücresel ve fonksiyonel ağları araştırmak için nöral aktiviteleri değerlendirmek ve manipüle etmek için kullanılabilir. İki fotonlu holografik mikroskopinin son biyolojik uygulamaları, görsel korteks 11,12, koku alma ampulü13 ve hipokampus 14'te öğrenme için gerekli nöral aktiviteyi ve devreyi aydınlatmıştır.
Dünya çapında çok sayıda laboratuvar, holografik stimülasyon sistemlerini kullanarak heyecan verici sonuçlar ve iyileştirmeler bildirmiştir 15,16,17,18,19,20,21,22,23. Burada açıklanan sistemde, holografik stimülasyon sistemi geleneksel bir mikroskop için ek bir cihaz olarak inşa edilebilir. Sadece faz uzamsal ışık modülatörü (SLM), bir düzlem dalga cephesini herhangi bir şekle modüle etmek için anahtar cihazdır ve parazit etkisi, odakların yoğunluğunu ve konumunu kontrol etmek için kullanılır. Şekil 2'de holografik stimülasyon ve görüntüleme ışık yolları görülmektedir. İlk ışık yolu nokta taramalı görüntüleme modu içindir ve bir tarama kafası ve görüntü dedektörlerinden oluşur. İkinci ışık yolu, 1040 nm dalga boyuna sahip holografik stimülasyon içindir ve bir SLM1'den oluşur. Üçüncü ışık yolu, 920 nm dalga boyuna sahip holografik aydınlatma içindir ve bir SLM2 ve bir görüntü sensöründen oluşur. Holografik görüntüleme modu, numunedeki birden fazla noktayı aydınlatarak birden fazla ilgi alanından gelen yoğunlukları kaydedebilir. Bu şekilde, kayıt hızı saniyede birkaç yüz kareye yükseltilebilir. Nokta taramalı görüntüleme veya holografik aydınlatma görüntülemesi elde etmek için, 920 nm lazer, 3: 7 sabit oranlı bir ışın ayırıcı tarafından iki yola ayrıldı. Tüm optik elemanlar, 600 mm × 600 mm boyutlarında optik bir breadboard üzerinde hizalanmıştır. Modüle edilmiş ışık, mikroskobik gövdenin yan tarafındaki ışık portundan girerken, nokta tarama görüntüleme ışığı, mikroskobik gövdenin üstündeki tarama kafasından girdi. Bu ışıklar objektif lensin hemen üzerine entegre edildi ve örnek düzlemde odaklar yarattı. Ek olarak, ısmarlama yazılım, normal iş akışının basit ve tutarlı olmasını sağladı.
Bu makalede, nöral aktiviteyi ölçmek ve nöronlar arasındaki fonksiyonel bağlantıyı değerlendirmek için holografik stimülasyon veya aydınlatma kullanımı için eksiksiz bir protokol sunulmuştur. Gösterim amacıyla, burada fare beyninin birincil somatosensoriyel korteksinin (S1HL) arka bacak bölgesini hedef alan bir beyin ameliyatını ve iki foton holografik mikroskopi kullanarak nöral aktiviteyi değerlendirmek ve manipüle etmek için bir yöntem açıklıyoruz. Deneysel prosedür dört bölüme ayrılmıştır. İlk olarak, kafa plakası diş çimentosu kullanılarak farenin kafatasına sabitlendi. İkincisi, jGCaMP8f veya GCaMP6m-P2A-ChRmine'i ifade eden viral bir vektör, S1HL'ye stereotaktik olarak enjekte edildi. Üçüncüsü, holografik stimülasyon veya aydınlatma sistemi kalibre edildi. Dördüncüsü, postoperatif iyileşme ve bu iki proteinin ekspresyonundan sonra, iki foton holografik mikroskopi ile nöronlar arasındaki nöral aktiviteyi ve fonksiyonel bağlantıyı değerlendirmek için in vivo Ca2 + görüntüleme yapıldı.
Protokol
Tüm deneysel protokoller Nagoya Üniversitesi Tıp Enstitüsü Hayvan Bakımı ve Kullanımı Komiteleri tarafından onaylanmıştır (onay numarası: M220295-003).
1. Kafa plakası implantasyonu (Şekil 1A)
- Fareyi uyuşturmak için anesteziyi (74 mg / kg ketamin ve 10 mg / kg ksilazin karışımı) intraperitoneal olarak uygulayın. Pedal reflekslerini değerlendirerek farenin anestezik durumunu sık sık kontrol edin.
- Anesteziden sonra, fareyi stereotaksik bir alete yerleştirin. Baş plağı implante edildiğinde korneanın kurumasını önlemek için bir göz merhemi uygulayın (bkz.
- Cerrahi bölgeyi tıraş edin ve cildi üç alternatif povidon-iyot veya klorheksidin ovma ve ardından% 70 alkollü mendille dezenfekte edin. Kafatasını dikkatlice açığa çıkarın ve pamuklu çubuklarla temizleyin.
NOT: Tüm cerrahi aletler sterilize edilmeli ve tüm işlemler buna göre yapılmalıdır. Kalan herhangi bir enkaz (örneğin, saç veya kurutulmuş kan) enflamatuar reaksiyonlara neden olur. Bu nedenle, herhangi bir döküntü, steril su veya% 70 alkol ile nemlendirilmiş pamuklu çubuklar kullanılarak bir stereoskop altında çıkarılmalıdır. - Kraniotominin merkezini bulmak ve bir işaretleyici kalemle etiketlemek için stereotaktik koordinatları kullanın - ön ve arka = 0.5 mm, medial ve lateral = bregma'dan 1.5 mm.
- Kafatasının ortasına ısmarlama bir kafa plakası yerleştirin. Daha sonra, kafatasına sıkıca sabitlemek için diş çimentosu uygulayın (bkz. Kafa plakası kafatasının önü ve arkası ile sıkı temas edene kadar hafif basınç uygulayın.
NOT: Bu adımın tamamlanması yaklaşık 20 dakika sürer ve iki fotonlu görüntüleme sırasında beyindeki hareket artefaktlarını azaltmak için kritik öneme sahiptir. Kafa plakasının boyutları 20 mm × 40 mm × 1 mm'dir, bir kenarı 15 mm uzunluğunda, iki bitişik tarafı 3 mm uzunluğunda ve kalan iki tarafı 10 mm uzunluğunda bir ev plakası şekli açıklığındadır. - Akrilik bazlı bir diş yapıştırıcı reçine çimentosunu aşağıdaki gibi karıştırın: yarım kaşık toz, üç damla sıvı ve bir damla katalizör (bkz. Kurumayı önlemek için, bu karışık diş yapışkan reçine çimentosunu farenin sağlam kafatası yüzeyine kafa plakası ile uygulayın.
- Anesteziden kurtulana kadar fareyi sıcak bir kafese yerleştirin. Sternal yatmayı sürdürmek için yeterli bilinci yeniden kazanana kadar fareyi gözetimsiz bırakmayın.
2. Cerrahi ve adeno ilişkili virüs (AAV) enjeksiyonu (Şekil 1B)
- Kafa plağı implantasyonundan 1 gün sonra diş yapıştırıcı reçine çimentosunu kafatasından çıkarmadan kraniyotomi veya viral enjeksiyon yapın.
NOT: Bu işlem sırasında fareye intraperitoneal olarak anestezi (74 mg/kg ketamin ve 10 mg/kg ksilazin karışımı) uygulayın. - Serebral ödemi önlemek için, ameliyattan 1 saat önce intraperitoneal olarak deksametazon sodyum fosfat (1.32 mg / kg) uygulayın.
- Bir ısıtma yastığı ile vücut ısısını korurken bir buharlaştırıcı (anestezi dağıtım sistemi) kullanarak fareyi kafa plakası ile% 1 izofluran anestezi ile uyuşturun. Kornea kurumasını önlemek için bir göz merhemi uygulayın.
- Bir stereoskop altında, bir diş matkabı kullanarak yaklaşık 2 mm çapında dairesel bir kraniyotomi yapın. Beyin hasarını azaltmak için, diş matkabını sürekli hafif hareket ve hafif aşağı doğru basınçla dikkatlice çalıştırın.
- Bir emme sistemi kullanarak kemik parçalarını birkaç kez çıkarın. Kemik parçalarını çıkardıktan sonra, beyin yüzeyinde kalan kalıntıları çıkarmak ve yıkamak için yapay bir omurilik sıvısı (ACSF) çözeltisi kullanın. Enflamatuar reaksiyonları bastırmak için bu temizleme prosedürünü birkaç kez tekrarlayın.
NOT: ACSF çözeltisi (140 mM NaCl, 2,5 mM KCl, 5 mM HEPES, 2,0 mM CaCl2 ve 1,0 mM MgCl2), reaktif çözüldükten ve filtrelendikten sonra 1 ay boyunca 4 °C'de depolanmıştır (gözenek boyutu = 0,22 μm). - Bir basınç enjeksiyon sistemi kullanarak (bakınız Malzeme Tablosu), 10 dakika boyunca uç çapı 10-20 μm olan (bir mikropipet çektirici ile hazırlanmış) bir cam kılcal damardan 500 nL AAV çözeltisi enjekte etmek için uygun basıncı (4 ms süreli darbelerde yaklaşık 10 PSI) ayarlayın.
- Cam kılcal damardaki AAV çözeltisinin seviyesinin giderek azalıp azalmadığını kontrol ederek AAV çözeltisinin beyne uygulanıp uygulanmadığını belirleyin.
- Geri akışı önlemek için cam kılcal damarı 10 dakika daha yerinde bırakın. Beyne toplam 1.5 μL AAV çözeltisi uygulamak için üç kez tekrarlayın.
- Katman 2/3 (L2/3) piramidal hücrelerdeki nöral aktiviteyi değerlendirmek ve manipüle etmek için, vahşi tip farelerin birincil somatosensoriyel korteksinin arka pençe bölgesine bir AAV çözeltisi (Ca 2+ görüntüleme için: AAV2/1-Syn-jGCaMP8f-WPRE× 10 14 vektör genomu/mL'de, salin içinde seyreltilmiş 1:1 oranında enjekte edin; optogenetik ile Ca2+ görüntüleme için: AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1-WPRE 1.73 ×10 14 vektör genomu/mL, tuzlu su içinde 1:1 seyreltilmiş) vahşi tip farelerin birincil somatosensoriyel korteksinin arka pençe bölgesine (S1, bregma'dan 0,5 mm posterior ve 1,5 mm yanalda, yüzeyden 150 μm derinlikte ortalanmıştır).
NOT: AAV çözeltisi, sırasıyla jGCaMP8f ve GCaMP6m-P2A-ChRmine ekspresyonu için görüntülemeden 2-3 hafta ve 1-2 hafta önce enjekte edilmelidir. - Bir mikropipet kullanarak S1'in beyin yüzeyine% 2 (w / v) düşük erime noktalı agaroz uygulamasından sonra, iki kapak gözlüğü ile kraniyotominin üzerine bir cam pencere yerleştirin. İki kapak camını (küçük 2,0 mm çapında ve büyük 4,5 mm çapında; Malzeme Tablosuna bakınız) UV ile kürlenebilir yapıştırıcı ile takın.
- Kapak camını hala sıvı iken agaroza bastırın; Bu, agarozda hava kabarcıklarının oluşumunu önler. Kraniyal pencerenin kenarlarını diş ve yapışkan reçine çimentosu ile kapatın (Şekil 1C).
- Fareyi stereotaksik cihazdan çıkarın ve kafesine geri getirin. Fareyi sıcak bir kafese yerleştirin ve anesteziden tamamen iyileşene kadar diğer hayvanlarla kafese geri dönmeyin. Hayatta kalma ameliyatı sırasında steril koşulları dikkatlice koruyun.
- Ameliyattan sonraki ilk 72 saat boyunca, genel davranışları gözlemleyerek farenin sağlık durumunu kontrol edin. Genel davranışta herhangi bir anormallik varsa, deri altından anti-enflamatuar ve analjezik ajanlar enjekte edin.
3. Holografik stimülasyon veya aydınlatma sistemi için hazırlık (Şekil 3)
- Kırmızı floresan slaytın (dökme akrilik substrat) yüzeyini numune düzlemine yerleştirerek holografik stimülasyon sistemini kalibre edin. Mikroskobu zayıf bir uyarma ışığıyla canlı görüntüleme moduna yerleştirin ve calibration_GUI.m dosyasını çalıştırın. Parametreler bölmesini kontrol edin ve Kaydet düğmesine tıklayın.
- Adım 1 bölmesindeki Z Taraması düğmesini tıklatın. Her düzlemden 2 μm uzakta olmak üzere 21 eksenel düzlemin tümünde otomatik olarak üç rastgele nokta oluşturacaktır.
- Kaydırma çubuğunu hareket ettirin ve canlı görüntüyü kontrol edin. Noktaların en küçük ve en parlak göründüğü mükemmel bir düzlem bulun ve ardından Kaydet düğmesine tıklayın. Bu, dijital hologram için otomatik olarak ofset küresel bir dalga cephesi oluşturacaktır.
NOT: En parlak floresan noktalarını bulamazsanız, tarama aralığının minimum ve maksimum değerlerini değiştirin ve yeniden deneyin. - Adım 2 bölmesinde Git düğmesini tıklatın ve sonra sol karede altı noktayı tıklatın. Canlı görüntüyü kontrol edin. Altı ayırt edilebilir floresan noktası varsa, x ve y eksenlerini düzenleme kutularına yazın ve İndirim düğmesine basın. Bu, holografik stimülasyon ve görüntüleme sistemi arasındaki kalibrasyonu koordine etmek için otomatik olarak afin dönüşüm katsayıları üretecektir.
NOT: Eksen çifti numarası ve tıklanan nokta numarası sırayla eşleştirilmelidir. Emin değilseniz veya görüntünüzde nokta yoksa, lütfen tekrar deneyin ve benzersiz bir nokta deseni oluşturun veya görüş alanının (FOV) merkezi etrafında daha küçük bir aralık seçin. - Adım 3 bölmesindeki Tara düğmesini tıklatın. FOV boyunca 21 × 21 adımda tek nokta taraması yapmak için 441 dijital hologram üretecek.
- İlk olarak, liste kutusundaki desenleri değiştirirken görüntüleri kontrol edin. Ardından, görüntüleme cihazının dinamik aralığında spot görüntüler elde etmek için lazer gücünü ayarlayın (örneğin, aşırı doygun görüntülerden kaçınmak için).
- Daha sonra, düzenleme kutusundaki aralık süresini ayarlayın; Aralık süresi, kayıt aralığı süresinin iki katından fazla olmalıdır. Son olarak, görüntüleme cihazını kayıt moduna getirin ve Oyun düğmesine basın. Oynatma tamamlanırsa, komut penceresinde gösterilen "ekran Tamam" dizeleri olacaktır. Kaydı durdurun ve maksimum yoğunluk yöntemini kullanarak kaydedilen sıralı görüntüleri üst üste koyun.
- Adım 4 bölmesinde WM Oluştur'u tıklatın ve yukarıdan yığılmış bir görüntü seçin. Ardından calibration_GUI pencereyi kapatın. Her noktadaki dengesiz yoğunluğu telafi etmek için otomatik olarak bir ağırlık haritası oluşturacaktır.
NOT: Daha ayrıntılı bir açıklama için lütfen 2; Matlab kodu buradan indirilebilir (https://github.com/ZenKG/SLM_control).
4. Holografik aydınlatmalı bir görüntü sensörü kullanarak Ca2+ görüntüleme (Şekil 4)
- AAV enjeksiyonlu fareyi mikroskop altına bir kafa plakası ile yerleştirin (Şekil 1D).
NOT: Bu prosedür sırasında, fare uyanık durumda tutulur, ancak rahatsız edici uyaranlardan kaçabilir. - Holografik mikroskop ve 25x hedefle 920 nm'ye ayarlanmış mod kilitli Ti: safir lazer kullanarak iki fotonlu görüntüleme (nokta tarama modu) gerçekleştirin (bkz.
- Ticari görüntüleme yazılımını açın (bkz. Canlı görüntüleme modunda, jGCaMP8f'yi ifade eden nöronların parlaklığını optimize etmek için görüntü dedektörünün voltajını ( Malzeme Tablosuna bakın) ve görüntüleme lazerinin gücünü ayarlayın. Bu proteini ifade eden nöronların görüntülerini yakalayın.
NOT: Görüntüleme lazerinin yoğunluğu (920 nm) 20-30 mW'dir. FOV, kortikal yüzeyden 100-150 μm derinlikte 512 μm × 512 μm idi. - jGCaMP8f'yi holografik aydınlatma ile ifade eden belirli nöronları aydınlatmak için SLMcontrol.m komut dosyasını çalıştırın. Referans Resim'e tıklayın ve yukarıda alınan resmi seçin. Ardından, sürekli fare tıklatmasıyla görüntüdeki nöronlar üzerindeki belirli pikselleri seçmek için Nokta düğmesini tıklatın (Şekil 4A). Seçim tamamlanırsa, sonlandırmak için klavyedeki Enter düğmesine basın.
NOT: Dijital hologram otomatik olarak hesaplanır ve SLM üzerinde görüntülenir. Bu desen, bir liste kutusuna tıklanarak da yeniden ziyaret edilebilir. SLM tarafından üretilen tek bir noktanın uzamsal çözünürlüğü, enine yön boyunca yaklaşık 1.2 μm ve optik eksen boyunca ~ 8.3 μm idi. Daha lokalize holografik stimülasyon elde etmek için yüksek sayısal diyaframlı (1.1) objektif lens kullandık. Tablo 1 , önceki raporları ve bu sistemi holografik stimülasyonun uzamsal çözünürlüğü açısından özetlemektedir. - Bir görüntü sensörü kullanarak yüksek zamansal çözünürlüğe sahip nöral aktiviteyi tespit etmek için (bkz. Malzeme Tablosu), görüntü yakalama gerçekleştirmeden önce pozlama süresini, görüntüleme alanını ve gruplamayı (Şekil 4B) ayarlayın (Şekil 4C).
NOT: Bir nöronu sürekli uyaran holografik aydınlatma lazerinin (920 nm) yoğunluğu 2 mW'dir ve bu da nöral aktiviteyi tespit etmek için yeterlidir. Örneğin, görüntüleme için 100 Hz'lik bir kare hızına ulaşmak için, pozlama süresi 9 ms, görüntüleme alanı 400 μm × 400 μm ve gruplama 4'tür. - Deneyden sonra, fareyi ev kafesine geri getirin.
5. Holografik mikroskop kullanarak optogenetik ile iki foton görüntüleme (nokta tarama modu) (Şekil 2)
- 4.1 ve 4.2 numaralı adımları yineleyin.
- Ticari görüntüleme yazılımını açın (bkz. Canlı görüntüleme modunda, GCaMP6m-P2A-ChRmine eksprese eden nöronların parlaklığını optimize etmek için görüntü dedektörünün voltajını ( Malzeme Tablosuna bakın) ve görüntüleme lazerinin gücünü ayarlayın. Bu proteinleri ifade eden nöronların görüntülerini yakalayın (Şekil 1E).
- 4.4 adımını yineleyin.
- L2/3 nöronlarındaki işlevsel bağlantıyı araştırmak için, optogenetik stimülasyonun holografik modellerini (ChRmine; 1.040 nm) oluşturmak için bir SLM kullanın ve bunu iki fotonlu Ca 2+ görüntüleme (GCaMP6m; 920 nm, 512 × 512 piksel, 2 Hz veya 30 Hz,2x dijital yakınlaştırma, nokta tarama modu; Şekil 4D-H).
- Bu protokol için, görüntüleme lazerinin yoğunluğunu 10-20 mW'de 920 nm'ye ve FOV'u kortikal yüzeyden 100-150 μm derinlikte ölçülen 256 μm × 256 μm olarak ayarlayın. Piksel bekleme süresini 2 Hz için 1,5 μs veya 30 Hz için 100 ns olarak ayarlayın.
- Tek bir holografik uyaranın nöronlarda kalsiyum tepkisine neden olup olmadığını görmek için, görüntüleme kare hızı olarak hem 2 Hz hem de 30 Hz kullanın. Tek bir nöronu uyaran holografik stimülasyon lazerinin yoğunluğunu (1.040 nm) 10 mW'da ayarlayın, bu da nöral aktiviteyi indüklemek için yeterlidir (Şekil 4D).
NOT: SLM tarafından üretilen tek bir noktanın uzamsal çözünürlüğü, enine yön boyunca yaklaşık 1,2 μm ve optik eksen boyunca ~8,3 μm'dir. Yanal yönde erişilebilir hacim aralığı yaklaşık 500 μm × 500 μm ve eksenel yönde 100 μm'dir. Ayrıca, 2 Hz veya 30 Hz görüntüleme kare hızında Ca2+ görüntüleme ile sadece bir nöronun değil, birden fazla nöronun aynı anda holografik olarak uyarılabileceğini doğruladık (Şekil 4E).
- Aşağıdaki protokolle görüntü yakalama gerçekleştirin: Ca2+ yanıtını 920 nm'de 10 holografik uyaranla 1.040 nm'de 8 s aralıklarla (0,125 Hz) 10 s'lik bir başlangıç periyodundan sonra 50 m'lik bir süre boyunca aynı anda görüntüleyin. Tüm deneyler tamamlandıktan sonra, fareler ötenazi yapılır.
NOT: Ca2+ geçicileri, eğer varsa, holografik stimülasyon tarafından uyarıldı ve zirveleri stimülasyondan sonra 1 s içinde ortaya çıktı (Şekil 4F-H).
6. Görüntü analizi ve fonksiyonel bağlantının değerlendirilmesi (Şekil 4)
- ImageJ kullanarak 4.5 veya 5.5 adımlarında kaydedilen ham görüntüleri açın. Odak düzlemi yer değiştirmesini telafi etmek için ImageJ eklentisi TurboReg'i kullanın.
NOT: TurboReg ile düzeltme yeterli değilse, odak düzlemi yer değiştirmesini düzeltmek için CaImAn (http://github.com/simonsfoundation) kullanılması önerilir. - Nöral aktiviteyi değerlendirmek için, otomatik bir algoritma (CaImAn) kullanarak L2/3'teki ilgi alanlarını (ROI'ler) belirleyin. Temel floresan yoğunluğunu (F0) ve eşik değerini tanımladıktan sonra Ca2+ geçicilerini algılayın ve analiz edin.
NOT: F0, temel görüntüleme döneminde elde edilen floresan yoğunluğunun 35.yüzdelik değeridir. Ca2+ geçicileri Δ F / F 0 (Δ F = F-F0) ile gösterilir, burada F anlık floresan sinyalidir. Δ F değeri F0'dan 2 S.D.'nin üzerindeyse, önemli birCa2+ geçicisini değerlendiririz. - L2/3 nöronlarında fonksiyonel bağlantıyı tanımlamak için, hedef nöronları uyarın ve uyarılmış ve çevreleyen nöronlarda GCaMP6m tepkilerini buna göre ölçün (Şekil 4F-H).
Sonuçlar
Burada açıklanan yöntem kullanılarak elde edilen temsili kayıtlar sunulmaktadır. İn vivo Holografik mikroskopi kullanılarak yapılan Ca2+ görüntüleme, kafa plakası implantasyonu ve AAV enjeksiyonundan veri toplamaya kadar 2-4 hafta sürer. Bu nedenle, istikrarlı sonuçlar elde etmek için, beyindeki hareket artefaktlarını azaltmak önemlidir. Kafa plağı implantasyonu (adım 1.5) ve kraniyal pencerenin yerleştirilmesi (adım 2.9) bu süreçte çok önemli adımlardır. Ayrıca, kalsiyum göstergesini ve opsini aynı anda tek bir nöronda ifade eden bir AAV (AAV2 / 8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1) seçmek de önemlidir (adım 2.8).
Şekil 4A, özel yapım bir MATLAB komut dosyası kullanılarak edinilen bir nöron görüntüsünün holografik aydınlatması için bir nokta göstermektedir. Holografik aydınlatma jGCaMP8f'yi ifade eden nöronları başarıyla aydınlattıysa, Şekil 4C'de gösterildiği gibi bir görüntü sensörü ile Ca2+ izleri elde edilebilir (Şekil 4B).
Nöronlar arasındaki fonksiyonel bağlantı, Şekil 4E'de gösterildiği gibi holografik stimülasyon (Şekil 4D) kullanılarak değerlendirildi. Nöronlar arasındaki fonksiyonel bağlantı, bir ağrı modeli fare24'ün patogenezinde değiştirilen nöral devre özelliklerinden biri olduğundan, bunu değerlendirmek için basit bir prosedür tarif ediyoruz. Şekil 4F, GCaMP6m kullanılarak görselleştirilen S1HL'deki L2/3 nöronlarının tipik bir görüntüsünü göstermektedir. Bir nöron (turuncu daire) holografik olarak uyarıldığında, başka bir nöron (kırmızı daire) aynı anda aktifti; Böylece, nöronlar arasındaki fonksiyonel bağlantıların sayısı birdi (Şekil 4G).

Şekil 1: Deneysel prosedürün şematik taslağı. (A) Kafa plakasının kafatasına sabitlenmesi. (B) AAV'nin birincil somatosensoriyel korteksin (S1HL) arka pençe bölgesine stereotaktik enjeksiyonu. (C) Kraniyal pencerenin implantasyonu. Nöral aktiviteyi değerlendirmek ve manipüle etmek için, in vivo Ca2+ görüntüleme, holografik stimülasyon (E) ile uyanık farelerde (D) gerçekleştirilir. Flaş işaretleri holografik stimülasyonu veya aydınlatmayı gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
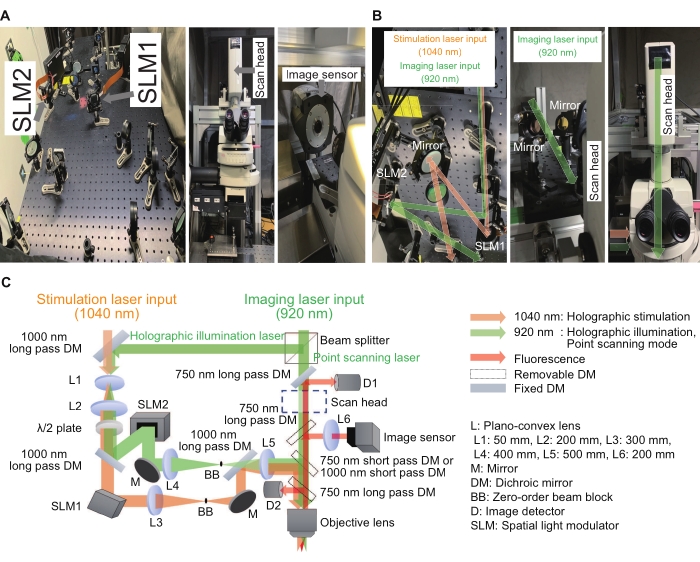
Resim 2: Holografik mikroskop için kullanılan sistem. (A) Mikroskobun yakınındaki holografik stimülasyon ve aydınlatma ışık yollarının görüntüleri (solda) ve bir görüntü sensörü (sağda). (B) Bunlar, ilgili SLM'lerin etrafındaki holografik stimülasyon ve aydınlatma ışık yollarının (sol ve sağ) büyütülmüş görüntüleri ve bir tarama kafasının etrafındaki bir nokta tarama ışık yolu (orta ve sağ). (C) Stimülasyon ve görüntüleme optik yollarının şeması. Dijital hologramları görüntülemek için yalnızca faz SLM'ler kullanılır ve her dijital hologramın suya daldırma objektif lensin çıkış gözbebeğinde görüntülendiğinden emin olmak için ilgili SLM'lerin önüne ve arkasına bir ışın genişletici (L1 ve L2'nin bir kombinasyonu) ve bir 4f röle sistemi (holografik stimülasyon için L3 ve L4 ve holografik aydınlatma için L4 ve L5'in bir kombinasyonu) yerleştirilir. biraz az doldurulmuş görüntü boyutu ile. Artık sıfır sıralı bileşenleri bastırmak için, ara düzleme bir ışın bloğu yerleştirilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
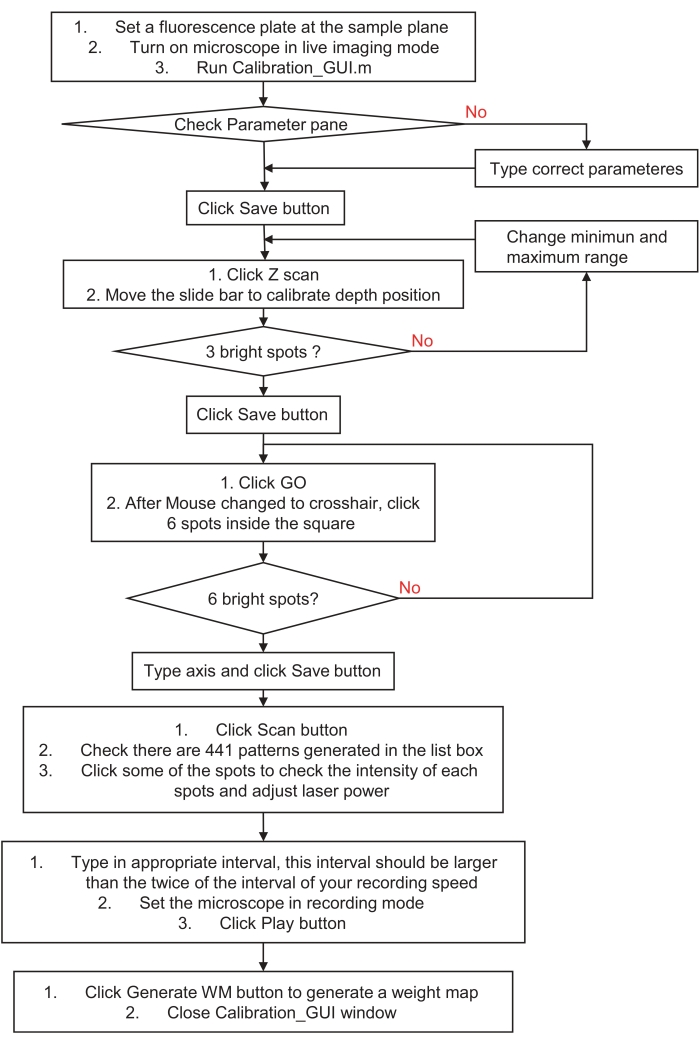
Şekil 3: Holografik stimülasyon veya aydınlatma sisteminin nasıl kalibre edileceğine dair akış şeması. Bu akış şeması, holografik bir stimülasyon veya aydınlatma sistemini numune alanına ve görüntüleme sistemine kalibre etme adımlarını açıklar. Ayrıntılı talimatlar için lütfen holografik stimülasyon veya aydınlatma sistemi için hazırlık olan 3. adımı ziyaret edin ve örnek bir program indirin. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
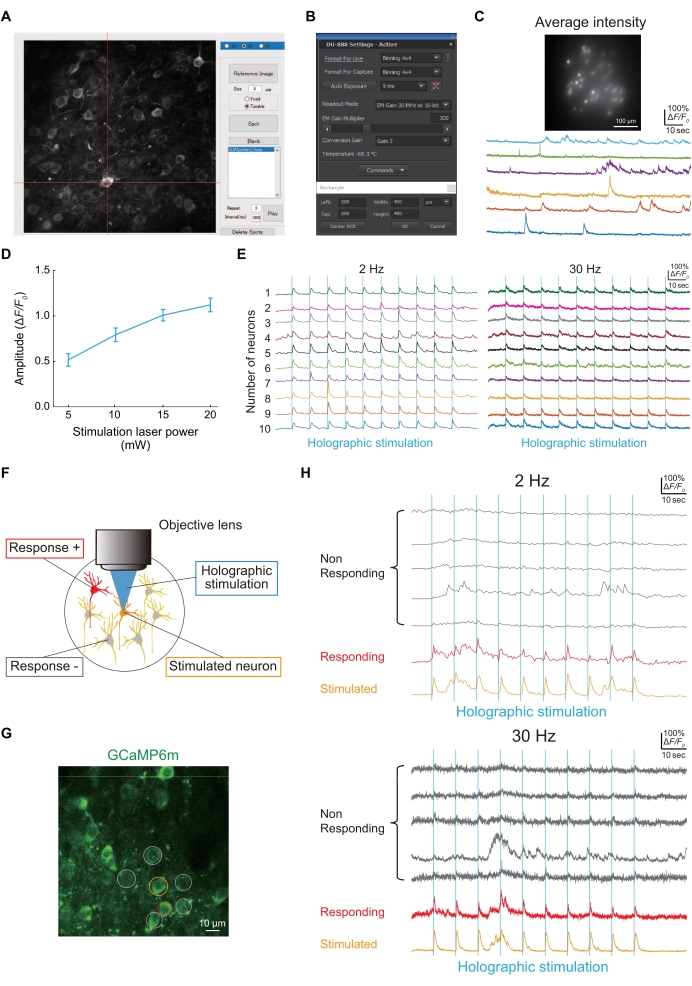
Şekil 4: Holografik mikroskop kullanılarak görüntüleme ve fonksiyonel bağlantının temsili sonuçları . (A) jGCaMP8f veya GCaMP6m-P2A-ChRmine'i ifade eden belirli nöronları aydınlatmak için, nöronların görüntüsü yakalanır ve daha sonra özel yapım bir MATLAB komut dosyası kullanılarak nöron üzerinde bir nokta oluşturulur. (B) Görüntü sensörünün ayarı (pozlama süresi, görüntüleme alanı ve ciltleme). (C) Holografik aydınlatma ve görüntü sensörü ile 100 Hz görüntülemede jGCaMP8f'yi ifade eden nöronların temsili görüntüsü ve izleri. (D) Bu grafik, her lazer gücünde holografik stimülasyona (1.040 nm) verilen nöral tepkiyi göstermektedir (GCaMP6m-P2A-ChRmine'den gelen veriler, nöronları 2 Hz görüntüleme kare hızında [n = 16] ifade eder). Hata çubukları, ortalamanın standart hatasını gösterir. (E) 2 Hz (solda) ve 30 Hz (sağda) görüntüleme kare hızlarında 10 farklı nöronun holografik stimülasyonu (mavi dikey çizgiler) sırasında temsili Ca2+ izler. 2 Hz ve 30 Hz Ca2+ izlerinde, aynı renk aynı nöronu gösterir. (F) Nöronlar arasındaki fonksiyonel bağlantıları değerlendiren şematik diyagram. Turuncu nöron uyarıldığında, kırmızı nöronlar aynı anda tepki verir ve bu nöronlar arasında işlevsel bağlantı olduğunu gösterir. (G) WT'de GCaMP6m'yi ifade eden S1HL nöronlarının tipik bir görüntüsü. Ölçek çubuğu = 10 μm. (H) Holografik stimülasyon sırasında tipik Ca2+ izleri (mavi dikey çizgiler) 2 Hz (üst) ve 30 Hz (alt) görüntüleme kare hızlarında. Uyarılan nöron turuncu renkte daire içine alınır, yanıt veren nöronlar kırmızı renkte daire içine alınır ve yanıt vermeyen nöronlar gri renkte daire içine alınır. Holografik stimülasyona nöral yanıt hem 2 Hz hem de 30 Hz görüntüleme hızlarında tespit edilebilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Kurulumumuz 6 | Prakash, R. ve ark. 25 | Marshel, J. H. ve ark. 12 | Robinson, N. T. M. ve ark. 14 | |
| Yanal çözünürlük | 1,2 μm | 1,27 μm | ― | 2,22 μm |
| Eksenel çözünürlük | 8,3 μm | 56,86 μm | 15,5 μm | 10,26 μm |
| Objektif lens/Sayısal Diyafram açıklığı | 25x/1.1 | 20x/0,5 | 16x/0,8 | 16x/0,8 |
Tablo 1: Holografik stimülasyonun uzamsal çözünürlüğü için önceki raporların ve bu sistemin özeti. Yanal çözünürlük, eksenel çözünürlük ve ölçüm sırasında kullanılan objektif lens açıklanmaktadır.
Tartışmalar
Beyin fonksiyonunu anlamak için, nöral aktivitenin dinamiklerini çıkararak beyin fonksiyonunun altında yatan nöral devreyi doğru bir şekilde değerlendirmek gerekir. Ayrıca, nöropsikiyatrik bozuklukların patogenezini aydınlatmak için bu nöral devrenin nasıl değiştirildiğini tanımlamak önemlidir. Gerçekten de, Alzheimer hastalığı4 ve kırılgan X sendromu26'nın fare modellerinde ve bozulmuş beyaz cevher fonksiyonu3 olan farelerde nöral aktivitenin arttığı bilinmektedir. Dahası, enflamatuar ağrının bir fare modelinde, nöral aktivitenin artan senkronizasyonu ve nöronlar arasındaki fonksiyonel bağlantı, semptomlarla ilişkilidir24. İki fotonlu holografik mikroskopi, bireysel nöronların aktivitesini ve sinir devresini anlamak için gerekli olan nöronlar arasındaki fonksiyonel bağlantıları aynı anda gözlemlememizi sağlar. Sayısal diyafram açıklığına sahip 25x objektif lens = 1.1 nm dalga boylarında 1,040x objektif lens kullandık. Teorik nokta yayılma fonksiyonu, yanal olarak maksimum 0.5 μm ve eksenel olarak 1.7 μm yarı yarıya tam genişliğe sahip bir Gauss dağılımıdır. Bununla birlikte, gerçek sayısal açıklık 1.1'den azdır ve bir floresan boncuk üzerinde ölçülen spot boyutu yanal olarak 1.2 μm ve eksenel olarak 8.3 μm'dir. Nöron çapının yaklaşık 15 μm olduğu ve kalibrasyon hatasının 3 μm içinde olduğu göz önüne alındığında, hedefleme genellikle iyidir. Bununla birlikte, eksenel yöndeki hücreler daha uzun nokta boyutu6'dan etkilenebilir. Burada, viral enjeksiyonu, ameliyatı, holografik stimülasyon veya aydınlatma sistemlerinin kalibrasyonunu ve mikroskopi sistemimizi kullanarak canlı farelerde nöral aktiviteyi değerlendirmek ve manipüle etmek için görüntüleme protokollerini açıkladık.
Kafa plakası implantasyonu ve virüs enjeksiyonundan holografik mikroskopi kullanılarak in vivo Ca2+ görüntüleme için veri toplamaya kadar tüm deneysel prosedürlerin tamamlanması 2-4 hafta sürer. Süreç karmaşık ve zahmetlidir ve deneyin nihai başarısı, postoperatif inflamasyondan etkilenen kraniyal pencerenin durumu, Ca2 + göstergesi ve opsin'in doğru seçimi ve elde edilen görüntülerdeki hareket artefaktlarının düzeltilip düzeltilemeyeceği gibi birçok faktöre bağlıdır. Özellikle başarılı bir sonuç için iki adım önemlidir. Birincisi kafa plakası fiksasyonu ve ameliyatı ile ilgilidir; Kafa plakasının diş çimentosu ile fare kafasına sıkıca sabitlenmesi çok önemlidir. Ayrıca, ameliyat sırasında soğuk ACSF kullanarak kemik parçalarını ve pıhtılaşmış kanı tekrar tekrar temizlemek önemlidir. Bu prosedüre bağlılık iltihabı azalttığından, beynin bağışıklık sisteminden sorumlu hücreler olan mikroglia'nın dinamiklerini, süreçlerini ve dikenlerini veya nöronların mikroyapılarını aktive etmeden başarıyla gözlemledik27,28. İkinci konu, nöral aktivitenin değerlendirilmesi ve manipülasyonudur. Ca2+ göstergesini ve opsin'i aynı anda bir nöronda ifade etmek için AAV2 / 8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1'i seçtik. Bunun nedeni, bir nöronu farklı AAV tipleriyle etkili bir şekilde enfekte etmenin zor olmasıdır. Bu seçimin bir başka nedeni, ChRmine'nin iki fotonlu bir lazer12 kullanarak 1.040 nm'de nöral aktiviteyi verimli bir şekilde aktive edebilmesiydi. Son zamanlarda, ChRmine'in, kriyo-elektron mikroskobu ile elde edilen yapısal bilgilere dayanarak yapısını mutasyona uğratarak, nörobilim alanında hedef fonksiyon analizi için yararlı olduğu düşünülenfonksiyon 29'u geliştirdiği bildirilmiştir. Bu konular ışığında, nöral aktiviteyi okurken ve holografik mikroskopi kullanarak bilgi yazarken nöronları değerlendirmek ve manipüle etmek için etkili yöntemleri paylaşmak gerekir.
Görüntüleme ve optogenetikteki son gelişmeler, öğrenme ve hafıza gibi beyin fonksiyonlarında yer alan ayrıntılı nöral aktiviteyi ortaya çıkarmıştır ve beyin fonksiyonlarını ifade etmek için bu sinirsel aktiviteyi yapay olarak manipüle etmek mümkündür30. Bununla birlikte, nöral aktivitenin manipülasyonu için geleneksel yöntemler, beyindeki optik liflerin yerleştirilmesi nedeniyle ve bir grup opsin eksprese eden hücrenin aynı anda uyarılması nedeniyle oldukça invazivdir, bu da nöral aktiviteyi zamansal ve mekansal hassasiyetle manipüle etmeyi imkansız kılar. Yöntemimiz, beyindeki sadece belirli nöronları uyararak nöral aktiviteyi manipüle edebilir, böylece sinirsel aktivitenin spesifik stimülasyon kalıpları ve yüksek uzaysal zamansal çözünürlükle manipüle edilmesini sağlar. Ayrıca, nöronlar arasındaki işlevsel bağlantının, beyin dilimi deneyleri kullanılarak yalnızca az sayıda nöronda değerlendirilebileceğini belirtmek önemlidir31; Bununla birlikte, bu teknik canlı hayvanlarda çoklu nöronların eşzamanlı olarak değerlendirilmesine izin verir.
Mevcut holografik mikroskopların en büyük sınırlamalarından biri, farenin davranışını sınırlayan fare kafasını sabitleme ihtiyacıdır. Son zamanlarda, minyatür bir iki foton mikroskobu geliştirildi32 ve cihazın daha da minyatürleştirilmesiyle, serbest hareket eden farelerde holografik stimülasyonla in vivo Ca2 + görüntüleme mümkün olabilir. Ek olarak, bu mikroskobun potansiyeli, görüntülemenin zamansal çözünürlüğünü artırarak ve onu yüksek hassasiyetli voltaja duyarlı floresan proteinleri33 ile birleştirerek genişletilebilir.
Açıklamalar
Yazarların beyan edecekleri çıkar çatışmaları yoktur.
Teşekkürler
Bu çalışma, Yenilikçi Alanlarda Bilimsel Araştırma için Hibe Yardımları (19H04753, 19H05219 ve H. W.'ye 25110732), Dönüştürücü Araştırma Alanları için Yardımlar (A) (20H05899'dan H. W.'ye, 20H05886'dan O. M.'ye ve 21H05587'den D. K.'ya), Ortak Uluslararası Araştırmaların Teşvik Edilmesi (B) (20KK0170'ten H. W.'ye), Bilimsel Araştırma için Hibe (B) (18H02598'den H. W.'ye), Bilimsel Araştırma için Hibe (A) (21H04663 - O. M.), Kariyerinin Başlarında Çalışan Bilim İnsanları için Hibe (20K15193 - X. Q.), JST Crest Hibe Numarası JPMJCR1755, Japonya ve JST A-STEP Hibe Numarası JPMJTR204C.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 25x Objective | Nikon | N25X-APO-MP | Objective |
| A1MP | Nikon | A1MP | Microscope |
| AnesII | Bio machinery | AnesII | Anesthesia delivery system |
| C2 plus | Nikon | C2 plus | Microscope |
| DECADRON Phosphate Injection | Aspen | 21N024 | Avoid cerebral edema |
| Dental Drill | Jota | C1.HP.005 | Dental drill |
| Electric Microinjector | NARISHIGE | IM-31 | Pressure injection system |
| FEATHERS | FEARGER | FA-10 | Shaving |
| G-CEM ONE ADHESIVE ENHANCING PRIMER | GC | 2110271 | Resin cement primer for dental adhesion |
| G-CEM ONE neo | GC | 43093 | Resin cement for dental adhesion |
| Glass Capillary with Filament | NARISHIGE | GDC-1 | Glass capillary |
| Image Detector | Hamamatsu | H10770PA-40 | GaAsP photocathode photomultiplier tube |
| Imaging Software | Nikon | NISelements | Imaging software |
| Isoflurane Inhalation Solution | Pfizer | 229KAR | Anesthetics |
| iXon EMCCD Camera | Andor | iXon Life 888 | Image sensor |
| Ketamine | daiitisannkyou | s9-018506 | Anesthetics |
| Leica-M60 | Leica | M60 | Stereoscope |
| Linicon | Linicon | LV-125 | Vacuum pump |
| Mode-locked Ti:sapphire Chameleon Ultra II laser | Coherent | Chameleon Discovery NX | Femtosecond laser |
| Mos-Cure | U-VIX | mini 365 | Portable LED UV Light Source |
| PEN Bright | SHOFU INC. | PEN Bright | Dental light curing unit |
| Puller | SUTTER instaument | P-97 | Puller |
| Stereotaxic Instrument (for Mice) | NARISHIGE | SR-6M-H | Stereotaxic instrument |
| Stereotaxic Micromanipulator | NARISHIGE | SM-15R | Stereotaxic micromanipulator |
| Super-Bond CATALYST V | SUN MEDICAL | 8070 | Dental adhesive resin cement |
| Super-Bond Dental Adhesive Monomer | SUN MEDICAL | 8071 | Dental adhesive monomer |
| Super-Bond Teeth Color Polymer Powder | SUN MEDICAL | 145052000 | Teeth color polymer powder |
| Tarivid Ophthalmic Ointment 0.3% | Santen Pharmaceutical | TRN3952 | Eye ointment |
| UlTIMATE XL | NSK | Y141446 | Dental laboratory micromotor control unit |
| UV Curing Optical Adhesives | THORLABS | NOA61 | UV Curing Optical Adhesives |
| Xylazine | Bayer | KP0F2BK | Anesthetics |
Referanslar
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nature Neuroscience. 17 (7), 987-994 (2014).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Kato, D., et al. Motor learning requires myelination to reduce asynchrony and spontaneity in neural activity. Glia. 68 (1), 193-210 (2020).
- Busche, M. A., et al. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models in vivo. Nature Neuroscience. 22 (1), 57-64 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Quan, X., Kato, D., Daria, V., Matoba, O., Wake, H. Holographic microscope and its biological application. Neuroscience Research. 179, 57-64 (2022).
- Adesnik, H., Abdeladim, L. Probing neural codes with two-photon holographic optogenetics. Nature Neuroscience. 24 (10), 1356-1366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Svoboda, K., Denk, W., Kleinfeld, D., Tank, D. W. In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 385 (6612), 161-165 (1997).
- Carrillo-Reid, L., Han, S., Yang, W., Akrouh, A., Yuste, R. Controlling visually guided behavior by holographic recalling of cortical ensembles. Cell. 178 (2), 447-457 (2019).
- Marshel, J. H., et al. Cortical layer-specific critical dynamics triggering perception. Science. 365 (6453), (2019).
- Gill, J. V., et al. Precise holographic manipulation of olfactory circuits reveals coding features determining perceptual detection. Neuron. 108 (2), 382-393 (2020).
- Robinson, N. T. M., et al. Targeted activation of hippocampal place cells drives memory-guided spatial behavior. Cell. 183 (6), 1586-1599 (2020).
- Packer, A. M., Russell, L. E., Dalgleish, H. W., Häusser, M. Simultaneous all-optical manipulation and recording of neural circuit activity with cellular resolution in vivo. Nature Methods. 12 (2), 140-146 (2015).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nature Neuroscience. 21 (6), 881-893 (2018).
- Yang, W., Carrillo-Reid, L., Bando, Y., Peterka, D. S., Yuste, R. Simultaneous two-photon imaging and two-photon optogenetics of cortical circuits in three dimensions. Elife. 7, 32671 (2018).
- Forli, A., et al. Two-photon bidirectional control and imaging of neuronal excitability with high spatial resolution in vivo. Cell Reports. 22 (11), 3087-3098 (2018).
- Pégard, N. C., et al. Three-dimensional scanless holographic optogenetics with temporal focusing (3D-SHOT). Nature Communications. 8 (1), 1228 (2017).
- Dal Maschio, M., Donovan, J. C., Helmbrecht, T. O., Baier, H. Linking neurons to network function and behavior by two-photon holographic optogenetics and volumetric imaging. Neuron. 94 (4), 774-789 (2017).
- Russell, L. E., et al. All-optical interrogation of neural circuits in behaving mice. Nature Protocols. 17 (7), 1579-1620 (2022).
- Oron, D., Papagiakoumou, E., Anselmi, F., Emiliani, V. Two-photon optogenetics. Progress in Brain Research. 196, 119-143 (2012).
- Hernandez, O., et al. Three-dimensional spatiotemporal focusing of holographic patterns. Nature Communications. 7, 11928 (2016).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Science Advances. 7 (12), 8261 (2021).
- Prakash, R., et al. Two-photon optogenetic toolbox for fast inhibition, excitation and bistable modulation. Nature Methods. 9 (12), 1171-1179 (2012).
- Gonçalves, J. T., Anstey, J. E., Golshani, P., Portera-Cailliau, C. Circuit level defects in the developing neocortex of Fragile X mice. Nature Neuroscience. 16 (7), 903-909 (2013).
- Akiyoshi, R., et al. Microglia enhance synapse activity to promote local network synchronization. eNeuro. 5 (5), (2018).
- Haruwaka, K., et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nature Communications. 10 (1), 5816 (2019).
- Kishi, K. E., et al. Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine. Cell. 185 (4), 672-689 (2022).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Ko, H., et al. The emergence of functional microcircuits in visual cortex. Nature. 496 (7443), 96-100 (2013).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Villette, V., et al. ultrafast two-photon imaging of a high-gain voltage indicator in awake behaving mice. Cell. 179 (7), 1590-1608 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
ISSN 1940-087X
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır
Sitemizdeki deneyiminizi iyileştirmek için çerezleri kullanıyoruz
Sitemizi kullanmaya devam ederek ya da "Devam et" butonuna tıklayarak, çerezleri kabul edebilirsiniz.