Method Article
İnsan Nötrofillerinin Tam Kan ve Buffy Coats'tan İzolasyonu
Bu Makalede
Özet
Bu protokol, nötrofillerin tam kan, buffy coats veya lökferez zarlarından izole edilmesinin, iyi verim, yüksek saflık ve minimum hücre aktivasyonu elde edilmesinin bir yöntemini detaylandırmaz. Yüksek kaliteli/saflıkta nötrofil preparatı elde etmek için gradyan saflaştırma, kırmızı kan hücresi (RBC) sedimilasyonu ve RBC lizizini kullanıyoruz.
Özet
Nötrofiller (PMN'ler), toplam kan lökositlerinin% 40 ila% 70'i arasında değişen insan dolaşımındaki en bol lökositlerdir. Damarlar yoluyla hızlı ekstravazasyon yoluyla iltihaplanma yerinde işe alınan ilk hücrelerdir. Orada, nötrofiller istilacı patojenleri öldürmek ve bağışıklık sinyaline aracılık etmek için bir dizi işlev gerçekleştirirler. İnsan kanından yeni arındırılmış nötrofiller, hiçbir hücre hattı PMN işlevlerini ve biyolojisini tam olarak çoğaltmaz, çünkü çalışma için tercih edilen modeldir. Bununla birlikte, nötrofiller kısa ömürlü, ölümcül olarak farklılaştırılmış hücrelerdir ve fiziksel (sıcaklık, santrifüj hızı) ve biyolojik (endotoksin, kemoterapi ve sitokinler) uyaranlara yanıt olarak aktivasyona oldukça duyarlıdır. Bu nedenle, saf ve aktive olmayan hücreler elde etmek için standartlaştırılmış, güvenilir ve hızlı bir yöntem izlemek çok önemlidir. Bu protokol, yüksek PMN saflığı elde etmek ve hücre aktivasyonunu en aza indirmek için yoğunluk gradyan santrifüjleme, kırmızı kan hücresi (RBC) sedimantasyon ve RBC lizizini birleştiren güncellenmiş bir protokol sunar. Ayrıca nötrofil izolasyon kalitesini, canlılığını ve saflığını değerlendirme yöntemleri de tartışılmaktadır.
Giriş
Doğuştan gelen bağışıklık sistemi, diğer birçok fizyolojik fonksiyonla birlikte immün homeostaz ve patojen boşluğu koruyan birçok hücre türünden oluşur. Nötrofiller insan dolaşımındaki en büyük beyaz kan hücresi havuzunu oluşturur1. Olgun nötrofillerin çoğu granülopeis olarak da adlandırılan yeni nötrofillerin üretim yeri olan kemik iliğinde depolanır. Kemik iliğinde, granülosit progenitörleri hücre döngüsünden çıkar ve karakteristik segmentli çekirdeklerini ve granüllerini elde ederek ölümcül bir şekilde farklılaştırır2. Enflamatuar koşullar altında, kemokinler, sitokinler ve hasarla ilişkili ve patojen ilişkili moleküler desenlere yanıt olarak, nötrofiller çok çeşitli işlevleri yerine getirmek için kan dolaşımından ve kemik iliğinden harekete geçirilir. Bunlar sitokin salgılanması, patojenin doğrudan fagositozu, reaktif oksijen türlerinin salınmesi, antimikrobiyal proteinlerin degranülasyonu ve nötrofil hücre dışı tuzakların oluşumudur.
Nötrofiller tarafından enfeksiyonla savaşmak için kullanılan moleküller mikroplar ve konak için toksiktir. Böylece, yaşlanma / ölmekte olan nötrofillerin ömrü ve uygun şekilde çıkarılması son derece düzenlenmiştir ve dolaşımda sınırlı bir yaşam süresine sahiptirler (<48 h)3. Bu kısa hayatta kalma nedeniyle, insan vücudu nüfus homeostazını korumak için her gün ortalama 100 milyar yeni nötrofil üretir4. Acil granülopeis, iltihaplanma ve enfeksiyon sırasında kanda hem olgun hem de olgunlaşmamış nötrofillerin salınımını daha da artırabilir5. Doğuştan gelen immün yanıtta nötrofillerin önemi, bakteriyel ve mantar enfeksiyonlarına duyarlı edinilmiş veya konjenital nötropeni hastaları tarafından vurgulanır6.
Nötrofil biyolojisini ve doğası gereği bağışıklık tepkislerindeki rollerini incelerken, kısa hayatta kalmaları ve sitotoksik içerikleri de dahil olmak üzere birçok zorluk ortaya çıkar. Nötrofil benzeri hücre hatları genellikle insan promiyelositik lösemi HL-60 hücrelerinden ve PLB-985hücrelerinden 7,8'denayırt edilmiştir. Nötrofil benzeri morfolojiyi gösterebilmelerine ve kemotaksi yapabilmelerine rağmen, bu hücre hatları nötrofillerin biyolojisini tam olarak nüksedemez. Bu hücre hatlarını kullanan in vitro tahliller de in vivo deneyleri nüksedemez. Ayrıca, bu hücrelerin farklılaşması indüklenmesi gerekir ve farklılaşmadan önce gen manipülasyonundan olumsuz etkilenebilir.
Son zamanlarda, HL-60 hücrelerinde gen ekspresyon sonrası farklılaşmayı modüle etmek için indükleyici promotörler kullanarak bu sorunları atlatmak için yöntemler geliştirilmiştir9. Bu tür araçlarla bile, farmakolojik yaklaşımları kullanarak hedefleri doğrulamak için birincil insan PMN'leri gereklidir. Bu nedenle, hücre hattı ve hayvan modellerinin bulgularını doğrulamak için kandan izole edilmiş saf ve inaktive nötrofiller elde etmek zorunludur. Bu makalede, mevcut yöntemlerin artılarının ve eksilerinin değerlendirildiği gözden geçirilmiş bir PMN izolasyon protokolü sunulmaktadır10. PMN'leri diğer bağışıklık hücrelerinden ayırmak için degrade santrifüjleme, RBC'lerin büyük kısmını çıkarmak için kısa dektran bazlı sedimantasyon, ozmotik basınç yoluyla hızlı artık RBC lizisi ve trombosit kontaminasyonunu gidermek için düşük hızlı santrifüjlemeden oluşan bir kombinasyon tasarlanmıştır.
Protokol
NOT: İnsan nötrofilleri, Boston Çocuk Hastanesi'ndeki Kan Bankası Laboratuvarı'ndan elde edilen atılmış beyaz kan hücresi filtrelerinden venöz kandan izole edildi. Kan bağışçıları tanımlanamayan bir kişiydi ve yaşayan bireylerle etkileşim veya tanımlanabilir kişisel bilgiler hakkında bilgi yoktu. Bu nedenle, bu çalışma HHS insan denekler yönetmeliği (45 CFR Bölüm 46) kapsamında insan denek araştırması olarak sınıflandırılmamıştır. Boston Çocuk Hastanesi Kurumsal İnceleme Kurulu (IRB) protokolü onayladı.
1. Degradenin katmanlaşması
- Buffy coat veya tam kan ambalajını ve laminar davlumbazı sterilize ettikten sonra, kanı her tüpte 10 mL kan ile 50 mL tüplere bölün.
- Daha temiz bir gradyan için kanı seyreltmek için % 5 fetal sığır serumu (FBS)/Hank'in Dengeli Tuz Çözeltisi (HBSS) ile hacmi 35 mL'ye kadar getirin.
NOT: Lökferez membran kullanırken, hücreler filtre başına 60 mL şırıng ve %5 FBS/HBSS'nin 30 mL'si kullanılarak dışarı atılabilir. Taze çekilmiş tam kanla çalışırken seyreltme gereksizdir. - 50 mL'lik tüp kapağını kapatın, ters çevirerek birkaç kez karıştırın ve alt kısmı RBC'lerden yoksun hale getirmek için baş aşağı tutun.
- Kanın hemen altına 10 mL yoğunluk degrade ortamı ekleyin (Bkz. Malzeme Tablosu). Ortamın ve kanın karışmamasını ve arayüzün keskin olduğundan emin olun (Şekil 1A).
NOT: Bu adım çok önemlidir. Yoğunluk degrade çözeltisinin oda sıcaklığında (RT) olduğundan ve her degradeden önce iyi karıştığından emin olun. Yoğunluk gradyan ortamının ilk mililitresinin mümkün olduğunca yavaş ve dikkatli bir şekilde katmanlanması gerekir. Elektronik pipet hızının düşük olması önerilir. - Tüpü gradyanı bozmadan hafifçe bir santrifüje yerleştirin ve RT'de 30 dakika boyunca 400 × g'da döndürün ve freni devre dışı bıraktığından emin olun. Spun gradyanının bir üst serum/plazma tabakasına, periferik kan mononükleer hücrelerinin (PBMC' ler) orta beyaz halkasına, bulutlu yoğunluk gradyan orta tabakasına ve RBC'lerin üstünde beyaz, ince nötrofil bandından oluşan bir alt peletine nasıl ayrılarak ayrıştığını gözlemleyin (Şekil 1B).
NOT: Santrifüjlemeden sonra tüpün bulutlu veya opak bir tarafı, hücrelerin (nötrofiller) aktive olduğunu ve kullanıma uygun olmayabileceğini düşündürebilir. - Emiş pipetini doğrudan PBMC katmanına çıkararak önce PBMC'leri çıkarın. Halka çıkarılırken serum/plazma tabakası azalırken tamamen aspire etmeyi unutmayın. PMBC'nin çıkarılmasını en üst düzeye çıkarmak için hücrelerin emme pipetiyle peletlendiği tüpün yan tarafını kazıyın. PBMC halkası ile nötrofil/RBC pelet arasındaki bulutlu yoğunluk gradyan orta tabakasını dikkatlice çıkarın.
NOT: Tüpün yan tarafındaki peletlenmiş hücrelerin kazınmış olarak kazınmış edilmesi, izolasyonun saflığını önemli ölçüde artırır. Çoğu nötrofil doğrudan RBC'lerin üzerinde oturduğundan, peleni aspire etmemeye dikkat edin.
2. Eritrositlerin tortulasyonu (RBC'ler)
- 10 mL pipet kullanarak nötrofil/RBC peletini temiz bir tüpe aktarın. Yukarı ve aşağı pipet yapmayın. 25 mL'lik son hacme %5 FBS/HBSS ekleyin. Ters çevirme ile hafifçe karıştırın.
NOT: PBMC kaldırma işleminden sonra RBC sedimasyonunun gerçekleştirilmesi verimi artırır ve aktivasyonu azaltır10. - Seyreltilmiş nötrofil/RBC pelet içeren tüpe doğrudan 25 mL önceden ısıtılmış (37 °C) %3 Dextran/%0,9 NaCl/H2O ekleyin ve ters çevrilerek hafifçe karıştırın. Tüpü 15 dakika boyunca titreşimsiz bir yüzeyeyerleştirin (Şekil 1C).
NOT: Daha uzun sedimentasyon RBC kontaminasyonunu azaltır, aynı zamanda verimi de azaltır. Ayrıca, uzun süreli dektran maruziyeti nötrofil aktivasyonuna veya hücre ölümüne yol açabilir11. - Tüpü yavaşça kaputun içine geri getirin (steril izolasyon için). Pipetleri sıvıya sadece hafifçe batırarak, sıvı yüzeyi aşağı doğru takip eden üst tabakayı (~30 mL) toplayın.
NOT: Sedimasyon ortam ve RBC'ler arasında keskin bir arayüz oluşturursa, RBC peleti daha küçüktür veya daha yüksek verim isteniyorsa, 35 mL'ye kadar toplayın. - Tüpü döndürün (400 × g, 10 dk, RT, düşük fren (3) kullanarak, medyada yüzen parçacıklar olmadan kırmızı bir peletle sonuçlanır.
3. Kalan RBC'lerin lizisi
- Peleti bozmadan süpernatantı hafifçe emiş.
- Doğrudan tüpe 25 mL steril ultra saf su ekleyin ve RBC'leri lyse etmek için 28 sn ters çevirerek hafifçe karıştırın. Peletin yeniden kullanılması için pipet kullanmayın.
NOT: Uzun süreli hipotonik koşullar aktif hale getirebileceği ve nötrofil ölümüne yol açabileceği için 30 s'yi aşmayın12. - Hemen tüpe 25 mL steril % 1.8 NaCl/ H2O ekleyin ve çözeltiyi izotonik koşullara geri getirmek için ters çevirerek hafifçe karıştırın.
NOT: Çözüm kırmızı ancak bulanıklık olmadan olmalıdır. - Nötrofiller (Şekil 1D ve Şekil 2 ) 13,14ile birlikte RBI'ları ve trombosit çökeltmelerini en aza indirmek için düşük fren (seviye 3) ile 3-5dakika boyunca 200 × g'da aşağı döndürün.
NOT: Pelet, üst kısım aspire edilirken hafifçe çıkarılabilen, üstünde minimum bir RBC tabakası bulunan beyaz olmalıdır. - Kültür ortamını (%10 FBS/RPMI1640) doğrudan peletin üzerine pipetleterek nötrofilleri yeniden dürtmek, ancak yukarı ve aşağı pipetlemeyin. Hücre aktivasyonunu en aza indirmek için tüpü bir yandan diğer yana yatay olarak sallayın.
NOT: Hücreler ~ 2 × 106 hücre / mL konsantrasyonda tutulmalıdır, çünkü daha yüksek yoğunluk hücre aktivasyonunun / ölümünün artmasına neden olacaktır15. Aynı nedenle, hücre peletı mümkün olan en kısa sürede yeniden çıkarılmalıdır. - Hücre toplama veya topaklanma görülürse, kümelenmiş nötrofilleri atmak için hücre süspansiyonunu 70 μm'lik bir ağ kullanarak filtreleyin.
4. Nötrofil izolasyon kalitesinin belirlenmesi
- Hücreleri nötrofillere özgü belirteçlerle (CD66b, CD11b), eozinofiller (CD193) (Şekil 3) ve CD62L ( Şekil 4 ) gibi bir aktivasyon işaretleyicisi ilelekeleyin. Akış sitometrisi ile 20.000 hücre elde edin. Şekil 3 ve Şekil 4'teönerilen gating stratejilerini kullanarak hücre saflığını ve aktivasyonunu analiz edin.
NOT: Nötrofil preparatının kalitesi, nötrofillerin benzersiz loblu çekirdeğini görselleştirmek için% 3 asetik asit-metilen mavi çözeltisi kullanılarak değerlendirilebilir. - Annexin V/propidium iyodür (PI) kullanarak hücre canlılığını belirleyin (Şekil 5).
NOT: Hücre canlılığını değerlendirmek için trypan mavi boyama kullanılabilir.
Sonuçlar
Nötrofilleri arındırmak için yoğunluk gradyanı kullanırken, kan ve yoğunluk gradyan ortamı arasındaki arayüzün mümkün olduğunca keskin olması ve santrifüjlemeden sonra ayrı bir katman ayrımının kalması önemlidir (adım 1.4). RBC lizizini takiben, tampon bulanık değil açık kırmızı olmalıdır (adım 3.3). Hazırlık bulutluysa, ikinci bir liziz turu (adım 3) gerekebilir, ancak bu nötrofil sağkalımını etkileyebilir (Şekil 1). Lizizden sonra, trombosit kontaminasyonunu önemli ölçüde azalttığı için saflığa öncelik edildiğinde düşük hızlı santrifüjleme (200 × g)önerilir. Bununla birlikte, yüksek hızlı santrifüjleme (400 × g)saflık pahasına verimi arttırır (adım 3.4, Şekil 2). Nötrofil izolasyondan sonra, izolasyon saflığını değerlendirmek için floresan ile aktive edilmiş hücre sıralama kullanılabilir (adım 4.1) ve mikroskopi yerine seçilmelidir. Hücrelerin FSC/SSC dağılımı tek başına hücre izolasyon kalitesinin tahminini sağlasa da (Şekil 3A), spesifik hücre işaretleyicilerinin kullanımı tercih edilmelidir. Bu durumda, en yaygın kirletici hücre popülasyonları, özellikle granülositler üzerinde ifade edilen CD66b ile birlikte spesifik antikorlarla lekelenir. CD45 boyama lökositleri (CD45+) ve kırmızı kan hücrelerini ve trombositleri (CD45-) ayırt etmek için kullanılır.
Diğer kirleticiler lenfositler (CD3+ veya CD19+, Şekil 3F),monositler (CD14+, Şekil 3D)ve eozinofiller (CD193+, Şekil 3G)içerir. CD11b miyeloid soyunda ifade edilen bir integrindir; nötrofiller ve monositler CD11b+, lenfositler ise CD11b- (Şekil 3C). Nötrofil aktivasyonu aşağı akış deneylerini etkileyebileceğinden, CD62L ifadesi değerlendirilmelidir; nötrofiller CD62L olur- etkinleştirildikten sonra (adım 4.1). Peptit fMLP, CD62L dökülmesi için pozitif bir kontrol olarak kullanılabilir (Şekil 4). Test yapmadan önce nötrofillerin sağlığını değerlendirmek de önemlidir; nötrofillerin yarı ömrü nispeten kısadır ve aktivasyon bunu daha da kısaltabilir (adım 4.2). Standart bir Annexin V ve PI boyama, nötrofil kültürünün canlı/ölü durumu hakkında belirlenen zamanlarda bilgi verebilir (Şekil 5).

Şekil 1: Granülositlerin yoğunluk gradyan orta bazlı ayrımı. (A) Santrifüjlemeden önce ve (B) sonra. Kan ve yoğunluk gradyan orta katmanları arasındaki keskin arayüze dikkat edin. (C) B resuspended pelet tortulasyon (1:1) içinde 5% FBS / HBSS ve 3% Dextran-0.9% NaCl. (D) H 2 O. Kısaltmaları ile (C) üstnatantındaki artıkRBC'lerinlizizden sonra PMN pelet: PBMC = periferik kan mononükleer hücre; PMN = nötrofil; RBC = kırmızı kan hücresi; FBS = fetal sığır serumu; HBSS = Hank'in Dengeli Tuz Çözeltisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
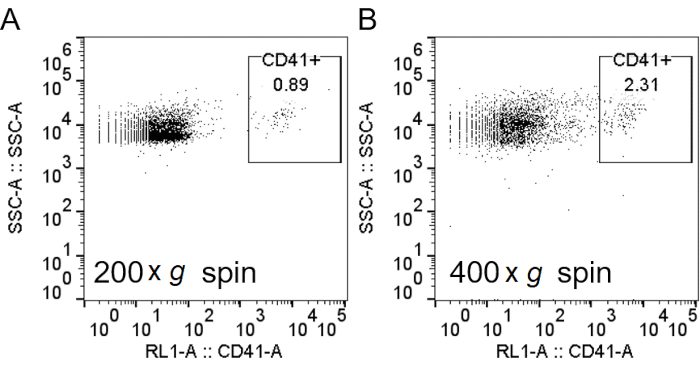
Şekil 2: RBC lizisi trombosit kontaminasyonünü azalttıktan sonra daha düşük hızlarda dönme. H2O'ya sahip RBC'lerin lizizden sonra, hücreler 200 × g (A) veya 400 × g (B)olarak aşağı döndürüldü. Nötrofiller boyandı ve şekil 3'teaçıklandığı gibi, trombositleri etiketlemek için anti-CD41 ilavesiyle akış sitometri analizi yapıldı. Kısaltmalar: RBC = kırmızı kan hücresi; CD41 = farklılaşma kümesi 41; SSC-A = yan dağılım Alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Buffy coat'dan izole edilmiş nötrofillerin değerlendirilmesi. İzole nötrofiller standart bir protokole göre anti-CD66b, anti-CD11b, anti-CD14 ve anti-CD193 ile boyanmıştır. Tek hücreli (B) toplam hücrelerden (A) kapılıydı. (C) CD11b+ hücreler tek hücreden kapılıydı. (D) Nötrofilleri (CD66b+, CD14 düşük / - ) ve çok düşük bir monosit kontaminasyonını (CD66b-, CD14+, Q1) gösteren nokta grafiği. (E) CD66b- ve CD66b+ hücreler kapılıydı. (F) CD66b- hücreler lenfosit belirteçleri için pozitifti (CD3, CD19). (G) CD66b+ hücrelerde CD11b ve CD193'ün ifade, farklı nötrofil (CD66b+, CD11b+, CD193-) ve eozinofil (CD66b+, CD11b-, CD193+) popülasyonlarını gösterir. Burada gösterilen temsili sonuçta nötrofil saflığı ~%3.7 lenfosit ve ~%3.7 eozinofil kontaminasyon ile ~%93'tür. (H) Saflaştırmadan sonra nötrofil saflığının nicelemesi. Veriler 5 bireysel denemeden derlenir ve SD. Kısaltmaları± ortalama olarak sunulur: CD = farklılaşma kümesi; SSC-A = SSC-A = yan dağılım alanı; FSC-A = ileri dağılım alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Degrade saflaştırma CD62L dökülmesine neden olmadı. (A-B) Kontrol (A) veya fMLP uyarılmış nötrofiller (B) (37 ° C'de 15 dakika boyunca 1 mM fMLP) nötrofil belirteçleri ve CD62L ile boyandı. (C) FMLP ile tedavi edilen hücrelerde CD62L dökülme ve nötrofil aktivasyonunu gösteren floresan ortalama cd62L yoğunluğu azalır. Kısaltmalar: CD26L = L-selectin; fMLP = N-Formylmethionyl-lökil-fenilalanin; SSC-A = SSC-A = yan dağılım alanı; FSC-A = ileri dağılım alanı; PE = fitoerythrin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Yoğunluk gradyan veya nötrofil izolasyon kiti ile saflaştırılmış nötrofillerin spontan ölümü. Nötrofiller yoğunluk gradyanı (A ve B) veya ticari mikrobeadlar (C ve D) ile saflaştırılmış ve RPMI-% 10 FCS'de 0 saat (A ve C) veya 24 saat (B ve D) kültürlenmiştir. Hücreler standart bir protokolden sonra ilgili zaman noktalarında Annexin V ve PI kullanılarak lekelendi. (E) Saflaştırılmış nötrofil spontan ölümün nicelleştirilmesi. n=5, ortalama ± SD. Kısaltmaları: SSC-A = SSC-A = yan dağılım Alanı; FSC-A = ileri dağılım alanı; PI = propidium iyodür; FCS = fetal baldır serumu; FITC = floresan izotiyosiyanat; AV5 = Annexin V. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Kısa yaşam süresi, terminal farklılaşma durumu ve nötrofillerin litik içeriği nedeniyle, bu hücreleri incelemek her zaman bir zorluk olmuştur. Fare modellerini veya hasta kohortlarından hücreleri kullanmanın yanı sıra, hücre çizgileri nötrofil biyolojisini incelemeye yardımcı olmak için yararlı araçlardır16. Bununla birlikte, nötrofil benzeri hücre çizgileri nötrofil biyolojisinin tüm yönlerini tamamen tekrarlayamaz ve bu hücrelerin incelenmesinde ekstra bir zorluk katmanı ekler. En sık kullanılan in vitro model, dimetilsüllfoksit veya retinoik asit 17,18 ile tedavi edilerek nötrofil benzeri hücrelere ayırt edilebilenHL-60hücre hattıdır. Bu hücreler göç ve solunum patlaması çalışmalarında yararlı olsa da, nötrofillerin mikrobiyosidal aktivitesini incelemek için uygun değildir. Diğer hücre hatları vardır (PLB-98, NB4) ve ayrıca19sınırlamaları kümesiyle de ilişkilidir.
Fare hastalığı modelleri ve hücre hatları ile yapılan birincil insan nötrofil gözlemleri ile doğrulamak çok önemlidir. Nötrofiller verimli bir şekilde kriyopreziserv edilemez ve bu nedenle genellikle donörlerden elde edilen ve hemen işlenen tam kan veya buffy katlardan taze olarak izole edilir. İzole edildikten sonra, hücreler nötrofil granüllerinde bulunan oksidasyon, sitoplazmik kaspazlar ve proteazlar tarafından düzenlenen karmaşık bir spontan ölüm formuna maruzlenmeye başlar20,21. Yanlış izolasyon yöntemleri veya teknikleri nötrofillerin aktivasyonuna yol açabilir, sadece hücre yıkımını hızlandırabilir. Donörlerden saf ve yüksek kaliteli nötrofil elde etmek için güvenilir ve tutarlı bir yönteme sahip olmak zorunludur.
İnsan nötrofil izolasyonu10,22. Esas olarak bazı paylaşılan stratejilerle iki kategoriye ayrılırlar. İlk kategori antikor bazlıdır, pozitif veya negatif seçim yoluyladır. Pozitif seçim nötrofilleri doğrudan etiketler, bu nedenle son derece saf bir hücre popülasyonu sağlar, ancak aynı zamanda hızlı hücre aktivasyonuna, hücre ölümüne ve nötrofillerin istenmeyen etiketlenmesine yol açar23. Negatif seçim, hücreleri etiketsiz bırakıp çok saf bir popülasyon vermesine rağmen, kesin mekanizma bilinmemekle birlikte nötrofil ölümünü hızlandırmıştır(Şekil 5). Olumlu veya olumsuz seçimden sonra gen veya protein ekspresyonlarının da değiştirilip değiştirilmediğinin daha fazla araştırılması gerekir. Ayrıca, diğer hücre türlerini tükenmek için gereken antikor miktarı nedeniyle, bu yöntemler büyük miktarlarda nötrofil çıkaramaz. Bununla birlikte, antikor bazlı tahliller hala kısa süreli kültür ve daha küçük ölçekte deneyler için kullanılabilir ve gen ve protein ekspresyon çalışmaları gibi çok yüksek hücre saflığı gerektiren deneyler için tercih edilen yöntemlerdir.
İkinci yalıtım yöntemi gradyan ve yoğunluk tabanlıdır. Genellikle Percoll, Ficoll-Paque veya diğer polisakkarit/polivinylpyrrolidone bileşenlerini içerir ve farklı kan hücrelerini hücre yoğunluğuna göre ayırmak için santrifüjleme kuvveti kullanır. Bu yöntemler genellikle kırmızı kan hücrelerinin dekstran ile tortulaşması ile tamamlanır. Bu yöntemler daha büyük başlangıç malzemesi ölçeklerini işleyebilir ve yüksek saflık da elde edebilir. Yoğunluğa dayalı izolasyonun bir uyarısı, diğer çok daha az bol granülositlerin (çoğunlukla eozinofiller) nötrofillerden verimsiz ayrılmasıdır ve bu nedenle, küçük hücre kontaminasyonunun varlığı bile nötrofil yanıtını etkileyebileceğinden, sunulan protokolün büyüksınırlamasıdır 24.
Burada sunulan, önceki yöntemleri rafine ederek degrade yalıtımı esas alınarak özetlenmiş biryöntemdir 10,22. Nötrofil spesifikliklerinin mevcut hafife alınmamasını kullanarak, sınırlı kalıntı trombosit ve RBC'lere sahip saf insan nötrofillerini güvenilir bir şekilde izole ederek nötrofil aktivasyonunu ve hızlandırılmış ölümü önlüyoruz. En önemli adım, keskin bir arayüz elde etmek için kanın altına yoğunluk gradyan ortamını ekleyerek çok daha etkili bir şekilde elde edilen gradyanın katmanlaşmasıdır. Santrifüjlemeden sonra PBMC halkasının ve gradyanın hızlı bir şekilde incelenmesi olası kirlenme, aktivasyon ve düşük verimleri ortaya çıkarabilir. Lökerez membran veya buffy coat ile çalışırken, aşırı hücre yoğunluğu hücre toplanmasına yol açacağından, safsızlıklara ve hücre aktivasyonuna yol açacağından kanın seyreltilmesi önemlidir.
Bu protokol hücre tazeliğini sağlamak için 2 saat içinde tamamlanmalıdır ve bu çözeltilere maruz kalma nötrofilleri değiştirebileceği için yoğunluk gradyan ortamı, dektran ve liziz içeren adımlar hemen yapılmalıdır. Bu protokol ile, nötrofillerin beklenen verimi en az ~ 10 milyon / 10 mL tam kan ve en az ~ 60 milyon / 10 mL buffy kattır. İzolasyon kalitesinin değerlendirilmesi şu şekilde yapılmalıdır: aktif nötrofiller% 10'dan az, lenfosit kontaminasyonu% 5'ten düşük, minimal eozinofil (aynı yan dağılım ama daha düşük ileri saçılma popülasyonu) ve hücre canlılığı% 90'ın üzerinde olmalıdır. Daha düşük saflık, yoğunluk gradyan ortamının yanlış katmanlaşmasından veya depolanmasının veya başlangıç kan ürününün kalitesi ve tazeliğinin neden olabileceği sonucuna varabilir.
Açıklamalar
Yazarlar, araştırmanın herhangi bir çıkar çatışması olmaması durumunda yapıldığını beyanlar.
Teşekkürler
Bu Proje P01HL095489 tarafından desteklendi. A.Y.H, T32HL066987 tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3% Acetic Acid with Methylene Blue | Stemcell technologies | #07060 | |
| Attune NxT | invitrogen | A24858 | FACS analyzer |
| Cd11b-PE | biolegend | 301305 | |
| CD14-BV421 | biolegend | 367144 | |
| CD193-BV605 | biolegend | 310716 | |
| CD19-PerCP | biolegend | 302228 | |
| CD3-PerCP | biolegend | 300326 | |
| CD41-APC | biolegend | 303710 | |
| Cd45-APC | biolegend | 103111 | |
| CD62L-PE | biolegend | 304802 | |
| CD66b-FITC | biolegend | 305103 | |
| Centrifuge 5810R | Eppendorf | 22625101 | Centrifuge |
| Dextran | Fisher | BP1580 | |
| Fetal Bovine Serum (FBS) | R&D systems | S11150H | complement inactivation of FBS is recommended |
| FITC Annexin V Apoptosis Detection Kit I | BD | 556547 | |
| Hanks balanced salt solution (-CaCl2), (-MgCl2) (-MgSO4) | Gibco | 14175-095 | HBSS without Ca2+/Mg2+ is advised as they have been shown to lead to neutrohpil activation |
| Lymphoprep | Stemcell technologies | #07801 | density gradient medium |
| MACSxpress Whole Blood Neutrophil Isolation Kit, human | Miltenyi | 130-104-434 | |
| RPMI-1640 | Gibco | 11875093 | |
| Sodium chloride | sigma | 71376 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | |
| ultrapure water | KD medical | RGF-3410 |
Referanslar
- Rosales, C. Neutrophil: A cell with many roles in inflammation or several cell types. Frontiers in Physiology. 9, 113 (2018).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Stoller, J. K. Murray & Nadel's textbook of respiratory medicine, 6th edition. Annals of the American Thoracic Society. 12 (8), 1257-1258 (2015).
- Dancey, J. T., Deubelbeiss, K. A., Harker, L. A., Finch, C. A. Neutrophil kinetics in man. Journal of Clinical Investigation. 58 (3), 705-715 (1976).
- Manz, M. G., Boettcher, S. Emergency granulopoiesis. Nature Reviews. Immunology. 14 (5), 302-314 (2014).
- Summers, C., et al. Neutrophil kinetics in health and disease. Trends in Immunology. 31 (8), 318-324 (2010).
- Pedruzzi, E., Fay, M., Elbim, C., Gaudry, M., Gougerot-Pocidalo, M. A. Differentiation of PLB-985 myeloid cells into mature neutrophils, shown by degranulation of terminally differentiated compartments in response to N-formyl peptide and priming of superoxide anion production by granulocyte-macrophage colony-stimulating factor. British Journal of Haematology. 117 (3), 719-726 (2002).
- Tucker, K. A., Lilly, M. B., Heck, L., Rado, T. A. Characterization of a new human-diploid myeloid-leukemia cell-line (Plb-985) with granulocytic and monocytic differentiating capacity. Blood. 70 (2), 372-378 (1987).
- Hsu, A. Y., et al. Inducible overexpression of zebrafish microRNA-722 suppresses chemotaxis of human neutrophil like cells. Molecular Immunology. 112, 206-214 (2019).
- Kremserova, S., Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 2087, 33-42 (2020).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunological Research. 2017, 1254792 (2017).
- Thorson, L. M., Turkalj, A., Hung, J. C. In vitro evaluation of neutrophil viability after exposure to a hypotonic medium. Nuclear Medicine Communications. 16 (7), 615-620 (1995).
- Dhurat, R., Sukesh, M. Principles and methods of preparation of platelet-rich plasma: a review and author's perspective. Journal of Cutaneous and Aesthetetic Surgery. 7 (4), 189-197 (2014).
- Etulain, J., et al. An optimised protocol for platelet-rich plasma preparation to improve its angiogenic and regenerative properties. Scientific Reports. 8 (1), 1513 (2018).
- Hannah, S., et al. Constitutive neutrophil apoptosis in culture is modulated by cell density independently of beta2 integrin-mediated adhesion. FEBS Letters. 421 (2), 141-146 (1998).
- Hsu, A. Y., et al. Phenotypical microRNA screen reveals a noncanonical role of CDK2 in regulating neutrophil migration. Proceedings of the National Acadermy of Sciences of the United States of America. 116 (37), 18561-18570 (2019).
- Martin, S. J., Bradley, J. G., Cotter, T. G. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clinical and Experimental Immunology. 79 (3), 448-453 (1990).
- Hauert, A. B., Martinelli, S., Marone, C., Niggli, V. Differentiated HL-60 cells are a valid model system for the analysis of human neutrophil migration and chemotaxis. International Journal of Biochemistry and Cell Biology. 34 (7), 838-854 (2002).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: Cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Kambara, H., et al. Gasdermin D exerts anti-inflammatory effects by promoting neutrophil death. Cell Reports. 22 (11), 2924-2936 (2018).
- Loison, F., et al. Proteinase 3-dependent caspase-3 cleavage modulates neutrophil death and inflammation. Journal of Clinical Investigation. 124 (10), 4445-4458 (2014).
- Siemsen, D. W., et al. Neutrophil isolation from nonhuman species. Methods in Molecular Biology. 1124, 19-37 (2014).
- Hasenberg, M., et al. Rapid immunomagnetic negative enrichment of neutrophil granulocytes from murine bone marrow for functional studies in vitro and in vivo. PLoS One. 6 (2), 17314 (2011).
- Calzetti, F., Tamassia, N., Arruda-Silva, F., Gasperini, S., Cassatella, M. A. The importance of being "pure" neutrophils. Journal of Allergy and Clinical Immunology. 139 (1), 352-355 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır