Method Article
Bimoleküler Floresan tamamlama
Bu Makalede
Özet
Proteinlerin hücre içi lokalizasyonu hücre sinyal uzay-zamansal düzenleme belirlenmesinde önemlidir. Burada, iki moleküllü floresan proteinlerin hücre mekansal etkileşimleri izlenmesi için basit bir yöntem olarak tamamlama (BiFC) açıklar.
Özet
Sinyalizasyon komplekslerinin hücre içi dağıtım tanımlama karmaşık çıkış anlamak için şarttır. , Immunoprecipitation konvansiyonel yöntemlerle komplekslerin uzamsal lokalizasyonu hakkında bilgi vermemektedir. BiFC aksine, etkileşim ve protein kompleksleri sar compartmentalization izler. Bu yöntemde, bir fluororescent protein, amino ve karboksi-terminal sonra iki protein ilgi erimiş olmayan floresan parçalarının içine ikiye bölünmüş durumda. Fluorofor sulandırma (Şekil 1) 1,2 proteinlerin etkileşimi. BiFC bir sınırlaması parçalanmış fluorofor sulandırılmış bir kez karmaşık 3 geri dönüşümsüz olmasıdır. Bu sınırlama, geçici ya da zayıf etkileşimleri tespit avantajlı, ama karmaşık dinamiklerin bir kinetik analizi engellemektedir. Ek bir uyarı sulandırılmış flourophore yine gerçek zamanlı etkileşimler 4 gözlem engelleyen, olgun ve floresan için 30 dakika gerektirir. Protein etkileşimleri 5,6: BiFC,, yeşil floresan protein çeşitleri olarak muhabir proteinleri (BiFC), dihidrofolat redüktaz, b-laktamaz ve protein ölçmek için lusiferaz istihdam protein parçası tamamlama yöntemi (PCA) belirli bir örnek . Protein çalışmak için alternatif yöntemler: hücrelerinde protein etkileşimleri floresan co-yerelleştirme ve Förster rezonans enerji transferi (FRET) 7 içerir. Eş-lokalizasyonu için, iki protein ayrı ayrı, doğrudan fluorofor veya dolaylı immünofloresan ya etiketlenir. Ancak, bu yaklaşım, co-lokalizasyon verileri yorumlamak zor olmayan etkileşim proteinlerin yüksek arka yol açar. Buna ek olarak, konfokal mikroskobi çözünürlük sınırları nedeniyle, iki proteinin mutlaka etkileşim olmadan co-lokalize görünebilir. BiFC ile ilgi iki proteinin etkileşime girdiğinde, floresan sadece görülmektedir. FRET protein çalışmak için başka bir mükemmel bir yöntemdir: protein etkileşimleri, ama teknik olarak zor olabilir. FRET deneyler, donör ve alıcı hücrede benzer bir parlaklık ve stokiyometri olması gerekir. Buna ek olarak, bir donör yoluyla alıcısı kanal ve tersi içine kanama için hesaba katmalısınız. FRET aksine, BiFC, küçük bir arka plan görüntü verilerini floresan, küçük işleme sonrası yüksek aşırı ekspresyonu gerektirmez ve zayıf veya geçici etkileşimler algılayabilir. Biyoparlaklık rezonans enerji transferi (Bret), donör, böylece heyecan verici bir alıcı bioluminescent olmak için bir substrat katalize bir enzim (örneğin lusiferaz) dışında FRET benzer bir yöntem. Bret teknik sorunlar, kanama ve yüksek arka plan floresan yoksun ama özel bölmeleri 8 substrat lokalizasyonu eksikliği nedeniyle mekansal bilgi sağlama yeteneğine yoksundur . Genel olarak, BiFC bölümlere sinyalizasyon içgörü kazanmak için protein kompleksleri hücre içi lokalizasyonu görselleştirmek için mükemmel bir yöntemdir.
Protokol
A. BiFC Kalibrasyon
- Fluorofor seçin. BiFC füzyon ortakları (Tablo 1) yanı sıra, YFP ve Venüs gibi, birden fazla fluorophores vardır. Venüs Amino-ve karboksi-terminal uçları YFP BiFC parçaları fluorofor oluşumu 2 kolaylaştırmak için 30 ° C'de bir ön inkübasyon gerektiren, karmaşık bir form için 37 ° C'de mümkün. Bu düşük bir ısıda inkübasyon bazı hücresel süreçleri değiştirmek ve parçaları seçerken dikkate alınmalıdır. Eritme proteinlerin karboksi-terminus Venüs vektörler Addgene ( http://www.addgene.org/pgvec1 kontrolleri olarak kullanmak için ek yapıları, örneğin birlikte; seepBiFC-VN173 ve pBiFC-VC155) pBiFC-bJunVN173 ve pBiFC-bFosVC155 2. Amino-terminal Venüs vektörler (pFLAG VN173 ve PHA-VC155) dahil olmak üzere daha fazla vektörler, aşağıdaki web sitesini de mevcuttur: http://people.pnhs.purdue.edu/ ~ hu1 / .
- Ilgi protein Etiketi BiFC parçaları aday proteinler, amino ve karboksi-terminal uçlarında kaynaşmıştır . Bazı proteinler, protein fonksiyonunun bozulması nedeniyle her iki ucunda, etiketleme için izin vermeyebilir. Örneğin, Ras GTPases süperailesinin birçok üyeleri o sonunda BiFC parçalarının karboksi-terminus böylece engelleyen eklenti değiştirilmiş lipit. Böylece, BiFC parçalarının eki ilgi proteinlerin fonksiyonu nasıl etkileyebileceği bazı fikir sahibi olmak önemlidir. Bir protein nasıl etiketleme etkileyecek belirsiz ise işlevi birden fazla kombinasyon test edilmelidir. BiFC parçası ek olarak, bir peptid ilintileyici parçalanmış fluorofor ve aday proteinleri arasındaki esnekliği artırmak dahil edilebilir. BiFC vektörler çoklu klonlama siteleri (MCS) yeterli esneklik, RSIAT, KQKVMNH ve RPACKIPNDLKQKVMNH linkers sağlayabilir kısa amino asit uzanır kodlamak BiFC deneyler 3,9 iken başarıyla kullanılmaktadır
- Transfeksiyon koşulları belirleyin. Birden fazla mutantlar test önce, birkaç kontrol deneyleri yapılmalıdır. Denenmelidir ilk iki BiFC kombinasyonları, iki yabani türü proteinler etkileşime girdiği bilinmektedir ve bir yabani tip ve mutant bir etkileşim yok. Bu iki kombinasyonları kullanarak, farklı miktarlarda DNA ve transfeksiyon kez aday proteinler için bir BiFC sinyal tespit için en uygun koşulların belirlenmesi için test edilmelidir. Biz 6 kuyu çanağı tek bir için her BiFC inşa 0.25ug, 0.5ug 1.0ug test öneririz. Sinyal gelişimi için en uygun zamanı belirlemek için floresan mikroskopi transfeksiyon monitör hücreleri bir gün sonra. PBiFC bJunVN173 ve pBiFC-bFosVC155 2 yapıları BiFC için yararlı pozitif kontrol ve Addgene (yukarıya bakınız) mevcuttur. Buna ek olarak, Western blot analizi yapıları eşit ifade onaylamak için yapılmalıdır. Koşullar floresan sinyal iki yabani türü proteinler ama hiç sinyal arasında gözlenen bu tür yabani tip ve mutant proteinler arasında görülmektedir tercih edilmelidir. Sonuç olarak, protein ekspresyonu herhangi bir non-spesifik etkileşimleri önlemek için mümkün olduğunca düşük tutmak için en iyisidir.
- BiFC parçalarının yanı sıra, ilgi proteinlerin yerelleştirme değiştirir olmadığını belirlemek Her BiFC inşa HA veya BAYRAK epitop etiketi içerir . Immunostain HA veya BAYRAK epitop etiketi yanı sıra BiFC etiketi ilgi proteinlerin lokalizasyonu etkiler olmadığını belirlemek için de endojen protein (mümkünse) hücreler transefected.
B. Hücre Kaplama ve Transfeksiyon
- COS hücreleri (1.3x10 5), her bir cam alt Matek örnek başına 6-plaka levha ve iki kuyu üzerine kaplanmıştır . Hücreler 37 ° C geceleme yerleşmek için izin verin Faiz aday proteinleri daha uygun olan alternatif hücre tipleri de kullanılıyor olabilir.
- DNA'lar transfeksiyon için hazırlayın. Biz genellikle COS transfections Lipofectamine (Invitrogen) kullanmaktadır. Ancak, diğer reaktifler ilgi hücre hattı için daha uygun olabilir. Transfeksiyon karışımı bir cam alt çanağı ve 6-plaka iki kuyu arasında bölünmüş olacağından, bu bölünme için hesap DNA uygun miktarda kullanın. Serum serbest (SF) DMEM 250uL DNA seyreltilir. 1 / 5 'transfeksiyon kontrol olarak toplam BiFC DNA'lar miktarı CFP ekleyin. BiFC ölçümü için, sadece hücreleri CFP için olumlu bir BiFC sinyal varlığı için analiz edilecektir. Bu nedenle alternatif bir transfeksiyon kontrolü; CFP spektrumları Tablo 1'de bazı BiFC çiftleri ile üst üste olacağını edinbelki de gerekli. 250uL SF DMEM (DNA 10uL Lipofectamine/1ug) Lipofectamine sulandırınız. DNA ve Lipofectamine dilüsyonları karıştırın. 20dk oda sıcaklığında inkübe edin.
Not: Lipofectamine: DNA oranı hücre tipine bağlı olarak değişebilir. Ilgi hücre hattı için uygun Transfeksiyonu yöntemi kullanın. - 2x hücrelerin sıcak SF DMEM ile durulayın. 6-iyi bir yemeğin her cam taban plakası veya SF DMEM 2mL ekleyin.
- Transfeksiyon karışımı bir cam alt çanağı ve 6-iyi bir yemeğin iki kuyu arasında eşit olarak her bir bölme.
- 5 saate hücreleri 37 ° C'de inkübe edin.
- Transfeksiyon ortamı çıkarın ve eksiksiz bir medya (% DMEM 10 FBS) ile değiştirin.
- Gecede inkübe hücreleri 37 ° C Inkübasyon aşağıdaki transfeksiyon uzunluğu ilgi proteinlerin ekspresyon düzeyleri bağlı olarak değişecektir. Bu adımı ampirik olarak tespit edilmesi gerekmektedir, böylece uzun süreli inkübasyon spesifik olmayan etkileşim meydana gelebilir.
Görüntüleme için C. Hücre Hazırlık
- Hücreler, başlangıçta pozitif kontrol floresan olduğundan emin olmak için bir epifluorescent mikroskop altında incelenir. Eğer doğru değilse, 37 ° C ye kadar sinyal görülmektedir hücreleri ek süre izin için gerekli olabilir.
- 3x hücreler PBS (pH 7.4) ile durulayın. Cam tabak içinde alt hücreleri için% 2 paraformaldehid (pH 7.4) ekleyin. 10 dakika süreyle buz üzerinde hücrelerin düzeltildi. 3x hücreler PBS (pH 7.4) ile durulayın. 4 Mağaza hücreleri ° C 1 ml PBS (pH 7.4) ile kaplanmıştır. Hücreler görüntüleme için sabit olmak zorunda değilsiniz, ancak bir kez BiFC parçaları sağlam bir fluorofor dinamik etkileşimleri 3 geri dönüşümsüz böylece önlenmesi analiz reform. Ayrıca, Sabitlenmemiş hücreleri sinyal geliştirmeye devam edeceğini unutmayın. 6-iyi çanak hücrelerin Lyse ve Western Blot analizi için lizatları hazırlamak. Parçalanmış hücreleri görüntülü hücrelerin temsilcisi böylece tüm hücreleri aynı zamanda hazır olduklarını önemlidir.
D. Görüntüleme Hücreler
- Floresan yoğunluğu, hücre başına hesaplanacaktır. Görüntü bireysel hücrelere emin olun.
- CFP bir tranfection kontrol olarak dahil oldu ve sadece CFP pozitif hücrelerin BiFC sinyalleri analiz için seçilir. Biz hücre CFP ile transfekte ise, aynı zamanda BiFC yapıları ile transfekte olduğunu varsayıyor. Bu yaklaşım BiFC bir sinyal eksikliği görüntülü hücreler ilgi proteinleri ve birinin yokluğu nedeniyle ya da o hücrenin hem de BiFC ifade yapıları arasında bir etkileşim eksikliği nedeniyle olumsuz olduğunu garanti eder.
- Biz Zeiss LSM 510 konfokal mikroskop hücre görüntüleme için kullanın. Bu mikroskop kullanarak zum, iğne deliği, dedektör kazanç, amplifikatör ofset, çerçeve boyutu, tarama hızı, tarama ortalama ve lazer güç tutarlı tutmak için önemlidir. Herhangi bir görüntüleme sistemi kullanılarak floresan örnekleri arasında karşılaştırılabilir şekilde ayarlar sabit tutmak için önemlidir. Ayrıca, floresan niceleme zaman piksel doymuş olması önemlidir.
E. Floresan miktarının
- Floresan herhangi bir görüntüleme yazılımı kullanarak sayısal olabilir. Biz NIH (http://rsb.info.nih.gov/ij/) serbestçe kullanılabilir. ImageJ kullanmaktadır. ImageJ görüntü dosyaları açın. AnalyzeSet Ölçümler git. Alan için onay kutularını ve Ölçümler kutusunda ortalama Gri Değer.
- 'Serbest el seçimi' aracını kullanarak, tüm hücre CFP kanal kenarında bir taslak çizin.
- Bu anahat yerinde bırakarak, YFP kanala geçiş. AnalyzeMeasure için gidin.
Ortalama Gri Değeri piksel sayısını (yani hücrenin alan başına ortalama floresan yoğunluğu) bölünmesiyle seçiminde tüm piksellerin gri değerlerin toplamıdır. - Her resim için bir hücre içermeyen bir alanda YFP kanal bir daire çizin. Arka plan olarak bu alan için bir ölçüm alın. Her görüntünün arka planı çıkarma.
- Bir örnek görüntülü tüm hücreler için ortalama Gri Değer eksi arka plan ortalama. Bu hücrelerden oluşan bir nüfus için ortalama floresan yoğunluğu olacak. Biz üç deney içinde yaklaşık 60 hücreleri sayısal olarak öneriyorum.
F. Temsilcisi Sonuçlar:
Bizim laboratuvar çok etki alanı iskele protein, birden fazla biyokimyasal ve sinyal yolları 10,11,12,13,14 düzenlemek için sayısız proteini ile etkileşime intersectin (ITSN) odaklanır. ITSN iki Eps15 homoloji (EH) etki, bir sarmal sarmal bölge ve beş Src homoloji 3 (SH3) etki içerir. ITSN, uzun izoformu Dbl homoloji (DH) ve Cdc42 15 guanin nükleotid değişim faktörü olarak konser pleckstrin homoloji (PH) alan bu hareket içerir. Bu modüler yapısı protein destekler:, protein etkileşimleri ve BiFC deneyler için ideal bir aday ITSN yapar. ITSN, hücre içi lokalizasyonu bağlayıcı ortakları değiştirmek ve bu nedenle ITSN (unpublis tarafından düzenlenen yollar değiştirebilirhed veri). Son zamanlarda, bizim laboratuvar ITSN bir roman sınıf II PI3K, PI3K-C2β 11 düzenlenmesi yoluyla nöronal hayatta kalma düzenleyen göstermiştir . PI3K-C2β amino-terminal Pro-zengin bir etki ITSN SH3 etki alanı için iki bağlanma yerleri içerir. ITSN ve PI3K-C2β kesilmesi mutantlar ile birlikte immunoprecipitation kullanarak ITSN SH3A ve SH3C etki alanı PI3K-C2β amino-terminal bölge ile etkileşim içinde olduğunu gösterdi. Sonra, bu karmaşık hücre içi lokalizasyonu görselleştirmek için BiFC kullandı. ITSN Venüs (PHA-VC155) karboksi-terminus erimiş Venüs (pFLAG VN173) ve PI3K C2β yapıları amino terminus erimiş oldu. Başka bir negatif kontrol olarak, non-spesifik peptid PHA-VC155 erimiş oldu. VN-ITSN ve VC-PI3K-C2β bir noktasal dağılımı (Şekil 2A, üst panelleri) ile bir BiFC kompleksi kurdu. PI3K-co-yağış ITSN ve PI3K-C2β bozabilir C2β Pro zengin etki Mutasyonlar BiFC sinyal (Şekil 2A, alt paneller) 11 azalmıştır. ITSN ve iki PI3K C2β proteinler arasında BiFC sinyal Bu fark, protein ekspresyonu (Şekil 2B) farklılıklar nedeniyle değildi.
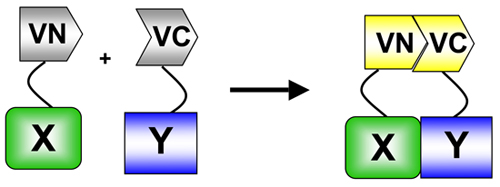
Şekil 1 BiFC, fluorofor (Bu durumda Venüs) amino (VN) ikiye bölünmüş durumda ve karboksi-terminal (VC) sona erer. Bu ilgi iki proteinlerine biter kaynaşmıştır. Iki protein etkileşim, VN ve VC parçaları yeniden ilişkilendirmek etkileşim siteleri fluorofor ve floresan sulandırıldıktan. Protein etkileşimleri 5: BiFC protein ölçmek için kullanılan protein parçası tamamlama yöntemi (PCA) belirli bir örnek.

Şekil 2 ITSN ve PI3K C2β formu BiFC kompleksi. A. VN etiketli ITSN VC-etiketli PI3K C3β WT veya prolin zengin bir etki ile birlikte-tranfected mutant (PI3K-C2β-PA). ITSN ve WT PI3K C2β formu bir kompleks (yeşil). CFP Western Blot yapıları eşit ifade göstermek için yapıldı transfeksiyon kontrolü B. (kırmızı) olarak kullanılmıştır. VC-etiketli yapıları HA etiketlenir.

Tablo 1 BiFC uyumlu birden çok vektörleri vardır. YN155: YFP 1-155aa; YC155: YFP 155-238aa; YN173: YFP 1-172aa; YFP YC173, 173-238aa; VN155: 1-Venüs 154aa; VC155: 155-238 Venüs; VN173: Venüs 1-172aa; VC173: 173-238aa Venüs; CN155 CFP 1-154aa; CC155 CFP 155-238aa, GN173: GFP 1-172aa CitN155: Sitrin 1-155aa CitC155: 155-238aa Sitrin CitN173: Sitrin 1-172aa, CitC173: Sitrin 173-238aa CerN173: 1-172aa Cerulean 2,3,9.
Tartışmalar
Bütün hücrelerde protein etkileşimleri ve bu kompleksleri hücre içi lokalizasyonu belirlenmesi: BiFC protein görselleştirmek için mükemmel bir yöntemdir. BiFC, avantajları sadece etkileşen proteinler floresan olduğunu, geçici etkileşimler stabilize ve görüntüleme verileri post-processing az. Bu yöntemin dezavantajları fluorofor ve fluorofor kompleks tersinmezlik için olgunlaşma zamanı. Bazı uygulamalar altında bu tersinmezlik bir avantaj olarak kullanılabilir. Örneğin, bir kurucu aktivasyon BiFC karmaşık bir enzimdir ve bu enzimin aktivatör kullanabilirsiniz. Bir proteinleri bu karmaşık ne işe alınırlar belirleyebilir. Ayrıca, BiFC kompleks tersinmezlik zayıf veya geçici etkileşimlerinin belirlenmesi için izin verir. Uygun kontroller BiFC deneyler yorumlanması için önemlidir. Boş BiFC vektörler yüksek eşiğe bu reaktifler sonucunda kontrol olarak kullanılan olmamalıdır. Uygun kontroller iki proteinin etkileşimi engellemek için bilinen ilgi proteinlerin tek bir mutasyon kullanmayı içerir. Alakasız bir protein ilgi protein ile kompleks de kullanılıyor olabilir olmamalıdır. Western blot analizi, farklı yapıları olduğunu ifade sağlamak için gerçekleştirildiğini de önemlidir eşit ve floresan sinyal farkları protein ekspresyonu çeşitli düzeylerde bağlı değildir. Yüksek ifadesi de non-spesifik etkileşimler ve floresan yol açabilir; dolayısıyla ekspresyon düzeyleri görece düşük tutulmalıdır.
BiFC kolayca diğer floresan teknikleri ile kombine pratik bir yöntem. Örneğin, bu yaklaşımın hala konfokal mikroskop çözünürlük sınırları tabi olmasına rağmen BiFC trimolecular kompleksleri incelemek için standart immunofluorescent co-localisation ile kombine edilebilir. Son çalışmalar, transkripsiyon faktörleri 16 trimolecular komplekslerinin incelenmesi için izin FRET ile BiFC bir araya getirmiştir . Bu uygulama için, donör CFP etiketli protein olarak kullanılır ve BiFC karmaşık bir alıcısı (yani YFP, Venüs) olarak kullanılır. Bu yaklaşım, bir protein kompleksidir temporal izleme ve üçüncü bir faiz etkileşen protein sağlar. Protein etkileşimleri: Bu tekniklerin kombinasyonları protein belirlemek için BiFC teknolojisi uygulama büyük çok yönlülük için izin verir. Hücrenin protein kompleksleri lokalizasyonu tanımlama fizyolojik süreçleri çözülmesi esastır. Böylece, BiFC, bu anlayışı yardımcı mükemmel bir araç temsil eder.
Açıklamalar
Teşekkürler
ITSN PI3K C2β, ve bu protokolde kullanılan kontrol vektörlerinin sadece ticari olmayan amaçlar için, talep üzerine yazarlar mevcuttur. Yazarlar, lütfen tavsiye ve O'Bryan laboratuar BiFC protokolü oluşturulmasında kullanılan reaktifler sağlamak için Dr. Chang-Deng Hu kabul etmek istiyoruz. KAW Vakfı Jerome Lejeune fon tarafından desteklenmiştir. O'Bryan laboratuvar İş Ulusal Sağlık Enstitüsü, (HL090651), DOD (PR080428), St. Baldrick Vakfı ve Vakıf Jerome Lejeune hibe tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM | Cellgro | 10-013 | |
| Fetal bovine serum | Cellgro | 35-011-CV | |
| Glass Bottom Microwell dishes | Matek | P35G-1.5-14C | |
| 6-well dishes | Falcon BD | 35-3846 | |
| Lipofectamine | Invitrogen | 18324020 | |
| PBS | Cellgro | 21-031-CV | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Confocal Microscope | Carl Zeiss, Inc. | LSM510 META |
Referanslar
- Kerppola, T. K. Visualization of molecular interactions by fluorescence complementation. Nat Rev Mol Cell Biol. 7, 449-456 (2006).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40, 61-66 (2006).
- Hu, C. D., Chinenov, Y., Kerppola, T. K. Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation. Mol Cell. 9, 789-798 (2002).
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Michnick, S. W., Remy, I., Campbell-Valois, F. X., Vallee-Belisle, A., Pelletier, J. N. Detection of protein-protein interactions by protein fragment complementation strategies. Methods Enzymol. S328, 208-230 (2000).
- Michnick, S. W., MacDonald, M. L., Westwick, J. K. Chemical genetic strategies to delineate MAP kinase signaling pathways using protein-fragment complementation assays (PCA). Methods. 40, 287-293 (2006).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends Biochem Sci. 32, 407-414 (2007).
- Ciruela, F. Fluorescence-based methods in the study of protein-protein interactions in living cells. Curr Opin Biotechnol. 19, 338-343 (2008).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21, 539-545 (2003).
- Martin, N. P. Intersectin regulates epidermal growth factor receptor endocytosis, ubiquitylation, and signaling. Mol Pharmacol. 70, 1643-1653 (2006).
- Das, M. Regulation of neuron survival through an intersectin-phosphoinositide 3'-kinase C2beta-AKT pathway. Mol Cell Biol. 27, 7906-7917 (2007).
- Mohney, R. P. Intersectin activates Ras but stimulates transcription through an independent pathway involving. JNK. J Biol Chem. 278, 47038-47045 (2003).
- Tong, X. K., Hussain, N. K., Adams, A. G., O'Bryan, J. P., McPherson, P. S. Intersectin can regulate the Ras/MAP kinase pathway independent of its role in endocytosis. J Biol Chem. 275, 29894-29899 (2000).
- Adams, A., Thorn, J. M., Yamabhai, M., Kay, B. K., O'Bryan, J. P. Intersectin an adaptor protein involved in clathrin-mediated endocytosis, activates mitogenic signaling pathways. J Biol Chem. 275, 27414-27420 (2000).
- O'Bryan, J. P., Mohney, R. P., Oldham, C. E. Mitogenesis and endocytosis: What's at the INTERSECTIoN? Oncogene. 20, 6300-6308 (2001).
- Shyu, Y. J., Suarez, C. D., Hu, C. D. Visualization of AP-1 NF-kappaB ternary complexes in living cells by using a BiFC-based FRET. Proc Natl Acad Sci U S A. 105, 151-156 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır