Method Article
Оптимизированный подход к протеомике на основе масс-спектрометрии с использованием выбранных участков ткани
В этой статье
Резюме
Здесь мы создали протеомный метод, основанный на масс-спектрометрии, с использованием изолированных областей интереса в фиксированных формалином и залитых парафином срезах ткани. Этот протокол используется для анализа протеома из определенных областей тканей в архивных фиксированных формалином и залитых парафином срезах ткани.
Аннотация
Протеомика на основе масс-спектрометрии (МС) позволяет проводить комплексный протеомный анализ широкого спектра биологических образцов, включая клетки, ткани и жидкости организма. Фиксированные формалином, залитые парафином (FFPE) срезы тканей, обычно используемые для долгосрочного архивирования, стали ценным ресурсом для протеомных исследований. Помимо преимуществ хранения, исследователи могут изолировать области интереса (ROI) от нормальных областей тканей благодаря совместным усилиям с патологоанатомами. Несмотря на этот потенциал, оптимизированный подход к протеомным экспериментам, включающий выделение ROI, протеомную пробоподготовку и анализ МС, по-прежнему отсутствует. В этом протоколе представлен интегрированный рабочий процесс, сочетающий макродиспарирование ROI, подготовку образцов на основе захвата суспензии и высокопроизводительный анализ МС. С помощью этого подхода были макродиспарированы, собраны и проанализированы ROI тканей FFPE пациентов, состоящих из доброкачественных серозных кистозных новообразований (СХН) и предраковых внутрипротоковых папиллярных муцинозных новообразований (ИПМН), диагностированных патологоанатомами, что привело к высокому покрытию протеома. Кроме того, были успешно идентифицированы молекулярные различия между двумя различными кистозными новообразованиями поджелудочной железы, что продемонстрировало применимость этого подхода для продвижения протеомных исследований с тканями FFPE.
Введение
На протяжении десятилетий хирургически удаленные человеческие ткани архивировались в виде фиксированных формалином и залитых парафином блоков (FFPE). Эти тканевые блоки изначально сохраняют трехмерную (3D) структуру, встроенную в парафин. Затем ткани разрезают с помощью микротомов, насаживают на предметные стекла и окрашивают — обычно гематоксилином и эозином (ПЭ) или иммуногистохимией (ИГХ) — для облегчения гистопатологической диагностики опытными патологоанатомами 1,2. Ткани FFPE обладают явными преимуществами для длительного хранения благодаря индуцированной формалином сшивке белков, которая останавливает ферментативную и протеолитическую активность3. Поскольку они поддерживают создание больших, хорошо архивированных наборов образцов, ткани FFPE считаются краеугольным камнем для открытия биомаркеров в различных областях, включая геномику 4,5,6,7.
Тем не менее, их применение в протеомике на основе жидкостной хроматографии и масс-спектрометрии (ЖХ-МС) исторически создавало проблемы. Ключевым ограничением является индуцированная формалином сшивка белков, которая препятствует триптическому перевариванию, что является критическим шагом вглобальном анализе протеома. Кроме того, небольшое количество белка, извлекаемого из предметных стекол, часто делает традиционные методы подготовки образцов непригодными. Несмотря на эти проблемы, достижения показали, что белковые сшивки могут быть обращены вспять с помощью длительной высокотемпературной обработки 9,10,11. В то же время, методы пробоподготовки, оптимизированные для образцов с низким содержанием белка, расширили использование тканей FFPE в исследованиях протеомики 12,13,14,15.
Одним из существенных преимуществ использования тканевых стекол FFPE в протеомике является их способность проводить анализ, специфичный для региона. Предметные стекла FFPE обычно содержат как поражения, так и прилегающие нормальные ткани (ANT). Анализ всей ткани без разбора рискует исказить результаты из-за смешанных молекулярных сигнатур. Напротив, выделение и анализ областей интереса (ROI) — поражения в сравнении с ANT — позволяет более точно охарактеризовать молекулярные особенности, специфичные для патологических областей. Следовательно, подходы, основанные на FFPE, становятся все более популярными в исследованиях протеомики 16,17,18,19,20. Несмотря на растущее их применение, оптимизированный рабочий процесс, который бы описывал весь протеомный эксперимент шаг за шагом, все еще остается дефицитным. В частности, не был опубликован протокол на основе видео.
В этом исследовании был разработан надежный протеомный рабочий процесс на основе ЖХ-МС, предназначенный для точного профилирования молекулярных изменений в областях, специфичных для поражения. С использованием тканей FFPE, диагностированных двумя патологоанатомами, были макродиспарированы, собраны и проанализированы ROI доброкачественных серозных кистозных новообразований (SCN) и предраковых внутрипротоковых папиллярных муцинозных новообразований (IPMN). Протокол включает в себя макроанализ ROI, подготовку образцов на основе захвата суспензии, оптимизированную для минимального ввода белка, и анализ с помощью узкого диапазона, независимого от сбора данных (DIA)-MS. Этот метод позволил идентифицировать более 9000 белков из областей тканей размером около 1 см², расшифровав отчетливые протеомные сигнатуры, связанные с SCN и IPMN.
протокол
Это исследование было рассмотрено и одобрено Институциональным наблюдательным советом больницы Сеульского национального университета (IRB No 1904-114-1028). Все участники предоставили письменное информированное согласие на участие в исследовании. Подробная информация обо всех материалах, использованных в данном протоколе, представлена в Таблице материалов.
1. Забор тканевого антигена FFPE для протеомной пробоподготовки
ПРИМЕЧАНИЕ: Убедитесь, что скальпели и все материалы, такие как используемая трубка, стерильны, чтобы избежать перекрестного загрязнения. Протоколы данного исследования могут быть адаптированы для любой ткани FFPE с незначительными изменениями в зависимости от лабораторных условий.
- Вырежьте срезы ткани FFPE размером 10 мкм из блоков ткани FFPE цельного крепления и поместите их на предметные стекла.
ПРИМЕЧАНИЕ: В этом исследовании ткань FFPE кисты поджелудочной железы человека (два разных типа кистозной ткани - SCN и IPMN) использовалась для подготовки образцов протеомики. - С осторожностью удалите парафин из ткани FFPE (депарафинизируйте) двумя промывками в ксилоле: одно в течение 5 минут, а другое в течение 2 минут.
- Регидратируйте ткань с помощью последовательного промывания смесью градуированного этанола: по 3 мин в 100%, 85%, 70% и 50% этаноле с последующим полосканием в деионизированной воде.
ПРИМЕЧАНИЕ: Убедитесь, что ксилол и этанол обрабатываются в вытяжном шкафу для химикатов.
2. Экстракция тканевого белка FFPE
- Подготовьте HE- или IHC-окрашенный предметный стекал тканей, на котором патологоанатомами указан ROI.
- Поместите предметное стекло без пятен и предметное стекло для окрашенной ткани тыльной стороной друг к другу, выровняв их вместе. Убедитесь, что окупаемость инвестиций наблюдается через предметное стекло.
- Удалите участки тканей, не представляющие интереса, с помощью скальпеля.
ПРИМЕЧАНИЕ: Если необходимо проанализировать соседние нормальные ткани, соберите их в другие пробирки. - Соскребите тканевые ROI до центра предметного стекла с помощью скальпеля и перенесите их в чистые пробирки объемом 1,5 мл с низким содержанием белка.
- Добавьте в каждую пробирку 180 мкл буфера для лизиса додецилсульфата натрия (SDS, 5 % SDS, 2 мМ трис (2-карбоксиэтил)фосфина) [TCEP], 300 мМ pH 8,5 Tris-HCl в деионизированной воде).
ПРИМЕЧАНИЕ: Убедитесь, что объем буфера для лизиса достаточен для растворения ткани во время ультразвуковой обработки и для суспензии экстрагированных белков. Недостаточный буфер может привести к неполному лизису тканей, в то время как избыток буфера может разбавить лизат белка. - Проводите ультразвуковую обработку зондом с амплитудой 20%, применяя 10 циклов по 5 с включено и 5 с выключено.
- Образцы инкубируют при 100 °C в течение 3,5 ч с концентрацией 1 000 x g.
ПРИМЕЧАНИЕ: Проводите ультразвуковую обработку образцов водой в течение 1 минуты каждый час во время инкубации для эффективной экстракции белка. - После инкубации образец охладить при комнатной температуре (RT) в течение 10 минут. Центрифугируйте образцы при 16 000 x g в течение 10 мин в режиме RT, чтобы отделить остатки тканей от надосадочной жидкости.
- Соберите надосадочную жидкость в чистую пробирку с маркировкой и храните при температуре -80 °C до дальнейшего использования.
3. Количественное определение белка лизата тканей FFPE
ПРИМЕЧАНИЕ: Большинство этапов анализа бицинхониновой кислоты для количественного определения белка основаны на инструкциях производителя с незначительными изменениями. Рекомендуется готовить реактивы в соответствии с рекомендациями производителя.
- Приготовьте стандарты бычьего сывороточного альбумина (БСА) различной концентрации путем последовательного разбавления исходного раствора (2 мг/мл БСА). При необходимости разбавляют пробы с коэффициентом разбавления 20 или 40.
- Приготовьте деионизированную воду в качестве заготовки и буфер для лизиса SDS в качестве контрольного образца.
- Пипетка 9 мкл эталонов, бланк, контроль образцов и образцы в центр микропланшета лунки.
- Добавьте 4 мкл раствора совместимого реагента в образец в каждую лунку.
- Накройте тарелку крышкой и перемешивайте в шейкере на средней скорости в течение 1 минуты. После этого выдержите тарелку при температуре 37 °C в течение 15 минут.
- Добавьте 260 μL рабочего реагента BCA в каждую лунку, а затем инкубируйте планшет при 37 °C в течение 30 минут.
- Охладите тарелку при RT в течение 3 минут.
- Измерьте поглощение лунок на длине волны 562 нм на планшетном считывателе.
- Вычтите значение поглощения заготовки 562 нм из значения всех образцов и контрольных образцов.
- Далее вычтите значение поглощения 562 нм для контроля холостого образца из значения всех образцов.
- Постройте и используйте стандартную кривую для определения концентрации белка в каждом образце.
ПРИМЕЧАНИЕ: Убедитесь, что примерно 200-250 мкг белков извлечены из трех стеклянных стекол тканей FFPE, каждое из которых имеет приблизительную площадь 1 см2 .
4. Ацетоновое осаждение белка
ПРИМЕЧАНИЕ: Убедитесь, что в общей сложности 100-300 мкг белка используется для осаждения ацетона и переваривания белка на основе улавливания суспензии.
- Поместите образец белка (соответствующий 100-300 мкг) в пробирку, совместимую с ацетоном.
- Добавьте в пробирку ацетон -20 °C в объеме, в пять раз превышающем объем образца.
- Выдерживать смесь при температуре -20 °C в течение 18 ч.
- Центрифугируйте пробирку при давлении 16 000 x g в течение 15 минут.
- Аккуратно утилизируйте надосадочную жидкость, не нарушая белковую гранулу.
- Добавьте 500 мкл ацетона -20 °C и повторите шаги 4,4-4,5.
- Высушите образец на воздухе.
5. Переваривание белка на основе улавливания суспензии
ПРИМЕЧАНИЕ: Процедура расщепления белка на основе фильтра для улавливания суспензии была адаптирована из инструкции производителя с незначительными изменениями.
- Приготовьте буфер для лизиса суспензии (5 % SDS, 5 мМ TCEP, 50 мМ pH 8,5 TEAB в деионизированной воде).
- Добавьте 40 μл буфера в пробирку с образцом и тщательно перемешайте, чтобы растворить высушенную на воздухе белковую гранулу.
- Образец инкубируют при 100 °C с встряхиванием при 1 000 x g в течение 35 минут.
- Добавьте в образец 10 мкл алкилирующего реагента (100 мМ хлорацетамида [CAA] в 100 мМ pH 8,5 тетраэтиламмония бромида [TEAB]).
- Инкубировать при РТ с встряхиванием при 300 х г в течение 1 ч.
- С осторожностью приготовьте подкислитель (10% трифторуксусной кислоты [ТЖК] в деионизированной воде). Убедитесь, что ТФК, сильная кислота, обрабатывается в вытяжном шкафу для химикатов.
- Добавьте в образец 5 μL подкислителя для достижения конечной концентрации 1% TFA (конечный объем образца: 55 μL).
- Проверьте pH образца с помощью pH-бумаги. Убедитесь, что pH меньше 1.
- Добавьте 350 мкл связывающего/промывочного буфера-1 (0,1 М pH 8,5 TEAB в 90% MeOH) в образец для захвата белков.
ПРИМЕЧАНИЕ: Избегайте завихрения и центрифугирования во время захвата белка (шаг 5.9), чтобы предотвратить потерю пробы. Достаточное количество белка обеспечивает образование видимых частиц коллоидного белка с полупрозрачным внешним видом. - Поместите колонну для улавливания суспензии в пробирку объемом 2 мл и перенесите весь образец, включая любой нерастворимый материал, в колонну для улавливания суспензии.
- Центрифугируйте колонку при давлении 4000 x g в течение 50 с, чтобы захватить белки.
ПРИМЕЧАНИЕ: Убедитесь, что весь образец проходит через колонку; Если нет, повторите центрифугирование до полной фильтрации. - Добавьте 400 μL промывочного буфера-2 (50 % CHCl3/50 % MeOH) в колонку, центрифугируйте при 4000 x g в течение 50 с и выбросьте проточный.
- Повторите шаг 5.12 три раза.
- Добавьте 400 мкл буфера-1, центрифугируйте при 4000 x g в течение 50 с и выбросьте проточный.
- Повторите шаг 5.14 три раза.
- Центрифугируйте при 4000 x g в течение 1,25 мин, чтобы обеспечить полное прохождение буфера-1.
- Перенесите колонну для улавливания суспензии в новую пробирку для образца для ферментативного разложения.
- Добавьте 125 мкл буфера для разложения (0,16 мкг/мкл трипсина/Lys-C в 50 мМ pH 8,5 TEAB) в колонну для улавливания суспензии и закройте ее крышкой, чтобы предотвратить испарение.
ПРИМЕЧАНИЕ: Соотношение трипсин/Lys-C должно быть 1:10 (вес/вес). Обеспечьте минимум 10 мкг трипсина/Lys-C для эффективного пищеварения. - Инкубировать при 37 °C в течение 18 ч без встряхивания.
- Приготовьте следующие элюирующие буферы: буфер-1 (50 мМ pH 8,5 TEAB в деионизированной воде), буфер-2 (0,2 % FA в деионизированной воде) и буфер-3 (50 % ацетонитрила [ACN] в деионизированной воде).
- Добавьте 80 мкл элюирующего буфера-1 в колонну для улавливания суспензии и центрифугируйте при 4000 x g в течение 1,25 мин.
- Повторите шаг 5.20 с 80 мкл элюирующего буфера-2 и буфера-3.
- Объедините элюированные пептиды и перенесите их в чистую новую пробирку.
6. Количественное определение пептидов
ПРИМЕЧАНИЕ: Большинство этапов количественного колориметрического пептидного анализа адаптированы из инструкции производителя с незначительными изменениями. Рекомендуется готовить реактивы в соответствии с рекомендациями производителя.
- Приготовьте ряд стандартов путем последовательного разбавления исходного раствора стандарта (1 мг/мл). При необходимости разбавьте образцы с коэффициентом разбавления 4 или 5.
- Приготовьте деионизированную воду в виде заготовки и смесь элюирующего буфера-1, буфера-2 и буфера-3 в равных пропорциях в качестве пробного контроля.
- Поместите 20 мкл стандартов, бланк, контрольный образец и образцы в центр каждой лунки микропланшета.
- Добавьте по 180 мкл рабочего реагента в каждую лунку и тщательно перемешайте пластину на вибростенде в течение 1 мин.
- Накройте тарелку крышкой и выдерживайте ее при температуре 37 °C в течение 20 минут.
- Дайте тарелке остыть при RT в течение 3 минут.
- Измерьте поглощение лунок на длине волны 480 нм с помощью планшетного ридера.
- Вычтите значение поглощения заготовки 480 нм из значения всех образцов и контрольных образцов.
- Далее вычтите значение поглощения 480 нм для контроля холостого образца из всех образцов.
- Постройте и используйте стандартную кривую для расчета концентрации пептидов для каждого образца.
7. Жидкостная хроматография-масс-спектрометрический анализ
- После количественного определения пептидов лиофилизировать 20 мкг пептидов.
- Повторно растворите пептиды в 40 мкл водного буфера (3 % ACN в 0,1 % воде с муравьиной кислотой [FA]) в течение 10 минут в ультразвуковой ванне. Полученная концентрация пептида составит 0,5 мкг/мкл.
- Центрифугируйте образец при давлении 16 000 x g в течение 60 минут и переложите образцы в пробирки для анализа на МС.
- Введите 2 мкл каждого образца с помощью автосамплера системы nano LC-MS/MS.
- Разделите пептиды на колонке с обратной фазой (0,075 мм ID x 150 мм, упакованной материалом C18 толщиной 3 мкм, используя 127-минутный градиент 5%-35% ацетонитрила при 100 нл/мин. Ионизируйте пептиды с помощью источника ионов с нанораспылением и перенесите их в масс-спектрометр на основе orbitrap.
- Анализ пептидов с использованием метода сбора данных в узком диапазоне21.
- Примените следующие настройки параметров MS: MS m/z диапазон: 495-745, целевое разрешение: 15000, цель AGC: 3 x 10E6, максимальное время впрыска: авто, окно MS/MS: определено пользователем (Дополнительный файл 1), целевое разрешение: 45000, мишень AGC 3 x 10E6, максимальное время впрыска: авто, энергия столкновения HCD: 22%, 26%, 30%.
ПРИМЕЧАНИЕ: Рекомендуется провести первоначальную проверку качества прибора путем анализа стандартных образцов перед анализом. Используйте программное обеспечение для сбора данных MS для настройки параметров (см. Таблицу материалов).
8. Анализ данных для поиска протеомики
ПРИМЕЧАНИЕ: Для протеомного поиска исходных данных MS были использованы инструменты с открытым исходным кодом для конвертации формата данных LC-MS и выполнения протеомного поиска (см. Таблицу материалов). Параметры, используемые для анализа данных, подробно описаны в Дополнительном файле 2. Основные инструкции по использованию инструментов с открытым исходным кодом см. по ссылке, приведенной в Таблице материалов.
- Скрытие необработанных файлов спектра MS/MS (*.raw), полученных из LC-MS, в формат *.mzML с помощью программного обеспечения с открытым исходным кодом.
- Используйте преобразованные в формат необработанные файлы (*.mzML) в качестве входных данных для поисковой системы с открытым исходным кодом для выполнения поиска протеома.
- Инициируйте протеомный поиск на основе параметров, указанных в дополнительном файле 2.
9. Статистический анализ
ПРИМЕЧАНИЕ: Для статистического анализа с целью идентификации дифференциально экспрессируемых белков был использован инструмент с открытым исходным кодом для проведения одномерного анализа (например, t-критерий Стьюдента; см. Таблицу материалов). Рекомендуется ознакомиться с основными инструкциями по использованию инструмента с открытым исходным кодом по ссылке, приведенной в Таблице материалов.
- Импортируйте список идентифицированных белков (*.txt) в инструмент с открытым исходным кодом.
- Классифицируйте образцы по группам. Для данного исследования были выделены две группы: SCN и IPMN.
- Выполните преобразование значений плотности Log2 , чтобы скорректировать распределение данных до приблизительного нормального распределения.
- Примените этап фильтрации, чтобы удалить белки с отсутствующими значениями. В этом исследовании для включения требовалось как минимум два действительных значения в каждой группе.
- Условное исчисление пропущенных значений с использованием подхода, основанного на нормальном распределении, для создания полного списка количественных белков для последующего одномерного анализа.
- Проведите t-критерий Стьюдента, чтобы определить дифференциально экспрессируемые белки между двумя группами. В этом исследовании была применена коррекция коэффициента ложных открытий Бенджамини-Хохберга (FDR).
- Извлечь дифференциально экспрессируемые белки, удовлетворяющие следующим критериям: Benjamini-Hochberg FDR < 0,05 и |кратное изменение| ≥ 2.
10. Биоинформатический анализ
ПРИМЕЧАНИЕ: Коммерческий инструмент биоинформатики был использован для анализа чрезмерной представленности (например, анализ пути Ingenuity, см. Таблицу материалов). Перед использованием данного средства рекомендуется обратиться к инструкции производителя.
- Импортируйте список DEP (*.txt) в коммерческий инструмент.
- Инициируйте анализ керна для проведения анализа чрезмерной представленности.
- Экспорт значимых канонических путей, обогащенных из DEP, с использованием точного теста Фишера (скорректированное p-значение < 0,05). Определите интересующие вас пути, которые имеют отношение к исследованию.
Результаты
К тканям кистозной FFPE поджелудочной железы применяли протеомную пробоподготовку на основе фильтра суспензии в сочетании с безмаркерным количественным определением с использованием однократного сбора, независимого от данных (рис. 1). Точная изоляция ROI во время обработки тканей FFPE была достигнута в различных тканях FFPE поджелудочной железы (рис. 2A), что привело к получению воспроизводимых хроматограмм общих ионов между биологическими трирепликатами для каждого типа кистозных новообразований поджелудочной железы (рис. 2B). Анализ LC-MS выявил 9 703 белка и количественно определил в среднем 7 886 и 8 273 белка для SCN и IPMN соответственно (рисунок 2C). Кроме того, во всех шести образцах было идентифицировано в общей сложности 80 245 прекурсоров и 75 412 пептидов, в среднем 55 729/51 488 и 63 573/59 519 прекурсоров/пептидов для SCN и IPMN соответственно (рисунок 2D). Распространенность всех идентифицированных белков составила 6,25 порядков величины, демонстрируя всеобъемлющий протеомный охват (рис. 2E). Кроме того, известные белковые маркеры рака поджелудочной железы, включая KRT19, KRAS, CEACAM5, MUC1, FUT3, SPARC, SAMD4 и GATA6, которые используются в прогнозировании и диагностике, были беспристрастно количественно оценены по всему диапазону распространенности протеома 22,23,24,25,26,27,28,29.
Коэффициенты корреляции Пирсона среди одного и того же типа тканей были выше (0,92 - 0,95), чем между типами тканей (0,82 - 0,88) (рис. 2F). Анализ главных компонент (PCA) SCN и IPMN показал четкую группировку по типам тканей по первому (52,2 %) и второму (15,6 %) компонентам (рисунок 2G), что соответствует результатам иерархической кластеризации, представленным на рисунке 2F. Были исследованы дифференциально экспрессируемые белки (DEPs) между SCN и IPMN, чтобы выяснить, можно ли интерпретировать биологические и молекулярные выводы с помощью общесистемного анализа на основе нашего протеома. Статистический анализ выявил 933 ДЭП, состоящих из 457 повышенных и 476 подавленных белков в IPMN (рис. 3A). Дальнейший биоинформатический анализ показал, что DEP были связаны с рядом путей, связанных с раком поджелудочной железы, включая термины, связанные с клеточным движением/пролиферацией, т.е. организацию внеклеточного матрикса, интегриновые взаимодействия на поверхности клеток, деградацию внеклеточного матрикса и деградацию коллагена, термины, связанные с клеточной смертью - сигнальный путь микроаутофагии и внутренний путь апоптоза, термины, связанные с межклеточной сигнализацией - передачу сигналов секреции поджелудочной железы пути и передача сигналов ERK/MAPK, а также термин, связанный с метаболизмом липидов - метаболизм сфинголипидов (рисунок 3B).
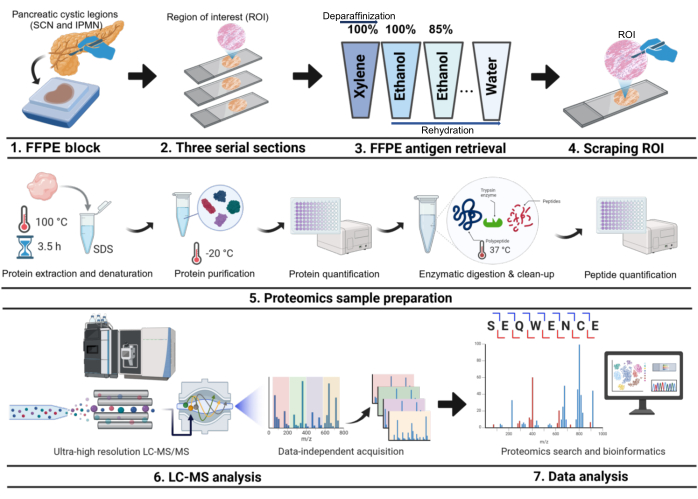
Рисунок 1: Экспериментальный рабочий процесс. Рабочий процесс включает в себя забор антигена FFPE, ROI соска, переваривание белка, анализ LC-MS и анализ данных. На этапах ферментативного сбраживания и очистки использовался фильтр-ловушка суспензии. FFPE, фиксированный формалином, залитый парафином; СХН, серозно-кистозные новообразования; IPMN, внутрипротоковые папиллярные муцинозные новообразования; ЖХ, жидкостная хроматография; МС, масс-спектрометрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Протеомная характеристика различных панкреатозных кистозных тканей FFPE. (A) Изображения тканей FFPE на предметном стекле по образцам. Область интереса (ROI) обозначена черной линией. (B) Общая ионная хроматограмма образцов, полученных с помощью анализа LC-MS. (C) Количество идентифицированных белков в образцах. (D) Количество идентифицированных прекурсоров и пептидов в образцах. (E) Динамический диапазон идентифицированных белков. Отмечены известные белки рака поджелудочной железы. (F) Коэффициенты корреляции Пирсона по выборкам. Иерархическая кластеризация выделена синим цветом для SCN и красным для IPMN соответственно. (G) Анализ главных компонент различных кистозных тканей поджелудочной железы на основе их протеомных профилей. СХН, серозно-кистозные новообразования; IPMN, внутрипротоковые папиллярные муцинозные новообразования; BR, биологическая репликация. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
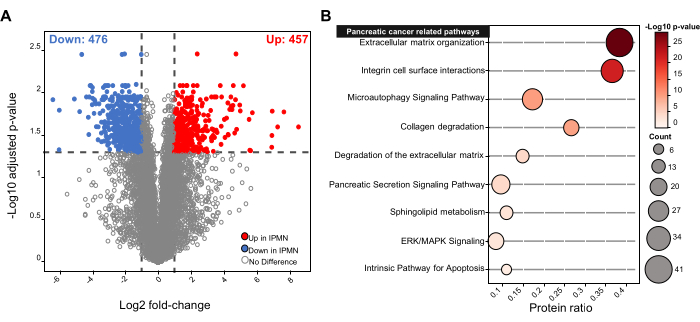
Рисунок 3: Протеомные изменения в различных панкреатозно-кистозных тканях FFPE. (A) Вулканический график, показывающий дифференциально экспрессируемые белки (DEPs) между IPMN и SCN (Benjamini-Hochberg FDR < 0,05 и |кратное изменение| ≥ 2). (B) Канонические пути, ассоциированные с раком поджелудочной железы, были обогащены из ДЭП. Соотношение белков определяется как количество белков в пути, удовлетворяющем p-значению < 0,05, деленное на общее количество белков в этом пути. IPMN, внутрипротоковые папиллярные муцинозные новообразования; FDR, процент ложных обнаружений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Этот протокол описывает быстрый и эффективный метод протеомики, в котором для патологической диагностики используются ROI, выделенные из срезов ткани FFPE, установленных на стеклянных предметных стеклах. Когда хирургическое вмешательство является благоприятным, солидные новообразования, такие как рак и кисты, хирургически резецируются и сохраняются для патологической оценки. Для длительного хранения ткани фиксируют в формалине и погружают в парафин (FFPE). Затем тканевые блоки FFPE разрезают до толщины 4-10 мкм, устанавливают на предметные стекла, подвергают извлечению антигена и окрашивают HE или IHC. Патологоанатомы оценивают клеточную морфологию и экспрессию молекулярных диагностических маркеров (например, HER2, ER и PR), чтобы помочь в принятии диагностических решений.
Современная протеомика позволяет проводить всестороннее качественное и количественное профилирование протеома человека в различных тканях и проводить молекулярный анализ в масштабах всей системы. Достижения в области сверхбыстрых масс-спектрометров со сверхвысоким разрешением, а также высоковоспроизводимой жидкостной хроматографии сыграли решающую роль в этих разработках. Кроме того, этот протокол интегрирует пробоподготовку на основе настройки захвата суспензии, что значительно сокращает время эксперимента и стратегию масс-спектрометрии сбора-масс-спектрометрии (DIA-MS) без меток, обеспечивая быстрое и высококомплексное протеомное профилирование ROI среза ткани FFPE. В отличие от методов на основе меток, протеомика без меток не требует реагентов с репортерной маркировкой, что обеспечивает большую гибкость при масштабировании наборов образцов. С другой стороны, методы мечения белков/пептидов, такие как тандемные массовые метки (TMT), обеспечивают лучшую количественную оценку белка, чем методы без меток, поскольку они позволяют мультиплексировать до 35 образцов, сводя к минимуму вариабельность, вызванную повторяющимися анализами МС. Однако такой подход приводит к неэффективности, когда количество образцов меньше или превышает доступные каналы маркировки. Безмаркерные методы были ограничены нестабильной аналитической воспроизводимостью, низкой чувствительностью и ограниченной количественной точностью. Тем не менее, безметочный DIA-MS в последнее время привлек внимание благодаря своей высокой чувствительности и глубокому количественному анализу в объемных или субмикромасштабных образцах, тем самым смягчая ограничения 21,30,31,32. Таким образом, безмаркерный подход DIA-MS особенно выгоден для углубленного количественного протеомного анализа больших наборов образцов, таких как архивные ткани FFPE, хранящиеся в биобанках или патологоанатомических отделениях до 10 лет.
Этот метод был применен для анализа протеомных различий в двух различных кистозных новообразованиях поджелудочной железы, IPMN и SCN, с акцентом на ROI, выявленные отделением патологии. Анализ LC-DIA-MS выявил более 9000 белков, более 900 DEP и пути, связанные с раком поджелудочной железы (рис. 3). В частности, было предсказано, что организация внеклеточного матрикса (ВКМ) и пути взаимодействия интегриновой поверхности клеток, которые, как сообщалось, участвуют в развитии рака поджелудочной железы, дифференциально активируются между двумя новообразованиями 33,34,35,36. Эти результаты подчеркивают молекулярные различия между предраковым IPMN и доброкачественным SCN, предполагая, что этот метод протеомики может обнаружить биологически значимые различия.
Этот протокол использует макродиссекцию для выделения ROI, что подходит для анализа опухолей или новообразований с четко определенными границами между поражением и ANT. В случаях, требующих точной изоляции ROI, рекомендуется лазерная захватывающая микродиссекция (LCM), о чем сообщалось ранее13. Однако в исследовательских условиях, где LCM недоступна, этот протокол представляет собой жизнеспособную альтернативу протеомному анализу, когда ROI легко различимы.
Раскрытие информации
Авторы не могут заявить о конфликте интересов
Благодарности
Все фигурки в этой статье были созданы с помощью BioRender (http://www.biorender.com). Эта работа была поддержана грантами Национального исследовательского фонда Кореи (NRF) (Grant No. RS-2023-00253403 и RS-2024-00454407).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.1% FA in ACN (LC-MS grade) | Fisher Chemical | LS120-212 | |
| 0.1% FA in Water (LC-MS grade) | Fisher Chemical | LS118-4 | |
| 0.5M TCEP | Thermo Scientific | 77720 | |
| 10% SDS | Invitrogen | 2679093 | |
| 1M TEAB (pH 8.5) | Sigma-Aldrich | 102545001 | |
| 1M Tris-cl (pH 8.5) | BIOSOLUTION | BTO21 | |
| A-14C centrifuge | Satorious | 167709 | |
| Acetone (HPLC grade) | Fisher Scientific | A949-4 | |
| ACN (HPLC grade) | J.T.Baker | 9017-88 | |
| CHCl3 (HPLC grade) | Thermo Scientific | 022920.k2 | |
| CR paper | ADVANTEC | 70406001 | |
| DIA-NN ver 1.9 | Open source | https://github.com/vdemichev/DiaNN | Proteomics Search Engine |
| EPOCH2 microplate reader | Agilent | 2106208 | |
| Ethanol | MERCK | K50505283 836 | |
| FA (LC-MS grade) | Fisher Chemical | A117-50 | |
| Ingenuity Pathway Analysis (IPA) | QIAGEN | 830018 | Bioinformatics tool |
| Lyophilizer (SRF110R+vaper trap) | Thermo Scientific | SRF-110-115 | |
| MeOH (HPLC grade) | MERCK | UN1230 | |
| Microplate BCA protein Assay kit-Reducing Agent Compatible | Thermo Scientific | 23252 | |
| MSConvert | Open source | http://proteowizard.sourceforge.net/tools.shtml | MS data transformation software |
| Orbitrap Exploris 480 | Thermo Scientific | MA10813C | MS |
| PepMAP RSLC C18 separation column | Thermo Scientific | ES903 | |
| Perseus | Open source | https://cox-labs.github.io/coxdocs/perseus_instructions.html | Statistical tool |
| PIERCE chloroacetamide No-Weigh Format | Thermo Scientific | A39270 | |
| PIERCE Quantitative colorimetric peptide Assay | Thermo Scientific | 23275 | |
| Plate shaker | Green SSeriker | VS-202D | |
| Probe sonicator | VibraCellTM | VCX750 | |
| Protein LoBind Tube 1.5 mL | Eppendorf | 22431081 | |
| QSP 10 µL pipette Tip | Thermo Scientific | TLR102RS-Q | |
| QSP 300 µL pipette Tip | Thermo Scientific | TLR106RS-Q | |
| Scalpel | Bard-Parker | 372615 | |
| S-Trap: Rapid Universal MS sample Prep | PROTIFI | CO2-mini-40 | |
| SureSTART Vial 0.2 mL | Thermo Scientific | 6pk1655 | |
| TFA | Sigma-Aldrich | 102614284 | |
| ThermoMixer C | Eppendorf | 5382 | |
| Trypsin/Lys-C (LC-MS grade) | Promega | V5073 | |
| Vanquish NEO | Thermo Scientific | 8348249 | LC |
| Water (HPLC grade) | Honeywell | AH365-4 | |
| Xcalibur ver 4.7 | Thermo Scientific | 30966 | MS data acquisition software |
| Xylene | Sigma-Aldrich | 102033629 |
Ссылки
- Van Maldegem, F., et al. Effects of processing delay, formalin fixation, and immunohistochemistry on RNA recovery from formalin-fixed paraffin-embedded tissue sections. Diagn Mol Pathol. 17 (1), 51-58 (2008).
- Fox, C. H., Johnson, F. B., Whiting, J., Roller, P. P. Formaldehyde fixation. J Histochem Cytochem. 33 (8), 845-853 (1985).
- Fraenkel-Conrat, H., Olcott, H. S. The reaction of formaldehyde with proteins; cross-linking between amino and primary amide or guanidyl groups. J Am Chem Soc. 70 (8), 2673-2684 (1948).
- Basyuni, S., et al. Large-scale analysis of whole genome sequencing data from formalin-fixed paraffin-embedded cancer specimens demonstrates preservation of clinical utility. Nat Commun. 15 (1), 7731 (2024).
- Gracia Villacampa, E., et al. Genome-wide spatial expression profiling in formalin-fixed tissues. Cell Genomics. 1 (3), 100065 (2021).
- Zhang, X., et al. Characterization of the genomic landscape in large-scale Chinese patients with pancreatic cancer. EBioMedicine. 77, 103897 (2022).
- Ren, Z., Ordway, B., Lin, P. -. H. Archival FFPE blocks: the gift that keeps giving. Innov. 5 (1), 100532 (2024).
- Magdeldin, S., Yamamoto, T. Toward deciphering proteomes of formalin-fixed paraffin-embedded (FFPE) tissues. Proteomics. 12 (7), 1045-1058 (2012).
- Soni, R. K. Protocol for deep proteomic profiling of formalin-fixed paraffin-embedded specimens using a spectral library-free approach. STAR Protoc. 4 (3), 102381 (2023).
- Gustafsson, O. J. R., Arentz, G., Hoffmann, P. Proteomic developments in the analysis of formalin-fixed tissue. Biochim Biophys Acta Proteins Proteomics. 1854 (6), 559-580 (2015).
- O'Rourke, M. B., Padula, M. P. Analysis of formalin-fixed, paraffin-embedded (FFPE) tissue via proteomic techniques and misconceptions of antigen retrieval. Biotechniques. 60 (5), 229-238 (2016).
- Ye, X., et al. Integrated proteomics sample preparation and fractionation: method development and applications. TrAC Trends Anal Chem. 120, 115667 (2019).
- Nwosu, A. J., et al. In-depth mass spectrometry-based proteomics of formalin-fixed, paraffin-embedded tissues with a spatial resolution of 50-200 µm. J Proteome Res. 21 (9), 2237-2245 (2022).
- Coscia, F., et al. A streamlined mass spectrometry-based proteomics workflow for large-scale FFPE tissue analysis. J Pathol. 251 (1), 100-112 (2020).
- Makhmut, A., et al. A framework for ultra-low-input spatial tissue proteomics. Cell Syst. 14 (11), 1002-1014.e5 (2023).
- Shin, D., et al. Identification of TUBB2A by quantitative proteomic analysis as a novel biomarker for the prediction of distant metastatic breast cancer. Clin Proteomics. 17 (1), 16 (2020).
- Lee, H., et al. Dual oxidase 2 (DUOX2) as a proteomic biomarker for predicting treatment response to chemoradiation therapy for locally advanced rectal cancer: using high-throughput proteomic analysis and machine learning algorithm. Int J Mol Sci. 23 (21), 12923 (2022).
- Tüshaus, J., et al. Towards routine proteome profiling of FFPE tissue: insights from a 1,220-case pan-cancer study. EMBO J. 44 (1), 304-329 (2024).
- Schweizer, L., et al. Quantitative multiorgan proteomics of fatal COVID-19 uncovers tissue-specific effects beyond inflammation. EMBO Mol Med. 15 (9), e17459 (2023).
- Kobayashi, G., et al. Proteomic profiling of FFPE specimens: discovery of HNRNPA2/B1 and STT3B as biomarkers for determining formalin fixation durations. J Proteomics. 301, 105196 (2024).
- Kawashima, Y., et al. Single-shot 10k proteome approach: over 10,000 protein identifications by data-independent acquisition-based single-shot proteomics with ion mobility spectrometry. J Proteome Res. 21 (6), 1418-1427 (2022).
- Li, W., et al. Identification and prognostic analysis of biomarkers to predict the progression of pancreatic cancer patients. Mol Med. 28 (1), 43 (2022).
- Martinelli, P., et al. GATA6 regulates EMT and tumour dissemination, and is a marker of response to adjuvant chemotherapy in pancreatic cancer. Gut. 66 (9), 1665-1676 (2017).
- Racu, M. -. L., et al. Smad4 positive pancreatic ductal adenocarcinomas are associated with better outcomes in patients receiving FOLFIRINOX-based neoadjuvant therapy. Cancers. 15 (15), 3765 (2023).
- Roy, L. D., et al. MUC1 enhances invasiveness of pancreatic cancer cells by inducing epithelial to mesenchymal transition. Oncogene. 30 (12), 1449-1459 (2011).
- Shi, H., Tsang, Y., Yang, Y. Identification of CEACAM5 as a stemness-related inhibitory immune checkpoint in pancreatic cancer. BMC Cancer. 22 (1), 1291 (2022).
- Waters, A. M., Der, C. J. KRAS: the critical driver and therapeutic target for pancreatic cancer. Cold Spring Harb Perspect Med. 8 (9), a031435 (2018).
- Yao, H., et al. Glypican-3 and KRT19 are markers associating with metastasis and poor prognosis of pancreatic ductal adenocarcinoma. Cancer Biomark. 17 (4), 397-404 (2016).
- Zhan, L., Chen, L., Chen, Z. Knockdown of FUT3 disrupts the proliferation, migration, tumorigenesis and TGFβ induced EMT in pancreatic cancer cells. Oncol Lett. 16 (1), 924-930 (2018).
- Frohlich, K., Furrer, R., Schori, C., Handschin, C., Schmidt, A. Robust, precise, and deep proteome profiling using a small mass range and narrow window data-independent-acquisition scheme. J Proteome Res. 23 (3), 1028-1038 (2024).
- Li, K. W., Gonzalez-Lozano, M. A., Koopmans, F., Smit, A. B. Recent developments in data independent acquisition (DIA) mass spectrometry: application of quantitative analysis of the brain proteome. Front Mol Neurosci. 13, 564446 (2020).
- Searle, B. C., et al. Chromatogram libraries improve peptide detection and quantification by data independent acquisition mass spectrometry. Nat Commun. 9 (1), 5128 (2018).
- Prakash, J., Shaked, Y. The interplay between extracellular matrix remodeling and cancer therapeutics. Cancer Discov. 14 (8), 1375-1388 (2024).
- Perez, V. M., Kearney, J. F., Yeh, J. J. The PDAC extracellular matrix: a review of the ECM protein composition, tumor cell interaction, and therapeutic strategies. Front Oncol. 11, 751311 (2021).
- Ferrara, B., et al. The extracellular matrix in pancreatic cancer: description of a complex network and promising therapeutic options. Cancers. 13 (17), 4442 (2021).
- Weniger, M., Honselmann, K. C., Liss, A. S. The extracellular matrix and pancreatic cancer: a complex relationship. Cancers. 10 (9), 316 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены