Method Article
Имплантация беспроводного телеметрического устройства в модель овцы Фонтана для непрерывного и долгосрочного гемодинамического мониторинга
В этой статье
Резюме
Этот протокол описывает хирургическую методологию имплантации беспроводного телеметрического устройства для крупных животных для обеспечения непрерывного и долгосрочного сбора гемодинамических данных, включая частоту сердечных сокращений, артериальное давление, давление нижней и верхней полых вен и сердечный ритм.
Аннотация
В то время как процедура Фонтена значительно увеличивает продолжительность жизни пациентов с одним желудочком, хорошо известно, что образовавшееся кровообращение вызывает значительное бремя заболевания в долгосрочной перспективе как следствие хронически повышенного давления в центральных венах и снижения сердечного выброса. Хронические модели Фонтена на животных являются ценным активом для изучения поздних физиологических последствий, связанных с этой операцией, и необходимым инструментом для оценки будущих устройств, предназначенных для смягчения отказа Фонтена. Тем не менее, предыдущие попытки создания хронических моделей Фонтена были затруднены из-за низких показателей выживаемости. Кроме того, эффективный сбор гемодинамических данных представляет собой серьезную проблему при свободном передвижении животных. С этой целью использование беспроводных имплантируемых телеметрических систем обеспечивает новое решение для долгосрочного мониторинга сердечно-сосудистых данных в режиме реального времени. Этот протокол описывает методологию хирургической имплантации беспроводного телеметрического устройства в модель выживаемости овец по Фонтену, облегчающую непрерывную и непрерывную регистрацию нескольких гемодинамических параметров, включая частоту сердечных сокращений, артериальное давление и локализованное давление в нижней (IVC) и верхней полой вене (SVC). Телеметрические устройства имплантировали с канюляцией либо сонной артерии и внутренней яремной вены, либо бедренной артерии и вены, для размещения чувствительных к давлению катетеров в восходящей аорте и ВПВ или брюшной аорте и НПВ соответственно. Использование беспроводных телеметрических систем позволило осуществлять тщательный послеоперационный мониторинг после одноэтапной операции Фонтена, что способствовало улучшению благополучия и выживаемости животных.
Введение
Разработка процедуры Фонтена в 1971 году привела к значительному улучшению исходов у пациентов с одним желудочком1. Целью данной операции является разделение системного и легочного венозного возврата к сердцу, тем самым увеличивая системную оксигенацию и снимая объемную нагрузку на системный желудочек. С момента его появления в хирургический подход были внесены многочисленные изменения. В настоящее время полное шунтирование правых отделов сердца чаще всего достигается путем этапной реконструкции 2,3. Как правило, первый этап проводится в течение первой недели жизни4. Затем пациенты проходят второй этап, который состоит либо из процедуры Гленна, либо из метода Хеми-Фонтена, чтобы перенаправить кровоток из верхней полой вены (ВПВ) в легочную артерию (ЛП)5. Затем следует операция Фонтена, которая включает в себя создание экстракардиального канала или латерального туннеля между нижней полой веной (IVC) и PA6. Хирургические достижения, подобные тем, которые были сделаны на протяжении всей истории процедуры Фонтена, не могли бы быть достигнуты безиспользования животных моделей.
В то время как процедура Фонтена значительно увеличивает продолжительность жизни пациентов с одним желудочком, хорошо известно, что возникающее кровообращение, которое функционирует без субпульмонального насоса, вызывает значительное бремя заболевания в долгосрочной перспективе в результате хронически повышенного центрального венозного давления (ЦВД) и снижения сердечного выброса 8,9,10,11,12 . Хронические модели Фонтена на животных являются ценным активом для изучения поздних физиологических последствий, связанных сэтой операцией. Активный сбор данных о сердечно-сосудистых параметрах, таких как CVP, частота сердечных сокращений и другие жизненно важные показатели, для фиксации послеоперационных гемодинамических изменений имеет важное значение для всесторонней оценки развивающейся патофизиологии. Кроме того, животные модели являются необходимым инструментом для проверки возможностей новых желудочковых вспомогательных устройств, предназначенных для смягчения гемодинамических недостатков циркуляции Фонтена in vivo 14,15,16,17,18,19.
Однако эффективный сбор данных представляет собой серьезную проблему. Методы на основе инвазивных катетеров ограничены их преходящим характером, связанными с процедурными рисками и невозможностью мониторинга состояния животного в течение длительных периодов времени. Более того, предыдущие попытки создать модель Фонтена крупного животного были затруднены низкими показателями выживаемости, предположительно из-за неспособности нормальных сердец адаптироваться к острому становлению циркуляции Фонтена 7,20. С этой целью использование беспроводных телеметрических систем обеспечивает новое решение для долгосрочного сбора сердечно-сосудистых данных в режиме реального времени у свободно движущихся животных21,22. Эти устройства также могут обеспечить тщательный послеоперационный мониторинг, что может привести к улучшению благополучия и выживаемости животных.
В данной статье мы опишем методологию успешной имплантации и использования беспроводной телеметрической системы23 в модели овцы хронического Фонтана. Этот метод обеспечил надежное и надежное средство непрерывного сбора гемодинамических данных, позволяющее изучать венозное давление и другие ключевые физиологические параметры. Внедрение этой технологии в доклинические модели имеет решающее значение для углубления нашего понимания физиологии Фонтена и разработки новых терапевтических стратегий, направленных на улучшение долгосрочных результатов лечения пациентов с болезнью Фонтена.
протокол
Этот экспериментальный протокол был одобрен Комитетом по уходу за животными и их использованию Национальной детской больницы Исследовательского института Эбигейл Векснер (AR20-00121). Все процедуры проводились в соответствии с рекомендациями, изложенными в Руководстве Национального института здравоохранения по использованию и уходу за лабораторными животными. Это исследование проводилось в соответствии с рекомендациями «Исследования на животных: отчетность об экспериментах in vivo ». Овцы породы Дорсет весом 23-38 кг и возрастом от 2 до 12 месяцев содержались в специальной среде, свободной от патогенов, со свободным доступом к пище и воде в течение как минимум 1 недели до операции. Оборудование и реагенты, использованные в исследовании, перечислены в Таблице материалов.
1. Подготовка животных
- За 1 неделю до операции ветеринарная бригада осмотрит овец, чтобы убедиться, что они могут безопасно проходить анестезию. Быстро оздоровить овец и лишить их воды за 12 ч до хирургического вмешательства.
- Седативный препарат с комбинацией кетамина (4 мг/кг) и диазепама (0,5 мг/кг) вводится через внутреннюю яремную вену (IJ).
- Брейте овец в соответствии с запланированной процедурой (подробно описано ниже) и над бедром для установки заземляющей прокладки электрокоагуляции. Очистите места операций спиртом.
- Введите в трахею однопросветную эндотрахеальную трубку диаметром 8-9 мм.
- Ввести орогастральный зонд для декомпрессии желудка и рубца.
- Введите однопросветный венозный катетер (16-18 G) в правую яремную вену или боковую подкожную вену для непрерывного введения жидкости, непрерывной инфузии (CRI) пропофола и инъекции препарата по мере необходимости.
- Поместите артериальный катетер (22-24 G) в ушную артерию для непрерывного мониторинга артериального давления.
- Поместите манжету для измерения артериального давления на правую переднюю конечность для неинвазивного измерения артериального давления, зажим на ухе или языке для контроля насыщения кислородом и электрокардиограмму (ЭКГ) на всех четырех конечностях.
- Во время процедуры следует поддерживать анестезию с использованием ингаляционного изофлурана 1%-3% со 100%O2 и/или пропофола CRI (20-45 мг/кг/ч).
- Асептически очистите места проведения операций с помощью препарата на основе хлоргексидина и наложите простыню стандартным стерильным способом.
- Вводите цефазолин (25 мг/кг) для антибиотикопрофилактики перед разрезом и повторно дозируйте каждые 4 ч во время операции по мере необходимости.
- Введите подкожное введение местного анестетика, такого как бупивакаин 0,25%, во все запланированные места разрезов до разреза.
2. Подготовка прибора телеметрии
- Откройте программу телеметрии и включите устройство телеметрии с помощью магнитного переключателя, пока оно еще запечатано в оригинальной упаковке.
- В программном обеспечении нажмите « Оборудование », расположенное на верхней панели, и выберите «Редактировать конфигурацию PhysioTel Digital (CLC) », чтобы назначить блок телеметрии контроллеру канала связи (CLC).
- Как только CLC будет выбран, откроется страница «Сведения о CLC ». На этой странице нажмите «Поиск имплантатов», после чего начнется поиск устройств для имплантатов, включенных поблизости.
- Нажмите кнопку Добавить , чтобы добавить единицу телеметрии в список Выбранные имплантаты . Теперь устройство будет отображаться в списке «Настроенные имплантаты» на странице сведений о CLC . Нажмите Сохранить и выйти.
- Начните сбор данных, нажав кнопку « Воспроизвести » рядом с названием блока телеметрии на вкладке «Контроль выборки ». Автоматически откроется график, отображающий сбор данных в реальном времени.
- Извлеките устройство из внешней упаковки и перенесите его в стерильную внутреннюю упаковку на операционный стол.
- Обнулите устройство, пока оно остается во внутренней упаковке. Подождите, пока измерения с помощью устройства не станут стабильными в течение 30 с, и используйте значения стабилизированного непульсирующего среднего давления (NPMN) в качестве смещения.
- В окне «Настройка темы» выберите значок настроек рядом с параметром, который обнуляется, и откройте вкладку «Смещения ». Введите значение смещения, полученное в результате измерений NPMN, в текстовое поле.
- После ввода смещения проверьте, составляют ли показания NPMN 0 ± 0,1 мм рт.ст. Если нет, повторяйте шаг 2.7 до тех пор, пока значения не окажутся в желаемом диапазоне.
- Выполните шаги 2.7-2.9 для обоих напорных каналов.
- Перед введением катетеров, чувствительных к давлению, в кровеносный сосуд постучайте по наконечнику, чтобы определить соответствующий канал. На выходе сигнала будут заметны постукивания.
- Используйте катетер, соответствующий каналу давления левого желудочка (ЛЖП) для измерения артериального давления и каналу артериального давления (АД) для измерения венозного давления.
- На вкладке Стандартные атрибуты диалогового окна Атрибуты анализа артериального давления установите минимальную высоту пульса равной 1 мм рт.ст. для канала АД.
3. Метод 1: Канюляция бедренной артерии и вены
- Брейте овец по широкому периметру вокруг правого паха и над животом и грудью.
- Положите овцу лежа на операционный стол так, чтобы ее передние конечности были зафиксированы в сгибании с помощью гибкого тканевого ремня, а задние конечности были зафиксированы в разгибании с помощью завязки, чтобы обеспечить доступ к паху (рисунок 1A).
- Сделайте поперечный разрез шириной 5 см в правой паховой области с центром пальпируемой бедренной артерии, примерно на 1 см ниже паховой складки.
- Используя комбинацию электрокаутеризации и тупого рассечения, рассекайте через подкожную клетчатку до бедренного треугольника. Определите местонахождение бедренных сосудов путем пальпации артериального пульса.
- Разделите мышцу сарториуса и длинную приводящую мышцу вдоль направления мышечных волокон, чтобы обнажить бедренные сосуды (рис. 1B).
- Используя комбинацию тупого и острого рассечения, очистите соединительную ткань от бедренных сосудов по окружности.
- Проведите шелковую завязку с двойной петлей 2-0 вокруг обоих сосудов проксимальнее и дистальнее места канюляции для временной перевязки сосуда.
- Сделайте 6-сантиметровый поперечный разрез через кожу в правой нижней части живота, примерно на 3 см выше паховой складки.
- Используя комбинацию электрокоагуляции и тупого рассечения, рассекайте подкожно-жировую клетчатку и соединительную ткань, чтобы создать карман размером 6 см x 4 см, поверхностный к наружной косой.
- Вставьте телеметрическое устройство в подкожный карман и закрепите его на месте с помощью шелкового шовного материала 2-0 (рис. 1C).
- Проведите туннель антенны телеметрического устройства под подкожную клетчатку и закрепите ее на месте с помощью шелкового шва 2-0.
- Для размещения биопотенциальных (ЭКГ) отведений делают 1-сантиметровые встречные разрезы на коже над средней и нижней частью живота, а также нижней и верхней частью грудной клетки. Туннель подкожно соединить эти разрезы с карманом на теле аппарата и направить провода ЭКГ к их нужному расположению.
- Поместите положительный электрод в подкожную клетчатку слева от нижней части грудины. Убедитесь, что силиконовая трубка снята, чтобы открыть кончик стальной проволоки под ней.
- Поместите отрицательный электрод в подкожную клетчатку справа от верхней грудины.
- Лишняя проводка для обоих проводов может быть свернута и закреплена в подкожном месте с помощью шелкового шва 2-0.
- Создайте подкожный туннель от нижнего кармана брюшного устройства к паховому разрезу и проденьте через него два катетера давления.
- Наложите кисетной шов с помощью полипропиленового шва 6-0 вокруг места канюляции бедренной артерии и вены, который можно закрепить с помощью пластикового жгута.
- Заполните гелевые наконечники катетера несжимаемым гелем с высокой вязкостью, чтобы предотвратить коагуляцию внутри наконечников катетера и обеспечить отсутствие пузырьков воздуха.
- Ввести дозу гепарина внутривенно (100 ЕД/кг) за 3 мин до канюляции.
- Затяните проксимальный и дистальный отделы 2-0 шелковыми жгутами вокруг бедренной артерии. Аккуратно надрежьте сосуд в центре кисетного стежка скальпелем с лезвием #11 и слегка расширьте кончиком изогнутого гемостата.
- Вставьте давящий катетер, соответствующий каналу LVP, и продвигайте его в брюшную аорту, ослабляя проксимальный шелковый жгут, чтобы обеспечить прохождение катетера. Затяните кисетный шов и завяжите его вокруг катетера.
- Повторите шаги 3.20 и 3.21 для канюляции бедренной вены с помощью напорного катетера, соответствующего каналу АД, и введите его в абдоминальную НПВ (Рисунок 1D).
- С помощью рентгеноскопии убедитесь, что кончики катетеров расположены правильно в НПВ и аорте.
- Повторите приближение портновской мышцы с помощью рассасывающегося шва 2-0.
- Закройте кожу глубокими дермальными и подкожными швами с помощью рассасывающихся швов 3-0 и 4-0 соответственно.
4. Метод 2: Канюляция сонной артерии и внутренней яремной вены
- Брейте овец по широкому периметру вокруг левой шеи и вниз по грудь.
- Расположите овцу в правом боковом пролежне на операционном столе так, чтобы левая передняя конечность была зафиксирована при сгибании с помощью завязки, чтобы обнажить грудную клетку (рисунок 2А).
- Сделайте продольный разрез кожи шириной 5 см над левой сонной артерией и IJ веной, примерно на 7 см краниально от грудного входа.
- С помощью электрокаутеризации рассекайте подкожно-жировую клетчатку, соединительную ткань и платизму, чтобы обнажить сосуды шеи (рисунок 2B).
- Используя комбинацию тупого и резкого рассечения, очистите соединительную ткань от левой сонной артерии и IJ вены по окружности.
- Проведите шелковую завязку с двойной петлей 2-0 вокруг обоих сосудов проксимальнее и дистальнее места канюляции для временной перевязки сосуда.
- Сделайте продольный разрез 6 см у основания левой шеи между лопаткой и шейным отделом позвоночника.
- Используя комбинацию электрокоагуляции и тупого рассечения, рассеките подкожно-жировую клетчатку и соединительную ткань, чтобы создать карман размером 6 см x 4 см, идущий к позвоночнику.
- Вставьте телеметрический прибор в подкожный карман и закрепите его на месте с помощью шелкового шва 2-0.
- Проведите туннель антенны телеметрического устройства под подкожную клетчатку и закрепите ее на месте с помощью шелкового шва 2-0.
- Сделайте встречные разрезы кожи по 1 см у основания шеи, а также в нижней левой и верхней правой части грудной клетки, для размещения отведений ЭКГ. Туннель подкожно соединить эти разрезы с карманом на теле устройства и направить провода ЭКГ к их нужному месту (рисунок 2В).
- Расположите провода ЭКГ аналогично описанным выше шагам для процедуры имплантации бедренной кости (раздел 3).
- Создайте подкожный туннель от латерального кармана устройства к медиальному разрезу шейки и проденьте через него два катетера давления. Подготовьте эти катетеры давления с помощью геля перед канюляцией, как описано в процедуре имплантата бедренной кости.
- С помощью полипропиленового шва 6-0 наложите кошельковый шов вокруг места канюляции на обоих сосудах и закрепите пластиковым жгутом.
- Ввести дозу гепарина внутривенно (100 ЕД/кг) за 3 мин до канюляции.
- Затяните проксимальный и дистальный отделы 2-0 шелковых жгутов вокруг сонной артерии. Аккуратно надрежьте сосуд в центре кисетного стежка скальпелем с лезвием #11 и слегка расширьте кончиком изогнутого гемостата.
- Вставьте давящий катетер, соответствующий каналу LVP, и продвинуте его в грудную восходящую аорту, ослабляя проксимальный шелковый жгут, чтобы обеспечить прохождение катетера. Затяните кисетный шов и завяжите его вокруг катетера.
- Повторите шаги 4.16 и 4.17 для канюляции левой вены IJ с помощью напорного катетера, соответствующего каналу АД, и введите его в грудной отдел ЖВК.
- Подтвердите правильное расположение кончиков катетеров в грудной ВПК и восходящей аорте с помощью рентгеноскопии (Рисунок 2D).
- Повторите аппроксимацию мышцы платизмы с помощью рассасывающегося шва 2-0.
- Закройте кожу глубокими дермальными и подкожными швами с помощью рассасывающихся швов 3-0 и 4-0 соответственно.
5. Восстановление
- Прекратить прием анестетиков. Извлеките орогастральный зонд и экстубируйте его, когда овца дышит без посторонней помощи аппарата искусственной вентиляции легких. Обычно это происходит после того, как овца проявляет признаки возбуждения (движение, моргание, реакция на болезненные раздражители, тонус челюсти, жевание).
- Удалите артериальный катетер.
ПРИМЕЧАНИЕ: Непрерывный мониторинг артериального давления может быть обеспечен телеметрическим устройством, если один из его катетеров давления был помещен в аорту. - Переведите овец в изолированный жилой блок для выздоровления. Помогите овцам оставаться в лежачем положении на грудине, а затем, в конечном итоге, стоять.
- Введите внутривенно банамин (2,2 мг/кг) и подкожно бупренорфин SR (0,03 мг/кг) при послеоперационной боли.
Результаты
Хирургические исходы
В общей сложности 13 овцам была выполнена одномоментная операция по методу Фонтена с полным каволегочным соединением с отслоением как ВПВ, так и НПВ от правого предсердия, прямым анастомозом ВПВ в ПА и размещением экстракардиального кондуита между НПВ и ПА. Овцы подвергались этой процедуре в среднем в возрасте 13,3 ± 7,6 месяцев. Из них 3 овцам была проведена имплантация беспроводного телеметрического устройства с размещением в брюшную аорту катетеров, чувствительных к давлению, и НПВ; 2 овцам выполнена имплантация телеметрического аппарата с установкой чувствительных к давлению катетеров в восходящую аорту и СВЦ; и у 8 овец не было имплантировано телеметрическое устройство. Ни у одного животного не наблюдалось серьезных послеоперационных осложнений после имплантации телеметрического устройства. Семь из 8 овец (87,5%) без телеметрического устройства умерли в течение 30 дней после операции Фонтена, в то время как только 1 из 5 (20,0%) овец с телеметрическим устройством умерла в этот послеоперационный период (табл. 1).
Сбор гемодинамических данных
Имплантация беспроводных телеметрических систем способствовала непрерывному и долгосрочному сбору данных по нескольким сердечно-сосудистым параметрам, включая частоту сердечных сокращений, артериальное давление и CVP. Это позволило осуществлять тщательный гемодинамический мониторинг животных, перенесших одномоментную операцию по Фонтану до, во время и в течение нескольких дней после операции (рис. 3). Изменения венозного давления наблюдались ежеминутно, хотя общие тенденции, по-видимому, показывали резкое повышение как абдоминального НПВ (рис. 4A), так и торакального давления SVC (рис. 4B) после установления циркуляции Фонтена. Некоторые ежеминутные колебания венозного давления могут быть связаны с уровнем активности овец и их положением. Например, наблюдалось, что давление в брюшной полости НПВ постоянно увеличивалось, когда овцы лежали на животе (Рисунок 5). У одной овцы в тот же день после имплантации устройства в область шеи была проведена процедура катетеризации с размещением венозного канала давления в СВЦ. Это было сделано для оценки расхождений между значениями, сообщаемыми телеметрическим устройством, и значениями, полученными при инвазивном мониторинге давления, который рассматривался как золотой стандарт. Непульсирующее среднее давление ВПВ, полученное в результате процедуры катетеризации, колебалось в пределах 2-4 мм рт.ст., при этом колебания были связаны с изменениями внутригрудного давления в течение дыхательного цикла (рис. 6). На протяжении всей процедуры телеметрическое устройство выдавало в среднем 43 показания непульсирующего среднего давления СВ в минуту при общем среднем давлении СВ 1,1 ± 3,1 мм рт.ст., что указывает на минимальное отклонение между измерениями устройства и фактическими значениями.

Рисунок 1: Имплантация устройства с канюляцией бедренной артерии и вены. Для имплантации устройства с канюляцией бедренной артерии и вены овца располагается на спине, задние ноги вытянуты. (A) Предоперационная маркировка указывает на расположение запланированных разрезов, карман на теле устройства и подкожный ход проводов ЭКГ и катетеров, чувствительных к давлению, до их конечного местоположения. (В) Между подкожной клетчаткой и над наружной косой мышцей создается подкожный карман размером приблизительно 6 см х 4 см для размещения корпуса телеметрического устройства. (C) Бедренные сосуды обнажаются после разделения портняжной мышцы. Пальпируемая бедренная артерия (белые стрелки) расположена медиально бедренной вены (синие стрелки). (D) Чувствительные к давлению катетеры вставляются в бедренную артерию (белая стрелка) и вену (синяя стрелка), а затем фиксируются на месте с помощью кисетного шва. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
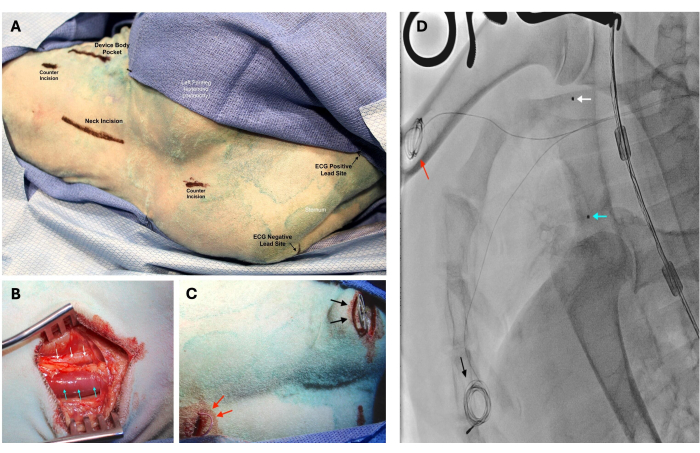
Рисунок 2: Имплантация устройства с помощью канюляции левой сонной артерии и внутренней яремной вены (IJ). Для имплантации устройства с помощью канюляции левой сонной артерии и внутренней яремной вены (IJ) овцу располагают в правом боковом пролежне, вытянув левую переднюю ногу кзади. (A) Предоперационная маркировка указывает на расположение запланированных разрезов. (B) Левая сонная артерия (белые стрелки) и IJ-вена (синие стрелки) обнажаются после разделения платизмы. Сонная артерия расположена глубоко и латерально по отношению к IJ вене. (C) Лишняя проводка проводов ЭКГ скручивается, а затем фиксируется в подкожном пространстве. Положительный отведение располагается слева от нижней части грудины (черные стрелки), в то время как отрицательное отведение располагается справа от верхней части грудины (красные стрелки). (D) С помощью рентгеноскопии было подтверждено размещение чувствительных к давлению кончиков катетеров в верхней полой вене (синяя стрелка) и восходящей аорте (белая стрелка). Расположение положительного (черная стрелка) и отрицательного (красная стрелка) отведений ЭКГ также можно увидеть на рентгеновской визуализации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
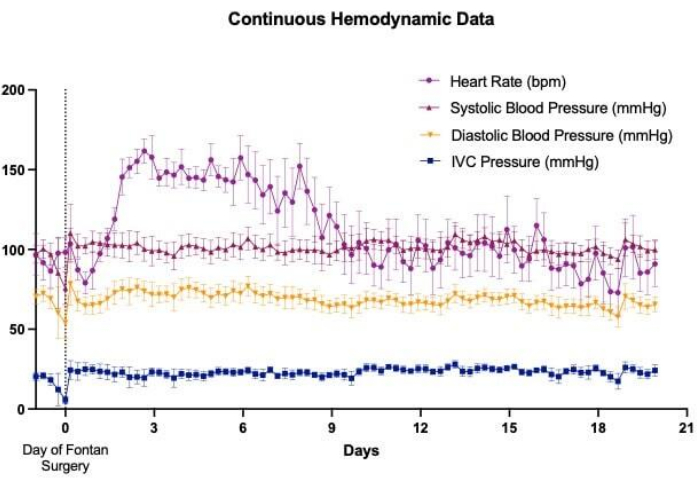
Рисунок 3: Имплантация беспроводного телеметрического устройства для непрерывного мониторинга. Имплантация беспроводного телеметрического устройства позволила обеспечить непрерывный мониторинг ряда сердечно-сосудистых параметров, включая частоту сердечных сокращений, артериальное давление и венозное давление, в моделях выживаемости овец по Фонтену на протяжении всего периоперационного периода. Гемодинамические тренды, изображенные на этом графике, являются репрезентативными для данных, собранных с помощью чувствительных к давлению катетеров, размещенных в брюшной аорте и нижней полой вене (НПВ). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
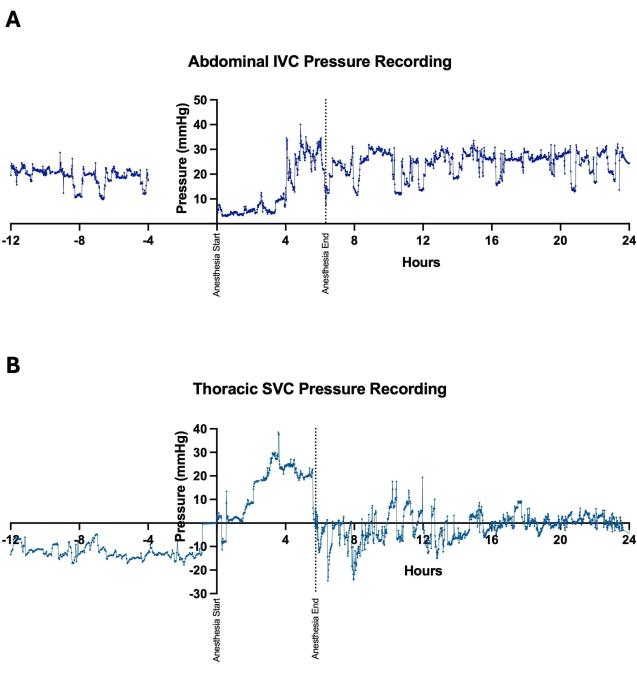
Иллюстрация 4: Расположение катетеров, чувствительных к давлению. Чувствительные к давлению катетеры располагались либо в (А) нижней полой вене (НПВ), либо в (В) верхней торакальной полой вене (ВПЦ) для непрерывной регистрации центрального венозного давления. Измерения венозного давления были получены дооперационно, интраоперационно во время процедуры Фонтена и после операции для оценки тенденций после установления циркуляции Фонтена. Ежеминутные колебания в измерениях давления происходили с изменениями в положении животного и уровне активности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
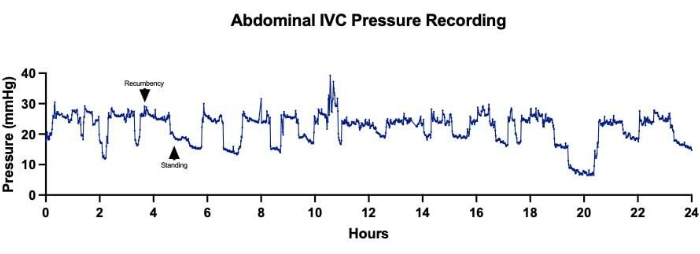
Рисунок 5: Давление в нижней брюшной полой вене (НПВ). Непрерывный сбор данных о давлении в брюшной полости НПВ в течение 24-часового периода показал колебания в измерениях давления, коррелирующие с изменениями в положении овец. Более высокое среднее давление НПВ соответствовало времени, когда овца отдыхала лежа, в то время как более низкое среднее давление НПВ было зарегистрировано, когда овца стояла. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
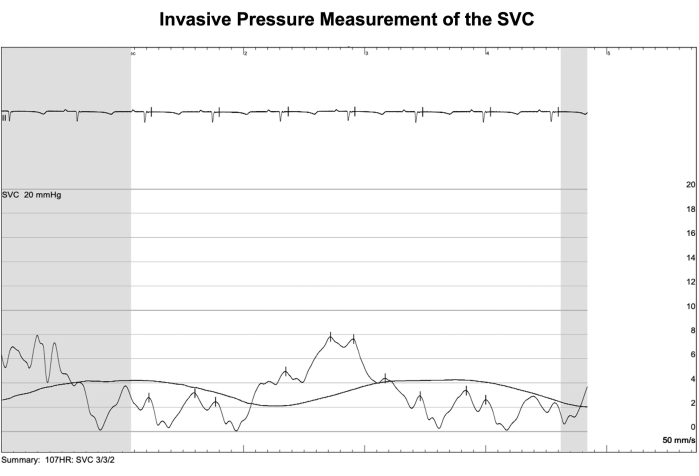
Иллюстрация 6: Инвазивное измерение давления ЦВК. Процедура катетеризации была проведена в тот же день после имплантации устройства у одной овцы для проверки показаний давления в верхней полой вене (ЦВК) от телеметрической системы. Значения, полученные с помощью этого метода инвазивного контроля давления, рассматривались как золотой стандарт. Непульсирующее среднее давление ВПВ, полученное в результате процедуры катетеризации, колебалось в пределах 2-4 мм рт.ст. синхронно с дыхательным циклом. Между тем, среднее значение всех непульсирующих средних давлений SVC, собранных телеметрическим устройством во время процедуры, составило 1,1 ± 3,1 мм рт.ст., что указывает на минимальное смещение между показаниями телеметрии и фактическими значениями. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Овца | Секс | Установка катетера телеметрическим устройством | Масса на момент операции по Фонтану (кг) | Возраст на момент операции Фонтена (мес.) | Периоперационная смерть |
| 1 | M | Никакой | 45 | 13 | Да |
| 2 | F | Никакой | 43 | 13 | Нет |
| 3 | M | Никакой | 46.5 | 25 | Да |
| 4 | F | Никакой | 46.5 | 19 | Да |
| 5 | M | Никакой | 50 | 20 | Да |
| 6 | F | Никакой | 53 | 28 | Да |
| 7 | M | Никакой | 40.5 | 8 | Да |
| 8 | M | Никакой | 42 | 10 | Да |
| 9 | F | Брюшная аорта и НПВ | 33.5 | 3 | Нет |
| 10 | M | Брюшная аорта и НПВ | 24 | 7 | Да |
| 11 | M | Брюшная аорта и НПВ | 29 | 8 | Нет |
| 12 | M | Восходящая аорта и СВК | 37.5 | 13 | Нет |
| 13 | M | Восходящая аорта и СВК | 39.5 | 6 | Нет |
Таблица 1: Результаты хирургического вмешательства. Тринадцати овцам была проведена одноэтапная операция по методу Фонтена, 5 из которых за 1 месяц до этого была имплантирована беспроводная телеметрическая установка. После операции Фонтена 7 из 8 овец (87,5%) без телеметрического устройства умерли в течение 30 дней, по сравнению с 1 из 5 (20,0%) овец с телеметрическим устройством.
Обсуждение
Нами разработаны два хирургических метода имплантации беспроводного телеметрического устройства в модель овцы. Устройство было успешно имплантировано 5 овцам для достижения непрерывного, долгосрочного мониторинга и записи нескольких сердечно-сосудистых параметров, включая частоту сердечных сокращений, артериальное давление и локализованное венозное давление из абдоминального НПВ и грудной ВПВ. Все овцы пережили операцию по имплантации устройства без каких-либо серьезных осложнений и через месяц перенесли одноэтапную операцию Фонтена.
В 2019 году Van Puyvelde et al. сообщили о создании первой модели выживания овец по Фонтену для изучения хронического процесса недостаточности Фонтена13. Тем не менее, две трети животных в конечном итоге не дожили до двадцатой недели после операции. Примечательно, что у животных с нормальным сердцем чрезвычайно трудно установить острое кровообращение Фонтена, по-видимому, потому, что они менее приспособлены, чем одножелудочковые сердца, к этому специфическому физиологическому состоянию. Таким образом, полезность имплантации телеметрического устройства двояка. Во-первых, возможность тщательного мониторинга жизненно важных функций в течение послеоперационного периода может обеспечить быстрое распознавание признаков сердечно-сосудистой декомпенсации и реагирование на них, а также облегчить начало целенаправленной терапии. По нашему опыту, имплантация устройств беспроводной телеметрии в когорту овец, перенесших одноэтапную операцию Фонтена, способствовала повышению их выживаемости. Во-вторых, возможность получать данные в режиме реального времени в долгосрочной перспективе позволит нам идентифицировать развивающиеся гемодинамические тенденции, связанные с недостаточностью Фонтена.
В то время как мы сосредоточились на создании хронической модели большого животного по Фонтену, преимущества беспроводных телеметрических систем могут быть применены и в других начинаниях, таких как тестирование и разработка новых каволегочных вспомогательных устройств (CPAD), направленных на обеспечение механической поддержки кровообращения в случаях отказа Фонтена. Несколько групп опубликовали крупные исследования на животных, изучающие целесообразность и функциональные возможности CPAD, применяемых к циркуляции Фонтена 16,17,18,19. Тем не менее, большинство этих экспериментов было проведено на острых моделях Фонтена с краткосрочной оценкой гемодинамических показателей с использованием методов сбора данных, которые нежизнеспособны за пределами операционной. В 2019 году Cysyk et al. описали успешную имплантацию CPAD в модель выживания овец по Фонтану14,15. В их исследовании заполненные жидкостью линии контроля давления были размещены в SVC, IVC, PA и левом предсердии и выведены через заднюю стенку грудной клетки для получения непрерывных измерений давления в течение 30-дневного периода исследования. Хотя этот метод был в значительной степени достаточным для целей их исследования, они отметили проблемы с миграцией катетера. При долгосрочном сборе данных более 30 дней более предпочтительным может оказаться использование беспроводной телеметрической системы.
Ни у одной из овец, которым имплантировали телеметрическое устройство, не возникло серьезных осложнений в результате процедуры. Тем не менее, было обнаружено, что электрод ЭКГ разъелся через кожу одной овцы в месте зажившего разреза через несколько недель после операции. Считается, что это связано с пролежней, поскольку овцы обычно лежат в положении лежа на грудине, а вес их тела приходится на переднюю грудину над местами, где подкожно были расположены отведения ЭКГ. Поэтому, чтобы избежать эрозии отведений ЭКГ, отведения ЭКГ располагались латерально, а не прямо над грудиной у будущих овец, подвергающихся имплантации устройства, и с тех пор ни одна другая овца не сталкивалась с этой проблемой.
Необходимо выполнить несколько шагов, чтобы показания давления были такими же точными. Во-первых, телеметрическое устройство должно быть обнулено до атмосферного давления на плоской поверхности так, чтобы кончики катетеров находились на одном уровне с корпусом устройства, пока оно находится в оригинальной упаковке. Перед введением чувствительных к давлению катетеров в кровеносный сосуд необходимо заполнить кончики катетеров несжимаемым гелем с высокой вязкостью, следя за тем, чтобы внутри прозрачного геля не было пузырьков воздуха. Наконец, важно обратить внимание на расположение корпуса устройства по отношению к кончику катетера, так как разница в высоте может исказить измерения давления. Мы решили разместить корпус устройства над нижней частью живота или у основания шеи позади лопатки так, чтобы он находился примерно на том же уровне, что и кончик катетера в брюшной НПВ или грудной ВПВ, соответственно, когда овца стояла прямо.
Следует отметить, что мы также расположили корпус телеметрического устройства на расстоянии не менее 15 см от области интереса, включая сердце, большие сосуды и печень, чтобы свести к минимуму количество артефактов, которые оно может произвести при будущей магнитно-резонансной томографии. Наконец, в левую сонную артерию и вену IJ были введены катетеры, чувствительные к давлению, чтобы в будущем можно было выполнять процедуры катетеризации через правую вену IJ.
В настоящее время при использовании беспроводных телеметрических систем в том виде, в котором они описаны, остаются некоторые ограничения. Следует отметить, что срок службы батареи устройства составляет 84 дня. После имплантации аккумулятор устройства нельзя заряжать или заменять. Тем не менее, устройства могут быть выключены и снова включены в периоды времени, в течение которых требуется сбор данных для продления срока их использования. Кроме того, было замечено, что измерения венозного давления варьировались в зависимости от положения животного, и неясно, было ли это связано с истинными изменениями внутривенного давления или изменениями в положении корпуса устройства относительно кончиков катетера. Более того, в то время как тела телеметрических устройств располагались примерно на том же уровне, что и кончики катетеров в IVC или SVC, когда животные находились в вертикальном положении, различия в росте сохранялись из-за анатомических ограничений. Для шейного имплантата корпус устройства располагался выше, чем кончик катетера в ИВВ, а для пахового имплантата корпус устройства располагался ниже, чем кончик катетера в НПВ. Тем не менее, изучение общих тенденций в значениях давления может дать решающее представление о любых гемодинамических изменениях, которые могут возникнуть. Дальнейший анализ долгосрочных данных, собранных этими телеметрическими системами, будет необходим для достижения более полного понимания хронической физиологии Фонтена и механизмов отказа Фонтена. Дополнительные процедуры катетеризации, выполняемые после операции, также потребуются для проверки точности телеметрических выходных данных и выявления возможного дрейфа датчика с течением времени. Наконец, смещение кончиков катетеров устройства в результате соматического роста является потенциальной проблемой, особенно когда телеметрические блоки имплантируются молодым животным. Расположение кончиков рентгеноконтрастного катетера может быть установлено и подтверждено во время послеоперационных процедур катетеризации.
Беспроводные телеметрические системы позволяют осуществлять непрерывный сбор гемодинамических данных в режиме реального времени со свободно движущихся крупных моделей животных. Хирургическая имплантация этих устройств с размещением чувствительных к давлению катетеров в НПВ и СВЦ, а также брюшной и восходящей аорты безопасна и осуществима.
Раскрытие информации
Этот проект был профинансирован организацией Additional Ventures Cures Collaborative, Пало-Альто, Калифорния.
Благодарности
Мы ценим преданный своему делу ветеринарный персонал в Центре исследований животных. Мы также хотим выразить нашу благодарность Мэри Уокер, доктору ветеринарных наук, магистру медицины, за ее бесценный опыт и бдительную заботу на протяжении всего исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution | Baxter Healthcare Corporation | Pharmacy | Intraoperative fluid resuscitation and wound rinse |
| 16 G intravenous catheter | BD | 382259 | For fluid and drug administration |
| 22 G intravascular catheter | BD | 381423 | For arterial blood pressure monitoring |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated clotting time |
| Backhaus towel clamp | Medline | MDS1411111 | To affix sterile drape |
| Banamine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 50 mg/mL, dose 2.2 mg/kg |
| Blood pressure cuff | Royal Philips | 9.89803E+11 | Non-invasive blood pressure monitoring |
| Bupivacaine hydrochloride | Hospira Pharmaceuticals | Pharmacy | Local anesthetic: concentration 2.5 mg/mL, dose 2.5 mg/kg |
| Buprenorphine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 0.3 mg/mL, dose 0.03 mg/kg |
| Castroviejo needle holder | Medline | MDS0750386 | Needle holder when suturing blood vessels |
| Cautery cleaner pad | Cardinal Health | 300-2SS | To clean cautery pencil tip |
| Cautery pencil | Medline | ESRK3002L | For dissection using electrocautery |
| Cefazolin | Hospira Pharmaceuticals | Pharmacy | Antibiotic prophylaxis |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray for intubation |
| Chloraprep | BD | 930825 | Topical antiseptic |
| Debakey atraumatic forceps | Medline | MDS1130630F | For tissue handling |
| Diazepam | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 5 mg/mL, dose 0.5 mg/kg |
| ECG leads | 3M | 2570 | ECG monitoring |
| Endotracheal tube, size 8-9 | Covidien | 86452, 86114, or 86454 | To secure airway |
| Hartmann hemostatic forceps | Medline | MDS1221109 | To clamp blood vessels and hold small sutures |
| Heparin | Hospira Pharmaceuticals | Pharmacy | Anticoagulant: 1,000 USP units/mL |
| Pressure transducer kit | Edwards Lifesciences | VSYPX12N | For arterial blood pressure monitoring |
| Pulse oximeter lingual clip | Nellcor | PO736 | For pulse oximetry |
| Isoflurane | Baxter Healthcare Corporation | Pharmacy | Anesthetic: dose 1-3% |
| Kantrowitz forcep (right angle) | Medline | MDS1243528 | For blunt dissection around blood vessels |
| Ketamine | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 100 mg/mL, dose 4 mg/kg |
| Laparotomy drape | Medline | DYNJP3008 | Sterile drape |
| Lubricating jelly | Medline | MDS0322273Z | Endotracheal tube lubricant |
| Mayo Hegar needle holder | Medline | MDS2418420F | Needle holder when suturing soft tissue |
| Mayo scissors | Medline | MDS0816121 | To cut suture |
| Metzenbaum curved scissors | Medline | MDS3223226 | For sharp dissection |
| Needles and syringes | Cardinal Health | 309604 | For intravenous and subcutaneous drug administration |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| Perma-Hand silk suture | Ethicon | C016D | For blood vessel ligation and attachment of the telemetry device subcutaneously |
| PhysioTel Digital wireless telemetry device | Data Sciences International | L21 model | Wireless telemetry device implant |
| Pierce microforceps | Medline | MDG384908 | Small needle handling |
| Plastic tourniquet and suture snare | Medtronic | 79013 | To facilitate hemostasis during vessel cannulation |
| Pressure bag | Carefusion | 64-10029 | For arterial blood pressure monitoring |
| Prolene 6-0 suture | Ethicon | 8307H | Purse string stitch for vessel cannulation |
| Propofol | Fresenius Kabi | Pharmacy | Anesthetic: concentration 10 mg/mL, dose 20-45 mg/kg/h |
| Scalpel #10 blade | Medline | MDS15310 | For skin incisions |
| Scalpel #11 blade | Medline | CISION11CS | For incision into blood vessels |
| Schnidt tonsil forceps | Medline | MDS5018719 | For blunt dissection through subcutaneous tissue |
| SoftCarry stretcher | Four Flags Over Aspen | SSTR-4 | For animal transportation |
| Sterile disposable OR towel | Medline | MDT2168201 | Sterile drape |
| Sterile bowl | LSL Industries | 5232 | To hold saline solution |
| Sterile cotton X-ray detectable gauze sponge | Medline | NON21430LF | Fluid absorption |
| Orogastric tube | Jorgensen Lab, Inc. | J0348R | For stomach and rumen decompression |
| T-port | Medline | DYNDTN0001 | Intravenous catheter tubing connector |
| Urine drainage bag | Covidien | 3512 | Connects to orogastric tube to collect gastric fluids |
| Veterinary trocar with stylet | Braintree Scientific, Inc. | TRO-STY 7B-12 | To guide telemetry wires through subcutaneous tissue |
| Vicryl 2-0 suture | Ethicon | VCPB269H | Closure of subcutaneous soft tissue |
| Vicryl 3-0 suture | Ethicon | VCPB416H | Closure of deep dermal layer |
| Vicryl 4-0 suture | Ethicon | J494H | Closer of subcuticular layer |
| Warming blanket | Jorgensen Lab, Inc. | J1034B | To maintain animal's body temperature |
| Weitlander retractor | Teleflex Medical | 165358 | For wound retraction |
| Yankauer bulb tip suction | Medline | DYND50138 | Sterile waste management |
Ссылки
- Fontan, F., Baudet, E. Surgical repair of tricuspid atresia. Thorax. 26 (3), 240-248 (1971).
- Attanavanich, S., Limsuwan, A., Vanichkul, S., Lertsithichai, P., Ngodngamthaweesuk, M. Single-stage versus two-stage modified fontan procedure. Asian Cardiovasc Thorac Ann. 15 (4), 327-331 (2007).
- Bove, E. L., Lloyd, T. R. Staged reconstruction for hypoplastic left heart syndrome. Contemporary results. Ann Surg. 224 (3), discussion 394-385 387-394 (1996).
- Iskander, C., et al. Comparison of morbidity and mortality outcomes between hybrid palliation and norwood palliation procedures for hypoplastic left heart syndrome: Meta-analysis and systematic review. J Clin Med. 13 (14), 4244(2024).
- Salik, I., Mehta, B., Ambati, S. Bidirectional Glenn Procedure or Hemi-Fontan. , Statpearls. Treasure Island, FL. (2024).
- Daley, M., D'udekem, Y. The optimal Fontan operation: Lateral tunnel or extracardiac conduit. J Thorac Cardiovasc Surg. 162 (6), 1825-1834 (2021).
- Jalal, Z., et al. Role and applications of experimental animal models of Fontan circulation. J Clin Med. 13 (9), 2601(2024).
- Al Balushi, A., Mackie, A. S. Protein-losing enteropathy following Fontan palliation. Can J Cardiol. 35 (12), 1857-1860 (2019).
- Emamaullee, J., et al. Fontan-associated liver disease: Screening, management, and transplant considerations. Circulation. 142 (6), 591-604 (2020).
- Mazza, G. A., Gribaudo, E., Agnoletti, G. The pathophysiology and complications of Fontan circulation. Acta Biomed. 92 (5), e2021260(2021).
- Schwartz, I., Mccracken, C. E., Petit, C. J., Sachdeva, R. Late outcomes after the Fontan procedure in patients with single ventricle: A meta-analysis. Heart. 104 (18), 1508-1514 (2018).
- Zafar, F., et al. Long-term kidney function after the Fontan operation: Jacc review topic of the week. J Am Coll Cardiol. 76 (3), 334-341 (2020).
- Van Puyvelde, J., et al. Creation of the Fontan circulation in sheep: A survival model. Interact Cardiovasc Thorac Surg. 29 (1), 15-21 (2019).
- Cysyk, J., et al. Chronic in vivo test of a right heart replacement blood pump for failed Fontan circulation. ASAIO J. 65 (6), 593-600 (2019).
- Cysyk, J. P., et al. Miniaturized Fontan circulation assist device: Chronic in vivo evaluation. ASAIO J. 67 (11), 1240-1249 (2021).
- D'udekem, Y., et al. Validating the concept of mechanical circulatory support with a rotary blood pump in the inferior vena cava in an ovine Fontan model. Bioengineering (Basel). 11 (6), 594(2024).
- Granegger, M., et al. Feasibility of an animal model for cavopulmonary support with a double-outflow pump. ASAIO J. 69 (7), 673-680 (2023).
- Wei, X., et al. Mechanical circulatory support of a univentricular Fontan circulation with a continuous axial-flow pump in a piglet model. ASAIO J. 61 (2), 196-201 (2015).
- Zhu, J., et al. Cavopulmonary support with a microaxial pump for the failing Fontan physiology. ASAIO J. 61 (1), 49-54 (2015).
- Kelly, J. M., et al. Investigation of a chronic single-stage sheep Fontan model. JTCVS Open. 21, 268-278 (2024).
- Anderson, N. H., et al. Telemetry for cardiovascular monitoring in a pharmacological study: New approaches to data analysis. Hypertension. 33 (1 Pt 2), 248-255 (1999).
- Kearney, K., Appleby, C., Kieper, J., Atterson, P. Comparative analysis of data sciences international PhysioTel™ D70 and PhysioTel™ digital telemetry platforms. J Pharmacol Toxicol Methods. 81, 364-365 (2016).
- Physiotel digital l series. , At https://www.datasci.com/products/implantable-telemetry/large-animal/physiotel-digital-l (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены