Method Article
Пространственный анализ высокого разрешения уровней экспрессии генов в сухожилиях
В этой статье
Резюме
В этой статье описывается, как выполнить оптимизированный протокол in situ для сухожилий. В этом методе обсуждается препарирование тканей, пермеабилизация среза, дизайн зонда и методы усиления сигнала.
Аннотация
В последние годы было разработано множество протоколов для транскриптомики высокого разрешения во многих различных областях медицины и биологии. Тем не менее, богатые матриксом ткани, в частности сухожилия, были оставлены из-за их малого количества клеток, низкого количества РНК на клетку и высокого содержания матрицы, что затрудняло их анализ. Одним из последних и наиболее важных инструментов для работы с одиночными клетками является пространственный анализ уровней экспрессии генов в сухожилиях. Эти пространственные инструменты РНК имеют особенно большое значение для сухожилий для определения местоположения конкретных клеток новых и неизвестных популяций, проверки результатов секвенирования РНК-клеток одиночных клеток и добавления гистологического контекста к данным секвенирования РНК одиночных клеток. Эти новые методы позволят проводить анализ РНК в клетках с исключительной чувствительностью и обнаруживать одномолекулярные РНК-мишени на уровне одной клетки, что поможет молекулярно охарактеризовать сухожилия и будет способствовать исследованию сухожилий.
В этой методической статье мы сосредоточимся на доступных методах анализа пространственных уровней экспрессии генов на гистологических срезах с использованием новых тестов гибридизации in situ для обнаружения целевой РНК в интактных клетках на уровне одиночных клеток. Во-первых, мы сосредоточимся на том, как подготовить ткань сухожилия к различным доступным анализам и как усилить сигналы, специфичные для мишени, без фонового шума, но с высокой чувствительностью и высокой специфичностью. Затем в статье будут описаны конкретные методы пермеабилизации, различные конструкции зондов и стратегии усиления сигнала, доступные в настоящее время. Эти уникальные методы анализа уровней транскрипции различных генов в разрешении одиночных клеток позволят идентифицировать и охарактеризовать клетки сухожильной ткани в молодых и пожилых популяциях различных животных моделей и тканей сухожилий человека. Этот метод также поможет проанализировать уровни экспрессии генов в других богатых матриксом тканях, таких как кости, хрящи и связки.
Введение
Сухожилия – это соединительные ткани, которые обеспечивают передачу силы между мышцами и костью1. В процессе развития осевые теноциты происходят из мезенхимальных клеток в склеротоме сомитов2; сухожилия конечностей отходят от мезодермы латеральной пластины; а краниальные сухожилия возникают из линии черепного нервного гребня 3,4. Сухожилие может характеризоваться экспрессией транскрипционного фактора5 склеракс, хотя несколько маркеров также играют ключевую роль в развитии сухожилий, включая теномодулин, ирокез и раннюю реакцию роста 1/2 6,7,8,9.
Несмотря на небольшое количество известных маркеров сухожилия, в целом, более глубокая характеристика сухожилия остается сложной задачей, поскольку сухожилие содержит клетки, которые охватывают градиент биомеханических свойств. От миотендинозного соединения, сухожильного среднего тела и более кальцинированного энтезиса сухожильные клетки находятся во внеклеточных матрицах, которые различаются по свойствам растяжения. Поскольку сухожилие должно выдерживать растягивающее напряжение, вызванное разницей в механической прочности между мягкими и твердыми тканями, пространственная организация клеток в сухожилии особенно важна для его функции. Тем не менее, мало что известно об этих субпопуляциях сухожилий.
Для начала выяснения субпопуляций клеток можно использовать множество пространственных транскриптомных инструментов с высоким разрешением, включая, помимо прочего, Seq РНК одиночных клеток или гибридизацию in situ . Однако, хотя эти анализы пространственного профилирования помогают выявить экспрессию РНК в ткани после микродиссекции или разреза, эти методы могут быть сложными при выполнении на сухожильной ткани. Сухожилия представляют собой богатые матриксом ткани, состоящие почти на 86% из коллагена по сухоймассе10, что затрудняет извлечение клеток для секвенирования. Из-за сложностей при выделении клеток из матрикса, гипоклеточной природы сухожилия11 и относительно низкого количества РНК, сухожилие является сложной тканью для анализа.
В этой статье мы представляем метод оптимизации новых тестов гибридизации in situ для их использования для сухожилий путем предоставления методов подготовки тканей, пермеабилизации и дизайна зондов. В сочетании с существующими технологиями секвенирования это может помочь исследователям пространственно охарактеризовать субпопуляции сухожилий у развивающихся, взрослых или поврежденных сухожилий с повышенной чувствительностью и специфичностью анализа.
протокол
Все эксперименты на животных проводились в соответствии с рекомендациями Институционального комитета по уходу за животными и их использованию (IACUC) и AAALAC. Эксперименты проводились в соответствии с утвержденным протоколом #2013N000062 в Массачусетской больнице общего профиля. В этом исследовании использовались мыши C57BL/J6 (в возрасте 5 недель и P0). Подробные сведения обо всех материалах, реагентах и инструментах, используемых в этом протоколе, см. в Таблице материалов .
1. Пробоподготовка и фиксация
- Усыпляйте мышей в камереCO2 с последующим вывихом шейки матки в качестве вторичного метода эвтаназии. Затем с помощью ножниц разрежьте задние конечности мыши вдоль тазобедренного сустава12. В сцинтилляционный флакон погрузите заднюю конечность мыши в достаточное количество 4% раствора параформальдегида (PFA), чтобы полностью покрыть образец, и зафиксируйте ткань на 24 часа.
ПРИМЕЧАНИЕ: Вместо 4% PFA для фиксации также можно использовать 10% формалин. После фиксации образец может храниться в фосфатно-солевом буфере (PBS) до дальнейшей обработки. Фиксируя всю заднюю конечность, мы можем сохранить напряжение на сухожилии и имеем возможность исследовать энтезис, сухожилие в средней части тела или миотендинозное соединение. - После извлечения PFA из сцинтилляционного флакона промойте образец в течение 3 x 10 минут 1x PBS, добавив достаточное количество PBS, чтобы покрыть образец. Затем погрузите задние конечности в 0,5 М ЭДТА при температуре 4 °С с перемешиванием в течение 1-2 недель, заменяя на свежие ЭДТА каждые 2-3 дня.
- После удаления ЭДТА промойте образец в течение 3 x 10 минут с помощью 1x PBS, обезвожьте образцы в 70% EtOH и погрузите их в парафин в желаемой ориентации. Используйте традиционные методы среза FFPE для разреза ткани толщиной 3 мкм и переноса срезов на обработанное заряженное предметное стекло микроскопа (см. Таблицу материалов)13.
ПРИМЕЧАНИЕ: Срезы можно хранить при температуре 4 °C перед переходом к следующим этапам. - Депарафинизация
- Выпекайте предметные стекла на горячей плите при температуре 60 °C в течение 1 часа, а затем дайте предметным стеклам нагреться до комнатной температуры (RT). Чтобы удалить парафин со слайдов, поместите слайды на решетку для слайдов и опустите их в тарелку для окрашивания, наполненную ксилолом. Повторите в свежем ксилоле в течение 3 х 5 минут.
ВНИМАНИЕ: Ксилол опасен; Обращайтесь с осторожностью. - Чтобы увлажнить секции, погрузите предметные стекла в следующие виды на 5 минут за промывку, все при RT: простирайте 2 раза в 100% EtOH, 1x в 75% EtOH, разбавленном в dH2O, 1x в 50% EtOH, разбавленном PBS, 1x в 25% EtOH, разбавленном в PBS, и 2x в PBS.
ПРИМЕЧАНИЕ: Все этапы регидратации выполняются с помощью слайдов на решетке для слайдов и с помощью различных растворов EtOH при окрашивании посуды.
- Выпекайте предметные стекла на горячей плите при температуре 60 °C в течение 1 часа, а затем дайте предметным стеклам нагреться до комнатной температуры (RT). Чтобы удалить парафин со слайдов, поместите слайды на решетку для слайдов и опустите их в тарелку для окрашивания, наполненную ксилолом. Повторите в свежем ксилоле в течение 3 х 5 минут.
2. Адаптация протокола 14 к RNAscope (коммерциализированному ISH)
- Подготовка растворов и зондов
- Готовят раствор ТЭГ для предварительной обработки срезанных образцов путем соединения 25 мМ Трис-HCl при рН 8, 10 мМ ЭДТА и 50 мМ глюкозы. Сделайте достаточный объем для обработки всех образцов или заготовьте излишки; фильтровать-стерилизовать и хранить при РТ; Перед использованием раствор тщательно перемешать.
- Подготовьте достаточное количество буфера для стирки 1x (см. Таблицу материалов) для всех стирок и храните его при RT.
- На водяной бане или в инкубаторе при температуре 40 °C прогрейте интересующие зонды в течение 10 минут. Затем подготовьте зонды в соответствии с протоколом ISH14.
- Предварительная обработка образцов
- Вместо использования рекомендованного раствора для предварительной обработки погрузите предметные стекла в чашку для окрашивания, содержащую буфер TEG, на 4 часа при температуре 60 °C.
ПРИМЕЧАНИЕ: Инкубация буфера ТЭГ может быть продлена на срок до 6 часов, если ткань особенно плотная или если извлечение антигена из интересующего вас мотива связывания РНК является сложной задачей. В этом случае здесь можно добавить точку остановки, высушить предметные стекла и хранить их в холодильнике при температуре 4 °C в течение ночи. - Извлеките образцы из буфера и дайте им высохнуть. Затем обведите образцы гидрофобной барьерной ручкой, погрузите их в другую чашку для окрашивания, содержащую протеазу IV, и инкубируйте в духовке в течение 45 минут при 40 °C.
ПРИМЕЧАНИЕ: Мы рекомендуем протеазу внутривенно для взрослых мышей. При использовании более молодых мышей, таких как P0, мы рекомендуем использовать более мягкий фермент, такой как протеаза III, в течение 30 минут. При устранении неполадок для разных возрастов наблюдайте за целостностью сухожилия и проверяйте на деградацию. Если ткань диссоциирует или деградирует, уменьшите время инкубации или измените используемую протеазу. - Снова промойте образцы в буфере TEG в течение 30 минут, а затем гибридизируйте зонды в соответствии с протоколом ISH14.
- Добавьте 50-100 мкл монтажного реагента поверх образца. Наденьте покровное стекло поверх образцов для микроскопии. При съемке используйте большое увеличение (объектив 40x или выше) для просмотра сигнала.
- Вместо использования рекомендованного раствора для предварительной обработки погрузите предметные стекла в чашку для окрашивания, содержащую буфер TEG, на 4 часа при температуре 60 °C.
3. Адаптация протокола HCR ISH15
- Постфиксация
- Приготовьте 4% PFA (в PBS), раствор PBT (0,1% Tween-20 в PBS) и протеиназу K в PBS (исходная концентрация 10 мг/мл, конечная концентрация 5 мкг/мл).
- Для начала первого постфиксного шага погрузите предметные стекла в посуду для окрашивания, содержащую 4% ПФА, на 5 минут; затем удалите 4% раствор PFA и храните его для использования на последующих этапах. Промойте предметные стекла в течение 2 х 5 минут в растворе PBT и удалите раствор PBT. Поместите предметные стекла в форму для окрашивания, содержащую раствор протеиназы К (5 мкг/мл) на 5 минут и промойте их в растворе PBT 2 x 5 минут.
- Начните второй этап постфиксации и погрузите предметные стекла в 4% PFA на 5 минут.
ПРИМЕЧАНИЕ: Это те же 4% PFA, которые были сэкономлены на шаге 3.1.2. - Промойте предметные стекла в течение 3 х 5 минут в растворе PBT.
ПРИМЕЧАНИЕ: Все этапы постфиксации выполняются с помощью предметных стекол на решетке для слайдов и в окрашивании посуды, содержащей соответствующие растворы.
- Ацетилирование
- Приготовьте раствор ацетилирования, содержащий 625 мкл ангидрида уксусной кислоты, 3,3 мл буфера 1 М триэтаноламин (TEA) и 246 мл ddH2O. Обязательно хорошо перемешайте и используйте сразу после приготовления.
- Поместите предметные стекла в раствор ацетилирования на 10 минут, а затем промойте 3 x 5 минут в растворе PBT. Промойте предметные стекла в ddH2O и дайте им высохнуть на воздухе в течение 30 минут. Затем обведите образцы гидрофобной барьерной ручкой.
ПРИМЕЧАНИЕ: Все этапы ацетилирования выполняются с помощью предметных стекол на решетке для слайдов и при окрашивании посуды, содержащей соответствующие растворы
- Гибридизация
- Разогрейте буфер для гибридизации до 37 °C и прогрейте увлажненную камеру до 37 °C.
ВНИМАНИЕ: Буфер содержит формамид, опасный материал. Если предметные стекла недостаточно сухие, промокните края лабораторной салфеткой, чтобы удалить излишки dH2O. - Приготовьте зондовые растворы, добавив 0,4 пмоль каждой смеси зондов в 100 мкл буфера для гибридизации.
ПРИМЕЧАНИЕ: При использовании визуализации dHCR используйте более высокую концентрацию зонда для повышения эффективности гибридизации зонда. - Приготовьте 4 л буфера цитрата натрия хлорида натрия (20x SSC), смешав 3 М NaCl (701,1 г NaCl в конечном объеме 4 л) и 0,3 М M Na3CH6H5O7•2H2O (352,8 г), а затем отрегулируйте окончательный pH до 7 путем добавления HCl или 10 N NaOH. Добавьте достаточное количество H2O, чтобы получить 4 л. Приготовьте 5x SSCT, разбавив 20x SSC до 5x и добавив достаточное количество 10% Tween 20, чтобы оно составило 0,1% от общего объема.
- Добавьте в образец 200 μл буфера для гибридизации, поместите предметные стекла в увлажненную камеру и дайте предметным стеклам инкубироваться в течение 10 минут. Удалите раствор для гибридизации и слейте лишний буфер на предметном стекле, промокнув края лабораторной салфеткой.
- Добавьте 100 μл приготовленного раствора зонда поверх образца и наложите на образец покровную крышку. Выдерживать в духовке в течение ночи или в течение 12-16 часов в камере, увлажненной раствором, содержащим 5x SSC и 50% формамид. Установите температуру на 37 °C.
ПРИМЕЧАНИЕ: Поскольку инкубация происходит в течение ночи, добавление покровного стекла необходимо свести к минимуму испарение. - Оставьте аликвоту 5x раствора SSCT на водяной бане при температуре 37 °C, а вторую аликвоту при RT. Предусмотрите необходимые объемы этих аликвот на основе количества образцов и количества стирок на следующем этапе.
- Разогрейте буфер для гибридизации до 37 °C и прогрейте увлажненную камеру до 37 °C.
- Стирка
- Используя предварительно нагретый раствор 5x SSCT, приготовьте 75% буфер для стирки / 25% 5x SSCT, 50% буфер для стирки / 50% 5x SSCT и 25% буфер для стирки / 75% 5x SSCT.
- Чтобы удалить излишки щупов, погрузите предметные стекла последовательно на 15 минут за промывку при температуре 37 °C в 75% буфер для стирки/25% 5x SSCT, 50% буфер для стирки/50% 5x SSCT и 25% буфер для стирки/75% 5x SSCT. Дайте покровным листам отплыть от образцов.
- Инкубируйте предметные стекла 2 x 15 минут со 100% 5x SSCT, а затем погрузите их в 5x SSCT на 5 минут при RT.
ПРИМЕЧАНИЕ: Этапы мытья можно выполнять с помощью предметных стекол на решетке для слайдов и при окрашивании посуды, содержащей соответствующие растворы или добавленные растворы в виде капель.
- Усиление
- Приготовьте 6 пмоль шпильки h1 и 6 пмоль шпильки h2 путем мгновенного охлаждения 2 мкл 3 мкМ материала (нагрейте при 95 °C в течение 90 с и охладите до температуры RT). Во время этого процесса беречь шпильки от света.
ПРИМЕЧАНИЕ: Шпильки HCR h1 и h2 поставляются в буфере для хранения шпилек и готовы к мгновенному охлаждению. Защелкните охлажденные шпильки h1 и h2 в отдельных пробирках. - Высушите предметные стекла, промокнув их края лабораторной салфеткой. Затем добавьте 200 мкл амплификационного буфера поверх образца и поместите его в увлажненную камеру на 30 мин при RT. Приготовьте смесь шпилек, добавив шпильки с защелкой h1 и шпильки с защелкой h2 с защелкой к 100 мкл буфера для амплификации при RT.
- Снимите буфер для усиления и слейте лишнюю жидкость с предметного стекла, промокнув края лабораторной салфеткой. Добавьте 100 μЛ приготовленной ранее шпильной смеси и положите поверх образца парапленку. Инкубируйте предметные стекла в течение не менее 4 часов или в течение ночи в темной, увлажненной камере в режиме RT.
- Чтобы удалить лишние шпильки, погрузите предметные стекла в 5x SSCT в форму для окрашивания и выдерживайте при RT в течение 30 минут. Повторите стирку в свежем 5x SSCT в течение 30 минут, а третий раз в течение 5 минут.
- Высушите предметные стекла, промокнув края лабораторной салфеткой, и добавьте 50-100 мкл монтажного реагента поверх образца. Наденьте покровное стекло поверх образцов для микроскопии. При съемке используйте большое увеличение (объектив 40x или выше) для просмотра сигнала.
- Приготовьте 6 пмоль шпильки h1 и 6 пмоль шпильки h2 путем мгновенного охлаждения 2 мкл 3 мкМ материала (нагрейте при 95 °C в течение 90 с и охладите до температуры RT). Во время этого процесса беречь шпильки от света.
Результаты

Рисунок 1: Экспрессия Poly A РНК в ахилловом сухожилии взрослой мыши с помощью RNAScope. Репрезентативное изображение успешного мечения Poly A в ахилловом сухожилии мыши (левая панель) с использованием коммерциализированного анализа ISH. Колокализация с DAPI подтверждает специфику преобразователя (средняя и правая панели), позволяя контролировать фоновый шум. Изображения были получены с 63-кратным увеличением с помощью конфокального микроскопа Leica SPE. Масштабные линейки = 20 μм. Сокращения: ISH = гибридизация in situ; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
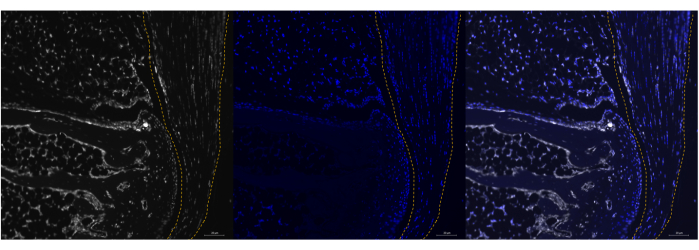
Рисунок 2: Экспрессия Poly A РНК в ахилловом сухожилии мыши P0 с помощью RNAScope. Репрезентативное изображение успешного мечения Poly A в пяточной кости мыши P0 (левая панель) с использованием коммерциализированного анализа ISH. Колокализация с DAPI и минимальный фоновый шум подтверждают специфичность преобразователя (средняя и правая панели). Сухожилие обозначено пунктирной линией. Изображения были получены с помощью микроскопа ZEISS Axio Imager. Масштабные линейки = 20 μм. Сокращения: ISH = гибридизация in situ; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Этот протокол поможет исследователям использовать коммерчески доступные инструменты гибридизации in situ и адаптировать их для использования в сухожильной ткани взрослого человека. В конечном итоге это позволяет нам анализировать уровни транскрипции различных генов в пространственно информированном разрешении отдельных клеток. Успешный запуск анализа ISH будет иметь высокую специфичность для интересующих целей и минимальный фоновый шум. Протокол может быть использован как для взрослых, так и для неонатальных ахилловых сухожилий (рис. 1, рис. 2, рис. 3 и рис. 4). Poly A может быть использован в качестве контроля для подтверждения успешного прогона, качественно подтверждая наличие ожидаемых уровней РНК в образце.
Тем не менее, существует несколько причин, по которым протоколы ISH могут нуждаться в устранении неполадок. Например, на рисунке 5 показана недостаточная зондовая гибридизация Poly A в сухожилии, так что несколько областей сухожилия не имели сигнала Poly A, несмотря на противодействие DAPI, показывающее, что клетки действительно присутствуют. Более того, если ткань переваривается на постфиксных стадиях HCR за счет увеличенного времени инкубации протеиназы К (рис. 6) или на стадиях предварительной обработки в RNAScope при длительной внутривенной инкубации протеазы, то морфология ткани может быть нарушена. Наконец, на рисунке 7 показан пример того, как будет выглядеть отрицательный контроль, если зонд для гибридизации РНК не будет добавлен, но при этом будет использоваться ядерное противодействие.

Рисунок 3: Экспрессия РНК склераксии в ахилловом сухожилии взрослой мыши с использованием HCR. Репрезентативное изображение успешного мечения РНК склераксии у ахиллова сухожилия взрослой мыши (левая панель) с использованием HCR. DAPI используется в качестве ядерного противоударника (средняя панель). Колокализация с DAPI подтверждает специфику зонда (правая панель). Изображения были получены с 63-кратным увеличением с помощью конфокального микроскопа Leica SPE. Масштабные линейки = 20 μм. Сокращения: HCR = цепная реакция гибридизации; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
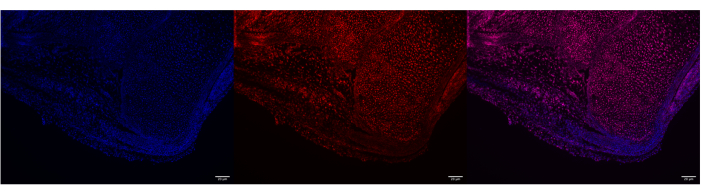
Рисунок 4: Экспрессия Poly A РНК в ахилловом сухожилии мыши P0 с использованием HCR. Репрезентативное изображение мечения Poly A РНК в ахилловом сухожилии мыши P0 с использованием HCR. DAPI и Poly A маркируют кость и ахиллово сухожилие в пяточной кости (левая и правая панели соответственно). Колокализация зондов DAPI и Poly A в обеих тканях и минимальный фоновый шум подтверждают успешный запуск HCR (правая панель). Изображения были получены с помощью микроскопа ZEISS Axio Imager. Масштабные линейки = 20 μм. Сокращения: HCR = цепная реакция гибридизации; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
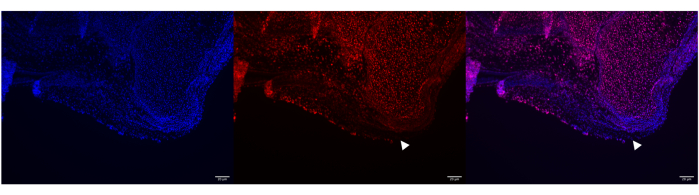
Рисунок 5: Неудачный запуск HCR с зондами Poly A RNA в ахилловом сухожилии мыши P0. Репрезентативное изображение неудачного мечения Poly A РНК в ахилловом сухожилии мыши P0 с использованием HCR. DAPI мечет ядра в кости и сухожилии пяточной кости (левая панель), но зонд Poly A HCR не проникает через все сухожилие (средняя и правая панели, см. белые стрелки). Тем не менее, Poly A успешно пометил большую часть кости. Изображения были получены с помощью микроскопа ZEISS Axio Imager. Масштабные линейки = 20 μм. Сокращения: HCR = цепная реакция гибридизации; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
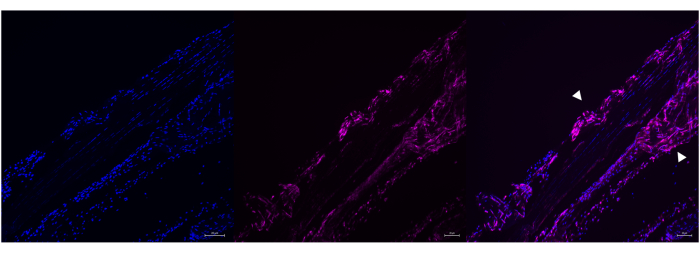
Рисунок 6: Пример мечения HCR Poly-A у переваренного ахиллова сухожилия взрослой мыши. Репрезентативное изображение мечения Poly A РНК в переваренном ахилловом сухожилии взрослой мыши с использованием HCR. Poly A и DAPI правильно колокализуются в этом образце (правая панель), но типичная одноосная морфология сухожилия нарушена (белые стрелки). Изображения были получены с помощью микроскопа ZEISS Axio Imager. Масштабные линейки = 20 μм. Сокращения: HCR = цепная реакция гибридизации; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Отрицательный контроль поли А РНК у взрослой мыши. Репрезентативное изображение отрицательного контроля для мечения Poly A РНК, в которое Poly A зонд не был добавлен, но были добавлены зонды амплификации. Как и ожидалось, DAPI успешно пометил ядро (левую панель), но сигнал для Poly A (средняя панель) отсутствовал. Изображения были получены с помощью микроскопа ZEISS Axio Imager. Масштабные линейки = 20 μм. Сокращение: DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этой статье мы описываем модификации, сделанные для использования существующих инструментов ISH таким образом, чтобы их можно было использовать в сухожильной ткани с высокой степенью специфичности и чувствительности. Поскольку сухожилие является тканью с высокой плотностью матрикса, часто необходимо вносить коррективы в протокол для достижения одинаковой степени проникновения и специфичности зонда. Эти специфические методы пермеабилизации и стратегии усиления сигнала сухожильной ткани являются неотъемлемой частью повышения эффективности обсуждаемых протоколов ISH. Без этих шагов зондам сложно поддерживать сильное и специфическое взаимодействие с РНК в сухожилии.
В РНК-скопе14 необходимо внести коррективы в используемый буфер перед обработкой, чтобы протокол работал более эффективно в ткани сухожилия. В частности, использование TEG Buffer в качестве предварительной обработки улучшает доступ зондов к целевой РНК. В дополнение к буферу ТЭГ, внутривенное введение протеазы продлевается сверх стандартного времени, так что его продолжительность составляет от 45 минут до 1 часа. В HCR15 длина промывок была увеличена, а постфиксные этапы были добавлены до начала анализа RNA-FISH. Постфиксные этапы включали добавление стадий инкубации в 4% PFA, PBT, протеиназу К и раствор ацетилирования. В совокупности эти модификации помогают улучшить доступ зонда к сухожильной РНК и снизить фоновый шум16,17. Однако, несмотря на то, что эти модификации протокола помогают повысить специфичность и чувствительность зондов, используемых при ISH, за счет модификации используемых растворов для предварительной обработки и добавления этапов постфиксации для повышения доступности связывания зонда с РНК, существуют ограничения, создаваемые конструкцией зондов.
Чтобы решить проблемы, связанные с доступностью РНК для зондов, можно внести дополнительные изменения для оптимизации анализов ISH. Если будет использоваться визуализация dHCR - метод цифрового абсолютного количественного определения мРНК15 - рекомендуется увеличить концентрацию зонда для повышения эффективности гибридизации зонда. Более того, использование более короткого периода на этапах амплификации гарантирует, что одномолекулярные точки будут ограничены дифракцией. Более длительные инкубационные периоды могут привести к более высокой аутофлуоресценции мышцы при визуализации. Если выбранное сухожилие плотнее и/или больше, чем ахиллово сухожилие взрослой мыши, мы рекомендуем увеличить продолжительность этапа фиксации 4% PFA.
Эти модификации вышеупомянутых коммерческих протоколов ISH наиболее полезны для тканей взрослых мышей или более плотных тканей, которые требуют более длительных этапов предварительной обработки или фиксации. Несмотря на то, что эти изменения в существующих протоколах помогают улучшить доступность зондов к РНК, некоторые зонды могут требовать более высокой концентрации или более длительного времени инкубации у старых мышей, чем у молодых мышей или у новорожденных, в зависимости от доступности целевых РНК-мотивов, с которыми зонды будут связываться в разных возрастных когортах. Что касается использования протеазы на этапах предварительной обработки РНК-скопа, мы рекомендуем использовать протеазу IV в течение 45 минут для сухожилий взрослых мышей и протеазу III в течение 30 минут для сухожилий новорожденных. Для оценки эффективности анализа, оценки любых корректировок в протоколе или для общего сравнения экспрессии в образцах может быть использовано несколько контрольных показателей. Например, зонд Poly A можно сравнить с ядерным противокрасителем, используемым для оценки специфичности прогона, для оценки распределения/деградации РНК в образце и для подтверждения того, что РНК была доступна для зондов. Аналогичным образом, зонды для генов уборки также могут служить в качестве контроля для доступа к доступности РНК. Позитивный контроль с мишенями, которые имеют известные паттерны экспрессии, помогает подтвердить специфичность, а отрицательный контроль поможет оценить любое потенциальное неспецифическое связывание.
В целом, поскольку разрабатывается несколько методов для лучшего понимания пространственного профиля экспрессии генов тканей, необходимы дополнительные методы для проверки результатов. В частности, такие анализы, как Seq РНК одиночных клеток, становятся популярными инструментами для оценки экспрессии генов, но их результаты должны быть изучены в пространстве с более высоким разрешением. Чтобы помочь в этом, можно использовать анализы ISH для лучшего понимания и проверки пространственного контекста транскриптомных данных, полученных с помощью более количественных анализов. В сухожилиях спаривание таких анализов поможет дополнительно охарактеризовать клетки, расположенные в энтезе, сухожильной середине тела и миотендинозном соединении, путем пространственной валидации маркеров, специфичных для уникальных клеточных популяций.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Авторы благодарят Дженну Гэллоуэй и сотрудников Galloway Lab за их поддержку и поощрение в разработке и устранении неполадок этих протоколов.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 M triethanolamine buffer | |||
| 10% Formalin solution | |||
| 10% Tween-20 | |||
| 20x Saline Sodium Citrate buffer | |||
| 4% PFA | |||
| ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 | ACD | 323100 | |
| Acetic Anhydride | |||
| Axio Imager Microscope | ZEISS | ||
| C57BL/J6 mice | JAX ID: 000664 | ||
| Coverslips | Fisher | 12-541-042 | |
| ddH2O | |||
| ETDA | Thermofisher | AM9262 | |
| EtOH | |||
| Glucose | VWR Chemicals BDH | BDH9230-500G | |
| HCR RNA-FISH Bundle | Molecular Instruments Inc. | ||
| HybEZ II Hybridization System | ACD | ||
| Immedge Barrier Pen | Vector Laboratories | H4000 | |
| Leica SPE Confocal Microscope | Leica | ||
| Parafilm | Fisher | ||
| Phosphate-buffered saline (PBS, 1x) | Invitrogen | AM9625 | Dilute 10x PBS in milli-Q water to get 1x solution |
| Protease IV | |||
| Proteinase K | Roche | 3115836001 | |
| RNAscope H2O2 and Protease Reagents | ACD | PN 322381 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V3 |
| RNAscope Multiplex Fluorescent Detection Kit | ACD | PN 323110 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 |
| RNAscope Target Retrieval reagents | ACD | 322000 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V4 |
| RNAscope Wash Buffer | ACD | PN 310091 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V5 |
| RNAscope Probe Diluent | ACD | 300041 | |
| Slide holder | StatLab | 4465A | |
| Staining Dish with Lid | StatLab | LWS20WH | |
| Superfrost Plus Microscope slides | Fisher | 1255015 | treated, charged slides |
| Tris-HCl | |||
| Xylene | Sigma-Aldrich | 534056-4L |
Ссылки
- Sharma, P., Maffulli, N. Tendon injury and tendinopathy: healing and repair. Journal of Bone and Joint Surgery. 87 (1), 187-202 (2005).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Noden, D. M. The role of the neural crest in patterning of avian cranial skeletal, connective, and muscle tissues. Developmental Biology. 96 (1), 144-165 (1983).
- Chen, J. W., Galloway, J. L. The development of zebrafish tendon and ligament progenitors. Development. 141 (10), 2035-2045 (2014).
- Schweitzer, R., et al. Analysis of the tendon cell fate using Scleraxis, a specific marker for tendons and ligaments. Development. 128 (19), 3855-3866 (2001).
- Tsai, S., Nödl, M., Galloway, J. Bringing tendon biology to heel: Leveraging mechanisms of tendon development, healing, and regeneration to advance therapeutic strategies. Developmental Dynamics. 250 (3), 393-413 (2021).
- Kannus, P., et al. Location and distribution of non-collagenous matrix proteins in musculoskeletal tissues of rat. The Histochemical Journal. 30 (11), 799-810 (1998).
- Kannus, P. Structure of the tendon connective tissue. Scandinavian Journal of Medicine & Science in Sports. 10 (6), 312-320 (2000).
- Thorpe, C. T., Birch, H. L., Clegg, P. D., Screen, H. R. C. The role of the non-collagenous matrix in tendon function. International Journal of Experimental Pathology. 94 (4), 248-259 (2013).
- Lin, T. W., Cardenas, L., Soslowsky, L. J. Biomechanics of tendon injury and repair. Journal of Biomechanics. 37 (6), 865-877 (2004).
- Grinstein, M., et al. A distinct transition from cell growth to physiological homeostasis in the tendon. eLife. 8, e48689 (2019).
- Villaseñor, S., Grinstein, M. Two-photon microscopy for the study of tendons. Journal of Visualized Experiments. , e65853 (2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. Journal of Visualized Experiments. (139), e58288 (2018).
- Wang, F., et al. RNAscope®: A Novel In Situ RNA Analysis Platform for Formalin-Fixed Paraffin-Embedded Tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Choi, H. M. T., et al. Third-generation situ hybridization chain reaction: multiplexed, quantitative, sensitive, versatile, robust. Development. 145 (12), 165753 (2018).
- Jackson, D. J., Herlitze, I., Hohagen, J. A whole mount in situ hybridization method for the gastropod mollusc Lymnaea stagnalis. Journal of Visualized Experiments. (109), e53968 (2016).
- Young, A. P., Jackson, D. J., Wyeth, R. C. A technical review and guide to RNA fluorescence in situ hybridization. PeerJ. 8, e8806 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены