Method Article
Генерация органоидов кровеносных сосудов человека из плюрипотентных стволовых клеток
В этой статье
Резюме
Этот протокол описывает генерацию самоорганизующихся кровеносных сосудов из плюрипотентных и индуцированных плюрипотентных стволовых клеток человека. Эти сети кровеносных сосудов демонстрируют обширную и связанную эндотелиальную сеть, окруженную перицитами, актином гладких мышц и непрерывной базальной мембраной.
Аннотация
Органоид определяется как сконструированная многоклеточная ткань in vitro , которая имитирует соответствующий орган in vivo , так что ее можно использовать для изучения определенных аспектов этого органа в чашке для культивирования тканей. Широта и применение исследований органоидов, полученных из плюрипотентных стволовых клеток человека (hPSC), значительно продвинулись вперед и включают мозг, сетчатку, слезный проток, сердце, легкие, кишечник, поджелудочную железу, почки и кровеносные сосуды, а также ряд других тканей. В частности, разработка методов генерации микрососудов человека открыла путь для моделирования развития кровеносных сосудов человека и заболеваний in vitro , а также для тестирования и анализа новых лекарств или тканевого тропизма при вирусных инфекциях, включая SARS-CoV-2. Сложные и длинные протоколы, лишенные визуального руководства, препятствуют воспроизводимости многих органоидов, полученных из стволовых клеток. Кроме того, неотъемлемая стохастичность процессов формирования органоидов и самоорганизации требует создания оптических протоколов для углубления понимания приобретения и программирования клеточной судьбы. Здесь представлен визуально управляемый протокол для генерации 3D-органоидов кровеносных сосудов человека (BVO), разработанных из hPSC. Представляя непрерывную базальную мембрану, эндотелиальные клетки сосудов и организованное сочленение с клетками фрески, BVO демонстрируют функциональные, морфологические и молекулярные особенности микроциркуляторного русла человека. Образование BVO инициируется путем образования агрегатов, за которым следует мезодерма и сосудистая индукция. Созревание сосудов и формирование сети инициируются и поддерживаются путем встраивания агрегатов в 3D-коллагеновую и солюбилизированную матрицу базальной мембраны. Сети сосудов человека формируются в течение 2-3 недель и могут быть дополнительно выращены в масштабируемых системах культивирования. Важно отметить, что BVO, трансплантированные мышам с ослабленным иммунитетом, анастомозируют эндогенное кровообращение мыши и попадают в функциональные артерии, вены и артериолы. Настоящий визуально управляемый протокол будет способствовать исследованиям органоидов человека, особенно в отношении кровеносных сосудов в нормальном развитии, васкуляризации тканей и заболеваний.
Введение
Сосудистая дисфункция и заболевания кровеносных сосудов проявляются выраженными осложнениями в функциях органов. Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти во всеммире1, а также основным фактором, способствующим увеличению расходов на здравоохранение в Соединенных Штатах. Число случаев сердечно-сосудистых заболеваний ежегодно увеличивается, и рост числа этих случаев происходит в более молодых возрастных группах (20-45 лет)2. Было разработано несколько моделей in vivo для изучения развития и созревания кровеносных сосудов, сосудистых заболеваний и эндотелиальной дисфункции 3,4. В настоящее время методы, объединяющие одиночные и множественные клетки, определенные по происхождению, полученные из стволовых клеток или выделенные из тканей взрослого человека in vivo, могут создавать сосудистые сети, которые воспроизводят аспекты сосудистой функции и анатомии человека 5,6. Кровеносные сосуды возникли как одна из первых функциональных систем во время развития мезодермы, и они организуются либо посредством процесса сборки, называемого «васкулогенезом», либо путем расширения и разветвления от ранее существовавших сосудов, что называется «ангиогенезом»7.
Используя возможности биологии развития и самоуправляемой сборки, Wimmer et al. сообщили о первых самоорганизующихся 3D-органоидах кровеносных сосудов человека из hPSC, которые демонстрируют функциональные, морфологические и молекулярные характеристики микроциркуляторного русла человека8. Подобно сосудистой сетичеловека 9, эти hBVO генерируются и присутствуют эндотелием, непрерывной базальной мембраной и окружающими клетками 8,10. hBVO могут быть трансплантированы in vivo и анастомозированы эндогенным кровообращением. Они также могут подвергаться созреванию in vitro и служить моделями сердечно-сосудистых заболеваний (например, диабета)8 или тканевого тропизма при вирусных инфекциях, таких как SARS-CoV-211. Несмотря на то, что ранее мы опубликовали письменный протокол10, не существует доступного видеопротокола для этого сложного метода.
Благодаря краткой ступенчатой прогрессии образование hBVO осуществляется путем формирования агрегатов, индукции мезодермы с использованием агониста WNT, Chiron (CHIR99021) и костного морфогенного белка - 4 (BMP4)12,13, сосудистой индукции с помощью фактора роста эндотелия сосудов A (VEGFA) и Forskolin (Fors)12 и встраивания в пользовательскую матрицупрорастания 8,10. Созревание сосудов и образование сетки следуют за встраиванием агрегатов в прорастающую матрицу. Эти сети сосудов человека формируются в течение 2-3 недель и могут быть удалены из матрицы прорастания и далее выращиваться в масштабируемых системах культивирования до 6 месяцев. Здесь проводятся процедуры под оптическим контролем для формирования и применения сосудистой сети, полученной из стволовых клеток человека.
протокол
Во всех экспериментах, проведенных в настоящем описании, использовалась коммерчески доступная линия ИПСК человека H9. Распространенные коммерчески и некоммерчески доступные линии плюрипотентных стволовых клеток человека (т.е. H9, NC8) также были протестированы и доказали свою эффективность для генерации органоидов кровеносных сосудов человека с использованием этого протокола. Для получения подробной информации, пожалуйста, обратитесь к нашим ранее опубликованным отчетам 8,10.
1. Рецептура сред и реагентов для генерации органоидов кровеносных сосудов человека
- Подготовьте агрегационную среду.
- Смешайте 40 мл нокаутирующего DMEM/F12 (среда с низкой осмоляльностью без L-глютамина или буфера HEPES, оптимизированного для роста ESC и iPSC человека), 10 мл заменителя нокаутирующей сыворотки (KOSR), 0,5 мл 200 мМ дипептида L-аланил-L-глутамина в 0,85% NaCl, 0,5 мл заменимых аминокислот (NEAA), 35 мкл бета-меркаптоэтанола (BME, 100 мкл 2-меркаптоэтанола в 10 мл стерильного PBS), и Y-27632 (клеточно-проницаемый и селективный ингибитор Rho-ассоциированной протеинкиназы, содержащей спиральную спираль [ROCK]14 [10 мМ] в соотношении 1:200) (см. Таблицу материалов).
- Приготовьте N2B27 (N2 и B27 дополняют основную среду).
- Смешайте 25 мл DMEM/F12, 25 мл нейробазальной среды, 1 мл добавки B27, 0,5 мл добавки N2, 250 мкл 200 мМ дипептида L-аланил-L-глутамина в 0,85% NaCl и 35 мкл бета-меркаптоэтанола (см. Таблицу материалов).
- Подготовьте среду для индукции мезодермы.
- Дополните среду N2B27 ChiR (12 мкМ, ингибитор GSK3a/b, стимулирующий индукцию мезодермы) и BMP-4 (30 нг/мл, активатор MSX2, индуцирующий линию мезодермы).
ПРИМЕЧАНИЕ: Запас (ChiR): 10 мМ (используйте 1:833 или 1,2 мкл / мл N2B27). Запас (BMP-4): 100 мкг/мл (используйте 1:3333 или 0,3 мкл/мл N2B27) (см. Таблицу материалов).
- Дополните среду N2B27 ChiR (12 мкМ, ингибитор GSK3a/b, стимулирующий индукцию мезодермы) и BMP-4 (30 нг/мл, активатор MSX2, индуцирующий линию мезодермы).
- Подготовьте сосудистую индукционную среду.
- Дополните среду N2B27 VEGFA (100 нг/мл) и форсколином (2 мкМ) (см. Таблицу материалов).
- Подготовьте внеклеточный матрикс (ECM).
- Используйте 1 мл ECM для одной скважины 12-луночной пластины (для заделки 30-50 агрегатов). Из 1 мл раствора ECM, используемого для каждой скважины, используйте 0,5 мл для создания нижнего слоя, «слоя 1», который будет служить фундаментом ECM, и 0,5 мл плюс заполнители для верхнего слоя, «слоя 2». Использование этого подхода обеспечивает, благодаря подвеске ECM, достаточное пространство и поддержку для прорастания сетей кровеносных сосудов человека во всех направлениях.
ПРИМЕЧАНИЕ: В целом, 1 мл ECM содержит 500 мкл очищенного бычьего коллагена типа I, 250 мкл солюбилизированного матрикса базальной мембраны, секретируемого клетками саркомы мыши Энгельбрета-Холма-Роя (см. Таблицу материалов), и 250 мкл раствора основного матрикса (этап 1.5.2). Приготовьте его свежим и держите на льду до готовности. - Чтобы приготовить основной матричный раствор для четырех 12-луночных планшетов (48 лунок), смешайте 5,627 мл 0,1 N NaOH, 2,498 мл 10x DMEM, 473 мкл HEPES, 368 мкл 7,5% бикарбоната натрия, 233 мкл 200 мМ дипептида L-аланил-L-глутамина в 0,85% NaCl и 3,451 мл F-12 Хэма (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Оставшийся раствор основной матрицы можно поместить в закрытую полипропиленовую коническую трубку высокой прозрачности объемом 50 мл и хранить при температуре 4 °C для использования до 2 месяцев.
- Используйте 1 мл ECM для одной скважины 12-луночной пластины (для заделки 30-50 агрегатов). Из 1 мл раствора ECM, используемого для каждой скважины, используйте 0,5 мл для создания нижнего слоя, «слоя 1», который будет служить фундаментом ECM, и 0,5 мл плюс заполнители для верхнего слоя, «слоя 2». Использование этого подхода обеспечивает, благодаря подвеске ECM, достаточное пространство и поддержку для прорастания сетей кровеносных сосудов человека во всех направлениях.
- Подготовьте среду для проращивания.
- Специально формулируйте 50 мл гибкой среды без сыворотки (SFM) для поддержки развития гемопоэтических клеток человека, 1,3 мл аликвоты гибкой питательной добавки без сыворотки, 15% эмбриональной бычьей сыворотки (FBS), 250 мкл пенициллина-стрептомицина, 500 мкл 200 мМ L-аланил-L-глутаминового дипептида в 0,85% NaCl, VEGFA (100 нг/мл) и FGF2 (100 нг/мл) (см. Таблицу материалов).
- Подготовьте буфер блокировки.
- Смешайте 0,5 г бычьего сывороточного альбумина, 1,5 мл фетальной бычьей сыворотки, 250 мкл Tween 20, 250 мкл Triton X-100, 500 мкл дезоксихолата натрия (1% мас./об.) и 47,5 мл 1x фосфатно-буферного физиологического раствора (см. Таблицу материалов). Пипеткой вверх и вниз до тех пор, пока все компоненты не будут хорошо интегрированы и раствор не станет прозрачным.
2. Поддержание и культивирование плюрипотентных и индуцированных плюрипотентных стволовых клеток человека
- Проводите культивирование клеток с использованием матрицы базальной мембраны с пониженным фактором роста, не содержащей LDEV (разведение 1:50), покрытой 6-луночными пластинами для культивирования тканей со средой для культивирования стволовых клеток (см. Таблицу материалов).
- Как только клетки достигнут ~ 70% слияния, проведите их, используя 1 мл фермента, диссоциирующего клетки млекопитающих (см. Таблицу материалов) в течение 3-4 мин при 37 ° C.
ПРИМЕЧАНИЕ: Расщепление клеток в соотношении 1:6 повышает жизнеспособность клеток и обеспечивает слияние в течение 2-4 дней для большинства линий стволовых клеток человека. Для повышения жизнеспособности клеток в течение 24 ч после пассажа используют питательную среду с добавлением ингибитора ROCK Y-27632 (10 мМ, 1:1000). - Меняйте питательную среду ежедневно до достижения слияния 70%.
ПРИМЕЧАНИЕ: В настоящем исследовании при слиянии 70% одна лунка 6-луночной клеточной культуральной пластины содержит около 1 миллиона H9 hPSCs.
3. День 0 - Генерация плюрипотентных агрегатов из одноклеточной суспензии
ПРИМЕЧАНИЕ: Слияние 70% в двух скважинах 6-луночной культуральной плиты даст примерно 175 гБВО.
- Используя пипетку или вакуумную систему, аспирируйте питательную среду, замените ее 1 мл реагента для диссоциации клеток (см. Таблицу материалов) и инкубируйте в течение 5 мин при 37 ° C.
- Пока клетки находятся под реагентом для диссоциации клеток, приготовьте необходимый объем агрегационной среды (этап 1.1) в конической пробирке объемом 15 мл по мере необходимости для желаемого количества лунок в 6-луночном культуральном планшете со сверхнизким прикреплением (см. Таблицу материалов).
- Аспирируют 1 мл реагента для диссоциации клеток и суспендируют клетки в 1 мл агрегационной среды. Создайте одноклеточную суспензию с щадящим пипетированием вверх-вниз перед подсчетом образцов.
ВНИМАНИЕ: hPSCs довольно чувствительны к механическим воздействиям и не переносят агрессивного пипетирования. - Подсчитайте клетки с помощью автоматизированного устройстваподсчета клеток 10 или стандартизированной системы под микроскопом. Вычислите количество ячеек, необходимых для эксперимента.
ПРИМЕЧАНИЕ: В зависимости от клеточной линии, от 200 000 клеток до 300 000 клеток в лунке считается идеальным для формирования агрегатов (т.е. 4 лунки = всего от 800 000 до 1 200 000 клеток). - Добавьте соответствующий объем клеточной суспензии в агрегационную среду в полипропиленовой конической трубке высокой прозрачности объемом 15 мл. Аккуратно нанесите пипеткой разбавленную клеточную суспензию вверх и вниз, чтобы обеспечить однородное распределение клеток.
- Пипетка 3 мл разбавленной клеточной суспензии в каждую желаемую лунку 6-луночной культуральной пластины со сверхнизким прикреплением.
- Поместите пластину в инкубатор (37 °C, 5% CO2, влажность >90%) и по возможности избегайте открывания и закрывания дверей инкубатора.
ПРИМЕЧАНИЕ: Этот начальный шаг лучше всего выполнять по вечерам или во время низкой загруженности инкубатора. Даже незначительные вибрации могут повлиять на размер и форму агрегатов, что может ухудшить результаты.
4. День 1 - Мезодермальная индукция агрегатов
- Убедитесь, что через 24 часа после посева под микроскопом видны небольшие агрегаты, состоящие из 2-10 клеток. Соберите агрегаты и дайте им осесть, прежде чем менять среду на среду для индукции мезодермы (этап 1.3).
- Установите одну полипропиленовую коническую трубку высокой прозрачности объемом 15 мл на лунку 6-луночной культуральной пластины со сверхнизкой насадкой.
- Используйте круговые движения (т. е. как орбитальный шейкер) для сбора заполнителей в центре каждой лунки, используйте пипетку объемом 1 мл, чтобы аккуратно собрать заполнители и окружающую среду из каждой лунки, поместите их в соответствующие полипропиленовые конические трубки высокой прозрачности объемом 15 мл и дайте заполнителям осаждаться при комнатной температуре.
- После сбора установите таймер на 1 час, который является временем, необходимым для осаждения большинства клеточных линий / агрегатов на этом этапе.
ПРИМЕЧАНИЕ: Если время составляет менее 1 часа, можно потерять любые агрегаты, которые, возможно, не осели на дно конической пробирки объемом 15 мл. - По прошествии часа с осторожностью аспирируйте надосадочную жидкость пипеткой или высокочувствительным аспирационным насосом. Убедитесь, что заполнители остаются нетронутыми на дне конической пробирки объемом 15 мл.
- Ресуспендируйте агрегаты каждой конической пробирки объемом 15 мл в 2 мл индукционной среды мезодермы и поместите их обратно в соответствующие лунки 6-луночной культуральной пластины со сверхнизким прикреплением.
- Поместите тарелку обратно в инкубатор (37 °C) и оставьте до 4-го дня.
ПРИМЕЧАНИЕ: Если агрегаты прикрепляются и растут друг на друга или врастают друг в друга, используя пипетку объемом 1 мл, аккуратно пипетируйте каждую лунку агрегатов вверх и вниз один раз в день, чтобы агрегаты были одинаковыми по размеру.
5. День 4 - Сосудистая индукция и прайминг агрегатов
- Соберите агрегаты и дайте им осесть, прежде чем менять среду на сосудистую индукционную среду (этап 1.4).
- Установите одну коническую пробирку объемом 15 мл на лунку 6-луночной культивальной пластины со сверхнизкой насадкой.
- Используйте круговые движения (т. е. как орбитальный шейкер) для сбора заполнителей в центре каждой лунки, используйте пипетку объемом 1 мл, чтобы аккуратно собрать заполнители и окружающую среду из каждой лунки и поместите их в соответствующие конические трубки объемом 15 мл.
- После сбора установите таймер на 30 минут, чтобы заполнители оседали.
ПРИМЕЧАНИЕ: На этом этапе для большинства клеточных линий требуется 30 минут. Если время составляет менее 30 минут, существует риск потери любых агрегатов, которые, возможно, не осели на дно конической пробирки объемом 15 мл. - Через 30 мин с осторожностью аспирируйте надосадочную жидкость пипеткой или высокочувствительным аспирационным насосом. Убедитесь, что заполнители остаются нетронутыми на дне конической пробирки объемом 15 мл.
- Ресуспендируют агрегаты каждой конической пробирки объемом 15 мл в 2 мл среды для сосудистой индукции и помещают их обратно в соответствующие лунки 6-луночной культуральной пластины со сверхнизким прикреплением.
- Поместите тарелку обратно в инкубатор (37 °C) и оставьте до 6-го дня.
ПРИМЕЧАНИЕ: Используя пипетку объемом 1 мл, аккуратно протирайте каждую лунку агрегатов вверх и вниз один раз в день, чтобы агрегаты оставались одинаковыми по размеру и предотвращали их врастание или прикрепление друг к другу.
6. День 6 - Заделка агрегата и индукция прорастания сосуда
- Во время работы на льду подготовьте желаемый конечный объем раствора ECM (шаг 1.5).
ПРИМЕЧАНИЕ: Ниже приведен протокол для одной скважины из 12-луночного планшета (30-50 агрегатов), который может быть скорректирован по мере необходимости.- Для одной лунки 12-луночной пластины нанесите 0,5 мл ECM в качестве нижнего слоя и используйте 0,5 мл ECM плюс заполнители на верхнем слое. Это создает «сэндвич» ECM, необходимый для эффективного проращивания 3D-заполнителя.
- Пипетка 500 мкл ECM в одну лунку 12-луночной пластины. Убедитесь, что не образуются пузырьки, а дно лунки и боковой мениск полностью покрыты. Он включает в себя слой 1 сэндвича ECM.
- Поставьте тарелку обратно при температуре 37 °C на 2 часа.
ПРИМЕЧАНИЕ: Для эффективной полимеризации необходимо время в 2 часа. Любое более короткое время может поставить под угрозу целостность ECM. - К концу полимеризации слоя 1 используйте круговые движения, чтобы собрать заполнители в центре каждой лунки, используйте пипетку объемом 1 мл, чтобы аккуратно собрать заполнители и окружающую среду из каждой лунки, и поместите их в соответствующие конические пробирки объемом 15 мл.
- Дайте агрегатам отстояться в течение 10-15 минут и аспирируйте надосадочную жидкость.
- Поместите заполнители в коническую пробирку объемом 15 мл на лед на 5 минут. Во время охлаждения выньте из инкубатора 12-луночную пластину с полимеризованным слоем 1.
ПРИМЕЧАНИЕ: Охлаждение заполнителей помогает предотвратить раннюю полимеризацию ECM слоя 2. - Работая быстро и осторожно, чтобы предотвратить образование пузырьков, ресуспендируйте агрегаты в 500 мкл ECM и нанесите суспензию ECM-агрегата на уже полимеризованный слой 1. Будьте осторожны, чтобы не прикоснуться к слою 1, используйте наконечник пипетки объемом 200 мкл, чтобы аккуратно распределить слой 2 и заполнители вокруг лунки.
- Поставьте тарелку обратно при температуре 37 °C на 2 часа.
ПРИМЕЧАНИЕ: Время инкубации 2 часа необходимо для эффективной полимеризации ECM. Любое более короткое время может нарушить целостность ECM и может предотвратить сильную адгезию между слоями 1 и 2. - Добавьте 1 мл предварительно подогретой (37 °C) среды для проращивания (этап 1.6), чтобы вызвать дифференцировку кровеносных сосудов. Прорастающие сосуды должны появиться через 1-3 дня после заделки. Меняйте средство через 3 дня, а затем через день.
ПРИМЕЧАНИЕ: Проращивающая среда должна быть предварительно подогрета; в противном случае может произойти отслоение слоя и нарушение целостности ECM.
7. День 11 - Изоляция и созревание БВО
- Работая в стерильных условиях, используйте закругленный конец стерильного шпателя, чтобы ослабить матрицу прорастания ECM, содержащую сосудистые сети. На этом этапе гель должен напоминать свободно плавающий диск.
- С помощью стерильных щипцов и закругленного конца стерильного шпателя осторожно перенесите гелевый диск (включая сосудистые сетки) на крышку 10-сантиметровой чашки для культуры.
- Поместите крышку и гель под стереомикроскоп, настроенный на желаемое увеличение и фокусировку, и используйте стерильные иглы, чтобы вырезать отдельные сети кровеносных сосудов, пытаясь ограничить количество неваскуляризированного ECM, полученного в процессе.
ПРИМЕЧАНИЕ: Клетки естественным образом разрушают окружающий ECM с течением времени; Тем не менее, уменьшение количества, вырезаемого с каждым органоидом, повышает качество изображения и целостность отдельно стоящей сети сосудов. - После того, как все органоиды будут выделены из геля, осторожно перенесите их обратно в одну лунку 6-луночной пластины со сверхнизкой насадкой с 3 мл прорастающей среды. На этом этапе органоиды можно оставить на ночь, или сразу перейти к шагу 7.4.
- Используйте пипетку объемом 1 мл для переноса отдельных органоидов из 6-луночной пластины в лунки 96-луночной пластины со сверхнизкой насадкой. После переноса добавьте 200 мкл предварительно разогретой (37 °C) прорастающей среды в каждую лунку 96-луночного планшета.
ПРИМЕЧАНИЕ: Одна скважина сосудистых органоидов из 12-луночной пластины должна заполнить 30-40 лунок 96-луночной пластины. - Через 4-6 дней после выделения в 96-луночные планшеты убедитесь, что органоиды обладают круглой и здоровой морфологией. На этом этапе органоиды готовы к фиксации и подготовке к окрашиванию.
8. День 15 - Фиксация, блокировка и окрашивание БВО
- Используя отрезанный наконечник объемом 1 мл, перенесите органоиды в микроцентрифужную пробирку объемом 1,5 мл.
- Соблюдая осторожность, чтобы избежать аспирации любых BVO, используйте пипетку объемом 200 мкл или 1,000 мкл для удаления оставшейся прорастающей среды в микроцентрифужной пробирке, а затем добавьте 1 мл 4% PFA в PBS в течение 1 часа.
ПРИМЕЧАНИЕ: Рекомендуется фиксация на орбитальном шейкере (125 об/мин) при комнатной температуре. Допустимо использование не более 60 БВО/микроцентрифужной пробирки. Любые дополнительные BVO ухудшат фиксацию и эффективность промывки.
ВНИМАНИЕ: PFA является вредным химическим веществом. Используйте его с осторожностью в вытяжном шкафу и следуйте инструкциям производителя по использованию и соответствующим методам утилизации. - Промывайте только что зафиксированные BVO 3 раза в течение 15 минут каждый раз с 0,25% PBS-Tween.
- Если органоиды больше 1 мм в диаметре, пронизывайте BVO 1% Triton X-100 в PBS в течение 30-60 минут при комнатной температуре.
- Аспирируйте все 0,25% PBS-Tween и добавьте 1 мл блокирующего буфера (шаг 1.7).
ПРИМЕЧАНИЕ: Несмотря на то, что антитело зависит от этого, 2 ч при комнатной температуре на орбитальном шейкере (125 об/мин) достаточно для снижения неспецифического связывания антител в процессе окрашивания. Органоиды можно оставлять в блокирующем буфере при 4 °C на срок до 2 недель. - Удалите блокирующий буфер и добавьте первичное антитело (1:100), разбавленное в 1 мл блокирующего буфера. Хранить в течение ночи при температуре 4 °C на орбитальном шейкере (12 об/мин), следя за тем, чтобы органоиды оставались погруженными в раствор первичного антитела.
ПРИМЕЧАНИЕ: Ночная инкубация первичных антител подходит для антител, используемых для этого исследования. Необходимые первичные и вторичные антитела и их соответствующие разведения приведены в таблице материалов. - После ночной инкубации первичных антител удалите раствор первичного антитела и промывайте 3 раза в течение 15 минут каждый раз 0,25% PBS-Tween.
- Добавьте вторичное антитело (1:250) плюс DAPI (1:1000), разведенный в 1 мл блокирующего буфера, и инкубируйте в течение 2 ч при комнатной температуре или при 4 ° C в течение ночи.
ПРИМЕЧАНИЕ: Если образцы подготовлены правильно (как описано выше), инкубация в течение 2 ч при комнатной температуре или при 4 °C в течение ночи подходит для антител, используемых в настоящем исследовании. - После инкубации удалите раствор вторичных антител и промывайте 3 раза в течение 15 минут каждый раз 0,25% PBS-Tween.
ПРИМЕЧАНИЕ: После окрашивания органоиды можно хранить в PBS до 2 недель.
9. Монтаж органоидов кровеносных сосудов (БВО)
- Приклейте монтажные прокладки к нужным защитным стеклам изображения (см. Таблицу материалов).
- Используя отрезанный наконечник пипетки диаметром 1 мм, используйте пипетку объемом 1 мл для переноса отдельных органоидов в прокладочные лунки и аспирации оставшегося PBS.
- Заполняют скважину 150-200 мкл очищающего раствора (см. Таблицу материалов), нагретого до 75 °С, полностью погружая органоид.
ПРИМЕЧАНИЕ: Образцы должны стать прозрачными в течение 1 часа после воздействия подогретого очищающего раствора.- Оставьте органоиды прозрачными в закрытом ящике в темноте при комнатной температуре на 6 часов или на ночь, если 1-часовое время очистки недостаточно. Оставляя образец на ночь, убедитесь, что в нем достаточно очищающего раствора, чтобы избежать высыхания.
- После очистки тщательно аспирируйте очищающий раствор наконечником пипетки объемом 100-200 мкл. Аккуратно переместите органоид к центру распорного колодца и добавьте капли монтажного геля (см. Таблицу материалов) (нагретого до 75 °C в контролируемом нагревательном блоке) до тех пор, пока лунка не заполнится.
- Аккуратно поместите второе покровное стекло поверх монтажной прокладки, чтобы запечатать образцы в пространстве между нижним и верхним покровными стеклами. Дайте монтажному гелю застыть в темноте при температуре 4 °C в течение ночи.
ПРИМЕЧАНИЕ: После отверждения для дальнейшей герметизации установленных образцов можно использовать лак для ногтей верхнего слоя.
Результаты
Этапы, описанные в этом протоколе, были разработаны специально для получения контролируемого и точного метода генерации органоидов кровеносных сосудов человека из hPSCs. Генерация агрегатов диаметром 30-100 мкм из культур hPSC знаменует собой отправную точку протокола (рис. 1, рис. 2B). Агрегаты проходят ступенчатую индукцию к мезодерме (1-4-й день) и сосудистым линиям (4-6-й день) до встраивания (6-й день) (рис. 2A-D), что необходимо для формирования сосудистой сети. Почти радиально-симметричное прорастание сосудов должно быть видно d7 или d8 (рис. 2E) и продолжаться до d10 (рис. 2F, G). Эксплантация hBVO из ECM в 96-луночные пластины со сверхнизким креплением снижает хрупкость прорастающих сетей и позволяет продолжать обслуживание в условиях суспензионной культуры (рис. 2H) до 6 месяцев. К d15 hBVO демонстрируют обширную и связанную эндотелиальную (CD31+) сеть, окруженную перицитами (PDGFR-ß+) и актином гладких мышц (SMA+) (рис. 3A-D). Непрерывная базальная мембрана коллагена IV (ColIV+) окутывает сосудистые сети (рис. 3E). Эндотелиальные клетки (CD31+, VE-кадгерин+) и перициты (PDGFR-ß+) составляют приблизительно 30%-35% и 60%-65% популяций органоидных клеток, соответственно8. Активное прорастание сосудов происходит под руководством эндогенно организованной популяции верхушечных клеток (CD31+), которая имеет типичную морфологию верхушечных клеток, такую как чрезмерная филиподия 8,10. Представление фресочных клеток PDGFR-ß+ и SMA+, инкапсулирующих сети эндотелиальных сосудов, можно увидеть на d15 процесса созревания органоидов (рис. 3A, C). После удаления из ECM и созревания в культуре суспензии (т.е. d15) hBVO пригодны для соответствующих анализов или трансплантации под капсулу почки мыши.

Рисунок 1: Схема протокола hBVO с указанием времени и ступенчатой прогрессии. Из, казалось бы, однородных культур hPSC или hiPSC происходит образование агрегатов в присутствии ингибитора Rho-киназы Y27632. BMP4 и CHiR-дополненная среда используется для инструктажа агрегатов к мезодермальной судьбе. Индукционная среда мезодермы заменяется средой с добавлением VEGFA и форсколина, чтобы стимулировать агрегаты к сосудистой линии. Механические и химические очереди, достигаемые за счет встраивания агрегатов в коллаген I и солюбилизированный матрикс базальной мембраны и воздействия среды, содержащей VEGFA и FGF2, приводят к почти радиально-симметричному прорастанию сосудов из тела агрегата. Образующиеся сосудистые сети могут быть удалены из коллагена I и солюбилизированной базальной мембраны и помещены в суспензионную культуру для дальнейшего созревания, анализа или трансплантации in vivo. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
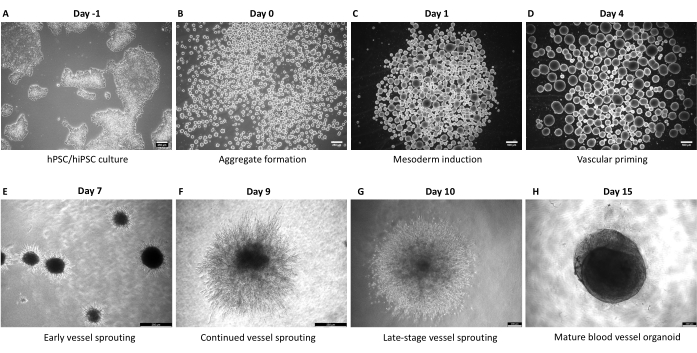
Рисунок 2: Ступенчатая прогрессия генерации hBVO, захваченная светлым полем. (A) Типичная морфология колоний hPSC (H9) в день −1. (B) Генерация агрегатов hPSC (день 0) на 6-луночных пластинах со сверхнизким креплением в присутствии Y-27632. (C) Мезодермальная индукция агрегатов с использованием среды с добавлением BMP4 и ChiR (день 1). Также можно наблюдать незначительные изменения в размере и форме агрегата. (D) Агрегаты 4-го дня, подготовленные к сосудистой линии с использованием VEGFA и среды, дополненной форсколином. (E) Раннее прорастание сосудов на 7-й день, через день после встраивания агрегатов в матрицу прорастания и воздействия среды для прорастания с добавлением VEGFA и FGF2 (день 7). (F) Здоровая морфология органоидов и продолжение прорастания сосудов на 9-й день. (G) Прорастание сосуда на поздней стадии на 10-й день. В идеале плотные клеточные структуры в органоидном центре к этому времени исчезнут. (H) Типичная морфология зрелых (15-й день) органоидов кровеносных сосудов человека. Удаление окружающей матрицы путем разрезания и созревания в 96-луночных культуральных пластинах со сверхнизким прикреплением формирует органоиды сферически, а сосудистые сети размещаются внутри. Масштабные линейки: (A, B, E, F) 250 мкм; (C,D) 500 мкм; (G,H) 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Окрашивание зрелых (15-й день) органоидов кровеносных сосудов человека. (A) Презентация зрелых (15-й день) органоидов кровеносных сосудов человека с самоорганизующимися эндотелиальными (CD31+, пурпурные) сетями и окружающим перицитами (PDGFR-β+, голубой) и альфа-гладкими мышцами (SMA+, желтый) покрытием. (B) Более высокое увеличение A, детализирующее SMA+ (желтый) и PDGFR-β+ (голубой) экспрессию сосудистых сетей. (C) Подробное представление об эндотелиальном (CD31+, пурпурный), перицитарном (PDGFR-β+, голубой) и альфа-гладкомышечном актине (SMA+, желтый) взаимодействии. (D) Окрашивание эндотелия сосудов (CD31+, пурпурный) и гладких мышц (SMA+, желтый) в поперечном сечении (слева) и более высокое увеличение (справа) зрелых органоидов кровеносных сосудов. (E) Самонаправленное формирование сосудистой базальной мембраны (Col IV+, оттенки серого) за счет тесной ассоциации клеток фрески и эндотелиальных трубок. Масштабные линейки: (A,D[слева]) 100 мкм; (B,D[справа],E) 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Недавние прорывы в органоидных культурах, полученных из стволовых клеток, обеспечили основу для более продвинутых и физиологически значимых моделей сосудистой сети человека. Представленная здесь модель органоида кровеносных сосудов человека (hBVO), разработанная в нашей лаборатории 8,10, предоставляет мощные средства для изучения не только дальнейших аспектов васкулогенеза человека, но и новых путей моделирования заболеваний и регенеративной терапии 8,10,11. Несколько моделей in vivo были использованы для изучения развития и созревания кровеносных сосудов, сосудистых заболеваний и эндотелиальной дисфункции 3,4. Различные подходы объединяют одиночные и множественные клетки, определенные по происхождению, либо полученные из стволовых клеток, либо выделенные из взрослых тканей in vivo, для создания репликативных сосудистых сетей человека 5,6. Представленный здесь протокол использует принцип биологии развития и самоорганизации, чтобы получить первые в истории сети кровеносных сосудов человека с несколькими клетками, которые могут быть созданы, по сути, из одного hPSC 8,10.
Каждая линия стволовых клеток имеет уникальный генетический состав и отличается от других с точки зрения источника, функции и чувствительности15. Таким образом, протокол для органоидов кровеносных сосудов человека (hBVO) был разработан и оптимизирован для обеспечения надежной и воспроизводимой совместимости протокола с несколькими (>12) различными линиями hPSC 8,10. Описанный здесь метод генерирует органоиды кровеносных сосудов, полученные из hPSC, в течение 2 недель. Однако изменения в составе среды и/или методах генерации hBVO могут привести к неэффективной сети сосудов и генерации органоидов. Различные скорости пролиферации отдельных линий стволовых клеток также заметно влияют на воспроизводимость экспериментов со стволовыми клетками15 и, следовательно, органоидных культур. Например, при генерации BVO большее количество пролиферативных клеток или большее количество крупных агрегатов 1-го дня по своей природе подвержены различным метаболическим средам и параметрам диффузии газов и питательных веществ. Это, в свою очередь, изменяет время и эффективность воздействия фактора роста, степень дифференцировки и прайминга сосудов и, самое главное, способность образовывать сосудистые сети при встраивании агрегатов в коллаген 1 и солюбилизированный матрикс базальной мембраны.
Пассивная диффузия кислорода и введение необходимых питательных веществ из внешней среды не идеальны для долгосрочного роста клеток 3D-органоидов и морфогенеза тканей in vitro16. Несмотря на то, что это зависит от нескольких факторов (т.е. скорости метаболизма в тканях, биодоступности питательных веществ и газов, статической или динамической среды), для тканей, культивируемых in vitro, был установлен общий предел диффузии 150 мкм O2 и питательных веществ, учитывая, что физиологически ткани человека представляют собой связки живых клеток в пределах 150 мкм от перфузированных кровеносных сосудов17. Хотя также были предложены эффективные расстояния диффузии газа и питательных веществ 70-200 мкм18,19,20,21, плотность конструкции, температура, рН и состав среды значительно влияют на эффективность диффузии. Благодаря оптимизации площади поверхности и коммуникации интегрин-бета-рецептора после встраивания на 6-й день агрегаты диаметром 250-300 мкм работают лучше, чем агрегаты диаметром >500-600 мкм, что приводит к полному процессу прорастания сосуда и минимально конденсированному органоидному ядру. Таким образом, размер агрегата имеет решающее значение и может зависеть как от количества ячеек, используемых во время первоначального посева, так и от времени, отведенного на формирование агрегата. Пластины с микролунками, которые позволяют контролировать размер заполнителя и номер22, являются жизнеспособной альтернативой методу формирования стохастических заполнителей, полученному в результате использования 6-луночных планшетов со сверхнизким креплением в этом протоколе. Последовательность в сроках и управлении размерами агрегатов в течение первых 6 дней протокола hBVO является одним из, если не самым важным, показателем успешного развития добросовестных органоидов кровеносных сосудов.
Изменения среды на 1-й день (индукция мезодермы) и на 4-й день (сосудистая индукция) должны быть завершены в сочетании с оседанием агрегатов. Хотя центрифугирование является заманчивой альтернативой, дополнительные силы, приложенные к слабо собранным агрегатам, могут вызвать нежелательное слипание, сборку и сдвиг, что отрицательно влияет на дифференциацию, созревание и эффективность прорастания на более поздних стадиях протокола. Работа на льду в течение 6-го дня процесса встраивания имеет решающее значение для сохранения правильной полимеризации ECM и формирования слоя. Во время индукции заделки и прорастания заполнителя воздействие на ЭБМ температур выше 4°С и/или рН ЭБМ, отличный от 7,4, повлияет не только на скорость полимеризации и целостность слоя ЭКМ, но и на эффективность прорастания встроенных заполнителей. Эластичная природа матрицы для проращивания ECM позволяет легко отсоединять и транспортировать из 12-луночной чашки для культивирования на стерильную режущую поверхность. Отдельные органоиды, удаленные из матрицы и перенесенные на 96-луночные пластины со сверхнизким прикреплением, будут потреблять оставшуюся окружающую ECM и сохранять самоорганизующиеся сети эндотелиальных микрососудов, покрытые клетками, с непрерывной базальной мембраной.
Хотя это предложение не охвачено этим предложением, изменения в составах сред могут воспроизводить заболевания, которые, в свою очередь, провоцируют патологические реакции в hBVOs 8,11. Границы моделирования заболеваний с использованием системы hBVO далеко не известны, и это, безусловно, область, которая нуждается в исследовании. Применение нашей технологии органоидов кровеносных сосудов в васкуляризации ранее аваскулярных органоидных конструкций23 также имеет значительное влияние и интерес.
Раскрытие информации
Нет никакой связи между финансовыми интересами авторов и представляемым исследованием. Технология органоидов кровеносных сосудов была лицензирована компанией Stemcell Technologies. J.M.P. является основателем и акционером компании Angios Biotech, которая разрабатывает органоиды кровеносных сосудов в качестве терапии трансплантации сосудов. Заявка на патент, относящаяся к этой работе, была подана под патентом. US20200199541A1, перечисляя Райнера А. Виммера, Йозефа М. Пеннингера и Дончо Керьяшки в качестве изобретателей.
Благодарности
Мы благодарим всех сотрудников наших лабораторий за критический вклад и обсуждения. JMP получила финансирование от Фонда Т. фон Застрова, премию FWF Витгенштейна (Z 271-B19), Австрийскую академию наук, совместное предприятие Innovative Medicines Initiative 2 (JU) в рамках грантового соглашения No 101005026, Leducq Transatlantic Networks of Excellence in Cardiovascular Research, Программу выдающихся исследователей Института Аллена и Канадскую программу 150 исследовательских кафедр F18-01336, а также гранты Канадских институтов исследований в области здравоохранения COVID-19 F20-02343 и F20-02015.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 M HEPES | Gibco | 15630080 | |
| 2-Mercaptoethanol | Millipore | 60-24-2 | |
| 7.5% sodium bicarbonate | Gibco | 5080094 | |
| Accutase | Gibco | A1110501 | cell dissociation reagent |
| Albumin fraction V (BSA) | AppliChem | A1391, 0100 | |
| Alexa Fluor 488–anti-rabbit IgG (Fab′)2 fragment | — | Jackson Immuno Research | 711-546-152 |
| Alexa Fluor 488–anti-sheep IgG | — | Life Technologies | A11015 |
| Alexa Fluor 647–anti-goat IgG (Fab′)2 fragment | — | Jackson Immuno Research | 705-606-147 |
| Automated cell counter | Invitrogen | Countess II | |
| B27 supplement | Gibco | 12587010 | |
| Biological safety cabinet | Faster | SafeFAST Premium 212 | |
| BMP4 | Miltenyi BioTec | 130-111-165 | |
| CD31 | Endothelial cell | DAKO | M0823 |
| CD31 | Endothelial cell | R&D | AF806 |
| Cellulose wipes | |||
| Centrifuge | Heraeus | Multifuge 4 KR | |
| CHIR99021 | Tocris Bioscience | 4423 | |
| Clear nail polish (essence, the gel, 01 absolute pure) | |||
| CO2 incubator | New Brunswick | Galaxy 170S | |
| Collagen type IV | Basement membrane | Millipore | AB769 |
| Confocal microscope (10x, 20x, 63x objectives) | Leica | SP8 | |
| Counting chamber slides- including 0.1% Trypan blue | Invitrogen | C10283 | |
| Coverslips (22 x 50 mm) | |||
| Cy3–anti-mouse IgG (Fab′)2 fragment | — | Jackson Immuno Research | 715-166-150 |
| DAPI | Sigma | D9542 | |
| DMEM/F12 | Gibco | 11330-032 | |
| Dulbecco's Modefied Eagle's Medium (DMEM) | Sigma | D5648-10L | |
| Eppendorf tubes | |||
| Falcon tubes | Fisher Scientific | 14-432-22 | |
| Fetal Bovien Serum (FBS) | Gibco | 10270-106 | |
| FGF2 | Miltenyi BioTec | 130-093-841 | |
| Fine forceps | FST | 11254-20 | |
| Fisherbrand Superfrost Clipped Corner Slides | Fisher Scientific | 12-550-016 | |
| Forskolin | Sigma | F3917 | |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Fisher Scientific | A1413302 | |
| Glutamax | Gibco | 35050061 | |
| Ham's F12 | Gibco | 11765054 | |
| Horizontal laminar flow station, if stereomicroscope cannot fit in BSC | Thermo Scientific | Heraguard | |
| Inverted contrasting tissue culture microscope | Zeiss | Vert.A1 | |
| iSpacer | SunJinLab | IS009 | |
| KnockOut DMEM/F12 | Gibco | 12660012 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| N2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| non-essential amino acids (NEAAs) | Gibco | 11140035 | |
| Orbital shaker | |||
| Parafilm | |||
| Paraformaldehyde (4%) in PBS | Boston BioProducts | BM-155 | |
| PDGFR-β | Pericyte | R&D | AF385 |
| PDGFR-β | Pericyte | Cell Signaling | 3169S |
| Penicillin-streptomycin | Gibco | 15140122 | |
| pH indicator strips (6.5-10) | Mquant, Millipore | 109543 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Pipettes (P1000, P200 and P20) | Gilson, Integra Pipetboy | ||
| Prime Surface-U 96-well plates | Sumilon | MS9096-U | |
| PurCol | Advanced BioMatrix | 5005 | |
| RapiClear CS gel | SunJinLab | RCCS005 | |
| RapiClear CS mounting solution | SunJinLab | RCCS002 | |
| Serological pipettes (5, 10 and 25 mL) | Falcon | 357529, 357530, 357515 | |
| SMA | vSMC/Pericyte | Sigma | 2547 |
| Sodium deoxycholate | Sigma | D6750 | |
| Sodium hydroxide solution (NaOH, 1.0 N) | Sigma | S2770 | |
| Solubilized Basement Membrane Matrix (i.e., Matrigel) | Corning | 356231 | |
| Stainless steel micro spatula (rounded end) | Fisher Scientific | 21-401-5 | |
| Stainless steel spoon (double-ended) | Fisher Scientific | BelArt H367290018 | |
| Stemflex medium | Thermo Scientific | A3349401 | stem cell culture medium |
| StemPro-34 SFM | Gibco | 10639011 | flexible serum-free medium |
| Stereomicroscope | Zeiss | Stemi 2000 | |
| Sterile filter pipette tips (1,000, 300 and 20 μL) | Biozym, Surphob | VT0270, VT0250, VT0220 | |
| Tissue culture–treated 12-well plates TC | BD Falcon | 353043 | |
| Tissue culture–treated 6-well plates | Eppendorf | 30720113 | |
| Triton X-100 | Sigma | 93420 | |
| Tryple Express Enzyme (1x), Phenol Red | Thermo Scientific | 12605010 | mammalian cell dissociating enzyme |
| Tween 20 | Sigma | P7949 | |
| Ultra-low-attachment 6-well plates | Corning | 3471 | |
| VEGFA | Peprotech | 100-20 | |
| Water bath (37 °C) | Fisher Scientific | Isotemp 210 | |
| Y-27632 | Calbiochem | 688000 |
Ссылки
- Okwuosa, I. S., Lewsey, S. C., Adesiyun, T., Blumenthal, R. S., Yancy, C. W. Worldwide disparities in cardiovascular disease: Challenges and solutions. International Journal of Cardiology. 202, 433-440 (2016).
- Page, R. L., Ghushchyan, V., Nair, K. A call to action: Responding to the future forecasting of cardiovascular disease in America. American Health & Drug Benefits. 4 (5), 280-288 (2011).
- Ferrara, N., Davis-Smyth, T. The biology of vascular endothelial growth factor. Endocrine Reviews. 18 (1), 4-25 (1997).
- Ishitobi, H., et al. Flk1-GFP BAC Tg mice: An animal model for the study of blood vessel development. Experimental Animals. 59 (5), 615-622 (2010).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Xu, Y., et al. A novel strategy for creating tissue-engineered biomimetic blood vessels using 3D bioprinting technology. Materials. 11 (9), 1581(2018).
- Risau, W. Mechanisms of angiogenesis. Nature. 386 (6626), 671-674 (1997).
- Wimmer, R. A., et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 565 (7740), 505-510 (2019).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From arteries to capillaries: Approaches to engineering human vasculature. Advanced Functional Materials. 30 (37), 1910811(2020).
- Wimmer, R. A., Leopoldi, A., Aichinger, M., Kerjaschki, D., Penninger, J. M. Generation of blood vessel organoids from human pluripotent stem cells. Nature Protocols. 14 (11), 3082-3100 (2019).
- Monteil, V., et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 181 (4), 905-913 (2020).
- Patsch, C., et al. generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Bruveris, F. F., Ng, E. S., Stanley, E. G., Elefanty, A. G. VEGF, FGF2, and BMP4 regulate transitions of mesoderm to endothelium and blood cells in a human model of yolk sac hematopoiesis. Experimental Hematology. 103, 30-39 (2021).
- Julian, L., Olson, M. F. Rho-associated coiled-coil containing kinases (ROCK): Structure, regulation, and functions. Small GTPases. 5, 29846(2014).
- Anitua, E., Prado, R. Addressing reproducibility in stem cell and PRP therapies. Trends in Biotechnology. 37 (4), 340-344 (2019).
- McMurtrey, R. J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids. Tissue Engineering Part C: Methods. 22 (3), 221-249 (2016).
- McKeown, S. R. Defining normoxia, physoxia and hypoxia in tumours-Implications for treatment response. The British Journal of Radiology. 87 (1035), 20130676(2014).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. British Journal of Cancer. 9 (4), 539-549 (1955).
- Olive, P. L., Vikse, C., Trotter, M. J. Measurement of oxygen diffusion distance in tumor cubes using a fluorescent hypoxia probe. International Journal of Radiation Oncology. 22 (3), 397-402 (1992).
- Torres Filho, I. P., Leunig, M., Yuan, F., Intaglietta, M., Jain, R. K. Noninvasive measurement of microvascular and interstitial oxygen profiles in a human tumor in SCID mice. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2081-2085 (1994).
- Lanzen, J., et al. Direct demonstration of instabilities in oxygen concentrations within the extravascular compartment of an experimental tumor. Cancer Research. 66 (4), 2219-2223 (2006).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), 1565(2008).
- Sun, X. Y., et al. generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, 76707(2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены