Method Article
Целевые исследования с использованием серийного блока лица и целенаправленной ионного луча сканирования электронной микроскопии
В этой статье
Резюме
Здесь мы представляем протокол для эффективного сочетания серийного лица блока и сфокусированного ионного луча, сканирующего электронную микроскопию, чтобы нацелить интересующую область. Это позволяет эффективно искать в трех измерениях и находить редкие события в большом поле зрения.
Аннотация
Этот протокол позволяет эффективно и эффективно проводить визуализацию образцов клеток или тканей в трех измерениях на уровне разрешения электронной микроскопии. На протяжении многих лет электронная микроскопия (ЭМ) остается по своей сути двумерной техникой. С появлением серийных методов визуализации электронного микроскопа (объем EM), используя либо интегрированный микротом, либо сфокусированный ионный луч, чтобы нарезать, а затем просмотреть встроенные ткани, третье измерение становится легко доступным. Серийный блок лица сканирования электронной микроскопии (SBF-SEM) использует ультрамикротом, заключенный в камере SEM. Он имеет возможность обрабатывать большие образцы (1000 мкм х 1000 мкм) и изображение больших полей зрения на небольшой размер X,Y пикселей, но ограничен в измерении й алмазным ножом. Фокусированный ионный луч SEM (FIB-SEM) не ограничен в 3D-разрешении(изотропные воксели в 5 нм достижимы), но поле зрения гораздо более ограничено. Этот протокол демонстрирует рабочий процесс для объединения двух методов, позволяющих находить отдельные области, представляющие интерес (ROIs) в большом поле, а затем визуализации последующего целевого объема с высоким изотропным разрешением voxel. Подготовка фиксированных клеток или тканей является более требовательной для объема EM методов из-за дополнительной контрастной, необходимой для эффективного генерации сигнала в SEM изображений. Такие протоколы отнимают много времени и трудоемкие. Этот протокол также включает в себя микроволновую обработку тканей, облегчающую проникновение реагентов, что сокращает время, необходимое для обработки протокола от нескольких дней до нескольких часов.
Введение
Этот протокол описывает рабочий процесс для эффективного таргетинга трехмерной электронной микроскопии высокого разрешения (EM) в конкретный регион, представляющий интерес (ROI). С момента своего начала в 1930-х годах, EM была по существу двумерной техникой. Первые опубликованные изображения были целых тканей или клеток, но вскоре уступили разделы, которые были вырезаны вручную с помощью ультрамикротома и изображения с помощью электронного микроскопа передачи (TEM). TEM производит микрографы с очень высоким разрешением, где даже самые маленькие клеточные структуры четко различимы. Тем не менее, тонкость секции, необходимой для изображения ткани электронным лучом, сделала информацию в измерении ю минимальной. Поскольку клетки являются трехмерными структурами, взаимодействия между клеточными структурами и поверхностями клеток должны были быть выведены из ограниченных данных. Это повышает вероятность неправильного толкования, особенно в сложных структурах. Некоторым микроскопам удалось получить более точные 3D-структуры с помощью серийных секционных клеток итканей, а затем кропотливо реконструировать их из отдельных tEM-изображений 1. Это был очень трудоемкий процесс, и до появления цифровых изображений и компьютерной визуализации результаты также было трудно визуализировать. В последние годы были введены два метода, которые стали коллективно известны как объем электронной микроскопии (объем EM) 2, которые сделали EM в трех измерениях доступны для более лабораторий.
Идея получения стопки изображений из встроенного блока внутри электронного микроскопа восходит к 1981 году, когда Стив Лейтон и Алан Кузириан построили миниатюрный микротом и поместили его в камеру сканирующего электронного микроскопа3 (SBF-SEM) . Этот прототип был в конечном итоге скопирован и улучшен 23 года спустя Denk и Horstmann 4, а затем коммерциализирован. Примерно в то же время биологические ученые узнали о другой технологии, используемой в основном в материаловедении, сфокусированном ионном луче. Этот метод использует ионный луч какой-то (Галлий, плазма) для удаления очень небольшого количества поверхностного материала из образца (FIB-SEM)5. В обоих методах используются секции с последующей визуализацией, обеспечивающей серию изображений, которые могут быть объединены в x, Y, , стек. Оба метода предоставляют 3D-информацию, но в разных масштабах разрешения. SBF-SEM ограничен физическими свойствами алмазного ножа ломтиками не тоньше 50 нм для длинных серийных запусков изображений; однако размер блока образца, который может быть разделен, большой, до 1 мм х 1 мм х 1 мм. Из-за большого цифрового формата приобретения обратно рассеянного электронного детектора (32k x 32k пикселей), который получает сигнал от блока лица , размеры пикселей изображения могут быть как малые как 1 нм. Это приводит к неизотропным вокселям, где измерение X,Y часто меньше, чем q. Благодаря точности ионного луча, FIB-SEM имеет возможность собирать изображения с изотропными вокселями 5 нм. Тем не менее, общая площадь, которая может быть изображена довольно мала. Сводная таблица различных образцов и томов, изображенных с двумя методами была опубликована ранее3.
Ткань подготовки к объему EM сложнее, чем для стандартных TEM или SEM, потому что образцы должны быть окрашены, чтобы обеспечить адекватное генерирование сигнала в SEM. Часто, окрашивания должны быть оптимизированы не только для конкретного типа ткани, но и для добавления контрастирует с определенными клеточными структурами, чтобы облегчить идентификацию и реконструкцию. Протокол, используемый здесь, основан на стандарте NCMIR6. Дополнительное окрашивание обычно означает дополнительные шаги протокола. Таким образом, для объема EM необходимо расширить стандартные протоколы, чтобы обеспечить достаточное время для проникновения реагентов в выборку. Микроволновая обработка может сократить время, необходимое для окрашивания отчасов до минут, и делает подготовку образца EM более эффективным 7. Этот метод применим ко всем типам клеток и тканей8 и к исследованиям вопросов, где неоднородность ткани делает выборку конкретной области, необходимой9.
После получения стека данных он может быть выровнен, а структуры интересов сегментированы из остальных данных и смоделированы в 3D. Хотя автоматизация визуализации многих фрагментов ткани сделала приобретение изображений относительно простым, процесс цифровой реконструкции и визуализации данных является трудоемкой задачей. Программное обеспечение для этой цели еще не интегрировано и не полностью автоматизировано. Поскольку большая часть ранних работ с использованием объема EM была направлена на нейронауки, методы для окрашивания и цифрового сегментации структур, таких как аксоны довольно далеко продвинутые по сравнению с другими клетками и органеллами. В то время как литература по другим ненейрональным тканям быстро растет, нелинейные или нерегулярные структуры требуют большего ручного ввода.
Использование SBF-SEM и FIB-SEM является полезным подходом для таргетинга и визуализации конкретных, неоднородных, структур тканей с высоким разрешением в 3D. Сочетание этого сочетания с микроволновой помощи обработки тканей, что значительно уменьшает время, необходимое для подготовки образца. Вместе этот рабочий процесс сделает создание высокоточных изотропных наборов изображений voxel тонких структур эффективным и более быстрым процессом.
протокол
1. Фиксация образца и обработка для электронной микроскопии
- Исправить саженцы arabidopsis thaliana, выращенные на агарных пластинах в 0,5% параформальдегида, 2,5% глюктаральдегида в 0,1 М фосфатного буфера (ПБ) рН 6,8 на 2 ч при комнатной температуре (RT).
ВНИМАНИЕ: Альдегиды являются раздражителями и коррозионными и обладают канцерогенным, мутагенным и тератогенным потенциалом. Все решения должны быть обработаны с соответствующим защитным оборудованием и в дымовой капот. - Вырезать корневые кончики растения, выращенные в шаге 1.1 и положить 2-3 советы в 0,5 мл труб, содержащих те же фиксаторы на ночь на 4 кв. C.
ПРИМЕЧАНИЕ: Объем этого и любых решений в остальных шагах определяется объемом выборки; минимальное соотношение выборки к раствору составляет 10:1. Образцы больше 1 мм в любом измерении будет трудно испачкать, поэтому работать с более крупными блоками ткани сложнее. Не все ткани имеют одинаковые характеристики; например, листья растений и стебли могут быть трудно испачкать. При желании более крупных образцов или сложных типов тканей необходимо провести оптимизацию обработки образцов, прежде чем переходить к сбору данных. - Приготовьте раствор тиокарбогидазид (TCH), необходимый свежий и доступный перед шагом 1.7. Добавьте 0,1 г тиокарбогидраза до 10 мл двойной дистиллированной воды (ddH2O) и растворите при нагревании до 60 градусов по Цельсию в духовке на 1 ч. Перед использованием отфильтруйте решение TCH с помощью фильтра шприца 0,22 мкм.
- Удалить фиксатор из труб и заменить 0,1 МП рН 6,8. Положите трубки на орбитальный стол со счетом 100 об/мин и вымойте 10 мин. Повторите стирку с помощью свежего PBS 5 раз.
- Опубликовать исправить корневые советы, заменив PB с 2% тетроксида осмия (OsO4) и 0,2% рутения красный в 0,1 МП пб рН 6,8. Положите трубки в микроволновой печи с открытыми крышками и начать программу 9(Таблица 1).
ВНИМАНИЕ: Осмий чрезвычайно опасен при поимке, очень опасен при вдыхании и опасен в случае контакта с кожей. Всегда обрабатывать с помощью соответствующего защитного оборудования и в дым капота.
ПРИМЕЧАНИЕ: На протяжении всего протокола, крышки труб всегда открыты во время микроволновой шаги. - Вымойте корневые кончики дважды с ddH2O в течение 5 минут каждый на скамейке. Для третьего и четвертого ddH2O мыть использовать программу 15 на микроволновой печи (Таблица 1). После первых 40 секунд ddH2O мыть, взять образцы из микроволновой печи и заменить буфер со свежим ddH2O. Положите образцы обратно в микроволновую печь и продолжить программу.
ПРИМЕЧАНИЕ: Микроволновая печь будет бить тревогу, когда буфер должен быть обновлен. Убедитесь, что крышка для вакуумной камеры заменяется правильно каждый раз. - Инкубировать образцы в ранее подготовленном растворе TCH на RT в течение 2 мин на скамейке и для дальнейшей инкубации используйте микроволновую программу 8(таблица 1). Не меняйте решение между скамейкой и микроволновой печью.
- Вымойте образцы, описанные в шаге 1.6.
- Место образцы в 1% OsO4 в ddH2O для микроволновой программы 9 (Таблица 1).
- Вымойте образцы, описанные в шаге 1.6.
- Инкубировать образцы в 1% уранила ацетата в ddH2O с помощью микроволновой программы 16 (Таблица 1).
ВНИМАНИЕ: Уранил ацетат является токсичным, раздражающим и имеет канцерогенный, мутагенный и тератогенный потенциал. Всегда обрабатывать с помощью соответствующего защитного оборудования. - Вымойте образцы, описанные в шаге 1.6.
- Подготовьте ведущее решение Walton для использования в шаге 1.14. Сначала сделайте стоковый раствор L-аспарновой кислоты, добавив 0,998 г L-аспарновой кислоты до 250 мл дДГ2О и регулируя рН до 3,8 с 1 М КН. Далее растворите 0,066 г нитрата свинца в 10 мл раствора l-аспарговой кислоты и нарежйте рН до 5,5. Оставьте раствор в духовке при температуре 60 градусов по Цельсию в течение 30 мин.
ПРИМЕЧАНИЕ: Никакие осадки не должны образовываться. - Инкубировать образцы в свинцовом растворе Уолтона в течение 30 мин в духовке при температуре 60 градусов по Цельсию.
- Вымойте образцы, описанные в шаге 1.6.
- Обезвоживание образцов в EtOH в градуированных шагов 50%, 70%, 90% в ddH2O, а затем 2x в 100% EtOH. Используйте микроволновую программу 10(Таблица 1) и микроволновая печь подскажет пользователям каждые 40 с, чтобы заменить решение со следующим шагом EtOH. Это последний шаг, сделанный в микроволновой печи.
- Дальнейшее обезвоживание в 100% оксида пропилена 2x в течение 10 минут каждый на RT на скамейке, заменив раствор между шагами.
ПРИМЕЧАНИЕ: Оксид пропилена может растворить некоторые пластмассы, такие как полистирол; либо использовать стеклянные флаконы для этого шага или предварительно проверить пластмассы для сопротивления.
ВНИМАНИЕ: Оксид пропилена легко воспламеняется. Всегда обрабатывать с помощью соответствующего защитного оборудования и в дым капота. - Начните инфильтрацию корневых кончиков путем инкубации в 50% сперавой мизины оксидом пропилена (мин 2 ч).
ВНИМАНИЕ: Компоненты смелей Spurr являются раздражителями. Всегда обрабатывать с помощью соответствующего защитного оборудования и в дым капота. - Замените решение 100% Spurr's и оставьте на ночь на RT.
- Изменение на свежие 100% сперава в области социы 2 раза (мин 2 ч инкубаций).
- Поместите образцы в встраивающую форму, снова содержащую свежую 100% сперрную семерную, и полимеризуйте в духовке при температуре 65 градусов по Цельсию в течение 36–48 ч.
ПРИМЕЧАНИЕ: Используемое встраивание плесени зависит от типа ткани и подхода, используемого для визуализации. Здесь использовалась плоская силиконовая встраивающая плесень(рисунок 1A).
2. Подготовка встроенных образцов для визуализации
- Удалите образцы из духовки, удалите из встраивающей форму(рисунок 1B).
- Используя лезвие бритвы, примерно обрезать образец до блока максимум 0,5 мм х 0,5 мм х 0,5 мм(рисунок 1С).
ПРИМЕЧАНИЕ: Для предотвращения зарядки в SBF-SEM, важно, чтобы обрезать как можно больше голой осекрови, как это возможно и сделать образец как плоский / тонкий, как это возможно. В идеале все стороны блока уже содержат ткани, но самое главное, что сторона, которая будет прикреплена к металлической штырю (см. шаг 2.3), должна содержать открытые ткани так, чтобы ткань находилась в непосредственном контакте с проводящим металлом. - Удалите образец из посторонней смолы и прикрепите его к металлической штырь(рисунок 1D) с проводящей эпоксидной смолы, убедившись, что часть ткани касаясь металлической штифт. Пусть эпоксидная вылечить на ночь в духовке при температуре 65 градусов по Цельсию.
ПРИМЕЧАНИЕ: Убедитесь, что образец расположен в центре штифта, потому что движение сцены в SB-SEM ограничено. Удаление очень небольшой смолы заключен образец из дополнительной смолы может быть трудно, как небольшой образец будет иметь тенденцию улетать, когда отделены. Простое и эффективное решение этого заключается в том, чтобы покрыть образец с листом парафина фильм, как показано в дополнительном фильме ссылки1. - Закрепите носитель в держателе для ультрамикротома. Используйте лезвие бритвы, чтобы удалить излишки эпоксидной смолы и использовать ультрамикротом и алмазный нож, чтобы сгладить лицо и стороны блока, образуя пирамиду. Убедитесь, что по крайней мере некоторые ткани уже подвергаются на блок-лицо.
ПРИМЕЧАНИЕ: Дополнительный шаг использования алмазного ножа является необязательным, но это делает в результате блок легче подходить в SBF-SEM, потому что тень ножа на лице блока яснее, что делает оценку расстояния между ножом и блок лицо легче определить. - Поместите обрезанный блок образца в сбрызгируйте и покройте образец тонким слоем (2,5 нм) платины (Pt).
ПРИМЕЧАНИЕ: Платина на блок-лицо будет отрезана во время подхода в SBF-SEM (см. ниже), но платина по бокам пирамиды обеспечит дополнительную проводимость. В этом примере образец был покрыт платиной, но золото, или золото / палладий также эффективен; однако, покрытие золотом привело к увеличению мусора на блок-лицо во время запуска изображения.
3. Изображение в SBF-SEM
- Вставьте носитель в микроскоп SBF-SEM и принесите нож близко к поверхности образца. Использование алмазного ножа обрезки верхней части образца так, что слой Pt уже удалены и по крайней мере часть ткани подвергается.
ПРИМЕЧАНИЕ: Поскольку этот процесс отличается для каждого микроскопа SBF-SEM, не каждый шаг указан здесь. До тех пор, пока поверхность образца свободна от Pt и готова к визуализации, возможны следующие шаги. - Начало изображения с низким разрешением и короткие времена, чтобы получить обзор выборки и найти область интереса(рисунок 1E).
ПРИМЕЧАНИЕ: Здесь для оптимизации окна и регулировки фокуса использовалось 512 х 512 пикселей и 1 х 1 х времени. - Используя ускоряющее напряжение 1,5-2,0 кВ при токе 80-100 pA, захватывайте изображение ткани.
ПРИМЕЧАНИЕ: Приведенный здесь пример был изображен на высокой вакуумной системе, где луч ток должен быть скорректирован, чтобы свести к минимуму зарядку, которая очень зависит от образца. Как правило, электронный луч установлен на 1,5-2,0 кВ, но это будет зависеть от образца. При более высоких увеличениях (обычно 10 000 х) на режущий луч слишком сильно влияет луч, чтобы гарантировать плавное сечение, поэтому обычно размер пикселя устанавливается до 8–20 нм при размере изображения 8000–10 000 х 8000–1000 пикселей с соответствующими увеличениями 430 — 1400x и размеры поля 64 X 64 мм и 200 х 200 мм соответственно. - Определите интересуемую область и решите, сколько секций необходимо для покрытия объема интереса и запустите запуск изображения, используя рассеянный на спине электронный детектор.
ПРИМЕЧАНИЕ: В приведенном здесь примере 500 секций по 80 нм были изображены на 10 нм пикселей и 10000 х 10000 пикселей изображения (время пребывания 1 й). Микроскоп был установлен на 1,6 кВ и 100 pA. В целом количество секций зависит от выборки и размера окупаемого автомобиля и может варьироваться от 100 до 1000 с последовательных секций. Полученный набор данных состоит из отдельных изображений каждого раздела. Эти изображения должны быть преобразованы в 3D-стек.
4. Обработка данных SBF-SEM
- Используя Фиджи, выберите последовательность файлов-импорта изображений и найдите стек изображения для загрузки изображений. В зависимости от размера набора данных проверьте поле «использовать виртуальный стек».
ПРИМЕЧАНИЕ: Если набор данных действительно большой, сначала преобразуйте его в 8 бит (если собрано на 16 бит) и при необходимости бен данные, пока он не имеет работоспособного размера. - Использование кнопки воспроизведения в нижней части изображения прокрутите набор данных, чтобы увидеть, если запуск изображения был успешным. Проверьте типичные артефакты изображения для SBF-SEM, такие как секции, падающие с ножа на блок-лицо, зарядка в области голой мисинки, резка артефактов ножа (горизонтальные линии на изображении).
- С помощью командных свойств изображения отрегулируйте размер пикселей и глубину вокселя (т.е. толщину секции), используемые во время выполнения. Если данные уже связаны, примите это во внимание.
- Использование командных плагинов-регистрационно-линейный стек выравнивания с SIFT для регистрации данных.
ПРИМЕЧАНИЕ: Регистрация данных SBF-SEM необходима, поскольку во время визуализации может быть небольшое движение выборки из-за зарядки или дрейфа образца. Поскольку это лишь минимальное движение в XY, нужен только перевод. - Проверьте выравнивание, прокрутив набор данных, и если OK использует команду сохранения в меню файла, чтобы сохранить выровненный набор данных в виде файла 3D-tif.
- Тщательно проанализируйте набор данных, чтобы увидеть, включена ли рентабельность инвестиций и сопой информацию, необходимую для биологического вопроса. На последнем изображении стека (является текущим блок-лицом), выберите новую рентабельность инвестиций для изображения FIB-SEM.
ПРИМЕЧАНИЕ: Если нет хорошего региона для изображения FIB-SEM, присутствующей на текущем блок-лицо, больше разделов может быть вырезано из блока (который все еще находится в SBF-SEM) до тех пор, пока не появится рентабельность инвестиций. Существует ограничение на объем, который можно отобразить с ПОМОЩЬю FIB. Рентабельность инвестиций на изображении SBF-SEM может быть максимальной в X,Y 30-40 мкм х 15-20 мкм.
5. Изображение в FIB-SEM
- Возьмите обзор изображения образца в SBF-SEM, в идеале в том числе один или несколько краев образца, которые затем узнаваемы в FIB-SEM (Рисунок 2A, C).
ПРИМЕЧАНИЕ: В этом примере sBF-SEM обзор изображения были приняты на 10 нм размер пикселей, 8000 х 8000 пикселей на 1 й осязать времени. Микроскоп по-прежнему был установлен на 1,6 кВ и 100 pA. - Удалите образец из SBF-SEM и поместите в сфере распылителя. Пальто образца с платиной 20 нм для изображения FIB-SEM.
- Загрузка образца в FIB-SEM и с помощью вторичного электронного детектора на 15 кВ, 1 nA найти рентабельность инвестиций определены в SBF-SEM на блок-лицо(Рисунок 2B, D).
ПРИМЕЧАНИЕ: Изображение при 15 кВ необходимо видеть через платиновое покрытие. - Принесите рентабельность инвестиций на выборке в точку совпадения лучей FIB и SEM, двигая и наклоняя сцену(рисунок 3A).
ПРИМЕЧАНИЕ: Колонна FIB обычно устанавливается под углом(рисунок 3A). Это означает, что любой образец должен быть наклонен таким образом, чтобы поверхность, подавёт изображение и секционирование, расположилась параллельно лучу FIB. Поверхность, подавательная, теперь наклонена по отношению к лучу SEM, и траншея ткани должна быть удалена до того, как SEM сможет собразить рентабельность инвестиций(рисунок 3E) - Используя пучок FIB и систему впрыска газа, депозит 1 мм защитный слой платины на поверхности выше рентабельности инвестиций(рисунок 3C). Далее, используя низкий фрезерный ток (50-100 pA), мельница тонкие линии в платиновые осаждения для автоматической фокусировки и 3D слежения во время запуска изображений(Рисунок 3D). Используя колонку FIB и инжектор углеродного газа, покройте эти линии осаждением углерода.
ПРИМЕЧАНИЕ: Размер рентабельности инвестиций здесь соответствует размеру рентабельности инвестиций на изображении SBF-SEM, а максимальный размер может быть 30-40 мкм х 15-20 мкм. В этом примере была изображена рентабельность инвестиций в размере 17 мкм х 8 мкм. Осаждение углерода необходимо для защиты линий и создания черно-белого контраста между углеродом и платиной, который идеально подходит для автоматической фокусировки. Фрезерные токи, используемые для каждого шага, можно найти в таблице 2. - Используя высокий фрезерный ток, мельница траншеи 30 мкм перед рентабельностью инвестиций, создавая поверхность изображения для луча SEM(рисунок 3E).
ПРИМЕЧАНИЕ: Луч FIB по своей сути разрушительен, тем более при высоких токах. Убедитесь в том, чтобы сохранить изображения при высоких токах до минимума и изображения при низком увеличении и быстрых скоростях сканирования, чтобы избежать плавления мелина на рентабельность инвестиций. - Гладкая поверхность изображения с фрезерным током ближе к току, используемому во время запуска изображения. Остановить полировку, когда все автофокусировки и 3D отслеживания знаки четко видны на поверхности изображения(рисунок 3F). Прогресс FIB может сопровождаться визуализацией поверхности с помощью EM (с помощью обратно рассеянного детектора электронов) во время полировки.
- Определите область, которая будет изображена на вновь созданной поверхности, и установите параметры изображения. Убедитесь, что электронный луч ориентирован на поверхность, установите яркость и контрастность и установите толщину пикселя и секции. Держите время изображения ниже 1 минуты, регулируя время и среднее значение линии.
ПРИМЕЧАНИЕ: Важно использовать низкое напряжение для визуализации с электронным лучом, чтобы убедиться, что только поверхность блока изображена (т.е., что нет электронов из более глубокого образца изображены). Это делается путем поддержания напряжения ниже 2 кВ и с помощью обратно рассеянного электронного детектора с напряжением сетки, что позволяет только высокоэнергетические электроны, которые будут изображены. В этом примере электронный луч был установлен на уровне 1,5 кВ и 1 н.а. с сетевым напряжением 1,2 кВ на заднем рассеянном детекторе электронов. Кроме того, здесь, пиксель размером 5 нм был использован с 5nm разделы в результате чего набор данных с изотропными voxels. Область 17 мкм х 10 мкм была изображена на 6,5 й осязание времени и линии в среднем 1,0. - Установите окна для автоматической настройки и 3D-отслеживания, используя тот же размер пикселя, время и среднее значение линии, используемое для визуализации.
ПРИМЕЧАНИЕ: Этот процесс будет отличаться для различных систем, поэтому только шаг упоминается без указания различных действий. - Запустите запуск изображения и следите за стабильностью процесса в течение первых разделов 50–100. После того, как система работает гладко, выйти из комнаты и убедитесь, что есть как можно меньше нарушений в комнате, как это возможно.
ПРИМЕЧАНИЕ: Продолжительность пробега и количество секций будет зависеть от размера рентабельности инвестиций и толщины секции. В FIB-SEM ось на самом деле является высотой окна ROI на изображении SBF-SEM (максимум 15–20 мкм; Рисунок 3E). - Регистрация данных FIB-SEM так же, как описано выше, для данных SBF-SEM.
Результаты
Изображения из SBF-SEM обеспечивают обзор ткани, давая представление о пространственной ориентации клеток и межклеточных связей(рисунок 4A). Последующее изображение FIB-SEM на новом регионе, который, как правило, является областью интереса, определяемой после осмотра пробега SBF-SEM, добавляет деталь высокого разрешения конкретных ячеек и/или структур(рисунок 4B).
Рисунок 4C ,D показать разницу в рендеринге неизотропных вокселей данных SBF-SEM(рисунок 4C) и изотропных данных FIB-SEM (рисунок4D). Толщина z, используемая в SBF-SEM, означает, что рендеринг четко показывает секции, что приводит к эффекту «лестницы» на поверхности. В данных FIB-SEM разделы 5 нм гарантируют, что рендеринг выглядит гораздо более гладкой, а отдельные секции полностью вписываются в поверхность.

Рисунок 1: Создание блочной грани из встроенного образца из госины. (A) Корень наконечник встроенных в мизины. (B) Использование лезвия бритвы избыток мелиссы обрезается до блока 0,5 мм2 остается. (C,D) Обрезанный блок приклеивается на металлический штифт и после ночи в духовке, стороны блока обрезаются и поверхность сглаживается с помощью алмазного ножа с помощью ультрамикротома. (E) Внутри SBF-SEM, образец ориентирован так, что блок-лицо и рентабельность инвестиций могут быть признаны, шкала бар 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Корреляция между SBF-SEM и FIB-SEM. Обзор изображения блока лицо с помощью SBF-SEM (A) и FIB-SEM (B), шкала бар 5 мкм. (C,D) Увеличить на рентабельность инвестиций. Красная коробка очернеет область, которая будет изображена с FIB-SEM, панель масштаба 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: схема FIB-SEM и шаги по подготовке. (A) Схема, показывающая ориентацию луча FIB, луча SEM и образца. Образец должен быть расположен в точке совпадения FIB и SEM лучей, чтобы иметь возможность мельницы и изображения на той же области. (B) Схематический рисунок траншеи, необходимой для SEM изображения разделов удалены FIB. (C) Изображение, сделанное с пучком FIB, показывающим платиновые осаждения на рентабельности инвестиций, шкала бар 5 мкм. (D) Изображение, сделанное с пучком FIB, показывающим линии, используемые для автофокусировки и 3D слежения. Линии в середине используются для автофокусировки, а внешние линии обеспечивают 3D-отслеживание. Осаждение углерода на верхней части линий обеспечивает необходимый контраст (платина против углерода) для выполнения этих задач, шкала 5 мкм. (E) Изображение, сделанное с пучком FIB после фрезерования траншеи, шкала 5 мкм. (F) Изображение, сделанное с лучом SEM, показывающим пучок SEM области интереса, изображенных во время запуска FIB-SEM, масштаб бар 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
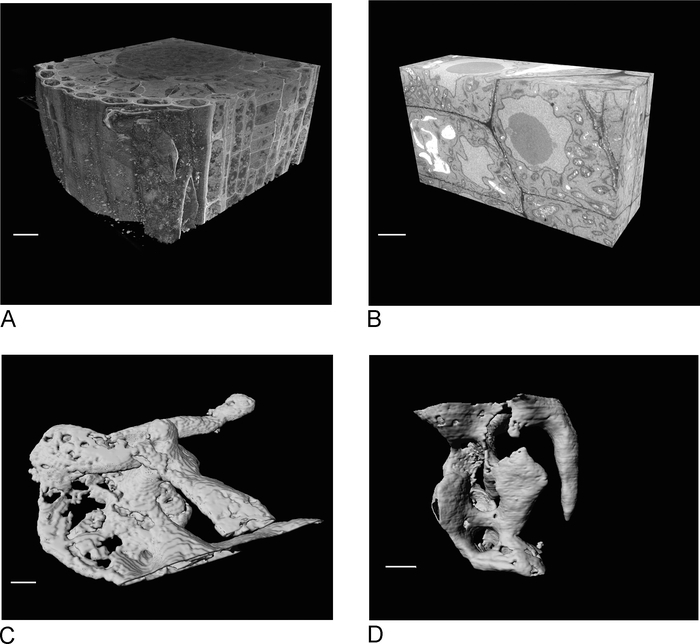
Рисунок 4: Результаты SBF-SEM и FIB-SEM до и после сегментации. (A) 3D-представление sBF-SEM набор данных (100 х 100 х 40 мкм, шкала бар 10 мкм), (B) 3D-вид FIB-SEM dataset (17 х 10 х 5,4 мкм, шкала бар 2 мкм), (C) Рендерированные vacuoles сегментированных из SBF-SEM данных по порогу, шкала бар. от данных FIB-SEM по пороговому значению, панель масштаба 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Протокол для микроволновой обработки | |||||||||
| Программа # | Описание | Запрос пользователя (в/выкл) | Время (hr:min:sec) | Мощность (Ватт) | Температура (КК) | Охладитель нагрузки (выкл/авто/на) | Вакуумный/Bubbler Насос (выкл/пузырь/вак цикл/вак на/вап) | Устойчивый темп | |
| Насос (в/выкл) | Температура (КК) | ||||||||
| 8 | Tch | ОФФ | 0:01:00 | 150 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 |
| ОФФ | 0:01:00 | 0 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:01:00 | 150 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| 9 | Осмий | ОФФ | 0:02:00 | 100 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 |
| ОФФ | 0:02:00 | 0 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:02:00 | 100 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:02:00 | 0 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:02:00 | 100 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| 10 | 50% EtOH | На | 0:00:40 | 150 | 50 | ОФФ | ОФФ | На | 30 |
| 70% EtOH | На | 0:00:40 | 150 | 50 | ОФФ | ОФФ | На | 30 | |
| 90% EtOH | На | 0:00:40 | 150 | 50 | ОФФ | ОФФ | На | 30 | |
| 100% EtOH | На | 0:00:40 | 150 | 50 | ОФФ | ОФФ | На | 30 | |
| 100% EtOH | На | 0:00:40 | 150 | 50 | ОФФ | ОФФ | На | 30 | |
| 15 | 0.1M CACODYLATE | На | 0:00:40 | 250 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 |
| 0.1M CACODYLATE | На | 0:00:40 | 250 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | |
| 15 | ddH2O | На | 0:00:40 | 250 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 |
| ddH2O | На | 0:00:40 | 250 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | |
| 16 | Уранил ацетат | ОФФ | 0:01:00 | 150 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 |
| ОФФ | 0:01:00 | 0 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:01:00 | 150 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:01:00 | 0 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:01:00 | 150 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:01:00 | 0 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
| ОФФ | 0:01:00 | 150 | 50 | ОФФ | ВАКУУМНЫЙ ЦИКЛ | На | 30 | ||
Таблица 1. Подробный протокол для микроволновой обработки.
| Шаг | Текущего | Ориентировочное время |
| Депозиция Платина | 3n А | 10-15 минут |
| Мельница Автонастройка и отслеживания знаков | 50-100 pA | 4-6 минут |
| Депозиция углерода | 3 nA | 5-10 минут |
| Мельница грубая траншея | 15-30 н.А. | 30-50 минут |
| Полировка поверхности | 1.5-3 nA | 15-20 минут |
| Запуск изображений | 700 pA-1.5 nA | Часы-дни |
Таблица 2. Фрезерационные токи FIB, используемые для подготовки образцов и выполнения изображений
Обсуждение
Объем электронной микроскопии является более сложным и трудоемким, чем обычные SEM или TEM. Из-за необходимости окрашить ткани или клетки ан блок, обработка шаги должны быть достаточно длинными, чтобы обеспечить проникновение реагентов во всем образце. Использование микроволновой энергии для облегчения проникновения делает для более короткой, более эффективной обработки и улучшает окрашивание. Поскольку подготовка к EM гораздо более строгая, чем для световой микроскопии, все растворы и реагенты должны строго контролироваться качественно. Изменения рН, тональность, использование нечистых реагентов и введение загрязняющих веществ из-за плохой техники могут иметь пагубные последствия для конечного изображения.
Том EM также требует индивидуально адаптированных протоколов для каждого типа выборки. Ткани млекопитающих различных типов: растения, одиночные клетки, такие как дрожжи, трипаносомы, C. elegansи т.д., все нуждаются в своих собственных вариациях для достижения оптимальных результатов. Фиксация и окрашивание должны быть разработаны таким образом, чтобы сохранить структурную целостность и сохранить образец как можно ближе к его морфологии in vivo. Фиксация тканей при физиологической температуре, рН и тонисти имеет решающее значение для создания образца, как жизнь, как это может быть. Замораживание образцов высокого давления (HPF) может помочь сохранить более жизнеспособную ситуацию (или, возможно, просто дать различные артефакты), но для других, чем клетки и очень тонкие ткани HPF не удастся, как стекловидный лед может быть создан только в небольших объемах. Поэтому для многих вопросов химическая фиксация является единственным вариантом. Независимо от того, если фиксация HPF или химических, в любом эксперименте EM структурные результаты должны быть тщательно по сравнению с аналогичными результатами из живых клеток или тканей изображения, чтобы увидеть, если они являются последовательными. Окрашивание также должно быть оптимизировано при рассмотрении конкретного вопроса, на который необходимо ответить, и протокола, который будет использоваться для визуализации цифровых изображений.
Наличие системы SBF-SEM и FIB в непосредственной близости является большим преимуществом во многих экспериментах. Большое поле зрения и высокое разрешение X,Y SBF-SEM делает поиск отдельных структур/клеток/событий простым и обеспечивает общую пространственную ориентацию клеток в тканях. Кроме того, его способность пропускать изображения через образец в К. является очень мощным; однако, реконструкции, требующие тонкой геометрической детали, могут выйти из строя или создать артефакты, используя эту технику, из-за неизотропных вокселей, которые она генерирует. FIB ограничен физикой процесса меньшим полем изображения, но его 3D-разрешение достаточно для очень точных реконструкций. Объединение двух методов является простым, как образцы могут перейти от SBF-SEM к FIB без дальнейшей обработки или подготовки. Мы признаем, что использование SBF-SEM для поиска по выборке, чтобы найти определенную область является очень дорогим использованием гораздо более способный инструмент. Тем не менее, возможность немедленно увидеть новый блок-лицо и определить, была ли рентабельность инвестиций достигнута является большим преимуществом. Кроме того, альтернативы использования серийных полутонких (0,5 мкм) LM разделов может удалить небольшие структуры, прежде чем они обнаружены, и проверки блока с помощью одного TEM разделы, которые должны быть вырезаны, положить на сетку, а затем рассматривать в столь же дорогих TEM не как эффективным, как представленный метод.
Поскольку существует много программ для сегментации и визуализации данных, а потребности данной структуры могут быть не в лучшем случае удовлетворены одним приложением, стандартный рабочий процесс не может быть предложен. Некоторые простые структуры могут быть сегментированы с помощью алгоритма порога, если они подпадают под очень узкие значения серой шкалы. Нейронные структуры могут быть полуавтоматически сегментированы с помощью такой программы, как Ilastik11, но она будет менее полезна на более случайных или сложных формеорганных органов, таких как ER. Microscopy Image Browser является очень гибкой программой, которая может выравнивать, сегментировать и визуализировать объем EM данных, но требует значительного взаимодействия с пользователем12. Как правило, количество времени, необходимого для цифровой визуализации результатов, значительно превысит время подготовки образца и визуализации.
Объем EM методы открыли третье измерение для ультраструктурного анализа. Другие методы получения 3D EM имеют ограничения по объему (Томография TEM) или их эффективности (серийный раздел TEM). Хотя по большей части методы ЭМ по объему являются слишком сложными и дорогостоящими для внедрения в отдельных лабораториях, число общих основных объектов, предлагающих их, растет, а число успешно отображаемых типов образцов быстро растет. Для тех, кто с конкретным вопросом и конкретной ткани, скорее всего, кто-то сможет дать советить и инструкции по его подготовке и визуализации. Оборудование EM тома можно улучшить для того чтобы включить емкость для того чтобы отрегулировать более большие образцы в SBF-SEM и способность фрезерования более больших ROIs с FIB. Программное обеспечение, способное более автоматизированно сегментировать структуры, представляющие интерес, значительно упростит процесс анализа данных, а улучшение вычислительной скорости сократит время, необходимое для этого. Несмотря на существующие ограничения, объем EM по-прежнему является полезным инструментом, и объединение SBF-SEM и FIB-SEM обеспечивает эффективный рабочий процесс для выявления редких событий и их визуализации с высоким разрешением.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Оборудование для объема EM было предоставлено щедрым грантом правительства Фландрии.
Материалы
| Name | Company | Catalog Number | Comments |
| 3View 2XP | Gatan | NA | In chamber ultramicrotome for SBFI |
| Cacodylate buffer 0.2M solution | EM Sciences | 11652 | |
| Conductive epoxy resin (circuit works) | RS components | 496-265 | |
| Diatome Histo 4.0mm diamond knife | EM Sciences | 40-HIS | |
| Digitizing tablet | Wacom | DTV-1200W | No longer available |
| Eppendorf tubes | Eppendorf | 0030 120.094 | |
| Flat Embedding Mold | EM Sciences | 70900 | |
| Gluteraldehyde 25% solution | EM Sciences | 16220 | |
| High MW Weight Tannic Acid | EM Sciences | 21700 | |
| Lead Citrate | Sigma-Aldrich | 22861 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Osmium Tetroxide 4% solution | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Pelco Biowave Pro + | Ted Pella | 36700 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P3289 | |
| Quorum Q150T ES sputter coater | Quorum Technologies | 27645 | |
| Reichert-Jung Ultracut ultramicrotome | NA | NA | No longer available |
| Sodium Cacodylate 0.2M | EM Sciences | 11653 | |
| Spurrs Resin kit | EM Sciences | 14300 | |
| Uranyl Acetate | EM Sciences | 22400 |
Ссылки
- Linberg, K. A., Fisher, S. K. An ultrastructural study of interplexiform cell synapses in the human retina. Journal of Comparative Neurology. 243, 561-576 (1986).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Leighton, S. SEM images of block faces, cut by a miniature microtome within the SEM – A technical note. Scanning Electron Microscopy. (pt 2), 71-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three dimensional tissue nanostructure. PLoS Biology. 11, 329 (2004).
- Heymann, J. A., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- . NCMIR Methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. V7_01_10 Available from: https://ncmir.ucsd.edu/sbem-protocol (2019)
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastructural Pathology. 27 (3), 187-196 (2003).
- Kremer, A., et al. Developing 3D EM in a broad biological context. Journal of Microscopy. 259 (2), 80-96 (2015).
- Vanslembrouck, B., Kremer, A., Pavie, B., van Roy, F., Lippens, S., van Hengel, J. Three-dimensional reconstruction of the intercalated disc including the intercellular junctions by applying volume scanning electron microscopy. Journal of Histochemistry and Cell Biology. 149, 479-490 (2018).
- Russel, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Sommer, C., Strähle, C., Köthe, U., Hamprecht, F. A. ilastik: Interactive Learning and Segmentation Toolkit. Eighth IEEE International Symposium on Biomedical Imaging (ISBI). Proceedings. , 230-233 (2011).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLoS Biology. 14 (1), e1002340 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены