Method Article
Изготовление внеклеточного матрикса, производных Пены и микроносителями как Тканеспецифическая культуре клеток и платформ доставки
В этой статье
Резюме
Тканеспецифический внеклеточный матрикс (ЕСМ) является ключевым медиатором клеточной функции. В этой статье описаны методы синтеза чистых ECM полученных пенопластов и микроносители , которые являются стабильными в культуре без необходимости химического сшивания для применения в передовых 3D моделей в пробирке клеточных культур или в качестве про-регенеративные bioscaffolds.
Аннотация
Функция клеток опосредована взаимодействием с внеклеточным матриксом (ECM), который имеет сложную тканеспецифическую композицию и архитектуру. Основное внимание в этой статье о методах изготовления ECM полученного пористых пен и микроносителей для использования в качестве биологически соответствующие субстратов в передовых 3D в пробирке моделей клеточных культур или как про-регенеративные подмостей и системы доставки клеток для тканевой инженерии и регенеративной медицины. Использование decellularized ткани или очищенный нерастворимый коллагена в качестве исходного материала, методики могут быть применены для синтеза широкого спектра тканеспецифического bioscaffolds с настраиваемой геометрией. Подход включает механическую обработку и мягкое ферментативное переваривание с получением суспензии ЕСМА, который используется для изготовления трехмерной пены или микроносителей через контролируемые процедуры замораживания и лиофилизации. Эти чистый ECM полученных каркасы имеют высокую пористость, но стабильные без необходимости химичесааль сшивающие агенты или другие добавки, которые могут отрицательно воздействовать на функцию клеток. Свойства строительных лесов могут быть настроены в некоторой степень различных факторов, такие как концентрация ECM суспензии, механические методы обработки или условия синтеза. В общем, каркасы надежны и просты в обращении и могут быть обработаны в качестве тканей для большинства стандартных биологических анализов, обеспечивая универсальную и удобную платформу 3D культуры клеток, который имитирует нативный состав ECM. В целом, эти простые методы для изготовления пользовательского ECM полученных пенопластов и микроносителей могут представлять интерес для обоего биологов и биомедицинских инженеров как ткан-специфических клетки-поучительны платформы для ин витро , так и в естественных условиях применения.
Введение
Внеклеточный матрикс (ECM) , состоит из сложной 3D - сети белков, гликопротеинов и полисахаридов 1. После того, как рассматриваются как преимущественно структурная основа, теперь хорошо известно , что ECM включает в себя широкий спектр биологически активных молекул с важными функциональными ролями 2. Cell-ECM взаимодействия могут направлять выживаемость клеток, адгезии, миграции, пролиферации и дифференцировки 3. В то время как основные классы ECM макромолекул , как правило , хорошо сохраняются через ткани и виды, каждая ткань имеет уникальную матрицу состав и архитектуру 4. В целом, ЕСМ тканеспецифический обеспечивает поучительную микросреду , который опосредует функцию от субклеточного в масштаб ткани / органе 5.
Из-за важной роли ЕСМ в опосредовании клеточной функции, там растет интерес к деvelopment из ECM полученных bioscaffolds для применения в тканевой инженерии и регенеративной медицине. В частности, метод decellularization широко исследован в качестве средства получения ЕСМА из широкого диапазона тканей для использования в качестве материала для строительных лесов регенерации тканей и доставок клеток 5, 6, 7. Decellularization , как правило , включает в себя ряд механических, химических и / или биологических стадий обработки , направленных на удаление клеток и клеточных компонентов, в то время как в идеале вызывая минимальные изменения в 3D - структуры и состава ECM 8. Через рассматривая литературу, различные протоколы decellularization могут быть идентифицированы практически для всех тканей в организме 7.
В то время как decellularized ткань может быть использована непосредственно в качестве имплантируемых каркасов или 3D подложек для культивирования клеток, клеточная инфильтрация можетбыть ограничены в тканях с плотной структурой ECM 9. Кроме того, естественная гетерогенность в ECM может привести к вариабельности прикрепления клеток и распределение в пределах decellularized матриц, которые потенциально могли бы повлиять на клеточный ответ 10. В целом, в то время как перспективные для некоторых приложений, применяя decellularized ткани в их интактной форме предлагает ограниченную гибкость в терминах свойств настройки строительных лесов , включая форму, пористость и жесткость, а также способ доставки для применения в естественных условиях.
Чтобы обойти эти ограничения, многочисленные исследовательские группы применяют дополнительные методы обработки для создания пользовательских форматов с использованием строительных лесов decellularized ткани в качестве основного материала. В простейшей форме, это может включать в cryomilling decellularized ткани для генерации инъекционных частиц ECM тканеспецифических 11. Эти частицы ECM могут быть включены в качестве клеток-инсctive компонент в композитных каркасах с другими биоматериалов, например, в месте сшивания гидрогели 12, 13, 14. В дополнении к механической обработке, decellularized ткань также может быть подвергнута ферментативным расщепление с протеолитическими и / или гликолитическими ферментами для изготовления ECM полученных гидрогелей, пен, микроносителей, и покрытиями 15, 16, 17, а также для синтеза bioinks для 3D печати 18.
В дополнении к ткани-инженерным приложениям, ECM полученных bioscaffolds обладают большим потенциалом для генерации более высокой точности в моделях пробирки для биологических исследований. Существует значительная потребность в разработке 3D - систем клеточных культур , которые лучше резюмировать родной клеточное микроокружение 19. Большинство в пробирке сELL исследование культуры на сегодняшний день проводится на тканевой культуре полистироле (ТКТ), который имеет небольшую корреляцию с биологически сложной и динамичной средой клеточной найденной в живых тканях 20. В то время как удобно для изучения клеточных взаимодействий в контролируемой среде, культивирования клеток на этих упрощенных жестких подложек 2D изменяет прикрепление клеток и морфологию, а также как клетка-клетка и клеток-ECM взаимодействиях 21, 22. Клеточные приспособления , наблюдаемые на 2D ПСКАХ могут воздействовать на внутриклеточные сигнальные путях , которые регулируют различные клеточные функции , включая выживание, пролиферацию, миграцию и дифференциацию, поднимая вопросы актуальности 2D исследований в области моделирования в системах 23 естественных условия. Там было более широкое признание , что клеточное поведение может значительно варьироваться в 2D по сравнению с системами 3D 24, и что биохимические и биomechanical сигнализация с ECM являются ключевыми медиаторами клеточной функции 25. Многие группы пытались преодолеть ограничения, установленные 2D систем путем покрытия ТКТ с компонентами ECM, такие как коллаген, ламинин, фибронектин и. Хотя эти стратегии могут улучшить прикрепление клеток и могут изменить клеточные ответы, эти модели остаются ограничены их 2D - конфигурация, не имитирует сложную пространственную организацию или биохимию родной ECM 26, 27.
Наша биоинженерия лаборатория была заинтересована в разработке ECM производных bioscaffolds в качестве субстратов для 3-D культуры клеток и тканей инженерных приложений. В частности, мы были пионерами использования decellularized жировой ткани (DAT) в качестве подмостей платформы для жировых регенераций 28. Кроме того, мы установили методы синтеза 3D микроносителей и пористых пенопластов с использованием DАТ расщепляли протеолитического фермента пепсина или гликолитического фермента α-амилазы 29, 30, 31. Следует отметить, что мы продемонстрировали во всех этих форматах строительных лесов, что полученную из жировой ткани ЕСМ обеспечивает индуктивную микросреду для адипогенной дифференцировки стволовых / стромальных клеток человека, полученных из жировой ткани (ИСС) в культуре. Совсем недавно мы расширили наши методы изготовления для создания 3D пористых пенопластов из α-амилаза-переваренных свиного decellularized левого желудочка (DLV) (методы decellularization , адаптированные из Уэйнрайт и др. 32), и показали , что они обеспечивают вспомогательную платформу для индуцирования раннего cardiomyogenic выражение маркеров в человеческом перикарде жира , полученные ИССАХ 31.
В данной статье подробно описаны методы синтеза не-химически сшитые 3D пористых пен и микроносители, полученные чистоиз альфа-амилазы-переваренная ECM для использования в качестве биологически сложная 3D в пробирке субстратов для культивирования клеток и в качестве биоматериалов для регенерации тканей. Теоретически, любой источник ЕСМ, содержащий коллаген с высокой молекулярной массы могут быть использованы в качестве исходного материала для этих методов. Для того, чтобы продемонстрировать гибкость данного подхода, методы были применены для создания тканеспецифического bioscaffolds с использованием человеческого DAT, свиной decellularized кожной ткань (ДДТ) 8, и свиной DLV в качестве репрезентативных примеров. На рисунке 1 представлен визуальный обзор процесса изготовления для ECM полученных пен и микроносителей.

Рисунок 1. Обзор методов для производства Тканеспецифическая ECM полученных пен и микроносителей. 1. Decellularized ткани, полученной в соответствии с установленной Decellularization протоколы, могут быть использованы для изготовления bioscaffold тканеспецифической ECM происхождения. Макроскопические изображения показаны гидратированного человека DAT (полученного , как описано в Flynn 2010 28), свиного ДДТ (полученного , как описано в Reing, JE, и др. 2010 8), и свиной DLV (полученного , как описано в Wainwright и др. 2010 32 ), в качестве репрезентативных примеров источников ECM, которые могут быть использованы в качестве исходных материалов. Масштабные столбики представляют 3 см. 2. decellularized ткань лиофилизировала, а затем механически 3. фарша. Масштабные полоски обозначают 1 см. 4. рубленого ЕСМ может быть затем cryomilled, который является необязательным для изготовления пены, но необходим для синтеза микроносителя. Шкала бар представляет собой 3 мм. 5. рубленого или cryomilled ЕСМ затем переваривают с альфа-амилазы и гомогенизируют для создания гомогенной суспензии ECM. Шкала бар представляет собой 1 см. 6а) Для изготовления пены, ЕСМ суспензия переносит в определенном пользователе форме, замораживают и лиофилизует , чтобы создать пористый 3D леску с хорошо определенной геометрией. Шкала бар представляет собой 1 см. 6б) Для изготовления микроносителя, то cryomilled ЕСМА суспензия electrosprayed для генерации дискретных сферических микроносителей. Шкала бар представляет 2 мм. 7. Пенопласты и микроносители могут быть затем постепенно регидратация и засевали клетки. Представительные изображения показаны человеческие ИСС (жизнеспособные клетки = зеленый) высевали на ДАТЫ пены (слева) и DAT микроносителе (справа). Шкала столбцы представляют 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
протокол
1. Decellularized обработки тканей
- Decellularization и лиофилизации
- Decellularize ткань (ы), представляющие интерес после установленного протокола.
Примечание: Каркасы в текущем исследовании были подготовлены следующие опубликованные протоколы decellularization для человека DAT 28, свиных DDT 8 и свиньи DLV 32. Коммерчески доступный, не растворимый коллаген также может быть использован для изготовления пены и микроносителей, таких как коллаген получен из бычьего сухожилия, который был успешно использован в диапазоне концентраций от 10 - 50 мг / мл. Другие нерастворимые источники коллагена могут быть использованы, но могут потребовать оптимизации, чтобы определить диапазон концентраций, что позволит получить устойчивые подмости. - Передача гидратированного decellularized ткани или очищенный коллагена в 50 мл центрифужной пробирки с пинцетом и добавить достаточное количество дистиллированной воды двойной (DDH 2 O) , чтобы погрузить ткани, тгабаритная максимальный общий объем 35 мл.
- Замораживание образца в течение ночи при -80 & deg; С, с центрифужной пробирки, расположенной горизонтально при замораживании, чтобы максимизировать площадь поверхности для сублимации во время последующей лиофилизации.
- Удалить колпачок с трубки центрифуги и передачи замороженного образца в лиофилизации банку.
- Лиофилизации образца с использованием сублимационной сушилки лабораторной в течение 48 - 72 ч или до полного высыхания.
Примечание: Время сушки может изменяться для различных лиофилизаторов и decellularized тканей. - Мелко фарш лиофилизированного ECM на мелкие кусочки (~ 1 - 2 мм 3) , используя острые хирургические ножницы.
- Храните рубленую ECM в эксикаторе до готовности для дальнейшей обработки.
Примечание: Рекомендуется, чтобы фарш ЕСМ быть использован немедленно, чтобы предотвратить поглощение влаги из окружающей среды.
- Decellularize ткань (ы), представляющие интерес после установленного протокола.
- Cryomilling (опция для изготовления пены)
- Наполните из нержавеющей стали шлифовальной камеры 25 мл для laboratoчень система стана шарика с мясным лиофилизированным ECM и добавить два 10 мм из нержавеющей стали помольных шаров.
- Закрыть и полностью погрузить загруженную шлифовальную камеру в жидком азоте в течение 3 мин.
- Мельница замороженного образца в течение 3 мин при 30 Гц (1800 оборотов в минуту).
- Повторите шаги 1.2.2 и 1.2.3, пока ECM не измельчают в мелкий порошок.
Примечание: Количество раз, эти шаги должны быть повторены могут различаться между источниками ECM. Например, как правило, требуют DAT-3 циклов фрезерования для создания тонкого порошка. - Передача порошок с помощью Кулинарная лопатка в стеклянную пробирку, плотно запечатать и хранить в эксикаторе.
- ЕСМ Подвеска Получение
- Взвешивают 250 мг либо фарша (для пен) или cryomilled (для пенопластов или микроносителей) ECM и передать его в 15 мл центрифужную пробирку. Обратитесь к шагу 1.1.6 и раздел 1.2 для приготовления фарша ECM и cryomilled ECM, соответственно.
Примечание: Этот протокол предназначен для подготовки 50 мг / мл ЕСМ suspenSion, который рекомендуется для человека DAT, свиного ДДТ и свиных DLV. В зависимости от конкретного источника ECM, однородные суспензии могут быть получены при более высоких или более низких концентрациях исходных. - Добавляют 5 мл 0,22 М NaH 2 PO 4 (рН 5,4) буфера в центрифужную пробирку и отметьте уровень жидкости на трубе.
- Подготовьте альфа-амилазы исходного раствора добавлением 7,5 мг альфа-амилазы до 1 мл 0,22 М NaH 2 PO 4 (рН 5,4) буфера. Добавьте 100 мкл альфа-амилазы исходного раствора (0,75 мг альфа-амилазы; 0,3% вес / вес сухой ткани) к образцу. Добавить 0,22 М NaH 2 PO 4 , чтобы получить конечный объем 10 мл.
- Перемешивают суспензию непрерывно со скоростью 300 оборотов в минуту в течение 72 ч при комнатной температуре.
- Центрифуга суспензии при 1500 мкг в течение 10 мин. Осторожно собрать и отбросить супернатант, не нарушая переваривается ECM гранул. Ресуспендируют гранулированный материал в 10 мл 5% NaCl , разбавленный в DDH 2 O.
- Повторите шаг 1.3.5 в общей сложности двух промывок с 5% NaCl в DDH 2 O.
- Удалите супернатант и ресуспендируют гранулированный материал в 10 мл DDH 2 O.
- Перемешивают суспензию непрерывно со скоростью 300 оборотов в минуту в течение 10 мин при комнатной температуре.
- Центрифуга суспензии при 1500 мкг в течение 10 мин. Осторожно собрать и отбросить супернатант, не нарушая переваривается ECM гранул.
- Добавить 0,2 М уксусной кислоты до метки 5 мл сделанного на шаге 1.3.2.
- Перемешивают суспензию непрерывно при 120 оборотов в минуту O / N при 37 ° С.
- Однородный ЕСМ суспензии при комнатной температуре в десяти-секундных интервалах с использованием ручного гомогенизатора, снабженным зубец 10 мм шириной зондом, пока никаких видимые фрагменты не остались. Поместите суспензию в химическом стакане холодной воды между интервалами гомогенизации, чтобы предотвратить перегрев.
Примечание: В зависимости от источника ECM, дополнительное разбавление в 0,2 М уксусной кислоты, которые могут потребоваться для получения гомогенной суспензии. Еxcessive охлаждение суспензии ECM может привести к увеличению вязкости, которые могут помешать эффективной гомогенизации. Если увеличение вязкости отмечено, образец может быть согревали до 37 ° С и подвергают дальнейшей обработке. - Хранить при температуре 4 ° С в течение до одного месяца до пены или микроносителя изготовления.
- Взвешивают 250 мг либо фарша (для пен) или cryomilled (для пенопластов или микроносителей) ECM и передать его в 15 мл центрифужную пробирку. Обратитесь к шагу 1.1.6 и раздел 1.2 для приготовления фарша ECM и cryomilled ECM, соответственно.
2. ЕСМ происхождения пены Изготовление
- Инкубируйте ECM суспензии со стадии 1.3.13 (рубленое или cryomilled) при 37 ° С при непрерывном перемешивании со скоростью 120 оборотов в минуту до тех пор, пока суспензия тепло.
- Развести ECM суспензии в 0,2 М уксусной кислой до желаемой концентрации.
Примечание: В зависимости от источника ECM, стабильные пены могут быть получены в диапазоне 10 - 100 мг / мл, с 15 - 50 мг / мл в качестве рекомендованного диапазона для DAT, ДДТ и DLV. Как правило, пенопласты, изготовленные при более высоких концентрациях будут немного менее пористыми, но более стабильными в культуре и проще в обращении. - С помощью шприца 3 мл шIth с иглой 18 G, чтобы предотвратить образование пузырьков в ECM суспензии, заполнить нужную форму с ЕСМ подвеской. Для того, чтобы изготовить DAT, ДДТ, и DLV пенопластов, обойтись 400 мкл 35 мг / мл ЕСМ суспензии в культуральной пластины обрабатывают 48-луночный.
Примечание: Форма выбранной формы и объем ЕСМ суспензии будут определять геометрию полученной пены. - Накройте и заморозить формы в течение ночи, помещая их в -20 ° С или -80 ° C морозильнике.
Примечание: Температура замерзания может повлиять на пористость пены. Более крупные поры , как ожидается , когда образцы замораживают при -20 ° C , по сравнению с -80 ° С из - за образования крупных кристаллов льда 33. Для изготовления пенопластов с однородной пористой структурой, убедитесь, что пресс-форма не находится в контакте с проводящей поверхностью для предотвращения направленного охлаждения. - Поместите пресс-форму, содержащую замороженные образцы в лиофилизаторе колбу. Подключите лиофилизации колбу к лабораторнуORY система сублимационной сушки и сухой в течение 24 ч.
Примечание: Очень важно, что образец остается замороженным до лиофилизации. - Хранить лиофилизированные пенопласты в эксикаторе, пока не требуется.
3. ЕСМ полученного микроноситель Изготовление с помощью Electrospraying
Примечание: обзор electrospraying установки показано на рисунке 2.
- Инкубируйте cryomilled ECM суспензии со стадии 1.3.13 при температуре 37 ° C при непрерывном перемешивании при 100 оборотов в минуту O / N.
Примечание: Cryomilled ЕСМ используется для изготовления ECM полученных микроносителей для обеспечения большей однородности в суспензии и предотвращение засорения во время electrospraying. - Нагрузка 3 мл ЕСМ суспензии в 3 мл шприца Luer замка и прикрепить крылатый инфузионный набор на отверстие шприца.
Примечание: Диапазон датчиков игл может быть использован, учитывая, что выбор может влиять на размер и форму получаемых микроносителей. Для изгое микроносителей DAT, ДДТ, и DLV, использовать 25 G иглу. - Безопасный шприц внутри шприцевой насос. Закрепить иглу в штативу и поместите кончик иглы вертикально на расстоянии 4 - 6 см от верхней части сосуд Дьюара с низким уровнем формы (250 - 500 мл диапазон размеров рекомендуется).
- Приложить крокодил электрода к наконечнику иглы и подключить его к положительному выводу источника питания высокого напряжения.
- Сложить полоску алюминиевой фольги (12 х 5 см) над краем вакуумной колбы.
- Приложить второй крокодил электрода к внешнему краю фольги и подсоединить его к источнику заземления клемме источника питания.
- Заполните сосуд Дьюара с жидким азотом до примерно 1 см от верха, так что три четверти фольга погружен в воду.
Примечание: Очень важно, чтобы держать сосуд Дьюара, заполненный жидким азотом. Поверхность жидкого азота должна быть не менее 2 см от верхней части колбы в течение electrospraying предпосаs. Непрерывное заполнение жидкого азота требуется для поддержания постоянного уровня в течение electrospraying. - Установить шприцевой насос к скорости инфузии 30 мл / ч.
Примечание: Изменение скорости инфузии может изменить форму микроносителя и диаметр, но рекомендуемый диапазон 25 - 35 мл / ч. В то время как она сильно зависит от вязкости суспензии, скорость потока ниже 25 мл / ч может привести к образованию более крупных микроносителей. При очень низких скоростях потока, размер и форма микроносителей могут стать менее однородными. При скорости инфузии выше 35 мл / ч, однородность капель , генерируемых с помощью electrospraying может быть нарушена, что приводит к несферическим микроносителям с более широким распределением по размерам 34. - Нанести напряжение 20 кВ и включите шприцевой насос, чтобы инициировать electrospraying.
Примечание: Напряжение может быть изменен, чтобы настроить размер микроносителей, и как правило, имеет большее влияние на диаметре, чем Infusioп ставка. Рекомендуемый диапазон напряжения 15 - 25 кВ. Уменьшение диаметра микроносителя , как ожидается , с увеличением напряжения 35. - После того, как вливание завершено, осторожно сливают избыток жидкого азота из сосуда Дьюара, оставляя микроносителей суспендированные в ~ 25 мл жидкого азота, чтобы гарантировать, что они остаются замороженными.
- Немедленно передать микроносители с жидким азотом в 50 мл центрифужной пробирки путем заливки одним плавного движения. Соберите все замороженные микроносителей, оставшиеся в сосуде Дьюара с Кулинарная лопатка и добавить их в пробирку для центрифугирования.
Примечание: В зависимости от размера сосуда Дьюар, микроносители в жидком азоте могут быть изначально выливают в среднем размере судно, а затем переносили непосредственно в мл центрифужной пробирки 50. - Накройте центрифужную пробирку, содержащее микроносители в жидком азоте с алюминиевой фольгой с перфорированной малыми отверстиями в подготовке к лиофилизации.
- Поместите покрытую центрифугупробирки в лиофилизующей колбу. Немедленно подсоединить колбу к лиофилизации и высушить образцы O / N.
Примечание: Очень важно, чтобы держать микроносители суспендированных в жидком азоте, чтобы гарантировать, что они не оттаивают перед этим шагом, как и оттаивание может привести к коллапсу и / или агрегации. DAT, ДДТ и DLV микроносителей, изготовленные при концентрации 35 мг / мл с использованием условий, описанных выше electrospraying, как правило, имеют диаметр гидратированный в диапазоне от 350 - 500 мкм. Распределение по размерам может варьироваться в зависимости от источника ECM. - Хранить лиофилизированные микроносители в эксикаторе, пока не требуется.
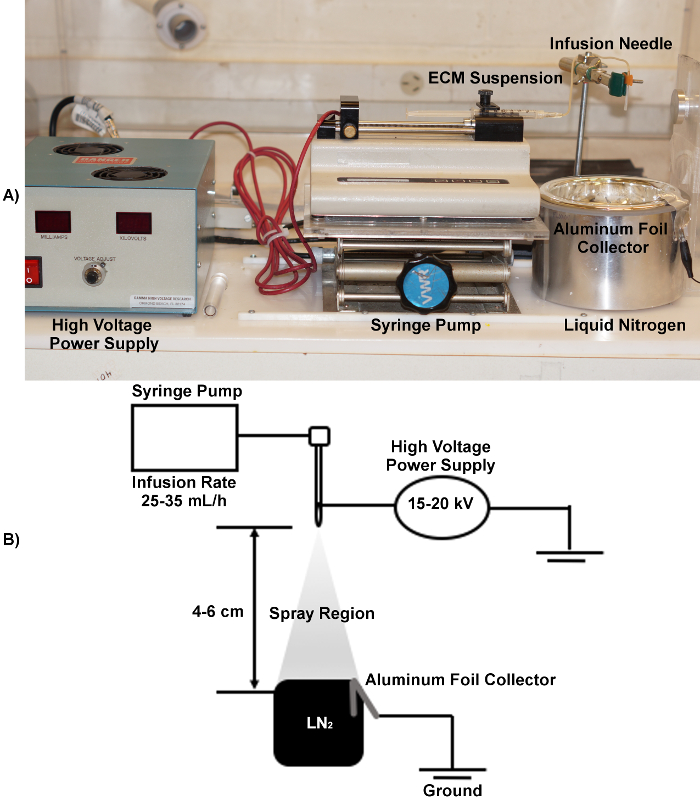
Рисунок 2. Обзор аппарата Electrospraying , используемого в микроносителя Fabrication. A: Изображение показывает расположение ключа electrospraying оборудования , включая шприцевой насоси высоковольтный источник питания, а также позиционирование иглы относительно Дьюара с жидким азотом. Б: Electrospraying схемы, в том числе рекомендуемых диапазонов для напряжения, скорости инфузии, и расстояния. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
4. Подготовка Пены и микроносителей для культивирования клеток
- Регидратация
- Передача лиофилизированных пенопластов с пинцетом в 50 мл центрифужной пробирки, содержащей избыток абсолютного этанола (~ 99,9%) (~ 5: 1 соотношения этанола и пену). Точно так же, ресуспендировании лиофилизированных микроносителей в избытке абсолютного этанола в пределах исходной трубки центрифуга, используемой для сбора. С помощью серологической пипетки, фильтровать микроносители через сито из нержавеющего с определенным размером ячеек в новую 50 мл центрифужной пробирку, чтобы удалить любые агрегаты и выберите требуемые диапазоны размеров.
Примечание: Если пенопласты изготавливаются в ТКТ пластин, они могут быть регидратации непосредственно в этих судах. - Инкубирует при температуре 4 ° С в течение 4 ч или до тех пор, пена или микроносители не имеют силы тяжести осели на дно трубки центрифуга. Выполнить все последующие шаги в ламинарном потоке с использованием стерильных реагентов и надлежащей асептической техники.
- Удалить абсолютный этанол с помощью серологической пипетки и добавить избыток (5: 1 соотношение) 95% этанола разбавляют стерильным физиологическим раствором с фосфатным буфером (PBS) в каркасах. Инкубируют при температуре 4 ° С в течение 4 ч или до тех пор, ECM полученные каркасы не опустились на дно регидратации судна.
- Постепенно регидратации строительных лесов через серию этанола (90, 85, 80, 75, 70, 50, 25 и 0%, разбавляет стерильную PBS). На каждом шаге, инкубировать при температуре 4 ° С до тех пор, пока каркасы опустились до дна сосуда перед заменой раствора. Дегазировать каркасы под действием света в вакууме, если образование пузырьков внутри каркасов является наблоerved.
- Заменить стерильную PBS в течение дополнительных двух промывок для удаления остаточного этанола.
- Хранить в 100% стерильной PBS при 4 ° С до готовности к клеточной культуре. Используйте каркасы в течение 1 - 2 недель после регидратации.
- Передача лиофилизированных пенопластов с пинцетом в 50 мл центрифужной пробирки, содержащей избыток абсолютного этанола (~ 99,9%) (~ 5: 1 соотношения этанола и пену). Точно так же, ресуспендировании лиофилизированных микроносителей в избытке абсолютного этанола в пределах исходной трубки центрифуга, используемой для сбора. С помощью серологической пипетки, фильтровать микроносители через сито из нержавеющего с определенным размером ячеек в новую 50 мл центрифужной пробирку, чтобы удалить любые агрегаты и выберите требуемые диапазоны размеров.
- Подготовка к посеву клеток
- В день перед посевом, передавать пенопласты с использованием щипцов в клеточной культуру , обработанная луночные планшеты или Transwell вставки и добавить достаточное количество среды для культивирования клеток (выбранная на основе типа клеток , представляющего интереса) , чтобы полностью погрузить каркасы (например, 2,5 мл / строительные леса в 12-луночный планшет). Аналогичным образом, позволяют микроносители к тяжести оседать в центрифужной пробирке, осторожно удалить PBS с помощью серологической пипетки, не нарушая микроносители, и добавить среду для культивирования клеток для достижения 5: 1 отношения среды к микроносителям.
Примечание: Для затравки человека ИСС, используют модифицированную среду Дульбекко Игла (DMEM): F12, питательная смесь Хэма с добавлением10% фетальной бычьей сыворотки (FBS), и 1% пенициллина-стрептомицина. - Заменить среду для культивирования клеток в общей сложности одного полоскания.
- Равновесие ночной каркасы в клеточной культуральной среды при 37 ° С. Каркасы будут готовы к клетке высева на следующий день.
Примечание: пенопласты могут быть статически высевают в вставок культуры клеток или культуры тканей пластин 29, или динамически высевают с помощью лабораторной шейкер 36. В зависимости от источника ECM, методов обработки и концентрации суспензии, динамическая затравки может усилить первоначальное прикрепление клеток, пролиферацию и инфильтрацию. Микроносители могут быть посеяны динамически с использованием системы 11 культуры спиннера.
- В день перед посевом, передавать пенопласты с использованием щипцов в клеточной культуру , обработанная луночные планшеты или Transwell вставки и добавить достаточное количество среды для культивирования клеток (выбранная на основе типа клеток , представляющего интереса) , чтобы полностью погрузить каркасы (например, 2,5 мл / строительные леса в 12-луночный планшет). Аналогичным образом, позволяют микроносители к тяжести оседать в центрифужной пробирке, осторожно удалить PBS с помощью серологической пипетки, не нарушая микроносители, и добавить среду для культивирования клеток для достижения 5: 1 отношения среды к микроносителям.
Результаты
В настоящем исследовании мы изготовили ECM полученных пенопластов и микроносители с использованием человеческих DAT, свиной ДДТ и свиной DLV в качестве типичных примеров, демонстрирующих, что методы могут быть применены для создания bioscaffolds тканеспецифического с использованием различных decellularized тканей в качестве источников (ECM Рисунок 1). Для обоих пены и микроносителя изготовления, метод Нисихара коллагена солюбилизации с гликолитического фермента альфа-амилазы 37, выполненный с возможностью формирования вязкого ECM суспензии из decellularized ткани исходных материалов, который используется для синтеза bioscaffolds посредством контролируемых процедур замораживания и лиофилизации.
Для изготовления пенопластов, в decellularized ткани могут быть обработаны либо через механические или измельчения cryomilling, чтобы увеличить площадь поверхности перед ферментативным расщеплением. Следующий45; амилазы обработки и гомогенизации, в результате ЕСМ суспензию разливают в определенной пользователем пресс-формы, который затем замораживают и лиофилизируют. Эти каркасы могут быть сохранены стабильно в сухом состоянии в течение длительного периода времени. Перед использование в исследованиях на культуре клеток, лиофилизированные каркасы должны быть подвергнуты контролируемым процесс регидратации , который дает пористые и высоко гидратированные однородные пенопласты , полученным из чистого ECM (Рисунок 3A). Если пены регидратации слишком быстро, быстрое набухание может повредить тонкие структурные особенности, что приводит к потере целостности и разрушения конструкций. В общем, пены будет сохранять форму, определяемую исходной формы следующей регидратации и являются стабильными без необходимости химического сшивания. Фигура 3В показывает представитель сканирующего электронного микроскопа (SEM) изображений DAT, ДДТ и DLV пенопласты изготовлены с cryomilled ECM при концентрации 35 мг / мл и при температуре замораживания от -80 & #176; С.
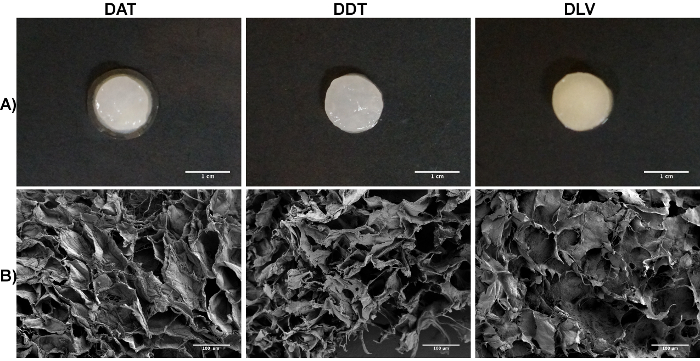
Рисунок 3. Типичные Изображения DAT, ДДТ и DLV пеноматериалов с Cryomilled сфабриковано ECM Суспензии при концентрации 35 мг / мл и замораживали при -80 ° С. А: Макроскопический вид на DAT, ДДТ и DLV размалывают пенопластов , синтезированные в 48-луночный планшет для тканевых культур плесени следующей регидратации. Масштабные полоски обозначают 1 см. Б: СЭМ изображение пенопластов ДАТ, ДДТ и DLV , показывающее однородные пористые ультраструктуры. Шкала столбцы представляют 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
В cryomilled ECM суспензии могут также быть использованы для создания чистого ECM полученных через микроносители методов electrospraying (Рисунок 2 ). Для каждого источника ECM, концентрации суспензии, иглы калибра, скорости инфузии, и напряжений может быть настроено для генерации дискретных сферических микроносителей в диапазоне от 350 - 500 мкм в диаметре следующих контролируемой регидратации (фиг.4А). В то время как микроносители можно хранить в лиофилизированном состо нии, рекомендуются для простоты обработки, что они разливают или просеивают до желаемого диапазона размера следующих ресуспендирований в этаноле. СЭМ изображение позволяет предположить , что микроноситель ультраструктура может варьироваться в зависимости от источника decellularized ткани (рис 4В).

Рисунок 4. Представитель Изображения DAT, ДДТ и DLV микроносители изготовлены с Cryomilled ECM Суспензией при концентрации 35 мг / мл, вливание скорости 0,5 мл / мин, и приложенное напряжение 20 кВ. A: Макроскопический вид ое гидратированных микроносителями DAT, ДДТ, и DLV. Масштабные столбики представляют 4 мм. Б: СЭМ изображение микроносителей ДАТ, ДДТ и DLV , показывающие , что ультраструктуры и размер могут варьироваться в зависимости от источника ECM. Шкала столбцы представляют 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Механические свойства каркасов зависят от источника ECM, метод обработки применяется (т.е. мясорубки по сравнению с cryomilling), концентрацию ЕСМ суспензии и температуры замерзания. В общем, каркасы являются мягкими и совместимый с модулями Юнга в диапазоне от 1 - 5 кПа сообщили в DAT (50 & 100 мг / мл) 29 и DLV пены (20 - 50 мг / мл) 31, а <1 кПа для микроносителей. В cryomilled пены обычно мягче гоН. фарш пенопласты из-за их более нарушенный характер. Специализированные механические испытательные системы, оснащенные высокочувствительными тензодатчики необходимы для точных определения характеристик сжимающих свойств. Как правило, пена и микроносители будут иметь более низкие модули, чем нативные decellularized ткани из-за дополнительные стадии обработки, участвующих в производстве, включая ферментативное расщепление и гомогенизацию, а также нековалентно сшитую природу каркасов. Тем не менее, это может варьироваться в зависимости от ткани, представляющей интерес. Например, в предыдущей работе, мы обнаружили , что измельченная ДАТ пенопластов изготовленные при высоких концентрациях ECM (100 мг / мл) были подобные модули к родной жировой ткани 29.
Регидратированный ECM полученных пены и микроносители могут быть засевают клетки в статических или динамических условиях культивирования , чтобы обеспечить платформу клеток поддерживающей для исследований в пробирке для культивирования клеток и / ог в естественных условиях доставки клеток. В то время как каркасы в целом поддерживают прикрепление клеток, эффективность посева будет зависеть от источника ECM, геометрии строительных лесов и пористости, а также от типа клеток, представляющего интереса. Таким образом, способы посева и плотности потребует оптимизации в зависимости от заданных пользователем условий. Для получения пены описана выше, мы рекомендуем концентрацию начальной ячейки в диапазоне от 0,25 - 1 × 10 6 клеток / помоста, с динамическим высевом на орбитальном шейкер для усиления клеточной инфильтрации. Для микроносителей, мы предлагаем начальную плотность посева в диапазоне от 25000 - 50000 клеток / мг микроносителей, с посевом , выполняемым в динамических условиях во вращающейся культуральной колбе 11. Изображения , показанные в нижней части фиг.1 , представляют собой человеческие ИСС высевали на DAT пены (слева) или DAT микроносителя (справа, предварительно меченных с амином-реактивный краситель и появление синего 13), как и визуализированы с помощью конфокальной микроскопии с использованием флуоресцентного жизнеспособности клеток пятна (живые клетки = зеленые, мертвые клетки = красный; чешуйчатые столбцы представляют 100 мкм). Конфокальная микроскопия может быть использована для визуализации клеток, посеянных на поверхности пен до 2 мм в толщине, но визуализация в центральные районы каркасов ограничена их непрозрачного характером. Тем не менее, пену и микроносители можно рассматривать как ткань и парафин или крио-секционный для гистологического и иммуногистохимического анализа, чтобы визуализировать распределение клеток и экспрессии маркеров.
Обсуждение
В общем, bioscaffolds, полученный из тканей decellularized может более точно аппроксимировать сложную 3D состав и структуру ECM в нативном сотовом микроокружении по сравнению с синтетическими каркасами или стандартные моделями, основанные на культуре 2D ПСТК. Как обсуждалось ранее, клетка-ЕСМ взаимодействия являются критически важными в опосредовании клеточного поведения как в культуре , и в корпусе 1. Признавая, что биохимические, биофизические и биомеханические свойства ECM являются уникальными для каждой ткани, появляется все больше доказательств в поддержку обоснования для применения тканевоспецифичные подходов в разработке биоматериалов для тканевой инженерии, а также в разработке более физиологически соответствующие модели культуры для экспериментов в пробирке 20. Использование decellularized тканей в качестве исходного материала, наши методы могут включать сложный состав ЕСМА тканеспецифического в пределах дополнительных Кастomizable форматы подмости. В то время как механические и ферментативные этапы обработки приведут к потере родного ECM ультраструктуры, предыдущие исследования с DAT продемонстрировали, что инструктивные эффекты полученной из жировой ткани ECM сохраняются в этих форматах строительных лесов, предполагая, что композиция bioscaffold является ключевым медиатором функции клеток 11, 29. Существенным преимуществом использования ECM полученных пенопластов и микроносителей в качестве субстратов для культивирования клеток по сравнению с интактными decellularized тканей является то, что они более однородны, что может улучшить равномерность распределения клеток и клетка-клетка / клеток-ECM взаимодействий.
Методы, описанные здесь, могут быть использованы для создания широкого спектра тканей конкретных bioscaffolds для использования в культуре клеток и тканей инженерных приложений. Например, в дополнение к DAT, ДДТ и DLV, наша лаборатория успешно применил эти методы для создания 3D POROUS пены с использованием decellularized кости, хряща, студенистого дра, и в кольцевом пространстве фиброз, а также коммерчески доступный, не растворимый коллаген, полученный из бычьей сухожилия. С точки зрения в пробирке, эти bioscaffolds могут быть использованы в качестве основы для более высоких верности моделей культуры 3D для исследования клеточной биологии, физиологии и патологии 38 заболеваний, в качестве биологически активных субстратов в высокой пропускной способности скрининга лекарственных средств платформы 39, или в виде инструктивных матриц для штока дифференцировка клеток 40, 41. DAT, ДДТ и DLV пенопласты , изготовленные при концентрациях 25 - 50 мг / мл стабильны в долгосрочной перспективе в пробирке культуры (проверено до 28 дней). Кроме того, все три типа микроносителей может поддерживать прикрепление клеток и пролиферации в динамических условиях в системе культуры вертушка с низким усилием сдвига (10 - 15 оборотов в минуту) в течение по крайней мере 2-х недель. Для применения в естественных условиях, биосовместимые и biodegradaBLE ECM полученных пены и микроносители перспективны в качестве выходных готовых продуктов , чтобы стимулировать конструктивное ремоделирование тканей и регенерации 11, 29. Кроме того, клеточные клейкие каркасы могут быть использованы в качестве системы доставки клеточной терапии 42, 43. В качестве примера, DAT пены было показано стимулировать ангиогенез и липогенез , когда затравку аллогенных ИСС и имплантировали подкожно в иммунокомпетентных модели крысы 29. По сравнению с интактной DAT, тем более высокой степенью обработки DAT-пенопластов деградирует гораздо быстрее, с уменьшением объема на 50% отмечено на 3 недели, как они стали интегрированы с принимающими тканями, и почти полное рассасывание 12 недель. Однако пенопласты также индуцирует более мощный ангиогенный ответ, предполагая, что фермент-переваренной ЕСМ имели уникальные про-регенеративные эффекты. Аналогичным образом , ECM полученных микроносители могут быть использованы как в пробирке </ EM> клеточной культуры субстратов в пределах динамических систем культуры и как инъекционные средства доставки ячейки 11, 30, 44. Более конкретно, малый диаметр и большая площадь поверхности микроносителей может позволить доставку большого количества клеток в небольшом объеме, обеспечивая при этом матрице , которая может помочь поддерживать жизнеспособность клеток и увеличение удержания клеток в месте инъекции 30. Перед использование в любой живой системе, имеет решающее значение для обеспечения того , чтобы источник ECM, по существу , лишен антигенных клеточных компонентов и / или потенциально цитотоксических decellularization реагентов , которые могут вызвать негативную реакцию хозяина 7.
Протеолитический фермент пепсин обычно используются при получении ECM полученных гидрогелей 15. Пепсин является неспецифической протеазой, которые переваривают коллаген и другие белки ECM Intо небольших фрагментах 45. В то время как гидрогели , изготовленные из пепсина-переваренной ECM Сообщалось , что у клеток-поучительно эффекты, ограничение в том , что эти материалы имеют тенденцию быть чрезвычайно слабым механическим способом 46. В нашей первоначальной разработке микроносителей DAT, мы использовали композиционный подход , в котором пепсин-переваренные ДАТЫ был в сочетание с альгинатом и добавляет по каплям в CaCl 2 с образованием сферических шариков 30. Шарики были затем фотосшитыми и альгинат экстрагировали с помощью цитрата натрия. В дополнение к требованию для химического сшивания, является ключевым ограничением было то , что микроносители Изготовленные с этим подходом имели плохую стабильность ниже в диапазоне размеров от 900 - 950 мкм 30. Вместо пепсина, методы, представленные здесь, используют более легкое переваривание ЕСМ с гликолитического фермента альфа-амилазы, который постулировал для расщепления углеводных групп из telopeptide области коллагена, тем самым увеличивая растворимость в уксусной кислоте 37. Такой подход делает возможным выделение высоко полимеризованного коллагена, который может быть использован для генерирования чистых ECM полученных пенопластов и микроносителей без необходимости химического сшивания или других добавок. Эти bioscaffolds стабилизированы с помощью физических взаимодействий и водородного связывания между хорошо сохранившихся коллагеновых фибриллы, похожих на коллаген в нативной ECM микросреде.
Пены являются очень гибкой платформой, которая может быть изготовлена в широком диапазоне геометрий, в зависимости от конкретной формы, выбранной. Для исследований на клеточных культурах, пенопласты могут быть поданы непосредственно в ТКТ-луночные планшеты для формирования покрытий или 3D каркасов различной толщины. Для изготовления 3D пенопластов с очень равномерными поверхностями, рекомендуется, что пользовательские формы предназначена, которые могут быть уплотнены с обеих сторон пластиковым или предметные стекла. Либо измельчить или cryomilled ЕСМ может быть использован для синтезапенопласты. В целом, мы обнаружили , что cryomilled пены , как правило, макроскопический мягче и имеет более нарушенные ультраструктуры при более низких концентрациях 31, 36. В зависимости от источника ткани, дополнительные механические операции обработки могут вызвать изменения в составе ECM, которые могли бы повлиять на функционирование клеток. Например, в нашей предыдущей работе, ламинин был обнаружен в рубленых DLV пен, но не cryomilled DLV пены 31. В отличие от этого , коллаген I, коллаген IV, ламинин, фибронектин и были обнаружены в обоих фарша и cryomilled ДАТ пены 36. В дополнении к механическому стадию обработки, пористость и размер пор пенопластов может быть настроен в некоторой степень путем изменения концентрации суспензии ECM и температуры замерзания 47. В целом, более низкие концентрации пены (~ 10 - 15 мг / мл), качественно более пористым, но может быстро сокращаться и имеют плохоестабильность в долгосрочной культуре 31, 36. Аналогичным образом , медленная скорость замораживания, как правило , достигается за счет более высокой температуры замерзания, может привести к более крупных пор в вспененных из - за размера кристаллов льда , образующихся в процессе изготовления 29. Все эти параметры могут влиять на клеточные взаимодействия с материалами, в том числе крепления, инфильтрации и ремоделирования. Так , например, рост клеток на пенах, которые изготовлены с более высокими концентрациями ECM может быть ограничен участками поверхности, в частности , с рублеными источниками ECM и в статических условиях культивирования 36.
Для микроносителей, основные параметры, которые могут быть настроены, являются концентрация ЕСМ подвески, иглы калибра, и приложенное напряжение, при более высоких концентрациях, как правило, получают микроносители, которые более стабильны при длительной динамической культуре. После инициации electrospraying, ЕСМ suspensКапли ионов должны быстро попасть в центр колбы, в направлении коллектора алюминиевой фольги. Для предотвращения агрегации, важно, чтобы гранулы связаться с жидким азотом до фольги. Расстояние между иглой и поверхностью жидкого азота можно регулировать, чтобы удовлетворить эти требования. Важно отметить, что оптимизация может потребоваться в зависимости от свойств каждого конкретного источника ECM, в частности, при выборе диапазона концентраций, который будет генерировать стабильные bioscaffolds. Еще одним ключевым фактором является протокол decellularization , который используется для генерации исходных материалов, как методы decellularization , которые ухудшают ECM или присутствие остаточных реагентов (например, поверхностно -активные вещества) может негативно повлиять на стабильность получаемых пен и микроносителей. Если проблемы встречаются со стабильностью bioscaffold, варианты, которые могут быть исследованы, включают использование более постепенный процесс регидратации, увеличивая ECM SUSPКонцентрация ension, а также изучение фарша против cryomilled ECM. Если все эти варианты не решить эту проблему, может быть необходимо изучить альтернативные протоколы decellularization или источники ECM.
Для обеспечения воспроизводимости при производстве строительных лесов, особое внимание должно быть принято на определенные шаги в протоколе. Когда cryomilling в decellularized ткани, рекомендуется, чтобы фрезерной проводиться сразу же после лиофилизации в сухой среде, чтобы уменьшить вероятность агрегации частиц за счет поглощения влаги из окружающей среды. Во время изготовления микроносителя, предполагаются, что суспензия electrosprayed малых партий, с максимальным объемом 3 мл, чтобы избежать проблем с охлаждением образца, что может привести к забиванию иглы. Кроме того, важно, чтобы микроносители не разрешаются оттаивать после процесса electrospraying. Для того, чтобы сохранить свою сферическую геометрию и механическую стабильность, microcarriERS должна быть собрана из жидкого азота, транспортирует в жидком азоте заполненного контейнера, и сразу лиофилизирует. Наконец, для обоих пен и микроносителями, важно, что шаги регидратации выполняются медленно, в течение нескольких дней. Быстрая регидратация может привести к структурному коллапсу на макро-, и / или микро-масштабе. Кроме того, регидратация должна происходить медленно, чтобы предотвратить образование мелких пузырьков воздуха внутри каркаса, который может потребовать значительное количество времени, чтобы дегазировать под легким вакуумом.
В заключении, методы, представленные в данном документе, могут быть использованы для изготовления разнообразного множества ткана-специфических пен и микроносителей, состоящих из чистой, не-химически сшитой ECM. Преимуществом для биологических исследователей является то, что bioscaffolds просты в обращении и могут быть обработаны аналогично ткани при проведении анализа с использованием таких методов, как гистологических, иммуногистохимических, или генов и экспрессии белка анализов.Кроме того, ECM полученных каркасы могут быть ферментативно деградируют для извлечения популяции клеток семян или могут быть использованы непосредственно в качестве биоразлагаемых и биосовместимых средств доставки клеток. В целом, эта гибкая технологическая платформа имеет большую полезность для многочисленных приложений, в том числе для 3D исследований клеточной культуры, расследующих функции клеток, в качестве субстратов расширения клеток, а также про-регенеративные bioscaffolds.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
The Natural Sciences and Engineering Research Council (NSERC) of Canada and the Canadian Institutes of Health Research (CIHR) have provided funding for this work. The authors would like to acknowledge Dr. Amin Rizkalla for the use of his electrospraying system, the Nanofabrication Facility at Western University for use of SEM imaging equipment, the Mount Brydges Abattoir for the provision of porcine tissue samples, and Drs. Aaron Grant, Brian Evans, and Robert Richards for their clinical collaborations in support of this research.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | BioShop | ACE222.500 | |
| Alligator clip leads | VWR | 470149-728 | |
| Aluminium foil | Fisher Scientific | 01-213-101 | |
| α-amylase | Sigma | 101074694 | from Aspergillus aryzae |
| Analytical balance | Sartorius | CPA225D | |
| Centrifuge | Thermo Scientific | 75004251 | With swinging bucket rotor for 15 & 50 mL centrifuge tubes |
| Centrifuge tubes (15 mL) | Sarstedt | 62.554.205 | |
| Centrifuge tubes (50 mL) | Sarstedt | 62.547.205 | |
| Collagen from bovine achilles tendon (insoluble) | Sigma | C9879 | Or similar insoluble collagen source; Can be used as an alternative to decellularized tissues to fabricate the foams and microcarriers |
| Cryomilling system | Retsch | 20.745.0001 | MM 400 |
| Dessicator | Fisher Scientific | 8624426 | For lyophilized ECM and bioscaffold storage |
| DMEM: F12 Hams | Sigma | D6421 | Used for proliferation media |
| Dewar flask | Fisher Scientific | 10-196-6 | Low form; volume range of 250 - 500 mL |
| Double distilled water (ddH2O) | From Barnstead GenPure xCAD Water Purification System | ||
| D-PBS (Phosphate-buffered Saline) | Wisent | 311425125 | |
| ECM (Extracellular Matrix) | Isolated from human adipose tissue, porcine dermis or porcine myocardium, as described in Flynn et al. 2010, Reing et al. 2010, and Wainwright et al. 2010 (ref # 28, 8, 32) | ||
| Ethanol | Greenfield Specialty Alcohols Inc. | P016EAAN | Absolute |
| Fetal bovine serum (FBS) | Wisent | 80150 | Used for proliferation media |
| Forceps | VWR | 37-501-32 | For transferring the foams |
| Freezer (-20 °C) | VWR | 97043-346 | |
| Freezer ( -80 °C) | Thermo Scientific | EXF40086A | |
| Glass vials | Fisher Scientific | 03-339-26D | To store lyophilized cryomilled ECM |
| Hand held homogenizer | Fisher Scientific | 14-359-251 | Speed: 8,000 - 30,000 rpm |
| Homogenizer accessories: saw tooth bottom generator probes | Fisher Scientific | 14-261-17 | 10 x 95 mm |
| Liquid nitrogen | For electrospraying | ||
| Lyophilizer | Labconco | 7750021 | FreeZone4.5 |
| Milling chamber | Retsch | 02.462.0213 | 25 mL volume recommended |
| Milling balls | VWR | 16003-606 | 10 mm diameter, stainless steel recommended |
| 18 G needle | VWR | C ABD305185 | For dispensing ECM suspension into moulds |
| Orbital incubator shaker | SciLogex | 832010089999 | Temperature controlled (37 °C) |
| Penicillin-streptomycin | Life Technologies | 15140-122 | Used for proliferation media |
| Pipet-Aid XP | Mandel Scientific | DRU-4-000-101 | |
| Retort stand | VWR | 470019-526 | |
| Retort stand clamp | VWR | 21573-606 | |
| Safety-Lok Syringe | BD | 309606 | 3 mL Luer lock syringe for microcarrier fabrication and dispensing ECM suspension |
| Serological pipettes (10 mL) | Sarstedt | 86.1254.001 | |
| Serological pipettes (25 mL) | Sarstedt | 86.1685.001 | |
| Sodium chloride | BioShop | 7647-14-5 | |
| Sodium phosphate monobasic | BioShop | 10049-21-5 | |
| Scoopula | VWR | 89259-968 | For collecting microcarriers |
| Surgical scissors | VWR | 82027-590 | |
| Syringe pump | VWR | 10117-490 | Microprocessor controlled |
| High voltage power supply | Gamma High Voltage Research | ES30P-5W/DDPM | Capable of recommended 15 - 25 kV voltage range |
| 12-well plates | Fisher Scientific | 12565321 | For use as molds during foam fabrication; Other sizes or user-defined molds can also be selected |
| Winged infusion set | Terumo | 22258092 | 30 cm tubing length, 25 G 3/4" recommended; Other needle gauges can be used and may influence microcarrier diameter |
Ссылки
- Eweida, A. M., Marei, M. K. Naturally Occurring Extracellular Matrix Scaffolds for Dermal Regeneration: Do They Really Need Cells? Biomed Res Int. , 1-9 (2015).
- Badylak, S. F., Taylor, D., Uygun, K. Whole Organ Tissue Engineering: Decellularization and Recellularization of Three-Dimensional Matrix Scaffolds. Annu. Rev. Biomed. Eng. 13, 27-53 (2011).
- Rosso, F., Giordano, A., Barbarisi, M., Barbarisi, A. From Cell-ECM Interactions to Tissue Engineering. J. Cell. Phys. 199 (2), 174-180 (2004).
- Du, J., et al. Extracellular Matrix Stiffness Dictates Wnt Expression Through Integrin Pathway. Sci. Rep. 6, 4195-4200 (2016).
- Badylak, S. F. The Extracellular Matrix as a Scaffold for Tissue Reconstruction. Cell & Dev. Biol. 13 (2), 377-383 (2002).
- Gilbert, T. W., Sellaro, T. L., Badylak, S. F. Decellularization of Tissues and Organs. Biomaterials. 27 (19), 3675-3683 (2006).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An Overview of Tissue and Whole Organ Decellularization Processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Reing, J. E., et al. The Effects of Processing Methods Upon Mechanical and Biologic Properties of Porcine Dermal Extracellular Matrix Scaffolds. Biomaterials. 31 (33), 8626-8633 (2010).
- Yang, Q., et al. Morphological Appearance, Content of Extracellular Matrix and Vascular Density of Lung Metastases Predicts Permissiveness to Infiltration by Adoptively Transferred Natural Killer and T Cells. Cancer Immun. Immunother. 55 (6), 699-707 (2006).
- Calle, E., Ghaedi, M., Sundaram, S., Sivarapatna, A., Tseng, M. K., Niklason, L. E. Strategies for Whole Lung Tissue Engineering. IEEE Trans. Biomed. Eng. 61 (5), 1482-1496 (2014).
- Turner, A. E. B., Yu, C., Bianco, J., Watkins, J. F., Flynn, L. E. The Performance of Decellularized Adipose Tissue Microcarriers as an Inductive Substrate for Human Adipose-Derived Stem Cells. Biomaterials. 33 (18), 4490-4499 (2012).
- Brown, C. F. C., Yan, J., Han, T. T. Y., Marecak, D. M., Amsden, B. G., Flynn, L. E. Effect of Decellularized Adipose Tissue Particle Size and Cell Density on Adipose-Derived Stem Cell Proliferation and Adipogenic Differentiation in Composite Methacrylated Chondroitin Sulphate. Biomed. Mater. 10 (4), 1-12 (2015).
- Cheung, H. K., Han, T. T. Y., Marecak, D. M., Watkins, J. F., Amsden, B. G., Flynn, L. E. Composite Hydrogel Scaffolds Incorporating Decellularized Adipose Tissue for Soft Tissue Engineering with Adipose-Derived Stem Cells. Biomaterials. 35 (6), 1914-1923 (2014).
- Almeida, H. V., Eswaramoorthy, R., Cunniffe, G. M., Buckley, C. T., O'Brien, F. J., Kelly, D. J. Fibrin Hydrogels Functionalized with Cartilage Extracellular Matrix and Incorporating Freshly Isolated Stromal Cells as an Injectable for Cartilage Regeneration. Acta Biomat. 36, 55-62 (2016).
- Wassenaar, J. W., Braden, R. L., Osborn, K. G., Christman, K. L. Modulating in vivo Degradation Rate of Injectable Extracellular Matrix Hydrogels. J. Mater. Chem. B. 4 (16), 2794-2802 (2016).
- Ugerleider, J. L., et al. Extracellular Matrix Hydrogel Promotes Tissue Remodeling, Arteriogenesis, and Perfusion in a Rat Hindlimb Ischemia Model. JACC Basic Transl. Sci. 1 (1-2), 32-44 (2015).
- Nagao, R. J., et al. Decellularized Human Kidney Cortex Hydrogels Enhance Kidney Microvascular Endothelial Cell Maturation and Quiescence. Tissue Eng. Part A. 22 (19-20), 1140-1150 (2016).
- Pati, F., et al. Printing Three-Dimensional Tissue Analogues with Decellularized Extracellular. Matrix Bioink. Nat. Commun. 5, 3935(2014).
- Ravi, M., Paramesh, V., Kaviya, S. R., Anuradha, E., Solomon, F. D. 3D Cell Culture Systems - Advantages and Applications. J. Cell. Phys. 230 (1), 16-26 (2015).
- Lee, J., Cuddihy, M. J., Kotov, N. Three-dimensional Cell Culture Matrices: State of the Art. Tissue Eng Part B, Rev. 14 (1), 61-86 (2008).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The Third Dimension Bridges the Gap Between Cell Culture and Live Tissue. Nature Rev. Mol. Cell Biol. 8, 839-845 (2007).
- Bouet, G., Marchat, D., Cruel, M., Malaval, L., Vico, L. In Vitro Three-Dimensional Bone Tissue Models: From Cells to Controlled and Dynamic Environment. Tissue Eng. Part B Rev. 21 (1), 133-156 (2015).
- Birgersdotter, A., Sandberg, R., Ernberg, I. Gene Expression Perturbation in vitro - A Growing Case for Three-Dimensional (3D) Culture Systems. Sem. Cancer Biol. 15 (5), 405-412 (2005).
- Bonnier, F., et al. Cell Viability Assessment Using the Alamar Blue Assay: A Comparison of 2D and 3D Cell Culture Models. Toxicology in vitro. 29 (1), 124-131 (2015).
- Frantz, C., Stewart, K. M., Weaver, V. M. The Extracellular Matrix at a Glance. J. Cell Sci. 123, 4195-4200 (2010).
- Liberio, M. S., Sadowski, M. C., Soekmadji, C., Davis, R. A., Nelson, C. C. Differential Effects of Tissue Culture Coating Substrates on Prostate Cancer Cell Adherence, Morphology and Behavior. PLoS ONE. 9 (11), e112122(2014).
- McKee, C., Perez-Cruet, M., Chavez, F., Chaudhry, G. R. Simplified Three-Dimensional Culture System for Long-Term Expansion of Embryonic Stem Cells. World J. Stem Cells. 7 (7), 1064-1077 (2015).
- Flynn, L. E. The Use of Decellularized Adipose Tissue to Provide an Inductive Microenvironment for the Adipogenic Differentiation of Human Adipose-Derived Stem Cells. Biomaterials. 31 (17), 4715-4724 (2010).
- Yu, C., et al. Porous Decellularized Adipose Tissue Foams for Soft Tissue Regeneration. Biomaterials. 34 (13), 3290-3302 (2013).
- Turner, A. E. B., Flynn, L. E. Design and Characterization of Tissue-Specific Extracellular Matrix-Derived Microcarriers. Tissue Eng. Part C: Methods. 18 (3), 186-197 (2012).
- Russo, V., Omidi, E., Samani, A., Hamilton, A., Flynn, L. E. Porous, Ventricular Extracellular Matrix-Derived Foams as a Platform for Cardiac Cell Culture. Biores Open Access. 4 (1), 374-388 (2015).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Eng. Part C, Methods. 16 (3), 525-532 (2010).
- Owen, S. C., Fisher, S. A., Tam, R. Y., Nimmo, C. M., Shoichet, M. S. Hyaluronic Acid Click Hydrogels Emulate the Extracellular Matrix. Langmuir. 29 (24), 7393-7400 (2013).
- Zargham, S., Bazgir, S., Tavakoli, A., Rashidi, A. S., Damerchely, R. The Effect of Flow Rate on Morphology and Deposition Area of Electrospun Nylon 6 Nanofiber. J. Eng. Fibers Fabr. 7 (4), 42-49 (2012).
- Gryshkov, O., Pogozhykh, D., Zernetsch, H., Hofmann, N., Mueller, T., Glasmacher, B. Process Engineering of High Voltage Alginate Encapsulation of Mesenchymal Stem Cells. Mater. Sci. Eng. C Biol. Appl. 36, 77-83 (2014).
- Turco, B. Characterization and Cell-Seeding of Decellularized Adipose Tissue Foams for Wound Healing. , Queen's University. Kingston, Ontario, Canada. (2014).
- Steven, F. S. The Nishihara Technique for the Solubilization of Collagen. Application To the Preparation of Soluble Collagens From Normal and Rheumatoid Connective Tissue. Ann. Rheum. Dis. 23, 300-301 (1964).
- Hansen, N. U. B., Genovese, F., Leeming, D. J., Karsdal, M. A. The Importance of Extracellular Matrix for Cell Function and in vivo Likeness. Exp. Mol. Pathol. 98 (2), 286-294 (2015).
- Justice, B. A., Badr, N. A., Felder, R. A. 3D Cell Culture Opens New Dimensions in Cell-Based Assays. Drug Discov. Today. 14 (1-2), 102-107 (2009).
- Cortiella, J., et al. Influence of Acellular Natural Lung Matrix on Murine Embryonic Stem Cell Differentiation and Tissue Formation. Tissue Eng. Part A. 16 (8), 2565-2580 (2010).
- Liao, J., Guo, X., Grande-Allen, K. J., Kasper, F. K., Mikos, A. G. Bioactive Polymer/Extracellular Matrix Scaffolds Fabricated with a Flow Perfusion Bioreactor for Cartilage Tissue Engineering. Biomaterials. 31 (34), 8911-8920 (2010).
- Choi, Y. C., Choi, J. S., Woo, C. H., Cho, Y. W. Stem Cell Delivery Systems Inspired by Tissue-Specific Niches. J. Control. Release. 193, 42-50 (2014).
- Han, T. T. Y., Toutounji, S., Amsden, B. G., Flynn, L. E. Adipose-Derived Stromal Cells Mediate in vivo Adipogenesis , Angiogenesis and Inflammation in Decellularized Adipose Tissue Bioscaffolds. Biomaterials. 72, 125-137 (2015).
- Yu, C., Kornmuller, A., Flynn, L. E. Porous Decellularized Extracellular Matrix Microcarriers for Tissue-Specific Cell Expansion and Delivery. Front. Bioeng. Biotechnol. , (2016).
- Qian, J., et al. Kinetic Analysis of the Digestion of Bovine Type I Collagen Telopeptides with Porcine Pepsin. J. Food Sci. 81 (1), C27-C34 (2016).
- Lin, H., Yang, G., Tan, J., Tuan, R. S. Influence of Decellularized Matrix Derived from Human Mesenchymal Stem Cells on their Proliferation, Migration and Multi-Lineage Differentiation Potential. Biomaterials. 33 (18), 4480-4489 (2012).
- Fonte, P., Reis, S., Sarmento, B. Facts and Evidences on the Lyophilization of Polymeric Nanoparticles for Drug Delivery. J. Control. Release. 225, 75-86 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены