Method Article
Генома Очистка экстрахромосомального кольцевой ДНК из эукариотических клеток
В этой статье
Резюме
This paper presents a sensitive method called Circle-Seq for purifying extrachromosomal circular DNA (eccDNA). The method encompasses column purification, removal of remaining linear chromosomal DNA, rolling-circle amplification and high-throughput sequencing. Circle-Seq is applicable to genome-scale screening of eukaryotic eccDNA and studying genome instability and copy-number variation.
Аннотация
Экстрахромосомального кольцевых ДНК (eccDNAs) являются общие генетические элементы в Saccharomyces CEREVISIAE и представлены в других эукариот , а также. EccDNAs способствуют генетической изменчивости среди соматических клеток в многоклеточных организмах и эволюции одноклеточных эукариот. Чувствительные методы обнаружения eccDNA необходимы, чтобы выяснить, как эти элементы влияют на стабильность генома и, как экологические и биологические факторы вызывают их образование в эукариотических клетках. Это видео представляет собой чувствительный метод eccDNA-очистки под названием Circle-Seq. Способ включает в себя очистку столбца кольцевой ДНК, удаление остаточного линейного хромосомной ДНК, прокатный круг усиление eccDNA, глубокое секвенирование и картирование. Обширное лечение экзонуклеазная было необходимо для достаточной линейной деградации хромосомной ДНК. Шаг прокатки круга амплификацииINE-высота:. нормальный; "> φ 29 - полимераза обогащенные для кольцевых ДНК по линейной ДНК Проверка Кольцевой-Seq методом на трех S.cerevisiae , CEN.PK популяций 10 10 клеток обнаружены сотни профилей eccDNA в размерах , размер которых превышает 1 килобаза . Повторные находки ASP3-1, COS111, cup1, RSC30, HXT6, HXT7 генов на кольцевой ДНК в обоих S288c и CEN.PK предполагает , что ДНК циркуляризации сохраняется между напряжениями на этих локусов. в сумме, Круг-Seq метод имеет широкое применимость для генома масштабного скрининга на eccDNA в эукариот, а также для выявления специфических типов eccDNA.
Введение
Обнаружение ранней или переходную хромосомной амплификации трудно, поскольку она требует идентификации изменений в отдельных молекул ДНК в больших популяциях клеток. Хромосомные вариации копирования номер (ВКК) , как правило , обнаруживаются также после их создания, оставив только окончательную структуру CNV в качестве доказательства механизма , который сгенерировал вариации 1,2. Обнаружение и восстановление экстрахромосомного кольцевую ДНК (eccDNA) в ранних стадиях формирования CNV может пролить свет происходящие процессы в геномных перестроек.
Ранее De Novo открытие eccDNA было по электронной микрофотографии 3, Гимза окрашивания метафазных хромосом 4 или двухмерного электрофореза гель 5. Эти методы дают мало или нет информации о последовательности кольцевой ДНК. Адресные методы , такие как Саузерну 6,7, обратный PCR 8, или флуоресценцию на месте hybridizatio вп 9 свидетельствуют лишь о конкретных элементах eccDNA. Ни один из этих методов не обеспечивают последовательность всех существующих типов eccDNA в клеточной популяции.
Геномная расхождение в пуле клеток можно охарактеризовать секвенирование генома и / или облицовочных массивов 10,11. Детектирование удалений или амплификации обычными способами очистки ДНК , как правило , требует , чтобы мутировавший аллель , составляют не менее 0,1-1% от клеточной популяции 12,13. Ацентрический eccDNAs, как ожидается, будет еще более переходная в культуре клеток из-за их отсутствия центромерах и потенциального отсутствия синтеза ДНК при репликации. Таким образом, так как большинство eccDNAs предположительно находятся в небольших количествах и их последовательности напоминают геном, альтернативные методы экстракции ДНК необходимы для обнаружения eccDNAs.
Несколько круговых методов очистки ДНК используют структурные различия между хромосомами и кольцевой ДНК. Например, высокоскоростной ultracentrifugвания в цезий-хлоридно градиентов используется для изоляции 350-3000 пар оснований (п.о.) большие eccDNAs из человеческого HeLa клеток рака линии 14. Тем не менее, высокая скорость может привести к поломке или ник основу суперспиральных структур кольцевых ДНК, изменяя скорость 15 оседания и выход eccDNA. Датта и его коллеги разработали метод De Novo, геном масштаба идентификации кольцевых ДНК из тканей мышей, а также из культур куриных и человеческих клеток 16,17. Их метод извлечения ядер из гомогенизированной ткани с помощью ультрацентрифугирования сахарозы с последующей очисткой плазмиды и нескольких раундов ферментативных реакций и извлечения ДНК. Их протокол в основном идентифицирует 200-400 п.о. eccDNAs, называемые microDNAs. Датта и его коллеги также пытались очистку microDNAs из Saccharomyces CEREVISIAE , но не смогли записать microDNA из этих дрожжей вида 16.
Мы разработали новый методDe Novo обнаружение eccDNA из дрожжей под названием Circle-Seq. Этот метод позволяет геном масштабных обследований для кольцевых молекул ДНК достаточно большой, чтобы нести целые гены и как крупные, как 86 килобаза (кб) митохондриальной ДНК (мтДНК). Метод Круг-Seq был разработан с хорошо налаженной прокариотической плазмиды способа очистки 18,19, оптимизированная для эукариотических клеток дрожжей и в сочетании с глубоким секвенирования. Используя Круг-Seq подход, 1756 различных eccDNAs, все больше 1 Кб, были обнаружены из десяти S. CEREVISIAE S288c популяций 20. Размер отсечка был выбран, чтобы сосредоточиться на eccDNA, которые были достаточно большими, чтобы нести целые гены. Круг-Seq был очень чувствительным; он обнаружил одну eccDNA в пределах тысяч ячеек 20. В текущем исследовании, Круг-Seq был использован для выделения и идентификации 294 eccDNAs из трех биологических повторностях другого S. CEREVISIAE штамм дрожжей, CEN.PK. Данные показывают, что eccDNA является распространенным генетическим Elemeнт в S. CEREVISIAE штаммы.
протокол
Примечание: обзор очистки круговой ДНК и методом секвенирования (Круг-Seq) показана на рисунке 1.
1. Выращивание, Cell Harvest и плазматической мембраны Срыв
- Привить клетки дрожжей (например Saccharomyces CEREVISIAE) из O / N культуры в 50 мл полной питательной среде дрожжей пептон декстроза (YPD). Инокулируйте при низкой начальной плотности клеток 1-3 × 10 5 клеток / мл или оптической плотностью приблизительно 0,01 OD 600.
- Инкубируйте клетки при 30 ° С при перемешивании со скоростью 150 оборотов в мин (оборотов в минуту) до тех пор , пока клетки не достигают максимальной плотности клеток приблизительно 1 × 10 10 клеток, примерно через 24 до 48 ч , или оптическую плотность при OD 600> 10,0.
Примечание: Время культивирования не имеет решающего значения, как можно использовать более низкие концентрации клеток.
- Инкубируйте клетки при 30 ° С при перемешивании со скоростью 150 оборотов в мин (оборотов в минуту) до тех пор , пока клетки не достигают максимальной плотности клеток приблизительно 1 × 10 10 клеток, примерно через 24 до 48 ч , или оптическую плотность при OD 600> 10,0.
- Перенести переросла культуру в коническую пробирку емкостью 50 мл, в пробирке осадка клеток центрифугированием при800 мкг в течение 3 мин и отбросить супернатант.
- Промывают осадок с 25 мл буферного раствора 10 мМ Трис-Cl, 1 мМ ЭДТА, рН 8,0, повторно осаждения клеток центрифугированием при 800 х г в течение 3 мин и отбросить супернатант.
- Ресуспендируют осадок клеток в 1,2 мл ресуспендирующего буфера, подаваемого из комплекта плазмида колонного очистки.
- Необязательный шаг: Добавьте сильно разбавленных плазмид в качестве контроля для очистки кольцевых элементов ДНК 20.
Примечание: В текущем наборе данных, плазмида смесь 7,7 мкл наносили для каждого образца , содержащего 10 10 клеток. Плазмида запас смесь состояла из трех плазмид в различных концентрациях; pBR322 при 38 нг / образец, pUC19 на уровне 0,5 нг / образец, и pUG72 на 0,01 нг / образец. - Передачи клеточной суспензии на две 2 мл микро-центрифужные пробирки, каждая из которых дополняется 0,5 мм стеклянных шариков в соотношении 1: 3 от общего объема суспензии.
- Vortex каждую пробирку на максимальной скорости в течение 10 мин, чтобы сорвать плазматическую клеткуМембраны. Гранул шарики центрифугированием при 268 мкг в течение 30 секунд и переносят 1,2 мл супернатанта комбинированный из двух микропробирок в новую пробирку.
Примечание: Альтернатива к шагу 1,6-1,7, используйте zymolyase для разрушения клеток в 0,6 мл ресуспендирования буферного раствора. Десять единиц zymolyase может нарушить 5 х 10 7 клеток в течение 1,5 ч при 35 ° С.
2. EccDNA Обогащение с помощью колоночной хроматографии
- Следовать протоколу из набора для очистки на колонке с плазмид. Короче говоря, рассматривать каждую пробу с 1,2 мл щелочного раствора, аккуратно перемешать и инкубировать в течение 3 мин при комнатной температуре.
- Добавьте 1,2 мл нейтрализующего буфера, аккуратно и центрифуга смешать в 9650 мкг в течение 5 мин.
- Загрузка раствора на колонку, уравновешенную с 1 мл раствора для уравновешивания и позволяет жидкости протекать через колонку под действием силы тяжести.
- Промывают колонку моющего раствора 4 мл. Когда раствор проходит через смолу, осторожно добавляют 0,3 мл элюирование таклюция заменить большую часть 0,35 мл колонку объемом пустот.
- Элюции ДНК в новую пробирку для сбора с 1 мл элюирующего раствора и осаждения ДНК добавлением 0,8 мл преципитации смеси. Центрифуга при 9650 мкг в течение 10 мин.
- Вымойте ДНК гранул с 0,5 мл 70% этанола, центрифуге при 9650 мкг в течение 5 мин, воздух сухой в течение от 5 до 15 мин и растворить очищенную ДНК в 25 мкл стерильной воды.
Примечание: Только кратковременного хранения ДНК в воде рекомендуется. Предпочтительно, переходите к шагу 3.
3. Расщепление Оставаясь линейной хромосомной ДНК
- Необязательный шаг: Для облегчения конкретного переваривание линейной ДНК с помощью экзонуклеазы, обработайте очищенную ДНК с редкой режущим эндонуклеазы, такие как NotI. Для получения 5 мкг ДНК, используют 1 единицу NotI, 5 мкл 10х буфера пищеварения и стерильную воду до общего объема 50 мкл. Инкубируют реакционную смесь при температуре 37 ° С в течение 16 ч и тепла инактивировать эндонуклеазы при 80 ° С в течение 5 мин.
- Добавить 20единиц экзонуклеазы (2 мкл), 4 мкл АТФ (25 мМ), 34 мкл стерильной воды и 10 мкл 10х реакционного буфера непосредственно к эндонуклеазы расщепленный ДНК в 50 мкл достичь 1х реакционного объема 100 мкл, с использованием АТФ-зависимый экзонуклеазы Комплект.
- Выполнить гидролиз линейной одноцепочечной и двухцепочечной ДНК при 37 ° С в течение 5 дней и более. Добавление дополнительного 4 мкл АТФ (25 мМ), 0,6 мкл 10х реакционного буфера и 20 единиц экзонуклеазы каждые 24 ч, чтобы продолжить ферментативное переваривание ДНК при 1х реакционного объема.
- После удаления линейной ДНК, образец 2 мкл из экзонуклеазной обработанному раствору , чтобы подтвердить устранение хромосомной линейной ДНК с помощью количественной полимеразной цепной реакции (КПЦР), с использованием хромосомной маркер , такой как ген актина ACT1 20.
- Каждый 20 мкл КПЦР объем реакционной смеси содержит 2 мкл экзонуклеазы обработанного образца, 150 нм ACT1 праймеров 5'-TCCGTCTGGATTGGTGGTTCTA-3 'и 5'-TGGACCACTTTCGTCGTATTC-3 ', 2% (объем / объем) диметилсульфоксида, и 10 мкл зеленого флуоресцентного основной смеси.
- Использование условий реакции; 3 мин при 95 ° С, а затем 45 циклов 15 с при 95 ° С и 30 с при 60 ° С.
Примечание: СИГН1 является особенно подходящим маркером для линейной ДНК , поскольку вариации номер копии этого гена являются пагубное 21-23 так eccDNA не должны нести ACT1. - Альтернативы анализу переваривания ДНК с помощью кПЦР являются стандартной ПЦР (4.3) или пропидийиодидом окрашивание (4.4).
- Используйте 2 мкл экзонуклеазы обработанного образца в качестве матрицы для ПЦР с СИГН.1 праймеров 5'-TGGATTCTGGTATGTTCTAGC-3 'и 5'-GAACGACGTGAGTAACACC-3'. В качестве положительного контроля СИГН.1, используют 50-100 нг геномной S. CEREVISIAE ДНК в качестве матрицы. Условия реакции ПЦР; 3 мин при 95 ° С, с последующими 35 циклами 30 сек при 95 ° С, 30 сек при 56 ° С и 1 мин при 72 ° С.
- Запуск реакции ПЦР с помощью гель electrophoreСИС на 1% агарозном геле с 0,5 мкг / мл этидий-бромида. Посмотрите на 0,8 кб СИГН.1 полосы.
- Отсутствие или наличие линейной ДНК также могут быть исследованы с помощью пропидиума йодида окрашивания до и после амплификации ДНК.
- Смешайте каждый образец ДНК в 1: 1 объем с 1: 1000 H 2 O-разбавленного раствора 20 мМ пропидийиодидом запаса. Оставьте раствор в темноте в течение 10-20 мин при комнатной температуре и анализируют окрашиванием ДНК с помощью флуоресцентной микроскопии при 100-кратном увеличении с использованием красной флуоресценции фильтра возбуждения при 663-738 нм и экспозиционной времени от 5 до 30 сек. В качестве контроля ДНК-окрашивание, использование ø29-амплифицируют геномную ДНК из дрожжей и / или ø29-амплифицировали плазмиды.
- Тепло инактивировать раствор экзонуклеазной при 70 ° С в течение 30 мин.
4. амплификацию ДНК
- Amplify очищенный и обогащается eccDNA со стадии 3.5) с помощью ДНК - полимеразы ø29 24-26 ACCORDИнг к протоколу производителя полимеразы.
- Короче говоря, смешайте 5 мкл, обогащенные eccDNA с 5 мкл буфера для денатурации.
- Через 3 мин при комнатной температуре, добавляют 10 мкл буфера для нейтрализации. Осторожно перемешать и добавить 30 мкл основной смеси, содержащей 29 мкл реакционного буфера и 1 мкл ДНК-полимеразы ø29. Инкубируют реакционную смесь при температуре 30 ° C в течение 16 часов или более (до 72 ч). Тепло инактивировать ø29 ДНК-полимеразы при 65 ° С в течение 3 мин.
5. Секвенирование и анализ данных
- Сдвигать усиленную eccDNA сфокусированным ультразвукового дезинтегратора до среднего размера целевого пика в 300 пар оснований. Используйте следующие параметры для 130 мкл образца ДНК: мощность 450W пиковой интенсивности, 60 сек лечения, 30% коэффициент заполнения, 200 циклов в порыве, температура 7 ° C.
- Добавить штрих-код этикетки и индексные адаптеры к фрагментированным читает для синтеза библиотек для секвенирования, используя соответствующий метод для подготовки библиотеки.
- Глубоки последовательности, например, как 141-нуклеотид одного конца читает на секвенирования платформы с высокой пропускной способностью.
- Карта читает к опорному генома дрожжей исследуемой и позволяют читает карту к нескольким регионам. Например, можно использовать свободно доступную систему 27,28 документооборота и короткого чтения картографическое программное обеспечение Согласователь 29.
- Идентифицировать читает из регионов предполагаемыми eccDNAs использованием , смежный чтений, например, более семи смежных операций чтения (> 1 кб) без пробелов 20.
Примечание: Программное обеспечение доступно для изучения 27,28 сопоставляются читает в геномных областях , представляющих интерес.
Результаты
Для проверки метода Circle-Seq, три S. CEREVISIAE CEN.PK популяции 1 × 10 10 клеток подвергали скринингу после того, как клетки выращивали отдельно в YPD в течение десяти поколений. Устранение линейной хромосомной ДНК , было подтверждено отсутствие сигнала КПЦР СИГН.1 , как описано выше 20 (данные не показаны). Очищенная и обогащенная eccDNA секвенировали до 68 миллионов просмотров (141-нуклеотид одного конца читает) и сопоставляется с CEN.PK113-7D референсный геном (версии 19 июня 2012 года). Записи предполагаемых eccDNAs из трех образцов, названных C1, C2 и C4 были назначены геномных областей, отображенных сближенными читает больше, чем 1 кб. На основе 10000 моделирования методом Монте-Карло, значимость каждого региона отображенной сближенными читает больше, чем 1 кб была оценена. Исходя из этого 79, 159 и 56 регионов были аннотированный , как вероятные последовательности eccDNA (р <0,1, Dataset 1). Число зарегистрированных contiguoмы читает> 1 кб увеличивается в зависимости от глубины последовательности предполагая , что еще больше eccDNA элементы были бы записаны , если образцы были секвенированы Далее (рисунок 2). Как и ожидалось, метод Круг-Seq извлеченный многочисленные считывает данные из множества известных элементов, кольцевых ДНК, включая плазмиды 2 мкм, митохондриальной ДНК, рибосомных РНК-генов на хромосоме XII, и трех плазмид внутреннего контроля, pBR322, pUC19 и pUG72, которые вносили в образцы непосредственно перед очисткой на колонке (рисунок 3).
Видео показывает пример прилегающего читает , что отображается на локус HXT7 _ARS432_ HXT6 на хромосоме IV. Ранее [HXT6 / 7 круг] был обнаружен Круг-Seq в десяти популяциях S288c (каждый с 1 × 10 10 клеток) и структуры круговой ДНК была подтверждена путем обратного ПЦР - анализа 20. [HXT6 / 7 CIrcle] также был записан в каждой из трех популяций CEN.PK (рис 4A). Кроме того, большинство общих генов eccDNA среди дублирующих образцов CEN.PK перекрывается генов eccDNA из наборов данных S288c (рис 4б).
Для проверки специфичности Circle-Seq протокола для очистки кольцевых ДНК, двух образцов, каждый из которых с 30 мкг геномной ДНК, были протестированы. Один образец был дополнен 100 нг ДНК плазмиды и eccDNA из обоих образцов были очищены Круга-Seq протокола. После колоночной хроматографии, выход ДНК, составила 1,27% (380 нг) для образца без плазмиды (GD) и 1,60% (480 нг) для образца с плазмидой (GD + P). Эффективность лечения экзонуклеазной тестировали на линейном содержание ДНК через 29 ч и 72 ч с помощью ПЦР против ACT1. Ни один из образцов не содержал усиленный СИГН1 (данные не показаны). Фракцию каждого экзонуклеазной обработанного образца было далее, аmplified по ø29 полимераза и продукты ферментативных реакций анализировали с помощью пропидийиодидом окрашивания (рис 5A-F) и электрофореза в агарозном геле (рис 5г). Образцы после обработки экзонуклеазной показали минимальный пропидий йод-пятно (рис 5A-B). Ø29 - усиленный образец только с геномной ДНК показал нитевидные структуры (рис 5в) , аналогичные контрольным образцом (рис 5E). Ø29 - усиленный образец , который был добавлен плазмиды показал фокусы (рис 5D) , напоминающих управления плазмиды (рис 5F). Изображения показали, что ø29 полимеразной обогащенные для кольцевых ДНК по линейной ДНК. Наиболее линейная хромосомная ДНК была удалена из образцов после обработки 29 ч экзонуклеазной (рис 5A-B, G). Однако интенсивное лечение экзонуклеазная в течение более 100 часов и с использованием более 100 единиц было нужно , чтобы удалить все хромосомные линейную ДНК, в качестве ø29 - амплифицированный образцы все еще показали фоне нитевидных структур после 72 ч обработки экзонуклеазной (Рисунок 5C-D).

. Рисунок 1. Схема круга-Seq метода Протокол состоит из 5 этапов: 1) культивирования клеток, 2) очистка и обогащение eccDNA путем колоночной хроматографии, 3) переваривания оставшиеся линейной хромосомной ДНК в элюате фракции, 4) амплификации ДНК с помощью ДНК - полимеразы ø29 и 5) секвенирования высокообогащенного eccDNA и картографирования читает на S. CEREVISIAE референсный геном. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
p_upload / 54239 / 54239fig2.jpg "/>
Рисунок 2. прилежащей читает> 1 кб в зависимости от глубины последовательности. EccDNA от 1 × 10 10 клеток увеличиваться в зависимости от глубины последовательности (в миллионах) сопоставляется читает. Показаны: биологические утраивает от гаплоидного CEN.PK S. CEREVISIAE популяции (C1, C2, C4) , разделенных 10 10 клеточных делений. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
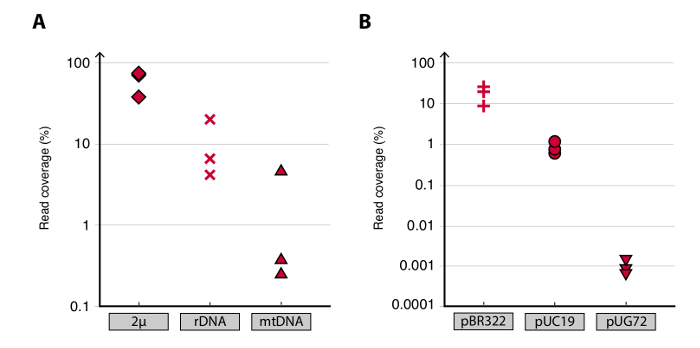
Рисунок 3. Обнаружение известных элементов кольцевых ДНК. (AB) Разброс участков покрытия чтения (читай плотности) в процентах для плазмид в CEN.PK биологических повторяет C1, C2 и C4. (A) Подключенные читает к эндогенным дрожжевых плазмид: 2 мкм; [РДНК круг] (рибосомальной РНК генов из хромосомы XII); и мтДНК (митохондриальная ДНК). (В) Уникальный чтениями для управления плазмид. Контрольные плазмиды вносили в образцы перед очисткой колонки. Плазмида отношения на клетку были: pBR322 (плюс знаки) 1: 1, pUC19 (кружки) 1:50, и pUG72 (треугольники) 1: 2500.

Рисунок 4. Элементы Общие eccDNA в CEN.PK и S288c. (A) диаграмма Венна отображения перекрытия между 476 гены на 294 eccDNA элементов в трех образцах CEN.PK (C1, C2, C4). В 16 общих перекрывающихся генов eccDNA / плазмид аннотируются (все названия генов находятся в Dataset 1). (B) , диаграмма Венна всех записанных генов на мнимых eccDNAs из трех образцов CEN.PK (C1, C2, C4), по сравнению со всеми записанными генов на мнимых eccDNAs от 10 S288c образцов: S1-S2, R1-R4, Z1-Z4 (см ссылку 20). Показаны 13 биологических повторностей (S1-S2, R1-R4, Z1-Z4, С1-С3) с генами / плазмид и предполагаемых областей eccDNA, что перекрывается минимум 2 штамма фонов и 3 или более экспериментальных установок. Образцы C, CEN.PK; R и Z образцы, S288c BY4741; S образцы, S288c M3750. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5. Визуализация образцов ДНК после того, как экзонуклеазы и O 2 9 лечение. (AF) Пропидиум йодида окрашивание ДНК. Шкала бар, 10 мкм. (А, С и Е) Образцы с геномной ДНК (GD); (В и D) образцы с GD плюс плазмиды (GD + P). ( Онг> AB) После 29 ч лечения экзонуклеазной (EXO 29 ч); (CD) после обработки экзонуклеазной 72 часа с последующим ø29 полимеразной амплификации (EXO 72 ч + ø29). (E) геномная ДНК после того, как управление е: ø29 полимеразной амплификации; (F) контроль плазмида (5,5 кб) после того, как 29 полимеразной амплификации; (G ø) агарозный гель-eletrophoresis. Слева направо: L, 1 кб маркеров; P, контроль плазмида (5,5 кб) после EXO 29 ч; GD, после того, как EXO 29 ч (образец , как и в A); GD + P, после того, как EXO 29 ч (образец как B); GD и GD + P, после того, как EXO 29 ч + ø29; GD и GD + P, после того, как EXO 72 ч + ø29 (образец , как в CD). Смотрите таблицу S1 для дополнительных деталей. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Асет 1 "SRC =" / файлы / ftp_upload / 54239 / 54239dataset1.jpg "/>
1. Потенциальные набора данных участков ДНК в CEN.PK. рассылке Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
Показаны данные о последовательности и анализ для 348 регионов. Столбцы AD, отображение eccDNA. A (первая колонка слева), образец, из которого был выявлен предполагаемый eccDNA; B, хромосомы; CD, начальный и конечный координаты предполагаемых eccDNAs. EH, содержание eccDNA. Е, автономно реплицироваться последовательность (ARS) в регионе; F, полный ген в регионе; G, часть гена, включенного в регионе; H, BLASTN идентифицированного гена. IO, охват EccDNA и р-значения. Я, самый длинный край с уникальной аннотированный последовательности в Вр; J, число всех сопоставляются читает; K, охват всех сопоставляются читает фрагментами в кб из миллиона отображенной читает (FPKM); L, р-значение для мнимого eccDNA по сравнению с возникновением случайно из Монте-Карло; М, число ипiquely сопоставляются читает; НЕТ; а K и L, используя только однозначно сопоставляются читает (UFPKM). Параметры для отображения операций чтения и моделирование по методу Монте - Карло , как описано 20.
Обсуждение
Круг-Seq метод позволяет генома масштабе обнаружение eccDNA из дрожжевых клеток с разрешением на уровне последовательности. Этот метод является легкой очистки eccDNA, который не требует интенсивного завихрения или пипетирования и использует разделение колонки под действием силы тяжести, чтобы ограничить eccDNA поломки, что приведет к экзонуклеазной пищеварения на последующей стадии. Эти признаки способа могут иметь решающее значение для обнаружения крупных eccDNAs, содержащих последовательности генов. Круг-Seq обнаружены многочисленные eccDNAs включая полные генов (Dataset 1). Он также обнаружил 86 т.п.н. дрожжевой митохондриальной ДНК. Таким образом, этот протокол облегчает очистку больших элементов кольцевых ДНК. Сохранение количества стадий экстракции ДНК к минимуму снижает риск потери eccDNA и максимизирует доходность. На основе результатов контроля, подскочили в плазмид, Круг-Seq обладает высокой чувствительностью, выявляя одну кольцевую ДНК из 2500 клеток. Кроме того, удаление обильные эндогенные плазмид, такие как 2 мкм; плазмида или митохондриальной ДНК может значительно повысить чувствительность. Отверждение 2 мкм от дрожжевых культур было описано 30. В качестве альтернативы, 2μ и митохондриальной ДНК удаление могло бы быть достигнуто с редкой режущим эндонуклеазы, такой как SwaI. Тем не менее, шаг рестриктазы могут быть ориентированы на другие eccDNAs интересов и ограничить общий выход eccDNA.
Критические шаги для обнаружения eccDNA были удаление линейной ДНК (шаг 3) и секвенирования ДНК (этап 5) на нужную глубину. Для того, чтобы записать большинство eccDNAs из клеточной популяции, глубокое секвенирование может потребоваться 20. Парноконцевое секвенирование должен обеспечить еще большую уверенность обнаружения eccDNA, как и круговые перекрестки ДНК ожидается выход парноконцевое читает эту карту вразнобой. Эти расхождения поддерживают обнаружение кольцевых структур ДНК и потенциально могут быть использованы в качестве дополнительного фильтра eccDNA обнаружения.
Круг-Seд метод был проверен путем использования трех независимых S. популяции CEREVISIAE CEN.PK. Обнаруженные последовательности включенных ранее сообщалось eccDNAs, эндогенные плазмид и шипами в плазмид и сотни предполагаемых eccDNAs (Dataset 1). Эти данные подтверждают предыдущие Круг-Seq наборов данных из S. CEREVISIAE S288c 20. Открытие нескольких eccDNAs общих для населения CEN.PK и S288c указывает на то, что эти локусы имеют склонность существовать в виде круговых элементов (рисунок 4). Ранее мы показали , что [GAP1 круг] обогащен в атмосфере азота в ограниченных условиях в CEN.PK фоне 8, хотя доказательство [GAP1 круга] в других слоев штамма не было найдено. Нахождение eccDNA от CUP1-1 RSC30, ASP3-1, COS111 и HXT6 HXT7 локусов в обоих S288c и CEN.PK предполагает , что предрасположенность к циклизации ДНК является конподается между штаммами дрожжей. Остается показать , если [HXT6 / 7 круг], [ASP3-1 круг], [COS111 круг], и [CUP1-1 RSC30 круг] придают селективные преимущества клеток или если их существование является лишь следствием высоких темпов ДНК циркуляризации.
Взятые вместе, результаты указывают на то, что круг-Seq хорошо подходит для обнаружения килобаза размера eccDNAs и имеет преимущества для идентификации eccDNAs с полными генов. Круг-Seq является очень чувствительным методом, который позволяет целого генома масштаба экраны eccDNAs из дрожжей. Круг-Seq метод может открыть новое направление исследований, направленных на выяснение роли eccDNA в формировании гена делеции и уточнениями. Учитывая, что архитектура и структура ДНК в значительной степени законсервирован от дрожжей до эукариотической высших эукариот, Круг-Seq метод должен, в принципе, быть applicablе для всех эукариотических клеток, с незначительными изменениями. В настоящее время этот метод не содержит каких-либо ограничений, хотя его способность очищать Мегабазе размера eccDNAs еще предстоит доказать. Кроме того, использование ø29 ДНК - полимеразы, который использует способ амплификации прокатка круга 31, создает уклон в сторону меньших eccDNAs делая eccDNA Количественное более трудным. Круг-Seq обнаруживает eccDNAs достаточно большой, чтобы нести полные гены, что делает его пригодным для проведения исследований по двойному минут кольцевой ДНК из соматических клеток человека. Двойные минут могут способствовать к раку , когда протоонкогены усиливаются на этих элементах 32-37. Исследования eccDNAs в клетках зародышевой линии могут быть использованы для измерения частоты мутаций зародышевой линии и оценки качества спермы, например, в животноводстве. Таким образом, Круг-Seq имеет потенциал, чтобы уступить понимание скорости, при которой возникает генетическая изменчивость в виде вариации числа копий, и привести к новому пониманию заболеваний, которые включают ген от копированияИзменение числа 38-40.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
Thanks to Kenn D. Møller and Claus Sternberg (DTU) for technical assistance and to Tue S. Jørgensen for quantitative PCR analysis.
Материалы
| Name | Company | Catalog Number | Comments |
| Bacto peptone | BD Difco | 211677 | Alternative product can be used. |
| Brilliant III SYBR Green PCR Master Mix | Agilent Technologies | 600882 | For qPCR analysis. Alternative product can be used. |
| Dextrose (D-glucose) | Carl Roth | HN06.4 | Alternative product can be used. |
| Disruptor Beads, 0.5 mm | Scientific Industries, Inc. | SI-BG05 | Glass beads to disrupt plasma cell membranes. Alternative product can be used. |
| Ethidium bromide | Carl Roth | 2218.2 | Agarose gel stain for detecting DNA/RNA. |
| GeneJet plasmid miniprep kit | Thermo Fisher | K0502 | Plasmid purifcation from bacteria. Alternative product can be used. |
| NotI, FastDigest | Life Technologies - Thermo Fisher Scientific, USA | FD0594 | Endonuclease. Alternative product can be used. |
| Plasmid Mini AX kit | A&A Biotechnology, Poland | 010-50 | Plasmid purifcation kit used to purify eccDNA. |
| Plasmid-Safe ATP-dependent DNase kit | Epicentre, USA | E3105K | ATP-dependent exonuclease kit. Alternative product can be used. |
| Propidium iodide | Sigma-Aldrich, USA | 81845 | Alternative product can be used. |
| pUG6 plasmid | EUROSCARF, Germany | P30114 | Marker gene: loxP-PAgTEF1-kanMX-TAgTEF1-loxP. |
| QIAGEN genomic-tip 100/G | Qiagen, USA | 13343 | Genomic DNA purifcation from yeast. Alternative product can be used. |
| REPLI-g Mini Kit protocol | Qiagen, USA | 150023 | Amplification of eccDNA by the phi29 polymerase. |
| Yeast extract | BD Difco | 210929 | Alternative product can be used. |
| Zymolyase 100T (Lyticase, Yeast Lytic Enzyme) | Nordic BioSite, Sweden | Z1004-3 | Alternative product can be used. |
| Data access to sequence files | European Nucleotide Archive | EccDNA dataset from Saccharomyces cerevisiae CEN.PK113-7D. Study accession number PRJEB9684. 2nd accession number is ERP010820. Locus tag prefix is BN2032. | |
| Name | Company | Catalog Number | Comments |
| Strains | |||
| Saccharomyces cerevisiae CEN.PK113-7D | Genotype MATa MAL2-8c SUC2 | ||
| Saccharomyces cerevisiae yeast deletion library pool | EUROSCARF, Germany | S288c BY4741 pool of 4400 viable single-gene deletion mutants disrubted by KanMX module. Genotypes MATa his3Δ1 leu2Δ0 met15Δ0 ura3Δ0 genexxx::KanMX. | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| DNA Spectrophotometer | NanoDrop 1000 Spectrophotometer, Thermo Fisher | Measuring DNA concentration. Alternative product can be used. | |
| Fluorescence microscopy | Nikon Optronics Magnafire. Red excitation fluorescence filter, 663-738 nm. | Alternative product can be used. | |
| Robotic library-build system | Apollo 324, IntegenX Inc. | DNA library preparation. Alternative product can be used. | |
| Sequencing platform | Illumina HiSeq 2000 platform, Illumina Inc. | DNA sequencing. Alternative product can be used. | |
| Ultrasonicator | Covaris LE220, microTUBE AFA Fiber tubes | Alternative product can be used. | |
| Name | Company | Catalog Number | Comments |
| Methods | |||
| 2% YPD media | Mix 10 g Dextrose, 10 g Yeast extract, 20 g Bacto peptone and add H2O to a total volume of 1000 ml and autoclave. | ||
| Circle-Seq test on genomic DNA | Genomic DNA was purified (Qiagen) from a pool of the yeast deletion library (Euroscarf). The DNA concentration was measured by nanodrop and 30 µg genomic DNA was pipetted into two micro centrifuge tubes. One micro centrifuge tube was supplemented with 100 nanogram plasmid (pUG6). The DNA samples were purified by Circle-Seq, omitting the protocol steps 1.1-1.3 and 1.5-1.7. The eluted DNA concentrations were measured by nanodrop and the entire DNA yield from sample GD and GD+P was treated with exonuclease for a period of 29 hours. A 10% fraction was collected for phi29-amplification and PCR analysis, while the remaining DNA was subjected to 72 hour exonuclease treatment. The samples were analyzed for linear DNA content by PCR, using the ACT1 gene as chromosomal marker. A 5% fraction of each of the exonuclease treated samples was amplified by the phi29 DNA polymerase for 16 hours (Qiagen). The presence of DNA in each sample was examined by loading an equal amount (7 µl) in wells on an 0.5 µg/ml ethidium-bromide 0.9% agarose gel after running gel-electrophoresis. | ||
| Mapping software | Bowtie2 aligner, John Hopkins University | Ultrafast short read alignment. Reference: 29. | |
| Propidium iodide stain | Images of propidium iodine stained DNA were captured by fluorescence microscopy at 100x magnification (100x/1.30 oil, Nikon) in the RFP channel (red excitation fluorescence filter, 663-738 nm) using identical exposition time (5 seconds). | ||
| Workflow bioinformatic system | Galaxy, Open source. | A free web-based platform for data intensive biomedical research. References: 27-28. |
Ссылки
- Kugelberg, E., Kofoid, E., et al. The Tandem Inversion Duplication in Salmonella enterica.: Selection Drives Unstable Precursors to Final Mutation Types. Genetics. 185 (1), 65-80 (2010).
- Reams, A. B., Kofoid, E., Savageau, M., Roth, J. R. Duplication Frequency in a Population of Salmonella enterica. Rapidly Approaches Steady State With or Without Recombination. Genetics. 184 (4), 1077-1094 (2010).
- Smith, C. A., Vinograd, J. Small polydisperse circular DNA of HeLa cells. Journal of Molecular Biology. 69 (2), 163-178 (1972).
- Carroll, S. M., DeRose, M. L., et al. Double Minute Chromosomes Can Be Produced from Precursors Derived from a Chromosomal Deletion. Molecular and cellular biology. 8 (4), 1525-1533 (1988).
- Cohen, S., Yacobi, K., Segal, D. Extrachromosomal Circular DNA of Tandemly Repeated Genomic Sequences in Drosophila. Genome research. 13 (6A), 1133-1145 (2003).
- Horowitz, H., Haber, J. E. Identification of Autonomously Replicating Circular Subtelomeric Y' Elements in Saccharomyces cerevisiae. Molecular and cellular biology. 5 (9), 2369-2380 (1985).
- Moore, I. K., Martin, M. P., Dorsey, M. J., Paquin, C. E. Formation of Circular Amplifications in Saccharomyces cerevisiae by a Breakage-Fusion-Bridge Mechanism. Environmental and molecular mutagenesis. 36 (2), 113-120 (2000).
- Gresham, D., Usaite, R., Germann, S. M., Lisby, M., Botstein, D., Regenberg, B. Adaptation to diverse nitrogen-limited environments by deletion or extrachromosomal element formation of the GAP1 locus. Proceedings of the National Academy of Sciences of the United States of America. 107 (43), 18551-18556 (2010).
- Windle, B., Draper, B. W., Yin, Y. X., O'Gorman, S., Wahl, G. M. A central role for chromosome breakage in gene amplification, deletion formation, and amplicon integration. Genes & development. 5 (2), 160-174 (1991).
- Gresham, D., Ruderfer, D. M., et al. Genome-Wide Detection of Polymorphisms at Nucleotide Resolution with a Single DNA Microarray. Science. 311 (5769), 1932-1936 (2006).
- Kidd, J. M., Cooper, G. M., et al. Mapping and sequencing of structural variation from eight human genomes. Nature. 453 (7191), 56-64 (2008).
- Gresham, D., Desai, M. M., Botstein, D., Dunham, M. J. The Repertoire and Dynamics of Evolutionary Adaptations to Controlled Nutrient-Limited Environments in Yeast. PLoS Genetics. 4 (12), 1-19 (2008).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic Variation and the Fate of Beneficial Mutations in Asexual Populations. Genetics. 188 (3), 647-661 (2011).
- van Loon, N., Miller, D., Murnane, J. P. Formation of extrachromosomal circular DNA in HeLa cells by nonhomologous recombination. Nucleic Acids Research. 22 (13), 2447-2452 (1994).
- Vinograd, J., Lebowitz, J. Physical and Topological Properties of Circular Dna. Journal of General Physiology. 49 (6P2), 103(1966).
- Shibata, Y., Kumar, P., et al. Extrachromosomal MicroDNAs and Chromosomal Microdeletions in Normal Tissues. Science. 336 (6077), 82-86 (2012).
- Dillon, L. W., Kumar, P., et al. Production of Extrachromosomal MicroDNAs Is Linked to Mismatch Repair Pathways and Transcriptional Activity. Cell Reports. 11 (11), 1749-1759 (2015).
- Li, L. L., Norman, A., Hansen, L. H., Sørensen, S. J. Metamobilomics - our knowledge on the pool of plasmid encoded traits in natural environments using high-throughput sequencing. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 18, 5-7 (2012).
- Brown Kav, A., Sasson, G., Jami, E., Doron-Faigenboim, A., Benhar, I., Mizrahi, I. Insights into the bovine rumen plasmidome. Proceedings of the National Academy of Sciences of the United States of America. 109 (14), 5452-5457 (2012).
- Møller, H. D., Parsons, L., Jørgensen, T. S., Botstein, D., Regenberg, B. Extrachromosomal circular DNA is common in yeast. Proceedings of the National Academy of Sciences of the United States of America. , 201508825(2015).
- Drubin, D. G., Miller, K. G., Botstein, D. Yeast Actin-Binding Proteins - Evidence for a Role in Morphogenesis. The Journal of cell biology. 107 (6), 2551-2561 (1988).
- Magdolen, V., Drubin, D. G., Mages, G., Bandlow, W. High levels of profilin suppress the lethality caused by overproduction of actin in yeast cells. FEBS letters. 316 (1), 41-47 (1993).
- Sandrock, T. M., Brower, S. M., Toenjes, K. A., Adams, A. Suppressor analysis of fimbrin (Sac6p) overexpression in yeast. Genetics. 151 (4), 1287-1297 (1999).
- Blanco, L., Bernad, A., Lázaro, J. M., Martìn, G., Garmendia, C., Salas, M. Highly Efficient DNA Synthesis by the Phage ø29 DNA Polymerase. The Journal of biological chemistry. 264 (15), 8935-8940 (1989).
- Dean, F. B. Rapid Amplification of Plasmid and Phage DNA Using Phi29 DNA Polymerase and Multiply-Primed Rolling Circle Amplification. Genome research. 11 (6), 1095-1099 (2001).
- Hutchison, C. A., Smith, H. O., Pfannkoch, C., Venter, J. C. Cell-free cloning using ø29 DNA polymerase. Proceedings of the National Academy of Sciences of the United States of America. 102 (48), 17332-17336 (2005).
- Goecks, J., Nekrutenko, A., Taylor, J., Galaxy Team, T. Galaxy: a comprehensive approach for supporting accessible, reproducible, and transparent computational research in the life sciences. Genome Biology. 11 (8), 86(2010).
- Giardine, B., Riemer, C., et al. Galaxy: A platform for interactive large-scale genome analysis. Genome research. 15 (10), 1451-1455 (2005).
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357(2012).
- Tsalik, E. L., Gartenberg, M. R. Curing Saccharomyces cerevisiae of the 2 micron plasmid by targeted DNA damage. Yeast. 14 (9), Chichester, England 847-852 (1998).
- Norman, A., Riber, L., Luo, W., Li, L. L., Hansen, L. H., Sørensen, S. J. An Improved Method for Including Upper Size Range Plasmids in Metamobilomes. PLoS ONE. 9 (8), e104405(2014).
- Storlazzi, C. T., Lonoce, A., et al. Gene amplification as double minutes or homogeneously staining regions in solid tumors: Origin and structure. Genome research. 20 (9), 1198-1206 (2010).
- Von Hoff, D. D., Needham-VanDevanter, D. R., Yucel, J., Windle, B. E., Wahl, G. M. Amplified human MYC localized to replicating submicroscopic circular DNA molecules. Proceedings of the National Academy of Sciences of the United States of America. 85 (13), 4804-4808 (1988).
- Raymond, E., Faivre, S., et al. Effects of hydroxyurea on extrachromosomal DNA in patients with advanced ovarian carcinomas. Clinical cancer research : an official journal of the American Association for Cancer Research. 7 (5), 1171-1180 (2001).
- Shimizu, N. Extrachromosomal Double Minutes and Chromosomal Homogeneously Staining Regions as Probes for Chromosome Research. Cytogenetic and genome research. 124 (3-4), 3-4 (2009).
- Eckhardt, S. G., Dai, A., Davidson, K. K., Forseth, B. J., Wahl, G. M., Von Hoff, D. D. Induction of differentiation in HL60 cells by the reduction of extrachromosomally amplified c-myc. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6674-6678 (1994).
- Vogt, N., Lefèvre, S. -H., et al. Molecular structure of double-minute chromosomes bearing amplified copies of the epidermal growth factor receptor gene in gliomas. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11368-11373 (2004).
- Ahn, K., Gotay, N., et al. High rate of disease-related copy number variations in childhood onset schizophrenia. Molecular psychiatry. 19 (5), 568-572 (2013).
- Girirajan, S., Johnson, R. L., et al. Global increases in both common and rare copy number load associated with autism. Human molecular genetics. 22 (14), 2870-2880 (2013).
- Vogt, N., Gibaud, A., Lemoine, F., de la Grange, P., Debatisse, M., Malfoy, B. Amplicon rearrangements during the extrachromosomal and intrachromosomal amplification process in a glioma. Nucleic Acids Research. , (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены