Method Article
Визуализации Центросомы в Fly семенников
В этой статье
Резюме
Визуализация центросомных белков Drosophila во время сперматогенеза является мощным методом для идентификации новых белков критических для центросом биологии, а также для выяснения конкретной функции известных игроков в этом процессе.
Аннотация
Центросомы сохраняются микротрубочек основе органеллы, структура которых и функциональные резко меняться в течение клеточного цикла и дифференцировки клеток. Центросомы имеют важное значение для определения оси деления клеток во время митоза и зарождаются реснички во время интерфазы. Идентичность белков, которые опосредуют эти динамические изменения остается лишь частично известны, а функция многих белков, которые были вовлечены в этих процессах все еще рудиментарным. Последние исследования показали, что дрозофилы сперматогенез предоставляет мощную систему для выявления новых белков критические для центросом функции и формирования, а также, чтобы разобраться в конкретной функции известных игроков в процессах центросомой связаны между собой. Дрозофилы является признанным генетическая модель организм, где мутанты в центросомных гены могут быть легко получены и легко проанализирована. Более того, последние достижения в области чувствительности и разрешения световой микроскопии иРазработка надежных генетически меченых центросомных маркеров превратили способность использовать Drosophila яички как простой и доступной модельной системы для изучения центросомы. Эта статья описывает использование генетически-меченых центросомных маркеров для выполнения генетические экраны для новых центросомных мутантов и, чтобы разобраться в специфической функции вновь выявленных генов.
Введение
Drosophila яички являются подходящим система органов для изучения разнообразных клеточных и развития процессов и были рассмотрены широко протяжении многих лет 1-9. Эта рукопись фокусируется на использовании Drosophila яичек для изучения центросому, консервативный сотовой органелл. Как и в других системах, центросома функции Drosophila семенников в митозе, мейоза, и цилиогенеза 10. Центросомы состоят из пары микротрубочек на основе структур, известных как центриолями окруженных сложной сети белка называют pericentriolar материала (PCM). Центриоль пара состоит из старой материнской центриоли и младшая дочь центриоли. Как клетка продвижения к митоза, обе центриоли отделить, не дублировать, и приобрести большое количество ИКМ в конечном счете сформировать два различных центросомы. Центросома содержащий оригинальную материнской центриоли называют материнской центросомы и CENTRosome содержащий оригинальную дочь центриоль называют дочерней центросоме.
Drosophila яички идеально подходят для изучения молекулярной основы центросом биологии на флуоресцентной микроскопии для целого ряда причин.
- Большинство белков дрозофилы, которые необходимы для центросом биологии в яичках законсервированы среди эукариот, предполагая, что понимание отношение к центросом биологии в организме человека и других видов могут быть получены путем изучения центросому у дрозофилы яички 1,11-14.
- Выполнение мутантный анализ у дрозофилы дает значительное преимущество, так как, в отличие от многих других моделей, центросомного мутации у дрозофилы не эмбриональными леталями, что позволяет классического генетического анализа центросом функции. Эта уникальная особенность дрозофилы связано с наличием материнской вклада, которая сохраняется во время критических стадиях эмбрионального развитвремя транспортировки. 1,11-14. Таким образом, можно) исследования мутации, которые полностью устраняют центросом образование и б) изучения судьбы нормальной центросоме, который был сформирован в начале эмбриона материнским вклад в мутантного контексте после материнский вклад был исчерпан (принцип метода описана в 11).
- Функциональные трансгены с генетически кодируемых флуоресцентных меток, которые маркируют центросому доступны. Многие из этих линий использовать собственный промотор протеина для привода транскрипцию трансгена, чтобы предотвратить сильное сверхэкспрессии. Это особенно важно, потому что сверхэкспрессия белков часто приводит к артефактам, которые мешают анализа центросом функции 1,11.
- Центриоль и центросома однозначно долго на протяжении Drosophila сперматогенеза, что позволяет быстро и просто анализа центросоме по визуализации.
- Последовательные шаги в сперматогенеза и центросом бiology расположены в хронологической последовательности по яичек, начиная с кончика яичка с центросомах спермы стволовых клеток и заканчивая в нижней части яичек с ограниченными центросом размера и активности в зрелых сперматозоидов (рис. 1 и 2). Это позволяет легко идентификации и анализа центросом функции во время различных стадиях развития сперматозоидов.
- Семенники легко рассекали от мужского личинок, куколок и взрослых 27.
- Во время сперматогенеза, центросома и ее центриоли пройти через многократного композиционных, структурных и функциональных состояний функционировать в митоза, мейоза и формирования реснички. В ходе этих процессов, центросоме собирает, дубликаты, мигрирует, якоря на конкретные частях клетки, созревает, делится, и создает ресничку. Кроме того, центриоль зрелого сперматиды порождает центриолей предшественника по имени PCL 1. Кроме того, в зрелом сперматиды, центросома подвергается процессу Called центросом снижение в котором он теряет многие компоненты PCM и центриоль (рис. 1 и 2). Таким образом, исследования в яичках позволяют решать многие аспекты центросом жизни, такие как центросом удержания в стволовых клетках, центриолей дублирования, центриолей стабильности, центриолей удлинения, центриолей разделения и сегрегации, найма PCM, цилиогенеза, формирование PCL, центросом сокращения и астральное микротрубочек зарождение и другие.
- Наконец, исследования центросом биологии помогали других известных характеристик Drosophila, которые сделали его предпочтительным модельный организм для биологических исследований. Они включают в себя короткое время поколения, легкость генетики, а также случайное и сайт-направленного мутагенеза.
Вместе указанное выше характеристики Drosophila яичек предоставляет модель, где центросома можно изучать с помощью легкого, быстрого и детального изображения. Методики, описанныев данной работе были применены для исследования многих аспектов центросомы биологии в том числе центриолей формирования 11 центриолей дублирования 15, набора PCM 16 центросом правила 17 и цилиогенеза 18. Эти методы также применяются для изучения центросому в других областях биологии, таких как мейоза правила 19, шпиндель узла 20 и центросом деятельности в дивизионе асимметричный стволовых клеток 21 и многие другие.
Визуализация яичек в центросомой начинается с получения мух, которые выражают генетически маркированные центросомного белки и выделения яички из мужского личинок, куколок или взрослых мух. Эти мухи доступны из нескольких исследовательских групп 1,11,15,22-25. Личинки яички содержать все этапы сперматогенеза до мейоза и полезны при анализе мутаций, которые смертельны в куколки или взрослого. Однако в конце куколки или молодой адуLt яички являются наиболее надежными и содержать все пред-и пост-мейоза этапы сперматогенеза, тем самым делая их предпочтительным для анализа. Так как число сперматозоидов уменьшается с лету возрастов, использование взрослых семенников также подходит для изучения центросому в контексте старения. 26. Способ выделения семенников от взрослых мух была ранее описана 27.
Визуализация центросомах и их функции в дрозофилы яичек может быть достигнуто с помощью трех взаимосвязанных треков, которые представлены здесь (рис. 3). Выбор дорожки из которых является наиболее подходящим зависит от характера вопроса исследователь адресации.
Трек включает съемку живых яичек. Это наиболее быстрый из трех дорожек, но может быть применен только когда образцы не должны быть сохранены и иммунного окрашивания, когда не требуется. В Track А, яички установлены (нетронутыми, пирсинг или вырезать) на слайдахи осторожно раздавленный под покровным что они образуют единый слой легко идентифицируемых сот. Затем клетки визуализировали с использованием как фазово-контрастной микроскопии и флуоресцентной микроскопии. Использование поэтапного отличие особенно важно для анализа Drosophila яичек, потому что это показывает сотовой информацию, которая не видна с другими формами проходящем свете и таким образом позволяет для быстрой идентификации различных стадиях развития сперматозоидов 28,29. Тем не менее, трек имеет два основных недостатка. Во-первых, морфологические целостность клеток часто ставится под угрозу, как только яички разрываются. Во-вторых, нефиксированные клетки иногда перемещаться внутри образца, делая съемку нескольких слоев конфокальной течение определенного региона сложной. Способствовать анализ конкретных типов клеток, яички могут быть пробиты или вырезать, чтобы направить путь яичка разрывы такое, что давя под покровное минимально влияет на морфологию типа клеток, представляющих интерес.
Дорожка B включает химическую фиксацию яичек. Этот трек требует промежуточное количество времени для подготовки образцов и имеет то преимущество, что фиксированные образцы могут быть сохранены для последующего анализа. Кроме того, фиксация служит, чтобы сделать клеточные структуры более жесткой, сводя к минимуму перемещение образца во время съемки. Тем не менее, фазово-контрастной микроскопии становится гораздо менее информативны после химической фиксации, что делает некоторые этапы развития сперматозоидов трудно определить.
Дорожка C является самой трудоемкой, но имеет дополнительное преимущество, что клеточные структуры фиксируются и иммуноокрашиванию, что позволяет для визуализации белков, которые не доступны с соответствующими генетики тегов. Есть много антитела доступные и коммерчески и из различных исследовательских групп для иммуноокрашивания центросомы и центросоме связанных структур в дрозофилы яичек.
протокол
1. Трек А. Получение Живые семенников
- Подготовка PBS путем растворения 8,0 г NaCl, 0,2 г KCl, 1,44 г Na 2 HPO 4, 0,24 г KH 2 PO 4 в 800 мл дистиллированной воды и доведения рН до 7,4. Довести объем до 1 л и стерилизуют в автоклаве.
- Изолировать яички, как описано выше 27.
- Подготовка DAPI для окрашивания буфер разбавлением 1 мг / мл запас в 1 мкг / мл в PBS. Используйте алюминиевую фольгу для защиты трубы от света и хранить при температуре -20 ° С.
- После выделения яички, погрузить образец в 6 мкл DAPI окрашивания буфера на вершине положительно заряженного стекло микроскопа в течение 10 мин. Семенники хорошо прилипать к коммерчески доступных положительно заряженных слайдов, что позволяет легко манипулировать образца. Положительно заряженные скользит ковалентно модифицированный для придания статический положительный заряд на поверхности стекла. Подобно полилизином покрытия, это способствует взаимодействие Wi яичекй поверхность слайда.
- Промыть избыток DAPI путем замены буфера окрашивания дважды с 6 мкл PBS. Используйте кусочек фильтровальной бумаги, чтобы фитиль от буфера после каждого этапа стирки. Будьте осторожны, чтобы случайно не удалить яички вместе с буфером во время каждого мытья.
- Добавить 6 мкл PBS к образцу. Количество используемого буфера должна быть скорректирована для размера покровного стекла. Объемы, представленные в этом протоколе указано для 18 х 18 мм покровным. Дополнительно: Желательно, чтобы проколоть яички вблизи относительного расположения типа клеток, представляющих интерес. Это будет гарантировать, что существует минимальное давление на этих клетках в течение тушить шагом, тем самым сохраняя свою структурную целостность. Прокалывание семенников можно выполнить с помощью острый, чистый скальпель.
- Осторожно помещают покровное на верхней части образца.
- Печать края покровного стекла с использованием четких лак для ногтей, чтобы обеспечить буфер не испаряется от живых образца в то время как имстарения.
- Используйте маркер для обозначения положения яичек для удобства в поиске образца на слайде и приступить к визуализации.
- Промыть избыток DAPI для окрашивания буфера путем замены буфера дважды с 6 мкл PBS. Используйте кусочек фильтровальной бумаги, чтобы фитиль от буфера после каждого этапа стирки. Будьте осторожны, чтобы случайно не удалить образец вместе с буфером во время каждого мытья.
2. Трек В. Получение основных семенников
- Подготовка Фикс буфера путем разбавления 37% формальдегида маточного раствора в PBS до конечной концентрации 3,7% формальдегидом в 1х PBS
- Подготовка DAPI для окрашивания буфер разбавлением 1 мг / мл DAPI запас в 1 мкг / мл в PBS.
- Погрузитесь яички в 6 мкл капли PBS в верхней части положительно заряженного стекло микроскопа.
- Вручную ориентироваться яички в линейном порядке или иным предпочтительным.
- Используйте кусочек фильтровальной бумаги, чтобы фитиль от в PBS и заменить его с 6 мкл Fixбуфер течение 5 мин.
- Используйте кусочек фильтровальной бумаги, чтобы фитиль от буфера Fix и погрузиться образца в 6 мкл DAPI окрашивания буфера в течение 10 мин.
- Осторожно помещают в 18 х 18 мм покровное на верхней части образца.
- Печать края покровного стекла с использованием четких лак для ногтей, чтобы обеспечить буфер не испаряется от образца в то время визуализации.
- Используйте маркер для обозначения положения яичек для удобства в поиске образца на слайде и приступить к визуализации.
3. Трек С. Получение иммуноокрашиванию семенников
Покровные силицирования: Погрузитесь несколько 18 х 18 мм покровные в маленьком подносе, содержащей силицирования решение и выдержать в течение 1 мин при комнатной температуре под вытяжкой. Убедитесь, что покровные полностью открыты и не накладываются на друг друга.
- Поместите образец в 5 мкл PBS капли на силиконизированной покровное. Ориентяички по желанию и проколоть яички используя острый скальпель. Аккуратно поместите положительно заряженный стекло микроскопа над покровного стекла, что позволяет PBS стать равномерно распределены между покровным и горкой. Используйте небольшой кусочек фильтровальной бумаги, чтобы фитиль от избытка буфер между покровным и горкой. Как буфер удаляют фильтровальной бумаги, повышение давления будет раздавить яички. Многие образцы должны быть подготовлены одновременно, как некоторые из них могут быть потеряны или повреждены в течение протокола. Стекло резчик может быть использован для обозначения слайды если различные типы образцов будет подготовлен одновременно.
- Промыть покровные 3 раза в течение 1 мин каждый в воде, а затем 3 раза в течение 1 мин каждый в 70% этаноле, и окончательной промывки в течение 1 мин в воде. Разрешить силицированного покровные высохнуть на воздухе под вытяжкой.
- Оставьте слайды в жидкий азот и позволяют образец заморозить в течение 5-10 мин.
- Удалить слайды из лiquid азота с использованием больших щипцов. Используйте скальпель, чтобы быстро удалить покровное. Образец должен оставаться на слайде. Будьте осторожны, чтобы не размазать образца во время этого процесса, сдвинув покровное по слайду.
- Инкубируйте слайды в prechilled метанола в стеклянной Коплин окрашивания банку при -20 ° С в течение 15 мин.
- Перенесите слайды в стекло Коплин окрашивания банку, содержащую prechilled ацетон при -20 ° С в течение 30 сек.
- Вымойте слайды в течение 1 мин в PBS при комнатной температуре с использованием стекла Коплин окрашивания банку.
- Подготовка PBST-B, дополняя PBS с 0,1% Triton-X100 и 1% бычьего сывороточного альбумина (BSA). 5% нормальный сыворотки из того же вида хосте, что и вторичным антителом (из шага 3.14) может быть использован вместо BSA, чтобы уменьшить фоновый шум, полученный из вторичного неспецифического связывания антитела.
- Инкубируйте слайды в течение 10 мин в PBST-B в стеклянной Коплин банку для окрашивания, чтобы блокировать неспецифические сайты.
- Заполните колодезикамера влаги с водой. Влажность внутри камеры позволит свести к минимуму испарение растворов антител из образца во время инкубации.
- Подготовка PBST-BR путем дополнения PBST-B с 100 мкг / мл РНКазы А. РНКаза А деградирует РНК в образце, а также служит в качестве дополнительного блокирующего агента, поглощая сильно к поверхности стекла.
- Поместите приблизительно 1х1 см кусок Parafilm сверху образца для распространения раствор антител равномерно и защитить раствор антитела испарение. Закройте камеру влаги и инкубировать образец в первичным антителом в течение 1 часа при комнатной температуре.
- Удалить слайды из PBST-B. Используйте кусочек фильтровальной бумаги, чтобы высушить области слайда вокруг образца в, используя осторожность, чтобы не сушить сам образец. Наконец, поместите слайд в камере влажности с образец вверх
- Аккуратно добавить 100 мкл первичных антител разводят в PBST-BR в верхней части спецификацииИмен (1:200, как правило, является хорошей отправной концентрация для неохарактеризованных антител).
- Обложка образца с приблизительно 1 х 1 см кусок парафильмом и замкнуть прострел влаги. Инкубируйте образца в вторичными антителами в течение 1 часа при комнатной температуре.
- Откройте камеру влаги и использовать пинцет, чтобы аккуратно удалить парафильмом от слайда. Инкубируйте слайды в течение 5 мин в PBST в стеклянной Коплин окрашивания банку при комнатной температуре, чтобы вымыть. Повторите этот процесс для всего три раза.
- Удалить слайды из PBST-B и поместите их в камере влажности с образец вверх. Осторожно добавьте 100 мкл вторичного антитела, разведенного в PBST-BR сверху образца.
- Откройте камеру влаги и использовать пинцет, чтобы аккуратно удалить парафильмом от слайда. Опять же, мыть образца 3 раза в течение 5 мин каждого в PBST в стеклянной Коплин окрашивания банку с последующим 3x в течение 5 мин каждого в PBS.
- Используйте Kimwipe и фильтровальную бумагу к тщательно высушить поверхность слайда, будьте осторожны, избегайте прикосновения или сушки образца.
- Добавить 6 мкл Монтаж СМИ к образцу, накройте чистой покровного (не покрытой силиконом), и печать края с лаком для ногтей.
- Используйте маркер для обозначения положения яичек для удобства в поиске образца на слайде и приступить к визуализации.
4. Визуализации Примечания
Изображений может быть достигнуто с помощью вертикальном или перевернутом регулярный светового микроскопа или конфокальной микроскопии. Важно, что микроскоп оснащаться фазе контраста, особенно для визуализации живых яичек образцов (трек A). Эта функция в последнее время стало доступно на конфокальной микроскопии.
Когда яички сломать спонтанно (трек), кончик (стволовых клеток регион), как правило, сохранены и легко идентифицировать, обеспечивая хорошую маркер изначально найти и использовать для ориентации.
_content "> Центриоли довольно небольшие структуры и, следовательно, изображения должны быть приняты с использованием 63x или 100x цели, коэффициент увеличения 4-6X, и разрешением не менее 512 х 512 пикселей при возможных.Результаты
Центросомы пройти несколько морфологических и функциональных преобразований в течение сперматогенеза. Эта характеристика сперматогенеза делает яички полезная система для изучения различных аспектов центросом биологии. Одним из таких легко наблюдать процесс центросома удлинение. В сперматогониев, центриолей маркер Ana1-GFP знаменует 0,6 мкм длиной центриоль (рис. 4а). Это центриоль удлиняется во сперматогенеза и достигает в длину 2,5 мкм почти зрелых сперматид. С центриоли в Drosophila спермы однозначно долго, изображения могут быть использованы, чтобы сделать количественные заявления относительно центросом удлинения (рис. 4б). Анализ центриолей длины также может быть выполнена в мутантных фоне и различные мутанты были идентифицированы, которые изменяют центриолей рост (рис. 5). Примеры всегда рано (Aly) и пушечное ядро (CAN), мутации, которые Arresт сперматогенез до начала мейоза 30, но не блокируют центриолей удлинение. В этих мутантов, центриоли зрелого сперматоцит расти примерно до ~ 2,4 мкм по сравнению с центриолей контрольных клеток, которые достигают максимум 1,8 мкм.

Рисунок 1. Сперматогенез и Центросома биологии. А) Развитие стволовых клеток и сперматогониев. Все сперматозоиды происходят из стволовых клеток, обнаруженных в апикальной кончике яичек. Каждый стволовых клеток делит асимметрично, чтобы сформировать стволовых клеток, который наследует мать центросому и spermatogonium предшественников, наследующий дочь центросому 31. Как сперматогониев форме, они становятся в окружении 2 кисты клеток, которые продолжают окружать сперматоцитов и сперматид всей сперматогенеза. Сперматогонии делят 4 раза, чтобы произвести 16 сперматогенов каждая из которых содержит два центриоли. Б) разработку сперматоцитов и мейоза. В процессе разработки сперматоцит, центриоли дублировать еще раз, чтобы генерировать четыре центриоли организованных в две пары на клетку и 64 центриолей в кисты. На ранних этапах развития сперматоцит, каждый центриоль движется к плазматической мембране, доки к нему, и удлиняется, чтобы сформировать структуру, которая напоминает первичная ресничка 18,32-34. В зрелых сперматоциты, центриоль длина достигает ~ 1,8 мкм. Центросомах играют существенную роль в мейозе. Во время мейоза I, в центриоль пар, которые все еще прикреплены к плазматической мембраны движении к центру клетки и создают инвагинации клеточной мембраны на их дистального конца. PCM вокруг центриолей растет, зарождается астральные микротрубочки, и локализуется с полюса шпинделя. В процессе перехода к мейоза II, центриоль пара отделяет таким образом, чтобы только один центриоль изложет на каждом полюса веретена. C) спермиогенеза. В конце мейоза II, в начале Круглый сперматиды имеет один центриоль, прикрепленный к инвагинированного плазматической мембране. Большой круглый митохондриальная производная находится вблизи ядра, а затем начинает удлиняться вдоль растущей аксонемы в более поздних раунда сперматид. Во время сперматогенеза, формы аксонемы и удлиняется внутри цитоплазмы. Кроме того новый центриолей структура известна как PCL (проксимального центриоль т.п.) появляется рядом с существовавшие ранее центриоли 1. В конце сперматогенеза, имеющие общую киста клетки отделяются друг от друга, чтобы стать полностью зрелым подвижных сперматозоидов. Диаграммы развития сперматоцит (B) и сперматогенеза (С) изображают только одну ячейку из 16 сперматоциты и 64 сперматид соответственно за кисты, и не изображают киста клетки. Нажмите здесь, чтобы посмотреть большоег цифра.
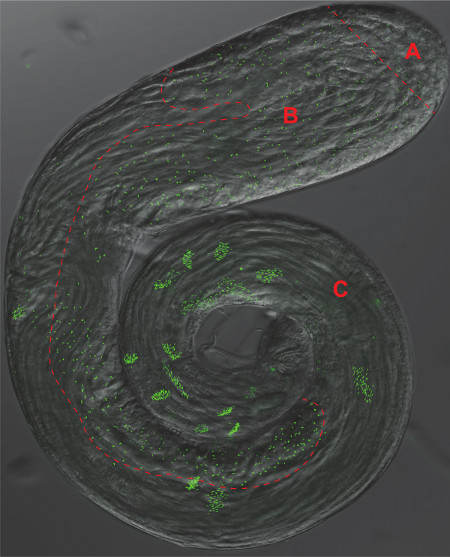
Рисунок 2. Drosophila Семенники. Наложение фазового контраста и флуоресценции GFP микрофотографии яичка целом монтажа, выражающей пан-центриолей маркер Ана-1-GFP. Отдельное область, соответствующая панелей 1-3 из рис.1 разделены красной пунктирной линии А) стволовых клеток и сперматогенов B) сперматоциты и мейоза, С) спермиогенеза.

Рисунок 3. Треки К обработки изображений центросомах в Drosophila яичек.

Рисунок 4. Центросома Удлинение Во сперматогенеза. А) Каждый этап показывает фазоконтрастной изображение (слева), флуоресценция изображения (в центре), и увеличенное изображение центросоме (справа). Фазового контраста изображения демонстрирует определенный этап клеток в зависимости от положения и морфологии клетки, ядра, ядрышка, и митохондрии. Флуоресценции изображение показывает ДНК окрашивали DAPI (синий). Центросома изображение показывает центросомы помеченных Asterless-GFP (ASL, лучших изображений) и Ana1-GFP (Ana1, нижнем изображении). Белый круг подчеркивает клеточную мембрану в обоих фазоконтрастных и флуоресцентные изображения. Пунктирные белые кружки и серый круг в изображении флуоресценции выделить положение ядра и ядрышек, соответственно. Желтые стрелка указывает на Y-хромосоменекоторые петли. Красный пунктирная круги отмечают митохондрии. Этапы 1-6 относится к 29 и этапы 13-17 относится к описанию клеточных стадиях в 32. Этап 1: Первичная сперматоцит. Определены как маленькой камере наконечника яичка. Этап 2а: Полярный сперматоцит. Выявленные присутствии митохондрий крышкой на одной стороне ядра. Этап 3: аполярных сперматоцит. Выявленные на его относительной большего размера, чем на первичном сперматоцит и отсутствие митохондрий крышкой. Этап 4: Первичная сперматоцит. Выявленные появлением все: Все 3 петли Y-хромосомы. Этап 5: Зрелые Первичная сперматоцит. Крупнейший сперматоцит производится в сперматогенеза, которые были определены дальнейшем увеличении размеров ядра. Этап 6: премейотической Первичная сперматоцит. Петли Y-хромосомы распадаются и ядро исчезает. Этап 13: Лук Стадия сперматиды. Круглый ячейка, содержащая не менее размера ядро и митохондрии. Этап 17: В конце сперматиды. Определены как удлиненной сперматиды, которая остается частью Bundlе из 64 сперматид с ядрами найденных у основания яичек., Ядра немного шире, чем зрелые сперматид найденных в семенных пузырьках. Масштабные бары, 10 мкм и 1 мкм. Б) График изображает средний и стандартное отклонение для каждой стадии как измерено Asterless-GFP (синий) и Ana1-GFP (зеленый). На стадии 6, (зеленый) средние значения и стандартные отклонения Asterless-GFP (синий) и Ana1-GFP перекрывают друг друга и только Asterless-GFP (синий) очевидна. Начиная с этапа 13, Asterless-GFP не украшает весь центриоль и измерения не были определены (ND).

Рисунок 5. Аномально Длинные Центриоли в Стадия 6 сперматоциты Али и может мутантов. AC) Свет микрофотография целых яичек и флуоресцентного панели представительной центросом Лос-Анджелесебелед по Ana1-GFP. Обратите внимание на ненормальное форму яичек в Али и может мутанты, что является результатом отсутствия сперматид как следствие задержку мейоза. D) График изображает средний, стандартное отклонение, и распределение данных центриолей длиной в дикого типа, Али и может . Образец номер для каждой точки данных в скобках. Шкала бар, 1 мкм.
Обсуждение
Изучение центросом биологию в лету яичек с использованием генетически-тегом центросомного маркеры является полезным методом для оценки центросом функции и деятельность в обоих дикого типа и мутанта контексте. В частности, трек подходит для быстрого скрининга центросомных аномалии, такие как порок, misegregation, нестабильности, или ненормальные длины в целях выявления новых мутантов. Кроме того, сперматиды реснички в живых препаратов остаются подвижными примерно 15 минут после вскрытия и использование живых яичек в Track А также позволяет подвижность сперматозоидов, чтобы быть легко решены. Поскольку активность сперматозоидов подвижных ресничек напрямую связано с центросом функции, анализы могут быть выполнены, чтобы определить влияние различных центросомных мутаций на функции ресничек. Дорожка B может быть использован для более конкретных наблюдений особенно когда статистические данные, необходимые для таких как подсчет количества центриолями на клетку и или количества клеток на кисты. Трек С самых usefuл для детальных наблюдений, которые требуют окрашивания с антителами. Примеры включают маркировку определенного типа клеток, таких как стволовые клетки, окрашивания белка, который не имеет доступный тег например ацетилированного тубулина или для проверки отсутствия или неправильной локализации белка в мутанта.
При визуализации центросомы и центросоме связанных структур, используя генетически маркированные маркеры, а не антитела не только экспериментально проще, но и обеспечивает более надежные и воспроизводимые результаты. Таким образом, использование генетически-меченых центросомных белков является надежным подходом для механистической и количественного анализа, которые требуют большой набор данных. Например, использование генетически-меченых центросомных маркеров было особенно ценно для количественной оценки центриолей длины. Такой анализ показал, что различные мутации могут быть разделены на две категории, основанные на изменчивости в центриолей длины. Одна категория включает в себя мутации, которые чанGE длина центриоль но не влияют на стандартное отклонение 1 и другая категория включает в себя мутации, которые влияют как длину центриолей и стандартное отклонение в длине 11. Такие количественные данные могут предоставить полезную информацию в зависимости от конкретных центросомных генов. Центросомных мутанты, которые обладают длина бракованного центриолей с увеличением стандартное отклонение может быть связано с дестабилизации центриолей структуры. Тем не менее, длина бракованного центриоль с нормальным стандартной ошибки может означать, что мутация не структурно дестабилизировать центриоль и, скорее всего, связано с изменением механизма регулирования контрольного центриолей длину. Из-за несоответствий в иммуноокрашивания, количественный анализ трудно с использованием маркеров антител в одиночку.
Центросома большой, сложный белковый состав и многие из его белков находятся только в его интерьере. Использование генетически-тегами центросомногомаркеры скорее антител позволяет последовательно маркировать внутренние компоненты центросоме которого эпитопы могут быть иначе недоступны для антител маркеров. Например, локализации исследования BLD10 с использованием антител узнает белок обогащаться на дистальных и проксимальных концах центриоль 13, в то время как BLD10-GFP показывает более равномерное распределение 1. Тем не менее, это также важно учитывать уровень экспрессии конкретного генетически-меченого белка, так как это может повлиять на распределение белка. Локализация ПАВ-4-GFP и SAS-6-GFP экспрессировался под их эндогенных ограничивается проксимальных концах центриоль 1,16,35 С другой стороны, САС-4-GFP и SAS-6-GFP экспрессировался под сильный убиквитин промоутер локализованы вдоль всей длины центриолей 12,14. Еще одним важным фактором является влияние генетической метки на функции белка. Анализируя если генетически-меченных белков функциональны может быть TESТед путем введения трансгенных белков в мутанта фоне и изучения, если трансгенные белок спасает фенотип мутанта.
Фиксация Drosophila семенников может быть выполнена с использованием различных химических фиксаторов. Здесь мы описываем фиксацию как с формальдегидом (трек B) и метанол-ацетон (трек C). Однако, как фиксатор может использоваться взаимозаменяемо и поскольку различные фиксаторы могут нарушить химически нативные эпитопы антител, выбор соответствующего фиксатора для иммунным окрашиванием должно быть определено экспериментально. Следующие фиксаторы и условия инкубации обычно используют: 3,7% формальдегида, 5 мин при комнатной температуре; метанол, 15 мин при -20 ° С; ацетон, 10 мин при -20 ° С; метанол, 15 мин при -20 ° C. затем ацетоном, 30 сек при -20 ° С, этанол, 20 мин при -20 ° С. Хотя фиксация смесью ацетон, метанол, этанол и не требуют длительной стадии проницаемости для фиксации иммуноокрашивания, шго формальдегида должны следовать один час инкубации в PBST-B при комнатной температуре в проницаемыми клеточные мембраны и позволит антитела доступ к внутриклеточным эпитопов. Кроме того, некоторые фиксаторы являются более подходящими для конкретных антигенов. Например, функции формальдегида хорошо для фиксации небольших белков, тогда как метанол и ацетон хорошо подходят для фиксации больших молекулярных комплексов 36.
Иммуноокрашивание Drosophila семенников было описано ранее для наблюдения хроматина структуры и микротрубочки цитоскелета 29,37. Здесь (трек С), процедура была оптимизирована для анализа центросомных структур, содержащих генетически-меченных белков. Мы предоставляем подробное описание этой процедуры, чтобы направлять людей, которые не имеют опыта работы в дрозофилы яичек. Эта процедура также включает модификации для улучшения сохранения и морфологию семенников, например, с помощью Siliconized покровные и положительно заряженные предметные стекла микроскопа.
Раскрытие информации
Свободный доступ к данной публикации была поддержана Leica Microsystems.
Благодарности
Эта работа была поддержана грантом (R01GM098394) от НИЗ и Национального Института общей медицинских наук, а также гранта 1121176 от Национального научного фонда.
Материалы
| Name | Company | Catalog Number | Comments |
| DAPI | Invitrogen | D1306 | |
| Positively Charged Slides | AZER Scientific | EMS200A+ | |
| Feather Microscalpel | Electron Microscopy Sciences | 72045-30 | |
| 37% Formaldehyde or Paraformaldehyde | Fisher Scientific | BP531-500 | |
| Phosphate Buffered Saline (PBS) | Boston Bioproducts | BM-220 | |
| 18x18 mm coverslips number 1.5 | VWR | 48366 205 | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Sigmacote | Sigma-Aldrich | SL2-100 ml | |
| Methanol | Fisher Scientific | A412-4 | |
| Acetone | Fisher Scientific | A949-1 | |
| Triton-X100 | Sigma-Aldrich | T9284-100ML | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| RNAse A | 5 prime | 2900142 | |
| Filter paper | Whatman | 1001-055 | |
| Glass engraver | Dremel | 290-01 | |
| TCS SP5 confocal microscope | Leica | ||
| Mounting Media | Electron Microscopy Sciences | 17985-10 | |
| Immuno Stain Moisture Chamber, Black | Electron Microscopy Sciences | 62010-37 | |
| Glass Coplin Staining Jar, Screw Cap | Electron Microscopy Sciences | 70315 |
Ссылки
- Blachon, S., et al. A proximal centriole-like structure is present in Drosophila spermatids and can serve as a model to study centriole duplication. Genetics. 182, 133-144 (2009).
- Hennig, W. Spermatogenesis in Drosophila. The International journal of developmental biology. 40, 167-176 (1996).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis: Big things come from little packages. Spermatogenesis. 2, 197-212 (2012).
- White-Cooper, H. Molecular mechanisms of gene regulation during Drosophila spermatogenesis. Reproduction. 139, 11-21 (2010).
- Davies, E. L., Fuller, M. T. Regulation of self-renewal and differentiation in adult stem cell lineages: lessons from the Drosophila male germ line. Cold Spring Harb Symp Quant Biol. 73, 137-145 (2008).
- Belote, J. M., Zhong, L. Duplicated proteasome subunit genes in Drosophila and their roles in spermatogenesis. Heredity. 103, 23-31 (2009).
- Xiao, X., Yang, W. X. Actin-based dynamics during spermatogenesis and its significance. Journal of Zhejiang University. Science. B. 8, 498-506 (2007).
- Hennig, W. Chromosomal proteins in the spermatogenesis of Drosophila. Chromosoma. 111, 489-494 (2003).
- Wakimoto, B. T. Doubling the rewards: testis ESTs for Drosophila gene discovery and spermatogenesis expression profile analysis. Genome research. 10, 1841-1842 (2000).
- Avidor-Reiss, T., Gopalakrishnan, J. Building a centriole. Curr Opin Cell Biol. , (2012).
- Blachon, S., et al. Drosophila asterless and vertebrate Cep152 Are orthologs essential for centriole duplication. Genetics. 180, 2081-2094 (2008).
- Basto, R., et al. Flies without Centrioles. Cell. 125, 1375-1386 (2006).
- Mottier-Pavie, V., Megraw, T. L. Drosophila bld10 is a centriolar protein that regulates centriole, basal body, and motile cilium assembly. Mol Biol Cell. 20, 2605-2614 (2009).
- Rodrigues-Martins, A., et al. DSAS-6 Organizes a Tube-like Centriole Precursor, and Its Absence Suggests Modularity in Centriole Assembly. Curr Biol. 17, 1465-1472 (2007).
- Stevens, N. R., Dobbelaere, J., Brunk, K., Franz, A., Raff, J. W. Drosophila Ana2 is a conserved centriole duplication factor. J Cell Biol. 188, 313-323 (2010).
- Gopalakrishnan, J., et al. Sas-4 provides a scaffold for cytoplasmic complexes and tethers them in a centrosome. Nat Commun. 2, 359(2011).
- Gopalakrishnan, J., et al. Tubulin nucleotide status controls Sas-4-dependent pericentriolar material recruitment. Nat Cell Biol. 14, 865-873 (2012).
- Riparbelli, M. G., Callaini, G., Megraw, T. L. Assembly and persistence of primary cilia in dividing Drosophila spermatocytes. Dev Cell. 23, 425-432 (2012).
- Maines, J. Z., Wasserman, S. A. Post-transcriptional regulation of the meiotic Cdc25 protein Twine by the Dazl orthologue Boule. Nat Cell Biol. 1, 171-174 (1999).
- Herrmann, S., Amorim, I., Sunkel, C. E. The POLO kinase is required at multiple stages during spermatogenesis in Drosophila melanogaster. Chromosoma. 107, 440-451 (1998).
- Yamashita, Y. M., Jones, D. L., Fuller, M. T. Orientation of asymmetric stem cell division by the APC tumor suppressor and centrosome. Science. 301, 1547-1550 (2003).
- Dix, C. I., Raff, J. W. Drosophila Spd-2 Recruits PCM to the Sperm Centriole, but Is Dispensable for Centriole Duplication. Curr Biol. , (2007).
- Stevens, N. R., Dobbelaere, J., Wainman, A., Gergely, F., Raff, J. W. Ana3 is a conserved protein required for the structural integrity of centrioles and basal bodies. J Cell Biol. 187, 355-363 (2009).
- Giansanti, M. G., Bucciarelli, E., Bonaccorsi, S., Gatti, M. Drosophila SPD-2 Is an Essential Centriole Component Required for PCM Recruitment and Astral-Microtubule Nucleation. Curr Biol. , (2008).
- Januschke, J., Llamazares, S., Reina, J., Gonzalez, C. Drosophila neuroblasts retain the daughter centrosome. Nat Commun. 2, 243(2011).
- Cheng, J., et al. Centrosome misorientation reduces stem cell division during ageing. Nature. 456, 599-604 (2008).
- Zamore, P. D., Ma, S. Isolation of Drosophila melanogaster testes. J. Vis. Exp. , e2641(2011).
- Fuller, M. T. The Development of Drosophila melanogaster. Bate, M., Martinez-Arias, A. , Cold Spring Harbor Laboratory Press. 71-174 (1993).
- Cenci, G., Bonaccorsi, S., Pisano, C., Verni, F., Gatti, M. Chromatin and microtubule organization during premeiotic, meiotic and early postmeiotic stages of Drosophila melanogaster spermatogenesis. J Cell Sci. . 107 (Pt. 12), 3521-3534 (1994).
- White-Cooper, H., Schafer, M. A., Alphey, L. S., Fuller, M. T. Transcriptional and post-transcriptional control mechanisms coordinate the onset of spermatid differentiation with meiosis I in Drosophila. Development. 125, 125-134 (1998).
- Yamashita, Y. M., Mahowald, A. P., Perlin, J. R., Fuller, M. T. Asymmetric inheritance of mother versus daughter centrosome in stem cell division. Science. 315, 518-521 (2007).
- Tates, A. D. Cytodifferentiation during Spermatogenesis in Drosophila melanogaster: An Electron Microscope Study. , Rijksuniversiteit de Leiden. Leiden, Netherlands. (1971).
- Baker, J. D., Adhikarakunnathu, S., Kernan, M. J. Mechanosensory-defective, male-sterile unc mutants identify a novel basal body protein required for ciliogenesis in Drosophila. Development. 131, 3411-3422 (2004).
- Avidor-Reiss, T., Gopalakrishnan, J., Blachon, S., Polyanovsky, A. The Centrosome: Cell and Molecular Mechanisms of Functions and Dysfunctions in Disease. Schatten, H. , Humana Press. (2012).
- Gopalakrishnan, J., et al. Self-assembling SAS-6 multimer is a core centriole building block. J Biol Chem. 285, 8759-8770 (2010).
- Hassell, J., Hand, A. R. Tissue fixation with diimidoesters as an alternative to aldehydes. I. Comparison of cross-linking and ultrastructure obtained with dimethylsuberimidate and glutaraldehyde. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 22, 223-229 (1974).
- Pisano, C., Bonaccorsi, S., Gatti, M. The kl-3 loop of the Y chromosome of Drosophila melanogaster binds a tektin-like protein. Genetics. 133, 569-579 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены