Method Article
Investigações Multiescala de Processamento Cortical Integrando Politrodos Laminares e Optogenética com Microeletrocorticografia em Roedores
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos dois protocolos para registro de microeletrocorticografia de alta densidade (μEcoG) em ratos e camundongos, incluindo métodos cirúrgicos, de implantação e de registro. As gravações de μECoG são realizadas em combinação com a gravação de politrodo laminar no córtex auditivo de ratos ou com a manipulação optogenética da atividade neural no córtex somatossensorial de camundongos.
Resumo
A eletrocorticografia (ECoG) é uma ponte metodológica entre a neurociência básica e a compreensão da função cerebral humana na saúde e na doença. O ECoG registra sinais neurofisiológicos diretamente da superfície cortical com resolução temporal de milissegundos e resolução espacial colunar em grandes regiões de tecido cortical simultaneamente, tornando-o posicionado de forma única para estudar cálculos corticais locais e distribuídos. Aqui, descrevemos o projeto de dispositivos micro-ECoG (μECoG) personalizados e de alta densidade e seu uso em dois procedimentos. Essas grades têm 128 eletrodos de baixa impedância com espaçamento de 200 μm fabricados em um substrato de polímero transparente com perfurações entre os eletrodos; esses recursos permitem a gravação simultânea de μECoG com gravações de politrodo laminar e manipulações optogenéticas. Primeiro, apresentamos um protocolo para registro epidural combinado de μECoG sobre o córtex somatossensorial do bigode de camundongos com manipulação optogenética de tipos específicos de células corticais geneticamente definidas. Isso permite a dissecação causal das contribuições distintas de diferentes populações neuronais para o processamento sensorial, ao mesmo tempo em que monitora suas assinaturas específicas em sinais μECoG. Em segundo lugar, apresentamos um protocolo para experimentos agudos para registrar a atividade neural do córtex auditivo de ratos usando grades μECoG e politrodos laminares. Isso permite o mapeamento topográfico detalhado das respostas neurais evocadas sensorialmente na superfície cortical simultaneamente com registros de várias unidades neurais distribuídas pela profundidade cortical. Esses protocolos permitem experimentos que caracterizam a atividade cortical distribuída e podem contribuir para a compreensão e eventuais intervenções para diversos distúrbios neurológicos.
Introdução
As funções cerebrais subjacentes à sensação, cognição e ação são organizadas e distribuídas em vastas escalas espaciais e temporais, variando desde os picos de neurônios individuais até os campos elétricos gerados por populações de neurônios em uma coluna cortical e a organização topográfica de colunas em áreas cerebrais (por exemplo, somatotopia no córtex somatossensorial, tonotopia no córtex auditivo primário). Compreender a função cerebral requer a detecção de sinais elétricos nessas escalas espaciais1. A neurociência atualmente tem muitos métodos amplamente utilizados para monitorar a atividade do cérebro. Eletrofisiologicamente, os politrodos laminares (como os Neuropixels) permitem o monitoramento de um número modesto (~ 300) de neurônios individuais, normalmente dentro de um punhado de colunas distantes, com alta resolução temporal (≥1 kHz). A imagem de Ca2+ permite o monitoramento de um número modesto a grande de neurônios individuais identificados genética e anatomicamente dentro de ~ 1-2 mm de extensão espacial em uma resolução temporal mais baixa (~ 10 Hz)2. A fMRI permite monitorar o estado metabólico de um grande número de neurônios (~ 1 M neurônios em um volume de 36 mm3 ) em todo o cérebro com resolução temporal muito baixa (~ 0,2 Hz). O EEG/MEG permite o monitoramento da atividade elétrica de toda a superfície cortical/cérebro em resolução temporal modesta (<100 Hz) e resolução espacial muito baixa (centímetros)3. Embora cada uma dessas metodologias tenha fornecido insights fundamentais e sinérgicos sobre a função cerebral, os métodos que permitem a detecção direta de sinais eletrofisiológicos em alta resolução temporal a partir de locais anatômicos precisos em amplas regiões espaciais do córtex são incipientes. A necessidade de ampla cobertura espacial é enfatizada pelo fato de que, no cérebro, a função neuronal muda muito mais drasticamente na superfície em comparação com a profundidade4.
A eletrocorticografia (ECoG) é um método no qual grades de eletrodos de baixa impedância são implantadas na superfície do cérebro e permitem o registro ou estimulação do córtex 1,5. O ECoG é normalmente implantado em ambientes neurocirúrgicos humanos como parte da investigação clínica para o tratamento da epilepsia farmacologicamente intratável. No entanto, também fornece informações únicas sobre o processamento cortical distribuído em humanos, como fala e mapeamento topográfico sensorial 6,7. Essas capacidades motivaram seu uso em modelos animais, incluindo macacos, ratos e camundongos 5,8,9,10,11. Em roedores, foi recentemente demonstrado que o micro-ECoG (μECoG) permite o monitoramento elétrico direto de alta resolução temporal (~ 100 Hz) de populações neuronais com resolução espacial colunar (~ 200 μm) e ampla cobertura espacial (muitos milímetros). O μECoG permite que os pesquisadores investiguem a dinâmica neural distribuída associada ao processamento sensorial complexo, funções cognitivas e comportamentos motores em modelos animais12,13. Avanços recentes integraram μECoG com optogenética e registros de politrodos laminares14 , 15 , 16 , 17 , 18 , 19 , 20 , permitindo investigações multiescala de redes corticais e preenchendo a lacuna entre a atividade neuronal em microescala e a dinâmica cortical em macroescala21 , 22. Criticamente, como o sinal μECoG é muito semelhante em modelos animais humanos e não humanos, o uso de μECoG torna a tradução de resultados e descobertas de modelos animais para humanos muito mais direta23. Como tal, as abordagens integrativas são cruciais para o avanço de nossa compreensão dos circuitos neurais e são promissoras para o desenvolvimento de novas intervenções terapêuticas para distúrbios neurológicos 5,24,25.
Consequentemente, há uma necessidade emergente de protocolos que integrem matrizes μECoG de alta densidade com registros laminares e ferramentas optogenéticas para permitir investigações abrangentes em várias escalas do processamento cortical 8,26. Para resolver essa lacuna, desenvolvemos dispositivos μECoG personalizados com 128 eletrodos de baixa impedância com diâmetro de eletrodo de 40 μm e espaçamento entre eletrodos de 20 μm em um substrato de polímero flexível e transparente (parileno-C e poliimida) com perfurações entre eletrodos, permitindo gravações simultâneas de μECoG e politrodo laminar com manipulações optogenéticas13,22. Os principais aspectos deste protocolo experimental incluem: (i) resolução espacial colunar e cobertura em larga escala da atividade cortical por meio de matrizes μECoG de alta densidade; (ii) a capacidade de registrar a partir de várias camadas corticais usando politrodos laminares inseridos através da grade μECoG; e (iii) a incorporação de técnicas optogenéticas para ativar ou inibir seletivamente populações neuronais específicas, permitindo assim a dissecção causal de circuitos neurais 27,28,29. A configuração de alta densidade permite registros de alta resolução espacial, fornecendo efetivamente uma "visão colunar" da atividade cortical, pois estudos anteriores mostraram que os sinais μECoG podem resolver a atividade em uma escala espacial comparável ao diâmetro da coluna cortical do roedor (~ 20 μm) 11 . Essa metodologia integrada permite o monitoramento e a manipulação simultâneos em várias escalas da atividade neural, potencialmente permitindo experimentos causais para determinar as fontes neuronais de sinais μECoG, bem como o processamento cortical distribuído. Para atingir esses objetivos, este manuscrito fornece protocolos detalhados para o uso de matrizes μECoG de alta densidade em duas combinações.
Primeiro, descrevemos μECoG combinado com a manipulação de células piramidais da camada 5 (L5) no córtex somatossensorial primário de camundongos (S1). No camundongo, a matriz μECoG é colocada por via peridural (devido à intratabilidade cirúrgica da durotomia em camundongos). Uma fibra óptica é posicionada sobre a grade ou combinada com uma lente para focalizar a luz optogenética sobre uma pequena área-alvo da superfície cortical. A estratégia optogenética é descrita aqui para a inibição dos neurônios excitatórios da camada 5, mas pode ser prontamente adaptada a qualquer população de neurônios fornecida com a linha de camundongo correspondente, específica da população e que expressa Cre. Em segundo lugar, descrevemos o uso combinado de μECoG com politrodos laminares de silício para registrar simultaneamente potenciais elétricos de superfície cortical (CSEPs) e atividade de pico de unidade única de vários neurônios através das camadas corticais do córtex auditivo de ratos (A1). A matriz possui perfurações entre os eletrodos, permitindo a inserção de politrodos laminares multicanais através da grade para registrar a atividade neuronal em diferentes camadas corticais. Durante o procedimento de craniotomia, a matriz μECoG é colocada subduralmente sobre o córtex auditivo e o politrodo laminar é inserido através das perfurações. Os sinais neurais do μECoG e da sonda laminar são gravados simultaneamente, amostrados a 6 kHz e 24 kHz, respectivamente, usando um sistema amplificador conectado opticamente a um processador de sinal digital.
Protocolo
Ambos os protocolos seguem as mesmas etapas principais (anestesia, fixação, craniotomia, registro de μECoG), mas têm diferenças notáveis. Na descrição a seguir, as etapas compartilhadas são mescladas, enquanto as especificidades de cada protocolo são anotadas. Essas etapas abaixo correspondem ao registro μECoG com optogenética (Mouse) ou registro μECoG com uma sonda laminar (Rat). Todos os procedimentos aqui descritos foram conduzidos em conformidade com as autoridades éticas ou legais locais (IACUC ou Comitês de Ética). Os medicamentos utilizados podem variar de acordo com o protocolo ético aprovado.
1. Preparação e protocolo para procedimentos em camundongos e ratos
- Diferenças notáveis entre protocolos de camundongos e ratos
- Configurações para cirurgia versus registros eletrofisiológicos
- Para um rato, use a mesma configuração durante a cirurgia e os registros eletrofisiológicos.
- Para um camundongo, execute a cirurgia na primeira configuração e os registros eletrofisiológicos na segunda configuração.
- Fixação da cabeça
- Para um rato, use o mesmo grampo de focinho para cirurgia e registro eletrofisiológico.
- Para um camundongo, use uma pinça de focinho para cirurgia e uma barra de cabeça de metal externa na configuração de eletrofisiologia para permitir a fixação sob anestesia leve com isoflurano. Implante a barra de cabeça com cimento dentário no crânio.
- Configuração de gravação: Use eletrônica de aquisição distinta, software de gravação e software de estimulação sensorial para as duas espécies.
- Para o protocolo do mouse, utilize o sistema SpikeGadgets (https://spikegadgets.com) e o software Trodes de código aberto (https://spikegadgets.com/trodes/) para aquisição de dados.
- Para o protocolo de ratos, utilize o software de gravação Synapse - Neurophysiology Suite (https://www.tdt.com/component/synapse-software/) para aquisição de dados.
- Induza a anestesia por injeção (rato) ou inalação (camundongo).
- Local de gravação
- Realize gravações no córtex somatossensorial (S1) para um camundongo.
- Realizar gravações no córtex auditivo primário (A1) para um rato.
NOTA: Essa diferença na localização anatômica requer diferentes locais de craniotomia para cada espécie.
- Configurações para cirurgia versus registros eletrofisiológicos
- Preparando e testando a grade
- Mergulhe a grade (excluindo a placa de conectores) em um detergente enzimático diluído (50% de detergente, 50% de água destilada) por pelo menos 1 h.
- Transfira-o para um banho de água destilada pura e deixe-o secar ao ar em um local seguro e limpo.
- Execute eletrodeposição de preto de platina como parte da preparação inicial do dispositivo μECoG, não antes de cada sessão de gravação.
NOTA: Uma vez depositado, o revestimento Platinum Black forma uma camada estável que permanece eficaz para várias gravações, embora seu desempenho deva ser monitorado por meio de testes regulares de impedância. A eletrodeposição de preto de platina (faixa alvo de 10-20 kΩ a 1 kHz.) diminui a impedância do eletrodo e melhora a relação sinal-ruído em gravações neurais. - Para realizar a eletrodeposição, prepare uma solução de ácido cloroplatínico (normalmente ácido cloroplatínico a 1-3% [H2PtCl6]) contendo uma pequena quantidade de acetato de chumbo (cerca de 0,005%) como modificador de deposição. Conecte os eletrodos μECoG para servir como eletrodo de trabalho em uma célula eletroquímica de três eletrodos, com um contra-eletrodo de platina e um eletrodo de referência Ag/AgCl.
- Aplique uma densidade de corrente constante de aproximadamente -0,5--2 mA/cm² por 10-30 s enquanto monitora os valores de impedância.
- Teste e registre a impedância dos eletrodos da grade (por exemplo, com um Nano-Z).
- Verifique a grade sobre uma fonte de luz e prepare a grade para uso na gravação pós-cirurgia.
- Solda de cabo de referência
- Para um mouse, solde a extremidade de um fio de prata (10 mm de comprimento, 30 G) a um pino de ouro para conectar ao cabo de referência do sistema de gravação.
2. Cirurgia
- Preparação de materiais e acompanhamento geral (Cuidados e registro de animais)
- Preparação: Limpe e desinfete bem a área cirúrgica com um desinfetante apropriado. Certifique-se de que todos os instrumentos cirúrgicos estejam esterilizados, normalmente usando uma autoclave.
- Colocação de ferramentas cirúrgicas: Organize as ferramentas cirúrgicas na almofada cirúrgica estéril. Abasteça a área cirúrgica com aplicadores de ponta de algodão e triângulos cirúrgicos absorventes de algodão. Descarte qualquer resíduo de risco biológico em um saco de descarte dedicado.
- Regulação da temperatura: Ligue a almofada de aquecimento dentro do local de registro cirúrgico e eletrofisiológico. Controle a temperatura da almofada de aquecimento durante a cirurgia e gravação.
- Almofada cirúrgica: Coloque uma almofada cirúrgica ou cobertor azul sobre a cama de regulação de temperatura.
NOTA: Esta almofada deve apresentar um fundo branco de algodão macio, que deve estar voltado para cima. - Posicionamento do microscópio: Prepare o microscópio e o iluminador conectado (por exemplo, anel de LED) em um lado da área cirúrgica. Verifique se está funcionando corretamente.
- Broca cirúrgica: Prepare a broca cirúrgica para o procedimento de craniotomia.
- Suprimento de oxigênio: Defina a taxa de fluxo do tanque de oxigênio para 1.0 L/min (Rato) ou 0.5 L/min (Mouse) e coloque a máscara de oxigênio perto da almofada de regulação. O animal precisará de oxigênio contínuo após a anestesia.
- Reposição de fluidos: Durante toda a cirurgia, reponha qualquer perda de líquidos visando uma reposição de pelo menos 1,5% do peso corporal do animal (Camundongo) ou 1 mL por h (Rato). Prepare soluções isotônicas de acordo.
- Animal: Traga o animal do biotério para a sala de cirurgia de acordo com os procedimentos aprovados. Use camundongos com idade entre 8 e 16 semanas, machos ou fêmeas, de origem C57Bl6; da mesma forma, use ratos com 7 semanas de idade, machos, da linhagem Sprague Dawley.
- Preparo de medicamentos: Pese o animal usando uma balança com precisão de 0,1 g. Prepare as quantidades adequadas de medicamentos para a cirurgia, usando soluções pré-diluídas, se necessário.
- Indução anestésica
- Indução anestésica para um camundongo
- Coloque o animal na câmara de indução de isoflurano (3-5% de isoflurano em 0,5 L/min O2).
- Uma vez confirmada a anestesia profunda (ausência de reflexo na pinça da cauda/dedo do pé), coloque o animal na almofada de aquecimento da cirurgia e fixe-o na cabeça.
- Injetar medicamentos subcutâneos para analgesia geral: Meloxicam: 5 mg/kg e Buprenorfina: 0,1 mg/kg.
- Fixe o mouse seguindo as etapas 2.2.1.5-2.2.1.6.
- Coloque o focinho na máscara de anestesia e a cabeça frouxamente no suporte de cabeça. Para colocar o mouse na barra de mordida, primeiro certifique-se de que a língua esteja abaixo da haste e não entre a haste e o céu da boca. Use uma pinça para mover a língua, se necessário.
- Insira os incisivos do animal no orifício da haste da barra de mordida. Prenda a máscara de anestesia do camundongo (1,5-2% de isoflurano em 0,5 L/min O2) apertando suavemente o parafuso de fixação. A estabilização da cabeça durante a cirurgia é garantida exclusivamente pela barra de mordida.
- Proteja os olhos do animal com uma pomada ou lubrificante à base de petróleo para evitar o ressecamento durante a cirurgia.
- Mantenha a anestesia durante todo o procedimento com um fluxo contínuo de isoflurano através da máscara.
- Indução anestésica para um rato
- Use isoflurano inicialmente para sedar o animal para facilitar a injeção de anestesia de indução.
- Administre os medicamentos para anestesia e analgesia:
Meloxicam: Dosagem de 5 mg/kg, concentração de 10 mg/mL, 0,4 mL/kg
Cetamina: Dosagem de 90 mg/kg, concentração de 100 mg/mL, 0,9 mL/kg
Xilazina: Dosagem de 10 mg/kg, concentração de 100 mg/mL, 0,1 mL/kg - Permita que o animal atinja a anestesia profunda em 15-30 min, dependendo do peso e da idade.
- Monitoramento anestésico
- Monitore continuamente os sinais vitais do animal (frequência respiratória) durante todo o procedimento. Verifique a frequência respiratória como um sinal particularmente útil de mudanças precoces no estado anestésico e ajuste o nível anestésico se a frequência respiratória mudar.
- O reflexo de retirada da pata é um sinal crítico do estado anestésico. Teste esse reflexo periodicamente, pois sua ausência total garante níveis suficientes de anestesia para a cirurgia.
- Indução anestésica para um camundongo
- Fixação da cabeça e monitoramento dos sinais vitais
- Monitoramento de sinais vitais de animais
- Verifique e registre os sinais vitais do animal em uma folha experimental. Se os reflexos do animal (por exemplo, retirada da pata) não estiverem totalmente extintos, administre meia dose adicional de cetamina suplementar (Rato) ou aumente a concentração de isoflurano em incrementos de 0,5% (Camundongo).
- Fixação da cabeça para um rato
- Assim que o rato estiver totalmente anestesiado (sem reflexos de pata ou cauda), insira os incisivos do animal no orifício da haste do suporte de cabeça.
- Insira cuidadosamente as pontas dos braços de montagem na crista do nariz para fixar a cabeça durante a cirurgia, garantindo que ela não entre em contato com os olhos.
- Ajuste o ângulo dos braços até que o céu da boca do animal esteja firmemente pressionado contra a haste. Certifique-se de que o crânio permaneça imóvel sob pressão.
- Prenda os dois braços do suporte apertando os parafusos com uma chave sextavada.
- Configuração de oxigênio para um rato
- Prenda o tubo de plástico do tanque de oxigênio sobre o focinho e o nariz do animal, prendendo-o com fita cirúrgica. Evite vincos na tubulação que possam obstruir o fluxo de ar. Defina o tanque de oxigênio para uma vazão de 1 L/min.
NOTA: Os sinais vitais dos animais, incluindo frequência cardíaca e respiratória, devem ser verificados em intervalos de 15 a 30 minutos durante todo o procedimento.
- Prenda o tubo de plástico do tanque de oxigênio sobre o focinho e o nariz do animal, prendendo-o com fita cirúrgica. Evite vincos na tubulação que possam obstruir o fluxo de ar. Defina o tanque de oxigênio para uma vazão de 1 L/min.
- Monitoramento de sinais vitais de animais
- Incisão no couro cabeludo
- Barbear e preparação
- Depile a área da parte superior do focinho até a parte de trás da cabeça, estendendo-se de um olho ao outro e ao redor das orelhas. Remova a maior parte do pelo com uma tesoura ou um aparador elétrico e aplique o creme depilatório.
- Desinfecção
- Desinfete a área usando um cotonete embebido em Betadine e depois enxágue com um cotonete embebido em etanol 70%. Repita esse processo três vezes e termine com uma aplicação final de Betadine para garantir que a área seja estéril.
- Injeção de anestésico local
- Injete o anestésico local Lidocaína (1%, 0,1 mL para camundongo / 0,4 mL por kg para rato) por via subcutânea na linha média do couro cabeludo do animal. Massageie suavemente o couro cabeludo para espalhar a lidocaína e aguarde 5 minutos para permitir que o anestésico faça efeito.
- Incisão
- Para um camundongo, levante um ponto na pele com uma pinça e ressece uma pequena seção de pele (aproximadamente 1 cm de diâmetro) usando uma tesoura cirúrgica.
- Para um rato, faça uma incisão precisa no lado anterior do couro cabeludo, logo acima do nariz, na linha média usando o bisturi. Puxe suavemente a pele para trás, criando uma incisão reta entre os olhos até a base do crânio. Levante cuidadosamente o couro cabeludo, corte o tecido conjuntivo e exponha totalmente o crânio.
- Exponha o local da craniotomia seguindo as etapas 2.4.4.4-2.4.4.5.
- Com um raspador, limpe o tecido conjuntivo e o periósteo na parte superior do crânio. Lave a solução salina e use aspiração ou esponja cirúrgica para limpar o local.
- Use clipes cirúrgicos nas margens da pele para facilitar a exposição clara da região do crânio onde a craniotomia será realizada.
- Barbear e preparação
- Craniotomia
- Procedimento geral de perfuração
- Defina a velocidade da broca cirúrgica para uma configuração baixa de 5000 rpm ou 7000 rpm para cirurgiões experientes. Faça toda a perfuração enquanto visualiza através do microscópio.
- Segure a broca paralela à superfície do crânio e descanse suavemente contra a superfície.
- Com uma leve pressão no pedal, comece a perfurar em um único local. Realize a perfuração em intervalos curtos (5-10 s) com verificações frequentes de alterações na cor do osso.
NOTA: O osso começará com um branco opaco e, à medida que o orifício se torna mais profundo, ele se torna mais translúcido, revelando uma tonalidade rosa. - Quando a perfuração chegar perto do cérebro, diminua a velocidade e procure sinais de umidade penetrando no buraco. Quando o furo estiver rosa escuro e tiver um leve brilho, pare de perfurar. Usando uma agulha curta de 30 G, perfure suavemente a camada restante de osso. O líquido claro deve sair do novo orifício.
- Procedimento de perfuração para um mouse
- Para colocar um eletrodo de referência para registros fisiológicos, faça um orifício na parte frontal do hemisfério ipsilateral à área registrada.
- Defina o contorno da craniotomia perfurando uma trincheira rasa em seu perímetro. No eixo médio-lateral, comece pela crista óssea lateral como referência e trace uma janela de 4 mm.
- No eixo ântero-posterior, perfure uma janela de 3 mm começando ~ 1 mm antes da crista óssea posterior. O tamanho final da craniotomia aberta é de aproximadamente uma janela de 4 x 3 mm.
- Procedimento de perfuração para um rato
- Faça dois furos: um no quadrante posterior esquerdo e outro no quadrante anterior direito.
- Injete o músculo masseter com uma segunda dose de lidocaína (0,4 mL / kg a 10 mg / mL) e distribua uniformemente onde o corte será feito.
- Ressecção apenas o conjunto mínimo de músculos necessários para expor a área da craniotomia.
- Usando uma lâmina de bisturi # 10 nova, crie um corte transversal dorsal-ventral no feixe de músculos acima da mandíbula do animal (lado direito). Segure a borda posterior do corte com uma pinça e descasque o crânio enquanto corta ao longo da crista óssea da maçã do rosto. Desta forma, o músculo pode ser destacado do osso com sangramento mínimo.
- Ressecção o músculo anterior de maneira semelhante até que uma linha de fissura no crânio seja revelada. Esta linha será o limite anterior da janela de craniotomia.
- Limpe o músculo ao redor da crista posterior com o bisturi e a pinça, usando uma fonte de luz forte para evitar cortes em regiões altamente vascularizadas.
- Lixe a crista posterior usando a broca até que ela não seja mais elevada acima da superfície do crânio.
NOTA: Esta etapa é essencial para definir a grade μECoG para fazer contato direto com a superfície cortical. - Perfure a borda dorsal da janela logo acima da crista onde o músculo ressecado foi fixado. Coloque a borda posterior anterior à crista posterior perfurada. Coloque a borda anterior posterior à linha da fissura que se estende para baixo perto da órbita ocular.
NOTA: Ao limpar o músculo anterior, deve-se tomar cuidado para evitar o olho.
- Procedimento geral de perfuração
- Perfuração de janela de craniotomia
- Perfurando a janela de craniotomia (dicas)
- Ao perfurar, certifique-se de que a broca seja mantida paralela à superfície do crânio. Aplique o mínimo de força possível, usando a broca como um pincel, permitindo que a broca faça um leve contato com o crânio enquanto usa movimentos curtos e repetitivos ao longo da linha de craniotomia pretendida.
NOTA: Em ratos, a borda posterior da janela tem o osso mais grosso. Se perfurar muito para trás, o osso pode exibir uma qualidade escamosa e "crocante" que complica a medição do progresso da perfuração. Se colocada incorretamente, essa área óssea pode revelar uma coloração vermelha com veias que dá uma falsa impressão de proximidade com o cérebro. - Perfure cada lado da janela de craniotomia até que o osso pareça rosa pálido com uma fina fissura branca ou rachadura ao longo de seu comprimento. Aplique uma leve pressão; O osso deve produzir uma "oscilação" distinta quando totalmente perfurado. Se a rachadura parecer desarticulada, continue perfurando levemente até obter uma linha contínua.
- Ao perfurar, certifique-se de que a broca seja mantida paralela à superfície do crânio. Aplique o mínimo de força possível, usando a broca como um pincel, permitindo que a broca faça um leve contato com o crânio enquanto usa movimentos curtos e repetitivos ao longo da linha de craniotomia pretendida.
- Removendo o crânio afinado dentro da janela de craniotomia
- Quando o crânio estiver afinado o suficiente para que uma pressão extremamente leve faça com que toda a janela se mexa visivelmente, remova o crânio afinado.
- Lave o local da craniotomia com uma gota de solução salina e aguarde pelo menos 1 min. Isso enfraquece o osso afinado e ajuda o osso a se desprender da dura-máter. Escorra o excesso de solução salina com um triângulo de algodão absorvente ou aspire.
- Levante cuidadosamente o crânio afinado usando uma pinça, evitando danos ao tecido subjacente.
- Use uma esponja hemostática para manter o cérebro úmido.
- Segure firmemente a janela nos lados dorsal e ventral com uma pinça dentada e puxe diretamente para longe do crânio. Se houver alguma dificuldade em puxar a janela para fora do local, pare e retome a perfuração leve até que o osso esteja suficientemente enfraquecido.
- Para gravações μECoG de camundongo, deixe a dura-máter intacta.
- Perfurando a janela de craniotomia (dicas)
- Implante de cimento e cabeceiro para um camundongo
- Insira e prenda o fio de referência.
- Insira a extremidade do fio de prata ~ 1 mm no orifício da rebarba, o suficiente para entrar em contato com a superfície do cérebro, mas não para causar sangramento.
- Aplique o cimento dentário no lugar enquanto aplica a primeira camada.
- Preparação de cimento dentário
- Use um prato de mistura de cerâmica resfriado para preparar a mistura de cimento dental. Este cimento engrossa rapidamente e requer a preparação regular de uma nova mistura. Limpe o prato antes de preparar uma nova mistura.
NOTA: O cimento nunca deve estar em contato direto com o cérebro.
- Use um prato de mistura de cerâmica resfriado para preparar a mistura de cimento dental. Este cimento engrossa rapidamente e requer a preparação regular de uma nova mistura. Limpe o prato antes de preparar uma nova mistura.
- Aplicação da primeira camada
- Aplique a primeira camada de cimento ao redor da craniotomia e em todo o crânio usando microaplicadores. Essa camada atua como isolamento elétrico entre o crânio e a barra de metal.
- Cerque completamente a craniotomia com cimento, incluindo cobertura lateral, para fornecer proteção adequada para a craniotomia aberta e a grade μECoG.
- Posicionando a barra de cabeça de metal
- Fixe a seção grande da barra de cabeça ao seu suporte sem apertá-la totalmente.
- Posicione a barra de cabeça conforme desejado, colocando a seção fina ao longo da linha média do crânio em contato com a superfície de cimento.
- Fixação do implante
- Cubra a barra de cabeça com cimento dental e conecte-a à superfície de cimento.
- Removendo o suporte
- Aguarde alguns minutos para que o cimento dental se fortaleça.
- Quando a barra de cabeça estiver totalmente presa, remova-a removendo primeiro o parafuso do suporte. Em seguida, retraia o suporte para trás, garantindo que nenhuma força seja aplicada à barra de cabeça.
- Insira e prenda o fio de referência.
- Durotomia para cirurgia de ratos
NOTA: Esta é uma etapa cirúrgica desafiadora.- Levantando a dura-máter
- Usando uma pinça nº 5, mantida o mais paralela possível à superfície do cérebro, levante uma pequena porção da dura-máter para longe do cérebro.
- Use uma agulha nova de 30 G (o mais curta possível) para rasgar cuidadosamente a dura-máter levantada.
NOTA: A dura-máter é uma camada fina e transparente de tecido que fica diretamente no topo do cérebro. É removido para registros de μECoG em ratos. É fundamental realizar a durotomia sem perturbar a vasculatura na superfície do cérebro. Os métodos recomendados para realizar a durotomia incluem o uso de uma pinça e uma agulha de seringa para perfurar a dura-máter antes de puxá-la para trás ou usar uma ferramenta duratome ancorada perto do crânio para retrair a dura-máter com cuidado.
- Ressecção da dura-máter
- Continue segurando a dura-máter com a pinça e levantando-a para longe do cérebro. Crie um rasgo diagonal com a agulha enquanto levanta.
- Use a pinça para descascar cuidadosamente a dura-máter em direção às laterais da janela da craniotomia, garantindo que a superfície do cérebro permaneça intacta.
- Levantando a dura-máter
- Transferindo o mouse para a configuração para registro eletrofisiológico
- Remova o animal da configuração da cirurgia levantando suavemente o focinho e os incisivos da barra incisiva e, em seguida, puxando o animal para trás. Injete clorprotixeno (1 mg / kg, intraperitoneal [IP]), um sedativo que permite que a anestesia contínua seja mantida usando uma concentração mais baixa de isoflurano.
- Coloque o mouse na configuração de gravação eletrofisiológica.
- Certifique-se de que a almofada de aquecimento esteja no lugar e funcionando corretamente.
- Cabeça fixe o animal usando a barra de cabeça no suporte na configuração eletrofisiológica.
- Aproxime a máscara de isoflurano para cobrir totalmente o focinho do animal.
- Ajuste da anestesia
- Reduza gradualmente os níveis de anestesia para 0,7-1% de isoflurano (em incrementos de 0,5% no máximo a cada 5 min).
- Monitore a frequência respiratória e os movimentos do animal.
NOTA: A frequência respiratória deve aumentar ligeiramente em relação ao estado cirúrgico, mas o animal não deve estar em movimento. - Se o animal estiver em movimento, aumente imediatamente a concentração de isoflurano para 2% antes de devolvê-la lentamente a um nível mais baixo em incrementos de 0,5%.
- Inserindo bigodes para estimulação sensorial
- Prenda as vibrissas do mouse ao dispositivo de estimulação do bigode. Neste protocolo, insira nove vibrissas em ponteiras curtas de pipeta de 10 μL, que são conectadas a atuadores piezoelétricos que fornecem deflexões rápidas das vibrissas.
3. Gravação
- Instalando a grade
- Passos preliminares
- Ligue o sistema de gravação e o amplificador.
- Verifique os sinais vitais do animal.
- Procedimento
- Para posicionar o animal e as ferramentas, siga os passos 3.1.2.2-3.1.2.4.
- Coloque o animal na configuração de gravação e certifique-se de que a craniotomia permaneça úmida aplicando regularmente uma solução salina.
- Para um rato, posicione o micromanipulador no corrimão da plataforma, localizado bem atrás do local da craniotomia, para evitar interferência.
- Para um camundongo, coloque o micromanipulador lateralmente ao local da craniotomia ao lado do animal.
- Para anexar e posicionar a grade em um mouse, siga as etapas 3.1.2.6-3.1.2.12.
- Conecte a grade μECoG ao headstage usando os conectores ZIF-clip (conector do headstage). Mantenha a placa eletrônica do headstage no lugar por meio de uma barra mecânica fixada a um micromanipulador.
- Abaixe a grade μECoG horizontalmente para alinhar plana sobre a craniotomia ao longo do eixo ântero-posterior.
NOTA: Ao longo do eixo lateral-medial, a borda da grade deve estar próxima à borda medial da craniotomia. - Uma vez que a grade esteja posicionada perto do cérebro, mas não em contato com ele, prenda o fio de referência da grade ao pino de ouro de fio prateado implantado. Se necessário, conecte o fio terra ao animal (por exemplo, a um músculo descoberto) para reduzir o ruído elétrico.
- Além disso, abaixe a grade para entrar em contato com o cérebro.
- Mova a grade lateralmente para "deslizar" sobre a superfície úmida da dura-máter. Continue ajustando até que a grade esteja centralizada ao longo do eixo mediolateral.
- Use aspiração ou uma esponja cirúrgica ao redor das bordas da craniotomia para remover qualquer excesso de solução salina.
- Quando a preparação estiver um pouco mais seca, certifique-se de que a grade adira mais firmemente à dura-máter e não deslize sobre sua superfície. Quando estiver mais seco, aplique um movimento lateral para medial à grade flexível, garantindo o contato com os eletrodos mais laterais. O cabo flexível da grade se dobrará naturalmente para combinar com o contorno do cérebro.
- Para posicionar a grelha num rato, siga os passos 3.1.2.14-3.1.2.18.
- Prenda a haste do garfo de retenção no micromanipulador, garantindo que a placa do conector da grade paire contra o lado posterior da janela de craniotomia quando abaixada.
- Ajuste a posição do micromanipulador no corrimão de modo que a grade fique aproximadamente acima do local da craniotomia. Abaixe a grade até que ela paire perto da superfície do cérebro. Umedeça a superfície do cérebro com uma pequena gota de solução salina.
- Execute estas etapas usando o microscópio. Usando os mostradores do micromanipulador, ajuste a posição da grade até que ela fique plana contra a superfície do cérebro no centro da craniotomia.
- Absorva a umidade com cuidado usando um triângulo de algodão absorvente sem tocar na própria grade. Certifique-se de que todas as linhas da grade estejam em contato com a superfície do cérebro.
NOTA: A remoção da umidade evita a propagação passiva do sinal elétrico através do fluido entre a superfície cortical e a grade, que difunde espacialmente o sinal detectado no eletrodo. - Usando a pinça número 2 ou número 5, insira o fio de aterramento da grade no mesmo orifício de rebarba ou insira o fio de referência em um orifício de rebarba e o fio terra no tecido muscular próximo.
NOTA: Os fios devem ser inseridos apenas ~ 1 mm, o suficiente para entrar em contato com o cérebro, mas não para causar sangramento ou trauma no cérebro.
- Passos preliminares
- Verificando o posicionamento da grade
- Monitoramento da atividade eletrofisiológica
- Observe a atividade eletrofisiológica usando o software de gravação. Sob anestesia leve, os sinais cerebrais são variáveis e podem exibir uma variedade de padrões.
- A conexão adequada dos fios de rede, referência e terra deve produzir uma alta relação sinal-ruído, com amplitudes de sinal na faixa de mV. Monitore o ruído na faixa de alta frequência usando filtragem passa-banda com Trodes (por exemplo, 100-6000 Hz) e certifique-se de que não exceda algumas dezenas de microvolts (μV).
- Avalie a capacidade de resposta sensorial usando ruído (por exemplo, bater palmas ou estalar os dedos) para induzir potenciais elétricos de superfície cortical (CSEPs) relacionados a eventos visíveis.
NOTA: A estimulação de um único bigode deve evocar um CSEP claro e nítido relacionado a eventos em apenas alguns canais (Mouse). - Verificação da posição da grade
- Para um rato, confirme se a grade está posicionada corretamente sobre o córtex auditivo. O primeiro bloco registrado normalmente deve ser um estímulo de ruído branco de 60 segundos definido para verificar se a grade registra uma resposta adequada do cérebro. Realize gravações de diagnóstico de ruído branco e tom com a grade somente antes de inserir o polytrode para ajudar a determinar se a grade foi colocada corretamente e se há uma resposta de sinal.
- Para um mouse, para verificar o posicionamento da grade, execute uma sessão de mapeamento rápido com 20 a 30 deflexões de bigode espaçadas por 350 ms. Registre a atividade na banda de potencial de campo local (LFP) usando Trodes e analise-a offline com um código MATLAB personalizado para visualizar a extensão espacial da atividade evocada por bigodes.
- Reposicionamento
- Se a grade precisar de ajuste, umedeça a superfície cortical com gotas de solução salina sobre a grade.
- Deixe a solução salina por 30 s a 1 min antes de tentar levantar a grade.
- Levante a grade com cuidado e lentamente.
- Reposicione-o usando as etapas descritas na etapa 3.1.
- Monitoramento da atividade eletrofisiológica
- Politrodos laminares para um rato
- Configuração de Polytrode
- Primeiro, conecte o adaptador do headstage na parte de trás do polytrode. Prenda o conector ao terceiro conjunto de canais na placa do adaptador. Certifique-se de que a marca preta no clipe esteja voltada para o lado direito da extremidade comercial do polytrodo.
- Inserção de Polytrode
- Insira o politrodo no cérebro até que os últimos eletrodos (superiores) sejam visíveis acima da superfície cortical. Uma descida lenta (até 1 μm/s) melhora a qualidade do sinal. Aguarde 15 minutos, permitindo que o cérebro se ajuste à presença do politrodo.
- Após 15 min, verifique se os últimos eletrodos entraram na superfície cortical. Caso contrário, abaixe o polytrode um pouco mais e espere mais 10 minutos antes de prosseguir.
- Configuração de Polytrode
- Posicionando a fonte de luz optogenética em um mouse
- Use um sistema de parafuso de ajuste fino em três dimensões, montado em um braço articulado, ou um micromanipulador para montar o suporte de fibra óptica.
- Para guiar a fonte de luz e ajudar no posicionamento da fibra, acenda a luz optogenética em baixa intensidade. Use o braço articulado para posicionar grosseiramente a luz optogenética em direção à área-alvo.
- Concentre e ajuste a posição da fibra usando um micromanipulador ou parafusos de ajuste fino.
- Gravando os sinais
- Preparação
- Desconecte todas as luzes, cabos de extensão e protetores contra surtos desnecessários no equipamento cirúrgico para reduzir a interferência elétrica. Desligue as luzes do teto do equipamento.
- Feche a porta do espaço de gravação isolado e a porta da sala de cirurgia antes de iniciar o experimento.
- Iniciando a aquisição
- Para um rato, inicie o Synapse na plataforma de gravação/computador e confirme se a aquisição está funcional visualizando e verificando os sinais. Provocar transientes de voltagem grandes e agudos no sinal μECoG, apresentando estímulos próximos ao animal, ou seja, palmas.
- Para um mouse, inicie a sessão de gravação no Trodes.
- Hidratação
- Injete no rato ou camundongo por via subcutânea com, respectivamente, 1 mL ou 0,1 mL de solução salina a cada 1-2 h durante a gravação para evitar a desidratação. Para um rato, espere de 5 a 10 minutos após a administração de solução salina antes de executar um novo bloco de gravação.
- Conjuntos de estímulos
- Para um rato, uma vez confirmado o local de gravação, prossiga com a gravação dos conjuntos de estímulos necessários. Um conjunto de exemplos pode incluir
Ruído Branco (60 s)
Diagnóstico de tom (5 min)
Tom Puro (23 min)
Ondulação Dinâmica em Movimento
Tom 150 (15 min)
TIMIT (38 min) - Para um rato, reapresente o ruído branco e o diagnóstico de tom sempre que a grade for reposicionada.
- Estímulos táteis para um camundongo: Forneça estímulos táteis em uma estrutura de teste, com cada teste contendo um trem de deflexões aleatórias de bigode a cada 350 ms. No exemplo fornecido, cada teste inclui 14 deflexões apresentadas em 4500 ms.
- Estímulos optogenéticos para um camundongo: Em alguns ensaios, aplique um pulso quadrado de luz optogenética durante toda a duração do ensaio (5 s). Determine o nível de luz necessário com base na opsina usada e na profundidade do tecido a ser alcançada usando estimativas de penetrância da luz (https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)
- Para um rato, uma vez confirmado o local de gravação, prossiga com a gravação dos conjuntos de estímulos necessários. Um conjunto de exemplos pode incluir
- Preparação
- Limpeza
- Levantando e limpando a grade
- Quando a gravação terminar, feche o software de gravação e reconecte as fontes de luz no equipamento.
- Se o cérebro estiver seco, aplique uma pequena gota de solução salina na superfície do cérebro usando uma seringa. Deixe a solução salina por 30 s a 1 min antes de tentar levantar a grade.
- Trabalhando sob o microscópio, levante suavemente a grade da superfície do cérebro usando micromanipuladores.
- Se for necessária força adicional ao levantar a grade, use uma pinça com ponta de carbono (fechada) para levantar suavemente a grade do cérebro. Certifique-se de que o movimento do micromanipulador seja ligeiramente anterior para retirar suavemente a grade da superfície do cérebro.
- Uma vez que a grade tenha sido totalmente removida, solte-a do garfo de aperto e limpe-a seguindo as etapas 3.6.1.6-3.6.1.7.
- Mergulhe a grade (excluindo a placa de conectores) em um detergente enzimático diluído (50% Enzol, 50% de água destilada) por pelo menos 1 h. Depois, transfira-o para um segundo banho de água destilada pura e deixe-o secar ao ar em um local seguro e limpo.
- Se as áreas da grade depositarem sangue ou tecido, use um triângulo de algodão embebido em solução enzimática para limpá-lo suavemente.
- Depois de seco, retorne a grade à sua caixa.
- Eutanásia do animal
- Para um camundongo, remova o animal da fixação da cabeça e coloque-o na câmara de eutanásia. Adicione uma gaze com 5 mL de isoflurano e aguarde 60 s após a cessação da respiração. Verifique a falta de reflexo de abstinência e decapite usando uma tesoura afiada.
- Para um rato, injete 0,2 mL de pentobarbital IP. Aguarde 60 s após a cessação da respiração, deite o animal de costas e use uma lâmina # 11 para realizar uma toracotomia dupla.
- Limpando o equipamento
- Leve todas as ferramentas cirúrgicas para a pia do laboratório e coloque-as em uma toalha cirúrgica. Pulverize as ferramentas com solução de alvejante a 10% e lave bem na pia. Para ferramentas mais sujas, deixe-as de molho em uma solução de alvejante antes de lavar.
- Como alternativa, use um detergente em pó (por exemplo, Contrex AP) com água esfregando os instrumentos com uma escova na pia.
- Depois que as ferramentas estiverem limpas e enxaguadas, limpe-as com lenços umedecidos com álcool e coloque-as de volta no espaço de armazenamento.
- Higienização do espaço de trabalho
- Descarte todas as agulhas e lâminas usadas no recipiente para objetos cortantes.
- Descarte cotonetes contaminados, triângulos e lenços umedecidos com álcool no saco de risco biológico.
- Limpe todas as superfícies de trabalho na sala de montagem com álcool e limpe todos os instrumentos antes de fechar o espaço de trabalho.
- Levantando e limpando a grade
Resultados
Descrevemos os protocolos de registro de sinais eletrocorticográficos combinados com métodos optogenéticos e registros laminares. Aqui, são apresentados sinais típicos obtidos do córtex somatossensorial do camundongo (Figura 1, Figura 2 e Figura 3) e dentro do córtex auditivo de ratos em resposta à estimulação sensorial (Figura 4, Figura 5 e Figura 6).

Figura 1: Gravação de sinais μECoG sobre o córtex somatossensorial do bigode do camundongo. (A) Componentes da configuração. Veja o texto. (B) Vista superior da configuração cirúrgica antes do registro de μECoG, mostrando a colocação do apoio de cabeça e do local da craniotomia. (C) Visão detalhada da grade μECoG e da fibra óptica posicionada no córtex exposto. (D) Superior: A fonte de luz está localizada fora da caixa de gravação. A luz de um LED de 473 nm é coletada na fibra óptica através de um tandem de lente. Abaixo: close-up da grade cortical sobre o córtex do camundongo em uma gravação de exemplo. (E) Traços μECoG representativos de todos os canais 16x8 mostrando respostas médias de teste à estimulação D2 do bigode. (F) Traço de tensão bruta do canal único indicado em (E) através de deflexões simples de vários bigodes. O canal exibiu a resposta mais forte durante a estimulação do bigode D2. (G) A resposta evocada média entre os ensaios no canal único (E, F), que exibiu uma deflexão acentuada da voltagem após a estimulação do bigode. Clique aqui para ver uma versão maior desta figura.
A Figura 1A-D fornece imagens de vários componentes do sistema usado para registro e manipulação optogenética no córtex S1 do camundongo. Os elementos rotulados incluem: 1- nove estimuladores de bigode independentes em uma matriz 3 x 3, 2- cone de nariz para anestesia com isoflurano, 3- suporte/contraparte do poste de cabeça, PCB de back-end de 4 μECoG, conectado ao PCB do headstage com um conector ZIF duplo; Grelha de eléctrodos de 5 μECoG na ponta de um cabo flexível de 8 mm; 6- fio de referência; 7- fio terra; 8- implante de cabeçote; 9- pino de ouro de referência (isolado do cabeceiro com cimento dentário); 10- craniotomia no hemisfério esquerdo, sobre o córtex do barril do bigode S1; 11- fibra optogenética de 1 mm de diâmetro (mantida por um micromanipulador, não mostrada); 12- um LED em forma de estrela acionado por um driver de LED (não mostrado); 13- Recolha de luz através de um conjunto de lentes asféricas. Ao estimular um único bigode, observa-se uma rápida deflexão do potencial de superfície em um pequeno número de eletrodos (Figura 1E). Esse conjunto de eletrodos representa o sinal local que atinge o pico na coluna cortical do bigode estimulado30. Olhando para um único eletrodo, observamos a resposta mais forte à estimulação de seu bigode preferido e a resposta mais fraca ou nenhuma resposta à estimulação de bigodes mais distantes (Figura 1F). Neste exemplo, o início da deflexão ocorre cerca de 10 ms após a vibração do bigode, com amplitude média de 1 mV (Figura 1G).
A Figura 2 apresenta exemplos de gravações durante a inibição optogenética. A luz pode atingir o tecido cortical através do substrato transparente da grade (Figura 2A). No entanto, ao usar uma fibra de grande diâmetro ou qualquer fonte de luz espacialmente ampla, os fótons também atingem os eletrodos, produzindo um artefato optoelétrico (Figura 2B). Neste protocolo de inibição, usamos um pulso quadrado de luz de 5 s de comprimento. Os artefatos optoelétricos resultantes estão presentes apenas no início e no deslocamento da luz. Em um animal sem opsina, a estimulação do bigode apresentada durante a luz acesa não evoca uma resposta diferente da estimulação do bigode apresentada em ensaios com a luz apagada (Figura 2C). Em contraste, a estimulação luminosa da opsina inibitória em uma subpopulação de neurônios excitatórios leva a uma diminuição na amplitude da resposta evocada sensorial (Figura 2D)
A Figura 2C,D apresenta exemplos de supressão optogenética no domínio da frequência de tempo. Para analisar os dados de μECoG, primeiro aplicamos uma referência de média comum (CAR) para remover sinais indiferenciados entre eletrodos (por exemplo, respiração) seguido por uma transformada wavelet Morse, que revela bandas de frequência ativas ao longo do tempo. A atividade neural no domínio da frequência normalmente exibe uma lei de potência aproximada de 1 / f 2,3. Para revelar o sinal evocado sensorial de maneira mais uniforme em todo o domínio da frequência, aplicamos a pontuação Z separadamente para cada banda de frequência. A pontuação Z é baseada nas estatísticas do sinal durante as épocas de linha de base. Aqui, usamos uma janela de tempo que precede o estímulo, -3000 ms a -1000 ms antes do início do teste. Esse processo produz o escore Z evocado por estímulo para cada banda de frequência (Figura 2C,D).
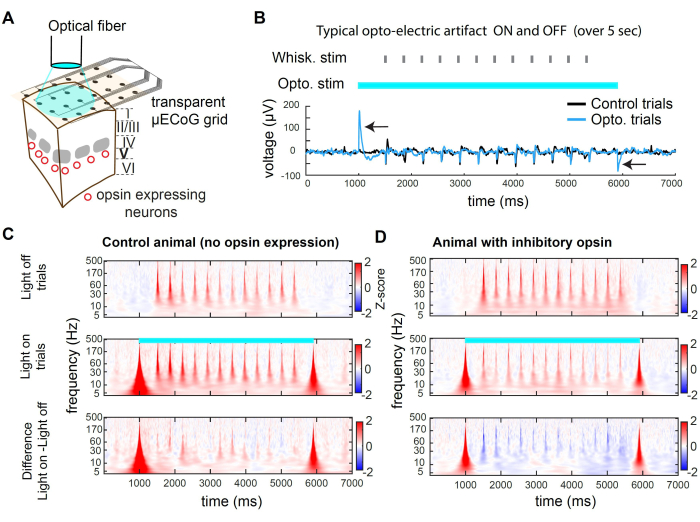
Figura 2: Supressão optogenética em wS1 durante o registro de μECoG em camundongos. (A) Esquema de um experimento optogenético representativo. Uma fibra óptica é apontada diretamente para o cérebro, permitindo a inibição transitória da população neuronal que expressa uma opsina inibitória. (B) Traço de tensão registrado no canal no centro da estimulação optogenética, calculada a média entre os ensaios. A seta preta indica artefatos optoelétricos no início e no deslocamento da luz de 473 nm. Observe a resposta à deflexão do bigode (identidade aleatória do bigode) no meio do teste. O artefato é transitório e não afeta o registro da atividade evocada sensorialmente após um atraso (aqui 500 ms). (C) Espectrograma médio de um canal de exemplo em ensaios de luz e testes de luz e a diferença entre os dois, em um animal onde nenhuma opsina foi expressa. Observe que o efeito optoelétrico induz um artefato transitório de banda larga, e a resposta evocada pelo bigode não é afetada pela luz. (D) Exemplo de espectrograma médio de teste em testes de luz desligada, testes de luz e a diferença entre os dois em um camundongo Rbp4-Cre32 no qual st-GtACR2.0 foi expresso em neurônios excitatórios da camada 5. Observe a supressão da resposta evocada pelo bigode no espectrograma. Clique aqui para ver uma versão maior desta figura.
A Figura 3 apresenta variações fáceis de implementar no sistema de entrega de luz. Usando uma fibra óptica menor, ou uma lente simples, é possível atingir uma área específica do córtex15. A luz que sai da fibra diverge rapidamente e atinge o tecido cortical além da área-alvo. Ao incorporar uma lente asférica (f = 16 mm) na saída de fibra óptica, é possível focar a luz em uma área de superfície menor ( Figura 3A, C ), até aproximadamente o diâmetro de uma única coluna cortical ( Figura 3C ). A luz também é menos divergente dentro do córtex. Idealmente, usando um laser ou uma fonte de luz poderosa com um conjunto de lentes em tandem, é possível atingir uma única coluna cortical com um feixe de luz colimado. No entanto, é importante considerar que a luz se espalhará dentro do tecido, o que pode iluminar parcialmente as colunas vizinhas. O artefato de luz medido nos dados μECoG revelará onde a luz foi entregue sobre a superfície cortical; veja a comparação da Figura 3B com a Figura 3D. O artefato de luz é medido como a potência de pico em uma faixa de alta frequência (65-500 Hz) 5 ms após o início da luz.

Figura 3: Entrega de luz aos pontos focais do córtex. (A) A luz da fibra óptica de 1 mm de diâmetro é focada na superfície do cérebro. Esse ajuste simples permite um direcionamento mais preciso da luz na superfície do cérebro e dentro do tecido. (B) A extensão espacial da luz fornecida ao cérebro é medida a partir do artefato optoelétrico. (C, D) A configuração é como nos painéis A,B com uma fibra óptica de 200 μm, o que permite atingir diretamente uma área de 250 μm de diâmetro, aproximadamente do tamanho de uma coluna cortical. Clique aqui para ver uma versão maior desta figura.
Gravações de μECoG e politrodo laminar de rato
A Figura 4A-D fornece imagens de vários componentes do sistema usado para gravações do córtex auditivo primário de ratos. Especificamente, os elementos rotulados incluem: (1) micromanipulador μECoG, (2) equipamento estereotáxico para roedores, (3) cabo μECoG com conectores de clipe ZIF, (4) micromanipulador de politrodo laminar, (5) cone de nariz de rato e aparelho de estabilização de cabeça, (6) alto-falante eletrostático para apresentação de estímulo, (7) cabo laminar de politrodo com adaptador de clipe ZIF, (8) clipe μECoGZIF preso por um garfo de duas pontas, (9) dispositivo de politrodo de 32 canais, (10) alto-falante eletrostático, (11) clipes jacaré para manter o local cirúrgico aberto, (12) fios de aterramento, um inserido no córtex através dos orifícios de rebarba no quadrante posterior esquerdo ou no quadrante anterior direito e outro é aterrado ao tecido, (13) visão aproximada da grade μECoG, (14) vista aproximada do politrodo inserido. A Figura 4E exibe o espectrograma neural médio derivado dos potenciais elétricos registrados de um único eletrodo μECoG em resposta a pips de tom de 50 ms da mesma frequência e atenuação (N = 20 tentativas). Em todas as frequências, a resposta evocada exibe um pico agudo entre 25 ms e 30 ms (indicado por linhas sólidas vermelhas) após o início do estímulo (linha pontilhada cinza esquerda). A resposta aparente que precede o início do estímulo (ostensivamente acausal) é devido à grande largura de banda em frequências mais baixas da transformada Q constante, que suaviza (acausal, mas sem deslocamento de fase) em vez de filtrar (causal, mas induz um deslocamento de fase) o sinal. Portanto, o tempo da resposta de pico permanece preciso. No momento do pico de resposta evocada, observamos que o potencial elétrico de superfície cortical (CSEP) com escore z era multimodal entre as frequências. Especificamente, exibiu três picos primários não harmônicos: o primeiro e maior na faixa de 40-180 Hz gama/alta gama (γ/Hγ), o segundo na faixa de 200-450 Hz ultra-alta gama (uHγ) e um pico final acima de 500 Hz associado à atividade de várias unidades (MUA) (Figura 4F)11. Essa estrutura multimodal evocada por estímulo é robusta em todos os eletrodos sintonizados. Aqui, focamos no Hγ devido à sua prevalência em registros de eletrocorticografia humana (ECoG)31. Na Figura 4G, exibimos uma matriz μECoG que foi colocada subduralmente ao lado de um politrodo laminar de silício para medir simultaneamente os potenciais elétricos da superfície cortical (CSEPs) e a atividade de pico nas lâminas corticais. A matriz μECoG fabricada sob medida consistia em 8×16 eletrodos com passo de 20 μm e diâmetro de contato de 4 μm, e utilizamos um politrodo laminar de 32 canais configurado como 2 × 16 canais com passo de 4 μm e diâmetro de contato de 1 μm. A matriz μECoG era suficientemente grande para cobrir todo o córtex auditivo primário de ratos (A1), e seus pequenos eletrodos de 4 μm de diâmetro permitiram a medição de CSEPs locais adequados para derivar a afinação auditiva. A resolução espacial do sinal μECoG high-gamma (Hγ) é de ~ 20 μm, comparável ao raio de uma coluna cortical de rato. Assim, μECoG fornece uma "visão colunar" da atividade cortical. Perfurações na grade μECoG permitiram que o politrodo laminar passasse entre os contatos da superfície, permitindo o registro direto da atividade neuronal através das lâminas corticais ( Figura 4H ). Exemplos de traços de tensão registrados de μECoG e eletrodos laminares de politrodo são mostrados na Figura 4I.
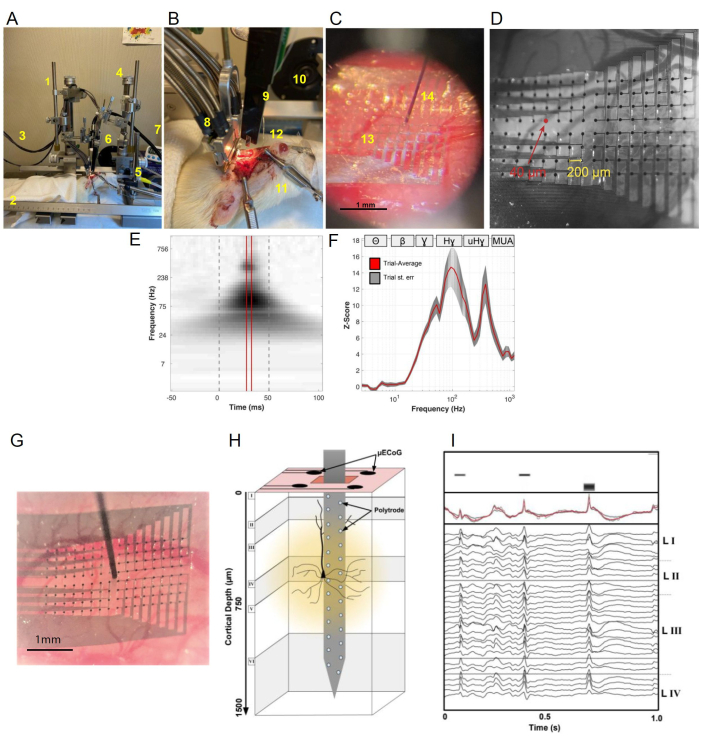
Figura 4: Registro de sinais μECoG e politrodo laminar sobre o córtex auditivo primário de ratos (A1). (A) Componentes da configuração de μECoG e politrodo laminar. Veja o texto. (B) Vista superior do arranjo cirúrgico antes do registro de μECoG e politrodo laminar, mostrando a colocação do encosto de cabeça e do local da craniotomia. (C) Visão detalhada da grade μECoG e do politrodo laminar no córtex auditivo exposto. (D) Uma visão aproximada da colocação da grade μECoG no córtex, incluindo o tamanho dos eletrodos individuais (40 μm) e entre os eletrodos (200 μm). (E) Decomposição média de wavelets com pontuação z de uma resposta de canal único a um único par de atenuação de frequência. As linhas vermelhas verticais indicam o período de resposta de frequência de pico mostrado em F.(F) Vermelho- Resposta de frequência de pico média em 20 apresentações de um único par de atenuação de frequência. Cinza- Erro padrão. O eixo de frequência está em uma escala logarítmica. As bandas de frequência neural canônicas são indicadas na parte superior. (G) Fotomicrografia de uma grade de 8 16 μECoG na superfície do córtex auditivo primário de ratos (A1). Um politrodo laminar de 32 canais foi inserido na janela μECoG central. (H) Esquema de gravação multiescala 3D da atividade cortical. (I) Topo: Espectrograma de 50 ms de pips de tom puro. Meio: Em vermelho, o potencial elétrico médio da superfície cortical de eletrodos de 4 μECoG (cinza). Inferior: os traços de tensão de politrodo laminar de 32 canais são organizados por profundidade cortical Clique aqui para ver uma versão maior desta figura.
A Figura 5 exibe a gravação de sinais μECoG simultaneamente com uma atividade de pico usando um politrodo de silício laminar (Camb64). O sinal μECoG, registrado a partir de um eletrodo de superfície, é mostrado como um traço de tensão bruta ( Figura 5A ) e sua transformada wavelet, destacando a decomposição de frequência ao longo do tempo ( Figura 5B ). A atividade de várias unidades foi registrada usando o polytrode, conforme ilustrado por um traço de tensão bruta representativo de um único canal (Figura 5C), onde potenciais de ação individuais (picos) foram detectados usando um método de limiar simples (tensão cruzando um limite de -120 μV). As formas de onda de pico extraídas deste canal são bem definidas para a maioria dos picos, embora possam se originar de várias fontes de neurônios (Figura 5D, inserção). Em vários canais na mesma penetração, as formas de onda médias de pico confirmam ainda mais a consistência de registros de atividade de pico bem definidos (Figura 5E). Assim, esses métodos de registro podem suportar o registro de unidade única com análise de classificação de pico e análise de métricas de qualidade, como o intervalo entre picos ou taxas de disparo (Figura 5F). Em resumo, a qualidade das gravações da sonda laminar é boa, com morfologia clara da forma de onda em canais únicos. Esses resultados ilustram que esse método permite a aquisição simultânea de μECoG e atividade de pico.
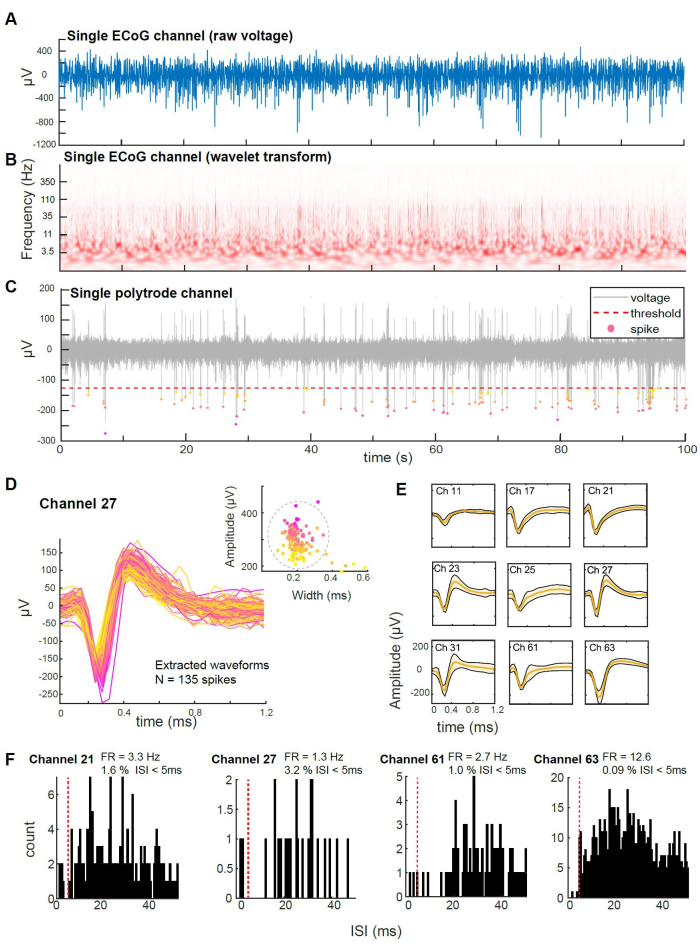
Figura 5: Gravações simultâneas de μECoG e atividade de pico colunar. (A) Exemplo de traço de tensão bruta de um único canal μECoG. (B) Transformada wavelet do mesmo canal μECoG, mostrando decomposição de frequência ao longo do tempo. (C) Exemplo de traço de tensão bruta de um único canal de politrodo (sonda de silício aguda de 64 canais camb64), mostrando potenciais de ação (picos) detectados usando um limite de tensão simples. (D) Formas de onda de pico extraídas do canal de politrodo em (C) alinhadas e codificadas por cores com base na distribuição da amplitude de tensão. 7 das 142 formas de onda de pico não são mostradas, pois foram consideradas discrepantes com base em sua distância do cluster principal em largura e amplitude de pico (ver inserção). (E) Formas de onda médias de pico de várias unidades extraídas de 9 canais na mesma penetração. (F) Histogramas de intervalo entre picos (ISI) para diferentes canais de politrodo (por exemplo, canais 21, 27, 63 e 61), com taxas de disparo correspondentes (FR) indicadas em Hz. As violações de ISI (< 5ms) representaram menos de 5% dos picos em todas as unidades. Clique aqui para ver uma versão maior desta figura.
Com a capacidade de realizar gravações simultâneas usando a matriz μECoG personalizada e o politrodo laminar, investigamos como os sinais μECoG se comparam às gravações de unidades neurais em profundidade cortical em termos de afinação auditiva. A Figura 6A apresenta gráficos de Amplitude de Resposta em Frequência (FRA), que descrevem a resposta gama alta (Hγ) em função da frequência e amplitude do estímulo auditivo. O painel superior mostra FRAs de um subconjunto de 2 × 16 de eletrodos μECoG posicionados no córtex auditivo, enquanto o painel inferior exibe FRAs de um subconjunto 1×16 de eletrodos laminares de politrodo inseridos através das perfurações da matriz μECoG (indicadas por setas cinza). Notavelmente, os FRAs obtidos dos eletrodos μECoG se assemelham muito aos dos registros laminares de politrodos, sugerindo que os sinais μECoG são sintonizados de forma semelhante à atividade da unidade neural nas camadas corticais.
Aproveitando a alta resolução espacial do array μECoG, geramos um mapa tonotópico de alta resolução de múltiplos campos corticais auditivos com base na atividade de Hγ11. Na Figura 6B, a melhor frequência de cada eletrodo é codificada por cores, revelando a organização tonotópica em toda a superfície cortical. A matriz de 8 × 16 μECoG cobriu vários campos corticais auditivos - incluindo o córtex auditivo primário (A1), o campo auditivo posterior (PAF) e o campo auditivo ventral (FAV) - com limites aproximados demarcados por linhas pretas. Este mapeamento detalhado ressalta a capacidade da matriz μECoG de fornecer uma "visão colunar" da atividade cortical, capturando a organização funcional com uma resolução espacial inferior a 20 μm, comparável às dimensões de uma coluna cortical de rato. Esses achados demonstram que os registros de μECoG não apenas refletem as propriedades de ajuste observadas nos registros de unidades neurais em toda a profundidade cortical, mas também permitem o mapeamento de alta resolução da organização cortical funcional.
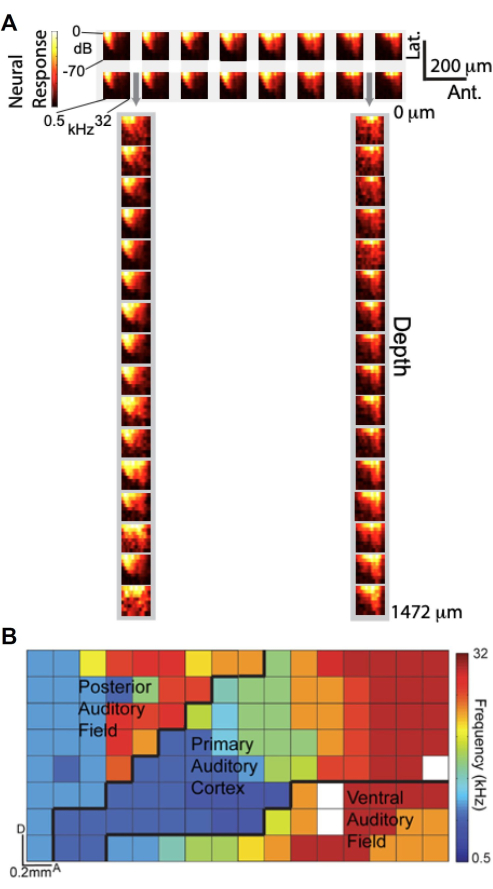
Figura 6. Os sinais μECoG são sintonizados de forma semelhante aos registros de pico da unidade neural em toda a profundidade e revelam a organização tonotópica do córtex auditivo. (A) Gráficos de amplitude de resposta em frequência (FRAs), que exibem a resposta gama alta (barra de cores) em função da frequência (eixo x) e amplitude (eixo y) do estímulo auditivo. (topo) FRAs de 2 16 subconjuntos de eletrodos μECoG no córtex auditivo; (parte inferior) FRAs de 1 16 subconjunto de eletrodos laminares de politrodo inseridos por meio de perfurações na matriz μECoG, indicadas por setas cinzas. (B) Organização tonotópica de alta resolução de múltiplos campos corticais auditivos derivados da atividade de alta gama. Cada pixel é codificado por cores de acordo com a melhor frequência desse eletrodo. A matriz de 8x16 μECoG exibida aqui cobre vários campos corticais auditivos (A1, PAF e VAF) e os limites aproximados são demarcados (linhas pretas). Clique aqui para ver uma versão maior desta figura.
Discussão
Os protocolos descritos aqui permitem a integração de matrizes de microeletrocorticografia de alta densidade (μECoG) com sondas laminares e técnicas optogenéticas. A facilidade de uso deste protocolo em modelos de roedores o torna uma ferramenta poderosa para a investigação da dinâmica cortical, e o número de indivíduos pode ser facilmente aumentado. A grade μECoG de alta densidade permite um mapeamento eficiente e espacialmente preciso da topografia cortical em várias áreas em camundongos e ratos, aproveitando o papel crítico das representações topográficas na organização do cérebro33. A adição de registro laminar permite o exame da dinâmica cortical em várias escalas espaciais e temporais. A inclusão da optogenética permite a manipulação causal para determinar as relações entre populações neurais específicas e suas contribuições para os potenciais evocados de superfície corticais (CSEPs) e processamento cortical34.
A optogenética permite a modulação seletiva de populações neuronais específicas, permitindo a investigação de seus papéis causais na geração de padrões de atividade cortical e participando de computação cujas assinaturas podem ser detectadas com μECoG. Por exemplo, nossos estudos demonstram que o direcionamento de um tipo específico de célula pode alterar os potenciais elétricos da superfície cortical (CSEPs). Essa abordagem pode ser usada para dissecar a base do tipo de célula neural dos sinais μECoG, permitindo-nos identificar quais tipos de células neuronais contribuem para atividades evocadas sensoriais características, como as observadas na banda gama alta. Outros fenômenos de grande escala, como ritmos corticais em diferentes bandas de frequência21 ou atividade espacialmente organizada, incluindo ondas viajantes35,36, poderiam ser investigados de forma semelhante. Além disso, uma variedade de linhagens de camundongos geneticamente modificados e opsinas estão prontamente disponíveis, oferecendo oportunidades para explorar mecanismos de circuito específicos. Técnicas optogenéticas podem ser empregadas para examinar os efeitos funcionais das conexões horizontais entre as colunas37, que desempenham um papel crucial em vários cálculos sensoriais, como supressão de surround38 ou ligação perceptiva39. Em resumo, a capacidade de manipular a atividade neuronal por meio da optogenética permite testar as ligações entre populações neuronais específicas e as propriedades dos CSEPs ou entre a população e cálculos corticais específicos mensuráveis com μECoG. Essa abordagem poderia dissecar efetivamente as relações entre as estruturas neurais locais e a atividade cortical global.
Os registros de politrodos laminares permitem a amostragem da atividade de um único neurônio de vários neurônios dentro de pequenos volumes corticais, ou seja, dentro de uma coluna cortical individual. Essas gravações são cruciais porque os neurônios individuais podem codificar informações distintas de forma independente, empregando codificação seletiva de estímulos - como os "neurônios de Jennifer Aniston" descritos por Quiroga et al.40 - ou fornecendo representações complementares em um espaço de dimensão superior, como visto na seletividade mista41. Tradicionalmente, os eletrofisiologistas estudavam a atividade neural no contexto de estímulos e comportamentos simples e parametricamente projetados (por exemplo, deflexão de bigode único ou tons puros, como implantado aqui). A representação de tais estímulos tende a ser bastante localizada espacialmente (por exemplo, colunas individuais). No entanto, muitos estímulos e comportamentos etologicamente relevantes são mais complexos e, como tal, os padrões típicos de atividade neural durante tais paradigmas freqüentemente se estendem além de colunas únicas - até mesmo em todo o cérebro42. Nesses casos, o μECoG oferece uma leitura abrangente que captura a atividade resolvida colunar de alta resolução temporal em várias colunas simultaneamente. Em resumo, o protocolo descrito aqui preenche efetivamente a lacuna entre o processamento local dentro de colunas corticais individuais e a dinâmica mais extensa que ocorre em várias colunas em uma área cortical inteira e em todas as áreas.
Como orientação geral e solução de problemas, propomos algumas recomendações. Os protocolos eletrofisiológicos agudos in vivo convencionais geralmente aconselham manter o cérebro úmido durante a exposição como um meio de prolongar a saúde do cérebro exposto. Embora isso seja provavelmente útil em algumas circunstâncias, nossa experiência sugere que o oposto é verdadeiro para gravações de μECoG em roedores. De fato, descobrimos que a qualidade de gravação foi qualitativamente melhor quando as matrizes μECoG foram colocadas em uma superfície cortical ligeiramente seca. Acreditamos que isso ocorra porque a solução salina, uma solução iônica altamente condutora posicionada entre a superfície cortical e os eletrodos de registro, homogeneíza os sinais elétricos gerados pelo cérebro. Efetivamente, a solução salina está 'curto-circuitando' os eletrodos juntos. Como as grades μECoG monitoram o campo elétrico contínuo gerado por populações de neurônios, é importante garantir que os sistemas eletrofisiológicos sejam bem montados e sem ruído. Durante as gravações, a conexão com o eletrodo de referência é crítica. Sem melhorias durante a gravação, o pré-processamento dos dados pode incorporar um filtro de entalhe a 50 Hz ou 60 Hz para remover o ruído da linha. No entanto, isso alterará drasticamente o sinal e, portanto, deve ser contabilizado na análise subsequente. Considerando a estimulação optogenética da luz, o artefato optoelétrico deve ser minimizado ou pelo menos contabilizado no projeto experimental (por exemplo, incluindo um atraso após o início ou deslocamento da luz). Idealmente, a luz é fornecida na área entre os eletrodos usando um pequeno diâmetro de fibra óptica ou focalizando ou colimondo a luz. Se esse artefato não puder ser completamente evitado (mas veja estudos que propõem diferentes designs de sonda 15,20,43 incluindo eletrodos transparentes), ele pode ser reduzido usando a menor quantidade de luz necessária. As opsinas de nova geração requerem menos luz para eficácia44,45. Sugerimos calibrar a potência da luz optogenética antes do experimento usando sondas laminares. A forma do artefato também pode ser modificada e reduzida evitando transições bruscas no estímulo luminoso (por exemplo, usando uma rampa de luz em vez de um pulso quadrado). Em qualquer caso, as condições de controle usando animais que não expressam opsinas são aconselháveis para diferenciar mudanças genuínas na atividade neural de sinais relacionados a artefatos. Finalmente, o processo de eletrodeposição cria um revestimento áspero e de alta área de superfície que aumenta a transferência de carga entre o eletrodo e o tecido, mantendo a estabilidade mecânica durante as gravações, reduzindo a impedância do eletrodo em 1-2 ordens de magnitude em comparação com a platina nua e permitindo uma melhor detecção de sinal neural46.
O μECoG agudo oferece flexibilidade e complexidade reduzida em configurações experimentais, permitindo o mapeamento detalhado da atividade neural ao longo de dezenas de minutos de gravações. Como um método de mesoescala, permite um rastreamento inter-area, mas não de todo o cérebro, da atividade cortical, embora as fontes exatas dos sinais permaneçam incertas 1,47. No futuro, estudos multimodais devem fornecer uma imagem melhor da origem do sinal. O μECoG agudo é limitado na captura da dinâmica neural de longo prazo e pode ser influenciado por fatores transitórios, como recuperação cirúrgica ou anestesia48,49. Em contraste, o μECoG crônico permite a observação prolongada da atividade neural, fornecendo informações sobre processos como aprendizado, plasticidade e progressão da doença10,13. O μECoG crônico também apresenta desafios como estabilidade do eletrodo, potencial degradação do sinal e riscos associados ao implante a longo prazo, incluindo cicatrizes ou infecções teciduais50,51. Esses desafios tendem a ser menos graves quando comparados aos eletrodos penetrantes e são supostamente reduzidos ainda mais com o implante peridural do μECoG em camundongos (ao custo de menor qualidade de sinal) 52 . É possível reutilizar a mesma grade μECoG em muitas sessões no mesmo animal ou em animais diferentes, removendo a grade no final de uma sessão e substituindo-a na próxima sessão. Nesta configuração subaguda, o cérebro deve ser mantido úmido o tempo todo e protegido com uma lamínula de vidro entre as sessões. Observamos que as grades μECoG são bastante duráveis; Uma grade individual pode ser reutilizada ~ 20 vezes com manuseio e limpeza adequados, tornando-os dispositivos de gravação econômicos. As grades podem ser projetadas com diversos números e geometrias de layouts de eletrodos. Os resultados aqui sugerem que a redução do passo do eletrodo para <200 μm resulta em melhorias insignificantes na resolução funcional devido à granularidade das representações neurais no córtex subjacente.
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo Lawrence Berkeley National Laboratory LDRD para o Laboratório de Sistemas Neurais e Aprendizado de Máquina (K.E.B.), NINDSR01 NS118648A (K.E.B.& D.E.F.) e NINDS R01 NS092367 (D.E.F.).
Materiais
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
Referências
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. Electric Fields of the Brain: The Neurophysics of EEG. , Oxford University Press, USA. (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Fabrication and testing of a large area, high density, parylene MEMS µECoG array. Ledochowitsch, P., et al. 2011 IEEE 24th International Conference on Micro Electro Mechanical Systems, Cancun, Mexico, , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003(2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007(2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- A transparent µECoG array for simultaneous recording and optogenetic stimulation. Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. 2011 Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Boston, MA, USA, , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612(2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814(2020).
- Buzsáki, G. Rhythms of the brain. , Oxford University Press, USA. (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893(2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125(2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , Cambridge University Press. (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005(2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados