Method Article
Medindo a estrutura, composição e mudança de ambientes subaquáticos com imagens de grande área
Neste Artigo
Resumo
Este protocolo abrange uma metodologia de pesquisa de imagem de grande área de quatro etapas usada para extrair métricas de complexidade estrutural, composição da comunidade e demografia da população para comunidades de recifes de coral. A qualidade das imagens coletadas e o acesso integrado às imagens de origem são priorizados em cada etapa do protocolo.
Resumo
A tecnologia de imagem e processamento digital evoluiu para facilitar a expansão de levantamentos de imagens de grande área, que aumentam nossa capacidade de estudar o status, as tendências e a dinâmica dos organismos que vivem em habitats subtidais. Ao criar gêmeos digitais fotorrealistas para análises ex situ , essas abordagens permitem que pequenas equipes de campo coletem substancialmente mais dados do que era possível anteriormente. Aqui, apresentamos um pipeline de pesquisa de imagens de grande área em quatro etapas e uma metodologia de análise, incluindo coleta de imagens, construção de modelos, análise ecológica e curadoria de dados, que foi desenvolvida e refinada por meio de experimentação na última década. Cada etapa descrita tem um foco consistente no valor exclusivo das imagens de origem originais. Embora os tipos de dados extraídos de levantamentos de imagens de grandes áreas sejam vastos, incluímos aqui fluxos de trabalho para extrair dados ecológicos para complexidade estrutural, composição da comunidade e análises demográficas valiosas para monitoramento e esforços orientados por hipóteses. Além disso, incluímos recomendações para padrões de metadados, que complementam a coleta de dados de imagens de grandes áreas e apoiam os esforços de arquivamento, facilitando a transparência e a colaboração entre grupos de pesquisa.
Introdução
Em ambientes terrestres, os pesquisadores aproveitaram a amostragem padronizada de grandes áreas de comunidades ecológicas, particularmente no contexto de locais de estudo de longo prazo, incluindo Barro Colorado Island1, a floresta experimental Hubbard Brook2 e outros3. Por meio da coleta de dados distribucionais espacialmente explícitos e resolvidos taxonomicamente, essa amostragem tem sido usada para explorar dinâmicas ecológicas fundamentais, como padrões de dispersão e recrutamento 3,4,5, preferência e disponibilidade de habitat, núcleos de dispersão, limitação de recursos 3,5,6,7,8 e uso do espaço 9,10. No entanto, até o momento, a maioria dos estudos espaciais de comunidades marinhas se baseou em métricas de cobertura relativa, relatadas como porcentagem de cobertura ocupada pelo táxon ou grupo 11,12,13,14,15. As estimativas agregadas de cobertura relativa, no entanto, são insuficientes para resolver detalhes da demografia em nível populacional, bem como da dinâmica em nível comunitário. Estudos que forneceram análises detalhadas de comunidades bentônicas basearam-se em laboriosos protocolos de monitoramento na água 16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32, mas a escala (incluindo escalas taxonômicas, espaciais e cronológicas) desses estudos é notavelmente limitada devido às demandas operacionais da metodologia na água.
A imagem de grande área (LAI) é uma abordagem que combina informações de várias imagens por meio de fluxos de trabalho computacionalmente intensivos para criar representações fotorrealistas de ambientes em escalas muito maiores do que as imagens constituintes33. O fluxo de trabalho LAI é particularmente adequado para aplicações em habitats subaquáticos, dada a visibilidade limitada devido à absorção de luz e dispersão na água. Devido à visibilidade limitada, as imagens que capturam detalhes finos dos bentos devem ser adquiridas perto do assunto; Para capturar uma visão da paisagem (ou paisagem marinha) de uma ampla faixa de habitat bentônico, mantendo detalhes finos de indivíduos bentônicos, é necessário obter imagens compostas. Além disso, em ambientes estruturalmente complexos, é essencial levar em conta a estrutura tridimensional (3D) na reconstrução da imagem composta para produzir representações fiéis da posição e proximidade relativa dos organismos bentônicos. O método fotogramétrico Structure-from-Motion (SfM) foi aplicado a ambientes com organismos bentônicos relativamente imóveis, incluindo recifes de coral 34,35,36, ecossistemas bentônicos antárticos 37, recifes de coral de água fria38, infiltrações frias39 e habitat de ervas marinhas40, gerando imagens compostas sem estereoscopia usadas para reconstruir uma cena de paisagem com geração de ortomapa subsequente e estimativa de nuvem de pontos.
Na ciência dos recifes de coral, o LAI ofereceu o potencial de visualizar paisagens de recifes em escalas espaciais cada vez maiores e compartilhar essas visualizações em mídias digitais. O LAI pode ser usado para estimar a cobertura de organismos recifais, a densidade e distribuição de colônias de corais, bem como a forma e condição de organismos individuais 41,42,43,44,45,46,47. Além disso, quando os produtos do IAF são coletados no mesmo local em diferentes pontos no tempo, é possível registrar mudanças no tamanho e na condição de organismos individuais 48,49,50,51. Dado que a maioria das colônias de corais escleractíneos cresce na ordem de milímetros a centímetros radialmente por ano, as séries temporais IAF coletadas ao longo dos anos podem fornecer um fluxo de dados inestimável para relatar a biologia e ecologia dessas espécies52. Os dados LAI repetidos e co-registrados oferecem insights únicos para estudar os recifes de coral em um formato que pode ser compartilhado, arquivado e usado como base para colaboração em todo o mundo.
À medida que o uso do LAI se expandiu entre os ecologistas de recifes de coral53, também aumentou a diversidade de sistemas de câmeras e metodologias de pesquisa52. Um protocolo LAI escolhido deve ter como alvo a resolução e o escopo das métricas ecológicas desejadas, mantendo-se limitado aos recursos disponíveis. A qualidade de qualquer reconstrução fotogramétrica dependerá, em última análise, da resolução das imagens de origem e da cobertura espacial da área de pesquisa. A qualidade da imagem é determinada por uma influência dos parâmetros da câmera, incluindo a resolução do sensor e a distância focal, bem como o procedimento de coleta, principalmente a distância do bentos54, todos os quais contribuem para a distância efetiva de amostragem do solo (GSD) de um determinado conjunto de imagens. Além disso, velocidades rápidas do obturador, aberturas pequenas e valores ISO baixos produzirão imagens nítidas, focadas e com baixo ruído eletrônico, respectivamente. Manter cada uma dessas configurações em limites que produzam imagens de qualidade suficiente pode ser um desafio em ambientes subaquáticos onde os níveis de luz são baixos. Sensores maiores, como os encontrados no estilo digital single-lens reflex (DSLR) e câmeras mirrorless, geram melhor qualidade de imagem e, por sua vez, reconstruções mais precisas em comparação com soluções menores e mais móveis, como câmeras de ação55. Recursos adicionais que não devem ser negligenciados ao considerar um modelo de câmera apropriado incluem um intervalômetro embutido e armazenamento suficiente e capacidade de bateria para suportar os esforços de coleta de imagens de longa duração em campo.
O desenho da pesquisa deve ser orientado pela hipótese ecológica, com as métricas candidatas determinando a resolução necessária e a cobertura espacial. Dentro da ecologia de recifes de coral, o LAI tem sido usado para caracterizar a complexidade estrutural 35,36,56,57,58,59, composição e assembléia da comunidade 60,61,62, distribuição espacial 45,63,64,65,66 e trajetórias da comunidade 48,49,50,67,68,69. A resolução da qualidade da imagem deve ser apropriada às necessidades de dados ecológicos, com resolução de escala mais fina nos detalhes sub-mm necessários para apoiar observações em escala de pólipo de competição ao longo das bordas da colônia70 ou pesquisas de pequenos corais juvenis66,71. Em contraste, a extração de métricas estruturais e de habitat em larga escala para mapeamento costeiro 72,73,74 requer uma extensão espacial maior com uma necessidade reduzida de resolução na escala cm-m. A demanda por resolução deve ser equilibrada com a extensão espacial necessária para obter amostragem suficiente e limites operacionais do tempo necessário para concluir um inquérito LAI33.
Aqui está descrito um protocolo de ponta a ponta para a realização de uma pesquisa LAI, que se concentra em maximizar a qualidade, utilidade e valor das imagens de origem, dividindo o protocolo em quatro etapas principais: coleta de imagens, construção de modelos, análises ecológicas e curadoria de dados33. A coleta de aproximadamente 3.500 levantamentos de imagens LAI de mais de 2.000 locais de recifes únicos na última década contribuiu para o refinamento da metodologia para cada etapa apresentada aqui (https://doi-org.remotexs.ntu.edu.sg/10.6075/J0T43RN1). O protocolo resultante é um método para coleta robusta de dados e reconstruções de modelos exatas e precisas, que permitem a coleta de dados ecológicos detalhados em uma ampla gama de aplicações, incluindo complexidade estrutural, composição da comunidade e demografia da população (por exemplo, densidade e estrutura de tamanho). Além disso, incluímos padrões de metadados para arquivamento de dados LAI, cujo estabelecimento é essencial para garantir a preservação, transparência e potencial colaborativo desses gêmeos digitais.
Protocolo
1. Coleta de imagens
NOTA: O procedimento de coleta de imagens de grande área a seguir descreve um método para pesquisar uma área de aproximadamente 100 m2, embora possa ser facilmente adaptado para áreas que variam de 10 m2 a 2.500 m2. O método de pesquisa descrito abaixo foi projetado para ser implantado em uma variedade de condições de trabalho, gerar imagens de alta qualidade e fornecer dados robustos que podem ser usados para muitas aplicações ecológicas a partir do esforço de um único mergulho de uma hora por uma equipe de duas pessoas.
- Preparação de engrenagens
- Monte a moldura da câmera conectando os painéis da estrutura externa aos painéis e colunas de montagem da câmera usando parafusos Philips de 1 1/2" de comprimento (Figura 1).
- Prepare duas câmeras DSLR, uma com lente grande angular fixa e uma segunda câmera equipada com lente zoom. Consulte a Tabela 1 para obter as configurações detalhadas da câmera.
NOTA: Embora a segunda câmera com lente zoom seja opcional, é altamente recomendável capturar maior resolução de imagem para determinar detalhes da taxonomia75,76, encontrar e identificar pequenos corais juvenis66,71 (1-5 cm de diâmetro) e distinguir as bordas da colônia de corais 45,48,50 durante futuras análises ecológicas. - Monte as caixas das câmeras subaquáticas conectando a porta dome e prenda com os parafusos de polegar da cúpula incluídos. Prenda as alças usando parafusos Phillips de 1/2" de comprimento e a placa de montagem da câmera usando um parafuso de cabeça cilíndrica de 1 1/8" de comprimento. Insira as câmeras na caixa e use a bomba de vácuo para definir a pressão da caixa para 5 pol. Hg, verificando a integridade da vedação do anel de vedação.
- Instale as caixas na estrutura da câmera deslizando a placa de montagem da câmera nos painéis da estrutura de montagem e prenda no lugar usando parafusos de aperto manual.
- Configuração do enredo
- Estabeleça os limites da parcela usando seis ladrilhos quadrados de aço inoxidável (10 cm de comprimento lateral) com marcadores codificados impressos. Coloque dois ladrilhos centrais separados por 10 m ao longo da isóbata alvo, com quatro ladrilhos de canto adicionados 5 m na costa e no mar dos ladrilhos centrais para criar uma área de parcela quadrada de 10 m por 10 m (Figura 2). Registre a profundidade em cada um dos seis ladrilhos para fornecer orientação para a vertical local e facilitar as etapas subsequentes de construção do modelo.
- Adicione flutuadores de referência com ~1,5 m de linha anexada a pesos de 0,45 kg (1 lb) aproximadamente 1 m fora de cada um dos quatro ladrilhos de canto.
NOTA: Esses flutuadores de referência servem como um guia para o operador da câmera denotar os limites do terreno e a altura acima dos bentos em que eles devem nadar na câmera. Colocá-los fora dos limites do gráfico de 10 m x 10 m cria uma zona de amortecimento das imagens, ajudando a garantir que a área de imagem do núcleo seja totalmente reconstruída. - Coloque uma barra de escala de 0,5 m de comprimento consistindo em dois ladrilhos de alvo codificados afixados a cloreto de polivinila (PVC) ou barra de alumínio em cada quadrante da parcela para um total de quatro barras de escala implantadas.
NOTA: É importante que as barras de escala e os blocos de profundidade permaneçam estáveis durante todo o processo de coleta de imagens. Barras de escala e blocos de profundidade também podem ser usados como pontos de referência visuais para o operador da câmera acompanhar o progresso do padrão de natação. - Para estabelecer parcelas permanentes, instale estacas de aço inoxidável de 0,46 m (18 pol) (haste roscada de 0,95 cm ou 3/8 pol) presas com epóxi marinho de duas partes usando um martelo adjacente a cada ladrilho central para marcar a linha central da parcela. Ao olhar para a costa, a estaca esquerda inclui uma porca de travamento para ajudar na orientação durante futuros esforços de pesquisa. No final da pesquisa, registre a coordenada do Sistema de Posicionamento Global (GPS) diretamente acima do local da estaca central esquerda usando uma unidade GPS armazenada dentro de um estojo à prova d'água afixado em um flutuador de mergulho.
NOTA: A instalação de estacas permanentes é recomendada quando permitida por meio de permissão para reduzir o tempo de busca em pesquisas subsequentes e afirmar o relevantamento da mesma área de recife. Use uma imagem ortográfica 2 dimensional (2D) impressa ou "roteiro" (Arquivo Suplementar 1) do local de pesquisa para localizar recursos invariantes e ajudar a identificar a localização da mesma área de plotagem para geração de imagens. Esses roteiros também podem ser usados para realocar parcelas de levantamento exatas nos casos em que o licenciamento não permite a instalação de estacas permanentes ou quando as estacas foram desalojadas ou removidas.
- Captura de imagem
- Defina o balanço de branco personalizado de cada câmera usando um cartão cinza na profundidade desejada do gráfico.
- Inicie cada câmera em um intervalômetro definido para capturar em um intervalo de 1 s-1 .
- Nade o sistema de câmera aproximadamente 1,5 m acima dos bentos em um padrão de grade, seguido por uma segunda passagem perpendicular com aproximadamente 1 m entre cada passagem nadando a uma velocidade lenta de aproximadamente 0,25 m s-1 (Figura 3). Certifique-se de que as passagens se estendam no mínimo 2 m além das bordas dos limites da parcela para garantir sobreposição suficiente dentro da área da parcela alvo.
NOTA: Seguir este padrão e velocidade de natação resulta na coleta mínima de aproximadamente 1.700 imagens de cada câmera durante 28 minutos de imagem. No entanto, para levar em conta o tempo de resposta entre as passagens e errar do lado da sobreamostragem para proteger contra sobreposição insuficiente que resulta em dados abaixo do ideal, recomendamos que os mergulhadores direcionem a coleta de 2.500 imagens de cada câmera durante aproximadamente 40 minutos de imagem. - Segure o sistema de câmera aproximadamente perpendicular à superfície do oceano para garantir cobertura suficiente de cima para baixo; no entanto, para locais de levantamento com topografia complexa, ajuste a orientação da câmera na segunda passagem para seguir perpendicularmente aos bentos e reduzir as oclusões na reconstrução 3D. Tome cuidado ao inclinar a câmera para minimizar a água azul capturada nas imagens.
NOTA: Em casos de condições oceânicas abaixo do ideal, como correntes fortes ou encostas íngremes, ambas as passagens podem ser feitas na mesma direção ao longo da costa. Usar apenas uma câmera de lente grande angular pode ser necessário em corrente forte para reduzir o perfil de arrasto e o esforço do mergulhador necessário para manter o progresso. O segundo conjunto de passes deve ser girado ligeiramente em relação ao primeiro. Se duas passagens forem feitas na mesma direção ao longo da costa, pelo menos uma ou duas "linhas de amarração" perpendiculares ou diagonais cortando o conjunto inicial de passagens devem ser adicionadas para melhorar a qualidade da reconstrução.
2. Construção do modelo
NOTA: A etapa de construção do modelo se concentra em manter o acesso a imagens de origem de alta resolução e gerar a nuvem de pontos densa derivada. A referência da densa nuvem de pontos ocorre dentro do software centralizado de visualização e análise (ver Tabela de Materiais)77, permitindo que o usuário insira e modifique em tempo real. Isso elimina a necessidade de reprocessar e reexportar produtos de dados para um conjunto de dados quando surgem novas informações, principalmente com pesquisas adicionais ao longo do tempo. Os ortomapas 2D, aqui chamados de ortoprojeções, são gerados usando uma visão de projeção ortorretificada da nuvem de pontos densa, com o ângulo de projeção ortogonal à direção da gravidade.
- Alinhamento de câmera e construção de nuvem de pontos densa 3D
- Usando um computador de alto desempenho, carregue todas as imagens, incluindo as das câmeras grande angular e de lente macro em um projeto do Agisoft Metashape , selecionando Fluxo de trabalho | Adicionar pasta. Depois que os arquivos forem carregados, selecione o layout de dados como Câmeras únicas, Adicionar todas as imagens aum pedaço. Remova imagens com excesso de água azul na cena do projeto.
NOTA: Antes de serem adicionadas ao projeto, as imagens de cada câmera devem ser organizadas em pastas separadas, que separarão os arquivos de imagem dentro do bloco como grupos de câmeras distintos. - Alinhe todas as imagens selecionando Fluxo de trabalho | Alinhar fotos. Consulte a Tabela 2 para obter as configurações de processamento de alinhamento.
- Quando o alinhamento estiver concluído, verifique se o conjunto de imagens foi alinhado com êxito com base na porcentagem de câmeras alinhadas e inspecione a nuvem de pontos esparsa gerada em busca de lacunas na cobertura ou desalinhamentos. Certifique-se de que a caixa delimitadora englobe toda a nuvem de pontos esparsa antes de continuar. Se necessário, modifique-o usando as opções Redimensionar ou Girar região .
NOTA: É possível ter 100% das imagens alinhadas e ainda ter lacunas em partes do modelo e, inversamente, ter 80-90% das imagens alinhadas, mas ter um modelo completo da área de levantamento de destino. Portanto, tanto a porcentagem de alinhamento quanto a cobertura de área devem ser usadas para tomar uma decisão informada sobre a usabilidade, em parte ou no todo, do conjunto de dados gerado ou se são necessários esforços adicionais para aumentar a qualidade de aquisição de imagem ou ajustes nas configurações de processamento de alinhamento. - Desative o grupo de câmeras que contém as imagens da lente de zoom. Construa a nuvem de pontos densa selecionando Fluxo de trabalho | Crie uma nuvem densa. Consulte a Tabela 2 para obter as configurações de processamento do Build Dense Cloud.
NOTA: Embora as imagens de ambas as câmeras devam ser usadas para alinhamento para facilitar a consulta de todas as imagens de alta resolução durante análises ecológicas, as imagens da lente de zoom não devem ser usadas durante a criação da nuvem de pontos densa, pois as diferenças sutis no balanço de branco e na exposição entre as duas câmeras adicionarão ruído visual à nuvem de pontos densa. - Exporte as estimativas de pose da câmera selecionando Ferramentas | Executar script | Extract_meta.py script (Arquivo Suplementar 2). Exporte a nuvem de pontos densa selecionando Arquivo | Exportação | Exportar pontos. Consulte a Tabela 2 para configurações de exportação.
- Arraste e solte o arquivo de nuvem de pontos densos exportado no arquivo vc5prep-confidence.bat localizado nos arquivos de programa do software de visualização.
- Compile os arquivos de dados exportados, incluindo os arquivos de pose da câmera (*.cams.xml e *.meta.json) junto com os arquivos de programa gerados (*.vml e pasta contendo arquivos *ptdata, *.xml, *.kdm) em um único diretório para uso no software de visualização.
- Usando um computador de alto desempenho, carregue todas as imagens, incluindo as das câmeras grande angular e de lente macro em um projeto do Agisoft Metashape , selecionando Fluxo de trabalho | Adicionar pasta. Depois que os arquivos forem carregados, selecione o layout de dados como Câmeras únicas, Adicionar todas as imagens aum pedaço. Remova imagens com excesso de água azul na cena do projeto.
- Escala e orientação
- No software de visualização, use a ferramenta scaler para colocar pares de marcadores em alvos de barra de escala e insira a distância conhecida.
NOTA: Mais detalhes sobre a ferramenta de dimensionamento podem ser encontrados na seção 4.2 do Arquivo Suplementar 3. - Coloque marcadores em cada bloco de profundidade e use a ferramenta de orientação para ajustar os valores de profundidade de cada bloco para definir o melhor plano de ajuste à vertical local.
NOTA: Mais detalhes sobre a ferramenta de orientação podem ser encontrados na seção 4.4 do Arquivo Suplementar 3.
NOTA: Verifique se os raios de profundidade apontam para cima, terminando na superfície da água estimada. No caso de raios voltados para baixo, verifique se há evidências de movimento em blocos de profundidade que levariam a erros no valor de profundidade em relação ao seu local reconstruído final ou erros nos metadados de profundidade.
- No software de visualização, use a ferramenta scaler para colocar pares de marcadores em alvos de barra de escala e insira a distância conhecida.
- Corregisto temporal
- Crie um arquivo de projeto organizacional no software para uma coleção de dados seguindo a seção 10.0 do Arquivo Suplementar 3. Inclua vários sites com pesquisas ao longo do tempo em um único projeto organizacional.
- Adicione arquivos de nuvem de pontos densos ao projeto da organização como camadas e modifique a estrutura organizacional no nível do site conforme necessário para conectar nuvens de pontos densas de um determinado site ao longo do tempo.
NOTA: Use um esquema de nomenclatura de arquivo consistente de [Região]_[Data]_[Site] para automatizar a organização da camada. - Selecione um ponto de tempo para um site para servir como a camada de referência para escala e orientação da série temporal.
NOTA: Várias camadas podem ser usadas para definir a escala; no entanto, uma camada de ponto de tempo deve ser selecionada como referência para orientação, pois as mudanças de maré e a grande altura do swell levam a erros na precisão e consistência das medições de profundidade ao longo do tempo. - Use a ferramenta de corregistro assistido para alinhar camadas ao longo do tempo.
NOTA: Mais detalhes podem ser encontrados na seção 11.0 do Arquivo Suplementar 3. Em casos de grande mudança estrutural devido a alto crescimento ou grandes eventos de ondulação, pode ser preferível usar o fluxo de trabalho de corregistro manual usando recursos invariáveis candidatos. Para séries temporais mais longas, ou quando há uma mudança substancial ao longo do tempo, geralmente é recomendável registrar um determinado modelo para o próximo ponto de tempo anterior.
- Ortorretificação 2D
- Usando a ferramenta caixas no software, defina uma vista de um ângulo de superfície (g: 0°) com limites abrangendo a área de análise focal (10 m x 10 m) junto com um buffer mínimo de 2 m ( mínimo l: 14 m, mínimo h: 14 m) estendendo-se de cada borda.
NOTA: Os detalhes sobre como usar a ferramenta de caixas podem ser encontrados na seção 6.0 do Arquivo Suplementar 3. - Na ferramenta caixas, ative a exportação de mapa para criar um arquivo de imagem de ortoprojeção. Defina a resolução de exportação como 1 mm px-1 e selecione capturar para gerar uma visualização. Role até um bloco de visualização contendo uma seção completa da densa nuvem de pontos e aumente o valor pt-size para preencher as lacunas entre os pontos.
- Selecione capturar para exportar a ortoprojeção como um arquivo ppm. Quando a captura estiver concluída, converta o arquivo exportado em um tif arrastando e soltando o arquivo .ppm gerado no arquivo convert-to-tif-flip.cmd localizado nos arquivos do programa.
- Para nuvens de pontos densas co-registradas de uma série temporal, repita as etapas 2.4.2 a 2.4.3 para o site, alterando a camada de tempo enquanto utiliza a mesma caixa.
- Usando a ferramenta caixas no software, defina uma vista de um ângulo de superfície (g: 0°) com limites abrangendo a área de análise focal (10 m x 10 m) junto com um buffer mínimo de 2 m ( mínimo l: 14 m, mínimo h: 14 m) estendendo-se de cada borda.
3. Análise ecológica
NOTA: Existem inúmeras opções para extração de dados ecológicos, uma seleção das quais apresentamos aqui. Esses fluxos de trabalho principais se concentram em métricas estabelecidas para monitoramento de longo prazo78,79, mas podem ser usados e adaptados para gerar dados suficientes para investigação científica baseada em observação. Os usuários devem selecionar e adaptar fluxos de trabalho com base em suas necessidades individuais de dados e metas analíticas. Os fluxos de trabalho descritos abaixo são projetados para integrar o acesso direto às imagens de origem para auxiliar na anotação de dados biológicos, usando produtos derivados, como a nuvem de pontos densa 3D ou a ortoprojeção 2D como uma estrutura organizacional.
- Complexidade estrutural
- Usando a ferramenta rugo, faça uma caixa de 10 m x 10 m na nuvem de pontos densa, definindo uma dimensão máxima de 10 m (rugo-dim: 10,0 m) e proporção de 1,0 (aspecto quádruplo: 1.000) para designar a área alvo de 100 m2 para extração de dados.
NOTA: Mais detalhes sobre como usar a ferramenta rugo podem ser encontrados na seção 7.0 do Arquivo Suplementar 3. - Defina o número de linhas de transecto para amostrar (linhas) e o número de pontos ao longo de cada transecto (amostras) com base no espaçamento de amostra desejado. Selecione preparar para exportar um arquivo csv contendo as coordenadas x, y e z de cada ponto amostrado, que pode ser usado para uma variedade de análises de complexidade estrutural.
- Execute o script encontrado no Supplemental File 4 para gerar funções usadas para análises de complexidade estrutural. Em seguida, siga os scripts encontrados no Arquivo Suplementar 5 com base nas métricas desejadas para quantificar a complexidade estrutural.
NOTA: Sugere-se selecionar uma escala de espaçamento na resolução mais alta (espaçamento de 1 cm recomendado) que os usuários podem direcionar para abordar sua escala de interesse, a partir da qual uma variedade de escalas, como as apresentadas aqui (espaçamento entre linhas de 0,5 m e espaçamento de pontos de 10 cm), podem ser avaliadas de forma semelhante por meio de amostragem56.
- Usando a ferramenta rugo, faça uma caixa de 10 m x 10 m na nuvem de pontos densa, definindo uma dimensão máxima de 10 m (rugo-dim: 10,0 m) e proporção de 1,0 (aspecto quádruplo: 1.000) para designar a área alvo de 100 m2 para extração de dados.
- Composição da comunidade
- Usando a ferramenta Virtual Point Intercept (VPI), faça uma caixa de 10 m x 10 m na nuvem de pontos densa, definindo uma dimensão máxima de 10 m (quad-dim: 10,0 m) e uma proporção de 1 (quad-aspect: 1.000) para designar a área alvo de 100 m2 para extração de dados.
NOTA: Detalhes sobre o uso da ferramenta de interceptação de ponto virtual podem ser encontrados na seção 5.0 do Arquivo Suplementar 3. - Defina os pontos a serem amostrados da densa nuvem de pontos em uma distribuição aleatória estratificada, com o número de pontos visando uma densidade escolhida. Selecione preparar para iniciar os pontos de amostragem.
NOTA: Recomenda-se uma densidade amostral de 25 m-2 (2.500 pontos) para análises a nível taxonómico. Os resultados apresentados aqui usaram uma densidade amostral mais baixa (10 m-2) para uma pesquisa de comparação de composição de comunidade mais ampla focada em um nível funcional. - Use a ferramenta cams para vincular as imagens de origem à nuvem de pontos densa e permitir vistas de várias imagens consultadas espacialmente de pontos no modelo.
NOTA: Mais detalhes sobre a ferramenta cams podem ser encontrados na seção 4.5 do Arquivo Suplementar 3. - Use o applet da web do navegador VPI para rotular principalmente cada ponto com sua designação taxonômica de resolução mais alta diretamente usando várias visualizações das imagens de origem. Adicione dois conjuntos opcionais de rótulos secundários para cada ponto, com exemplos de rótulos de coral, incluindo tensão de branqueamento75 e morfologia.
NOTA: Os conjuntos de legendas primário e secundário podem ser modificados editando o arquivo qclasses.json localizado na pasta *.pq. - Exporte um resumo da cobertura percentual de cada etiqueta como um arquivo .csv usando o miniaplicativo da Web.
- Usando a ferramenta Virtual Point Intercept (VPI), faça uma caixa de 10 m x 10 m na nuvem de pontos densa, definindo uma dimensão máxima de 10 m (quad-dim: 10,0 m) e uma proporção de 1 (quad-aspect: 1.000) para designar a área alvo de 100 m2 para extração de dados.
- Levantamento de densidade
- Certifique-se de que as imagens já foram vinculadas no software seguindo o passo 3.2.3. Defina uma visualização pseudo-mapa da nuvem de pontos densa alterando a distância focal da vista em perspectiva para 100 mm e diminuindo o zoom para uma vista completa de cima para baixo do modelo. Use o arquivo de amostragem quadrat no Supplemental File 6 para capturar a exibição usando o applet da web clicando em eval para a célula c1 e selecione o botão de captura.
NOTA: Mais detalhes podem ser encontrados na seção 8.0 do Arquivo Suplementar 3. - Ative as câmeras e vincule as imagens no fluxo de trabalho de amostragem quadrada clicando em eval para as células c2 e c3 no script de amostragem quadrada.
- Certifique-se de que uma caixa de rugo já tenha sido feita seguindo a etapa 3.1.1 para designar a área de extração de dados alvo de 100 m2 . No miniaplicativo da web, avaliamos a seção de células de preparação c4 para amostrar 100 quadrados de 1 m2 .
- No endereço da web Quadrat Sampling, use as imagens de origem para pesquisar em um quadrado e rotular os organismos-alvo. Clique duas vezes com o botão esquerdo do mouse em um local para redirecionar o local de amostragem. Clique em um botão taxonômico para designar o ponto de destino como uma amostra. Para remover um ponto marcado, clique duas vezes com o botão esquerdo do mouse nesse ponto e selecione NADA.
NOTA: Os quadrados são apresentados em uma ordem aleatória predeterminada, permitindo que um subconjunto de quadrados seja amostrado aleatoriamente para levantamentos de densidade. - Compile todos os arquivos de amostragem localizados em *aux/recruits/test1 em um único diretório, renomeando cada arquivo para incluir o nome do site. Adicione o arquivo de pesquisa de botão (Arquivo Suplementar 7) ao mesmo diretório que os arquivos de amostragem. Execute o script no Arquivo Suplementar 8, seguindo as instruções em linha para agregar dados de amostra em densidade por site e grupo taxonômico.
NOTA: Aqui, amostramos invertebrados sésseis, mas a mesma ferramenta pode ser usada para pesquisar uma variedade de organismos, incluindo densidades de corais juvenis e adultos.
- Certifique-se de que as imagens já foram vinculadas no software seguindo o passo 3.2.3. Defina uma visualização pseudo-mapa da nuvem de pontos densa alterando a distância focal da vista em perspectiva para 100 mm e diminuindo o zoom para uma vista completa de cima para baixo do modelo. Use o arquivo de amostragem quadrat no Supplemental File 6 para capturar a exibição usando o applet da web clicando em eval para a célula c1 e selecione o botão de captura.
- Demografia
- Carregue o arquivo de ortoprojeção para segmentação de colônias no software de análise de segmentação (ver Tabela de Materiais)80. Carregue arquivos de ortoprojeção co-registrados para vários pontos de tempo como novos mapas dentro do mesmo arquivo de projeto para segmentar e rastrear o tamanho das colônias ao longo do tempo.
- Use as imagens de origem por meio do miniaplicativo da web para iView encontrado na seção 17.1 do Arquivo Suplementar 3 enquanto segmenta colônias como referência para identificação taxonômica e de limite. Certifique-se de que as imagens já foram vinculadas no software de visualização seguindo a etapa 3.2.3. Coloque um marcador na nuvem de pontos densa para a colônia focal e percorra as imagens de origem para o local do marcador para diferentes visualizações em perspectiva.
- Use a ferramenta de anotação de cliques positivos/negativos para segmentar colônias de corais individuais. Modifique os limites usando o ajuste de limite manual ou baseado em cliques.
4. Curadoria de dados
NOTA: Os esforços de arquivamento devem priorizar a preservação das imagens de origem, pois todos os produtos derivados subsequentes são reproduzíveis. Embora os repositórios disponíveis para um determinado usuário variem, esforços devem ser feitos para padronizar os metadados de pesquisa associados incluídos no conjunto de dados da imagem de origem para maximizar sua utilidade quando disponibilizados para a comunidade em geral.
- Repositório de dados
- Gere um arquivo de descrição de métodos que inclua detalhes de levantamento, como área coberta, sistema de câmera, marcadores de controle de solo e padrão de coleta. Consulte o Arquivo Suplementar 9 para obter um exemplo de descrição para este protocolo.
- Gere um arquivo de metadados de levantamento específico para o conjunto de dados da imagem, incluindo campos como nome do local, data de coleta, coordenadas GPS, rolamentos de plotagem, dados de profundidade e escala de controle de solo e o padrão de coleta usado e sistema de câmera para o levantamento em questão.
NOTA: Campos adicionais que incluem contexto geográfico e condições mais amplas durante a pesquisa são altamente recomendados. Um exemplo de arquivo de metadados com campos recomendados pode ser encontrado no Arquivo Suplementar 10. - Combine o arquivo de descrição, o arquivo de metadados e os arquivos de imagem em um único arquivo zip para ser ingerido no repositório de dados escolhido.
NOTA: Coleções de dados de imagem foram disponibilizadas em https://doi-org.remotexs.ntu.edu.sg/10.6075/J0DV1HDR.
Resultados
A coleta bem-sucedida de imagens de grande área no campo deve resultar na criação de uma reconstrução densa da nuvem de pontos com cobertura total de cima para baixo da área de pesquisa, enquanto a redundância inadequada na cobertura pode resultar em lacunas ou degradação total da nuvem de pontos (Figura 4). Para um conjunto de 43 levantamentos de imagens de grande área realizados em todo o arquipélago havaiano em 2016, uma média de 99,6% das imagens foram alinhadas por conjunto de dados, com 66% dos conjuntos de imagens tendo 100% das imagens alinhadas com sucesso. As imagens coletadas da câmera de lente grande angular tiveram um GSD médio de 0,52 mm px-1 , enquanto as imagens da câmera de lente zoom tiveram um GSD médio de 0,18 mm px-1. Essas pesquisas geraram nuvens de pontos densas com um tamanho médio de 557,7 milhões de pontos (15 GB).
Os fluxos de trabalho ecológicos descritos aqui foram projetados para gerar dados comparáveis às metodologias existentes para monitoramento de recifes de coral78. Os dados ecológicos extraídos das pesquisas LAI em todo o Havaí mostram, além de alguns outliers, medidas de rugosidade linear resultantes do fluxo de trabalho de complexidade estrutural que se alinham bem com os valores relativos em comparação com as medidas in situ de complexidade em todos os locais81 (Figura 5A, B). Análises adicionais de composição da comunidade do LAI para medir a cobertura percentual dos principais grupos funcionais bentônicos mostram alinhamento semelhante em comparação com pesquisas fotoquadradas tradicionais82 (Figura 5C, D). A amostragem quadrada aqui foi usada para medir a densidade de invertebrados sésseis, sendo os mais comuns os ouriços-do-mar, que foram resumidos como medidas categóricas de abundância relativa. Os métodos LAI registraram regularmente níveis mais altos de abundância em relação aos métodos in situ 81 (Figura 5E, F), o que pode ser devido à capacidade de pesquisar e pesquisar de forma abrangente todos os indivíduos dentro de uma determinada área em comparação com um censo visual rápido. A segmentação de colônias de corais usando a ortoprojeção 2D também revelou distribuições de tamanho semelhantes de táxons de corais comuns aos métodos in situ 83 (Figura 5G, H).
Uma grande vantagem das pesquisas LAI é a capacidade de arquivar e rastrear mudanças nas áreas de recife ao longo do tempo por meio do co-registro da densa nuvem de pontos. Os recifes de coral são substratos vivos, o que, para as pesquisas do LAI, pode ser um desafio identificar superfícies permanentes, naturais ou instaladas, que podem ser usadas para registrar de forma confiável nuvens de pontos densos de diferentes pontos de tempo. O exemplo do atol do milênio (Figura 6) mostra um exemplo com alto crescimento e perda estrutural em que o fluxo de trabalho de co-registro assistido foi usado para co-registro de nuvem de pontos densa, apesar de pouca ou nenhuma estabilidade da superfície do recife ao longo do tempo.

Figura 1: Diagrama dos quadros de câmera montados. Exemplos de visualizações das configurações de quadro de câmera dupla (A,B) e (C,D) única. As caixas de câmera Ikelite são fixadas à estrutura no painel de montagem da câmera usando uma placa deslizante presa às alças da caixa. Instrumentos opcionais para auxiliar na navegação, como nível, bússola e computador de mergulho, podem ser anexados ao quadro, conforme mostrado em B. Clique aqui para ver uma versão maior desta figura.

Figura 2: Diagrama do gráfico de imagem de grande área de 100 m2 . Esquema de um lote de imagem de grande área totalmente configurado com 100 m2 de área. Os marcadores de plotagem temporários incluem seis marcadores de bloco de limite, quatro barras de escala e quatro flutuadores de referência. Os marcadores de parcela permanentes incluem duas estacas de aço inoxidável com a estaca esquerda, ao olhar para a costa, incluindo uma contraporca. A referência GPS para o gráfico deve ser tomada acima do ladrilho ou estaca central esquerda. Clique aqui para ver uma versão maior desta figura.
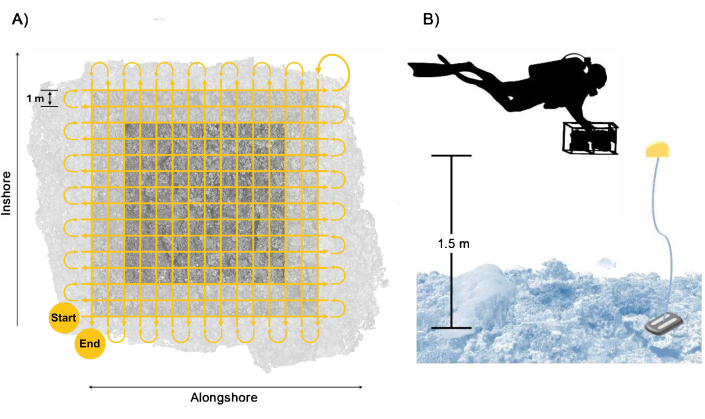
Figura 3: Padrão de coleta do mergulhador. Exemplo de (A) trajetória de natação do mergulhador para garantir cobertura suficiente e sobreposição da área da parcela com um buffer incluído e (B) arranjo do mergulhador com o sistema de câmera com os flutuadores de referência fornecendo um guia para a altura de natação. Clique aqui para ver uma versão maior desta figura.

Figura 4: Redução na sobreposição de imagens. A degradação da nuvem de pontos densa à medida que o número de imagens sobrepostas é reduzida por meio de amostragem aleatória. Cada painel mostra a densa nuvem de pontos gerada a partir de (A) todas as imagens, (B) 1/2, (C) 1/3, (D) 1/5 e (E) 1/10 das imagens originais. Clique aqui para ver uma versão maior desta figura.

Figura 5: Extração de dados ecológicos. Os dados candidatos extraídos de imagens de grandes áreas para cada um dos fluxos de trabalho ecológicos são mostrados em comparação com os métodos de coleta de dados in situ estabelecidos. Isso inclui (A, B) complexidade estrutural, (C, D) composição da comunidade (barras de erro indicam erro padrão), (E, F) densidade de invertebrados e (G, H) dados demográficos da estrutura de tamanho. Abreviatura: LAI = imagem de grande área. Clique aqui para ver uma versão maior desta figura.

Figura 6: Co-registro de nuvem de pontos densa. Um exemplo de comparação visual de duas nuvens de pontos densas co-registradas temporalmente. As áreas de perda estrutural, provavelmente devido a danos causados por ondulação, são codificadas visualmente em vermelho, conforme indicado pela seta magenta. As áreas de adição estrutural, normalmente atribuídas ao crescimento de colônias de corais, são codificadas visualmente em azul, conforme indicado pela seta amarela. O fluxo de trabalho de corregistro descrito aqui ainda pode ser usado para áreas de recife tão dinâmicas quanto as vistas aqui, onde os Pontos de Controle Terrestre (GCPs) instalados permanentemente não seriam confiáveis devido ao crescimento excessivo ou deslocamento. Clique aqui para ver uma versão maior desta figura.
| Recurso de câmera | Configuração recomendada |
| Foco | Automático |
| Modo de disparo | P (Automático Programado) para lente grande angular |
| A (Automático com prioridade à abertura), definido para uma abertura de F8 para objetiva macro | |
| Modo de Liberação | S (automático com prioridade ao obturador) |
| Configurações de foco automático | Foco automático central (AF-C), ponto central único (S) |
| Controle automático de sensibilidade ISO | EM |
| Sensibilidade ISO máxima | 3200 |
| Velocidade mínima do obturador | 1/320 |
| Qualidade de imagem | RAW + JPEG |
| Temporizador de intervalo | 1 s |
| Equilíbrio de branco | Costume |
Tabela 1: Configurações recomendadas da câmera. A seguir está uma lista das principais configurações da câmera usadas para otimizar a qualidade da imagem. Essas configurações priorizam a captura de imagens em foco capturadas por um operador em movimento em condições de iluminação subaquática.
| Alinhar fotos | |
| Exatidão | Alto |
| Pré-seleção genérica | Não |
| Limite de pontos-chave | 5000 |
| Limite de ponto de amarração | 0 |
| Correspondência de imagem guiada | Não |
| Ajuste de modelo de câmera adaptável | Sim |
| Crie uma nuvem densa | |
| Qualidade | Alto |
| Filtragem de profundidade | Moderada |
| Calcular cores de ponto | Sim |
| Calcular Confiança de Ponto | Sim |
| Exportar pontos | |
| Tipo de arquivo | Stanford PLY |
| Sistema de coordenadas | Coordenadas locais (m) |
| Dados de origem | Nuvem densa |
| Salvar cores de ponto | Sim |
| Ponto de salvamento normal | Sim |
| Economize confiança no ponto | Sim |
| Salvar classes de ponto | Não |
| Converta cores para RGB de 8 bits | Sim |
| Codificação binária | Sim |
Tabela 2: Configurações de construção de nuvem de pontos densa 3D. Uma lista de configurações usadas no Agisoft Metashape para criar e exportar uma reconstrução de nuvem de pontos densa de alta qualidade.
Arquivo Suplementar 1: Roteiro. Exemplo de imagem ortomosaico marcada com recursos e profundidades de plotagem para ajudar a encontrar a área de plotagem para repesquisa. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Extract_meta.py. Script executado no Agisoft Metashape para exportar informações de pose de câmera e diretório de arquivos para uso no Viscore para consultar as imagens originais. Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: Guia para Viscore. Guia de software para Viscore, que inclui fluxos de trabalho para visualização de modelos, co-registro e análises ecológicas. Clique aqui para baixar este arquivo.
Arquivo Suplementar 4: Rugosity_Functions.Rmd. Script usado em R contendo funções para processar dados de rugosidade extraídos do Viscore. Clique aqui para baixar este arquivo.
Arquivo suplementar 5: Rugosity_Analysis.Rmd. Script usado em R para calcular métricas de rugosidade. Clique aqui para baixar este arquivo.
Arquivo Suplementar 6: Quadrat_sampling.rpl.json. Script usado no Viscore para fluxo de trabalho de análise de densidade quadrada. Clique aqui para baixar este arquivo.
Arquivo Suplementar 7: Density_taxo_lookup.json. Arquivo de pesquisa de botão para executar o script de amostragem quadrática para agregar dados de amostragem quadrática por grupo taxonômico. Clique aqui para baixar este arquivo.
Arquivo suplementar 8: Density_Analysis.R Script usado em R para agregar dados de amostragem quadrada que calculam a densidade por grupo taxonômico em um nível de pesquisa. Clique aqui para baixar este arquivo.
Arquivo Suplementar 9: README.txt Exemplo de arquivo de texto a ser incluído com imagens originais para arquivamento de dados que descreve a metodologia de captura de imagem. Clique aqui para baixar este arquivo.
Arquivo Suplementar 10: METADATA_KAH_2016-07_03.txt Exemplo de arquivo de texto a ser incluído com imagens originais para arquivamento de dados que contém campos de metadados para levantamento LAI. Isso inclui campos para dados de escala e profundidade da pesquisa para referência, bem como metadados gerais do site para contexto geográfico. Abreviatura: LAI = imagem de grande área. Clique aqui para baixar este arquivo.
Discussão
A imagem de grande área é uma ferramenta que permite aos cientistas de domínio visualizar e analisar digitalmente características do ambiente em escalas maiores do que as imagens individuais coletadas. Ao capturar várias imagens do ambiente de várias perspectivas, os protocolos LAI ajudam a criar representações de paisagens relativamente amplas (em relação à cobertura espacial de imagens individuais), mantendo os detalhes coletados das imagens originais. O valor único do LAI reside na capacidade de explorar dados ambientais em escalas, desde a maior escala (definida pela extensão da área da pesquisa) até a escala mais fina (definida pela resolução realizada das imagens originais). No entanto, para capitalizar essa força em escala cruzada, é fundamental garantir acesso regular e fluido a todos os níveis dos dados capturados, especificamente para garantir acesso fácil às imagens originais e ao modelo 3D derivado. Em cada etapa do protocolo apresentado aqui, destacamos essa força única do LAI, garantindo consistentemente que as imagens originais sejam acessíveis, utilizáveis e arquivadas com segurança junto com os modelos LAI derivados.
O método LAI entregará produtos vinculados diretamente às imagens originais coletadas. Ao mudar os detalhes da aquisição de imagens, os usuários podem produzir produtos de dados de qualidade e cobertura diferentes. Ao pesquisar ambientes de recifes de coral estruturalmente complexos, um usuário com tempo de pesquisa limitado debaixo d'água (ou um número constante de imagens disponíveis para serem capturadas) pode priorizar o aumento da cobertura de área da área de pesquisa ou aumentar o nível de detalhe de cada seção da área amostrada. Haverá necessariamente uma compensação, com o grande modelo de área tendo menos detalhes (e talvez mais oclusões) por unidade de área e o modelo detalhado cobrindo menos área total (com provavelmente menos oclusões). Neste protocolo, incluímos o uso de duas câmeras, cada uma com lentes diferentes, o que permite ao usuário amostrar uma área maior (sobreposição suficiente com a lente grande angular para atender aos requisitos do SfM) e, ao mesmo tempo, coletar imagens originais mais detalhadas (maior detalhe da lente zoom que tem menos sobreposição de foto para foto). Ao incluir a estimativa de pose de imagens de ambas as câmeras, os protocolos de visualização e análise downstream incluem visualizações de alta resolução de grande parte da área amostrada. Embora o protocolo tenha como objetivo expandir a gama de viabilidade de pesquisa, os usuários podem descobrir que os produtos derivados carecem de cobertura de área suficiente ou detalhes suficientes de imagens originais para completar as rotinas analíticas preferidas. Os usuários são incentivados a revisar as imagens originais e os modelos derivados para garantir que o protocolo de pesquisa ambiental atenda às necessidades do programa e modificar a abordagem de pesquisa na água (por exemplo, mudança da distância de amostragem do solo, alteração da duração da pesquisa ou número de imagens coletadas) para chegar ao equilíbrio preferido de cobertura de área e resolução por unidade de área.
Os métodos LAI agregam valor à ciência subaquática, capturando 'instantâneos' ricos em informações e de ampla cobertura de ambientes bentônicos que podem ser eficientes em termos de tempo e exigem conhecimento limitado de domínio específico para coleta. O valor desses produtos de dados pode ser considerado com referência aos fluxos de dados existentes, bem como para aplicativos específicos de domínio novos e acelerados. Considerando a comparação com os fluxos de dados existentes, os produtos de análise do LAI podem fornecer dados ecológicos diretamente comparáveis aos dados coletados in situ por observadores subaquáticos 84,85,86,87. Fornecemos aqui uma análise quantitativa das saídas de dados ecológicos derivados de cada uma das atividades clássicas de monitoramento in situ e da análise padronizada de produtos LAI, seguindo este protocolo. Concentrando-se em quatro métricas comuns nos esforços de monitoramento de recifes de coral (complexidade estrutural, composição da comunidade bentônica, densidade de invertebrados móveis e estrutura do tamanho do coral; Figura 5), demonstramos forte concordância quantitativa nas saídas de dados. Notavelmente, para os fluxos de dados que requerem observações em escala fina (por exemplo, identificações taxonômicas, definições precisas de fronteiras biológicas), os fluxos de trabalho do LAI que incluem acesso regular e confiável a imagens originais fornecem uma força única para acompanhar as oportunidades observacionais que historicamente foram limitadas apenas à amostragem imersiva in situ. Os avanços no manuseio e visualização de dados fornecidos pela Viscore e descritos neste protocolo oferecem um valor único para garantir a comparabilidade de dados ecológicos derivados do LAI e produtos de monitoramento in situ, permitindo a manutenção imparcial de fluxos de dados de longo prazo com a incorporação de fluxos de trabalho digitalmente aprimorados do LAI.
Para cientistas subaquáticos, o LAI oferece a oportunidade de alavancar fluxos de trabalho novos e acelerados na aquisição e exploração de dados. O LAI tem pontos fortes únicos como uma ferramenta de mapeamento de alta resolução que contém informações não apenas que descrevem a composição relativa do ambiente bentônico, mas também as características espaciais. Explícitos para a criação de um modelo 3D a partir do fluxo de trabalho SfM, os produtos LAI contêm informações sobre a complexidade estrutural que pode ser explorada em várias escalas56. Como ferramentas que capturam paisagens marinhas de áreas maiores, os produtos LAI podem fornecer uma oportunidade para considerar padrões de distribuição espacial e características de vizinhança para organismos bentônicos45,66. Além disso, ao ser capaz de visualizar paisagens bentônicas em escalas maiores, torna-se possível detectar características que não são facilmente visíveis em habitats subaquáticos devido às limitações de visibilidade de longa distância debaixo d'água, por exemplo, padrão poligonal em grande escala (3-4 m) de uma macroalga comum em um recife de coral do Pacífico64.
Embora o LAI ofereça oportunidades para análise em larga escala, houve preocupações declaradas em relação aos desafios relacionados à coleta eficiente na água e ao pós-processamento de imagens. A expansão da extensão espacial da aquisição de imagens subaquáticas exigirá avanços tecnológicos além da imagem implantada por mergulhadores, para a utilização de sistemas de mapeamento assistido88 e, finalmente, o uso de ROVs38 e AUVs67,89. Metodologias robustas de pesquisa em relação ao padrão de aquisição e sistemas de câmeras garantirão uma transição suave e consistência nos dados gerados nessas diferentes plataformas. Dadas as demandas computacionais, bem como o grande formato de dados dos produtos LAI, alguns cientistas marinhos expressaram preocupação com a acessibilidade tecnológica do fluxo de trabalho90 e as grandes demandas de tempo associadas à extração de dados ecológicos84,86. Um número crescente de ferramentas está sendo apresentado, no entanto, que alavancam soluções criativas para os obstáculos técnicos da extração de dados 80,91,92,93. É importante ressaltar que o uso de fluxos de trabalho aprimorados por IA de análise LAI é limitado pela qualidade do sinal de entrada fornecido. Como tal, permanece uma demanda consistente na manutenção de padrões e qualidade de aquisição de imagens e gerenciamento de dados em protocolos LAI, independentemente de a extração de dados ser conduzida por um observador humano, por um algoritmo de IA treinado ou (idealmente) por um fluxo de trabalho acelerado por IA e human-in-the-loop. Ao manter um foco consistente na importância primária das imagens originais nos protocolos LAI, conforme descrito aqui, surgem oportunidades únicas para explorar habitats subaquáticos de forma robusta, transparente e consistente.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho é apoiado pelos esforços do 100 Island Challenge na Scripps Institution of Oceanography. Agradecemos aos Schmidt Marine Technology Partners, Ed e Christy Scripps, e à Moore Family Foundation por seu apoio financeiro à pesquisa associada e aos esforços de treinamento em imagens de grandes áreas que ajudaram a refinar a metodologia. Além disso, agradecemos à tripulação dos navios de pesquisa Hi'ialiki, Hanse Explorer e Plan B, que forneceram apoio aos esforços de campo. Agradecemos particularmente à equipe da Divisão de Ciências do Ecossistema do Centro de Ciências da Pesca das Ilhas do Pacífico da NOAA, que auxiliou na coleta de campo dos dados apresentados aqui.
Materiais
| Name | Company | Catalog Number | Comments |
| 1" x 4 1/4" x 3 1/4" custom machined acetal | N/A | N/A | 1.1 Gear Preparation; For contruction of camera slides and mounts |
| 1/2" marine grade high density polyethylene | King Starboard | N/A | 1.1 Gear Preparation; For contruction of camera outer frame and camera mounting panels |
| 18-8 Flathead Stainless Steel Phillips Flat Head Screws, 3/8”-16 Thread Size, 1-1/2” Long | McMaster-Carr | 91771A628 | 1.1 Gear Preparation; For camera frame assembly |
| 18-8 Stainless Steel Socket Head Screw, 10-24 Thread Size, 1-1/8" Long | McMaster-Carr | 92196A248 | 1.1 Gear Preparation; Used to secure mounting plate to handles |
| 1 lb dive weights | House of Scuba | WBELT24 1LB | 1.2 Plot Setup; Used for reference floats |
| 200DL Underwater Housing for Nikon D780 DSLR Camera | Ikelite | 71019 | 1.1 Gear Preparation; Underwater housing for digital camera |
| 24mm fixed lens (AF-S NIKKOR 24mm f/1.8G ED) | Nikkor | 20057 | 1.1 Gear Preparation; Wide-angle lens for greater image overlap |
| 250# gray longline poly soft | Continental Western | 503086 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 3 lb drilling hammer | Estwing | B3-3LB | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| 3/8-16 X 18" THRD ROD W/60 DEGREE POINT 316 S/S | Ababa Bolt | 37C1800ROD6/60DEG | 1.2 Plot Setup; For permanent installation to mark survey site |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 1/4"-20 Thread Size | McMaster-Carr | 90715a125 | 1.2 Plot Setup; For scale bars and frame assembly. |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 3/8"-16 Thread Size | McMaster-Carr | 90715A145 | 1.2 Plot Setup; Affixed to left stainless steel stake for orientation of the plot |
| 316 Stainless Steel Phillips Flat Head Screws, 10-32 Thread Size, 3/8" Long | McMaster-Carr | 91500a827 | 1.1 Gear Preparation; For camera frame assembly |
| 4"x4" Agisoft marker printed on waterproof paper | Agisoft | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x1/4" Stainless steel tile | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x3/4" custom printed plastic agisoft marker high density polyethylene color core | N/A | N/A | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 512 GB Extreme PRO SDXC UHS-I Card - C10, U3, V30, 4K UHD, SD Card | SanDisk | SDSDXXY-512G-GN4IN | 1.1 Gear Preparation; High speed, large capacity storage card. Up to 2 used per camera for image storage |
| 5TB Elements Portable External Hard Drive HDD, USB 3.0 | Western Digital | WDBU6Y0050BBK-WESN | 1.3 Image Capture; Large volume external hard drive for image storage and image backup |
| 60 mm fixed lens (AF-S Micro NIKKOR 60mm F2.8G ED) | Nikkor | 2177 | 1.1 Gear Preparation; Macro zoom lens, optional for dual-camera setup |
| Acetal machined and tapped for 1"x12" 3/8" 16 thread support braces | N/A | N/A | 1.1 Gear Preparation; Camera frame support columns |
| AquaMend Epoxy Putty Stick | JD Industrial Supply | 470550 | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| Architectural 6063 Aluminum U-Channel, 1/8" Wall Thickness, 1/2" High x 3/4" Wide Outside | McMaster-Carr | 9001k46 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 1/2" Long | McMaster-Carr | 91249a537 | 1.1 Gear Preparation; To attach ikelite handle to housing |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 5/8" Long | McMaster-Carr | 91249A539 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Blue Steel Rope | Continental Western | 402020 | 1.2 Plot Setup; Used to secure dive float to the benthos during surveys |
| D780 camera body | Nikon | 1618 | 1.1 Gear Preparation; Camera body model |
| DGX Tech Compass w/Bungee Mount and Cord | Dive Gear Express | DX-9050x | 1.2 Plot Setup; For collection of plot bearings and as an addition to the camera frame as a navigational aid |
| Dive computer - Suunto Zoop Novo | Suunto | N/A | 1.2 Plot Setup; To record depth at reference tiles |
| Dive slate | TexWipe | TX5835 | 1.2 Plot Setup; Used to record plot metadata such as tile depth, and coded target numbers |
| DL 8 inch Dome Port | Ikelite | 75340 | 1.1 Gear Preparation; Dome port for underwater housing |
| FLOAT, PVC SPONGE, 5-3/4" DIA. BY 3/4", RUST | Memphis Net & Twine | SB1 | 1.2 Plot Setup; Used as a visual reference to determine plot boundaries and swim height of camera operator |
| Garmin 78s GPS | Garmin | 010-00864-01 | 1.2 Plot Setup; Used to record location of survey site |
| High performance computer | N/A | N/A | 2.0 Model Construction; For 3D dense point cloud processing, recommended specifications to include a high speed 10+ core CPU, 128GB RAM (64 GB minimum), 1TB solid state drive, and a dedicated NVIDIA or AMD GPU. |
| Inflatable surface dive float | Omer | Atol 6246 | 1.2 Plot Setup; Dual purpose surface marker buoy and |
| JOHNSON Cross Check Level: Nonmagnetic, 2 1/4 in x 1 7/16 in x 3/16 in, Plastic, Hanging Hole, 1mm/m | Grainger | 6C225 | 1.1 Gear Preparation; Optional addition to the camera frame as a navigational aid |
| Long Tape Measure,1/2 In x 30m,Pumpkin | Grainger | 3LJW9 | 1.2 Plot Setup; Used to set up plot area |
| Manta reel SR. Reel | Manta Industries | N/A | 1.2 Plot Setup; Attached to dive float for use during surveys |
| Metashape Professional License | Agisoft | N/A | 2.0 Model Construction; Software for dense point cloud processing |
| Non-glare clear acrylic | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| O-Ring 0132.45 for DL Port System, ULTRAcompact Housings | Ikelite | 132.45 | 1.1 Gear Preparation; O-ring for underwater housing |
| O-Ring 0132.59 for DSLR & Mirrorless Housings (Type 1) | Ikelite | 132.59 | 1.1 Gear Preparation; O-ring for underwater housing |
| Paracord or Dacron Line | N/A | N/A | 1.2 Plot Setup; Used to attach referene floats to dive weights |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1" Long | McMaster-Carr | 91771a542 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1-3/4" Long | McMaster-Carr | 91771a548 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 10-32 Thread, 3/8" Long | McMaster-Carr | 91771A827 | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| Pelican 1060 micro case | Pelican | 1060-025-100 | 1.2 Plot Setup; Housing for GPS unit that is affixed to the inflatable dive float |
| Plastic-Head Thumb screw 1/4"-20 x 2" | McMaster-Carr | 91185A819 | 1.1 Gear Preparation; Use to secure camera housing to frame |
| Right Hand Quick Release Handle with Extension | Ikelite | 4077.02 | 1.1 Gear Preparation; Handle for underwater housing |
| R | N/A | N/A | 3.0 Ecological Analysis; Software for running structural complexity scripts |
| Taglab | N/A | N/A | 3.0 Ecological Analysis; Software for segmentation analysis |
| Trigger Extension v2 for Shutter or Back Button Focus | Ikelite | 4077.95 | 1.1 Gear Preparation; Trigger extenstion for underwater housing shutter button control |
| Vacuum pump with gauge | Ikelite | 47011 | 1.1 Gear Preparation; To test integrity of o-ring seals for underwater camera housings |
| Viscore | N/A | N/A | 2.0 Model Construction; 3.0 Ecological Analysis; Software for ecological analysis |
Referências
- Hubbell, S. P., Foster, R. B. Short-term dynamics of a neotropical forest: Why ecological research matters to tropical conservation and management. Oikos. 63, 48-61 (1992).
- Fahey, T. J., et al. The promise and peril of intensive-site-based ecological research: Insights from the Hubbard Brook ecosystem study. Ecology. 96 (4), 885-901 (2015).
- Condit, R., et al. Spatial patterns in the distribution of tropical tree species. Science. 288 (5470), 1414-1418 (2000).
- Lieberman, D., Lieberman, M., Peralta, R., Hartshorn, G. Mortality patterns and stand turnover rates in a wet tropical forest in Costa Rica. J Ecol. 73 (3), 915-924 (1985).
- Hubbell, S. P. Tree dispersion, abundance, and diversity in a tropical dry forest: That tropical trees are clumped, not spaced, alters conceptions of the organization and dynamics. Science. 203 (4387), 1299-1309 (1979).
- Connell, J. H. The consequences of variation in initial settlement vs. Post-settlement mortality in rocky intertidal communities. J Exp Mar Biol Ecol. 93 (1-2), 11-45 (1985).
- Turner, M. G. Landscape ecology: The effect of pattern on process. Annu Rev Ecol Syst. 20, 171-197 (1989).
- Rietkerk, M., Van De Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Harms, K. E., Wright, S. J., Calderón, O., Hernandez, A., Herre, E. A. Pervasive density-dependent recruitment enhances seedling diversity in a tropical forest. Nature. 404 (6777), 493-495 (2000).
- Marhaver, K., Vermeij, M., Rohwer, F., Sandin, S. Janzen-connell effects in a broadcast-spawning caribbean coral: Distance-dependent survival of larvae and settlers. Ecology. 94 (1), 146-160 (2013).
- Kenyon, J. C., Maragos, J. E., Cooper, S. Characterization of coral communities at rose atoll, american samoa. Atoll Res Bull. 586, 1-28 (2010).
- Goreau, T. F. The ecology of jamaican coral reefs i. Species composition and zonation. Ecology. 40 (1), 67-90 (1959).
- Sandin, S. A., et al. Baselines and degradation of coral reefs in the northern line islands. PLoS One. 3 (2), e1548 (2008).
- Newman, M. J. H., Paredes, G. A., Sala, E., Jackson, J. B. C. Structure of Caribbean coral reef communities across a large gradient of fish biomass. Ecol Lett. 9 (11), 1216-1227 (2006).
- Smith, J. E., et al. Re-evaluating the health of coral reef communities: Baselines and evidence for human impacts across the central pacific. P Roy Soc B: Biol Sci. 283 (1822), 20151985 (2016).
- Lewis, J. B. Spatial distribution and pattern of some Atlantic reef corals. Nature. 227 (5263), 1158-1159 (1970).
- Bradbury, R. H., Young, P. C. The effects of a major forcing function, wave energy, on a coral reef ecosystem. Mar Ecol Prog Ser. 5, 229-241 (1981).
- Bak, R. P. M., Nieuwland, G. Long-term change in coral communities along depth gradients over leeward reefs in the Netherlands Antilles. Bull Mar Sci. 56 (2), 609-619 (1995).
- Connell, J. H., Hughes, T. P., Wallace, C. C. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time. Ecol Monogr. 67 (4), 461-488 (1997).
- Hughes, T. P. Population dynamics based on individual size rather than age: A general model with a reef coral example. Am Nat. 123 (6), 778-795 (1984).
- Hughes, T. P., Tanner, J. E. Recruitment failure, life histories, and long-term decline in Caribbean corals. Ecology. 81 (8), 2250-2263 (2000).
- Fong, P., Glynn, P. A dynamic size-structured population model: Does disturbance control size structure of a population of the massive coral Gardineroseris planulata in the Eastern Pacific. Mar Biol. 130 (4), 663-674 (1998).
- Vardi, T., Williams, D. E., Sandin, S. A. Population dynamics of threatened elkhorn coral in the Northern Florida Keys, USA. Endanger Species Res. 19 (2), 157-169 (2012).
- Doropoulos, C., Ward, S., Roff, G., González-Rivero, M., Mumby, P. J. Linking demographic processes of juvenile corals to benthic recovery trajectories in two common reef habitats. PLoS One. 10 (5), e0128535 (2015).
- Edmunds, P. A quarter-century demographic analysis of the Caribbean coral, Orbicella annularis, and projections of population size over the next century. Limnol Oceanogr. 60 (3), 840-855 (2015).
- Deignan, L. K., Pawlik, J. R. Perilous proximity: Does the Janzen-Connell hypothesis explain the distribution of giant barrel sponges on a Florida coral reef. Coral Reefs. 34, 561-567 (2015).
- Zvuloni, A., et al. Spatio-temporal transmission patterns of black-band disease in a coral community. PLoS One. 4 (4), e4993 (2009).
- Karlson, R. H., Cornell, H. V., Hughes, T. P. Aggregation influences coral species richness at multiple spatial scales. Ecology. 88 (1), 170-177 (2007).
- Jolles, A. E., Sullivan, P., Alker, A. P., Harvell, C. D. Disease transmission of aspergillosis in sea fans: Inferring process from spatial pattern. Ecology. 83 (9), 2373-2378 (2002).
- Carlon, D. B., Olson, R. R. Larval dispersal distance as an explanation for adult spatial pattern in two Caribbean reef corals. J Exp Mar Biol Ecol. 173 (2), 247-263 (1993).
- Bak, R., Termaat, R., Dekker, R. Complexity of coral interactions: Influence of time, location of interaction and epifauna. Mar Biol. 69, 215-222 (1982).
- Stimson, J. An analysis of the pattern of dispersion of the hermatypic coral Pocillopora meandrina var. Nobilis verril. Ecology. 55 (2), 445-449 (1974).
- Edwards, C., et al. Large-area imaging in tropical shallow water coral reef monitoring, research and restoration: A practical guide to survey planning, execution, and data extraction. NOAA Technical Memorandum NOS NCCOS. (313), (2023).
- Pizarro, O., Eustice, R. M., Singh, H. Large area 3-d reconstructions from underwater optical surveys. IEEE J Oceanic Eng. 34 (2), 150-169 (2009).
- Figueira, W., et al. Accuracy and precision of habitat structural complexity metrics derived from underwater photogrammetry. Remote Sens. 7 (12), 16883-16900 (2015).
- Burns, J., Delparte, D., Gates, R., Takabayashi, M. Integrating structure-from-motion photogrammetry with geospatial software as a novel technique for quantifying 3d ecological characteristics of coral reefs. PeerJ. 3, e1077 (2015).
- Piazza, P., et al. Underwater photogrammetry in Antarctica: Long-term observations in benthic ecosystems and legacy data rescue. Polar Biol. 42, 1061-1079 (2019).
- Price, D. M., et al. Using 3d photogrammetry from rov video to quantify cold-water coral reef structural complexity and investigate its influence on biodiversity and community assemblage. Coral Reefs. 38, 1007-1021 (2019).
- Fallati, L., et al. Characterizing Håkon Mosby Mud Volcano (Barents Sea) cold seep systems by combining ROV-based acoustic data and underwater photogrammetry. Front Mar Sci. 10, 1269197 (2023).
- Ventura, D., et al. Seagrass restoration monitoring and shallow-water benthic habitat mapping through a photogrammetry-based protocol. J Environ Manage. 304, 114262 (2022).
- Combs, I. R., Studivan, M. S., Eckert, R. J., Voss, J. D. Quantifying impacts of stony coral tissue loss disease on corals in Southeast Florida through surveys and 3D photogrammetry. PLoS One. 16 (6), e0252593 (2021).
- Bongaerts, P., et al. Reefscape genomics: Leveraging advances in 3D imaging to assess fine-scale patterns of genomic variation on coral reefs. Front Mar Sci. 8, 638979 (2021).
- Raoult, V., Reid-Anderson, S., Ferri, A., Williamson, J. E. How reliable is Structure from Motion (sfm) over time and between observers? A case study using coral reef bommies. Remote Sens. 9 (7), 740 (2017).
- Weinberg, S. A comparison of coral reef survey methods. Bijdr Dierkd. 51 (2), 199-218 (1981).
- Edwards, C. B., et al. Large-area imaging reveals biologically driven non-random spatial patterns of corals at a remote reef. Coral Reefs. 36 (4), 1291-1305 (2017).
- Gracias, N., Santos-Victor, J. Underwater video mosaics as visual navigation maps. Comput Vis Image Und. 79 (1), 66-91 (2000).
- Lirman, D., et al. Development and application of a video-mosaic survey technology to document the status of coral reef communities. Environ Monit Assess. 125 (1-3), 59-73 (2007).
- Kodera, S. M., et al. Quantifying life history demographics of the scleractinian coral genus Pocillopora at Palmyra Atoll. Coral Reefs. 39 (4), 1091-1105 (2020).
- Ferrari, R., et al. 3D photogrammetry quantifies growth and external erosion of individual coral colonies and skeletons. Sci Rep. 7 (1), 16737 (2017).
- Sandin, S. A., et al. Considering the rates of growth in two taxa of coral across Pacific Islands. Adv Mar Biol. 87 (1), 167-191 (2020).
- Ventura, D., et al. Integration of close-range underwater photogrammetry with inspection and mesh processing software: A novel approach for quantifying ecological dynamics of temperate biogenic reefs. Remote Sens Ecol Conserv. 7 (2), 169-186 (2021).
- Ferrari, R., et al. Photogrammetry as a tool to improve ecosystem restoration. Trends Ecol Evol. 36 (12), 1093-1101 (2021).
- Remmers, T., et al. Close-range underwater photogrammetry for coral reef ecology: A systematic literature review. Coral Reefs. 43 (1), 35-52 (2024).
- Marre, G., Holon, F., Luque, S., Boissery, P., Deter, J. Monitoring marine habitats with photogrammetry: A cost-effective, accurate, precise and high-resolution reconstruction method. Front Mar Sci. 6, 276 (2019).
- Nocerino, E., et al. Comparison of diver-operated underwater photogrammetric systems for coral reef monitoring. Int Arch Photogramm Remote Sens Spat Inf Sci. 42 (2/W10), 143-150 (2019).
- Mccarthy, O. S., Smith, J. E., Petrovic, V., Sandin, S. A. Identifying the drivers of structural complexity on Hawaiian coral reefs. Mar Ecol Prog Ser. 702, 71-86 (2022).
- Pascoe, K. H., Fukunaga, A., Kosaki, R. K., Burns, J. H. 3D assessment of a coral reef at Lalo Atoll reveals varying responses of habitat metrics following a catastrophic hurricane. Sci Rep. 11 (1), 12050 (2021).
- Torres-Pulliza, D., et al. A geometric basis for surface habitat complexity and biodiversity. Nat Ecol Evol. 4 (11), 1495-1501 (2020).
- Friedman, A., Pizarro, O., Williams, S. B., Johnson-Roberson, M. Multi-scale measures of rugosity, slope and aspect from benthic stereo image reconstructions. PloS One. 7 (12), e50440 (2012).
- Hernández-Landa, R. C., Barrera-Falcon, E., Rioja-Nieto, R. Size-frequency distribution of coral assemblages in insular shallow reefs of the Mexican Caribbean using underwater photogrammetry. PeerJ. 8, e8957 (2020).
- Fukunaga, A., Burns, J. H., Pascoe, K. H., Kosaki, R. K. Associations between benthic cover and habitat complexity metrics obtained from 3D reconstruction of coral reefs at different resolutions. Remote Sens. 12 (6), 1011 (2020).
- Ferrari, R., et al. Quantifying multiscale habitat structural complexity: A cost-effective framework for underwater 3D modelling. Remote Sens. 8 (2), 113 (2016).
- Kopecky, K. L., et al. Quantifying the loss of coral from a bleaching event using underwater photogrammetry and ai-assisted image segmentation. Remote Sens. 15 (16), 4077 (2023).
- Sandin, S. A., et al. Evidence of biological self-organization in spatial patterns of a common tropical alga. Am Nat. 200 (5), 722-729 (2022).
- Burns, J. H. R., Alexandrov, T., Ovchinnikova, K., Gates, R. D., Takabayashi, M. Data for spatial analysis of growth anomaly lesions on Montipora capitata coral colonies using 3D reconstruction techniques. Data Br. 9, 460-462 (2016).
- Pedersen, N. E., et al. The influence of habitat and adults on the spatial distribution of juvenile corals. Ecography. 42, 1-11 (2019).
- Ferrari, R., et al. Quantifying the response of structural complexity and community composition to environmental change in marine communities. Glob Chang Biol. 22 (5), 1965-1975 (2016).
- Cresswell, A. K., et al. Structure-from-motion reveals coral growth is influenced by colony size and wave energy on the reef slope at Ningaloo Reef, Western Australia. J Exp Mar Biol Ecol. 530, 151438 (2020).
- Lange, I. D., Perry, C. T. A quick, easy and non-invasive method to quantify coral growth rates using photogrammetry and 3D model comparisons. Methods Ecol Evol. 11 (6), 714-726 (2020).
- George, E. E., et al. Space-filling and benthic competition on coral reefs. PeerJ. 9, e11213 (2021).
- Sarribouette, L., Pedersen, N. E., Edwards, C. B., Sandin, S. A. Post-settlement demographics of reef building corals suggest prolonged recruitment bottlenecks. Oecologia. 199 (2), 387-396 (2022).
- Lyons, M. B., et al. Mapping the world's coral reefs using a global multiscale earth observation framework. Remote Sens Ecol Conserv. 6 (4), 557-568 (2020).
- Ventura, D., et al. Coastal benthic habitat mapping and monitoring by integrating aerial and water surface low-cost drones. Front Mar Sci. 9, 1096594 (2023).
- Castellanos-Galindo, G. A., Casella, E., Mejía-Rentería, J. C., Rovere, A. Habitat mapping of remote coasts: Evaluating the usefulness of lightweight unmanned aerial vehicles for conservation and monitoring. Biol Conserv. 239, 108282 (2019).
- Fox, M. D., et al. Limited coral mortality following acute thermal stress and widespread bleaching on palmyra atoll, central pacific. Coral Reefs. 38, 701-712 (2019).
- Charendoff, J. A., et al. Variability in composition of parrotfish bite scars across space and over time on a central pacific atoll. Coral Reefs. 42 (4), 905-918 (2023).
- Petrovic, V., Vanoni, D. J., Richter, A. M., Levy, T. E., Kuester, F. Visualizing high resolution three-dimensional and two-dimensional data of cultural heritage sites. Mediterr Archaeol Ar. 20 (10), 93-100 (2014).
- Noaa Coral Program. . National coral reef monitoring plan. NOAA Coral Reef Conservation Program. , (2021).
- Goergen, E. A., et al. Coral reef restoration monitoring guide: Methods to evaluate restoration success from local to ecosystem scales. NOAA Technical Memorandum NOS NCCOS. 279, (2020).
- Pavoni, G., et al. Taglab: Ai-assisted annotation for the fast and accurate semantic segmentation of coral reef orthoimages. J Field Robot. 39 (3), 246-262 (2022).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. . National coral reef monitoring program: Benthic complexity and urchin abundance at climate stations of the hawaiian archipelago since 2013. , (2016).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. . National Coral Reef monitoring program: Benthic percent cover derived from analysis of benthic images collected for climate stations across the hawaiian archipelago since 2013. , (2021).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. . National Coral Reef monitoring program: Stratified random surveys (strs) of coral demography (adult and juvenile corals) across the Hawaiian archipelago since 2013. , (2022).
- Couch, C. S., et al. Comparing coral colony surveys from in-water observations and structure-from-motion imagery shows low methodological bias. Front Mar Sci. 8, 647943 (2021).
- Barrera-Falcon, E., Rioja-Nieto, R., Hernández-Landa, R. C., Torres-Irineo, E. Comparison of standard Caribbean coral reef monitoring protocols and underwater digital photogrammetry to characterize hard coral species composition, abundance and cover. Front Mar Sci. 8, 722569 (2021).
- Carneiro, I. M., et al. Precision and accuracy of common coral reef sampling protocols revisited with photogrammetry. Mar Environ Res. 194, 106304 (2024).
- Curtis, J. S., Galvan, J. W., Primo, A., Osenberg, C. W., Stier, A. C. 3D photogrammetry improves measurement of growth and biodiversity patterns in branching corals. Coral Reefs. 42 (3), 623-627 (2023).
- Menna, F., Battisti, R., Nocerino, E., Remondino, F. Frog: A portable underwater mobile mapping system. Int Arch Photogramm Remote Sens Spat Inf Sci. 48, 295-302 (2023).
- Zhang, Y., Wang, Q., Shen, Y., He, B. An online path planning algorithm for autonomous marine geomorphological surveys based on AUV. Eng Appl Artif Intel. 118, 105548 (2023).
- Mccarthy, O. S., et al. Closing the gap between existing large-area imaging research and marine conservation needs. Conserv Biol. 38 (1), e14145 (2024).
- Pierce, J., Butler Iv, M. J., Rzhanov, Y., Lowell, K., Dijkstra, J. A. Classifying 3-D models of coral reefs using structure-from-motion and multi-view semantic segmentation. Front Mar Sci. 8, 706674 (2021).
- Runyan, H., et al. Automated 2D, 2.5 D, and 3D segmentation of coral reef pointclouds and orthoprojections. Front Robot AI. 9, 884317 (2022).
- Pavoni, G., Corsini, M., Pedersen, N., Petrovic, V., Cignoni, P. Challenges in the deep learning-based semantic segmentation of benthic communities from ortho-images. Appl Geomat. 13 (1), 131-146 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.
