Method Article
Coleta, Expansão e Diferenciação de Modelos Primários de Células Epiteliais Nasais Humanas para Quantificação da Frequência de Batimento de Cílios
Neste Artigo
Resumo
Este protocolo descreve a coleta, expansão e diferenciação de células epiteliais nasais para modelos de células epiteliais organotípicas das vias aéreas e quantificação da frequência de batimentos de cílios por meio de imagens de células vivas e scripts personalizados.
Resumo
Medidas da função dos cílios (frequência de batimento, padrão) foram estabelecidas como ferramentas diagnósticas para doenças respiratórias, como discinesia ciliar primária. No entanto, a aplicação mais ampla dessas técnicas é limitada pela extrema suscetibilidade da função ciliar a mudanças em fatores ambientais, por exemplo, temperatura, umidade e pH. Nas vias aéreas de pacientes com Fibrose Cística (FC), o acúmulo de muco impede o batimento dos cílios. A função dos cílios tem sido investigada em modelos celulares primários das vias aéreas como um indicador da atividade do canal CF Transmembrane conductance Regulator (CFTR). No entanto, uma considerável variabilidade de paciente para paciente na frequência de batimento de cílios foi encontrada em resposta a drogas moduladoras de CFTR, mesmo para pacientes com as mesmas mutações de CFTR . Além disso, o impacto da secreção disfuncional de cloreto regulado por CFTR na função ciliar é pouco compreendido. Atualmente, não existe um protocolo abrangente que demonstre a preparação de amostras de modelos de vias aéreas in vitro , a aquisição de imagens e a análise da frequência de batimento ciliar (CBF). Condições de cultura padronizadas e aquisição de imagens realizadas em uma condição ambientalmente controlada permitiriam quantificação consistente e reprodutível do FSC entre indivíduos e em resposta a drogas moduladoras de CFTR. Este protocolo descreve a quantificação do CBF em três diferentes sistemas de modelos de células epiteliais das vias aéreas: 1) folhas epiteliais nativas, 2) modelos de interface ar-líquido fotografados em pastilhas de suporte permeáveis e 3) organoides tridimensionais embutidos em matriz extracelular. Os dois últimos replicam a fisiologia pulmonar in vivo, com batimento de cílios e produção de muco. A função ciliar é capturada usando uma câmera de vídeo de alta velocidade em uma câmara controlada pelo ambiente. Scripts personalizados são usados para a análise do CBF. A tradução das medidas do CBF para a clínica é considerada uma importante ferramenta clínica para prever a resposta a medicamentos moduladores de CFTR por paciente.
Introdução
Medidas de frequência e padrão de batimento ciliar (CBF) têm sido estabelecidas como ferramentas diagnósticas para doenças respiratórias, como a discinesia ciliar primária (PCD)1. Na Fibrose Cística (FC), a disfunção do canal de cloreto do Regulador de Condutância Transmembrana Transmembrana da FC (CFTR) causa desidratação do líquido superficial das vias aéreas e comprometimento do clearance mucociliar2. A função ciliar tem sido investigada in vitro em modelos primários de células das vias aéreas como um indicador da atividade do canal CFTR3. No entanto, existe uma considerável variabilidade paciente-a-paciente no FSC em resposta a drogas moduladoras de CFTR, mesmo para pacientes com as mesmas mutações do CFTR 3. Além disso, o impacto da secreção disfuncional de cloreto regulado por CFTR na função ciliar é pouco compreendido. Atualmente, não há um protocolo abrangente que demonstre a preparação de amostras de modelos de vias aéreas in vitro , aquisição de imagens e análise de CBF.
Folhas epiteliais nasais isoladas de escovações da mucosa nasal são diretamente utilizadas para medidas da função ciliar para o diagnóstico de PCD4. No entanto, embora não haja controle sobre o tamanho ou a qualidade das folhas epiteliais nasais obtidas, o FSC varia dependendo se é medido em células únicas ou folhas celulares e em bordas ciliadas de folha epitelial que são interrompidas ou ininterruptas5. Dessa forma, discinesias secundárias causadas por danos às células durante a coleta de escovações da mucosa nasal podem influenciar o FSC. A cultura celular primária de células epiteliais nasais e sua diferenciação na Interface Ar-Líquido (LPA) ou na matriz tridimensional da membrana basal em organoides epiteliais das vias aéreas ciliadas dão origem a cílios livres de discinesias secundárias 4,6,7,8. As células epiteliais das vias aéreas diferenciadas na LPA (doravante denominadas modelos de LPA) têm sido consideradas um importante auxiliar diagnóstico secundário que replica os padrões de batimentos ciliares e a frequência de escovações ex vivo da mucosa nasal6 e permite a análise da ultraestrutura ciliar, padrão de batimento e frequência de batimentos, mantendo defeitos específicos do paciente9 . No entanto, existem discrepâncias nas metodologias usadas para criar esses modelos de células pseudoestratificadas e mucociliares diferenciadas. Diferentes protocolos de expansão ou diferenciação da cultura podem induzir fenótipos epiteliais distintos (ciliados ou secretores)10 e resultar em diferenças significativas no CBF11. O CBF foi quantificado em escovações epiteliais nasais 4,6,12,13,14,15,16, organoides epiteliais das vias aéreas 14,17,18 e modelos LPA 3,4,6,13,19,20, 21. No entanto, entre esses protocolos, existem grandes variabilidades e, muitas vezes, muitos parâmetros não são controlados. Por exemplo, em alguns estudos, o CBF é fotografado in situ enquanto as células do modelo LPA permanecem na inserção de suporte permeável 3,19,20,21, outras ainda raspam as células da inserção de suporte permeável e as fotografam suspensas em meio 4,6,13.
Além disso, a aplicação mais ampla de técnicas que medem a função ciliar é limitada pela extrema suscetibilidade da função ciliar a mudanças em fatores ambientais. Fatores ambientais como temperatura22, umidade 23,24 e pH25,26 influenciam a função ciliar e devem ser regulados para quantificar o FSC com precisão. Os diversos parâmetros fisiológicos utilizados em diferentes laboratórios e como eles influenciam o FSC já foram revisados anteriormente27.
Várias tecnologias de imagem e abordagens para medidas de CBF são relatadas na literatura. Para o diagnóstico de PCD, a videomicroscopia é utilizada para medir a função ciliar28,29. Recentemente, um algoritmo de videoanálise baseado em microscopia dinâmica diferencial foi utilizado para quantificar a coordenação do FSC e dos cílios em modelos de LPA de células epiteliais das vias aéreas 3,30. Este método permite a caracterização do batimento ciliar em células epiteliais das vias aéreas de forma rápida e totalmente automatizada, sem a necessidade de segmentar ou selecionar regiões. Vários métodos de imagem e quantificação do FSC podem se somar às diferenças relatadas no FSC na literatura (Arquivo Suplementar 1).
Um protocolo da cultura à quantificação para agilizar os métodos existentes, a padronização das condições de cultura e a aquisição de imagens, realizadas em condições rigorosas e ambientalmente controladas, permitiriam a quantificação consistente e reprodutível do CBF dentro e entre os indivíduos.
Este protocolo fornece uma descrição completa da coleção de células epiteliais, condições de cultura de expansão e diferenciação e quantificação do FSC em três diferentes sistemas de modelo de células epiteliais das vias aéreas de origem nasal: 1) folhas epiteliais nativas, 2) modelos de LPA fotografados em pastilhas de suporte permeável e 3) organoides tridimensionais embutidos na Matriz Extracelular (ECM) (Figura 1 ). As células epiteliais nasais obtidas a partir de escovações nasais de cornetos inferiores são utilizadas como representantes do epitélio das vias aéreas, uma vez que são um substituto eficaz para as células epiteliais brônquicas31, superando o procedimento invasivo associado à coleta de escovações brônquicas. O método Conditional Reprogramming Cell (CRC) é usado para expandir células epiteliais primárias das vias aéreas para a criação de modelos de LPA e organoides tridimensionais. A reprogramação condicional de células epiteliais das vias aéreas para um estado semelhante a células-tronco é induzida pela cocultura com o sistema de células alimentadoras de fibroblastos preso ao crescimento e inibidor da quinase associada a Rho (ROCK)32. É importante ressaltar que o método do CCR aumenta a duplicação populacional das células epiteliais das vias aéreas, mantendo seu potencial de diferenciação tecidual específico33,34. Em todos os modelos de células epiteliais das vias aéreas, a função ciliar é capturada em uma câmara de temperatura controlada usando uma câmera de vídeo de alta velocidade com configurações padronizadas de aquisição de imagem. Scripts personalizados são empregados para a quantificação do CBF.
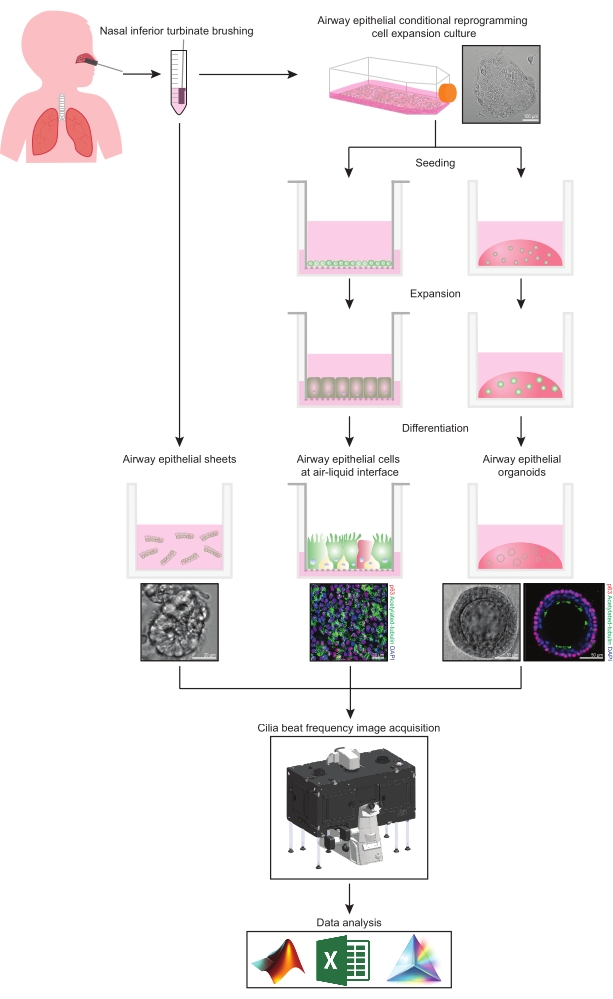
Figura 1: Esquema do fluxo de trabalho. Após a escovação do corneto nasal inferior dos participantes, as células epiteliais das vias aéreas são utilizadas de duas maneiras. Ou as folhas epiteliais das vias aéreas são isoladas e a frequência de batimento dos cílios é visualizada imediatamente, ou as células epiteliais das vias aéreas são expandidas através do método de células de reprogramação condicional. As células epiteliais das vias aéreas expandidas por CCR são diferenciadas para estabelecer células epiteliais das vias aéreas em uma interface ar-líquido ou culturas organoides epiteliais das vias aéreas. A imagem da frequência de batimentos ciliares é adquirida usando um microscópio de imagem de células vivas com uma câmara ambiental de aquecimento e umidade e uma câmera científica de taxa de quadros rápida (>100Hz). A análise de dados é realizada usando scripts personalizados. Por favor, clique aqui para ver uma versão maior desta figura.
Protocolo
A aprovação do estudo foi recebida do Conselho de Revisão de Ética da Rede de Hospitais Infantis de Sydney (HREC/16/SCHN/120). O consentimento por escrito foi obtido de todos os participantes (ou responsável dos participantes) antes da coleta dos bioespécimes.
1. Preparações para o estabelecimento de modelos de células epiteliais das vias aéreas
- Preparar meios de coleta de células nasais combinando 80% de Meio de Águia Modificado de Dulbecco e 20% de Soro Fetal Bovino. Suplemento com 1 μL/mL de Penicilina/Estreptomicina. Conservar a 4 °C durante um período máximo de 3 meses.
- Revestir os frascos ou as pastilhas de suporte permeáveis com solução de colagénio por necessidade, seguindo os passos 1.2.1-1.2.4. Não armazene vasos revestidos de colágeno a longo prazo.
- Fazer uma diluição 1:100 da solução de colágeno tipo I (estoque de 3 mg/mL) com solução salina tamponada com fosfato (PBS) até uma concentração final de 0,03 mg/mL. Misture bem.
- Revestir os frascos de cultura celular (secção 4) com 160 μL/cm 2 (ou seja, 4 ml por balão T25) e pastilhas de suporte permeáveis (secção 5) com 455 μL/cm2 (ou seja, 150 μL por inserção de 6,5 mm) da solução de colagénio preparada.
- Incubar a 37 °C durante 2-24 h.
- Remova a solução de colagénio por pipeta ou aspirador de vácuo antes de semear as células. Não lave o recipiente antes de semear as células.
- Prepare a mídia de Célula de Reprogramação Condicional (CRC) combinando os componentes32 listados na Tabela 1. Esterilize o filtro usando um sistema de filtro a vácuo com tampa de garrafa. Conservar a 4 °C durante um período máximo de 2 meses.
- No dia do uso, adicione o fator de crescimento epidérmico humano, o inibidor de ROCK e os antibióticos, conforme indicado na Tabela 1.
| Componente | Volume |
| DMEM, glicose elevada | 156,7 Ml |
| DMEM/F-12, HEPES | 313,3 Ml |
| Hidrocortisona | 55,6 μL |
| Insulina | 1,25 mL |
| Toxina da cólera | 21 μL |
| Adenina | 1,2 mL |
| HI-FBS | 25 mL |
| Penicilina-Estreptomicina | 5 mL |
| Fator de crescimento epidérmico humano | 1 μL/mL |
| Inibidor de ROCK | 1 μL/mL |
| Fungizona | 2 μl/ml |
| Tobramicina | 2 μL/mL |
| Ceftazidima hidratada | 4 μL/mL |
| Solução de gentamicina | 1 μL/mL |
Tabela 1: Componentes para 500 mL de meio celular de reprogramação condicional
2. Coleta de escovações nasais de cornetos inferiores
NOTA: Esta seção do protocolo requer um tubo de coleta (50 mL) com meios de coleta de células nasais, escovas de citologia, tecidos e equipamentos de proteção individual apropriados. Evite escovar durante uma infecção do trato respiratório superior. Há um pequeno risco de sangramento, que é aumentado se a inflamação estiver presente. Se o objetivo da escovação é obter folhas epiteliais das vias aéreas para medições ex vivo do CBF, a escovação deve ocorrer no mínimo 6 semanas após qualquer infecção respiratória superior; idealmente, mais de 10 semanas após a infecção35.
- Preparar o meio de recolha de células nasais (secção 1) e manter o tubo sobre gelo.
- Descreva o procedimento para o participante como desconfortável. Explique-lhes que uma sensação completa é sentida na narina durante a escovação, semelhante a pular no oceano/piscina e a água correndo para a passagem nasal. Aconselhe os participantes que o procedimento induzirá a produção de lágrimas como reflexo.
- Avalie qual posicionamento é apropriado para o participante. Coloque o participante em decúbito dorsal se um sofá de exame estiver disponível, uma vez que o posicionamento supino impede o movimento da cabeça do participante para longe da escova durante o procedimento. Alternativamente, coloque o participante ao lado de uma parede, contra a qual ele pode pressionar a cabeça para trás.
- Inspecione a passagem nasal. Observe o desvio septal, pólipos e quaisquer outras anormalidades anatômicas que possam afetar a passagem da escova na passagem nasal e aumentar o risco de sangramento.
- Limpe o nariz do excesso de muco, pedindo aos participantes para soprar o nariz em um tecido.
- Peça ao participante que respire pela boca. Pegue uma escova de citologia na mão dominante. Ao apoiar o quinto dígito no queixo do participante para ancorar a mão, insira o pincel de citologia na passagem nasal do participante (Figura 2). Insira o pincel a ~45° no rosto do participante para passar pelo meato nasal.
- Giregue o pincel na vertical para que fique perpendicular ao rosto do participante. Avance a escova suavemente, mas com firmeza, contra a parede lateral do nariz sob o corneto inferior até que esteja na parte média a posterior do corneto inferior.
NOTA: Evite a inserção excessiva; se uma queda súbita na resistência for sentida, a faringe nasal foi inserida e a escova deve ser retraída até que a resistência seja novamente sentida pelo proceduralista. - Gire a escova 360° até três vezes. Remova a escova suavemente no sentido inverso da manobra de inserção, para que as células não sejam desalojadas da escova.
- Coloque a escova no tubo de coleta preparado com meios de coleta de células nasais. Coloque o tubo de coleta no gelo.
- Repita a escovação na segunda narina se o participante estiver de acordo/for necessário um grande número de células (por exemplo, para iniciar a cultura celular).
NOTA: A mesma narina pode ser escovada novamente se não houver células sanguíneas visíveis na escova, observando, no entanto, que o risco de sangramento é ligeiramente aumentado com uma segunda escovação na mesma narina.
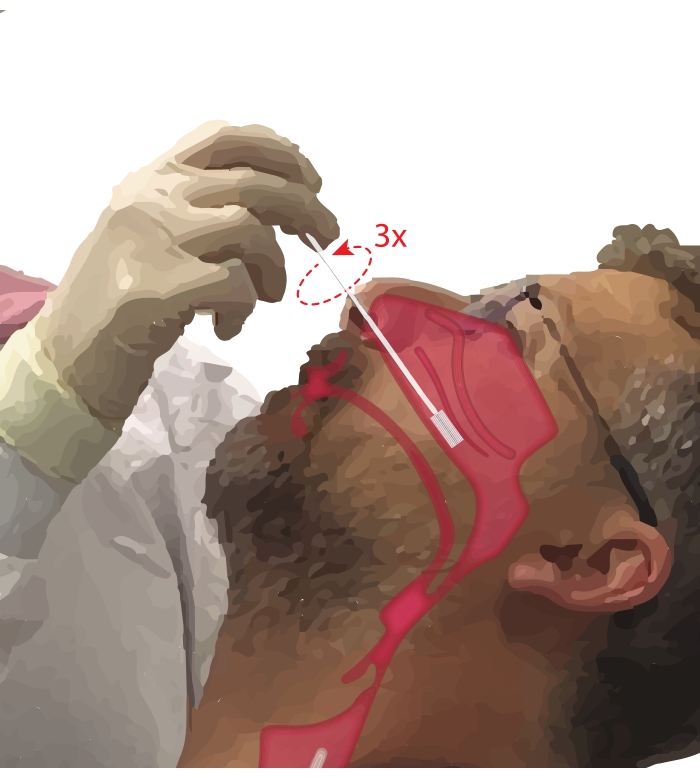
Figura 2: Coleção de células epiteliais nasais. Ilustração da localização da escova de citologia na parte média a posterior do corneto inferior. Esta posição é alcançada inserindo a escova através das narinas, girando a escova para um ângulo de 90° em relação à face e guiando a escova ao longo da passagem nasal abaixo do corneto inferior. Por favor, clique aqui para ver uma versão maior desta figura.
3. Preparação das folhas epiteliais das vias aéreas
NOTA: Esta seção do protocolo requer tubo de coleta (escova(s) de citologia + 1 mL de meio de coleta de células nasais) (seção 2) e placa de fundo plano de 96 poços. Se coletar escovações de cornetos nasais com a finalidade de imagem de folhas epiteliais das vias aéreas, use apenas 1 mL de meio de coleta de células nasais livre de antibióticos; caso contrário, as folhas epiteliais estarão muito dispersas para a imagem.
- Gire suavemente o tubo de coleta contendo a(s) escova(s) de citologia para desalojar as folhas epiteliais das vias aéreas da(s) escova(s).
- Colete todas as mídias e células com uma pipeta P1000. Dispense 5-6 gotas em um poço de uma placa de fundo plano de 96 poços. Repita por aproximadamente sete poços.
- Transfira a placa para o microscópio de acordo com o passo 7.1.4 e siga o restante da secção 7 para a frequência de batimento dos cílios da imagem.
- Imagem de folhas epiteliais (Figura 1) e não de células únicas desanexadas, uma vez que foi demonstrado que a função ciliar difere entre as folhas epiteliais e as células únicas não ligadas5.
4. Expansão e manutenção das células epiteliais das vias aéreas
- Cultura de expansão celular de reprogramação condicional epitelial das vias aéreas
NOTA: Vaso revestido com solução de colagénio (secção 1), Células alimentadoras embrionárias irradiadas de ratinhos (NIH-3T3), Célula de Reprogramação Condicional (CCR) (secção 1), Escova(s) de citologia em meios de recolha de células nasais (secção 2).- Células alimentadoras irradiadas em placas em recipiente(s) de cultura revestido(s) de solução de colagénio preparado(s) a uma densidade de semeadura de 8 000 células/cm2 pelo menos 2 h e não mais de 72 h antes da cocultura com células epiteliais das vias aéreas (ver36 para cultura de células de alimentação e irradiação).
- Transfira as células escovadas no tubo de coleta (escova(s) de citologia + meio de coleta de células nasais) para o vórtice no gelo. Em uma velocidade baixa, tubo de vórtice 10 s on, 10 s desligado (manter no gelo no meio) para desalojar as células da(s) escova(s). O vórtice vigoroso pode diminuir a viabilidade celular. Inspecione a(s) escova(s) para verificar se o muco ainda está aderido. Em caso afirmativo, repita o vórtice.
- Transfira o(s) tubo(s) no gelo de volta para o gabinete de biossegurança. Use uma pipeta sorológica para transferir o meio do tubo de coleta para um novo tubo (tubo B), deixando para trás as escovas de citologia. Tubo de centrífuga B a 300 × g durante 7 min a 4 °C.
- Retire o tubo B da centrífuga, descarte o sobrenadante. Se o muco estiver visível, lave o pellet com mais 5 mL de meio de coleta de células nasais e centrifugar novamente.
- Adicione 1 mL de meio de CCR para ressuspender o pellet celular no Tubo B. Usando uma pipeta sorológica de 5 mL, passe as células através de uma peneira celular colocada em cima de um tubo de 50 mL (Tubo C) em um movimento circular.
- Repita várias vezes para formar uma única suspensão de célula. Colete o meio residual do fundo da peneira e incorpore-o com o meio. Descarte a peneira de células.
- Usando uma pipeta sorológica de 5 mL, pegue 1 mL de meio do tubo C e transfira-o para um tubo de microcentrífuga.
- Tomar 10 μL desta suspensão celular e adicioná-la ao tubo de microcentrífuga pré-alicitado com 10 μL de azul de tripano. Misture bem e use imediatamente um contador de células automatizado para registrar a contagem e a viabilidade das células.
- Semeados as células epiteliais das vias aéreas no balão T25 pré-semeado com células alimentadoras irradiadas.
- Manutenção e dissociação das células epiteliais das vias aéreas
NOTA: O meio CRC deve ser aquecido a 37 °C, colocando-o num banho-maria de laboratório com temperatura controlada ou num dispositivo de banho de contas antes de ser adicionado às células.- Verifique as células sob o microscópio de cultura celular (4× lente objetiva) regularmente quanto à fixação, contaminação, morfologia e confluência.
- Mude a mídia CRC a cada dois dias. Quando forem observadas células reprogramadas (Figura 1) e não houver contaminação presente, reduza ou retire os antibióticos.
- Quando as células atingirem 90% de confluência, use um método de tripsina dupla32 para dissociar as células e realizar uma contagem de células, conforme descrito na etapa 4.1.8 (consulte o Arquivo Suplementar 2 para dissociação e congelamento celular).
5. Semeadura e diferenciação de células epiteliais das vias aéreas e manutenção de modelos diferenciados de LPA
- Semeando células epiteliais das vias aéreas para inserções de suporte permeáveis
- Transfira as pastilhas de suporte permeáveis revestidas com solução de colagénio (secção 1) da incubadora de CO2 para o armário de biossegurança. Aspirar a solução de colagénio e eliminar. Adicione um meio de expansão de 750 μL (isento de antibióticos) ao compartimento basal das pastilhas de suporte permeáveis.
- Transfira as células dissociadas ou células descongeladas no gelo para o gabinete de biossegurança. Adicione o volume de meio de expansão necessário para semear 200.000-250.000 células em 150 μL ao compartimento apical de cada inserção de suporte permeável.
- Ter cuidado para não criar bolhas; misture bem para garantir que as células sejam homogêneas e em suspensão. Adicionar 150 μL da suspensão celular ao lado apical de cada inserção de suporte permeável.
- Ressuspenda as células após a semeadura a cada três inserções de suporte permeáveis para manter uma suspensão celular homogênea.
- A cada dois dias até que uma monocamada de células confluentes seja formada (geralmente até o dia 4 pós-semeadura), descarte o meio e adicione um meio de expansão fresco aquecido à temperatura ambiente (RT, 15-25 °C).
- Diferenciação de células epiteliais das vias aéreas na interface ar-líquido
- Meios de LPA quentes (sem antibióticos) a RT (15-25 °C).
- Remova o meio de expansão e mude para o meio de diferenciação (LPA) nos compartimentos apical e basal.
- Após 2 dias de cultura em meios ALI submersos, aspirar e descartar os meios de comunicação.
- Adicione 750 μL de meio ALI ao compartimento basal apenas para criar uma interface ar-líquido.
NOTA: Se após 1 semana de cultura, a monocamada não for confluente e ainda forem observados furos, as células podem não ter mais a capacidade de se expandir para as regiões do vazio, considere o descarte das células epiteliais das vias aéreas.
- Manutenção do modelo diferenciado de LPA e remoção de muco
- Altere os meios apical e basal a cada dois dias até a diferenciação completa (dia 21-25 pós-estabelecimento de interface ar-líquido).
- Uma vez por semana, lave o muco do lado apical seguindo os passos 5.3.3-5.3.4.
- PBS quente a RT (15-25 °C).
- Adicionar 200 μL de PBS ao compartimento apical. Incubar na incubadora de CO2 por 10 min. Use um dispositivo de aspiração ou pipeta para remover o PBS.
6. Organoides epiteliais tridimensionais das vias aéreas
- Preparações para cultura de organoides epiteliais das vias aéreas
- Coloque a(s) placa(s) de 24 poços numa incubadora de CO2 para aquecer a 37 °C durante a noite.
- Descongele um frasco para injetáveis de 10 ml de ECM (Tabela de Materiais) no gelo de acordo com as instruções do fabricante. Prepare alíquotas de 500 μL (uso único) para minimizar o número de ciclos de congelamento-descongelamento.
NOTA: Recomenda-se o uso de ECM com concentração de proteína >10,5 mg/mL para os melhores resultados da cultura. Uma concentração mais baixa acelerará a desintegração da cúpula da ECM e aumentará a ocorrência de organoides voltados para fora apical. - Use o Kit de Organoides das Vias Aéreas (Tabela de Materiais) para preparar o Meios de Semeadura de Organoides das Vias Aéreas (AOSM) e os Meios de Diferenciação (AODM) de acordo com as instruções do fabricante.
- Preparar o meio basal organoide das vias aéreas de acordo com a Tabela 2.
| Componente | Volume |
| DMEM/F-12 avançado | 500 mL |
| HEPES | 5 mL |
| Alanil-glutamina | 5 mL |
| Penicilina-Estreptomicina | 5 mL |
Tabela 2: Componentes do meio basal organoide das vias aéreas
- Utilizar o número de células epiteliais vivas das vias aéreas dissociadas na secção 4.2 para calcular quantos poços podem ser semeados a uma densidade de semeadura de 10.000 células (ver Tabela 3).
- Calcule o volume total de ECM e AOSM necessário para criar 1 x 50 μL de cúpula de ECM de 90% (45 μL de ECM e 5 μL de AOSM) por poço.
NOTA: A densidade de semeadura recomendada de 10.000 células por poço é para células epiteliais nasais expandidas por CRC na passagem 1. Células de passagem posteriores podem exigir maior densidade de semeadura para alcançar a formação do mesmo número de organoides.
| Número de poços | Número de células | Número de cúpulas | Vol de Matrigel ECM | Vol de AOSM |
| 1 | 10.000 células | 1 | 45 μL x 1,1 | 5 μL x 1,1 |
| 2 | 20.000 células | 2 | 90 μL x 1,1 | 10 μL x 1,1 |
| 5 | 50.000 células | 5 | 225 μL x 1,1 | 25 μL x 1,1 |
| ......... | ......... Células | ......... | .........μL x 1,1 | .........μL x 1,1 |
Tabela 3: Cálculos para semeadura de células epiteliais das vias aéreas em cúpulas de MEC
- Semeadura de células epiteliais das vias aéreas em cúpulas de ECM
NOTA: Mantenha a ECM no gelo em todos os momentos e execute todas as etapas que envolvam a ECM no gelo, uma vez que a ECM começará a solidificar a temperaturas >10°C.- Ressuspender as células epiteliais das vias aéreas dissociadas na secção 4.2 com o volume calculado de 90% de ECM de acordo com a Tabela 3.
- Segurando a pipeta em um ângulo de 90° (vertical) o mais próximo possível do fundo do poço, dispense 50 μL (até a primeira parada para evitar a criação de bolhas) da suspensão da célula ECM no centro do poço. Evite tocar na parede do poço.
- Incubar a placa a 37 °C durante 20 minutos até à solidificação da MEC. Enquanto o ECM está se solidificando, aqueça o AOSM para RT (15-25 °C) para evitar que ele cause reliquificação e desintegração da cúpula do ECM após a adição.
- Adicione 500 μL de AOSM aquecido a cada poço, distribuindo a parede do poço. Não pipete a mídia diretamente para a cúpula ECM.
- Mude de mídia a cada 2 dias por 4-7 dias. Para aspirar o meio, incline a placa em um ângulo de 45° e aspirar da borda inferior do poço para longe da cúpula ECM.
- Após 4-7 dias, inicie a diferenciação organoide adicionando 500 μL de AODM (15-25 °C) a cada poço e mude de meio a cada 2 dias durante 7 dias.
- Replating de organoides epiteliais das vias aéreas no Dia 7 de diferenciação
NOTA: O replating de organoides epiteliais das vias aéreas é necessário porque a borda das cúpulas de ECM se desintegra gradualmente ao longo do período de cultura de 2 semanas. Os organoides epiteliais das vias aéreas na borda da cúpula podem ser perdidos (desalojados no meio) ou ter orientação apical-voltada para fora quando não totalmente incorporados na ECM. A etapa de replating também "limpa" a cúpula da ECM, removendo células / detritos que não formam organoides com sucesso.- Aspirar a mídia de cada poço. Adicione 500 μL de meio basal organoide das vias aéreas frias (doravante denominado meio basal) a cada poço.
- Use a pipeta P1000, pois esta ponta da pipeta tem o maior orifício e reduzirá a probabilidade de estourar organoides durante a pipetagem. Ajuste a pipeta para 350 μL para evitar a criação de bolhas e, em seguida, pipete para cima e para baixo suavemente para interromper a cúpula ECM em cada poço. Recolher todos os meios de ECM/basais num tubo de centrífuga de 15 ml.
- Enxaguar cada poço com 500 μL de meio basal frio. Recolher o meio basal contendo qualquer MEC e organoides remanescentes no mesmo tubo de centrífuga de 15 ml que acima.
- Centrífuga a 300 x g durante 5 min a 4 °C. Das três camadas visíveis após a centrifugação - (1) sobrenadante, (2) ECM contendo detritos celulares (fofos) e (3) pellets contendo organoides - descarte a camada sobrenadante e ECM e preserva o pellet organoide.
- Adicione 1 mL de meio basal frio ao pellet organoide e à pipeta para cima e para baixo suavemente para separar qualquer ECM restante. Adicione 6 mL de meio basal frio ao tubo e misture suavemente.
- Centrífuga a 300 × g durante 5 min a 4 °C. Descarte o sobrenadante.
- Se o excesso de ECM ainda estiver visível, repita as etapas 6.3.5- 6.3.6 para realizar outra lavagem.
- Ressuscite o pellet organoide com um volume apropriado de 90% de ECM (use AODM em vez de AOSM) para placa ~ 30 organoides por 50 μL da cúpula.
- Verifique a densidade de organoides sob o microscópio de cultura celular (lente objetiva 4x) após o revestimento da primeira cúpula. Se muito denso, adicione um adicional de 90% de ECM para atingir a densidade desejada de ~ 30 organoides.
- Siga os passos 6.2.3-6.2.4 para solidificar a MEC e alimentar as células a cada dois dias com 500 μL de AODM aquecido para cada poço por mais 14 dias até atingirem a maturidade (após 21 dias de diferenciação) com formação de lúmen cercado por epitélio pseudoestratificado voltado para dentro contendo células basais, células ciliadas e células caliciformes.
NOTA: Os organoides epiteliais das vias aéreas aqui descritos são terminalmente diferenciados e não podem ser passados ou criopreservedos.
7. Imageamento da frequência de batimento dos cílios
NOTA: Esta seção do protocolo requer um microscópio de imagem de células vivas com uma câmara ambiental de aquecimento e umidade, uma câmera científica de taxa de quadros rápida (>100 Hz), uma objetiva de longa distância de trabalho de 20x e software de imagem (consulte Tabela de Materiais para obter o equipamento recomendado usado neste protocolo).
- Configuração do microscópio
- Certifique-se de que o sistema de aquecimento do microscópio está ligado e equilibrado a 37 °C. Ligue o microscópio. Ajuste o gás para 5% de CO 2 através do misturador de gás CO2/ar.
- Recarregue a garrafa do módulo de umidade pela qual o CO2 passa com água purificada. Defina a umidade relativa para 85% através do controlador de topo do palco para que a água seja aquecida e as células sejam fornecidas com ar umidificado. Equilibre a câmara por 30 min.
- Coloque a inserção da placa do microscópio no suporte do microscópio.
- Transferir os modelos de células epiteliais das vias aéreas da incubadora para o microscópio em um bloco de calor ou esferas térmicas equilibradas a 37 °C para manter a amostra a uma temperatura fisiológica.
- Coloque a placa de cultura contendo os modelos de células epiteliais das vias aéreas na inserção da placa do microscópio. Feche a câmara ambiental do microscópio.
- Deixar a amostra equilibrar-se na câmara de microscópio pré-aquecida a 37 °C, 5% de CO2, cheia durante 30 minutos.
NOTA: Um tempo de equilíbrio mais curto pode ser suficiente. Isso pode ser determinado pela realização de um experimento para identificar o tempo necessário para a estabilização do FSC (consulte a Figura 3).

Figura 3: Estabilização da frequência do batimento ciliar em microscópio de imagem de células vivas. Gráficos de pontos da frequência média de batimento de cílios (CBF) em células epiteliais das vias aéreas na interface ar-líquido (modelos LPA) após transferência para um microscópio de imagem de células vivas com uma câmara ambiental. A câmara foi equilibrada e mantida a 37 °C, 5% de CO2 e umidade relativa de 85% por 30 min antes de abrir a porta da câmara e colocar a placa de cultura na inserção da placa do microscópio. Os modelos celulares foram fotografados por 60 min nos intervalos indicados. Os modelos de LPA foram derivados de dois participantes com FC. Seis imagens de campo de visão (FOV) foram adquiridas por modelo de LPA. Cada ponto (azul) representa a média do FSC em 12-36 imagens FOV. Os dados são representados como média ± MEV, com média conectada por uma linha pontilhada. A análise de variância unidirecional (ANOVA) foi utilizada para determinar as diferenças estatísticas. P < 0,0001, ns: sem significância. Por favor, clique aqui para ver uma versão maior desta figura.
- Durante o período de equilíbrio, no computador, abra o software de aquisição. Selecione a lente objetiva de longa distância de trabalho de 20x.
- Na ocular do microscópio, concentre-se no modelo celular (~Z = 8000 μm).
- Certifique-se de que o microscópio esteja configurado para iluminação Kohler de modo que os filamentos da lâmpada de fonte de luz de transmissão não estejam focados no plano da amostra, evitando artefatos na imagem. Para isso, siga as etapas 7.1.10-7.1.13
- Feche completamente o diafragma da íris de campo acima do condensador. Abra lentamente o diafragma da íris do campo e mova o condensador para cima/para baixo até que apareça uma forma de octógono.
- Se o diafragma da íris de campo não estiver alinhado (ou seja, o octógono não estiver no centro do campo de visão (FOV)), alinhe-o ao centro usando teclas Allen.
- Uma vez que o diafragma da íris de campo esteja alinhado, ajuste o foco do condensador para colocar o octógono em foco nítido.
- Abra o diafragma da íris de campo até que ele não possa mais ser visto dentro do FOV.
- Usando o software de aquisição, clique em L100 para alternar o caminho da luz para a porta onde a câmera está montada. Clique no botão verde play (Run) para visualizar o FOV do microscópio através do software. Verifique se os cílios estão em foco e ajuste, se necessário.
- Usando o software de aquisição, configure o microscópio com as seguintes configurações: Filtros: vazio; Condensador: vazio; Formato: sem binning; Tempo de exposição: 0.003 s; Modo de leitura: obturador rolante; ROI: 512 × 512 pixels.
NOTA: O tempo de exposição baseia-se na frequência mais elevada que tem de ser medida, uma vez que 1/tempo de exposição deve ser pelo menos o dobro desta frequência. Por exemplo, se a faixa fisiológica máxima de batimento de cílios = 30 Hz, então 1/tempo de exposição = 60, e o tempo de exposição devem ser ≤ 0,016 s. ROI depende das especificações da taxa de quadros da câmera. Selecione um ROI que capture taxas de quadros >100 Hz.
- Aquisição de imagens
- Para adquirir imagens de lapso de tempo no menu, clique em Adquirir e, em seguida, clique em Lapso de tempo rápido. Na janela pop-up, selecione um local de salvamento e um nome de arquivo. Adquira 1000 quadros.
- Clique em Aplicar. Clique no botão verde play (Run) para visualizar os cílios no FOV do microscópio e ajustar o foco Z, se necessário. Clique em Executar agora para capturar o lapso de tempo rápido.
- Uma vez que o lapso de tempo rápido tenha sido capturado, clique no botão de reprodução verde (Executar) para visualizar o FOV do microscópio. Usando o joystick do microscópio, mova-se ao longo do eixo X/Y para outro FOV.
- Ajuste o foco Z para colocar os cílios em foco. Clique em Executar agora para capturar outro lapso de tempo rápido.
- Repita as etapas 7.2.3-7.2.4. Para modelos de LPA e organoides das vias aéreas, a imagem 6x FOV em cada uma das amostras de replicação 3x. Para folhas epiteliais das vias aéreas, a imagem de um mínimo de 4x replicar imagens por participante.
8. Análise dos dados e quantificação do CBF
- Preparações para análise de dados
Observação : esta seção do protocolo requer scripts de análise personalizados (arquivo suplementar 3), arquivos de imagem bruta (adquiridos na seção 7.2), um software de computação e software de análise.- Instale o software de computação, de preferência a versão mais recente, no computador de análise. Certifique-se de que as caixas de ferramentas de software de computação padrão (elmat, ops, datafun, uitools, tipos de dados, iofun, iotools, audiovídeo) e as caixas de ferramentas de processamento de imagem e sinal estejam instaladas.
- Copie os scripts de análise personalizados 'BeatingCiliaBatchOMEfiles_JOVE.m' e 'LoadRawDataExportFilteredMovies_JOVE.m' e a pasta 'support scripts' para a unidade local do computador.
- No software de computação, clique na guia Início. Em seguida, clique em Set Path (Figura 4A-B).
- Na janela pop-up, clique em Add With Subfolders (Figura 4C). Em 'Caminho de pesquisa do MATLAB', selecione as pastas mostradas na Figura 4D e clique em Salvar e Fechar (Figura 4E-F).
- Confirme se os scripts de análise estão vinculados ao software de computação verificando se eles aparecem no painel esquerdo (Figura 4G).
- Transfira os arquivos de imagem raw (formato OME (ambiente de microscopia aberta)) adquiridos na seção 7.2 para a unidade local do computador.
Observação : exemplos de arquivos de imagem raw podem ser acessados em: https://doi-org.remotexs.ntu.edu.sg/10.6084/m9.figshare.16649878.v1.
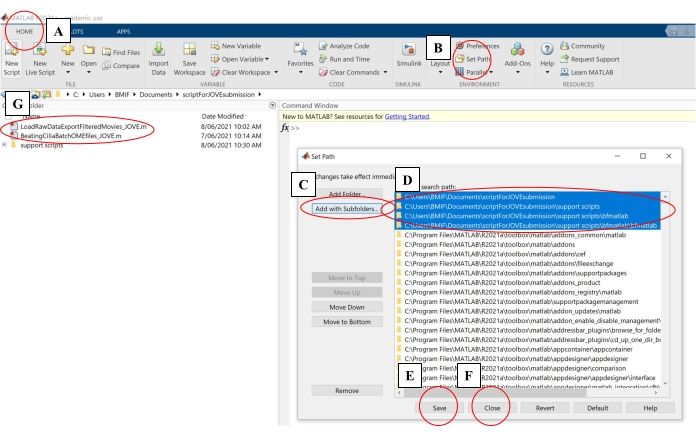
Figura 4: Configurando o software de computação para análise de dados. (A) Abra a guia Página Inicial . (B) Selecione Definir Caminho. (C) Selecione Adicionar com subpastas. (D) Selecione as pastas que contêm os scripts de análise. (E) Selecione Salvar. (F) Selecione Fechar. (G) Os scripts de análise aparecerão no painel esquerdo. Por favor, clique aqui para ver uma versão maior desta figura.
- Quantificação do CBF pela detecção de pico do espectro de intensidade de pixels únicos
- Abra o software de computação. Clique no arquivo de script de análise 'BeatingCiliaBatchOMEfiles_JOVE.m' (Figura 5A).
- Clique na guia Editor e, em seguida, clique no botão verde play (Run) para executar o script (Figura 5B-C). Na janela de prompt, selecione os arquivos de imagem raw a serem analisados (Figura 5D).
- Insira o tempo de exposição da etapa 7.1.15 na janela de solicitação de tempo de aquisição por período e, em seguida, clique em OK (Figura 5E).
- Aguarde ~ 15 min por arquivo enquanto o script calcula e produz o CBF no arquivo 'AveSpectrum' (Arquivo Suplementar 4), que é salvo automaticamente na mesma pasta que os arquivos de imagem brutos. Visualize o progresso por meio da barra de progresso (Figura 5F).
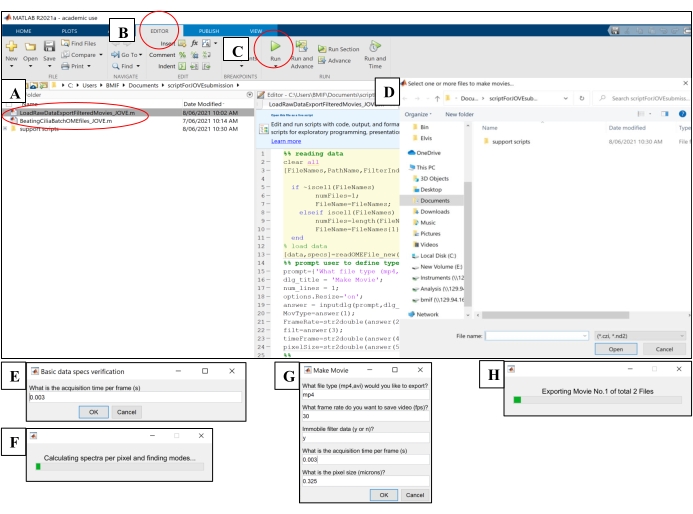
Figura 5: Execução de scripts de análise utilizando software de computação . (A) Abra o roteiro para análise de CBF ('BeatingCiliaBatchOMEfiles_JOVE.m') ou criação de filme de cilia beating ('LoadRawDataExportFilteredMovies_JOVE.m'). (B) Abra a guia Editor . (C) Selecione o botão verde play (Executar) para executar o script de análise. (D) Uma janela de prompt exigirá a seleção de arquivos para análise ou criação de filmes. (E) Ao executar o script 'BeatingCiliaBatchOMEfiles_JOVE.m', um prompt aparecerá para inserir manualmente o tempo de aquisição por período(s) caso o script de leitura de arquivos não leia os metadados corretamente. (F) Barra de progresso indicando a frequência de batimento dos cílios sendo calculada. (G) Ao executar o script 'LoadRawDataExportFilteredMovies_JOVE.m', um prompt aparecerá para inserir manualmente o tipo de filme a ser produzido (mp4 ou avi), a taxa de quadros do filme (fps), se o componente imóvel é removido dos dados do filme ('y' ou 'n'), o(s) tempo(s) do quadro e o tamanho do pixel (mícrons) dos dados exportados para o filme. Recomenda-se usar 'y' para filtragem imóvel, pois removerá o muco ou qualquer outra camada imóvel obstrutiva nos dados. (H) Barra de progresso para indicar o filme que está sendo exportado. Por favor, clique aqui para ver uma versão maior desta figura.
- Execute o script 'GetFirstAmplitude.m' na pasta que contém os arquivos 'AveSpectrum' usando o processo nas etapas 8.2.1-8.2.2. Aguarde até que o script produza o arquivo 'FirstAmplitudeStacked.xlsx', que contém a frequência que tem a maior amplitude e está dentro da faixa fisiológica de batimento dos cílios do epitélio das vias aéreas, ≥3 e <30 Hz.
- Copie os valores de frequência do arquivo 'FirstAmplitudeStacked.xlsx' e plote usando um software de análise científica.
Observação : uma explicação de como o script de análise personalizada quantifica CBF é fornecida no arquivo suplementar 5. Exemplos de conjuntos de dados analisados podem ser acessados em: https://doi-org.remotexs.ntu.edu.sg/10.6084/m9.figshare.16649815.
- Exportando um vídeo de cílios batendo
- Abra o software de computação. Clique no arquivo de script 'LoadRawDataExportFilteredMovies_JOVE.m' (Figura 5A) para carregar o script.
- Clique na guia Editor e, em seguida, clique no botão verde play (Run) para executar o script (Figura 5C). Na janela de prompt, selecione os arquivos de imagem raw a serem exportados para arquivos de filme (Figura 5D).
- Insira as configurações detalhadas na Tabela 4 na janela pop-up 'Make Movie' (Figura 5G).
- Aguarde ~ 8 min por arquivo enquanto o script cria os arquivos de filme e os envia para o local dos arquivos de imagem brutos. Visualize o progresso através da barra de progresso (Figura 5H).
| Entradas de filme | Descrição |
| Tipo de arquivo | Insira o tipo de arquivo que você gostaria de exportar (mp4 ou avi). |
| Taxa de quadros | Insira a taxa de quadros na qual o filme deve ser exportado. Se você tiver ~ 1000 quadros por série temporal adquirida, recomenda-se definir a taxa de quadros ~ 30 fps. |
| Filtragem imóvel | As opções são 'y' ou 'n'. O padrão é 'y', e o script de filtragem de tempo remove, usando o espaço de Fourier, todos os componentes imóveis dos dados do filme. Normalmente, quaisquer camadas de células sob cílios ou muco imóvel contribuirão com um componente de deslocamento de frequência zero ou componente invariante de tempo no sinal que pode ser filtrado. |
| Tempo de aquisição por período | O tempo de aquisição por período de dados adquiridos. Ele é usado para exibir um carimbo de data/hora no filme em segundos. |
| Tamanho do pixel | O tamanho do pixel em micrômetros é usado para exibir uma barra de escala no filme em micrômetros. |
Tabela 4: Configurações de entrada para criação de filmes
Resultados
Para demonstrar a eficiência deste protocolo na quantificação do FSC, são apresentados os resultados do FSC medido em modelos de LPA de células epiteliais das vias aéreas derivados de três participantes com FC e três participantes controles saudáveis. No 14º dia de diferenciação cultural, os cílios batedores estavam presentes (Figura 6). Do 14º ao 21º dia de diferenciação cultural, observou-se um aumento estatisticamente significativo (P < 0,0345) no FSC em ambas as coortes. No Dia 21 de diferenciação cultural, a média do FSC para participantes controles saudáveis (7,61 ± 0,11 Hz) foi significativamente maior do que a dos participantes com FC (6,75 ± 0,17 Hz). Para entender até que ponto o acúmulo e a remoção de muco afetam o CBF, o CBF foi fotografado nos mesmos modelos celulares após a remoção do muco. Nos modelos de LPA tanto de indivíduos saudáveis quanto daqueles com FC, houve um aumento estatisticamente significativo (P < 0,0001) no FSC quando o muco foi removido (Figura 6).
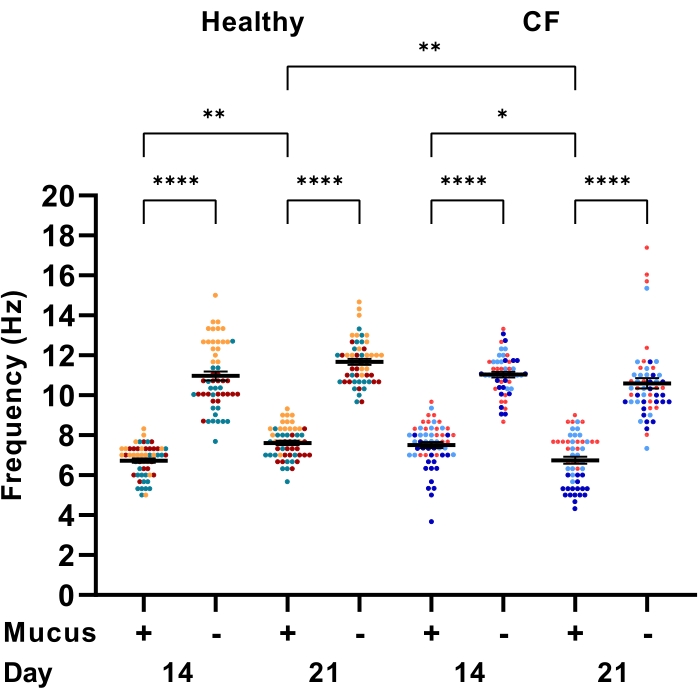
Figura 6: Efeito da remoção de muco na frequência de batimento dos cílios. Gráficos de pontos da frequência média de batimentos de cílios (CBF) em células epiteliais das vias aéreas na interface ar-líquido (modelos LPA), adquiriram lavagem pré e pós-muco nos dias 14 e 21 de diferenciação da cultura. O washout mucoso foi realizado por lavagem da superfície celular apical com 200 μL de PBS aquecido. Os modelos de LPA foram derivados de participantes saudáveis (n=3) e participantes com FC (n=3). Os dados são representados como média ± EPM. Cada ponto representa uma única imagem de campo de visão. Seis imagens de campo de visão foram adquiridas em três modelos replicados de LPA. Cada participante é codificado com uma cor diferente. A análise de variância unidirecional (ANOVA) foi utilizada para determinar as diferenças estatísticas. P < 0,0001, ** P < 0,01, * P < 0,05. Por favor, clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Resumo de 18 publicações mostrando a diversidade de parâmetros de cultura e imagem de células vivas utilizados para quantificar a frequência de batimentos ciliares em modelos organotípicos do epitélio das vias aéreas. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Dissociação de células epiteliais das vias aéreas para diferenciação ou criopreservação Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: Scripts de análise personalizados Clique aqui para baixar este arquivo.
Arquivo Suplementar 4: Arquivos de dados gerados pelo script de análise Clique aqui para baixar este arquivo.
Arquivo Suplementar 5: Descrição do algoritmo de análise do CBF Clique aqui para baixar este Arquivo.
Discussão
Existem múltiplos fatores que podem obscurecer a quantificação do FSC nas folhas epiteliais nasais. As folhas epiteliais devem ser fotografadas dentro de 3-9 horas após a coleta da amostra, uma vez que a função ciliar é mais estável durante esse período37. Menos glóbulos vermelhos e detritos são mais ideais para imagens, uma vez que interferem na aquisição de dados. Ao selecionar um ROI para exames de imagem, é importante selecionar uma folha epitelial que não tenha sido danificada ou interrompida durante a coleta da amostra, e não uma única célula epitelial desanexada, uma vez que essas variáveis demonstraram influenciar o CBF5. Também é necessário que a folha epitelial seja estacionária, pois os movimentos podem obscurecer a aquisição de dados. As folhas epiteliais em meios muitas vezes orientam-se em direções diferentes27. Uma vez que já foi demonstrado anteriormente que variâncias na qualidade da amostra, como bordas epiteliais rompidas, impactam o CBF5, é provável que a orientação da folha epitelial também possa influenciar o CBF. Uma limitação deste protocolo é que o impacto da orientação da folha epitelial não foi avaliado. Espera-se que esta seja uma importante área de estudo para uma maior padronização.
Modelos maduros de LPA apresentam epitélio pseudoestratificado com a presença de células caliciformes que produzem muco34. A abundância e a viscosidade do muco impactam a função ciliar 2,38. Recentemente, demonstrou-se que a remoção do muco acumulado dos modelos de células de LPA epitelial nasal causou um aumento no FSC3. Um processo cíclico foi descrito, em que a regeneração do muco durante um período de 24 horas comprometeu o FSC até que o muco fosse removido e o FSC aumentasse novamente. Para demonstrar que a repetibilidade das medidas do FSC depende da regulação do ambiente fisiológico dos cílios, avaliou-se o impacto da remoção do muco no FSC. Uma alteração estatisticamente significativa de 3,5 Hz no CBF foi observada após a remoção do muco. Em comparação com esses resultados, um estudo recente testando a resposta dos cílios a compostos moduladores de CFTR3 relatou uma mudança no CBF não maior do que a causada pela remoção de muco em nosso sistema modelo. Isso enfatiza a importância de regular as variáveis ambientais que influenciam o FSC, especialmente para que esse sistema modelo seja estabelecido como uma plataforma para estudar a resposta específica do paciente aos tratamentos no futuro. Dessa forma, recomenda-se ser consistente na remoção ou não do muco antes da imagem, a fim de controlar a influência dessa variável ambiental nas quantificações do CBF.
A temperatura é o fator dominante que causa flutuações no FSC. Os cílios já demonstraram ser sensíveis a flutuações na temperatura fisiológica em cortes pulmonares de camundongos e biópsias nasais 39,40. Como tal, é fundamental observar etapas que minimizem as flutuações de temperatura ambiental ao manusear amostras para aquisição de imagens e garantir que as células sejam estabilizadas na câmara do microscópio de 37 °C antes da imagem. Ao fazer a imagem dos cílios, os cílios devem entrar em foco logo acima da monocamada celular. Se o batimento dos cílios não for observável via microscopia óptica, a remoção do muco acumulado por lavagem com PBS aquecido pode aumentar o batimento dos cílios, uma vez que se sabe que o muco obstrui o batimento dos cílios3. Outra situação subótima será se houver um movimento de muco sobre as células, pois isso obstruirá a aquisição de dados. Uma solução seria selecionar um ROI sem o movimento visível do muco. No entanto, na situação em que isso é inevitável, recomenda-se a remoção do muco por lavagem.
Uma ressalva importante a considerar é selecionar uma câmera apropriada e uma lente objetiva para cumprir a amostragem temporal e espacial de Nyquist. A lente de longa distância de trabalho empregada neste protocolo de estudo permite capturar um campo de visão relativamente grande. Isso permite que o CBF seja fotografado em culturas ALI intactas, com uma resolução espacial de ~500 nm (NA0,45). Como tal, o feixe ciliar pode ser resolvido espacialmente. No entanto, uma limitação deste protocolo é que todo o modelo ALI não pode ser fotografado em uma resolução passível de análise. Como resultado, um ROI deve ser selecionado para aquisição de dados. Para limitar o viés associado à seleção de um ROI, recomenda-se que seis ROIs sejam selecionados de diferentes zonas dentro de cada inserção de suporte permeável. Isso é importante, pois já foi demonstrado anteriormente que os cílios não batem de forma síncrona dentro de uma amostra, e o FSC varia entre diferentes bordas e ROI16,41, o que implica que diferentes ROIs provavelmente têm diferentes valores médios de CBF. Além disso, é essencial ter acesso a câmeras de velocidade rápida com uma taxa de quadros de pelo menos 100 Hz para que qualquer evento temporal que aconteça a uma taxa de 50 Hz possa ser resolvido pelo critério de amostragem de Nyquist. Recomenda-se uma câmera sCMOS rápida com ruído extremamente baixo, permitindo a medição de molécula única. No entanto, este protocolo não é limitado pelo uso deste tipo de câmera, desde que a câmera atenda aos requisitos de amostragem temporal e capture as flutuações de intensidade de pixels resultantes do batimento ciliar.
Divulgações
Os autores declaram que não têm nada a revelar.
Agradecimentos
Agradecemos aos participantes do estudo e suas famílias por suas contribuições. Agradecemos a assistência do departamento respiratório de Randwick do Sydney Children's Hospitals (SCH) na organização e coleta de bioespécimes de pacientes - agradecimentos especiais ao Dr. John Widger, Dr. Yvonne Belessis, Leanne Plush, Amanda Thompson e Rhonda Bell. Reconhecemos a assistência de Iveta Slapetova e Renee Whan da Instalação de Microscopia de Luz Katharina Gaus dentro do Centro Analítico Mark Wainwright da UNSW Sydney. Este trabalho é apoiado pelo Conselho Nacional de Saúde e Pesquisa Médica (NHMRC) Austrália (GNT1188987), CF Foundation Austrália e Sydney Children's Hospital Foundation. Os autores agradecem à Luminesce Alliance - Innovation for Children's Health por sua contribuição e apoio. A Luminesce Alliance - Innovation for Children's Health é uma joint venture cooperativa sem fins lucrativos entre a Sydney Children's Hospitals Network, o Children's Medical Research Institute e o Children's Cancer Institute. Foi estabelecido com o apoio do governo de NSW para coordenar e integrar a pesquisa pediátrica. A Luminesce Alliance também é afiliada à Universidade de Sydney e à Universidade de Nova Gales do Sul de Sydney. A KMA é apoiada por uma bolsa de estudos do Programa de Treinamento em Pesquisa do Governo Australiano. A LKF é apoiada pelo Rotary Club de Sydney Cove/Sydney Children's Hospital Foundation e pelas bolsas de pós-graduação da UNSW University.
Materiais
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
Referências
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados