Method Article
Capturando a molécula pequena comunicação entre os tecidos e células usando a imagem latente de espectrometria de massa
Neste Artigo
Resumo
Um novo método de preparação da amostra foi desenvolvido para acomodar coculture célula e tecido para detectar a troca de pequena molécula usando espectrometria de massa de imagens.
Resumo
Espectrometria de massa (IMS) de imagem rotineiramente aplicou-se a três tipos de amostras: cortes histologicos, esferoides e colónias microbianas. Estes tipos de amostra foram analisados usando laser assistida por matriz dessorção/ionização tempo-de-voo espectrometria de massa (MALDI-TOF-MS) para visualizar a distribuição de proteínas, lípidos e metabolitos em toda a amostra biológica de interesse. Nós desenvolvemos um método de preparação de amostra romance que combina os pontos fortes das três aplicações anteriores para abordar uma abordagem underexplored para identificar a comunicação química em câncer, por semeadura de culturas de células de mamíferos em agarose em coculture com tecidos saudáveis, seguidos por dessecação da amostra. Células e tecidos de mamíferos são cocultured nas proximidades, permitindo a comunicação química via difusão entre os tecidos e células. Em pontos específicos de tempo, a amostra com base em agarose é seco da mesma maneira como colónias microbianas preparado para análise IMS. Nosso método foi desenvolvido para modelar a comunicação entre o câncer de ovário serosa da classe elevada, derivado de Falópio como ele interage com o ovário durante a metástase. Otimização da preparação amostra resultou na identificação de norepinefrina como um componente químico chave no microambiente do ovário. Esse método recentemente desenvolvido pode ser aplicado a outros sistemas biológicos que exigem uma compreensão da comunicação química entre células adjacentes ou tecidos.
Introdução
Imagem de espectrometria de massa (IMS) foi otimizado para caracterizar a distribuição espacial das características moleculares em três aplicações: fatias de tecido, esferoides e colónias microbianas1,2,3. Fatias de tecido podem ser usadas para avaliar a localização de metabólitos no contexto de condições biológicas em um host, ou alvo ou segmentados em um intervalo específico de massa. No entanto, diferenças entre características moleculares são as mais significativas e óbvio quando um tecido saudável é comparado a uma condição de doente, por exemplo, um tumor. Esta abordagem IMS é particularmente adaptada para detecção de biomarcadores da doença, no entanto, adquirir amostras de tecido em fases distintas na progressão da doença (tais como notas de tumor) opõe-se à identificação dos sinais que pode ser importante para a iniciação do doença. O intercâmbio de informações através do espaço é uma característica onipresente de muitos sistemas biológicos, e fatias de tecido não podem capturar este relé químico dinâmico. Uma técnica que é capaz de visualizar a difusão e a troca química é IMS das colónias microbianas cultivadas em placas de ágar; pequenas moléculas são capazes de difundir através de e através do ágar-ágar e podem ser capturadas através do laser assistida por matriz (MALDI-TOF) de dessorção/ionização espectrometria de massa4. Esta configuração de crescimento pode ser usada para identificar moléculas trocadas entre entidades biológicas distintas (colônias) e também pode determinar a direção de produção do metabólito. A plataforma originalmente projetada para o crescimento da colônia microbiana foi adaptada para explorar o metabolismo primário de tecido explantes cultivados com células de mamíferos, e IMS foi utilizado para avaliar a dinâmica troca de química em um sistema de mamíferos in vitro.
Nos últimos anos, tornou-se claro que o câncer de ovário serosa de alto grau (HGSOC) muitas vezes se origina no epitélio da trompa de Falópio (FTE) e então metastatiza para o ovário durante cedo doença desenvolvimento5,6, 7 , 8. a razão que FTE oncogenicidade células se espalhou para o ovário, onde grandes tumores eventualmente formam e metastatizam ainda mais, é atualmente incerto. A pesquisa anterior centrou-se sobre o papel das proteínas ovarianos primária metástases para o ovário; no entanto, recentemente demonstrou que a transição de um saudável para um tecido oncogenicidade resulta em enormes perturbações do metabolismo celular e altera a produção de pequenas moléculas9,10,11. Portanto, formulamos a hipótese que pequenas moléculas trocadas entre o ETI e o ovário podem ser parcialmente responsáveis por metástase de primário de HGSOC.
Usando nosso procedimento IMS recém-desenvolvido, determinamos que coculture de FTE oncogenicidade e tecido ovariano induz a produção de norepinefrina do ovário. No entanto, outros tipos de célula ou células FTE normais não provocam este efeito. Um extraordinário benefício desse método é que a produção molecular e troca de sinais que representam moléculas reais podem ser visualizados, assim, mesmo em um coculture é possível determinar a fonte do sinal. Esta é uma vantagem com a análise de amostras homogeneizadas, onde todas as informações espaciais são perdidas. Em nosso sistema de modelo, conseguimos atribuir claramente a produção de noradrenalina para o ovário. A noradrenalina tem sido associada à metástase e chemoresistance de câncer de ovário, e nossa detecção desta molécula validou que o novo método IMS pode descobrir moléculas biologicamente relevantes12,13, 14. esta validação permite-nos propor que esta nova aplicação do IMS pode ser particularmente útil para a investigação de grupos que estão tentando identificar moléculas pequenas em ambientes coculture e entender os primeiros eventos que influenciam a transformação de células e metástase. O objectivo geral deste método é elucidar a identidade e a distribuição espacial de pequenas moléculas durante o intercâmbio entre os tecidos e órgãos, representados por em vitro culturas de células 3D ou tecido ex vivo .
Protocolo
Todos os procedimentos de animais estavam em conformidade com a institutos nacionais de saúde orientações para o cuidado e o uso de animais de laboratório e aprovaram pelo Comitê de uso institucional do Animal e cuidados (IACUC) na Universidade de Illinois em Chicago.
1. preparação dos reagentes
- Manter células de epitélio ovidutária murino (MOE) a 37° C com 5% CO2 em uma incubadora umidificada no alfa mídia meio essencial mínimo (αMEM), suplementada com 10% de soro fetal bovino selênio (FBS), 2 mM L-glutamina, insulina 10 mg/mL, transferrina, (ITS) , ng/mL 1.8 fator de crescimento epidérmico (EGF), 100 U/mL penicilina-estreptomicina, gentamicina 1 mg/mL e 18.2 ng/mL estradiol-17 β. Passe as células a cada 3-4 dias, garantindo que existem células suficientes no mesmo dia os ratos vão ser sacrificados.
- Prepare a agarose 2% misturando-se 1 g de agarose de baixo ponto de fusão com 50 mL de água destilada. Autoclave o agarose, deixar arrefecer, e então alíquota (1 mL) em 2 mL de tubos (ver Tabela de materiais) antes de agarose solidifica. Agarose pode ser armazenado a-20 º C por tempo indeterminado.
- Prepare pelo menos 2 mL de médio (DMEM) meios de comunicação modificado águia de 1 x Dulbecco.
- Para a matriz para MALDI-TOF MS, prepare-se 10 mL de 5 mg/mL ácido alfa-ciano-4-hyroxycinnamic de 1:1 (CHCA): ácido benzoico (DHB) (ver Tabela de materiais) em 90:10 ACN:H2O + 0,1% o ácido trifluoroacético (TFA). Proceda à sonicação solução até matriz é dissolvido.
2. mouse colônia e remoção do ovário
- Manter casais reprodutores de camundongos CD-1 usando procedimentos padrão de habitação. Perto do dia do parto, verificar os ratos todos os dias para que a idade dos filhotes é conhecida.
- Eutanásia em filhotes com 16 – 18 dias de idade por inalação de CO2 por diretrizes do NIH. Entregar o CO2 (100%) em um fluxo taxa de 10%-20% volume por minuto de câmara e continuar durante dois minutos depois de respiração parou. Confirme a eutanásia por deslocamento cervical.
- Desinfecte todos os equipamentos cirúrgicos submergindo em etanol a 70%. Aquecer L-15 meios de comunicação a Leibovitz com 1 x penicilina-estreptomicina 37 ° c.
- Molhe a superfície abdominal com etanol a 70% para desinfetar a área e minimizar a contaminação com cabelo. Alcance a pele que cobre a parede abdominal usando romba fórceps e uso tesoura cirúrgica tornar-se uma grande forma de V corte através da pele e a parede abdominal, expondo os órgãos internos.
- Mova os órgãos internos para o lado usando fórceps. Individualmente agarrar cada corno uterino com uma pinça fina e levante ligeiramente.
- Localize o ovário, que será no final do corno uterino, imediatamente abaixo do rim. Use uma tesoura cirúrgica para dissecar o ovário livre de tecido conjuntivo. Em seguida, corte a trompa ovário ao meio.
- Mover o ovário, oviduto e aproximadamente uma metade de cada corno uterino para mídia de L-15 do Leibovitz previamente aquecido.
- Sob um microscópio dissecar cuidadosamente mover cada ovário de bursa circundante, libertando-o do oviduto, bursa e qualquer tecido adiposo. Mover-se para um novo prato de mídia do L-15 do Leibovitz cada ovário.
- Corte cada ovário ao meio axialmente. Manter as peças no ovário (agora chamadas de explantes) mantidas a 37 ° C até chapeamento de agarose.
3. criação e incubando o Slide ITO-tratada para Cocultures
-
Cocultures indivisos
- Dissolver o agarose a 70 ° C, em um prato quente.
- Coloque o divisor 8 poços em cima tinoxide o índio (ITO)-slide tratada (figura 1A). O fundo de borracha na linha divisória auxilia na adesão ao slide, mas certifique-se de aplicar uma pressão descendente suave contínua durante chapeamento de agarose para garantir que nenhum escape ou mistura entre poços.
- Recolher pilhas em um tubo cônico de 15 mL, centrifugador (5 min a 800 rpm) e ressuspender a 50 mil células por 150 µ l em 1 x DMEM de mídia. Se uma densidade de célula diferente é ideal, certifique-se que nesta etapa a suspensão celular é 2x a densidade final desejada (por exemplo, para uma concentração final de 50.000 células em 300 µ l, densidade celular neste passo é 50.000 células em 150 µ l).
- Antes do chapeamento cultura celular, adicionar explante ovário ao centro do poço (figura 1B).
- Adicione agarose para cada cultura de células em tubos individuais 2ml antes do chapeamento. Para cada poço, combine 200 µ l de suspensão de células e 200 µ l de agarose liquefeito em um tubo de 2 mL. Por exemplo, para quatro poços, combine 800 µ l de suspensão de células e 800 µ l de agarose 2%. Uma mistura ficarão sobre, mas fazendo um pouco mais do que necessário evita bolhas de ar durante a pipetagem.
- Adicione agarose para culturas de células individuais, imediatamente antes do chapeamento essa cultura de célula. A agarose será legal em menos de um minuto, então esteja preparado para placa rapidamente.
- Imediatamente adicione 300 µ l da mistura de célula/agarose a cada poço (Figura 1). A Figura 1 mostra três condições de célula e a condição de uma mídia, que cada um chapeado com e sem um ovário.
- Incube o slide em 37 ° C e 5% CO2 em uma incubadora umidificada.
-
Cocultures divididas.
- Corte os divisores de plástico fino, liso (Figura 2A).
Nota: Esta experiência usa os lados de uma bacia de mídia descartável estéril, porque eles são lisos e finos. Cortá-los só larga o suficiente para se encaixar confortavelmente a hipotenusa do poço (~ 13 mm). - Dissolver o agarose a 70 ° C, em um prato quente.
- Coloque o divisor 8-bem em cima do slide ITO-tratada (Figura 2B). O fundo de borracha na linha divisória auxilia na adesão ao slide, mas certifique-se de aplicar uma pressão descendente suave contínua durante chapeamento de agarose para garantir que nenhum escape ou mistura entre poços.
- Recolher pilhas em um tubo cônico de 15 mL, centrifugador (5 min a 800 rpm) e ressuspender a 50 mil células por 150 µ l em 1 x DMEM de mídia. Se uma densidade de célula diferente é ideal, certifique-se que, neste passo, a suspensão de células é 2 x a densidade final desejado (por exemplo, para uma concentração final de 50.000 células em 300 µ l, densidade celular neste passo é 50.000 células em 150 µ l).
- Inserir divisores de plástico na diagonal em poços (Figura 2).
- Adicione agarose à cada suspensão de células um uma hora antes do chapeamento. Para cada poço, combinam-se 100 µ l de suspensão de células e 100 µ l de agarose liquefeito em um tubo de 2 mL. Por exemplo, para quatro poços, combine 400 µ l de cultura celular e 400 µ l de agarose 2%. Uma mistura de célula/agarose ficarão sobre mas fazendo um pouco mais do que necessário evita bolhas de ar durante a pipetagem.
- Adicione agarose para culturas de células individuais, imediatamente antes do chapeamento essa cultura de célula. A agarose será legal em menos de um minuto, então esteja preparado para placa rapidamente.
- De um lado da linha divisória, placa 150 µ l de mistura de célula/agarose. Permitir que a agarose esfriar e solidificar (cerca de um minuto) e em seguida retire o divisor (Figura 2D).
- Coloque o ovário explante no centro da metade vazia do poço. Mistura de mídia/agarose lugar 150 µ l sobre a parte superior do ovário e apenas no lado correto do poço (Figura 2E).
- Incube o slide em 37 ° C e 5% CO2 em uma incubadora umidificada.
- Corte os divisores de plástico fino, liso (Figura 2A).
4. Slide de secagem e preparação para MALDI-TOF-MS
- Depois de quatro dias (ou qualquer ponto do tempo preferido), retire o divisor de câmara os plugues de agarose e o slide (Figura 1). Suavemente retire os lados do agarose da câmara com uma espátula plana e puxe suavemente a câmara para cima, tomando cuidado para não mover qualquer plugue de agarose. Se movem, suavemente, substituí-los para que eles não estão tocando um ao outro.
- Coloque o slide em um forno de 37 ° C por aproximadamente 4h, girar 90° cada h.
Nota: A rotação do slide é importante para garantir a distribuição de calor mesmo por toda a amostra. - Depois de seco, retire a lâmina do forno (Figura 1E).
- Aplique a solução de matriz usando o pulverizador (Figura 1F), com os seguintes parâmetros: temperatura = 30 ° C, vazão = 0,2 mL/min, o número de passes = 8, direção = CC e distância do bocal = 40 mm.
Nota: Em vez de um pulverizador de matriz, um aerógrafo artístico pode ser usado para aplicar líquido matriz. A mesma solução de matriz pode ser usada para pulverizar, mas aproximadamente duas vezes mais solução é necessária. Com o slide pinçado para que pendura-se verticalmente, pulverizar o slide de um ângulo de 90° de aproximadamente um pé de distância (adaptado de Hoffmann15) até a matriz de camada é visível. - Adicione 1 µ l de calibrant (fósforo vermelho para alvos < 500 promotora, uma mistura de peptídeo (ver Tabela de materiais) para alvos < Da 5.000) para claro local no slide. Fósforo vermelho não requer nenhuma mistura com matrix, mas a mistura de peptídeo requer mistura 1:1 com matriz para ionização de auxílio. Espere por calibrant secar.
- Desenhar um X usando um marcador permanente em cada canto do slide e levar uma imagem óptica usando um scanner ou uma câmera em 1.200 dpi.
5. imagem latente de aquisição de dados de espectrometria de massa
- Abra uma nova sequência sobre o software de análise de dados IMS (ver Tabela de materiais). Defina a largura de varredura para resolução espacial desejada, pelo menos 50 µm.
- Carregar a imagem ótica do slide para o software de análise e definidos três ensinam pontos usando as interseções nos x ' s desenhados em cada canto.
- Designar as regiões de interesse para a imagem latente do software de aquisição e nomeá-los de acordo.
- Calibrar o aparelho usando o software de aquisição de dados (consulte a Tabela de materiais) dentro de erro de 5 ppm.
- Salve o método otimizado e começar a correr. Este experimento otimizado os seguintes parâmetros: polaridade = positivo, Detector = Reflectron, tamanho de Laser = 2, poder do Laser = 50%, ganho de detector de modo Reflector = x 3.
6. processamento de dados IMS
- Importar arquivo de .mis no software estatístico (ver Tabela de materiais) para análise de significância.
Resultados
Um slide de ITO otimamente secado resultará em uma amostra dessecada plana com mínima para sem rugas através da superfície do agarose e pedaços de agarose que mantêm uma separação espacial no slide (Figura 3). A figura 3A mostra ideal de secagem, enquanto a Figura 3B mostra as rugas que devem ser evitadas. Essa otimização requer cuidadoso monitoramento do slide no forno, como vezes exatas podem variar com base na umidade relativa. Enquanto as rugas ligeiramente podem afetar a altura, e, portanto, sinaliza a precisão em massa do IMS, ligeiras rugas não terá impacto sobre a qualidade dos dados. Portanto, qualquer agarose que em última análise, tem pequenas rugas ainda pode ser analisado através de MALDI-TOF MS. O slide deve ser completamente seco ou isso poderia levar a uma explosão da amostra no ambiente de alto vácuo o espectrômetro de massa MALDI-TOF.
Outros substratos além do agarose podem funcionar, mas muitas vezes não manter sua integridade estrutural após secagem ou remoção da câmara bem, o que resulta em espalhando o slide ITO e perda de informação espacial. Por exemplo, nós testamos anteriormente colágeno como um substrato e isto resultou na difusão e perda de informação espacial, quando a câmara foi removido (dados não mostrados). O tecido utilizado deve ser no centro do poço se é indivisível, ou no centro do triângulo do meio se é dividido, para que a aquisição de dados IMS não está contaminada com efeitos de borda. A Figura 4 mostra exemplos de tecido otimamente localizado (painel A) e o tecido mal posicionado (painel B). Na Figura 4B, o tecido está localizado na borda da agarose que, quando fotografado, pode resultar é falsos sinais em massa contra os efeitos de borda e não permite que os usuários o agarose em torno do tecido, o que significa que secretado sinais pode ser perdidas de imagem durante a análise. Tecido deve ser mais próximo do centro possível, conforme demonstrado na Figura 4A.
Uma série de experimentos determinou que uma câmara de 8 poços era a melhor embarcação para incubação, em comparação com uma placa de 6 e uma placa de 24, porque a câmara de 8 poços resulta em perturbações mínimas para as células, enquanto as outras câmaras maiores requerem agarose lajes para ser transferido para um slide de ITO ou aço inoxidável após incubação16. As câmaras de 8 poços de várias marcas de slides câmara podem ser usadas, mas aqueles com um adesivo de borracha inferior e paralelo os lados dos poços facilitam fácil introdução e remoção de um divisor de plástico para os poços divididos. A placa de 6 exigido muito mais material e enfrentou dificuldades com grandes áreas de secagem. Câmara de 24-poço também teve problemas durante a secagem, porque o efeito do menisco foi evidente em poços e, portanto, os plugues secos com bordas significativamente maiores. A câmara de 8 poços não resulta em efeito o menisco quando a agarose é banhado diretamente no centro do poço, e plugues de agarose não teve de ser transferido. Além disso, a câmara de 8 poços permite 8 condições ser testado ou controlada por em uma única experiência. Dependendo da experiência, pode ser importante incluir controles tais como (1) poços sem ovário explantes ou células, (2) poços com células apenas, ou (3) poços com ovário explantes apenas. Porque a preparação da amostra (concentração exacta de mídia e agarose, quantidade de matriz, etc.) difere ligeiramente entre as execuções, as condições devem ser comparadas quando eles são adquiridos no mesmo slide.
Mais experimentos determinaram que um slide ITO-revestido foi a melhor plataforma para incubação quando comparado com uma placa de aço MALDI porque o slide permite a verificação visual da célula estadual e posicionamento. Por exemplo, usando o slide de ITO, podemos verificar que as células têm morfologia normal e que eles mantenham uma distribuição homogénea ao longo da agarose antes e seguir dessecação16. O slide também permitirá para incorporação de linhas celulares fluorescentes conforme necessário. Além disso, é necessária a remoção da câmara antes da dessecação para manter na íntegra a ficha de agarose. Se o slide está dissecado com câmara de 8 poços aderiu, o plástico separa o plug de agarose e resulta em grandes rachaduras nos plugues. A Figura 5 demonstra os problemas enfrentados quando a câmara não é removida antes da secagem.
Ao analisar a populações de células, é importante que a resolução espacial é pelo menos 50 µm para começar a capturar o tamanho pequeno das interações tecido e celular. Com matriz pulverizado, é possível obter uma resolução de 5 µm, mas isto aumenta o tempo total para coletar os dados de espectrometria de massa, enquanto produzindo resultados comparáveis. Resolução espacial também é dependente da capacidade de se concentrar o laser no espectrômetro de massa MALDI-TOF.
Em geral, otimizamos esta configuração de slide para melhor detectar moléculas pequenas trocadas em coculture. Portanto, durante a análise de dados estamos buscando características moleculares que só estão presentes ou são significativamente mais abundantes em um plugue de agarose que representa a condição biológica de interesse. Porque não há a opção de incluir sete outros controles e condições no slide, isto pode ser conseguido visualmente e no software estatístico para dados do IMS. Nosso processo de desreplicação após a detecção de massas espacialmente relevantes é extenso, assim podemos ortogonalmente obter um alta resolução dados de massa e fragmentação. O primeiro passo que tomamos para desreplicação é uma busca da massa nominal através de um banco de dados, tais como o banco de dados de Metabolome humano (HMDB) para mamíferos metabolitos. A maioria das moléculas no banco de dados tem um número significativo de espectros cobrindo muitas técnicas para comparação com dados experimentais. Uma vez que massas nominal tem moléculas de candidato potencial como sua identidade putativa, geralmente é possível comparar dados físicos como fragmentação de MS/MS, perfil de UV e tempo de retenção entre a estrutura do candidato e um padrão.
Por exemplo, identificação de norepinefrina no coculture de oncogenicidade FTE células incubadas com tecido ovariano validou que este método IMS é capaz de detectar moléculas pequenas relevantes deste sistema16. Figura 6 mostra a sensibilidade das pistas IMS, mostrando o tipo de dados que se pode esperar, seguindo o protocolo para câmaras indivisos. A Figura 7 mostra, da mesma forma, dados representativos para a instalação da câmara dividida.

Figura 1: fluxo de trabalho para a preparação da amostra de coculture indiviso. (A) câmara de 8 poços Adhere ao lado condutor de ITO-revestido slide. (B) lugar empatado ovários no centro de poços para condições coculture. (C) Adicionar 300 µ l de suspensão de agarose/célula diretamente nos poços. Verifique se há nenhuma bolha de ar e que o ovário permanece no centro do poço. Se a agarose pipetted perturbado o ovário, suavemente, use a ponta da pipeta para centralizá-la antes que a agarose esfria. (D) após quatro dias de incubação (ou caso contrário otimizado tempo) Remova a câmara de 8 poços de slide. Agarose estejam ligado à câmara, delicadamente desanexar agarose plug da câmara utilizando uma espátula e reposicioná-la no slide. A agarose não aderirão ao slide, por isso vai ser fácil mover-se. Desenhe um 'X' em cada canto do slide e tirar uma foto. (E) seco o slide em um forno de 37 ° C por 4 h, a rotação de 90 ° cada hora. Agarose deve ser totalmente ressecado e deve deite-se de slide. (F) aplicar matriz de escolha através de um pulverizador ou aerógrafo para deslizar. Camada de matriz deve ser visível como amarelo. Digitalizar o slide em um scanner em 1.200 dpi e adicionar calibrants ou padrões para análise de MALDI-TOF MS. Clique aqui para ver uma versão maior desta figura.

Figura 2: fluxo de trabalho para a preparação da amostra de coculture dividida. (A) corte abas fora da bacia de mídia (~ 13 mm) e certifique-se de que os lados estão em linha retas. (B) câmara de 8 poços anexar ao lado condutor de ITO-revestido slide. (C) inserir divisores na diagonal em poços. (D) adicionar 150 µ l de cultura de células em agarose para um dos lados da divisória, permitem agarose esfriar e retire o divisor. (E) adicionar ovário ao centro do meio bem vazio e cubra com 150 µ l de suspensão de mídia e agarose. Esta figura reproduzida com permissão de Zink et al 201816. Clique aqui para ver uma versão maior desta figura.

Figura 3: rugas em agarose plugues. Rugas podem formar os tampões de agarose se o slide é deixado no forno por muito tempo. Isso será não impede que a amostra de análise MALDI-TOF MS mas pode afetar a qualidade dos dados. (A) imagem de um slide otimamente seca. Todos o agarose o tecido ovariano é completamente plana e livre de rugas, proporcionando ampla área para análise do IMS. (B) a imagem de um slide mal seca com agarose enrugado por toda a amostra. Esta figura reproduzida com permissão de Zink et al 201816. Clique aqui para ver uma versão maior desta figura.
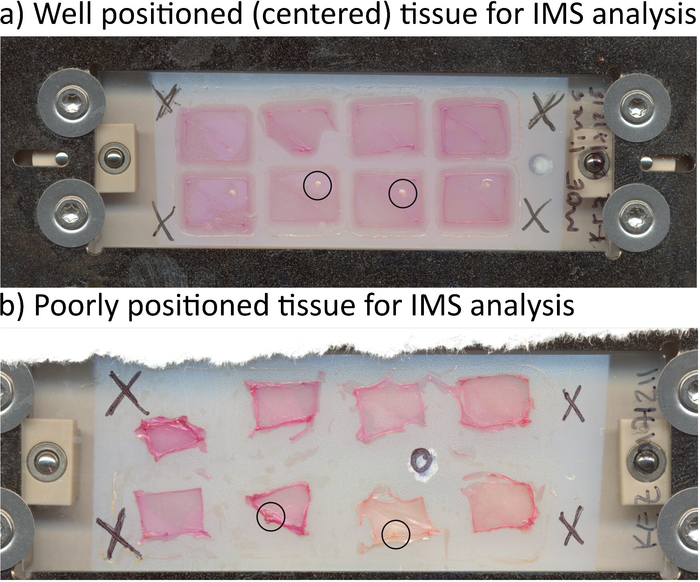
Figura 4: posicionamento do tecido. Posição do tecido na amostra seca é muito importante para a aquisição de dados. (A) plugues de agarose secos das câmaras divididas mostram o ovário no centro de uma metade do poço, que é ideal para a imagem latente. (B) secas agarose plugues da câmara dividida, onde o ovário não foi centralizado para incubação ou secagem. O tecido ovariano secos no perímetro dos plugues de agarose e, portanto, não pode ser analisado. Clique aqui para ver uma versão maior desta figura.
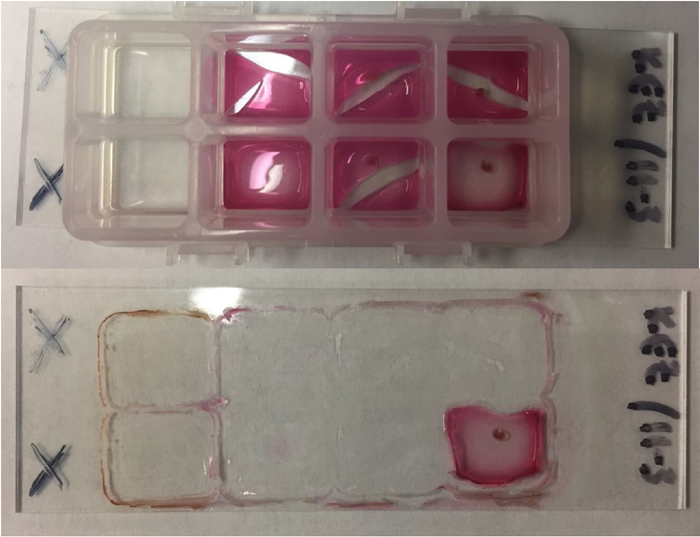
Figura 5: slides com a câmara de secagem. Quando o slide é definido no forno antes da remoção da câmara, os plugues de agarose aderirem mais fortemente o plástico do que a mesmos e começarem a separar-se no calor. Isso resulta em graves rachaduras no agarose e pouca adesão ao slide em si. Rachaduras este grande não são conducentes à análise do IMS. Top: Slide após dessecação de 2h com 8 poços câmara aderiu. Todos os plugues de agarose mas dois rachado através do centro devido à adesão à câmara de 8 poços. Fundo: Slide após a remoção da câmara de 8 poços. Apenas um plug de agarose permaneceu no slide. Esta figura reproduzida com permissão de Zink et al 201816. Clique aqui para ver uma versão maior desta figura.

Figura 6: detectando sinais originais. Quando comparando 8 condições, é possível detectar sinais que são exclusivos para uma única condição. Imagem de slide (A) a seco é usada para ensinar o espectrômetro de massa MALDI-TOF quais regiões a imagem. Aqui nós selecionamos pequenas regiões em torno do tecido ovariano para IMS em 50 µm. (B) uma representativa imagem de um sinal de m/z que é upregulated em uma condição contra as oito no mesmo slide. Clique aqui para ver uma versão maior desta figura.

Figura 7: dados representativos da configuração da câmara dividida. Tecido ovariano é descrito em branco. A m/z 112 é secretada a partir da metade do bem que contém o ovário. IMS foi realizado a 50 µm. Esta figura reproduzida com permissão de Zink et al 201816. Clique aqui para ver uma versão maior desta figura.
Discussão
Há um crescente corpo de evidências que implique o papel da noradrenalina em HGSOC12,17,18, e esta técnica contribuiu com informações mais mecanicistas. Pelo menos oito condições biológicas presentes no mesmo slide, o método pode conta para controles biológicos tais como gene e especificidade da célula, bem como controles de mídia em um único IMS executar. Enquanto o método foi otimizado avaliar trocadas pequenas moléculas em um modelo de metástase principal em HGSOC, qualquer célula ou tipo de tecido que pode ser colocado em agarose pode ser substituído para analisar uma grande variedade de questões biológicas e Estados de doença.
Um dos passos mais importantes no protocolo é assegurar que os tipos de tecidos ou células estão em estreita proximidade com o outro e estão presentes no centro do plugue de agarose. Outra consideração importante é a otimização do tempo de secagem para o slide inteiro. Este método foi otimizado usando tecido ovariano, que seca facilmente e cujo tamanho pequeno resultou em pequenas complicações de secagem. No entanto, outros tecidos, com composição diferente como gordura, têm perfis muito diferentes de secagem e, portanto, exigem mais extensa otimização de dessecação. Após secagem foi otimizado para a amostra biológica, o fluxo de trabalho restante deve exigir apenas a mínima alteração.
Durante a aquisição de massa espectral, é provável que muitos projetos exigirá a análise dos grupos compostos além de pequenas moléculas. Os parâmetros IMS para a aquisição e a seleção da matriz, portanto, devem ser adaptados para gerar os melhores dados para o respectivo destino, se é conhecido. Além disso, que só temos realizado aquisição de dados em modo positivo com uma matriz de CHCA:DHB de 50: 50, mas experiências de modo negativo podem preferir um tipo diferente da matriz, e moléculas maiores seria mais facilmente detectadas em uma matriz diferente também. O método pode ser usado com uma variedade larga de massa em uma abordagem não segmentada ou com um intervalo de massa mais estreito para uma pesquisa específica. No caso do método discutido acima, pequenas moléculas foram alvo de interesse, porque o foco era detectar moléculas que foram trocadas através do agarose entre representantes de célula e tecido. Apesar de que não podemos afirmar que as limitações em termos de tamanho e estrutura que inibem o movimento através de agarose, nosso objetivo foi detectar pequenas moléculas, então nossa decisão de matriz e MALDI-TOF MS parâmetros foram otimizados para esse objetivo. Experiências futuras estão sendo desenvolvidas para alvo de lipídios e proteínas que podem ter sido perdidas nosso método de aquisição original.
Além a limitação da deteção do composto classe, esse método também requer que as células compatíveis com agarose, e que a amostra de tecido (se usado) ser adaptado para se encaixar em uma câmara de oito poços. Certos tecidos podem ser adaptados para poços maiores se menos condições biológicas são necessárias para a comparação, mas é fundamental que o tecido selecionado é capaz de secagem a uma altura uniforme de menos de 100 a 200 µm após dessecação4. Múltiplas amostras biológicas podem ser avaliadas como mais de um tipo de célula na comunicação com um lenço de papel. Porque a preparação da amostra é capaz de separar espacialmente culturas celulares baseados em agarose, é possível atribuir visualizado m/z 's para a fonte de cultura de células com base em padrões de difusão observados.
Usando o IMS para estudar cortes histologicos de amostras humanas ou modelos de rato transgénico recapitula a complexidade dos tecidos. No entanto, amostras humanas são difíceis de obter, que drasticamente pode limitar a capacidade de estudar coisas como progressão da doença. Tecido de modelos transgénicos do mouse pode ser coletado em pontos de tempo bem definidos. Mas, modelos do rato podem ser demorado e caro para desenvolver. Além disso, a complexidade cheia dos tecidos reais em ambos estes modelos pode tornar difícil avaliar com precisão a comunicação entre células específicas ou tecidos. Em contraste, o método apresentado aqui é um altamente adaptável. Diferentes tecidos ou linhas de células podem ser cocultured no mesmo slide para examinar as diferenças na comunicação. Por exemplo, as células normais ou células tumorais do mesmo tecido podem ser cultivadas no mesmo slide compreender diferenças devido a transformação. Estudos do curso de tempo podem descobrir novas cascatas de sinalização entre as células, ou inibidores de pequenas moléculas e/ou RNAi poderia ser incorporado para examinar o papel das moléculas de sinalização específicas ou metabólitos. Acreditamos que estas possibilidades fará com que esta técnica útil para estudar comunicação célula a célula em uma ampla variedade de contextos.
Divulgações
Os autores não têm nada a divulgar
Agradecimentos
O financiamento foi fornecido pelo consórcio biomédica Chicago, com o apoio dos fundos Searle em Chicago comunidade Trust (C-076) (LMS); Universidade de Illinois em Chicago inicialização fundos (LMS); Grant 543296 da Aliança de fundo de pesquisa de câncer de ovário (MD); e UG3 ES029073 (J.E.B) e pelo centro nacional para avançar translacional Ciências, Instituto Nacional de saúde, através da concessão de UL1TR002003 (JEB & LMS).
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon tubes | Denville | C1017-O | To collect cells |
| 8-well chamber (Millipore EZ-slide chamber) | Millipore | PEZGS0816 | Repurposed from Millipore Millicell EZ-slide chamber slide |
| Acetonitrile | Sigma-Aldrich | 34998-4L | Solvent for sprayed matrix |
| Alpha Minimum Essential Medium (αMEM) | Fisher | 10-022-CV | Cell culture media |
| Autoflex speed MALDI-TOF LRF | Bruker | For IMS data analysis | |
| Centrifuge | Eppendorf | 5810 R | To collect cells and remove supernatant |
| CHCA Matrix | Bruker Daltonic | 8201344 | Matrix sprayed onto dried slide |
| DHB Matrix | Bruker Daltonic | 8201346 | Matrix sprayed onto dried slide |
| Disposable Scalpels | Fisher | 22-079-707 | For removal of the ovaries |
| Dissecting Scissors | Fisher | 13-804-6 | For removal of the ovaries |
| DMEM Media | Gibco | 11995-065 | Media mixed with agarose |
| epidermal growth factor | Peprotech Inc. | 100-15 | Cell culture media supplement |
| Eppendorf tubes | Genesee Scientific | 22-282 | For agarose aliquots |
| Estradiol-17β | Simga-Aldrich | E2758 | Cell culture media supplement |
| Fetal Bovine Serum | Denville | fb5001 | Cell culture media supplement |
| FlexControl 3.4 | Bruker Daltonic | IMS data acquisition software | |
| FlexImaging 4.1 | Bruker Daltonic | IMS data analysis software | |
| Forceps (fine) | Fsiher | 22-327379 | For removal of the ovaries |
| Gentamycin | Cellgro | 30-005-CR | Cell culture media supplement |
| Insulin, Transferrin, Selenium (ITS) | Sigma-Aldrich | 11074547001 | Cell culture media supplement |
| ITO-coated slide | Bruker | 8237001 | Platform for co-culture incubation |
| Leibovitz's L-15 Medium | Gibco | 11415064 | Media used during tissue dissection |
| L-glutamine | Gibco | 25030-081 | Cell culture media supplement |
| Low-melting agarose | Sigma-Aldrich | A9414-10G | Mixed with media for plating |
| Media basin | Corning | 4870 | Used to cut plastic dividers for divided chambers |
| Penicillin-streptomycin | Gibco | 15140-122 | Cell culture media supplement |
| Peptide Calibration Standard | Bruker Daltonic | 8206195 | Calibrant for medium mass range |
| Phophorus red | Sigma-Aldrich | 343-242-5G | Calibrant for low mass range |
| SCiLS Lab 2015 | Bruker Daltonic | IMS data statistical analysis | |
| Surgical Forceps (blunt) | Fisher | 08-875-8B | For removal of the ovaries |
| TFA | Fisher Technologies | A116-50 | Added to matrix solution |
| TM Sprayer | HTX Technologies | For applying matrix |
Referências
- Paine, M. R., et al. Whole Reproductive System Non-Negative Matrix Factorization Mass Spectrometry Imaging of an Early-Stage Ovarian Cancer Mouse Model. PLoS One. 11 (5), e0154837 (2016).
- Yang, Y. L., Xu, Y., Straight, P., Dorrestein, P. C. Translating Metabolic Exchange with Imaging Mass Spectrometry. Nature Chemical Biology. 5 (12), 885-887 (2009).
- Li, H., Hummon, A. B. Imaging Mass Spectrometry of Three-Dimensional Cell Culture Systems. Analytical Chemistry. 83 (22), 8794-8801 (2011).
- Yang, J. Y., et al. Primer on Agar-Based Microbial Imaging Mass Spectrometry. Journal of Bacteriology. 194 (22), 6023-6028 (2012).
- Coscia, F., et al. Integrative Proteomic Profiling of Ovarian Cancer Cell Lines Reveals Precursor Cell Associated Proteins and Functional Status. Nature Communications. 7, 12645 (2016).
- Labidi-Galy, S. I., et al. High Grade Serous Ovarian Carcinomas Originate in the Fallopian Tube. Nature Communications. 8 (1), (2018).
- Klinkebiel, D., Zhang, W., Akers, S. N., Odunsi, K., Karpf, A. R. DNA Methylome Analyses Implicate Fallopian Tube Epithelia as the Origin for High-Grade Serous Ovarian Cancer. Molecular Cancer Research. 14 (9), 787-794 (2016).
- Falconer, H., Yin, L., Gronberg, H., Altman, D. Ovarian Cancer Risk After Salpingectomy: A Nationwide Population-Based Study. JNCI Journal of the National Cancer Institute. 107 (2), dju410 (2015).
- Dean, M., Davis, D. A., Burdette, J. E. Activin A Stimulates Migration of the Fallopian Tube Epithelium, an Origin of High-Grade Serous Ovarian Cancer, through Non-Canonical Signaling. Cancer Letters. 391, 114-124 (2017).
- King, S. M., Burdette, J. E. Evaluating the Progenitor Cells of Ovarian Cancer: Analysis of Current Animal Models. BMB Reports. 44 (7), 435 (2011).
- Reznik, E., et al. Landscape of Metabolic Variation across Tumor Types. Cell Systems. 6 (3), 301-313 (2018).
- Watkins, J. L., et al. Clinical Impact of Selective and Nonselective Beta-Blockers on Survival in Patients with Ovarian Cancer: Beta-Blockers and Ovarian Cancer Survival. Cancer. 121 (19), 3444-3451 (2015).
- Lutgendorf, S. K., et al. Stress-Related Mediators Stimulate Vascular Endothelial Growth Factor Secretion by Two Ovarian Cancer Cell Lines. Clinical Cancer Research. 9 (12), 4514-4521 (2003).
- Sood, A. K. Stress Hormone-Mediated Invasion of Ovarian Cancer Cells. Clinical Cancer Research. 12 (2), 369-375 (2006).
- Hoffmann, T., Dorrestein, P. C. Homogeneous Matrix Deposition on Dried Agar for MALDI Imaging Mass Spectrometry of Microbial Cultures. Journal of The American Society for Mass Spectrometry. 26 (11), 1959-1962 (2015).
- Zink, K. E., Dean, M., Burdette, J. E., Sanchez, L. M. Imaging Mass Spectrometry Reveals Crosstalk between the Fallopian Tube and the Ovary That Drives Primary Metastasis of Ovarian Cancer. ACS Central Science. 4 (10), 1360-1370 (2018).
- Armaiz-Pena, G. N., et al. Src Activation by β-Adrenoreceptors Is a Key Switch for Tumour Metastasis. Nature Communications. 4, 1403 (2013).
- Choi, M. J., et al. HTERT Mediates Norepinephrine-Induced Slug Expression and Ovarian Cancer Aggressiveness. Oncogene. 34 (26), 3402 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados