Method Article
Dois métodos para Decellularization de tecidos vegetais para aplicações de engenharia de tecidos
Neste Artigo
Resumo
Aqui apresentamos, e contraste dois protocolos usados para decellularize de tecidos vegetais: uma abordagem baseada em detergente e uma abordagem livre de detergente. Ambos os métodos deixam a matriz extracelular dos tecidos da planta utilizada, que pode então ser utilizada como andaimes para aplicações de engenharia de tecidos.
Resumo
Os enxertos autólogos, sintéticos e derivados de animais usados atualmente como andaimes para substituição de tecido têm limitações devido à baixa disponibilidade, pobre biocompatibilidade e custo. Tecidos vegetais têm características favoráveis que as tornam excepcionalmente adequado para usar como andaimes, tais como elevada área superficial, transporte de água excelente e retenção, porosidade interconectada, preexistente redes vasculares e uma vasta gama de mecânica Propriedades. Dois métodos bem sucedidos de decellularization planta para aplicações de engenharia de tecido são descritos aqui. O primeiro método é baseado em banhos de detergente para remover matéria celular, que é semelhante aos métodos estabelecidos anteriormente usados para limpar tecidos de mamíferos. O segundo é um método livre de detergente, adaptado de um protocolo que isola a vasculatura de folha e envolve o uso de uma lixívia aquecida e o banho de sal para limpar as folhas e caules. Ambos os métodos produzem andaimes com propriedades mecânicas comparáveis e baixo impacto metabólico celular, permitindo que o usuário selecione o protocolo que melhor se adapte às sua aplicação pretendida.
Introdução
Engenharia de tecidos surgiu na década de 1980 para criar tecidos vivos substitutos e potencialmente endereço importantes órgãos e tecidos escassez1. Uma estratégia tem andaimes usados para estimular e orientar o corpo para regenerar tecidos ou órgãos. Embora avançado abordagens de fabricação, tais como impressão 3-d produziram andaimes com propriedades físicas originais, a capacidade de fabricar andaimes com uma variada gama de propriedades físicas e biológicas realizáveis permanece um desafio2 , 3. Além disso, devido à falta de uma rede vascular funcional, estas técnicas têm sido limitadas em regenerar tecidos 3-dimensional. A utilização de tecidos animais e humanos decellularized como andaimes tem auxiliado em contornar este problema,4,5,6,7. No entanto, custo elevado, lotes de variabilidade e disponibilidade limitada podem limitar a utilização generalizada de animal decellularized moldes8. Também existem preocupações sobre a transmissão de doença potencial aos pacientes e uma reação imunológica de alguns tecidos de mamíferos decellularized9.
Celulose, derivada da planta e fontes bacterianas, tem sido extensivamente usado para gerar biomateriais para uma ampla gama de aplicações na medicina regenerativa. Alguns exemplos incluem: osso10,11, cartilagem12,13,14 e15de cicatrização de feridas. Andaimes que são compostas de celulose têm um benefício adicional em que eles são duráveis e resistentes a ser discriminadas em células de mamíferos. Isto é devido ao fato de que células de mamíferos não produz as enzimas necessárias para quebrar as moléculas de celulose. Em comparação, andaimes produziram usando macromoléculas da matriz extracelular, como o colágeno, são facilmente quebrados16 em podem não ser adequados para aplicações de longo prazo. Andaimes de colágeno podem ser estabilizadas por químicos do cross-linking. No entanto, há um trade-off devido a toxicidade inerente dos cross-linkers que afetam a biocompatibilidade dos andaimes17. Por outro lado, a celulose tem o potencial de permanecem presentes no local da implantação por períodos prolongados de tempo porque é impermeável à degradação enzimática por pilhas mamíferas18,19,20. Isto pode ser alterado por meio do ajuste da taxa de degradação através de pré-tratamento de hidrólise e co entrega dos andaimes com cellulases21. A biocompatibilidade de celulose de origem vegetal decellularized andaimes na vivo também foi demonstrada em um estudo feito em ratos22.
Através de centenas de milhões de anos de evolução, as plantas refinaram sua estrutura e composição para aumentar a eficiência do transporte de fluidos e retenção. Planta vasculares vasos minimizam resistência hidráulica, ramificando em vasos menores, semelhantes da vasculatura mamíferos de acordo com Murray lei23. Depois da decellularization, complexa rede da planta de vasos e poros interconectados é mantida. Tendo em conta o vasto número de espécies de plantas distintas prontamente disponíveis, andaimes de origem vegetal têm potencial para superar as limitações de projeto atualmente afetando andaimes em tecido engenharia24,25. Por exemplo, Modulevsky et al demonstraram que angiogênese e célula de migração ocorreu quando apple decellularized tecido foi implantado por via subcutânea na parte de trás de um rato de22. Da mesma forma, Gershlak et al mostrou que as células endoteliais poderiam ser crescidas dentro da vasculatura de folhas decellularized24. Em um experimento separado, Gershlak et al também foram capazes de mostrar que cardiomyocytes poderiam ser cultivadas na superfície das folhas e foram capazes de contrato24.
Plantas também incluem a organização complexa do celular à escala macroscópica, que é difícil de alcançar, mesmo com as mais avançadas técnicas de fabricação desenvolvidas até à data. A complexa concepção hierárquica de tecidos vegetais torna-los mais forte do que a soma dos seus constituintes,26. Plantas possuem uma infinidade de propriedades mecânicas diferentes, que vão desde componentes rígidos e duros como hastes, para os muito mais flexíveis e maleáveis, tais como folhas de27. Folhas variam dependendo da espécie em termos de tamanho, forma, quebrar a força, o grau de vascularização e podem levar a diferentes graus de Hidrofilia. Em geral, essas propriedades da planta sugerem que plantas decellularized podem servir como únicos e altamente funcionais de dispositivos médicos, incluindo como andaimes de engenharia de tecidos.
Este protocolo centra-se em dois métodos de decellularize de tecidos vegetais, tais como folhas e caules, para utilização como andaimes em engenharia de tecidos. O primeiro método é uma técnica baseada em detergente que usa uma série de banhos para retirar DNA e matéria celular, que foi adaptada de uma técnica amplamente utilizada decellularize mamíferos e vegetais tecidos6,22,25 ,28,29,30. O segundo método é livre de detergente e é uma adaptação de um protocolo de "esqueletonização", geralmente usado para remover os tecidos moles de folhas31. Trabalhos anteriores mostraram que ferver as folhas em uma solução de água sanitária e bicarbonato de sódio facilitou a separação da vasculatura do tecido mole circundante31. Esta técnica pode ser citada para experiências realizadas nodia 17 e18 séculos, tais como o trabalho de Albertus Seba32 e Edward Parrish33 . Estas experiências centradas em torno de deixando matéria vegetal, como folhas e frutos, submersos em água por longos períodos de tempo (semanas ou meses) e permitindo que os tecidos mais macios à deterioração embora naturalmente. Aqui, a abordagem de "esqueletonização" é adaptada para usar condições mais leves, tais como tempos de incubação mais longos a temperaturas mais baixas, para remover resíduos celulares e para não perturbar significativamente a estrutura de tecido mole. Para os experimentos detalhados neste documento, foram utilizados três tipos de plantas: Ficus hispida, Pachira aquatica e uma espécie de Garcinia. Resultados de DNA quantificação, ensaios mecânicos e impacto sobre a atividade metabólica celular de ambos os métodos são descritos.
Protocolo
1. decellularization do tecido de planta usando a abordagem baseada em detergente
-
Use o fresco ou congelado F. hispida, amostras de folha. Congele não utilizadas amostras frescas em uma loja para uso futuro (até um ano) e congelador-20 ° C.
Nota: Use tecido de tronco ou folha de quase qualquer planta desejada. Tempos de armazenagem prolongada podem causar danos aos tecidos.- Determinar o tamanho e a forma de amostras a ser processados com base na utilização do exemplo (ou seja, amostras cortadas em tiras são adequadas para aplicações de testes mecânicas, entretanto, amostras de disco de 8 mm são úteis em aplicações de cultivo multi bem ). Corte a folha em discos de 8 mm com uma biópsia afiada, limpa soco enquanto submerso sob temperatura ambiente (20-25 ° C) água deionizada H2O.
Nota: Este protocolo pode ser usado em caules e folhas de toda. No entanto, as amostras menores serão decellularize mais rápido. - Incube as amostras durante 5-10 min à temperatura ambiente (20-25 ° C) água deionizada H2O em um conjunto de placa de agitação para uma configuração de baixa velocidade para lavar e/ou descongelá-los. Uso bastante água deionizada H2O para garantir que todas as amostras são completamente molhadas.
- Determinar o tamanho e a forma de amostras a ser processados com base na utilização do exemplo (ou seja, amostras cortadas em tiras são adequadas para aplicações de testes mecânicas, entretanto, amostras de disco de 8 mm são úteis em aplicações de cultivo multi bem ). Corte a folha em discos de 8 mm com uma biópsia afiada, limpa soco enquanto submerso sob temperatura ambiente (20-25 ° C) água deionizada H2O.
-
Preparar uma solução de 10% (p/v) Dodecil sulfato de sódio (SDS) em desionizada H2O. lugar as amostras em um recipiente adequado (um copo ou prato plástico é ideal) e adicione solução de SDS para cobrir completamente as amostras. Incube as amostras por 5 dias em temperatura ambiente (20-25 ° C) em um conjunto de placa de agitar a baixa velocidade para evitar danos às amostras.
Nota: Não sobrecarregar o contêiner como isso pode retardar o processo de decellularization e levar a um tratamento desigual por SDS. Durante esta etapa, as amostras devem adquirir uma tonalidade marrom.- Depois de 5 dias, substitua a solução de SDS desionizada H2O. Incubar as amostras para um adicional 10-15 min na placa de agitação para enxaguar fora qualquer solução residual de SDS.
- Prepare um tensoativo não-iônico de 1% (v/v) em solução 10% (v/v). Para fazer uma solução de 500 mL, misturar 5 mL de tensoativo não-iônico com 50 mL de água sanitária, em seguida, adicionar 445 mL de deionizada H2O. submergir amostras em solução recentemente preparada.
Nota: A solução de tensoativo não-iônico/água sanitária não tem uma vida útil longa, portanto, deve ser usado dentro de 48 h de preparação. -
Substitua a solução de tensoativo não-iônico/lixívia cada 24h até as amostras são completamente desmarcadas (consulte a figura 1A , para comparação visual). Então incube a amostra em água desionizada num prato de agitar por 2 min para enxaguar a excesso tensoativo não-iônico/lixívia solução. Coloque a placa de agitação para um baixo ajuste para não danificar as amostras.
Nota: O tempo necessário para limpar as amostras utilizadas varia, dependendo do tipo e da espécie da planta. A descoloração completa das amostras é indicativo de decellularization completo (realizar a quantificação de DNA para garantir a limpeza completa).- Lyophilize as amostras para armazená-los até um ano (flash congelamento com nitrogênio líquido é preferencial, congelar as amostras em-80 ° C também é aceitável) e armazená-los em temperatura ambiente (20-25 ° C) em baixa umidade.
- Reconstituir as amostras em Tris-HCl (10 mM, pH 8,5) usando o suficiente para amostras de casaco. Lave as amostras 2 - 3 vezes em media serum-free suavemente utilizando uma micropipeta antes do uso (ou seja, uso de 150-300 µ l por enxágue, em um prato bem 24 padrão).
Nota: Tampão Tris-HCl e media serum-free (ou seja, DMEM, mas qualquer célula básica cultura mídia pode ser substituída) é mais eficaz na redução do impacto de viabilidade celular das amostras de SDS tratada do que aqueles tratados com desionizada H2O sozinho.
2. preparação das amostras usando a abordagem de Decellularization livre de detergente
Nota: Os passos iniciais deste procedimento coincidem com passos 1.1-1.1.2 (veja acima).
- Prepare uma lixívia 5% (v/v) (NaClO) e solução de bicarbonato de sódio (NaHCO3) de 3% (p/v). Aquecer a solução em uma coifa para 60-70 ° C para amostras de folha de F. hispida cortado em discos de 8 mm, agitando um prato quente.
Nota: O bicarbonato de sódio pode ser substituído com carbonato de sódio (Na2CO3), ou hidróxido de sódio (NaOH). A temperatura varia muito (de temperatura de 90 ° C) e deve ser ajustada de acordo com as propriedades das amostras utilizadas. - Uma vez que a solução atinja a temperatura desejada, mergulhe as amostras e reduzir a velocidade de agita para evitar danificá-los. Depois que as amostras são visivelmente limpas (consulte a figura 1B para comparação visual), retirar do banho com cuidado. Incube amostras uma vez em desionizada H2O para 1-2 min remover a solução de água sanitária em excesso.
Nota: O tempo necessário para limpar as amostras pode variar amplamente. Por exemplo, corte de salsa pode ser cancelada em 10-15 min, enquanto amostras mais espessas e/ou maiores como todo folhas ou caules podem demorar horas em banhos de alta temperatura para limpar completamente. - Lyophilize as amostras e armazená-los em temperatura ambiente (20-25 ° C) em baixa umidade.
Resultados
Ambos os métodos renderam andaimes que foram adequados para a cultura de células e tecidos, aplicações de engenharia. A Figura 1 mostra o fluxo de trabalho geral do processo de decellularization, usando uma folha intacta para o método baseado em detergente e cortadas amostras (8 mm de diâmetro) para o método livre de detergente. Decellularization bem sucedido dos tecidos Ficus hispida , ambos os métodos a seguir rendeu amostras claras e intactas (figura 1A e 1B). Foi possível decellularize tecidos de planta inteira (figura 1A); no entanto, as amostras menores apareceram para limpar mais rápido e mais eficaz. Um problema potencial observado com a abordagem baseada em detergente envolvidos decellularization heterogêneo como resultado da remoção prematura do banho de tensoativo não-iônico (Figura 1). Uma desvantagem do método livre de detergente é que danos podem ocorrer devido a incubação prolongada na banheira aquecida (Figura 1).
As propriedades mecânicas dos andaimes decellularized preparados usando ambos os métodos foram investigadas usando testes de tração uniaxial, como foi feito em outros estudos24,34. Este teste rendeu o máximo módulo tangente (MTM) (Figura 2A), tensão em fracasso (SAF) (Figura 2B) e resistência à tração (UTS) (Figura 2) para F. hispida e Pachira aquatica amostras. P. aquatica amostras preparadas usando ambos os protocolos de decellularization exibido propriedades mecânicas similares em todos os três dos parâmetros medidos. As amostras de F. hispida mostraram uma tendência semelhante em todos os casos, exceto as UTS testes. Em particular, amostras preparadas usando o protocolo de base detergente (SDS) tinham resultados de UTS médios mais elevados do que aqueles preparados com a abordagem de detergente livre (água sanitária). Esses resultados mostram que as amostras coletadas de diferentes espécies de plantas podem produzir Propriedades distintas decellularized andaime quando preparados através de dois protocolos de decellularization.
Para medir a remoção do DNA, as amostras foram limpas usando ambos os métodos e o DNA genômico foi isolado usando um protocolo previamente estabelecido,35. Ambos os métodos decellularization (detergente baseada e sem detergente) diminuíram significativamente o conteúdo de DNA genômico de amostras a 2,47 ng de DNA/mg (n = 3, s = 0.18) e 2,71 ng de DNA/mg de tecido (n = 3, s = 1,60) respectivamente (Figura 2D). Amostras de non-decellularized tinham 104.67 ng de DNA/mg de tecido (n = 3, s = 26.21) (Figura 2D). Importa a diminuição substancial do conteúdo de DNA após decellularization indicado uma eficaz remoção da célula vegetal.
O impacto na viabilidade celular dos dois métodos decellularization foi avaliado através da medição da atividade metabólica de fibroblastos dérmicos humanos (hDF) cultivadas por 2 dias na presença de decellularized p. aquatica ou Garcinia andaimes. hDFs tinha maior atividade metabólica quando cultivadas na presença de andaimes decellularized através do método livre de detergente contra aqueles preparados através do método baseado em detergente (Figura 3A). Para assegurar a completa remoção dos reagentes usados durante o decellularization, um conjunto adicional de experimentos foi realizada em que os andaimes preparados foram lavados extensivamente antes da cultura de pilha. Dois métodos de lavagem separadas foram testados em amostras preparadas usando a abordagem baseada em detergente: uma lavagem em tampão Tris-HCl (10 mM, pH 8,5) seguido por uma lavagem em meios livres de soro vs 2 lavagens em desionizada H2O. Ambas as abordagens usadas etapas de lavagem final com PBS 1x. O impacto para as células de mamíferos, posteriormente expostos para os planta decellularized andaimes foi medido usando o mesmo ensaio de atividade metabólica como acima. Tampão Tris-HCl (10 mM, pH 8,5) seguido por meios livres de soro ajudou a reduzir o impacto sobre a atividade metabólica celular comparado com desionizada H2O, fazendo amostras tratadas com a abordagem baseada em detergente comparável às amostras de detergente-livre Método (Figura 3B).
Foi previamente demonstrado que células mamíferas poderiam crescer em andaimes preparados usando a abordagem baseada em detergente25; Portanto, era preciso demonstrar isso em amostras preparadas pelo método de detergente livre previamente testado. Células-tronco mesenquimais (MSCs) foram semeadas em decellularized amostras de folha de F. hispida (discos de 8 mm) em 20.000 células por andaime e permitido para incubar por 24 h. Estes andaimes eram acrescidas antes da introdução da célula com um conjugado de RGD-dopamina para facilitar a aderência. A Figura 4 ilustra imagens coletadas de uma amostra típica. Uma imagem de campo brilhante foi coletada para mostrar a estrutura geral de uma seção da amostra utilizada (Figura 4A). Os MSCs foram corados usando calceína e fotografada com um microscópio de fluorescência (Figura 4B). As imagens foram então sobrepostas (Figura 4) para exibir a localização das células crescentes na superfície da folha.
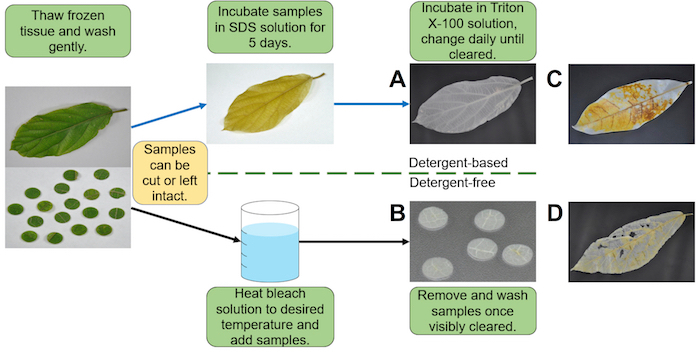
Figura 1 . O fluxo de trabalho geral para decellularization de tecidos vegetais. Fluxo de trabalho típico para o decellularization de tecidos vegetais (etapas de lavagem e preparatórias são universais); (A) top caminho é para baixo para o método livre de detergente detergente baseada método (B). (C) uma incompleta/falhou decellularization de uma folha de p. aquatica , usando o método baseado em detergente devido a remoção prematura do decellularization de banho (D) um danificado tensoativo não-iônico/lixívia de uma folha de F. hispida devido a incubação prolongada na solução de lixívia aquecida no método livre de detergente. Clique aqui para ver uma versão maior desta figura.

Figura 2 . Comparação das propriedades mecânicas e a eficácia da decellularization entre os métodos. Média ± DP; análise estatística foi feita utilizando as duas amostras teste-t e p valores listados onde estatisticamente significativa (menor ou igual a 0,05). Comparação de teste mecânico resultados entre amostras de F. hispida e p. aquatica (barras azuis utilizadas para abordagem baseada em detergente, vermelho para o detergente livre e verde para amostras não tratadas) (F. hispida detergente baseada n = 4, livre de detergente n = 2; P. aquatica detergente-base n = 3, livre de detergente n = 4) (A) máximo módulo de elasticidade tangente (MTM) (B) tensão no fracasso (SAF) (C) e Ultimate resistência à tração (UTS). (D) um ensaio de quantificação de dsDNA foi executado em triplicado em três amostras de cada grupo: não tratada (fresco, n = 3), o método livre de detergente (Bleach, n = 3) e o método baseado em detergente (SDS, n = 3), valores de p são para o método decellularization grupo em relação ao grupo de amostra não tratada. Clique aqui para ver uma versão maior desta figura.
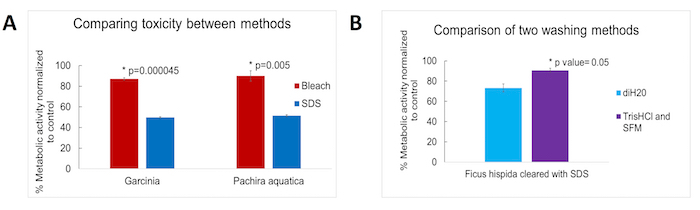
Figura 3 . Resultados de ensaio de atividade metabólica comparando o impacto entre os dois métodos de decellularization. Média ± DP; análise estatística foi feita utilizando o teste t de duas amostras e p valores listados onde estatisticamente significativa (menor ou igual a 0,05). Atividade metabólica celular foi medida na presença de amostras de tecido do p. aquatica e uma espécie de Garcinia (normalizados para controle de poços com nenhuma amostra adicionada) para exibir uma (A) comparação do impacto metabólico dos dois métodos de decellularization (n = 3 para cada grupo) e (B) comparação do impacto para a atividade metabólica, usando dois métodos de lavagem em protocolo baseado em detergente: tampão Tris-HCl (10 mM, pH 8,5) combinado com meios livres de soro (n = 4) vs desionizada H 2 Ó (n = 4). Clique aqui para ver uma versão maior desta figura.
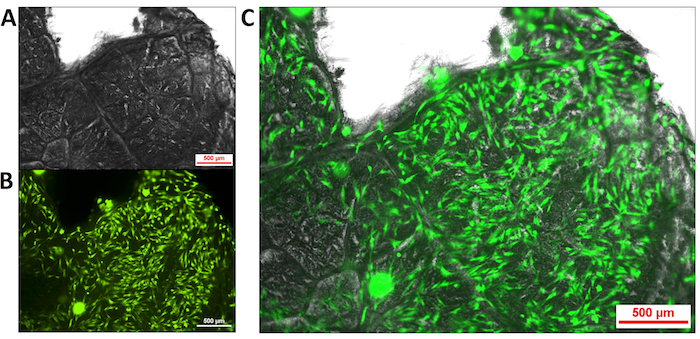
Figura 4 . Decellularized de células-tronco mesenquimais (MSCs) crescer na superfície da folha de Ficus hispida , acrescida com um conjugado de RGD-dopamina. MSCs foram cultivadas em folhas de F. hispida , decellularized pelo método livre de detergente e acrescidas com um conjugado de RGD-dopamina (500 µm escala bares foram adicionados para referência) (A) imagem de campo brilhante de uma seção de folha de decellularized (B ) Imagem de fluorescência de calceína manchado MSCs crescendo na folha superfície mesclada (C) brilhante campo e fluorescência imagem. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, dois métodos de decellularize de tecidos vegetais são descritos. Os resultados apresentados aqui, juntamente com os resultados de estudos prévios25, sugerem que os protocolos apresentados são prováveis aplicável a um amplo espectro de espécies de plantas e podem ser executadas em ambos os caules e folhas. Estes procedimentos são simples e não requer equipamento especializado, então decellularization de planta pode ser realizada na maioria dos laboratórios. Vale ressaltar que, após a decellularization, os andaimes devem ser acrescidos para facilitar a aderência de células de mamíferos. Técnicas de functionalization diferentes para permitir a adesão de células de mamíferos e crescimento na fábrica de tecidos têm sido descritas em outros lugares25 e são não o tópico do manuscrito atual.
A etapa final em ambos os protocolos de decellularization aqui apresentados (Figura 1) foi fundamental para seu sucesso. Quando executar qualquer um dos métodos não sobrecarregar o banho como isto irá resultar em uma clareira desigual. Esses métodos podem ser aplicados a toda folhas e caules; no entanto, isto irá aumentar o comprimento de tempo requerido para desmarcá-las. Certifique-se que as amostras são submergidas inteiramente para manter a clareira consistente ao longo de toda a amostra. Idealmente, decellularization deve limpar tecidos vegetais da matéria mais celular, minimizando danos estruturais. É provável que o método livre de detergente pode ser modificado conforme necessário para trabalhar com amostras desejadas. Umas mais altas temperaturas do banho podem resultar em mais rápido limpando vezes mas também podem resultar em mais danos para as amostras se eles são excessivamente incubados. Temperaturas mais baixas podem exigir mais tempos de incubação e seria apropriadas para amostras mais frágeis. A concentração de cloro na solução também pode ser alterada para acelerar ou desacelerar o processo de decellularization. Ao testar novas amostras para uso com o método livre de detergente, recomenda-se começar com uma temperatura de banho de 50-60 ° C, com frequentes verificações sobre o progresso da decellularization (idealmente a cada 15-20 minutos) até que eles são adequadamente limpas. Esta faixa de temperatura foi bem tolerada pela maioria das espécies de plantas que foram testadas durante a otimização da técnica. Após a conclusão, as amostras podem ser inspecionadas visualmente e manualmente garantir que eles não foram incubados over e irreparavelmente danificados como iria ser indicado pelo lacrimejamento ou desintegração após a remoção do banho. Amostras preparadas usando esta abordagem mostram um menor impacto sobre o crescimento da célula (consulte a Figura 3A) do que a abordagem baseada em detergente com apenas lavar em desionizada H2O. No entanto, recomenda-se lavagem adicionalmente com Tris-HCl (10 mM, pH 8,5) e media serum-free, especialmente em aplicações sensíveis.
O método detergente (SDS) é provável aplicável à maioria das espécies de plantas e é especialmente útil para limpar a folha inteira e amostras delicadas porque requer mínima agitação física. Como mencionado acima, a etapa final é fundamental para a decellularization das amostras. Amostras com diferentes propriedades físicas podem ser canceladas, ajustando o tempo de incubação nos banhos não iónico. Uma desvantagem significativa deste processo é que os tecidos decellularized podem conter vestígios de detergentes usados, que posteriormente podem influenciar a atividade metabólica celular de células de mamíferos. Portanto, as etapas de lavagem completa são recomendadas antes da utilização. Aqui verificou-se que as amostras de lavado com tampão Tris-HCl (10 mM, pH 8,5) seguido por mídia livre de soro tinham maior viabilidade celular do que aqueles lavados com água deionizada H2O antes da sua utilização (Figura 3B).
Ao armazenar amostras não tratadas para uso futuro em ambos os métodos, é importante para monitorá-los por danos garantir que os andaimes resultantes não serão afetados. Dano pode aparecer como descoloração dos tecidos vegetais, bem como rachaduras ou excessiva fragilidade quando manuseados. Recomenda-se monitorar as amostras em uma base semanal a fim de utilizá-los antes que eles não são mais úteis e precisam ser descartados. O aparecimento de danos varia entre tipos de amostra, com amostras mais robustos mais espessas, durando mais.
Em geral, plantas segurar muita promessa como uma fonte potencial de biomateriais. Isto é reforçado pela suas estruturas intricadas naturalmente desenvolvidas e características que ajudá-los a crescem em seus ambientes nativos. Utilização bem sucedida de tecidos vegetais como andaimes engenharia de tecido propõe uma alternativa potencialmente mais barata ao caro e muitas vezes difícil projetar, biomateriais. Topografia de superfície do tecido de planta, que inerentemente varia de uma espécie para outra, também pode ser aproveitada para direto espacialmente orientado crescimento celular25. Por exemplo, um estudo anterior mostrou que células humanas respondem aos sinais topográficos presentes em plantas decellularized25, assim que estes andaimes podem ser usados para cultura de células em padrões altamente organizados25. Outra característica que é desejável em engenharia de tecidos é perfusability de novo . Tecidos vegetais evoluíram ao longo de centenas de milhões de anos para ser extremamente eficiente no transporte de fluidos, e suas redes vasculares podem ser eficientemente perfundidos24. Esta propriedade pode ser potencialmente usada para guiar a migração celular e a angiogênese, com o objetivo final da criação de tecidos de substituição para aplicações clínicas. Isto é reforçado pelas conclusões de estudos anteriores que demonstraram que biomateriais com a elevada área superficial e porosidade interconectada são favoráveis à proliferação celular e quando implantado no vivo, habilitar a migração para dentro das células hospedeiras para o implante36,37,38,39. A elevada área superficial e porosidade interligada também são a marca registrada de tecidos de planta40,41,,42, assim planta-derivados andaimes tem o potencial de integração com os tecidos circundantes, vivo em. Além disso, estudos recentes encontraram que decellularized folhas podem ser pintadas com êxito com células24 e que, quando as células humanas foram semeadas em tecidos de planta decellularized, obedecessem aos seus sinais topográficos25. Quando tomadas andaimes todos juntos, de origem vegetal possuam as propriedades necessárias para ser aplicado com sucesso para aplicações de engenharia de tecidos.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Gostaríamos de agradecer a John Wirth dos jardins Olbrich para fornecer graciosamente as amostras utilizadas neste projeto. Este trabalho é apoiado em parte pela nacional do coração, pulmão e Instituto de sangue (R01HL115282 a G.R.G.) Fundação Nacional de ciência (DGE1144804 J.R.G e G.R.G.) e o departamento de cirurgia da Universidade de Wisconsin e fundo Alumni (H.D.L.). Este trabalho também foi financiado em parte pela Agência de protecção ambiental (grant estrela n. º 83573701), o National Institutes of Health (R01HL093282-01A1 e UH3TR000506) e o National Science Foundation (IGERT DGE1144804).
Materiais
| Name | Company | Catalog Number | Comments |
| Sodium dodecyl sulfate | Sigma Life Science | 75746-1KG | |
| Triton X-100 | MP Biomedicals, LLC | 807426 | Non-ionic surfactant referenced in paper. Very viscous reagent, can help to cut end of pipette tip when drawing it up. |
| Concentrated bleach (8.25% sodium hypochlorite) | Clorox | Item #: 31009 | Standard concentrated bleach. |
| Sodium bicarbonate | Acros Organics | 217120010 | Can be substituted with sodium hydroxide or sodium carbonate. |
| 8 mm Biopunch | HealthLink | 15111-80 | Cuts samples that fit well in 24 well plate |
| Belly Dancer-Shake table | Stovall Life Sciences | BDRAA115S | Use low speeds to not damage tissues. Can use any model/brand of shake table. |
| Isotemp hot/stir plate | Fisher Scientific | Can use any style/brand of hot/stir plate. | |
| Beaker | Any | Can use any size beaker as long as it will fit your samples and not overcrowd them. | |
| Tris Hydrochloride | Fisher Scientific | BP153-500 | |
| DMEM | Corning | MT50003PC | |
| Quant-iT Picogreen dsDNA assay | Life Technologies | P11496 | Can use any dsDNA quantification mehtod on hand. |
Referências
- Vacanti, J. Tissue engineering and regenerative medicine: from first principles to state of the art. Journal of Pediatric Surgery. 45 (2), 291-294 (2010).
- Kim, S., et al. Survival and function of hepatocytes on a novel three-dimensional synthetic biodegradable polymer scaffold with an intrinsic network of channels. Annals of Surgery. 228 (1), 8-13 (1998).
- Park, A., Wu, B., Griffith, L. Integration of surface modification and 3D fabrication techniques to prepare patterned poly(L-lactide) substrates allowing regionally selective cell adhesion. Journal of Biomaterial Science, Polymer Edition. 9 (2), 89-110 (1998).
- Steinhoff, G., et al. Tissue engineering of pulmonary heart valves on allogenic acellular matrix conduits: in vivo restoration of valve tissue. Circulation: JAMA. 102 (Suppl 3), III-50- III -55. 102 (Suppl 3), III-50-III-55 (2000).
- Stock, U., et al. Tissue-engineered valved conduits in the pulmonary circulation. Journal of Thoracic Cardiovascular Surgery. 119 (4 Pt 1), 732-740 (2000).
- Ott, H., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Guyette, J., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Huerta, S., Varshney, A., Patel, P., Mayo, H., Livingston, E. Biological Mesh Implants for Abdominal Hernia Repair: US Food and Drug Administration Approval Process and Systematic Review of Its Efficacy. JAMA Surgery. 151 (4), 374-381 (2016).
- Catalano, E., Cochis, A., Varoni, E., Rimondini, L., Azzimonti, B. Tissue-engineered skin substitutes: an overview. Journal of Artificial Organs. 16 (4), 397-403 (2013).
- Fang, B., Wan, Y., Tang, T., Gao, C., Dai, K. Proliferation and osteoblastic differentiation of human bone marrow stromal cells on hydroxyapatite/bacterial cellulose nanocomposite scaffolds. Tissue Engineering. 15 (5), 1091-1098 (2009).
- Wan, Y., et al. Biomimetic synthesis of hydroxyapatite/bacterial cellulose nanocomposites for biomedical applications. Materials Science and Engineering. 27 (4), 855-864 (2007).
- Vinatier, C., et al. An injectable cellulose-based hydrogel for the transfer of autologous nasal chondrocytes in articular cartilage defects. Biotechnology and Bioengineering. 102 (4), 1259-1267 (2009).
- Vinatier, C., et al. A silanized hydroxypropyl methylcellulose hydrogel for the three-dimensional culture of chondrocytes. Biomaterials. 26 (33), 6643-6651 (2005).
- Vinatier, C., et al. Engineering cartilage with human nasal chondrocytes and a silanized hydroxypropyl methylcellulose hydrogel. Journal of Biomedical Materials Research Part A. 80 (1), 66-74 (2007).
- Helenius, G., Bäckdahl, H., Bodin, A., Nannmark, U., Gatenholm, P., Risberg, B. In vivo biocompatibility of bacterial cellulose. Journal of Biomedical Materials Research Part A. 76 (2), 431-438 (2006).
- Zhong, S., et al. An aligned nanofibrous collagen scaffold by electrospinning and its effects on in vitro fibroblast culture. Journal of Biomedical Materials Research Part A. 79 (3), 456-463 (2006).
- Thomas, D., et al. A shape-controlled tuneable microgel platform to modulate angiogenic paracrine responses in stem cells. Biomaterials. 35 (31), 8757-8766 (2014).
- Lai, C., Zhang, S., Wang, L., Sheng, L., Zhou, Q., Xi, T. The relationship between microstructure and in vivo degradation of modified bacterial cellulose sponges. Journal of Materials Chemistry B. 3 (46), 9001-9010 (2015).
- Märtsonad, M., Viljantoa, J., Hurmea, T., Laippalac, P., Saukkob, P. Is cellulose sponge degradable or stable as implantation material? An in vivo subcutaneous study in the rat. Biomaterials. 20 (21), 1989-1995 (1999).
- Miyamoto, T., Takahashi, S., Ito, H., Inagaki, H., Noishiki, Y. Tissue biocompatibility of cellulose and its derivatives. Journal of Biomedical Materials Research. 23 (1), 125-133 (1989).
- Entcheva, E., Bien, H., Yin, L., Chung, C., Farrell, M., Kostov, Y. Functional cardiac cell constructs on cellulose-based scaffolding. Biomaterials. 25 (26), 5753-5762 (2004).
- Modulevsky, D., Cuerrier, C., Pelling, A. Biocompatibility of Subcutaneously Implanted Plant-Derived Cellulose Biomaterials. PLoS One. 11 (6), e0157894 (2016).
- McCulloh, K., Sperry, J., Adler, F. Water transport in plants obeys Murray's law. Nature. 421 (6926), 939-942 (2003).
- Gershlak, J., et al. Crossing kingdoms: Using decellularized plants as perfusable tissue engineering scaffolds. Biomaterials. 125, 13-22 (2017).
- Fontana, G., et al. Biofunctionalized Plants as Diverse Biomaterials for Human Cell Culture. Advanced Healthcare Materials. 6 (8), (2017).
- Wegst, U., Bai, H., Saiz, E., Tomsia, A., Ritchie, R. Bioinspired structural materials. Nature Materials. 14 (1), 23-36 (2015).
- Gibson, L. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society Interface. 9 (76), 2749-2766 (2012).
- Hoshiba, T., et al. Decellularized Extracellular Matrix as an In vitro Model to Study the Comprehensive Roles of the ECM in Stem Cell Differentiation. Stem Cells International. 2016, (2016).
- Guyette, J., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Modulevsky, D. J., et al. Apple derived cellulose scaffolds for 3D mammalian cell culture. PLoS ONE. 9 (5), e97835 (2014).
- Seba, A., Sloane, H. The Anatomical Preparation of Vegetables, by Albertus Seba, F. R. S. Communicated to the Royal Society by Sir Hans Sloane, Bart. Pr. R. S. and Col. Med. Lond. Translated from the German, by Mr. Zolman, F. R. S. Philosophical Transactions. 36 (407), 441-444 (1775).
- Parrish, E. The Phantom Boutique: A Popular Treatise on the Art of Skeletonizing Leaves and Seed-Vessels and Adapting Them to Embellish the Home of Taste. The Phantom Boutique: A Popular Treatise on the Art of Skeletonizing Leaves and Seed-Vessels and Adapting Them to Embellish the Home of Taste. , (1865).
- Coffin, S., Gaudette, G. Aprotinin extends mechanical integrity time of cell-seeded fibrin sutures. Journal of Biomedical Materials Research Part A. 104 (9), 2271-2279 (2016).
- Zangala, T. Isolation of Genomic DNA from Mouse Tails. Journal of Visualized Experiments: JoVE. (6), e246 (2007).
- Borselli, C., Cezar, C., Shvartsman, D., Vandenburgh, H., Mooney, D. The role of multifunctional delivery scaffold in the ability of cultured myoblasts to promote muscle regeneration. Biomaterials. 32 (34), 8905-8914 (2011).
- Hill, E., Boontheekul, T., Mooney, D. Designing Scaffolds to Enhance Transplanted Myoblast Survival and Migration. Tissue Engineering. 12 (5), 1295-1304 (2006).
- Hill, E., Boontheekul, T., Mooney, D. Regulating activation of transplanted cells controls tissue regeneration. Proceedings of the National Academy of Sciences. 103 (8), 2494-2499 (2006).
- Ma, J., Holden, K., Zhu, J., Pan, H., Li, Y. The Application of Three-Dimensional Collagen-Scaffolds Seeded with Myoblasts to Repair Skeletal Muscle Defects. Journal of Biomedicine and Biotechnology. 2011, 1-9 (2011).
- Tyree, M. Plant hydraulics: the ascent of water. Nature. 424 (6943), 923 (2003).
- Raven, P., Evert, R., Eichhorn, S. . Biology of Plants. , (2005).
- Turrell, F. The area of the internal exposed surface of dicotyledon leaves. American Journal of Botany. 23 (4), 255-264 (1936).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados