Method Article
Simultânea vídeo-EEG-ECG de monitoramento para identificar a disfunção Neurocardiac em modelos de Mouse de epilepsia
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para gravar o cérebro e coração bio sinais nos ratos usando vídeo simultâneo, Eletroencefalografia (EEG) e eletrocardiograma (ECG). Descrevemos também métodos para analisar as gravações de EEG-ECG resultantes para convulsões, potência espectral de EEG, função cardíaca e variabilidade da frequência cardíaca.
Resumo
Na epilepsia, convulsões podem evocar distúrbios de ritmo cardíaco, tais como alterações de frequência cardíaca, condução blocos, asystoles e arritmias, que potencialmente podem aumentar o risco de morte inesperada súbita em epilepsia (SUDEP). Eletroencefalografia (EEG) e eletrocardiograma (ECG) são ferramentas de diagnóstico clínicas utilizadas para monitorizar o cérebro anormal e ritmos cardíacos em pacientes. Aqui, uma técnica para simultaneamente gravar vídeo, EEG e ECG em ratos para medida de comportamento, cérebro e atividades cardíacas, respectivamente, é descrita. A técnica descrita neste documento utiliza um amarrados (i.e., com fio) configuração de gravação em que o eletrodo implantado na cabeça do rato é Hard-wired para o equipamento de gravação. Comparado a telemetria sem fio, sistemas de gravação, o arranjo amarrado possui diversas vantagens técnicas tais como um maior número possível de canais para gravação de EEG ou outros biopotentials; custos mais baixos de eletrodo; e maior frequência de largura de banda (ou seja, taxa de amostragem) de gravações. O básico desta técnica também pode ser facilmente modificado para acomodar gravando outros bio-sinais, tais como a eletromiografia (EMG) ou pletismografia para avaliação do músculo e atividade respiratória, respectivamente. Além de descrever como realizar as gravações de EEG-ECG, detalhamos também métodos para quantificar os dados resultantes para convulsões, EEG potência espectral, função cardíaca e variabilidade da frequência cardíaca, que demonstramos em um experimento de exemplo usando um mouse com epilepsia devido ao apagamento do gene Kcna1 . Vídeo-EEG-ECG, monitorização em modelos do rato de epilepsia ou outra doença neurológica fornece uma ferramenta poderosa para identificar a disfunção a nível do cérebro, coração ou as interações cérebro-coração.
Introdução
Eletroencefalografia (EEG) e eletrocardiograma (ECG) são técnicas poderosas e amplamente utilizadas para a avaliação na vivo o cérebro e a função cardíaca, respectivamente. EEG é a gravação da atividade elétrica cerebral, anexando eletrodos para o couro cabeludo1. O sinal gravado com EEG invasivo representa flutuações de tensão decorrentes de Likert excitatórios e inibitórios potenciais pós-sinápticos gerados principalmente pelos neurônios piramidais corticais1,2. EEG é o teste de neurodiagnostic mais comuns de avaliação e gerenciamento de pacientes com epilepsia3,4. É especialmente útil quando crises epilépticas ocorrem sem manifestações comportamentais convulsivas evidentes, tais como crises de ausência ou não-convulsiva estado de mal epiléptico5,6. Inversamente, epilepsia não relacionados com as condições que levam a episódios convulsivos ou perda de consciência podem ser diagnosticadas como crises epilépticas sem monitoramento de vídeo-EEG7. Além de sua utilidade no campo da epilepsia, o EEG é também amplamente utilizado para detectar a atividade anormal do cérebro associada com distúrbios do sono, encefalopatias e distúrbios de memória, bem como para complementar a anestesia geral durante cirurgias2 , 8 , 9.
Em contraste com EEG, ECG (ou EKG como ele às vezes é abreviado) é a gravação da atividade elétrica do coração10. Geralmente são realizadas por ECGs, anexando os eletrodos para as extremidades dos membros e da parede torácica, que permite a detecção das alterações de tensão gerada pelo miocárdio durante cada ciclo cardíaco de contração e relaxamento de10,11. Os principais componentes de forma de onda de ECG de um ciclo cardíaco normal incluem a onda P, o complexo de QRS e a onda T, que corresponde à despolarização atrial, ventricular despolarização e repolarização ventricular, respectivamente,10, 11. monitorização de ECG é usada rotineiramente para identificar arritmias cardíacas e defeitos do sistema de condução cardíaca12. Entre os pacientes de epilepsia, a importância do uso de ECG para identificar arritmias potencialmente fatais é amplificada, já que eles são significativamente maior risco de ataque cardíaco súbito, bem como a morte inesperada súbita em epilepsia13, 14,15.
Além de suas aplicações clínicas, gravações de EEG e ECG tornaram-se uma ferramenta indispensável para a identificação de disfunção de cérebro e coração em modelos do rato da doença. Embora tradicionalmente estas gravações foram realizadas separadamente, aqui nós descrevemos uma técnica para gravar vídeo, EEG e ECG simultaneamente em ratos. O método de vídeo-EEG-ECG simultâneo detalhado aqui utiliza uma configuração de gravação amarrados em que o eletrodo implantado na cabeça do rato é Hard-wired para o equipamento de gravação. Historicamente, esta amarrado, ou com fio, configuração tem sido o padrão e método mais amplamente usado para gravações de EEG em ratos; no entanto, sistemas de telemetria de EEG sem fio também foram desenvolvidos recentemente e estão ganhando na popularidade,16.
Em comparação com sistemas de EEG sem fio, o arranjo amarrado possui várias vantagens técnicas que podem tornar preferível dependendo da aplicação desejada. Estas vantagens incluem um maior número de canais para gravação de EEG ou outros biopotentials; custos mais baixos de eletrodo; disponibilidade de eletrodo; menor susceptibilidade para sinalizar a perda; e maior largura de banda de frequência (i. e., taxa de amostragem) de gravações17. Feito corretamente, o método de gravação amarrados descrito aqui é capaz de fornecer alta qualidade, livre de artefato EEG e ECG dados simultaneamente, junto com o vídeo correspondente para acompanhamento comportamental. Este dados de EEG e ECG podem então ser extraídos para identificar neural, cardíaca ou anormalidades neurocardiac tais como convulsões, alterações no EEG de energia espectro, blocos de condução cardíaca (i. e., ignorada batidas do coração) e mudanças na variabilidade da frequência cardíaca. Para demonstrar a aplicação destes métodos quantitativos de EEG-ECG, apresentamos um experimento de exemplo usando um nocaute de Kcna1 (- / -) do mouse. Kcna1 ratos - / - faltam de voltagem-dependente Kv1.1 subunidades α e apresentam como consequência espontâneas convulsões, disfunção cardíaca e morte prematura, tornando-os um modelo ideal para avaliação simultânea de EEG-ECG de deletérios associados a epilepsia disfunção neurocardiac.
Protocolo
Todos os procedimentos experimentais devem ser realizados em conformidade com as diretrizes do National Institutes of Health (NIH), aprovada do sua instituição cuidado institucional do Animal e uso Comité (IACUC). Os principais instrumentos cirúrgicos necessários para este protocolo são mostrados na Figura 1.
1. preparação do eléctrodo para implantação
- Coloque o 10-soquete fêmea nanoconnector (ou seja, o eletrodo; Figura 2A) em torno do tabletop com 10 fios voltada para cima e o fio preto na frente. Usando a pinça fina, dobre o primeiro fio (preto) para a direita e o segundo fio (tan) para a esquerda. Em seguida dobre o vermelho, laranja, azul e púrpura fios alternando direita e esquerda (Figura 2B). Corte os fios amarelos, verdes, brancos e cinzento na base da sua fixação.
- Para preparar os fios de ECG, use um marcador permanente para fazer marcas sobre o fio roxo ~3.2 cm e ~3.5 cm da base do eletrodo e o fio azul na ~2.2 cm e ~2.5 cm (Figura 2). Retire o eletrodo o torno e expor os filamentos de prata entre as áreas marcados descascando o isolamento de um lado do fio com uma lâmina de bisturi (Figura 2D).
Nota: Raspar os fios deve ser feita sob o microscópio. Cuidado deve ser usado para garantir que os filamentos de prata não são danificados como o isolamento é raspado fora. - Coloque o eletrodo de volta no torno. Afixe um pedaço de fita dupla-face de montagem, pré-cortados para o comprimento e a largura do eletrodo, a parte superior dos fios usando uma fina camada de supercola.
Nota: Antes de aderir a fita, ser não distorcida e certeza de que os fios estão deitado, saindo direto para os lados, uma sobre a outra. - Apare os fios a utilizar para EEG em um ângulo ligeiramente em forma de V para um comprimento de aproximadamente 7-9 mm, com os fios marrom e pretos, cortados o mais curto. Não corte os fios a utilizar para ECG (Figura 2E).
- Empacotar e esterilizar o eletrodo para uso posterior.
2. o Mouse se preparando para a cirurgia
- Pese o mouse. Injetar uma dose de 5 mg/kg de carprofeno por via subcutânea (s.c.). Anestesia o animal com uma injeção intraperitoneal (i.p.) de Mouse anestésica Cocktail contendo cetamina (80 mg/kg), acepromazina (1 mg/kg) e xilazina (10mg/kg).
- Uma vez que o rato torna-se anestesiada, aplique uma linha fina de pomada oftálmica veterinária para cada olho. Utilizar um aparador elétrico, barba duas pequenas áreas (~ 2 cm2) em ambos os lados do tronco do rato, correspondente a onde os fios de ECG será implantado (Figura 3A).
Nota: A área raspada no lado direito deve ficar em uma posição aproximadamente dorsolateral apenas atrás do direito "axila" do animal. No lado esquerdo, a área depilada deve ser localizada em uma orientação mais ventrolateral ao longo do lado do animal, mas cerca de 1 cm mais posterior do que a área raspada no lado direito (Figura 3A). - Remover o cabelo cortado e limpe ambas as áreas depiladas com uma solução de clorexidina.
3. anexar o eletrodo no crânio
- Posicione o mouse na posição de bruços no palco do microscópio dissecação e confirmar a profundidade adequada de anestesia pela ausência do reflexo do dedo do pé-pitada.
Nota: Os passos 3.2 para 5.6 devem ser feitos com o auxílio de um microscópio. - Mantendo a cabeça firme entre o polegar e o indicador, parte da pele para baixo do centro da cabeça entre as orelhas apenas atrás dos olhos com um cotonete de algodão embebido em álcool (Figura 3B).
Nota: Embora esta cirurgia deve ser feita com técnica asséptica, não é um procedimento estéril desde o couro cabeludo não pode ser raspado e o mouse deve ser manipulado durante a cirurgia. - Usando um bisturi, faça uma incisão de ~ 1 cm através do couro cabeludo, entre as peles se separaram de apenas na frente das orelhas apenas entre os olhos (Figura 3, D).
- Usando tanto o lado do bisturi ou um cotonete, lixe ligeiramente a membrana de muco no topo do crânio até o osso aparece seco.
- Arranca a pele ao redor do perímetro da incisão formando uma fina borda de pele careca. Retire cuidadosamente qualquer pele que pode ter caído do campo cirúrgico com um par de pinças. Seca a superfície do crânio com um aplicador com ponta de algodão estéril, aplicando uma pressão suave durante alguns segundos, se necessário.
- Faça quatro marcas no crânio com um marcador permanente esterilizado em locais onde a trepanação serão perfurados (Figura 3E). Coloque duas marcas, uma em cada lado da sutura sagital anterior bregma, anterior cerca de 4 mm e 5 mm lateral de bregma (acima do córtex frontal), para os fios de referência e o chão. Coloque outra duas marcas, uma em cada lado da sutura sagital posterior de bregma, aproximadamente 2 mm posterior e lateral de 7 mm para bregma (acima de córtex parietotemporal), para os dois fios de gravação de EEG.
Nota: Isto não é uma cirurgia estereotáxica e as distâncias referidas são aproximações que irão variar dependendo do tamanho do mouse. Certifique-se de que os buracos são colocados lateralmente para acomodar facilmente a base do implante eletrodo que vai ser afixada à sua mediana ao longo da sutura sagital (Figura 3F). - Usando uma broca de micro estéril, fazer buracos no crânio pequeno em cada marca com uma broca de 0,8 mm de diâmetro.
- Aplique uma pressão suave enquanto perfuração para criar pequenos nichos em cada marcado ponto. Perfurar o crânio por pulsando o bocado de broca, como o buraco se aproxima da conclusão, certificando-se de não aplicar muita pressão, o que poderia levar a penetrar e danificar o tecido cerebral subjacente.
- Depois que todos os furos, limpe a área limpa com um cotonete.
- Para aderir o eletrodo para o topo do crânio, retire a película protectora da fita dupla-face de montagem sobre o eletrodo. Aplique uma camada fina de cola para a fita. Usando um par de pinças, retire o eletrodo o torno. Prepare-a tal que, quando posicionada ao longo da sutura sagital, os fios mais curtos do EEG são rostrais e os fios mais longos de ECG são caudais.
- Aderir o eletrodo no crânio sobre a sutura sagital entre os furos (Figura 3F).
Nota: O crânio deve estar completamente seco para a colagem sobre o eletrodo para furar. Certifique-se para não obstruir a trepanação no crânio com o eletrodo ou cola. - Brevemente, segure o eletrodo no lugar para assegurar a aderência no crânio e em seguida, permitir que a cola secar durante 5-10 min.
- Aderir o eletrodo no crânio sobre a sutura sagital entre os furos (Figura 3F).
4. implantar os fios para ECG
- Gire o mouse um pouco para o seu lado direito, mantendo a cabeça ereta. Pegue o fio de ECG a longa do lado esquerdo e estendê-lo para o lado do mouse para a área depilada no lado esquerdo. Visualize onde o fio exposto será posicionado uma vez que é um túnel por baixo da pele.
Nota: Para a referência, uma pequena marca pode ser feita na pele com um marcador permanente. - Usando um bisturi, faça uma incisão de ~ 1 cm na pele no local onde será posicionado o fio exposto. Mantendo a incisão aberta com pinça Adson, use fórceps Dumont para soltar a pele em volta da incisão do tecido conjuntivo subjacente para formar um bolso para o fio. Início no local de incisão no lado do animal, por via subcutânea do túnel com um pedaço de tubo de polietileno estéril (que foi preparado por um corte a ~ 6 cm de comprimento com a ponta chanfrada) até a borda chanfrada sai da incisão feita na cabeça (< C0 > figura 4A, B).
- Alimente o arame de ECG através da tubulação usando fórceps Dumont (Figura 4). Ao remover o tubo, segure o fio eléctrodo com pinça Adson como ele sai da incisão lateral. Puxe o fio esticado (Figura 4).
- Fixe o cabo de ECG por sutura-lo para o tecido sob a pele com Nylon 6-0 (Figura 4E). Usando pinças e suportes de agulha Olsen Hegar, aplica uma sutura sobre os filamentos expostos e outra sutura antes ou após a parte exposta.
- Cortar o fio eléctrodo cerca de 2-3 mm após a última sutura e dobra final no bolso de pele formada anteriormente. Reunir os dois lados da incisão e fechar com um clipe de ferida aplicado usando suportes de agulha Crile-madeira (Figura 4F).
- Vire o mouse para que o nariz está apontando na direção oposta. Com a cabeça ainda na posição de bruços na vertical, rode o mouse levemente para o lado esquerdo.
- Repita os passos acima para colocar o cabo de ECG contralateral.
Nota: Para aproximar uma pista configuração de gravação II ECG, ECG certo fio deve ser colocado um pouco mais dorsal e anterior do que o fio esquerdo do ECG, que deve ser ligeiramente mais ventral e posterior.
5. implantar os fios para EEG
- Para implantar os fios para EEG, posicione o mouse horizontalmente na posição de bruços e abre a incisão no couro cabeludo com o polegar e o indicador da mão não dominante.
- Com a pinça, retire qualquer pele que pode ter sido puxado debaixo da pele pela tubagem de. Se necessário, seque o crânio novamente com um cotonete. Usando pinças de Dumont, cuidadosamente Retire e remover quaisquer detritos ou coágulos de sangue que pode ter coletado na trepanação.
- Começando com o buraco mais anterior de um lado, dobre o fio que está mais próximo daquele buraco que é posicionado diretamente sobre o furo, mas ainda não inserido. Segure a extremidade inferior do fio e alimentá-lo mais horizontalmente possível dentro do buraco até ~ 2-3 mm do fio está sob o crânio (Figura 5A).
Nota: Os fios devem passar horizontalmente entre o crânio e a superfície do cérebro. Os fios não devem empalar o cérebro. - Com a extremidade do fio seguro no buraco, misture delicadamente para baixo a parte restante do fio para que encontra-se encostado contra o crânio.
- Continue da mesma maneira com o fio posterior do mesmo lado. Repita para os fios de anteriores e posteriores do outro lado (Figura 5B).
Nota: A configuração do fio está resumida na Figura 5.
6. fechar a incisão de cabeça com cimento Dental
- Misture duas colheres de pó de policarboxilato com ~ 5 gotas de líquido de policarboxilato. Agite a mistura com um palito para fazer um colar com a viscosidade desejada.
Nota: As etapas subsequentes 6.2 a 6.4 devem ser realizadas rapidamente uma vez que o cimento dental seca dentro de 1 min após a mistura. - Pegue uma gota grande de massa de cimento com o palito e aplicá-lo em torno da base do eléctrodo começando caudalmente (figura 6A). Continue em torno do eletrodo, permitindo que o cimento gotejar sobre os fios, formando um tampão ao redor do implante (Figura 6B).
- Usando pinças de Dumont, puxe a pele nas bordas da incisão sobre a tampa de cimento e pressione juntos, tomando cuidado para não perturbar os fios implantados abaixo. Pressione a pele para cima em cimento para ajudar com fechamento.
- Sele a incisão entre os olhos lig a pele com o cimento dental (Figura 6).
7. auxiliando a recuperação pós-cirúrgica
- Coloque o mouse em uma gaiola vazia em uma almofada de calor circulante. Monitore o mouse até que recupere a consciência e pode manter a prostração esternal.
- Post-surgically, casa do rato individualmente em uma gaiola com comida e gel hidratante colocados no chão da gaiola. Topo da gaiola com uma tampa de microisolador.
- No pós-operatório de 24 h, injete (s.c.) o mouse com 5 mg/kg de carprofeno.
- Permita ≥ 48 h de recuperação pós-cirúrgica, antes da gravação.
8. sinais de EEG-ECG gravação de um rato amarrado
- Após a recuperação, transferi o mouse implantado para uma câmara de gravação com paredes transparentes para facilitar o monitoramento de vídeo. Ao baraço (i.e., "ligue") o mouse (Figura 7A), com delicadeza mas com firmeza Mantenha o mouse em uma mão enquanto com a outra mão para inserir o nanoconnector de 10 pinos (macho) com post guia os soquetes do implante de eletrodos de EEG-ECG (fêmea) na cabeça do rato.
- Segure os fios acima da câmara utilizando uma haste de suporte, certifique-se de há folga suficiente no fio para permitir o mouse para mover-se livremente mas não tanto que a fiação arrasta o piso da câmara.
- Conecte os fios de nanoconnector a 10 pinos para uma unidade de interface de aquisição de sinal de computador conectado com vídeo sincronizado gravação conforme representado na Figura 7B.
- Definir as taxas de amostragem para a gravação ser ≥ 2 KHz para ECG e ≥ 500 Hz para EEG (isto é, pelo menos duas vezes a frequência que um está interessada em estudar).
- Para melhor visualização dos traços sinal, aplicam-se os seguintes filtros como feito anteriormente18: um filtro de 60Hz entalhe para todos os dados, um filtro de passa-alta banda de 75 Hz baixa e 0,3-Hz para EEG e um filtro passa-altas de 3 Hz para ECG.
- Gravar vídeo simultâneo e EEG-ECG (Figura 7) e salvar os dados digitalizados para análise off-line com software de processamento de sinal.
- Uma vez concluídas as gravações, cuidadosamente, solte o mouse e devolvê-lo à sua gaiola em casa.
9. analisar as gravações de EEG
- Realizar análise de quantificação de apreensão.
- Inspecione visualmente a gravação inteira de EEG para identificar manualmente episódios de convulsão, definidos neste modelo como alta-amplitude (pelo menos duas vezes a linha de base), rítmicas descargas electrographic duração maior que 5 s (Figura 8A). Examine o vídeo que corresponde as convulsões electrographic identificar comportamentos associados a apreensão.
- Para calcular a frequência de apreensão (apreensões/h), divida o número de apreensões pelo número total de horas de gravação.
- Para calcular a duração da convulsão, medir o tempo decorrido desde o início da convulsão electrographic até a cessação da cravação (Figura 8A).
- Para calcular o fardo de apreensão, definido como o tempo gastado a apreensão por hora, resumir as durações de apreensão e dividir pelo total de gravação horas.
- Realizar a análise do poder espectral de EEG pré e estável.
- Selecione um 30-min (ou qualquer outra duração de tempo desejado) segmento de dados de EEG peri-estável em torno do episódio de convulsão a ser examinado. Exporte os dados brutos (com configurações de filtro removidas) como um arquivo de dados ASCII ou alguns outro arquivo tipo compatível com software de espectro de energia.
- Converta o arquivo ASCII para um arquivo de texto usando um aplicativo de editor de texto simples.
- Abra o arquivo de texto resultante do segmento do EEG no software do espectro de energia e especifique as seguintes configurações: "ignorar linhas não-numéricos"; "vírgula como delimitador de dados"; e taxa de amostragem de 1000 Hz padrão.
- Uma vez que o sinal de EEG aparece no software do espectro de energia em seu respectivo canal, clique no menu suspenso de canal e selecione "filtro digital". Aplica filtros passa-faixa digital correspondente à faixa de frequência desejada para ser analisado.
- Abra "Vista de espectro" do painel de menu, selecione o canal de exibição de EEG adequado para ser analisado e em seguida, clique em "configurações". Em "configurações", especifique os seguintes parâmetros para o espectrograma e clique em "Fechar" para gerar o espectrograma (Figura 8): tamanho da FFT: 8192, janela de dados: Welch, sobreposição de janela: 93,75%, modo de exibição: densidade de potência, espectrograma cores: arco-íris, Não. de cores: 64, com média de PSD: 1, componente de frequência Remove zero: verifiquei como "on".
- Ajuste a escala colorimétrica conforme necessário para a visualização ideal do espectrograma.
- Abra o "Gerenciador de análise" do painel de menu. Clique em "+ nova análise" para criar duas análises (análise 1 e 2 de análise), que irão corresponder aos segmentos de EEG de pré e estável para ser analisado. Especificar os segmentos pré e estável desejados sobre o espectrograma e associá-las com análise 1 e 2 da análise, respectivamente.
Nota: Somente os dados de EEG sem ruído e artefatos devem ser considerados e períodos das gravações de EEG com artefatos significativos devem ser retirados da análise. - Uma vez que os segmentos de análise são criados, abra "Exibição de bloco de dados" do painel de menu. Clique sobre o respectivo canal de EEG para abrir o menu "Dados Pad coluna Setup" para esse canal.
- Em "Configuração de coluna de almofada dados", selecione a opção para "Espectro" e selecione "Percentagem Total de energia."
- No menu "dados Pad coluna configuração," clique em "opções" e especificar o intervalo de frequência a ser examinado. Clique em "Okey" nas "Espectro dados Pad opções" e no "Dados Pad coluna Setup", e o poder de porcentagem (%) para a banda de frequência especificada aparecerá na exibição da almofada de dados para o segmento de análise selecionados (ou seja, análise 1 ou 2 análise) conforme especificado no " Gerente de análise. "
Nota: O % de energia, ou poder relativo, de cada banda é expresso como a porcentagem do total de energia espectral dentro da faixa de frequência especificada. - Repita a etapa anterior para cada banda de frequência ser analisado.
Nota: Frequentemente utilizados intervalos para as cinco bandas de frequências de EEG principais incluem18: δ-banda = 0.5-3 Hz, - banda = 3.5-7 Hz, α-banda = 8-12 Hz, β-banda = 13-20 Hz e γ-banda = 21-50 Hz.
10. analisar as gravações de ECG
- Quantificar os batimentos cardíacos saltado.
- Inspecione visualmente a gravação inteira de ECG para identificar manualmente batimentos cardíacos saltado, definidos como um prolongamento do intervalo RR igualando intervalo ≥ 1,5 vezes o anterior R-R, que é frequentemente associado com um indicativo de onda P não conduzidas do atrioventricular bloco de condução (Figura 9A).
- Para calcular a frequência das batidas do coração saltado por hora, divida o número total de batidas ignorados durante a sessão de gravação pela duração total de horas de gravação.
- Realizar análise de frequência cardíaca (VFC) de variabilidade.
- Do software de aquisição de dados, altere as configurações de log para 1 época para o canal de ECG. Gerar segmentos de analisador para as gravações de ECG: segmento de um ECG de 5 min cada 3 horas durante o período de luz-fase de 12 horas, para um total de 4 segmentos.
Nota: As gravações de ECG selecionadas para análise devem ser durante os momentos em que o animal está parado e os dados são livres de artefatos de movimento. - Gerar uma planilha dos valores intervalo R-R do ECG selecionado analisado segmentos clicando em "Salvem analisados dados derivados." Rever a planilha para qualquer dados ausentes ou maus dados e remover todos os outros valores numéricos, exceto os dados de intervalo R-R. Salvar esta planilha modificada como um arquivo de texto, selecionando a opção de "delimitado por tabulação."
- Abra o arquivo de texto como um arquivo ASCII personalizado no software HRV, especificando o seguinte opções: número de linhas de cabeçalho: 0, separador de coluna: guia / espaço, tipo de dados: RR, a coluna de dados: 1, unidades de dados: ms e a coluna de índice de Time: nenhum.
- Na seção de preferências do menu, defina as opções como detalhado abaixo.
- Defina opções de análise como mencionado. Intervalo R-R detrending, método de detrending: smoothn antecedentes, parâmetro de suavização: 500, VFC frequência bandas19, muito baixa frequência: 0-0.15 Hz, de baixa frequência: 0.15-1.5 Hz e alta frequência: 1.5-5 Hz
- Defina configurações avançadas, como mencionado. Opções de estimação de espectro, interpolação de RR série: 20Hz, pontos no domínio da frequência: 500 pontos/Hz, espectro FFT, usando métodos de periodograma de Welchs, largura de janela: 32s e sobreposição de janela: 50%
- Execute a análise de VFC para gerar valores de análise de domínio de tempo para dizer RR, RR STD (i.e., SDNN), RMSNN e frequência valores de análise de domínio para poder de HF, se poder e a relação de poder se/HF. Se desejar, salve os resultados como um arquivo PDF.
- Do software de aquisição de dados, altere as configurações de log para 1 época para o canal de ECG. Gerar segmentos de analisador para as gravações de ECG: segmento de um ECG de 5 min cada 3 horas durante o período de luz-fase de 12 horas, para um total de 4 segmentos.
Resultados
Para demonstrar como analisar os dados de gravações de EEG-ECG para identificar anormalidades neurocardiac, os resultados são apresentados para uma gravação de EEG-ECG de 24 horas de um Kcna1–/– rato (2 meses de idade). Estes animais mutantes, que são projetados para falta de voltagem-dependente Kv1.1 α-subunidades codificadas pelo gene Kcna1 , são um modelo genético usado com frequência de epilepsia, desde que eles apresentam início de atividade frequente e confiável convulsão tônico-clônica generalizada em cerca de 2-3 semanas de idade20. Além de convulsões espontâneas, Kcna1–/– ratos também apresentam morte prematura coincidindo com o início da epilepsia, bem como interictais e apreensão associado a disfunção cardíaca21, 22. portanto, Kcna1–/– ratos também costumam ser usados para estudar os potenciais processos fisiopatológicos subjacentes a morte inesperada súbita em epilepsia (SUDEP), a principal causa de epilepsia-relacionados mortalidade, que acredita-se que envolvem apreensão relacionados cardiorrespiratória, até o momento, mal compreendida mecanismos23.
Neste experimento, o componente de EEG das gravações do Kcna1–/– rato mostrou frequentes convulsões espontâneas que tipicamente são observadas como um pico inicial grande pelo aparecimento de convulsão seguido de breve tensão depressão, transita para alta amplitude spiking e terminando em estourar padrões de supressão (Figura 8A). Usando o vídeo gravado simultaneamente, estes apreensões electrographic foram encontrados para coincidir com a apreensão, como comportamentos, caracterizados pela criação e membro anterior clonus que posteriormente evoluiu para convulsões tônico-clônicas de corpo inteiro. Digno de nota, uma das principais vantagens do EEG é a capacidade de identificar ataques electrographic "silenciosas" que não estão associados com comportamentos óbvios, significando que eles iria ser perdidos por um observador marcando convulsões com base no comportamento sozinho. A quantificação da incidência de apreensão neste particular Kcna1–/– rato revelou 15 apreensões durante o período de 24 horas de gravação (Figura 8B). A duração destes apreensões em média 60 ~ s, variando de cerca 15-105 s (Figura 8B). Para demonstrar a análise de densidade de potência espectral relativa do período pré e estável, uma convulsão de duração 80-s foi seleccionada para avaliação utilizando o software do espectro de energia e um espectrograma peri-estável gerados (Figura 8). A potência espectral relativa estável da faixa de frequência delta foi aumentada em ~ 50% em comparação com a linha de base pre-estável (Figura 8). Além disso, o poder relativo estável das outras maior frequência EEG bandas exibiu correspondente diminui em relação ao período pré-estável (Figura 8). O aumento no poder de delta estável e as diminuições no poder estável das outras bandas são indicativos de EEG, retardando, uma característica de longas, graves convulsões neste modelo18.
Analisando o componente de ECG da gravação a partir do Kcna1–/– rato, o número de batimentos cardíacos saltado interictais foi contado manualmente conforme descrito acima. A frequência das batidas do coração saltado neste Kcna1–/– do mouse foi 5.84/h (tabela 1), que é um > 5-fold aumento em comparação com ratos WT em nossos estudos anterior de18,21. No ECG de Kcna1–/– ratos, saltado coração bate muitas vezes apresentam uma onda P que não é seguida por um QRS complexos, como mostrado na Figura 9A, indicando um atrioventricular (AV) condução bloco21. Em seguida, usando o software HRV, VFC foi analisado para fornecer uma medida da influência do sistema nervoso autônomo na função cardíaca neste animal. As seguintes medidas de domínio de tempo de HRV foram calculadas para o Kcna1–/– do mouse: o desvio-padrão dos intervalos de passo-a-passo (SDNN), que é um índice de variabilidade autonômica total; e o raiz quadrático das diferenças sucessivas de passo-a-passo (RMSNN), que é um índice de tom parasympathetic. 24 usando os sinal aquisição gerado pelo software R-R intervalo valores para o Kcna1–/– rato (Figura 9B), o software HRV calculada uma taxa de coração de 737 batimentos/min (tabela 1) , que é similar aos ratos do WT em nossos anteriores estudos18. O SDNN e RMSNN valores foram calculado para ser ms 2,4 e 3,2 ms, respectivamente (tabela 1), que são sobre 2 - a 3 vezes maior do que uma normal WT rato18. O elevado tempo medidas de VFC domínio neste Kcna1–/– rato indicam o tom parasympathetic aumentado, sugerindo anormal controle autonômico do coração. Em seguida, usamos software de VFC para calcular os seguintes valores de VFC no domínio da frequência, que estão resumidos na tabela 1: a percentagem de energia de baixa frequência (LF); a percentagem de energia de alta frequência (HF); e a relação se/HF. Os componentes de HF são pensados para refletir a modulação parassimpática, Considerando que os componentes se são pensados para refletir que uma combinação do simpático e parassimpático influencia25. A relação se/HF é usada para capturar o equilíbrio relativo da atividade parassimpática e simpática.
Finalmente, além de derivar medidas quantitativas de disfunção neural e cardíaca, as gravações de EEG-ECG podem também ser analisadas qualitativamente para a relação temporal entre anormalidades EEG e ECG para identificar potenciais neurocardiac disfunção , como feito anteriormente21,26. Por exemplo, quando as convulsões ou descargas interictais epileptiforme são identificadas no EEG, ECG correspondente pode ser inspecionado para anormalidades cardíacas, como blocos de condução ou arritmias, que podem ser evocadas por atividade cerebral epiléptica. Em Kcna1–/– ratos, convulsões às vezes evocam bradicardia ou assistolia que pode progredir para letalidade21,22. Em um outro modelo de epilepsia, o rato mutante Kcnq1 , blocos de condução e asystoles ocorrer simultaneamente com as descargas interictais de EEG, sugerindo que eles são uma consequência de interação patológica neurocardiac26. Assim, as gravações simultâneas de EEG e ECG fornecem uma imagem mais completa da interação entre o cérebro e o coração, que é especialmente importante em epilepsia desde convulsões podem evocar a disfunção cardíaca potencialmente letal.
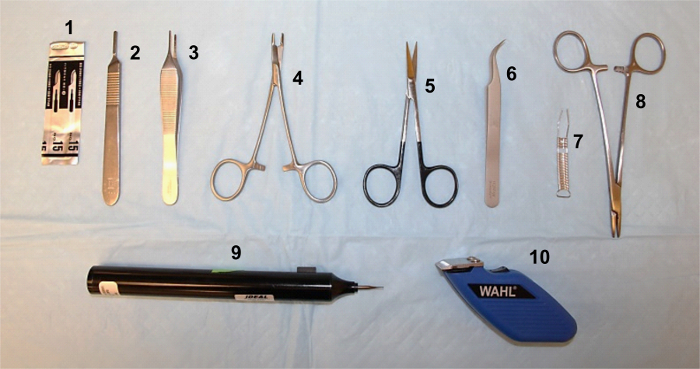
Figura 1. Instrumentos cirúrgicos, necessários para o procedimento. (1) lâmina #15; alça para bisturi (2) #3; Pinça de Adson (3) ; Porta-agulha Hegar Olsen (4) ; (5) muito bem a tesoura; Pinça de Dumont #7 (6) ; (7) Michel ferida clipes; Porta-agulha Crile-madeira (8) ; (9) micro furadeira com broca 0,8 mm; aparador elétrico (10) . Clique aqui para ver uma versão maior desta figura.

Figura 2. Preparação do eléctrodo para implantação. (A) exemplo de um 10-soquete fêmea nanoconnector (i.e., eletrodo). (B) o eletrodo no torno do tabletop com os fios a ser implantado para EEG e ECG dobrado para baixo. As cores do fio são indicadas. Os fios restantes, que são apontados para cima, serão cortados. A inserção mostra uma visão ampliada dos fios saindo do eletrodo. (C) marcando o fio azul do ECG para indicar onde a tira fora do isolamento. (D) usando uma lâmina de bisturi para retirar a isolação do fio revelando os filamentos de prata dentro. (E) a configuração final do eletrodo preparado, mostrando o EEG aparado os fios e os cabos de ECG despojados com a fita de montagem aderiram ao topo. A inserção mostra uma vista ampliada da fita de montagem e os fios saindo do eletrodo. Clique aqui para ver uma versão maior desta figura.
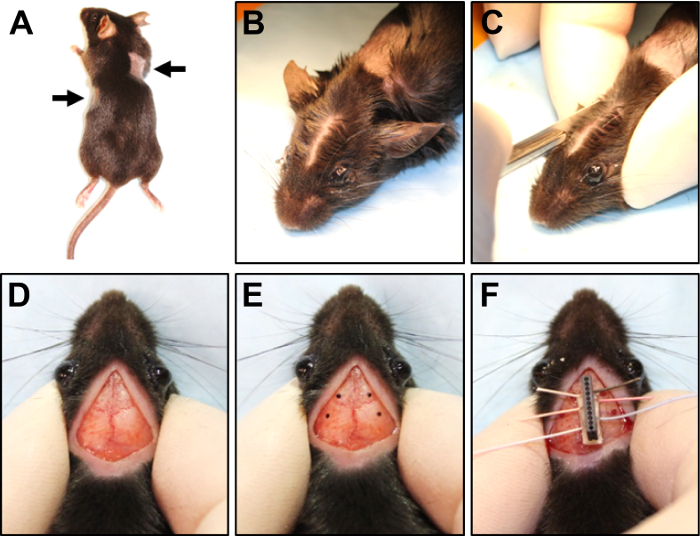
Figura 3. Fixação cirúrgica do eléctrodo no crânio. (A) exemplo de um rato com os lados raspada (indicado pelas setas) para ECG implantação de fio. (B) de despedida da pele entre os olhos e ouvidos para fazer um caminho para a incisão. (C) usando um bisturi para fazer uma incisão no couro cabeludo. (D) a incisão no couro cabeludo. (E) a exemplo das quatro marcas no crânio usado para indicar sites de broca. (F) colocação do eletrodo no crânio após a trepanação de perfuração. Clique aqui para ver uma versão maior desta figura.
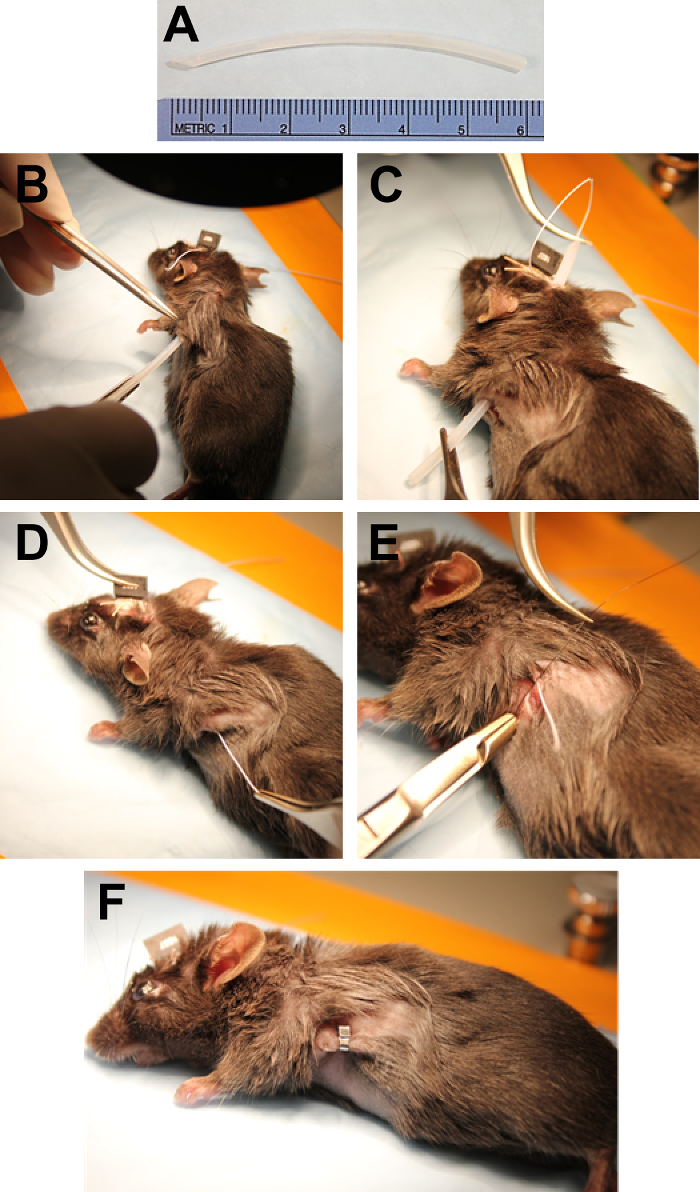
Figura 4. Encapsulamento e implantação dos fios ECG. (A) exemplo de um tubo de polietileno que foi cortado para cerca de 6 cm e chanfrado em uma extremidade para facilitar o túnel subcutâneo. Tunneling (B) por via subcutânea com o tubo de polietileno, começando no local da incisão lateral. (C) alimentar o arame de ECG do elétrodo na cabeça através do tubo. (D) puxando o fio esticado após a remoção do tubo. (E) aplicando uma sutura à porção exposta não isolada do fio ECG segurá-lo no lugar do tecido subjacente. (F) fechamento da incisão lateral com um grampo de ferida. Clique aqui para ver uma versão maior desta figura.
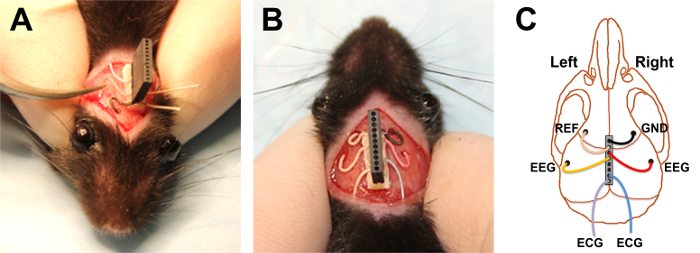
Figura 5. Implantar os fios de EEG. (A) segurando o fio vermelho do EEG e alimentando-o horizontalmente na trepanação do crânio, à seguinte colocação do preto terra fio. (B) a configuração final do nanoconnector e fios pós-implante. (C) esquemático mostra colocação dos bilateral EEG e ECG fios, bem como de referência (REF) e os fios terra (GND). Clique aqui para ver uma versão maior desta figura.

Figura 6. Fechar a incisão de cabeça. (A) aplicação de cimento dental em torno da base do eléctrodo começando caudalmente e prosseguindo rostral. (B) exemplo da tampa de cimento dental em torno da nanoconnector inteira e fios, imediatamente antes do fechamento final da incisão. (C) exemplo da incisão final selado. Clique aqui para ver uma versão maior desta figura.
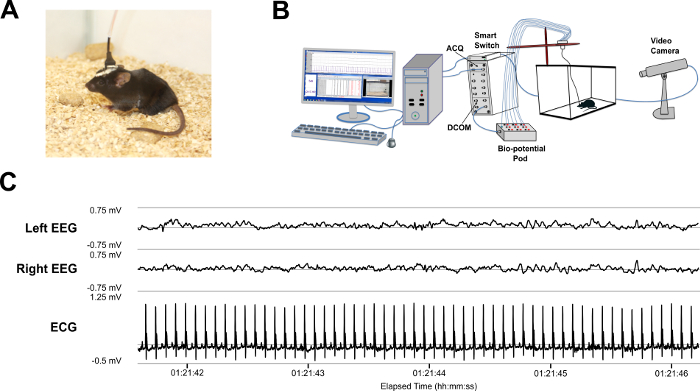
Figura 7. Gravação de sinais de vídeo EEG-ECG. (A) exemplo de um rato amarrado durante uma gravação. (B) esquema mostrando a configuração do equipamento para o sistema em vivo a gravação de vídeo-EEG-ECG amarrados. A fiação de um nanoconnector de 10 pinos macho, que conecta o nanoconnector feminino implantado no crânio, é soldada a 1,5 mm fêmeas cabos que estão ligados a uma interface de 12 canais isolados bio-potencial vagem. Esta cápsula é então ligada por um cabo de ligação serial para um módulo de comunicação digital (DCOM), que transfere dados para uma unidade de interface de aquisição do sinal (ACQ) que está conectado a um computador com software de aquisição de dados de digitalizados. Vídeo é adquirido também simultaneamente usando uma câmera de vídeo de rede adjacente à gaiola e posicionada fora de. A câmera está ligada ao computador através de um poder inteligente do comutador Ethernet. (C) representante vestígios de EEG e ECG típico sinal de dados com os seguintes filtros aplicados: entalhe de 60 Hz, 75 Hz baixa e 0,3 Hz passa-alta banda filtros para EEG; e um filtro passa-altas de 3 Hz para ECG. Clique aqui para ver uma versão maior desta figura.
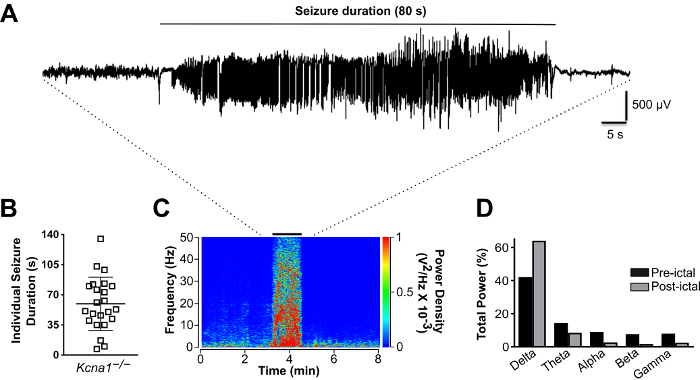
Figura 8. Análise de sinais EEG. (A) rastreamento de um EEG mostrando uma representante apreensão espontânea em um Kcna1–/– rato. (B) enredo das durações de tempo de cada ataque observado durante a sessão de gravação de 24 horas no Kcna1–/– rato. As barras correspondem o média ± desvio-padrão. (C) Peri-estável espectrograma mostrando a densidade de frequência e potência antes, durante e depois da convulsão representativa. (D) comparação do poder relativo em cada banda de frequência de EEG durante os períodos pré e estável revela um aumento no poder relativo delta e diminui em theta, alfa, beta e gama de poder. Clique aqui para ver uma versão maior desta figura.

Figura 9. Análise de sinais de ECG. (A) um rastreamento de ECG de amostra de um Kcna1–/– rato mostrando ritmo sinusal normal anterior de um bloco de condução atrioventricular, que se manifesta como uma onda P que não é seguida por um QRS complexos. Uma onda P, complexo QRS e intervalo R-R são rotulados para referência. (B) uma parcela representativa de uma série de intervalo R-R obtidos a partir da gravação de ECG do Kcna1–/– rato mostrando as flutuações no tempo entre as batidas. A linha vermelha mostra a baixa frequência componentes de tendência que se retirados da série de intervalo R-R detrending a seguir. Clique aqui para ver uma versão maior desta figura.
| Faltou coração bate / h | Variabilidade da frequência cardíaca (VFC) | |||||
| No domínio do tempo | Domínio da frequência | |||||
| HR | SDNN | RMSNN | SE | HF | Proporção se/HF | |
| (batimentos/min) | (ms) | (ms) | (%) | (%) | ||
| 5.84 | 736.8 | 2.4 | 3.2 | 52.27 | 46.38 | 1.127 |
Tabela 1. Quantificação de saltado coração bate, frequência cardíaca (FC) e a variabilidade da frequência cardíaca (VFC) em um Kcna1–/– rato. São dadas as seguintes medidas de domínio de tempo da VFC: desvio-padrão dos intervalos de passo-a-passo (SDNN) e a raiz quadrada de diferenças sucessivas de passo-a-passo (RMSNN). No domínio da frequência, são mostradas as seguintes medidas HRV: porcentagem de energia de baixa frequência (se %); percentual de poder de alta frequência (HF %); e a proporção de energia de baixa frequência ao poder de alta frequência (relação se/HF).
Discussão
Para obter gravações de EEG-ECG de alta qualidade que estão livres de artefatos, devem ser tomadas todas as precauções para evitar a degradação ou afrouxamento do eletrodo implantado e fios. Como um implante de cabeça de EEG torna-se solto, os contatos de fio com o cérebro irão degradar levando a amplitudes de sinal diminuiu. Implantes soltos ou pobre fio contatos também podem causar distorção dos sinais elétricos, introdução de artefatos de movimento e ruído de fundo para as gravações. Para evitar potenciais afrouxamento do implante cabeça, aplique uma quantidade generosa de cimento dental em torno da base do implante, ao fechar a incisão no couro cabeludo, para garantir a adesão e a força máxima. Deve também ter cuidado para assegurar a remoção completa da pele do crânio, como restos de pele podem causar inflamação pós-cirúrgica prematura e principal ao inchaço ao redor do implante implante de desprendimento. Ao longo do tempo, os implantes de cabeça têm o potencial para afrouxar devido o estresse associado com repetidas a conexão e desconexão do animal. Portanto, se possível, tente minimizar o número de vezes que o animal está ligado/desligado através da realização de gravações único de longa duração, ao invés de várias gravações de curta duração. Outra fonte potencial de danos implante pós-cirúrgicas e subsequente animal é contato físico entre o implante e o wiretop em casa gaiola do animal. Para eliminar a necessidade de wiretops, comida pelotas e gel hidratante podem ser colocados no chão da gaiola. Finalmente, para manter a integridade dos fios ECG, manipulação do animal deve ser minimizada, especialmente ao longo dos lados do corpo onde correm os fios de ECG.
Além de degradação dos contatos implante ou fio, outra complicação potencial de uma configuração de gravação amarrados é a possibilidade do animal se tornar independente (ou seja, desconectado ou unhooked) durante um experimento, levando a perda de sinal. Desprendimento pode ser especialmente problemático para os ratos que sofrer graves ataques convulsivos com correndo e saltando. Para minimizar a probabilidade do mouse se tornando desanexado, otimize a quantidade de folga a corda de fio. O melhor comprimento de fio é, normalmente, um equilíbrio entre fornecendo tensão suficiente folga para o animal explorar todos os cantos da gaiola, mas não tão pouco é desnecessária nos fios que poderia promover o desapego. Na determinação do comprimento do fio ideal, certifique-se de que não há tanta folga que o rato pode prontamente mastigar o fio, o que pode levar à perda do sinal, se o fio está quebrado. Usar o eletrodo nanoconnector implantes com pelo menos 10 fios (isto é, pares de soquete/10-pinos) também é importante para fornecer estabilidade extra para a conexão amarrado, como nanoconnectors com menos de 10 fios tendem a soltar mais frequentemente. Para reduzir ainda mais a probabilidade do animal se tornar independente, este protocolo pode ser facilmente modificado por ligar os fios da cabeça do rato de um comutador de baixa torção suspendido acima da câmara de gravação. O comutador funciona girando conforme o mouse se move para aliviar o acúmulo de tensão torcional no arame, impedindo o mouse de desligá-lo.
Uma força principal do presente protocolo amarrado de vídeo-EEG-ECG é a capacidade de modificar o método de aplicativos adicionais. Conforme descrito aqui, apenas seis dos fios disponíveis dez eletrodos são utilizados. No entanto, os restantes quatro condutores também podem ser implantados como um EEG quatro adicional conduz para fornecer melhor resolução espacial da atividade cerebral. Alternativamente, dois dos fios não utilizados podem ser suturado nos músculos do pescoço para gravar a eletromiografia (EMG), que fornece uma medida da atividade muscular que, em combinação com EEG é importante para determinar o estado de sono/vigília. Outra modificação possível seria gravar o animal em uma câmara de pletismografia de corpo inteiro que é modificada para acomodar a corda de fio. Na pletismografia, mudanças de pressão pequena associada a inspiração e expiração são convertidos em formas de onda respiratórias. Portanto, incorporando a pletismografia, é tecnicamente possível conseguir uma gravação simultânea de vídeo, EEG, ECG, EMG e respiração, o que representaria uma leitura das atividades de comportamento e cérebro, coração, músculo e pulmão. Tão abrangente no vivo gravações fisiológicas são praticamente impossíveis na telemetria sistemas de hoje fazendo a aproximação amarrada descrito aqui uma ferramenta especialmente poderosa para interrogatório simultânea de múltiplos bio-sinais em camundongos.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado por cidadãos Unidos para pesquisa em epilepsia (número de concessão 35489); o National Institutes of Health (conceder números R01NS100954, R01NS099188); e um centro de Ciências da saúde de Universidade Louisiana estado Malcolm Feist Postdoctoral Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| VistaVision stereozoom dissecting microscope | VWR | ||
| Dolan-Jenner MI-150 microscopy illuminator, with ring light | VWR | MI-150RL | |
| CS Series scale | Ohaus | CS200 | for weighing animal |
| T/Pump professional | Stryker | recirculating water heat pad system | |
| Ideal Micro Drill | Roboz Surgical Instruments | RS-6300 | |
| Ideal Micro Drill Burr Set | Cell Point Scientific | 60-1000 | only need the 0.8-mm size |
| electric trimmer | Wahl | 9962 | mini clipper |
| tabletop vise | Eclipse Tools | PD-372 | PD-372 Mini-tabletop suction vise |
| fine scissors | Fine Science Tools | 14058-11 | ToughCut, Straight, Sharp/Sharp, 11.5 cm |
| Crile-Wood needle holder | Fine Science Tools | 12003-15 | Straight, Serrated, 15 cm, with lock - For applying wound clips |
| Dumont #7 forceps | Fine Science Tools | 11297-00 | Standard Tips, Curved, Dumostar, 11.5 cm |
| Adson forceps | Fine Science Tools | 11006-12 | Serrated, Straight, 12 cm |
| Olsen-Hegar needle holder with suture cutter | Fine Science Tools | 12002-12 | Straight, Serrated, 12 cm, with lock |
| scalpel handle #3 | Fine Science Tools | 10003-12 | |
| surgical blades #15 | Havel's | FHS15 | |
| 6-0 surgical suture | Unify | S-N618R13 | non-absorbable, monofilament, black |
| gauze sponges | Coviden | 2346 | 12 ply, 7.6 cm x 7.6 cm |
| cotton-tipped swabs | Constix | SC-9 | 15.2-cm total length |
| super glue | Loctite | LOC1364076 | gel control |
| Michel wound clips, 7.5mm | Kent Scientific | INS700750 | |
| polycarboxylate dental cement kit | Prime-dent | 010-036 | Type 1 fine grain |
| tuberculin syringe | BD | 309623 | |
| polyethylene tubing | Intramedic | 427431 | PE160, 1.143 mm (ID) x 1.575 mm (OD) |
| chlorhexidine | Sigma-Aldrich | C9394 | |
| ethanol | Sigma-Aldrich | E7023-500ML | |
| Puralube vet ointment | Dechra Veterinary Products | opthalamic eye ointment | |
| mouse anesthetic cocktail | Ketamine (80 mg/kg), Xylazine (10 mg/kg), and Acepromazine (1 mg/kg) | ||
| carprofen | Rimadyl (trade name) | ||
| HydroGel | ClearH20 | 70-01-5022 | hydrating gel; 56-g cups |
| Ponemah software | Data Sciences International | data acquisition and analysis software; version 5.2 or greater with Electrocardiogram Module | |
| 7700 Digital Signal conditioner | Data Sciences International | ||
| 12 Channel Isolated Bio-potential Pod | Data Sciences International | ||
| fish tank | Topfin | for use as recording chamber; 20.8 gallon aquarium; 40.8 cm (L) X 21.3 cm (W) X 25.5 cm (H) | |
| Digital Communication Module (DCOM) | Data Sciences International | 13-7715-70 | |
| 12 Channel Isolated Bio-potential Pod | Data Sciences International | 12-7770-BIO12 | |
| serial link cable | Data Sciences International | J03557-20 | connects DCOM to bio-potential pod |
| Acquisition Interface (ACQ-7700USB) | Data Sciences International | PNM-P3P-7002 | |
| network video camera | Axis Communications | P1343, day/night capability | |
| 8-Port Gigabit Smart Switch | Cisco | SG200-08 | 8-port gigabit ethernet swith with 4 power over ethernet supported ports (Cisco Small Business 200 Series) |
| 10-pin male nanoconnector with guide post hole | Omnetics | NPS-10-WD-30.0-C-G | electrode for implantation on the mouse head |
| 10-socket female nanoconnector with guide post | Omnetics | NSS-10-WD-2.0-C-G | connector for electrode implant |
| 1.5-mm female touchproof connector cables | PlasticsOne | 441 | 1 signal, gold-plated; for connecting the wiring from the head-mount implant to the bio-potential pod |
| soldering iron | Weller | WESD51 BUNDLE | digital soldering station |
| solder | Bernzomatic | 327797 | lead free, silver bearing, acid flux core solder |
| heat shrink tubing | URBEST | collection of tubing with 1.5- to 10-mm internal diameters | |
| heat gun | Dewalt | D26960 | |
| mounting tape (double-sided) | 3M Scotch | MMM114 | 114/DC Heavy Duty Mounting Tape, 2.54 cm x 1.27 m |
| desktop computer | Dell | recommended minimum requirements: 3rd Gen Intel Core i7-3770 processor with HD4000 graphics; 4 GB RAM, 1 GB AMD Radeon HD 7570 video card; 1 TB hard drive; Windows 7 OS | |
| permanent marker | Sharpie | 37001 | black color, ultra fine point |
| toothpicks | for mixing and applying the polycarboxylate dental cement | ||
| LabChart Pro software | ADInstruments | power spectrum software; version 8.1.3 or greater | |
| Kubios HRV software | Univ. of Eastern Finland | HRV analysis software; version 2.2 | |
| Notepad | Microsoft | simple text editor software |
Referências
- Fisch, B. J. Fisch and Spehlmann's EEG Primer. , Elsevier. Amsterdam, Netherlands. (1999).
- Constant, I., Sabourdin, N. The EEG signal: a window on the cortical brain activity. Paediatr. Anaesth. 22 (6), 539-552 (2012).
- Mendez, O. E., Brenner, R. P. Increasing the yield of EEG. J. Clin. Neurophysiol. 23 (4), 282-293 (2006).
- Smith, S. J. M. EEG in the diagnosis, classification, and management of patients with epilepsy. J. Neurol. Neurosurg. Psychiatry. 76, Suppl 2. ii2-ii7 (2005).
- Bauer, G., Trinka, E. Nonconvulsive status epilepticus and coma. Epilepsia. 51 (2), 177-190 (2010).
- Hughes, J. R. Absence seizures: a review of recent reports with new concepts. Epilepsy Behav. 15 (4), 404-412 (2009).
- Mostacci, B., Bisulli, F., Alvisi, L., Licchetta, L., Baruzzi, A., Tinuper, P. Ictal characteristics of psychogenic nonepileptic seizures: what we have learned from video/EEG recordings--a literature review. Epilepsy Behav. 22 (2), 144-153 (2011).
- Smith, S. J. M. EEG in neurological conditions other than epilepsy: when does it help, what does it add? J. Neurol. Neurosurg. Psychiatry. 76, Suppl 2. ii8-ii12 (2005).
- Kennett, R. Modern electroencephalography. J. Neurol. 259 (4), 783-789 (2012).
- Thaler, M. S. The Only EKG Book You'll Ever Need. , Lippincott Williams & Wilkins. (2012).
- Becker, D. E. Fundamentals of electrocardiography interpretation. Anesth. Prog. 53 (2), quiz 64 53-63 (2006).
- Luz, E. J. S., Schwartz, W. R., Cámara-Chávez, G., Menotti, D. ECG-based heartbeat classification for arrhythmia detection: A survey. Comput. Methods Programs Biomed. 127, 144-164 (2016).
- Bardai, A., et al. Epilepsy is a risk factor for sudden cardiac arrest in the general population. PloS One. 7 (8), e42749(2012).
- Lamberts, R. J., et al. Increased prevalence of ECG markers for sudden cardiac arrest in refractory epilepsy. J. Neurol. Neurosurg. Psychiatry. 86 (3), 309-313 (2015).
- Thurman, D. J., Hesdorffer, D. C., French, J. A. Sudden unexpected death in epilepsy: assessing the public health burden. Epilepsia. 55 (10), 1479-1485 (2014).
- Zayachkivsky, A., Lehmkuhle, M. J., Dudek, F. E. Long-term Continuous EEG Monitoring in Small Rodent Models of Human Disease Using the Epoch Wireless Transmitter System. J. Vis. Exp. (101), e52554(2015).
- Bertram, E. H. Monitoring for Seizures in Rodents. Models of Seizures and Epilepsy. , Academic Press. 97-109 (2017).
- Mishra, V., et al. Scn2a deletion improves survival and brain-heart dynamics in the Kcna1-null mouse model of sudden unexpected death in epilepsy (SUDEP). Hum. Mol. Genet. 26 (11), 2091-2103 (2017).
- Thireau, J., Zhang, B. L., Poisson, D., Babuty, D. Heart rate variability in mice: a theoretical and practical guide. Exp. Physiol. 93 (1), 83-94 (2008).
- Smart, S. L., et al. Deletion of the K(V)1.1 potassium channel causes epilepsy in mice. Neuron. 20 (4), 809-819 (1998).
- Glasscock, E., Yoo, J. W., Chen, T. T., Klassen, T. L., Noebels, J. L. Kv1.1 potassium channel deficiency reveals brain-driven cardiac dysfunction as a candidate mechanism for sudden unexplained death in epilepsy. J. Neurosci. 30 (15), 5167-5175 (2010).
- Moore, B. M., Jerry Jou,, Tatalovic, C., Kaufman, M., S, E., Kline, D. D., Kunze, D. L. The Kv1.1 null mouse, a model of sudden unexpected death in epilepsy (SUDEP). Epilepsia. 55 (11), 1808-1816 (2014).
- Ryvlin, P., et al. Incidence and mechanisms of cardiorespiratory arrests in epilepsy monitoring units (MORTEMUS): a retrospective study. Lancet Neurol. 12 (10), 966-977 (2013).
- Stables, C. L., Auerbach, D. S., Whitesall, S. E., D'Alecy, L. G., Feldman, E. L. Differential impact of type-1 and type-2 diabetes on control of heart rate in mice. Auton. Neurosci. 194, 17-25 (2016).
- Gehrmann, J., Hammer, P. E., Maguire, C. T., Wakimoto, H., Triedman, J. K., Berul, C. I. Phenotypic screening for heart rate variability in the mouse. Am. J. Physiol. Heart Circ. Physiol. 279 (2), H733-H740 (2000).
- Goldman, A. M., Glasscock, E., Yoo, J., Chen, T. T., Klassen, T. L., Noebels, J. L. Arrhythmia in heart and brain: KCNQ1 mutations link epilepsy and sudden unexplained death. Sci. Transl. Med. 1 (2), 2ra6(2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados