Method Article
Modelos experimentais para estudar a neuroproteção do pós-condicionamento ácido contra a isquemia cerebral
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O pós-condicionamento ácido protege contra a isquemia cerebral. Aqui apresentamos dois modelos para executar a APC. Eles são obtidos, respectivamente, transferindo fatias corticostriatais para o tampão ácido após a privação de oxigênio-glicose in vitro e pela inalação de 20% de CO 2 após a oclusão da artéria cerebral média in vivo .
Resumo
O acidente vascular cerebral é uma das principais causas de mortalidade e incapacidade em todo o mundo, com abordagens terapêuticas limitadas. Como uma estratégia endógena para a neuroproteção, os tratamentos pós-condicionamento provaram ser terapias promissoras contra a isquemia cerebral. No entanto, procedimentos complicados e possíveis problemas de segurança limitam sua aplicação clínica. Para superar estas desvantagens, desenvolvemos pós-condicionamento ácido (APC) como terapia para isquemia cerebral focal experimental. APC refere-se ao tratamento de acidose leve por inalação de CO 2 durante a reperfusão após isquemia. Aqui apresentamos dois modelos para executar APC in vitro e in vivo , respectivamente. O tratamento de privação de oxigênio-glicose (OGD) de camundongos e a oclusão corticostriatal e oclusão da artéria cerebral média (MCAO) de camundongos foram empregados para imitar a isquemia cerebral. APC pode ser simplesmente conseguido através da transferência de fatias de cérebro para tampão ácido borbulhado com 20% de CO 2 , oR por camundongos que inalam 20% de CO 2 . A APC mostrou efeitos protetores significativos contra a isquemia cerebral, como reflete a viabilidade do tecido e o volume do infarto cerebral.
Introdução
O acidente vascular cerebral é uma das principais causas de mortalidade e incapacidade em todo o mundo. Grandes esforços foram feitos para encontrar tratamentos efetivos para AVC nas últimas décadas, no entanto, a conquista é bastante insatisfatória. O pós-condicionamento é um processo manipulado por tensões subtoxicas após um episódio isquêmico. O pós-condicionamento, incluindo o pós-condicionamento isquêmico, hipóxico, baixo teor de glicose e remoto, desencadeia mecanismos adaptativos endógenos e provou ser terapias promissoras contra a isquemia cerebral 1 , 2 , 3 , 4 . Contudo, o pós-condicionamento isquêmico pode introduzir lesões adicionais. O pós-condicionamento isquêmico remoto dos membros geralmente precisa de vários ciclos de 5 a 20 min de oclusão e reperfusão nos membros traseiros ipsilaterais ou bilaterais 5 , 6 , 7 . ºPortanto, essas manipulações pós-condicionamento são perigosas ou impraticáveis na prática clínica. Para superar essas desvantagens, desenvolvemos APC como terapia para isquemia cerebral focal em camundongos 8 . Induzido simplesmente por inalação de 20% de CO 2 , APC reduz significativamente a lesão cerebral isquêmica de uma maneira mais viável e segura. Recentemente, provamos que a APC estende a janela de reperfusão, destacando o significado da APC para terapia de AVC 9 .
Aqui apresentamos dois modelos experimentais para estudar a neuroproteção de APC contra isquemia cerebral. O primeiro é o modelo de privação de oxigênio-glicose (OGD) em fatias corticostriatais de camundongos. A rápida preparação e transferência das fatias do cérebro para um ambiente artificial, geralmente fluido cerebrospinal artificial (ASCF), pode manter a viabilidade celular e circuitos neuronais, o que possibilita o estudo da função cerebral in vitro 10 11 . OGD em ASCF imita a isquemia cerebral e induz a lesão isquêmica 12 , 13 , 14 . Após OGD, as fatias de cérebro são atualizadas em ASCF (r-ASCF) regulares para fornecer reperfusão e depois tratadas com APC usando ASCF ácido borbulhou com 20% de CO 2 . A fatia corticostriatal mantém a caracterização histológica intacta em comparação com células primárias cultivadas.
Para estudar a função cerebral in vivo , emprega-se o modelo de oclusão da artéria cerebral média (MCAO) do mouse. A artéria cerebral média é bloqueada pela inserção de um monofilamento inflamado através da artéria carótida comum. Como um dos modelos de AVC mais amplamente utilizados, o modelo MCAO mostra relevância clínica e a aplicação de um monofilamento torna mais fácil a reperfusão. Simplesmente pela inalação de gases mistos normoxicos contendo 20% de CO 2 após o início do reperfusioN, a APC mostrou efeitos protetores significativos contra a isquemia cerebral indicada por volumes reduzidos de infarto cerebral.
Protocolo
Todos os experimentos foram aprovados e conduzidos de acordo com as diretrizes éticas do Comitê de Experimentação Animal da Universidade de Zhejiang e estavam em completa conformidade com os Institutos Nacionais de Guia de Saúde para o Cuidado e Uso de Animais de Laboratório. Foram feitos esforços para minimizar qualquer dor ou desconforto, e o número mínimo de animais foi usado.
1. OGD de fatias Corticostriatal
- Preparação da solução:
- Preparar 1000 ml de r-ACSF (124 mmol / L, NaCl, 5 mmol / L de KCl, 1,25 mmol / L KH 2 PO 4, 2 mmol / L de MgSO4, 26 mmol / L NaHCO3, 2 mmol / L de CaCl 2, 10 mmol / L de glicose, pH final 7,4). Bolha com 5% de CO 2 e 95% de O 2 ao longo da experiência.
- Preparar 200 mL ACSF sem glicose (GF-ACSF) como acima mas excluindo a glucose, borbulhar com 5% de CO 2 e 95% de N2. Bolha os gases por 30 min antes de aplicar para brEm fatias para reduzir o teor de oxigênio na solução. Continue borbulhando até o procedimento OGD terminar.
- Prepare ácida ACSF (a-ACSF) equilibrando 200 ml de r-ACSF com 20% de CO 2 e 80% de O 2. Bolha os gases durante 30 minutos antes de aplicar a fatias do cérebro para reduzir o pH da solução para pH 6.8 e continuar borbulhando até o procedimento APC terminar.
- Coloque três suportes de tecido em r-ACSF, gf-ACSF, a-ACSF, respectivamente.
- Preparação da fatia do cérebro:
Nota: foram utilizados camundongos C57Bl / 6J de oito semanas de idade neste estudo. Os animais foram alojados sob temperatura controlada (22 ± 2 ° C), com um período de ciclo de luz-escuro de 12 h e acesso a alimentos e água com sedimentos.- Sacrifique um mouse com uma overdose de isoflurano em uma câmara de indução. Decapite o mouse. Dissecesse o cérebro usando pequenas tesouras e fórceps. Remova o cérebro com uma espátula fina e coloque-o cuidadosamente em um copo de vidro comtenção gelada r-ACSF equilibrada com 5% de CO 2 e 95% de O 2.
NOTA: Estas etapas devem ser feitas de forma rápida, mas meticulosamente possível. - Mantenha o cérebro no r-ACSF gelado por 5 min. Ajuste a pressão do gás para evitar movimentos do cérebro.
- Coloque cola de crioprecipitado na placa de vibração em duas tiras. Coloque um pedaço de agarose a 3% sobre a tira de cola para longe da lâmina para suportar o cérebro.
- Inverta uma placa de Petri de 10 cm sobre gelo e depois coloque um papel de filtro no prato. Humedecer o papel de filtro com gotas de r-ACSF geladas.
- Transfira o cérebro para o papel de filtro com fórceps. Corte o poste frontal e o cerebelo com lâmina e pinça.
NOTA: As seções transversais devem ser tão lisas quanto possível e vertical para o plano sagital. - Coloque o tecido cerebral restante verticalmente sobre a outra tira de cola e mantenha o cérebro encostado à agarose. Adicione o r-ACSF gelado ao reservatório de corte paraMergulhe o cérebro e adicione gelo na área do suporte de gelo. Manter o r-ACSF no reservatório borbulhar com 5% de CO 2 e 95% de O 2.
- Levante o reservatório e ajuste a posição da navalha para colocar a navalha tão perto do cérebro quanto possível e logo acima do cérebro.
- Escolha o modo "CONT" para cortar as seções do cérebro continuamente. Defina a espessura de corte para 400 μm, a freqüência de vibração para 6 a 8 e a velocidade para 3 - 4. Pressione o botão "iniciar / parar" para iniciar o corte automático.
- Corte a ponta de uma pipeta Pasteur de 3 mL para fazer uma abertura correspondente ao tamanho das fatias do cérebro.
NOTA: A abertura deve ser grande o suficiente para evitar danos adicionais nas fatias do cérebro. - Extrair cinco fatias de cérebro de um por um, com a pipeta de ponta-cutPasteur e colocá-los no suporte do tecido em gelada r-ACSF borbulhar com 5% de CO 2 e O 2 95%. Não colete a primeira fatia produzida. Ajuste a pressão do gás para avoiD movimentos das fatias do cérebro.
NOTA: As fatias do cérebro não devem cobrir uma a outra. - Coloque fatias de cérebro com r-ACSF à temperatura ambiente durante 30 min e depois a 37 ° C em banho-maria por mais 10 min para recuperar funções sinápticas.
- Sacrifique um mouse com uma overdose de isoflurano em uma câmara de indução. Decapite o mouse. Dissecesse o cérebro usando pequenas tesouras e fórceps. Remova o cérebro com uma espátula fina e coloque-o cuidadosamente em um copo de vidro comtenção gelada r-ACSF equilibrada com 5% de CO 2 e 95% de O 2.
- OGD e APC:
- Coloque gf-ACSF e a-ACSF em um banho-maria a 37 ° C e borbulhe os tampões com os gases correspondentes, conforme mencionado acima em 1.1.2 e 1.1.3 durante 30 min.
- Deixe uma fatia no r-ACSF como um controle. Transfira as outras quatro fatias de cérebro no suporte de tecido com gf-ACSF pré-aquecido com cuidado e incube durante 15 min. Transfira as fatias de volta para o suporte de tecido em r-ACSF para obter reperfusão.
- Para estudar a janela de tempo da APC, transfira uma fatia diretamente de gf-ACSF para a-ACSF. Transfira as outras três fatias para o r-ACSF em primeiro lugar, e depois transfira duas delas para o suporte de tecido em a-ACSF 5 e 15 min após a reperfusão, respectivamente.
- IncubatE as duas fatias em a-ACSF por 3 min e depois transferi-las de volta para r-ACSF. Incube as três fatias em r-ACSF por mais 1 h. Defina as restantes fatias no r-ACSF como o grupo OGD.
- Para um estudo de resposta à dose, transferir as quatro fatias para o suporte de tecido em r-ACSF no início após OGD e incubar durante 5 min. Em seguida, deixe uma fatia no r-ACSF como o grupo OGD e transfira as outras três fatias para a-ACSF. Incubar as fatias em a-ACSF por 1, 3 e 5 min, respectivamente, e depois transferi-las para r-ACSF. Incube as três fatias em r-ACSF por mais 1 h.
- Determinação da viabilidade da fatia:
- Preparar 0,25% de solução salina normal de cloridrato de 2,3,5-trifeniltetrazólio (TTC). Adicione 1,25 g de pó de TTC a 500 ml de solução salina normal.
NOTA: Depois que o pó se dissolver completamente, transfira a solução para uma placa de 24 poços (500 μL por poço) coberta de papel alumínio e guarde-a a 4 ° C. TTC e tecido corado com TTC são light senSitive. - Transfira as fatias para uma placa de 24 poços (uma fatia por poço) contendo solução de TTC e estique a fatia na solução. Incubar as fatias na solução de TTC a 37 ° C num banho de água pouco profunda durante 30 min.
- Transfira as fatias para limpar os tubos de centrífuga de 1,5 mL cobertos com papel alumínio e medir o peso seco das fatias.
- Adicionar etanol / sulfóxido de dimetilo (1: 1) nos tubos da centrífuga (v: w = 10: 1) para extrair o formazan. Incubar as fatias em etanol / dimetilsulfóxido à temperatura ambiente longe da luz durante 24 h.
- Adicione todo o etanol / sulfóxido de dimetilo nos tubos em uma placa de 96 poços e mede a absorvância a 490 nm por um leitor de placas.
- Normalize a absorvância para o peso seco da fatia e viabilidade expressa como a porcentagem da fatia de controle.
- Preparar 0,25% de solução salina normal de cloridrato de 2,3,5-trifeniltetrazólio (TTC). Adicione 1,25 g de pó de TTC a 500 ml de solução salina normal.
2. MCAO
- Preparação:
- Desinfecte o banco de trabalho, a superfície do Doppler Laser FlowmetrY (LDF) e seus acessórios com 70% de álcool etílico.
- Preparar instrumentos autoclavados: duas tesouras, 10 cm; Duas fórceps, 10 cm; Uma pinça oftálmica, 11 cm; Uma tesoura micro oftálmica, 9 cm; Uma braçadeira de microvento, 1,8 cm; Oneneedle drive, r 12,5 cm; Várias suturas cirúrgicas (△ 1/2 4 × 10); cotonetes.
- Prepare uma seringa (sem agulha) com solução salina para manter uma área de operação hidratada.
- Prepare o gás de anestesia (100% O 2 + isoflurano).
- Detecção do fluxo sanguíneo cerebral:
- Configure o instrumento LDF.
- Injete analgésicos por via intraperitoneal no mouse: metamizol 200 mg / kg, carprofen 4 mg / kg e buprenorfina 0,1 mg / kg.
- Coloque o mouse em uma câmara de indução com 4% de isoflurano em oxigênio para anestesiar até que o movimento espontâneo do corpo e a vibração parem.
- Coloque o mouse em posição inclinada com o nariz encaixado naE cone de nariz e manter isoflurano a 1,5% para o procedimento subseqüente.
- Aplique pomada de dexpantenol em ambos os olhos.
- Desinfecte a cabeça com 70% de álcool etílico.
- Faça uma incisão da pele paramediana direita entre olhos e ouvidos usando um bisturi para expor o bregma.
- Esfregue o crânio com algodão estéril.
- Aplique uma a duas gotas de cola cirúrgica na superfície do crânio.
- Coloque a ponta da sonda de fibra óptica de 5 mm caudal para a bregma e 6 mm lateral à linha média.
- Comece a gravar o fluxo sanguíneo no software do computador. Aguarde até ocorrer uma linha de base estável do fluxo sanguíneo e aplique um catalisador de 20 μL sobre a cola para consertar a sonda.
NOTA: uma linha de base ideal deve ser mais de 500 fluxos. - Se a linha de base for inferior a 200 fluxos, ajuste a posição finamente para obter uma linha de base adequada. Mantenha a sonda unida ao crânio durante a duração da experiência.
- Desinfecte a cabeça com iodophor afTer a sonda de fibra óptica anexada.
- MCAO:
- Coloque e repare o mouse anestesiado (com a sonda LDF anexada ao crânio) em posição supina e mantenha a temperatura do corpo usando uma lâmpada de calor ao longo da cirurgia. Desinfecte o pescoço com 70% de álcool etílico.
- Faça uma incisão cutânea paramediana no pescoço usando um bisturi; Dissimulam os tecidos moles com fórceps para expor os vasos. Adicione uma gota de solução salina aos tecidos expostos para mantê-los hidratados.
- Dissecar a artéria carótida comum do tecido circundante e do nervo vago usando pinça oftálmica. Tenha cuidado para não danificar o nervo vago. Desinfecte novamente a pele do pescoço com iodóforo após exposição à artéria carótida comum.
- Coloque uma braçadeira de microvasos na extremidade distal da artéria carótida comum e, em seguida, amarre um nó morto com suturas de seda 6-0 na extremidade proximal. Coloque o grampo o mais proximamente possível para operações subsequentes. Certifique-se de que o comprimento deO recipiente entre o grampo eo nó morto é o maior tempo possível para as operações subsequentes.
- Faça uma sutura temporária proximal ao grampo, amarrando um nó solto. Certifique-se de que haja espaço suficiente entre dois nós para a inserção de monofilamentos.
- Faça uma pequena incisão longitudinal entre os dois nós com tesoura micro-oftálmica. Certifique-se de que a incisão seja tão próxima ao nó morto quanto possível para as operações subsequentes. Tenha cuidado para não cortar a embarcação.
- Insira um monofilamento com mola de 12 mm com a incisão para entrar no lúmen da artéria e avance-o alguns mm. Aperte o nó solto em torno da ponta do monofilamento e retire o grampo.
- Avance o filamento para a artéria carótida interna (10 mm para ocultar a artéria cerebral média) com pinça oftálmica até o software LDF mostrar um declínio acentuado (> redução de 80% no fluxo sanguíneo basal) no fluxo sanguíneo. Registre o tempo de início da oclusão.
NOTA: a configuração do instrumento LDF éDescrito na seção 2.2. - Ocultar a artéria cerebral média durante 1 h. Corte a sonda LDF e coloque os ratos em uma incubadora de 30 ° C durante o período de oclusão.
- Reperfusão e APC:
- Re-anestesiar os animais com isoflurano como descrito acima 55 minutos após o início da oclusão. Coloque e repare ratos em posição supina. Abra a incisão do pescoço e reexponha a artéria carótida comum.
- Retire suavemente o filamento com pinça oftálmica após o período de oclusão para obter reperfusão e torne a sutura temporária em permanente, apertando o nó.
- Para o tratamento de acidose, mudar o gás inalado pelo cone de nariz para os gases de mistura contendo 20% de CO2, 20% de O2 e 60% de N 2 durante 5 min a 5, 50, ou 100 minutos após a reperfusão. Feche a incisão com uma sutura cirúrgica interrompida.
- Coloque ratos em uma gaiola de calor a 30 ° até que os ratos recuperem a consciênciaE depois devolver os ratos para limpar, gaiolas individuais. Forneça ratos com uma placa de Petri de água e alimentos umedecidos. Monitore os ratos de perto após a cirurgia por dor excessiva e morte.
- Medição do volume do infarto do cérebro:
- Medir o volume do infarto cerebral usando TTC coloração 24 h após a reperfusão.
- Prepare a solução TTC de 0,25% como mencionado no passo 1.4.1 antes do tempo designado de sacrifício. Transfira a solução para uma placa de 24 poços (1 mL por poço) coberta de papel alumínio e guarde-a a 4 ° C.
NOTA: TTC e tecido corado com TTC são sensíveis à luz. - Às 24 h após a reperfusão, sacrificar o animal com uma overdose de isoflurano em uma câmara de indução. Decapite os ratos. Dissie os cérebros usando pequenas tesouras e fórceps. Examine os pontos de sangue nos cérebros para excluir os ratos submetidos a hemorragia subaracnóidea no círculo de Willis.
- Coloque o cérebro em um slide de vidro limpo em -20 ° C embalagem de gelo. Coloque o cérebro e o vidro deslize em um refrigerador de -20 ° C por 5 minutos para facilitar o corte do cérebro.
- Retire o cérebro eo vidro deslize de -20 ° C e coloque-os de volta no pacote de gelo de -20 ° C. Dissecar o pólo frontal e o cerebelo com lâmina e pinça.
- Corte as seções do cérebro horizontalmente até uma espessura de 1 mm com uma lâmina para produzir 5 fatias. Transfira as fatias para dentro da placa de 24 poços contendo solução TTC (1 fatia por poço) com fórceps e estique as fatias na solução. Incubar as fatias na solução de TTC a 37 ° C num banho de água pouco profunda durante 30 min.
- Aspirar a solução TTC. Adicione 10% de formaldeído (1 mL por poço) e incuba à temperatura ambiente durante 30 min. Coloque as fatias na ordem em que foram cortadas em uma folha de celofane e digitalizar os segmentos na imagem fotográfica fotográfica.
- Analise o tamanho do infarto como uma porcentagem de toda a fatia do cérebro usando o software de análise ImageJLass = "xref"> 8 com base na identificação visual; Veja a Figura 2 (esquerda).
Resultados
No modelo da fatia corticostriatal descrita acima, a viabilidade corticostriatal da fatia foi quantificada por meio de ensaio TTC às 1 h após a reperfusão. A conversão TTC foi calculada normalizando a absorção a 490 nm para a fatia de controle. De acordo com a conversão de TTC, a APC protegeu contra lesões de reperfusão induzidas por OGD de uma maneira dependente de tempo e de início. Em detalhes, tanto 1 quanto 3 minutos de tratamento de acidose melhoraram significativamente a viabilidade aos 5 min após 15 min OGD, enquanto que 5 min não (OGD: 0,609 ± 0,029, 5/1: 0,758 ± 0,034, 5/3: 0,821 ± 0,041, 5/5: 0,672 ± 0,053, dados reportados como média ± SEM) ( Figura 1 A ). A neuroprotecção pelo tratamento de acidose permaneceu protetora dentro de 5 minutos após a reperfusão, enquanto que 15 min não (OGD: 0,584 ± 0,044, 0/3: 0,762 ± 0,036, 5/3: 0,833 ± 0,062, 15/3: 0,627 ± 0,038) ( figura 1 B ).
No modelo MCAO, 5 minutos de tratamento de acidose iniciados aos 5 minutos após o início da reperfusão resgataram a morte celular causada por insulto isquêmico, refletida por menores volumes de infarto (MCAO: 33,4 ± 4,4%, 5/5: 16,6 ± 2,7%, 50 / 5: 19,5 ± 2,1%, 100/5: 37 ± 2,1%). A neuroproteção ainda era robusta, mesmo quando o tempo de início foi adiado para 50 minutos após a reperfusão. Contudo, o tratamento de acidose iniciado a 100 min não bloqueou as lesões isquêmicas ( Figura 2 ).
Todos os dados foram coletados e analisados de forma cega. Os dados são apresentados como média ± SEM. No modelo da fatia corticostriatal, cada grupo possui 6-8 amostras. No modelo MCAO, cada grupo possui 9 a 10 amostras. A análise de variância unidirecional com diferença menos significativa foi aplicada para comparações múltiplas.
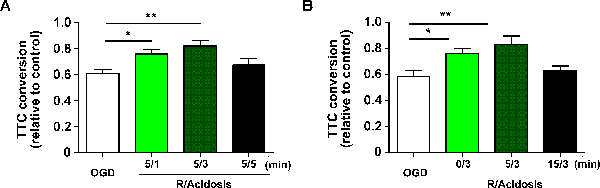
Figura 1 . APC protege contra lesões de reperfusão induzidas por OGD em fatias Corticostriatal. As fatias corticostriatais foram tratadas com acidose (pH 6,8) para as durações indicadas (A) e indicaram períodos de recuperação (B) após OGD. A viabilidade celular foi avaliada pelo ensaio de brometo de 3- [4,5-dimetiltiazol-2-il] -2,5-difeniltetrazólio a 24 h após a reperfusão e a viabilidade da fatia corticostriatal foi quantificada por ensaio TTC às 1 h após a reperfusão. Os valores mostram média ± SEM. N = 6 - 8 para cada grupo; * P <0,05 e ** p <0,01 por análise de variância unidirecional; R, reperfusão. Clique aqui para ver uma versão maior desta figura.

Figura 2 . APC protege contra lesão induzida por MCAO em ratos. Os animais foram submetidos a 60 minutos de MCAO e tratados por inalação de 20% de CO2 durante 5 min a 5, 50 ou 100 minutos após a reperfusão. O volume de infarto foi quantificado pela coloração de cloridrato de 2,3,5-trifeniltetrazólio a 24 h após a reperfusão (indicado por linha pontilhada preta no painel esquerdo). Os valores mostram média ± SEM. N = 8-10 para cada grupo; * P <0,05 e ** p <0,01 por análise de variância unidirecional; R, reperfusão. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui apresentamos dois modelos experimentais para estudar a neuroproteção de APC contra isquemia cerebral. Em fatias de cérebro, a APC é conseguida através da incubação de fatias corticostriatais de camundongos em tampão ácido borbulhado com 20% de CO 2 após o início da reperfusão, enquanto que no modelo MCAO, a APC é conseguida inalando 20% de CO 2 para ratos após reperfusão. Ambos os modelos refletem a neuroproteção da APC contra a isquemia cerebral. A proteção foi comparável à alcançada pelo pós-condicionamento isquêmico, mas com uma janela de tempo mais larga. No modelo MCAO, a janela de tempo pode ser até 50 minutos após a reperfusão em comparação com 10 minutos para o pós-condicionamento isquêmico 15 . Além disso, o procedimento da APC é mais fácil e seguro.
No modelo das fatias corticostriatais, operações suaves e rápidas são cruciais para garantir a viabilidade das fatias do cérebro na máxima extensão. Para o desempenho do MCAO, o monitoramento do fluxo sangüíneo cerebral éRequerido, e o declínio acentuado do fluxo sanguíneo deve ser observado para garantir a oclusão da artéria cerebral média. Depois que os cérebros foram dissecados para a coloração TTC, um exame cuidadoso dos cérebros é necessário para a exclusão da hemorragia subaracnóidea.
A extensão e a duração da acidose são críticas para a neuroproteção da APC. A duração prolongada do tratamento de acidose não é benéfica no modelo de fatias corticostriatal ( Figura 1 A ). Além disso, nosso estudo anterior mostrou que tanto 10% como 20% de inalação de CO 2 , em vez de 30% de inalação de CO 2 conferem neuroproteção em camundongos 8 . Estes sugerem acidose leve é crucial para a neuroproteção da APC e, portanto, a concentração de CO 2 e a duração da APC são indispensáveis para a neuroproteção de acidose.
Além da coloração TTC, muitas técnicas podem ser combinadas para sSatisfazer diversas necessidades de pesquisa. Por exemplo, a gravação elétrica extracelular pode ser adicionada ao passo final para observar como isquemia e acidose afetam o potencial neural 16 . A solução de perfusão de fatia de cérebro também pode ser coletada para medir a mudança de concentração de neurotransmissores de aminoácidos após APC por HPLC 17 . Fatias de certas regiões cerebrais podem ser preparadas para estudar as respostas de uma determinada área à isquemia e APC. No geral, muitas alternativas podem ser introduzidas para iluminar os impactos da isquemia e acidose.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pela Fundação Nacional de Ciências Naturais da China (81573406, 81373393, 81273506, 81221003, 81473186 e 81402907), Fundação Provincial de Ciências Naturais de Zhejiang (LR15H310001) e o Programa para a equipe líder de Zhejiang da equipe de inovação S & T (2011R50014).
Materiais
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Sigma | S5886 | |
| Potassium chloride | Sigma | P5405 | |
| Potassium phosphate monobasic | Sigma | P9791 | |
| Magnesium sulfate | Sigma | M2643 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Calcium chloride dihydrate | Sigma | C5080 | |
| D-(+)-Glucose | Sigma | G7021 | |
| Vibratome | Leica | VT1000 S | |
| 2,3,5-triphenyltetrazolium hydrochloride | Sigma | T8877 | |
| Absolute Ethanol | Aladdin Industrial Corporation | E111993 | |
| Dimethyl sulfoxide | Sigma | D8418 | |
| Laser Doppler Flowmetry | Moor Instruments Ltd | Model Moor VMS-LDF2 | |
| Diethyl ether anhydrous | Sinopharm Chemical Reagent Corporation | 80059618 | |
| Trichloroacetaldehycle hydrate | Sinopharm Chemical Reagent Corporation | 30037517 | |
| 10% Formalin | Aladdin Industrial Corporation | F111936 | |
| 24-well plates | Jet Biofil | TCP-010-024 |
Referências
- Zhao, H., Sapolsky, R. M., Steinberg, G. K. Interrupting reperfusion as a stroke therapy: ischemic postconditioning reduces infarct size after focal ischemia in rats. J Cereb Blood Flow Metab. 26 (9), 1114-1121 (2006).
- Leconte, C., et al. Delayed hypoxic postconditioning protects against cerebral ischemia in the mouse. Stroke. 40 (10), 3349-3355 (2009).
- Fan, Y. Y., et al. Transient lack of glucose but not O2 is involved in ischemic postconditioning-induced neuroprotection. CNS Neurosci Ther. 19 (1), 30-37 (2013).
- Hess, D. C., Hoda, M. N., Bhatia, K. Remote limb perconditioning [corrected] and postconditioning: will it translate into a promising treatment for acute stroke. Stroke. 44 (4), 1191-1197 (2013).
- Ren, C., Yan, Z., Wei, D., Gao, X., Chen, X., Zhao, H. Limb remote ischemic postconditioning protects against focal ischemia in rats. Brain Res. 1288, 88-94 (2009).
- Sun, J., et al. Protective effect of delayed remote limb ischemic postconditioning: role of mitochondrial K(ATP) channels in a rat model of focal cerebral ischemic reperfusion injury. J Cereb Blood Flow Metab. 32 (5), 851-859 (2012).
- Li, P., et al. Remote limb ischemic postconditioning protects mouse brain against cerebral ischemia/reperfusion injury via upregulating expression of Nrf2, HO-1 and NQO-1 in mice. Int J Neurosci. , 1-8 (2015).
- Fan, Y. Y., et al. A novel neuroprotective strategy for ischemic stroke: transient mild acidosis treatment by CO2 inhalation at reperfusion. J Cereb Blood Flow Metab. 34 (2), 275-283 (2014).
- Shen, Z., et al. PARK2-dependent mitophagy induced by acidic postconditioning protects against focal cerebral ischemia and extends the reperfusion window. Autophagy. , (2017).
- Skolnik, J., Takacs, L., Szende, E. In vitro oxygen consumption of slices from kidney, brain, cortex and liver in hypoxia. Nature. 209 (5020), 305 (1966).
- Lynch, G., Schubert, P. The use of in vitro. brain slices for multidisciplinary studies of synaptic function. Annu Rev Neurosci. 3, 1-22 (1980).
- Zheng, S., Zuo, Z. Isoflurane preconditioning reduces purkinje cell death in an in vitro model of rat cerebellar ischemia. Neuroscience. 118 (1), 99-106 (2003).
- Yin, B., Barrionuevo, G., Weber, S. G. Optimized real-time monitoring of glutathione redox status in single pyramidal neurons in organotypic hippocampal slices during oxygen-glucose deprivation and reperfusion. ACS Chem Neurosci. 6 (11), 1838-1848 (2015).
- Medvedeva, Y. V., Ji, S., Yin, H. Z., Weiss, J. H. Differential vulnerability of CA1 vs CA3 pyramidal neurons after ischemia: possible relationship to sources of Zn2+ accumulation and its entry into and prolonged effects on mitochondria. J Neurosci. , (2016).
- Pignataro, G., et al. In vivo and in vitro characterization of a novel neuroprotective strategy for stroke: ischemic postconditioning. J Cereb Blood Flow Metab. 28 (2), 232-241 (2008).
- Zhang, X., Ding, H. Z., Jiang, S., Zeng, Y. M., Tang, Q. F. An in vitro study of the neuroprotective effect of propofol on hypoxic hippocampal slice. Brain Inj. 28 (13-14), 1758-1765 (2014).
- Niu, Y., et al. Chemical profiling with HPLC-FTMS of exogenous and endogenous chemicals susceptible to the administration of chotosan in an animal model of type 2 diabetes-induced dementia. J Pharm Biomed Anal. 104, 21-30 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados