Method Article
Coleção, isolamento e Citometria de Fluxo de Análise de Amostras endocervix Humano
Neste Artigo
Resumo
The use of cytobrush sampling to collect lymphocytes and monocytes from the endocervix is a minimally invasive technique that provides samples for analysis of female genital tract immunity. In this protocol, we describe the collection of cytobrush samples and immune cell isolation for flow cytometry assays.
Resumo
Despite the public health importance of mucosal pathogens (including HIV), relatively little is known about mucosal immunity, particularly at the female genital tract (FGT). Because heterosexual transmission now represents the dominant mechanism of HIV transmission, and given the continual spread of sexually transmitted infections (STIs), it is critical to understand the interplay between host and pathogen at the genital mucosa. The substantial gaps in knowledge around FGT immunity are partially due to the difficulty in successfully collecting and processing mucosal samples. In order to facilitate studies with sufficient sample size, collection techniques must be minimally invasive and efficient. To this end, a protocol for the collection of cervical cytobrush samples and subsequent isolation of cervical mononuclear cells (CMC) has been optimized. Using ex vivo flow cytometry-based immunophenotyping, it is possible to accurately and reliably quantify CMC lymphocyte/monocyte population frequencies and phenotypes. This technique can be coupled with the collection of cervical-vaginal lavage (CVL), which contains soluble immune mediators including cytokines, chemokines and anti-proteases, all of which can be used to determine the anti- or pro-inflammatory environment in the vagina.
Introdução
A maioria das novas infecções pelo HIV em todo o mundo surgem através de transmissão heterossexual, com as mulheres representando 47% das novas infecções em 2011 (UNAIDS 1). Compreender o trato genital feminino (FGT), um dos principais portais de entrada para o HIV e outros patógenos sexualmente transmissíveis, é de grande importância no caminho para encontrar estratégias eficazes para prevenir a infecção. As respostas imunitárias a mucosa genital são claramente único e diferem dos que foram medidos no sangue periférico 2. No entanto, o conhecimento atual sobre a dinâmica do sistema imunológico no FGT é limitada na melhor das hipóteses. Até o momento, os estudos sobre o ambiente imune da mucosa em grande parte focada nos tecidos linfóides associados ao intestino (GALT), onde se tornou claro que os primeiros eventos em tecidos da mucosa após a infecção ter um forte impacto na posterior progressão da doença 3,4. A recolha de amostras a partir da mucosa genital representa um grande desafio e é pelo menos parcialmente responsável pela lack de compreensão da imunologia da FGT. Resolvendo o quebra-cabeça da dinâmica imunológico entre o hospedeiro eo agente patogénico no contexto do ambiente distinto que é o FGT necessita de métodos eficientes para a coleta e análise de amostras a partir desta localidade.
A FGT está dividido em duas partes: a parte superior do tracto reprodutivo, que inclui os tubos de Falópio, endométrio e endocervical, e do tracto inferior, o qual contém o ectocérvix e da vagina (revisto por Kaushic et al, 5). Não é ainda claro que a contribuição relativa de diferentes locais é a infecção pelo HIV, mas acredita-se que ambos os locais poderiam contribuir para a entrada do VIH 6. As células T representam 40-50% dos leucócitos do trato reprodutivo superiores e inferiores, enquanto que os macrófagos representam cerca de 10% (revisto em Rodriguez-Garcia et al 2). As células T podem ser detectadas na vagina, colo do útero, endométrio e. Os macrófagos são mais fortemente localized no endométrio e miométrio tecido conjuntivo do que o colo do útero, embora possam ser detectados em ambos os tecidos. Finalmente, as células dendríticas plasmacytoid (PDCs) e as células de Langerhans pode também ser detectada em tecidos FGT. O fenótipo e proporções de populações do sistema imunológico e a sua susceptibilidade à infecção por HIV pode variar de acordo com os ciclos importante hormonais, o uso de contraceptivos hormonais, a vaginose bacteriana ou actividades sexuais 5,7-9.
Diversos métodos foram desenvolvidos para estudar as populações imunes e Meio Ambiente da FGT. Biópsia do colo do útero, colo do útero e cytobrushes lavagens cérvico-vaginais (CVL) 10-12 são os mais comumente usados em literatura. Coleção CVL por PBS lavagem é o método mais simples e permite o estudo de proteínas moduladoras do sistema imunológico, mas os resultados no rendimento extremamente baixo da pilha, e não é, portanto, adequado para estudar as populações de células imunes do FGT 13. CVL amostras são, por outro lado, vEry útil para avaliar o ambiente imunológico do FGT medindo a expressão de diversas citocinas, quimiocinas e factores anti-microbianos, utilizando métodos tais como ELISA, citocina talão de matriz 14, ou espectrometria de massa de 15,16. Caracterização das frequências de células imunitárias, fenótipos e funções pode ser alcançado através da recolha de células mononucleares do colo do útero (CMC) por cytobrush cervical ou por amostragem de biopsia cervical.
Amostragem de biopsia cervical é um método invasivo, que aumenta o desconforto e risco de hemorragia e leva de 2 a 11 dias para curar seguindo o procedimento de acordo com o estado imunitário do mulher 12. Por outro lado, cytobrushes cervicais, apesar do rendimento mais baixo de células recolhidas, é um método menos invasivo e mais conveniente para recolher células do sistema imunológico do FGT. Ambos os métodos podem atingir o mesmo rendimento de leucócitos CD45 +, mas dois cytobrushes cervicais sequenciais são necessárias para se obter a mesma quantidade de células continha in uma biópsia 13. No entanto, a amostragem cytobrush ainda fornece um número aceitável de células (cerca de 5.000 células CD45 + / cytobrush) para posterior ex vivo fenotipagem por citometria de fluxo 14. Além disso, a caracterização funcional pode ser levada a cabo com as amostras, tal como a estimulação do fluxo intracelular e citometria de qPCR ou ter sido realizada utilizando derivados de CMC cytobrush para identificar as respostas imunitárias específicas para o HIV 17 ou polarização celular Th 18. Expansão da população de células T podem também facilitar estudos funcionais com CMC 19.
É importante notar que as biópsias e cytobrushes amostra porções distintas do FGT. As biópsias são derivados a partir da porção superior do epitélio e estroma da ectocérvix 12,13, enquanto cytobrushes cervicais amostra do orifício cervical, recolhendo as células derivadas do epitélio endocervical e presumivelmente da zona de transformação. Portanto amostras cytobrush provar uma região composto por uma única camada de epitélio, enquanto que as biópsias, incluem uma região revestida por um epitélio escamoso estratificado 5. Como resultado, a natureza das populações de leucócitos recolhidos por biopsia cervical e cytobrush difere. Biópsias recolher uma proporção mais elevada de células T CD3 +, ao passo que cytobrushes resultam na recolha de uma maior proporção de monócitos CD14 + / macrófagos 13.
O estudo da imunologia da FGT tem havido um interesse por muitos anos 20-22 e temos acumulado uma grande quantidade de conhecimentos com o estudo da CMC derivados de cytobrush. Nossos estudos se concentram principalmente no estudo do HIV-infectados, não infectados e expostas ao HIV soronegativos (HESN) profissionais do sexo de Nairobi, no Quênia. VIH replica preferencialmente em células T activadas 23 e inferior do número de células activadas que podem ser alvo de HIV no FGT poderiam contribuir para a protecção contra a infecção pelo VIH. Em linha com esta hipótese, vários studies descreveram ativação imune menor entre os trabalhadores do sexo HESN que estão altamente expostos ao HIV ainda permanecem não infectados 24,25, e este fenótipo quiescente também é observado no FGT 14. Aqui, descrevemos a metodologia para o processamento e avaliação de ativação de células T em amostras de CMC derivadas cytobrushes cervicais por ex vivo citometria de fluxo.
Protocolo
Declaração de ética: a ética conselhos de administração da Universidade de Manitoba e Kenyatta National Hospital / Universidade de Nairobi de pesquisa aprovado este estudo e consentimento informado foi obtido de todos os participantes do estudo.
1. Preparação de Mídia e CMC Coleção Tubes
- Preparar a solução (PBS) (NaCl 137,93 mM, KCl 2,67 mM, 8,1 mM de Na 2 HPO 4, 1,47 mM, KH 2 PO 4) tampão fosfato salino. Autoclave para esterilidade. Este pode ser armazenado a 4 ° C durante vários meses.
- Pré-alíquota de 5 ml PBS em 50 ml tubo falcon (uma por amostra a ser coletado) e armazenar a 4 º C até o tempo de coleta de amostras.
- Rotular 2-4 criotubos ou 1,5 ml microtubos por amostra para coletar lavagem para armazenamento.
- Preparar meios de cultura celular: RPMI 1640 + 1% de penicilina / estreptomicina / anfotericina B (concentração final de 100 unidades / ml, 100 ug / ml e 250 ng / ml, respectively, sem FCS / FBS acrescentou.
2. Coleta de Amostras cytobrush
Coleta de amostras cytobrush é um procedimento não-invasivo, que deve ser realizada por um médico ou ginecologista treinado.
- Coletar células mononucleares do colo do útero (CMC) usando tanto um cytobrush e um raspador de madeira ou de plástico. Colete CMC do participante sob exame especular, inserindo o raspador e girando ao redor do orifício cervical (Figura 1). Insira o cytobrush no SO endocervical, gira 360 ° e coloque imediatamente tanto o cytobrush e raspador no tubo falcon 50 ml contendo 5 ml de PBS.
- Manter as amostras em gelo / a 4 º C até o processamento. Para manter a viabilidade celular, amostras de processos dentro de 2 horas da coleta.
- Se possível, coletar amostras de sangue compensadas em top vacutainers heparina verdes para células mononucleares do sangue periférico (PBMC) de isolamento para servir como um comparador / controle para análise CMC.
3. Isolamento de CMC
Executar o processamento de amostras em um laboratório de biossegurança nível 2, em uma cabine de segurança biológica estéril com luvas duplas.
- Durante a coleta, as amostras de CMC podem ser contaminados com sangue. Excluir amostras com contaminação de sangue visível a partir do estudo, a fim de evitar a inclusão de confusão de PBMC na amostra final. Devido ao baixo número de linfócitos isolados a partir de amostras de CMC, contaminação sanguínea menor pode facilmente sobrecarregar o componente de linfócitos CMC.
- Tubos Vortex falcon contendo tanto o cytobrush e raspador para 45 seg dissociar células das escovas. As amostras podem tornar espumoso durante este processo; isso é normal.
- Use o cytobrush para raspar qualquer material restante fora do raspador, e descartar o raspador em uma solução de água sanitária. Para coletar as células continuem ligadas ao escova / raspador, use uma luva fresca para espremer o raspador entre o polegar eo indicador.Deslize a escova, permitindo que as células e PBS a ser recolhidos no mesmo tubo de 50 ml. Descarte o cytobrush em uma solução de água sanitária, e descarte a luva.
IMPORTANTE: Use uma luva nova para cada amostra. - Instale um filtro de células 100 mm de nylon para um novo tubo de 50 ml falcão. Usando uma pipeta de transferência, recolher a suspensão PBS-célula do tubo de amostra e filtra-se através do filtro para dentro do tubo fresco.
- Adicionar 5 ml de meio RPMI 1640 para o tubo de amostra original. Utilizando a pipeta de transferência, lavar os lados do tubo de ensaio com o meio RPMI, e transferir através do filtro para o novo tubo de recolha. Lava-se a parte inferior do filtro de nylon, com o meio RPMI bem.
- Centrifugar as amostras durante 10 min a 514 x g. É crucial para deixar o freio de centrifugação, durante este passo, a fim de evitar desalojamento do sedimento CMC.
- Remova cuidadosamente o sobrenadante do tubo, tomando cuidado para não perturbar o sedimento. Tamanho da pelota será altamente variável; no modome amostras, o sedimento é muito grande, devido à presença de grandes números de células epiteliais, enquanto em outros casos, a pelete é pouco visível e altamente transparente.
- Ressuspender o sedimento por agitação suave do tubo falcon. Adicionar 5 ml de PBS para lavar a amostra.
- Centrifugar novamente durante 10 min a 514 x g sem travão de centrifuga.
- Cuidadosamente descarte do sobrenadante e re-suspensão da pelota como acima. As células estão prontas para qualquer criopreservação (usando um protocolo de criopreservação PBMC), a estimulação ou citometria de fluxo fenotipagem.
4. CMC manchas na superfície e Citometria de Fluxo
- Ressuspender o sedimento do passo de 3,10 em 100 ul de solução de bloqueio e transferir quer numa placa de 96 poços ou de tubo de FACS. A solução de bloqueio (para bloquear os receptores Fcy) receita é como se segue: 1,8 ul de IgG (concentração final de 0,2 ug / ul), 5 ul de FBS e 93,2 ul de lavagem de FACS (PBS 2% de FBS).A coloração pode ser realizada em uma placa de 96 poços que os tamanhos de aglomerados são suficientemente pequenas, mas podem precisar de ser realizada em tubos de FACS se pelotas são rotineiramente grande. É importante para a titulação de anticorpos em conformidade.
- Bloquear as amostras durante 10 min em gelo / a 4 ° C.
- Lavar as células com 100 ul de FACS de lavagem (PBS 2% de FBS) em placas de 96 poços, ou 500 ul em tubos de FACS. Centrifugar a 600 xg por 10 minutos a 4 ° C com o freio baixo (ou fora, se um nível baixo de freio não estiver disponível).
- Remover o sobrenadante e ressuspender o sedimento de células por agitação. Adicionar Stain viabilidade (corante de viabilidade solucionáveis Morto Live). Prepare corante de viabilidade de acordo com as instruções do fabricante. Ela pode necessitar de ser ajustada para uso em cada configuração de laboratório / citómetro. Incubar durante 30 min no escuro a 4 ° C.
- Lave as células 100 μl/500 ul de PBS (para tubos de placa / FACS de 96 poços). Centrifugar a 600 xg por 10 min com baixo / nenhum freio. Remover supernatant e ressuspender as células.
- Incubar as células com o cocktail de anticorpos de marcadores de superfície, num volume total de 100 ul. IMPORTANTE: Otimizar e titular cada citometria de fluxo do painel antes de provar coloração. Incubar as células durante 30 min no escuro a 4 ° C.
- Repita o passo 4.5. Se a coloração em uma placa de 96 poços, as células de transferência para um tubo de FACS e diluir para um volume final de 750 ul de FACS de lavagem contendo 1% de paraformaldeído (PFA) (ou Cytofix, diluídos 1 para 4). Continuar a aquisição de dados em um citómetro de fluxo.
5. Coleta e Preparação de colo do útero Vaginal Lavage (CVL)
- Antes da amostragem cytobrush, utilizar uma seringa, para lavar o endocérvix com 2 ml de PBS estéril e aspirar a lavagem do saco posterior.
- Colete a amostra do lavado aspirado em um tubo falcon de 15 ml e manter em gelo / a 4 º C até o processamento.
- Amostra Centrifugar a 400 g durante 7 min para remover os restos celulares.
- Collect o sobrenadante, alíquota da amostra em 1 ml ou 500 mL alíquotas e armazenar a -70 ° C. As alíquotas podem ser descongelados para ELISA ou análise disposição talão de proteínas CVL, mas evite múltiplos ciclos de congelamento / descongelamento.
- Se desejado, ressuspender o sedimento de restos celulares em ARN Posterior para medir a expressão de ARN seguindo o protocolo do fabricante.
6. Aquisição de Dados
- Preparar um conjunto de tubos de compensação que corresponde painel de anticorpos. Execute os tubos de compensação para ajustar sobreposição espectral. Execute as amostras de qualquer fluxo multicolor citômetro que está configurada para os anticorpos conjugados com fluorocromos utilizados no painel.
- Adquirir uma amostra PBMC primeiro para ajustar Forward Scatter (FSC) e Side Scatter tensão (SSC), a fim de detectar a população de linfócitos. Tente mantê-los em 100 em cada eixo em uma escala linear. Executando um controle PBMC irá facilitar significativamente para encontrar a população de linfócitos CMC.
- O limiar do FSC para amostras de CMC pode precisar de ser aumentada relativamente a amostras de PBMC devido a manchar-se o eixo de SSC a baixos valores de FSC.
- Vortex cada tubo antes de adquirir. Adquirir todo o tubo para maximizar o número de eventos de porta de linfócitos recolhidos. Monitore a máquina com cuidado para evitar entupimento.
- Exportar os dados em um programa de análise por citometria de fluxo, tais como FlowJo.
7. Estratégia de propagação
- Selecione Encaminhar dispersão lateral elevada (FSC-H) / área de dispersão lateral para a frente (FSC-A) para determinar a população singlet.
- Selecione Tempo contra marcador fluorescente (como exemplo FITC) para controlar a qualidade da aquisição. Alteração da taxa de fluxo pode introduzir artefatos nos dados. Excluir qualquer área que mostra discrepância na taxa de fluxo.
- Identificar a população de linfócitos em SSC-A/FSC-A trama. Use um controle PBMC para facilitar a identificação. Note-se que a população de linfócitos CMC pode não ser tão clara como o controle PBMC.
- Portão em SSC-A/viability tingir para excluir as células mortas de células vivas. As células mortas pode não especificamente incorporar os anticorpos, que vai introduzir artefatos.
- Porta na SSC-A/CD3 para identificar a população de células T. Deste portão, identificar as populações de células CD4 + e CD8 +.
Resultados
Citometria de fluxo Multi é uma poderosa ferramenta para dissecar os fenótipos e funções de subpopulações de células em tecidos previamente descaracterizados. Análise de amostras de CMC pode render informações sobre ambos linfócitos e monócitos populações com as estratégias de propagação apropriados.
Uma estratégia de propagação CMC representativo, em comparação com um perfil combinado de PBMC, é mostrada na Figura 2. O FSC-A versus FSC-H trama permite a exclusão de dupletos de células, que são altamente prevalentes em amostras de CMC comparado com PBMC, mesmo após a filtração (Figura 2A). O controle de qualidade inclui a remoção de problemas de fluxo pela passagem no tempo, onde as mudanças na taxa de fluxo ou artefactos devido a pedaços de exemplo podem ser facilmente identificados (Figura 2B). Identificação das populações de linfócitos / monócitos é relativamente semelhante em ambos as PBMC e de amostras de CMC (Figura 2B). Exclusão de células mortas por corante de viabilidade impede inclusãocélulas da apoptose que tiveram não especificamente se os conjugados de anticorpos fluorescentes. A viabilidade é menor nas amostras de CMC comparado com PBMC, e pode ser altamente variável de amostra para amostra (Figura 2B).
Esta análise incidirá sobre a fenotipagem da população de linfócitos T, mas as amostras de CMC também contêm monócitos. Após gating na população de monócitos, as células são fechado baseada em um corante de viabilidade e de um canal de descarga (Figura 3A). O canal de despejo contém anticorpos contra CD56, CD3 e CD19, e gating em células dos canais de negativa de despejo vai eliminar qualquer contaminação de linfócitos na população de monócitos. As células podem então ser identificados com base na expressão de marcadores tais como CD16 e CD11c. A população de linfócitos CD3 + é tipicamente reduzido em proporção entre CMC comparado com PBMC (Figura 3B, a Tabela 1). A elevada proporção de células epiteliais, granulócitos e leucócitos CD45 + CD3 + não contidos em amostras de CMC dominates mais a população de células T. As células T CD4 + (mediana: 55,30%, IQR: 50,53% -68,18%) e as células T CD8 + (mediana: 25,60%, IQR: 21,50% -33,80%) encontram-se numa proporção inferior (mais próxima de 2:1 entre CMC) em comparação com a relação de 5:1 observada entre amostras saudáveis PBMC da coorte de profissionais do sexo no Quênia (Figura 3C, Tabela 1). Tal como no sangue, a infecção pelo HIV afeta as proporções de células CD4 + e CD8 + T entre CMC, diminuindo o CD4: CD8 + para 0,7 (mediana: 0,7, IQR: 0,31-2,45) (Figura 3C, Tabela 1). No entanto, não é invulgar observar uma maior proporção de células T CD8 + entre as populações de CMC de indivíduos saudáveis (Figura 3C). Curiosamente, um expandiu CD4-CD8-(duplo negativo, DN) T população de células em relação à freqüência de células PBMC DN T pode ser observada entre muitas amostras de CMC de indivíduos HIV-negativos (Tabela 1). Estes resultados são semelhantes aos obtidos para as amostras de prepúcio 26, althourg estas células são mal caracterizadas.
Marcadores fenotípicos células T típicas são facilmente quantificados entre CMC, mas podem ser diferentes das PBMC e a figura 4 mostra a identificação de um CD161 + + + (MAIT) população CD8, que é distinto em PBMC mas quase ausentes em CMC (Figura 4A). Expressão dos marcadores de activação CD69 e HLA DR, marcador migração CCR5 ou marcadores exaustão PD-1 pode ser claramente identificada em células T CD4 + ou CD8 + populações (Figura 4B).
A quantificação da concentração de citocinas / quimiocinas em CVL podem ser analisados em paralelo com a coloração de CMC. Isto permite a correlação entre o meio de citocinas CVL (pró-inflamatória contra imunorreguladora) eo fenótipo da CMC. Estes dados também pode ser utilizado para determinar se a frequência de expressão do receptor da quimiocina em CMC está relacionado com a expressão relativa de plasma ou quimiocinas CVL 14. Quadro 2 </ Strong> indica a concentração média de citocinas e quimiocinas analitos em CVL coletados de mulheres saudáveis e ensaiadas por kits MILLIPLEX matriz citocina talão.
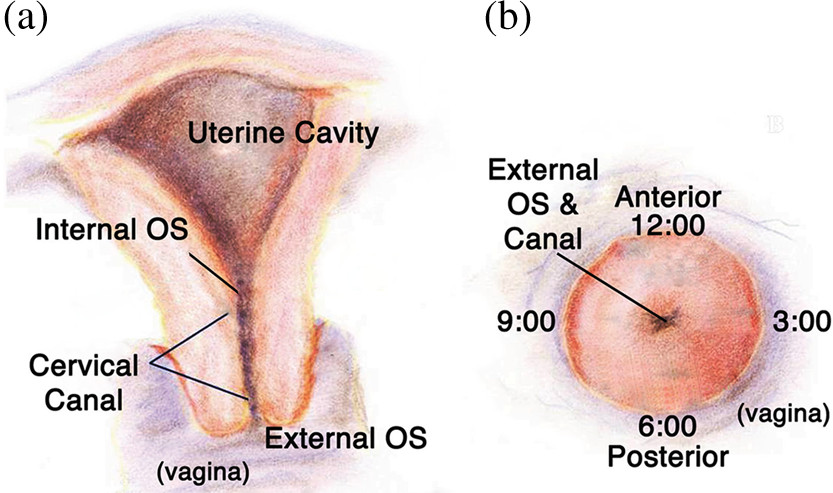
Figura 1. Anatomia do aparelho reprodutor feminino. A) vista em corte transversal do sistema reprodutivo das mulheres, mostrando a relação da vagina para o orifício externo do colo do útero, canal cervical e cavidade uterina. B) ângulo frontal do colo do útero, mostrando o orifício externo eo fundo de saco anterior e posterior regiões às 12:00 e 06:00, respectivamente. Reproduzido com permissão da Reusch et al 27. O raspador cervical é rodado em torno do orifício do colo do útero para recolher CMC, enquanto o cytobrush é inserido dentro do canal cervical e rodada para recolher CMC adicional. Lavagens vaginais cervicais (CVL)são recolhidos por lavar o endocérvice com PBS e recolher-lo do saco posterior.
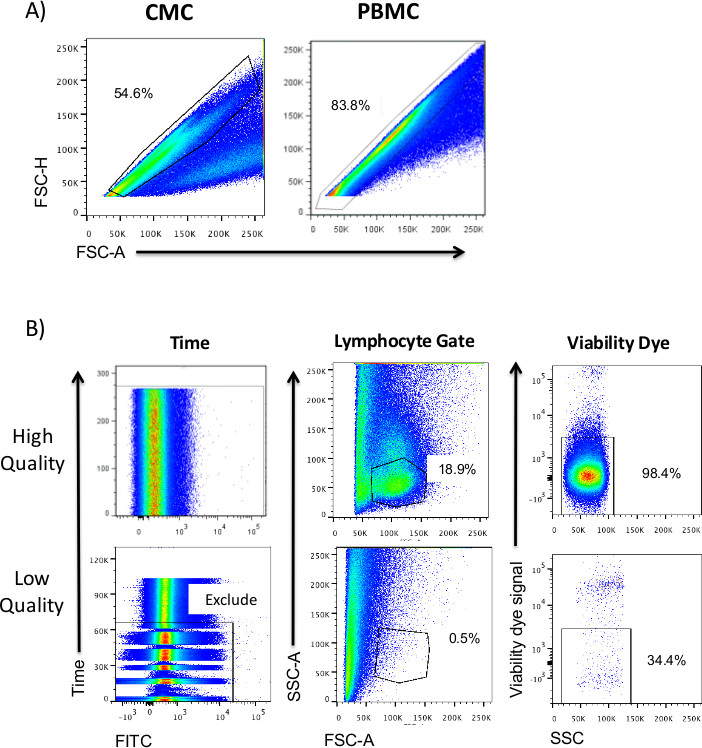
Figura 2. Gating e de controlo de amostras de CMC de qualidade. A) Identificação de singlets pelo FSC-A versus FSC-H enredo demonstra o baixo percentual de singletos em amostras de CMC em comparação com amostras de PBMC, mesmo depois baseado em filtro CMC isolamento. B) Exemplos de amostras de alta e de baixa qualidade são mostrados para vários qualidade medidas de controlo. De selecção de tempo versus fluorescência (ou SSC / FSC) pode identificar problemas de vazão e ser usada para excluir eventos que podem resultar em artefatos de coloração. Uma população de linfócitos com base no FSC vs SSC pode ou não pode ser facilmente identificado, dependendo da amostra. A inclusão de um corante de viabilidade é crucial, como algumas amostras podem conter menos de 50% de células viáveis. Viability (reactivo a amina) Corantes de corar as células mortas mais intensamente do que as células vivas, como perda de integridade da membrana sobre a morte celular permite que o corante para aceder grupos amina em proteínas dentro da célula. As células viáveis são então identificados pela passagem sobre a população de corante negativo viabilidade.

Figura 3. Identificação de subconjuntos de células T. A) O CD3 + da população entre as amostras de CMC é, geralmente, uma proporção menor da porta de linfócitos em comparação com amostras de PBMC. Amostras de CMC também são mais variáveis em tamanho da população de células T, como mostrado. B) células T CD4 +, T CD8 + e as populações de células T CD4-CD8-T são facilmente identificados em ambos CMC e amostras de PBMC. CD4: proporção de células T CD8 podem variar de amostra para amostra entre CMC, como mostrado. Os dados apresentados foram coletados de mulheres não infectadas pelo HIV.
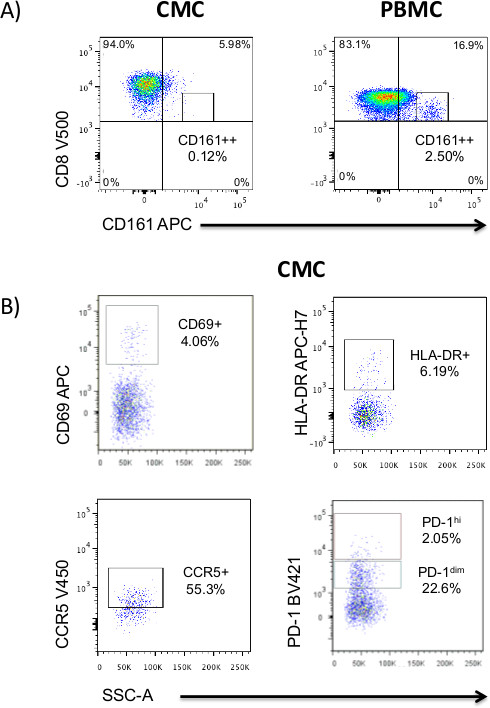
Fenótipos celulares Figura 4. T em amostras de CMC. A) A mucosa associada células T invariantes (MAIT) CD8 + CD161 + + população que é facilmente identificado em amostras de PBMC é quase inteiramente ausente na CMC. As células T CD8 + CD161 + T podem ser identificados em ambos os exemplos. B) CMC expressão exposição de marcadores fenotípicos, incluindo CD69, HLA DR, CCR5 e DP-1. Portões foram desenhados com base na fluorescência menos um (FMO) controles. Os dados apresentados foram coletados de mulheres não infectadas pelo HIV.
| CMC | PBMCs | |||||
| População | HIV + (n = 34) | VIH-(n = 44) | Valor de P um | HIV + (n = 28) | VIH-(n = 35) | Valor de P um |
| mediana (IQR) | mediana (IQR) | mediana (IQR) | mediana (IQR) | |||
| % de linfócitos ao vivo | 85,65 (60.25-92.63) | 88,70 (74.85-95.38) | 0,1193 | - | - | |
| % CD3 + em linfócitos ao vivo | 5,94 (0,90-16,80) | 1,44 (0,39-8,46) | 0,0303 | 41,15 (17.08-62.10) | 41,90 (20.40-51.30) | 0,4231 |
| valor p b | <0,0001 | <0,0001 | ||||
| % CD8 + CD3 + no portal | 43,20 (25.75-66.00) | 25,60 (21.50-33.80) | 0,001 | 30,05 (22.75-38.78) | 14,60 (8.01-24.80) | <0,0001 |
| valor p b | 0,0291 | <0.0001 | ||||
| % CD4 + em CD3 + portão | 31,10 (20.45-63.10) | 55,30 (50.53-68.18) | 0,0003 | 56,10 (50.10-61.28) | 77,20 (65.90-92.80) | <0,0001 |
| valor p b | 0.002 | <0,0001 | ||||
| Relação CD4: CD8 | 0,71 (0,31-2,45) | 2,09 (1,55-3,01) | 0,0003 | 1,92 (1,44-2,39) | 5,34 (2,66-10,77) | <0,0001 |
| valor p b | 0.004 | <0,0001 | ||||
| % DN em CD3 + portão | 10,40 (6,36-14,30) | 10,70 (6,76-19,10) | 0,4793 | 9,58 (6.65-15.98) | 7,01 (5,26-8,07) | 0,0032 |
| valor de p b | 0,8338 | 0,0006 | ||||
Tabela 1. Proporções relativas de subconjuntos de células T em CMCs e PBMC. CMCsamples a partir de 44 HIV-negativo e 34 trabalhadoras do sexo HIV-positivos e amostras de PBMC de 35 HIV-negativo e 28 HIV-positivos foram comparados por sua proporção relativa de células vivas, células T CD3 + e CD4 +, CD8 + e CD8-CD4-DN subconjuntos de células T. Os dados são apresentados como mediana (25 º -75 º interquartil, IQR). As diferenças entre os grupos foram calculados pelo teste de Mann-Whitney. Os valores de p indicam os resultados de uma comparação entre um VIH + e VIH-, ou b CMC e PBMC de dados.
height = "20">| Analyte | A média de um (Desvio Padrão). | Limite de detecção |
| pg / mL | pg / mL | |
| MIP-3a | 35,5 (90,6) | 2,9 |
| MIG | 1447 (3026) | 19,4 |
| ITAC | 2,7 (6,3) | 0,8 |
| Fractalcina | 51,6 (69,5) | 10,6 |
| IFN-a2 | 24,0 (12,0) | 40,6 |
| IFN-g | 3,9 (14,2) | 0,3 |
| A IL-1a | 268,4 (721,3) | 6.4 |
| IL-1b | 46,8 (126,2) | 0,7 |
| IL-1ra | 4967,0 (3597) | 5.5 |
| IL-2 | 0,9 (2,6) | 0,6 |
| IL-6 | 14,8 (30,5) | 0,7 |
| IL-7 | 6,3 (10,1) | 0,1 |
| IL-8 | 1491 (2126) | 0,3 |
| 4,5 (8,6) | 0,5 | |
| IL-15 | 1,4 (2,7) | 0,7 |
| IL-17 | 1,1 (2,2) | 0,3 |
| IP-10 | 381,4 (1100) | 2.2 |
| MCP-1 | 129,4 (340,4) | 1.6 |
| MCP-3 | 5,9 (7,1) | 3.7 |
| MDC | 84,2 (94,6) | 6.9 |
| MIP-1a | 20,9 (28,9) | 6.4 |
| MIP-1b | 28,5 (42,6) | 8.9 |
| sCD40L | 10,8 (19,3) | 9 |
| sIL-2rA | 8,4 (9,8) | 7.7 |
| O TNF-a | 1,9 (4,1) | 0,1 |
Tabela 2. Expressão de citocinas e quimiocinas em CVL. Amostras de 51 não infectadas pelo VIH (não HESN) participantes da coorte trabalhador sexo feminino no meio do ciclo menstrual, foram ensaiadas quanto à concentração de citocinas / quimiocina usando o MILLIPLEX MAP citocinas humano / Quimiocina talão kit de matriz de acordo com o fabricante'S de protocolo durante a noite, testados em duplicata. IFN: interferon; MCP: proteína quimiotática de monócitos; MDC: quimiocinas macrófagos derivados, s: solúvel; TNF: factor de necrose tumoral; MIP: proteína inflamatória de macrófagos; ITAC: interferon alfa célula T inductible chemoattractant; MIG: monocina induzido pelo interferão gama; PI-10; proteína interferon inductible. a Valores abaixo do limite de detecção foi atribuído um valor de metade do limite de detecção.
Discussão
Dadas as grandes lacunas de conhecimento no que diz respeito à imunidade no trato genital feminino (FGT), análise fenotípica de CMC pode fornecer uma ampla gama de conhecimentos em várias populações linfocitárias no colo do útero. Juntamente com análise proteômica e medições da carga viral no lavado cervical, imunidade a infecções sexualmente transmissíveis (IST) s e outros patógenos pode ser dissecada em várias populações.
Considerações técnicas - CMC: O isolamento ea coloração bem sucedida de amostras CMC pode ser um desafio. Optimização do protocolo de recolha de CMC tem enfatizado a eficácia da recolha do LVC primeiro, seguido pelo raspador cervical e, em seguida, finalmente, o cytobrush. É importante aumentar o tamanho das amostras de planeamento em comparação com as calculadas para estudos de sangue periférico, devido ao aumento da probabilidade de exclusão de amostra para uma variedade de razões, discutidas abaixo.
Teste do desejopainel d fluxo de amostras de CMC é crítico antes do início do estudo. É importante controlar a autofluorescência celular em amostras de CMC, particularmente na barreira monocitária. CMC autofluorescência em alguns canais pode ser elevado em comparação com PBMC, que podem afectar gating e relações sinal-para-ruído. Além disso, as tensões ideais deve ser confirmado para amostras CMC se previamente determinada em amostras de PBMC.
Para preservar a integridade dos dados, é importante excluir amostras com contaminação por sangue ou confundindo DSTs. A inclusão de um corante de viabilidade de células na citometria de fluxo, o painel é vital para excluir as células mortas que se não se especificamente anticorpos fluorescentes. Enquanto a maioria das amostras são altamente viáveis, não é incomum para excluir 10-20% das células por corante de viabilidade. Se for prevista com base na análise de subconjuntos CD4 e CD8 de expressão, que é importante para se obter, pelo menos, 100 CD3 + eventos para prosseguir com a análise. Amostras coletadas de diferentes mulheres, e até mesmo a partir de uma mesma mulher um t diferentes pontos de tempo, pode produzir o número de células muito diferentes 13.
Análise por citometria de fluxo de linfócitos da mucosa é mais fácil e mais bem sucedido se uma amostra de controlo PBMC pode ser executado simultaneamente com as amostras de CMC. Em algumas amostras de CMC, a população de linfócitos é difícil identificar pelo FSC / SSC gating, mas a inclusão da amostra PBMC dará uma idéia melhor de onde a porta. Mesmo em amostras sem um linfócito claro FSC / SSC população, CD3 + distintas populações pode ser identificado. Se a aquisição de dados é interrompida por problemas técnicos (citômetro entupimento ingestão, bolhas, etc) gating em fluorescência ao longo do tempo pode remover artefatos de coleta de dados e ainda permite que a análise da amostra. Controlos adequados, tais como fluorescência menos um (FMO) para a colocação de tubos de portão pode precisar de ser realizada em células mononucleares do sangue periférico (PBMC), quando o número de células necessário é muito substancial para utilizar amostras cytobrush.
EOR "> Vários estudos têm demonstrado a detecção de respostas de células T específicas para o antigénio em amostras de CMC. produção de citocinas CMC também pode ser induzida por PMA / Ionomycine, PHA, IFN-y e anti-CD3 Uma das principais limitações das estimulações com CMC estimulação. está número de células, o que reduz o número de condições e controles que podem ser realizadas por amostra. Também é fundamental para monitorar com cuidado e tomar medidas adicionais para evitar a contaminação da cultura celular. trato genital não é um site estéril e, em alguns casos, antibióticos extras deve ser adicionado ao meio de cultura para prevenir o crescimento excessivo de bactérias. Embora CMC podem ser criopreservadas com pouca perda de viabilidade, a recuperação é de aproximadamente 50%, fazendo amostras criopreservadas candidatos pobres para os estudos de estimulação, a menos que a expansão das células está previsto 10.Considerações técnicas - CVLS: Coleção de CVL geralmente resulta em amostra limitada volume, impedindo a análise de um grande número de concentrações de proteína por repetidas ELISA. Um ensaio alternativo é a matriz do grânulo de citocina, com base na plataforma ou plataforma Luminex Citometria de Fluxo. Kits multiplexados estão disponíveis a partir de várias fontes comerciais, permitindo a quantificação de até 30 analitos numa extremamente pequeno volume da amostra (~ 25 vezes ul). Optimização destes ensaios revelou detecção óptima de analitos usando o protocolo de incubação durante a noite. Alguns analitos que são detectáveis em amostras de plasma / soro não são detectáveis em CVL. Notavelmente, a concentração de amostras CVL usando colunas de spin não melhorar a detecção de quaisquer analitos, sugerindo que não há nenhum benefício para concentração da amostra antes da execução do ensaio variedade pérola.
Confundidores específicos para a mucosa genital: Estudos de FGT imunologia deve tomar cuidado para reconhecer e representam o maior número de variáveis de confusão possível. O ciclo menstrual hcomo já foi demonstrado para impactar a imunidade de sangue periférico 28, e exerce provavelmente maiores impactos sobre CMC fenótipo e composição celular, bem como as proteínas colhidas a partir de amostras de CVL 29. Sincronizando a coleta de amostras para a fase do ciclo menstrual é a maneira preferida de reduzir a variabilidade dos dados, seja medido pelos níveis de estrogênio / progesterona ou dias desde o primeiro dia da última menstruação. O uso de contracepção hormonal também influencia o ambiente da mucosa e seu efeito deve ser levado em consideração ao projetar ou análise de um estudo. A alteração da flora vaginal, resultando em vaginose bacteriana (BV) também modifica o ambiente imunológico e fenótipos celulares. BV pode ser diagnosticada por coloração de Gram e uma pontuação Nugent pode ser estabelecido para controlar o efeito de confusão da BV.
A atividade sexual também tem um profundo impacto sobre imunologia genital, já que alo-respostas a sêmen pode induzir mudanças rápidas e dramáticas no cell fenótipo eo tráfico. Com efeito, Lajoie et al. descreveram diferenças na composição da proteína CVL entre profissionais do sexo e populações de trabalhadores não-sexuais, com as alterações ocorridas nos primeiros anos após o início do trabalho sexual.
Finalmente, as práticas culturais, como ducha irá introduzir mais variações em amostragem da mucosa. Dependendo do reagente utilizado (água sanitária, detergente, suco de limão, etc), ducha pode reduzir a freqüência / fenótipo de populações de células, ou alterar autofluorescência em comparação com outras amostras. Idealmente, ducha antes de cytobrush amostragem deve ser desencorajado entre os doadores.
As aplicações futuras: Além de ceder informação importante sobre a regulação da imunidade da mucosa durante menstrual / hormonal variabilidade, infecção viral / bacteriana e antes / depois da menopausa, a análise de amostras de mucosa é particularmente relevante para estudos de vacinas contra DSTs / patógenos mucosas. No caso do HIV,onde um dos principais objetivos dos estudos de vacinas é obter um anticorpo mucosa ou resposta das células T, desenvolvimento de ensaios baseados em CMC irá desempenhar um papel crucial na determinação correlatos de proteção.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors would like to thank Joshua Kimani, clinical director of the research program at the University of Nairobi, for his assistance with mucosal immunology studies related to this protocol. The authors would like to acknowledge funding from CHVI grant MOP 86721.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 μm cell strainer for 50 ml Falcon tube | BD | 352360 | CMC processing |
| RPMI 1640 | Hyclone | SH30027.01 | CMC processing |
| Fetal bovine serum | Life technology | 16000044 | CMC processing |
| Fungizone | Life technology | 15290-018 | CMC processing |
| Penicillin/streptomycin | Sigma | P4333-20ml | CMC processing |
| 50 ml Falcon tube | Fisher | 14-959-49A | CMC processing |
| Blood Bank disposable transfer pipette | Fisher | 13-711-6M | CMC processing |
| Cytobrush plus | Cooper surgical | C0121 | CMC sampling |
| Disposable cervical scraper | Quick medical | 2183 | CMC sampling |
| 15 ml Falcon tube | Fisher | 14-959-70c | CVL processsing |
| 1.5 ml tube Eppendorf | Fisher | 05-402-18 | CVL storage |
| LIVE/DEAD Fixable Cell Stain Kit | Invitrogen | Various | Flow cytometry reagent |
| Fixation buffer (4% PFA) | BD | 554655 | Flow cytometry regeant |
| IgG mouse | Sigma | I8765 | Flow cytometry regeant |
Referências
- UNAIDS. Global Report 2013. http://www.unaids.org/en/media/unaids/contentassets/documents/epidemiology/2013/gr2013/UNAIDS_Global_Report_2013_en.pdf. , (2013).
- Rodriguez-Garcia, M., Patel, M. V., Wira, C. R. Innate and adaptive anti-HIV immune responses in the female reproductive tract. Journal of reproductive immunology. 97, 74-84 (2013).
- Douek, D. HIV disease progression: immune activation, microbes, and a leaky gut. Topics in HIV medicine : a publication of the International AIDS Society, USA. 15, 114-117 (2007).
- Hofer, U., Speck, R. F. Disturbance of the gut-associated lymphoid tissue is associated with disease progression in chronic HIV infection. Seminars in immunopathology. 31, 257-266 (2009).
- Kaushic, C., Ferreira, V. H., Kafka, J. K., Nazli, A. HIV infection in the female genital tract: discrete influence of the local mucosal microenvironment. American journal of reproductive immunology. 63, 566-575 (2010).
- Hladik, F., Hope, T. J. HIV infection of the genital mucosa in women. Current HIV/AIDS reports. 6, 20-28 (2009).
- Sharkey, D. J., Tremellen, K. P., Jasper, M. J., Gemzell-Danielsson, K., Robertson, S. A. Seminal fluid induces leukocyte recruitment and cytokine and chemokine mRNA expression in the human cervix after coitus. Journal of immunology. 188, 2445-2454 (2012).
- Saba, E., et al. Productive HIV-1 infection of human cervical tissue ex vivo is associated with the secretory phase of the menstrual cycle. Mucosal immunology. 6, 1081-1090 (2013).
- St John, E. P., Martinson, J., Simoes, J. A., Landay, A. L., Spear, G. T. Dendritic cell activation and maturation induced by mucosal fluid from women with bacterial vaginosis. Clinical immunology. 125, 95-102 (2007).
- Liebenberg, L. J., et al. Stability and transport of cervical cytobrushes for isolation of mononuclear cells from the female genital tract. Journal of immunological methods. 367, 47-55 (2011).
- Hirbod, T., Kaldensjo, T., Broliden, K. In situ distribution of HIV-binding CCR5 and C-type lectin receptors in the human endocervical mucosa. PloS one. 6, (2011).
- Hasselrot, K., et al. Feasibility and safety of cervical biopsy sampling for mucosal immune studies in female sex workers from Nairobi, Kenya. PloS one. 7, (2012).
- McKinnon, L. R., et al. Optimizing viable leukocyte sampling from the female genital tract for clinical trials: an international multi-site study. PloS one. 9, (2014).
- Lajoie, J., et al. A distinct cytokine and chemokine profile at the genital mucosa is associated with HIV-1 protection among HIV-exposed seronegative commercial sex workers. Mucosal immunology. 5, (2012).
- Burgener, A., et al. Comprehensive Proteomic Study Identifies Serpin and Cystatin Antiproteases as Novel Correlates of HIV-1 Resistance in the Cervicovaginal Mucosa of Female Sex Workers. Journal of proteome research. 10, (2011).
- Burgener, A., et al. A systems biology examination of the human female genital tract shows compartmentalization of immune factor expression. Journal of virology. 87, (2013).
- Bere, A., Denny, L., Naicker, P., Burgers, W. A., Passmore, J. A. HIV-specific T cell responses detected in the genital tract of chronically HIV-infected women are largely monofunctional. Immunology. 139, (2013).
- McKinnon, L. R., et al. Characterization of a Human Cervical CD4+ T Cell Subset Coexpressing Multiple Markers of HIV Susceptibility. Journal of immunology. , (2011).
- Bere, A., Denny, L., Burgers, W. A., Passmore, J. A. Polyclonal expansion of cervical cytobrush-derived T cells to investigate HIV-specific responses in the female genital tract. Immunology. 130, 23-33 (2010).
- Iqbal, S. M., et al. Elevated T cell counts and RANTES expression in the genital mucosa of HIV-1-resistant Kenyan commercial sex workers. The Journal of infectious diseases. 192, 728-738 (2005).
- Hirbod, T., et al. Stable CD4 expression and local immune activation in the ectocervical mucosa of HIV-infected women. Journal of immunology. 191, 3948-3954 (2013).
- Horton, R. E., et al. A comparative analysis of gene expression patterns and cell phenotypes between cervical and peripheral blood mononuclear cells. PloS one. 4, (2009).
- Begaud, E., et al. Reduced CD4 T cell activation and in vitro susceptibility to HIV-1 infection in exposed uninfected Central Africans. Retrovirology. 3, 35 (2006).
- McLaren, P. J., et al. HIV-exposed seronegative commercial sex workers show a quiescent phenotype in the CD4+ T cell compartment and reduced expression of HIV-dependent host factors. The Journal of infectious diseases. 202 Suppl 3, (2010).
- Card, C. M., et al. Reduced Cellular Susceptibility to In Vitro HIV Infection Is Associated with CD4T Cell Quiescence. PloS one. 7, (2012).
- Prodger, J. L., et al. Foreskin T-cell subsets differ substantially from blood with respect to HIV co-receptor expression, inflammatory profile, and memory status. Mucosal immunology. 5, 121-128 (2012).
- Reusch, L. M., et al. Nonlinear optical microscopy and ultrasound imaging of human cervical structure. Journal of biomedical optics. 18, (2013).
- Oertelt-Prigione, S. Immunology and the menstrual cycle. Autoimmunity reviews. 11, (2012).
- Rahman, S., et al. Mucosal serpin A1 and A3 levels in HIV highly exposed sero-negative women are affected by the menstrual cycle and hormonal contraceptives but are independent of epidemiological confounders. American journal of reproductive immunology. 69, 64-72 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados