Method Article
Realização de experimentos de Miller-Urey
Neste Artigo
Resumo
O experimento de Miller-Urey era um estudo pioneiro sobre a síntese abiótica de compostos orgânicos com possível relevância para as origens da vida. Gases simples foram introduzidos em um aparelho de vidro e submetido a uma descarga elétrica, simulando os efeitos de um raio no sistema oceano-atmosfera primordial da Terra. O experimento foi realizado durante uma semana, após o qual, as amostras coletadas a partir dele foram analisadas para os blocos de construção químicos da vida.
Resumo
Em 1953, Stanley Miller relatou a produção de biomoléculas de simples matérias-primas gasosos, usando um aparelho construído para simular o sistema oceano-atmosfera primordial da Terra. Miller introduzidos 200 ml de água, 100 mmHg de H 2, 200 mmHg de CH4, e 200 mmHg, de NH 3 para dentro do aparelho, em seguida, submetida a mistura, sob refluxo, a uma descarga eléctrica durante uma semana, enquanto a água era simultaneamente aquecido. A finalidade deste artigo é a fornecer ao leitor um protocolo experimental geral que pode ser utilizado para efectuar um ensaio de ignição de descarga tipo de Miller-Urey, utilizando um balão de reacção 3 L simplificada. Uma vez que o experimento envolve a exposição de gases inflamáveis a uma descarga elétrica de alta tensão, vale destacar passos importantes que reduzem o risco de explosão. Os procedimentos gerais descritos no presente trabalho pode ser extrapolada para conceber e realizar uma grande variedade de experimento descarga eléctricaé simular ambientes planetários primitivos.
Introdução
A natureza das origens da vida na Terra permanece uma das questões científicas mais inescrutáveis. Na década de 1920 o biólogo russo Alexander Oparin e britânicos evolutiva biólogo e geneticista John Haldane propôs o conceito de uma "sopa primordial" 1,2, descrevendo os oceanos terrestres primitivos que contêm compostos orgânicos que podem ter facilitado a evolução química. No entanto, não foi até a década de 1950, quando os químicos começaram a realizar estudos de laboratório deliberados que visam compreender como as moléculas orgânicas poderiam ter sido sintetizados a partir de matérias-primas simples na Terra primitiva. Um dos primeiro relatórios para esta finalidade a síntese de ácido fórmico a partir de a irradiação de soluções aquosas de 2 CO 3 em 1951.
Em 1952, Stanley Miller, então um estudante de pós-graduação na Universidade de Chicago, Harold Urey abordado sobre fazer um experimento para avaliar a possibilidade de que os compostos orgânicosimportante para a origem da vida podem ter sido formados abiologically na Terra primitiva. O experimento foi realizado utilizando um aparelho de vidro feito por encomenda (Figura 1A), concebido para simular a Terra primitiva. O experimento de Miller imitou relâmpago pela ação de uma descarga elétrica em uma mistura de gases que representam a atmosfera primitiva, na presença de um reservatório de água líquida, o que representa os primeiros oceanos. O aparelho também simulado evaporação e precipitação, através da utilização de uma manta de aquecimento e um condensador, respectivamente. Detalhes específicos sobre o aparelho Miller usou pode ser encontrada em outro lugar 4. Depois de uma semana de produção de faíscas, o conteúdo do balão foi visivelmente transformada. A água voltou, uma cor avermelhada turva 5 e material de amarelo-marrom acumulado nos eletrodos 4. Este trabalho inovador é considerada para ser a primeira síntese deliberada, eficiente de biomoléculas sob condições simuladas Terra primitivas.
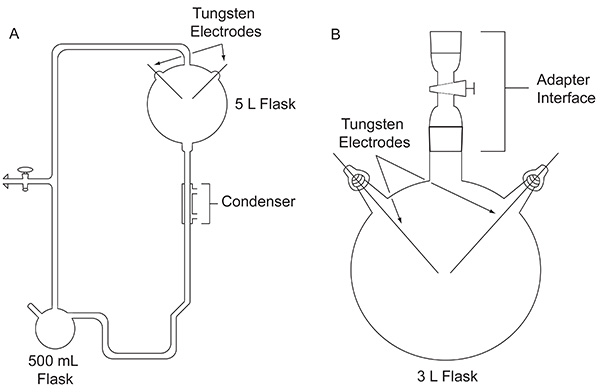
Figura 1. A comparação entre os dois tipos de aparelhos discutidos neste documento. Clássico O aparelho utilizado para o original experimento de Miller-Urey (A) e do aparelho simplificada utilizada no protocolo descrito aqui (B). Clique aqui para ver a imagem ampliada .
Após a publicação dos resultados do experimento clássico de Miller, inúmeras variações do experimento descarga de ignição, por exemplo, usando outras misturas de gases, foram realizados para explorar a plausibilidade de produzir compostos orgânicos importantes para a vida sob uma variedade de possíveis condições iniciais da Terra 1953. Por exemplo, um CH4 / H 2 O / NH 3 / H 2 S mistura de gás foi testado quanto à sua capacidade para produzir os ácidos α-amino-contendo enxofre codificadas, embora estes não foram detectados 6. Cromatografia gasosa-espectrometria de massa (GC-MS), a análise de um CH 4 / NH3 mistura foi submetida a uma descarga eléctrica mostraram a síntese de α-aminonitrilos, que são precursores de ácido aminado 7. Em 1972, utilizando um aparelho simples, introduzido pela primeira vez por Oró 8 (Figura 1B), Miller e colegas demonstraram a síntese de todos os aminoácidos codificados α-9 e aminoácidos não proteicos 10 que tinham sido identificadas no meteoritos Murchison à data, sujeitando CH 4, N 2, e pequenas quantidades de NH 3 a uma descarga eléctrica. Mais tarde, utilizando este mesmo modelo experimental simplificado, as misturas de gases contendo H 2 O, N 2, e CH 4, CO 2, CO ou foram provocou a study o rendimento de cianeto de hidrogénio, formaldeído, e aminoácidos como uma função do estado de oxidação das espécies de carbono na atmosfera 11.
Além da exploração de projetos experimentais alternativos ao longo dos anos, os avanços analíticos significativos ocorreram desde experimento clássico de Miller, que recentemente ajudou investigações mais de sondagem de descarga elétrica amostras experimentais arquivados por Miller, que teria sido facilitado pelas técnicas Miller teve acesso a na década de 1950. O experimento de Miller vulcânica 12, relatada pela primeira vez em 1955 4, e um 1958 H 2 S-contendo experimento 13 foram mostrados para ter formado uma maior variedade e maiores abundâncias, de vários aminoácidos e aminas que a experiência clássica, incluindo muitos dos quais que não tinha sido identificado previamente em experiências de descarga de faísca.
O experimento descrito neste trabalho pode ser realizado utilizandouma variedade de misturas de gases. Tipicamente, pelo menos, estas experiências irão conter um gás de suporte de C, com um gás de suporte de N, e água. Com algum planeamento, quase qualquer mistura de gases pode ser explorada, no entanto, é importante ter em conta alguns aspectos químicos do sistema. Por exemplo, o pH da fase aquosa pode ter um impacto significativo sobre a química que ocorre ali 14.
O método descrito aqui foi adaptado para instruir os pesquisadores como para conduzir experimentos de descarga centelha que lembram o experimento de Miller-Urey usando um vaso de 3 L reação simplificada, conforme descrito em Miller 1972 publicações 9,10. Uma vez que este ensaio envolve um arco eléctrico de alta tensão sob gases inflamáveis, é crucial para remover O2 a partir do balão de reacção para eliminar o risco de explosão, o que pode ocorrer após a combustão de gases reduzidas portadores de carbono, como o metano ou o monóxido de carbono, ou reação of H 2 com o oxigênio.
Há detalhes adicionais que devem ser mantidos em mente quando se prepara para conduzir o experimento discutido aqui. Em primeiro lugar, sempre que trabalhar com linhas de vácuo de vidro e gases pressurizados, existe o perigo inerente de ambos implosão e excesso de pressionar. Portanto, óculos de segurança deve ser usado em todos os momentos. Em segundo lugar, a experiência é geralmente realizado em menos de pressão atmosférica. Isso minimiza o risco de excesso de pressão sobre o distribuidor e balão de reacção. Artigos de vidro pode ser avaliado em ou acima da pressão atmosférica, no entanto, pressões acima de 1 atm não são recomendados. Pressões pode aumentar nestas experiências como insolúveis em água H 2 é libertado a partir de gases reduzidas (tais como CH4 e NH3). O excesso de pressionar pode levar a fugas de vedação, o que pode permitir que ó 2 atmosférico para entrar no balão de reacção, o que torna possível induzir a combustão, resultando numa explosão. Em terceiro lugar,deve-se ter em mente que a modificação deste protocolo para realizar variações do experimento requer um planejamento cuidadoso para assegurar condições inseguras não são criadas. Em quarto lugar, é altamente recomendável que o experimentador prospectivo ler todo o protocolo com cuidado várias vezes antes de tentar esta experiência para ter certeza de que ele ou ela está familiarizado com potenciais armadilhas e que todo o hardware necessário está disponível e no lugar. Por último, a realização de experimentos envolvendo gases combustíveis exigir o cumprimento de Saúde e Segurança Ambiental diretrizes departamentais da instituição de acolhimento do experimentador. Cumpra estas recomendações antes de prosseguir com qualquer experimento. Todos os passos descritos no protocolo aqui estão em conformidade com as diretrizes de acolhimento de Saúde e Segurança Ambiental institucionais dos autores.
Protocolo
1. Configurando um Sistema Manifold / Vacuum
- Utilizar um tubo de distribuição de vidro para introduzir os gases no frasco de reacção. Este colector podem ser comprados ou construídos por uma unidade de sopragem de vidro, mas deve incluir portas estanque ao vácuo, que pode ser ligado a um sistema de vácuo, cilindros de gás, um medidor de vácuo, e o vaso de reacção.
- Utilize juntas de vidro e velas de vidro com válvulas no bloco. Assegurar que todos os O-rings nas tampas são capazes de fazer os selos necessários. Se utilizar juntas de vidro, uma quantidade suficiente de lubrificante pode ser aplicado vácuo para ajudar a fazer a vedação, se necessário. Graxa vácuo de silício pode ser utilizado para evitar a contaminação biológica potencial.
- Use torneiras de vidro no colector. Aplique a quantidade mínima de gordura necessária vácuo para fazer um selo.
- Meça o volume do bloco. Este volume será usado para os cálculos relacionados com a pressão de gás finais no balão de reacção 3 L e deve ser conhecido de forma tão precisa quanto possível.
- A não ser que o distribuidor tem conexões suficientes para acomodar todos os cilindros de gás simultaneamente, conectar um cilindro de cada vez para o colector. Incluem a este respeito, uma torneira que permite o distribuidor ser isolado a partir da atmosfera ambiente.
- Use adequado, limpo, inerte, e química e vazamento tubulação resistente e acessórios de vácuo ultratorr para ligar os cilindros de gás para o colector. Acessórios Ultratorr, quando utilizados, devem ser apertados dedos.
- Conecte-se ao distribuidor, uma bomba de vácuo capaz de estabelecer um vácuo de <1 mmHg. A exaustão da bomba de vácuo deve estar localizado dentro do exaustor de fumos, ou devidamente ventilado por outros meios.
- Para garantir a realização rápida de vácuo e para proteger a bomba, inserir uma armadilha entre o colector e a bomba de vácuo. Um azoto dedo-sifão é recomendada, uma vez que irá evitar voláteis, tais como NH 3, CO 2 e H 2 O de entrar na bomba. Cuidados devem ser tomados, como voláteis presos, após warming, pode sobrepressão no colector e resultar em ruptura de vidro.
- Conecte-se ao distribuidor, um manómetro ou outro indicador de vácuo capaz de uma resolução mmHg ou superior. Enquanto vários dispositivos podem ser usados, um manômetro de mercúrio, ou calibre MacLeod, é preferível que o mercúrio é bastante não reactivo.
- Meça e registre a temperatura ambiente usando um termômetro adequado.
2. Preparação do balão de reacção
- Aquecer todos os artigos de vidro a 500 ° C durante pelo menos 3 horas em ar antes da utilização, para remover os contaminantes orgânicos.
- Limpar os eléctrodos de tungsténio, lavando cuidadosamente com lenços de laboratório limpas e metanol, e secagem ao ar.
- Despeje a 200 ml de água ultrapura (18,2 mohms cm, <5 ppb TOC) para o balão de reacção 3 L.
- Introduzir uma barra de agitação magnética previamente limpas e esterilizadas, o que irá garantir a rápida dissolução de gases solúveis e mistura de reagentes durante o experiment.
- Anexar os eléctrodos de tungsténio para o balão de reacção 3 L usando uma quantidade mínima de gorduras de vácuo, com pontas separadas por cerca de 1 cm para dentro do frasco. Prenda com grampos.
- Inserir um adaptador com uma torneira embutida dentro do gargalo do balão de reacção 3 L e seguro, com um grampo.
- Prenda o balão de reacção 3 L para o colector de gás através do adaptador. Use um clipe ou grampo para ajudar a proteger o frasco.
- Unte levemente todas as conexões para garantir uma boa vedação de vácuo.
- Abra todas as válvulas e torneiras no colector, com exceção da válvula 6 e torneira 1 (Figura 4), e ligue a bomba de vácuo para evacuar o colector. Uma vez que uma leitura estável do vácuo <1 mmHg foi atingido, perto da válvula 1 e permitir que o colector de sentar-se para ~ 15 min para verificar se há vazamentos de vácuo. Se nenhum for detectado, vá para o passo 2.8. De outro modo a solucionar as diversas ligações até as fugas podem ser identificados e fixa.
- APPLY agitação magnética para o vaso de reacção. Abrir a válvula 1 e torneira 1 (Figura 4) para evacuar o espaço superior do frasco de reacção de 3 litros até a pressão atingir <1 mmHg.
- Fechar a válvula 1 (Figura 4), e monitorizar a pressão no interior do balão de reacção 3 L. A pressão medida deve aumentar a pressão de vapor de água. Para garantir que não existem vazamentos, espere ~ 5 min nesta fase. Se a pressão (lida no manômetro) aumenta enquanto válvula 1 está fechada durante esta etapa, verificar se há vazamentos na torneira 1 e as várias conexões balão de reacção. Se nenhum vazamento for encontrado, prossiga para a próxima etapa.
3. Introdução de gases NH 3
- Calcula-se a pressão necessária de NH3 gasoso para introduzir no tubo de distribuição de tal modo que 200 mmHg, de NH 3 irá ser introduzido no balão de reacção. Os detalhes sobre como fazer isso são fornecidos na seção Discussão.
- Feche as válvulas de1 e 6, e de uma torneira (Figura 4) antes da introdução de qualquer gás para o colector. Deixe as outras válvulas e torneiras abertas.
- Introduzir NH3 no colector até que uma pequena pressão (cerca de 10 mmHg) é atingido e, em seguida, retirar o tubo de distribuição a uma pressão de <1 mm Hg através da abertura de válvula 1 (Figura 4). Repita 3x.
- Introduzir NH3 no colector para atingir a pressão determinada no passo 3.1.
- Abrir torneira 1 (Figura 4) para introduzir a 200 mmHg de NH3 para o balão de reacção de 3 litros. O NH3 irá dissolver-se na água no recipiente de reacção e a pressão cai lentamente.
- Uma vez que a pressão pára quedas, perto torneira 1 (Figura 4) e registrar a pressão lida pelo manômetro. Este valor representa a pressão dentro do frasco, e será usada para calcular as pressões para outros gases que vão ser introduzidos no colector depois.
- Abrir a válvula 1 (Figura 4) para evacuar o colector para uma pressão de <1 mm Hg.
- Fechar a válvula de 2 (Figura 4) e desligue o cilindro de gás NH3 do colector.
4. Introdução de CH 4
- Calcula-se a pressão necessária de CH4 a ser introduzida no tubo de distribuição de tal modo que 200 mmHg de CH 4 vai ser introduzido no balão de reacção 3 L. Exemplo cálculos são mostrados na seção Discussão.
- Conecte o cilindro de gás CH4 para o colector.
- Abra todas as válvulas e as válvulas de bloqueio, com exceção de válvula 6 e torneira 1 (Figura 4), e retirar o tubo de distribuição a uma pressão de <1 mm Hg.
- Fechar a válvula 1 uma vez que o colector foi evacuado (Figura 4).
- Introduzir CH 4 para o colector até que uma pequena pressão (cerca de 10 mmHg) é obtido. Isso limpa a linha de quaisquer gases contaminantes from etapas anteriores. Abrir a válvula 1 (Figura 4) para evacuar o colector e <1 mmHg. Repita mais 2x.
- Introduzir CH 4 para o colector até que a pressão calculada na etapa 4.1, é alcançado.
- Abrir torneira 1 (Figura 4) para introduzir a 200 mmHg de CH 4 para o balão de reacção 3 L.
- Fechar torneira 1 uma vez que a pressão a que se destina o CH 4 foi introduzido no balão de reacção 3 L (Figura 4) e registar a pressão medida pelo manómetro.
- Abrir a válvula 1 (Figura 4) para evacuar o colector e <1 mmHg.
- Fechar a válvula de 2 (Figura 4) e desligue o CH 4 cilindros do colector.
5. Introdução de Mais Gases (eg N 2)
- Neste ponto, não é necessária a introdução de gases adicionais. No entanto, se desejado, é recomendável adicionar 100 mmHg de N2. Neste caso, calcula a necessária pressão de N2 para ser introduzida no tubo de distribuição de tal modo que 100 mmHg de N 2 vai ser introduzido no balão de reacção 3 L. Exemplo cálculos são mostrados na seção Discussão.
- Conecte o cilindro de gás N 2 para o colector.
- Abra todas as válvulas e as válvulas de bloqueio, com exceção de válvula 6 e torneira 1 (Figura 4), e retirar o tubo de distribuição a uma pressão de <1 mm Hg.
- Fechar a válvula 1 uma vez que o colector foi evacuado (Figura 4).
- Introduzir N 2 para o colector até que uma pequena pressão (cerca de 10 mmHg) é obtido. Abrir a válvula 1 (Figura 4) para evacuar o colector e <1 mmHg. Repita mais 2x.
- Introduzir N 2 para o colector até que a pressão no passo 5.1 calculada for atingido.
- Abrir torneira 1 (Figura 4) para introduzir a 100 mmHg de N2 para dentro do frasco de reacção.
- Fechar torneira 1 uma vez que a pressão pretendida de N 2 foi introduzido no balão de reacção, (Figura 4) e registar a pressão, utilizando o manómetro.
- Abrir a válvula 1 (Figura 4) para evacuar o colector e <1 mmHg.
- Fechar a válvula de 2 (Figura 4) e desligue o N 2 cilindros do colector.
6. Começando o Experimento
- Separe o balão de reacção a partir do colector por uma torneira de fechamento e da válvula 1 (Figura 4), uma vez que todos os gases tenham sido introduzidos no balão de reacção, de modo que o ar ambiente pode entrar no colector e trazer o colector para cima para a pressão ambiente.
- Depois de desligar cuidadosamente no balão de reacção do colector, coloque o frasco em algum lugar que não será perturbado (por exemplo, dentro de uma coifa vazio).
- Desligue a bomba de vácuo e retire cuidadosamente a câmara de frio e permitem a ventilação dentro de um totalmentecoifa operacional.
- Fixar a bobina de Tesla ligado ao gerador de alta frequência de faísca.
- Conecte o eletrodo de tungstênio oposto a um aterramento elétrico para permitir a passagem de corrente elétrica eficiente em toda a diferença entre os dois eletrodos.
- Ajustar a tensão de saída do gerador de faísca de aproximadamente 30.000 V, como detalhado por documentos disponíveis a partir do fabricante.
- Antes de se iniciar a ignição, fechar o caixilho coifa, para servir como uma blindagem de segurança entre o aparelho e o experimentador. Gire a bobina de Tesla para começar a experiência, e permitir que faíscas de continuar durante 2 semanas (ou outro período desejado) em 1 hora em ciclos / off.
7. Fim da Experiência
- Parar a experiência, desligando a bobina Tesla.
- Abrir torneira 1 (Figura 4) para introduzir lentamente o ar ambiente para dentro do balão de reacção e facilitar a remoção do adaptador e os eléctrodos de tungsténio assim samples pode ser coletado. Se desejado, um vácuo pode ser usada para evacuar o balão de reacção dos gases de reacção nocivos.
8. Coleta de amostra de líquido
- Usando uma pipeta de vidro pirolisado, retirar amostras de líquido a partir do balão de reacção, tendo o cuidado de minimizar a exposição aos contaminantes, tais como aqueles que podem ser introduzidas por pipeta para o tocar da graxa de vácuo ou outras superfícies não esterilizadas.
- Transferir a amostra para um plástico estéril ou recipiente de vidro. Os recipientes plásticos são menos propensas a rachar ou romper após congelação, em comparação com os recipientes de vidro.
- Recipientes de amostra Seal e armazenar em um freezer capaz de atingir temperaturas de -20 ° C ou menos, como produtos insolúveis podem impedir a solução da amostra de congelar a 0 ° C.
9. Limpar o aparelho
- Use laboratório limpo limpa para remover cuidadosamente graxa de vácuo do pescoço do aparelho, a adaptar-seer e torneira, eo vidro em torno dos eletrodos de tungstênio.
- Limpam-se as mesmas superfícies descritas no passo 9.1 com tolueno para remover completamente graxa de vácuo orgânica do vidro. Se usar graxa de silicone, a alta graxa de vácuo podem permanecer no vidro após a pirólise, criando problemas futuros, conforme detalhado na seção Discussão.
- Limpe bem o frasco de reação com uma escova e os seguintes solventes em ordem: água ultrapura (18,2 mohms cm, <5 ppb TOC), água ultrapura (18,2 mohms cm, <5 ppb TOC) com 5% de detergente de limpeza, metanol, tolueno, metanol, água ultrapura (18,2 mohms cm, <5 ppb TOC) com 5% de detergente de limpeza e água ultrapura, finalmente, (18,2 mohms cm, <5 ppb TOC).
- Cubra todos os orifícios abertos do balão de reacção com papel alumínio e embrulhe a placa e seus componentes em papel alumínio.
- Uma vez que todo o material de vidro foi envolto em folha de alumínio, pirolizar por pelo menos 3 horas emar a 500 ° C.
- Eletrodos Limpe suavemente com metanol e deixar secar naturalmente.
10. Análise da amostra
Nota: Quando a preparação de amostras para análise, o uso de um protocolo de hidrólise de ácido, tal como tem sido descrito em detalhe noutro local 15, é útil para a obtenção de mais aminoácidos. A hidrólise de uma porção da amostra recuperada proporciona a oportunidade de analisar os aminoácidos livres, bem como os seus precursores de ácido-lábeis que são sintetizados em condições abióticas.
- Para a análise de aminoácidos, usar uma técnica adequada (tal como a cromatografia líquida e métodos baseados em espectrometria de massa, ou outros métodos adequados). Tais técnicas analíticas incluem cromatografia líquida de alta eficiência com detecção de fluorescência (HPLC-FD) de 14, e cromatografia líquida de desempenho ultra elevado com detecção de fluorescência em paralelo com a espectrometria de massa com ionização por electrospray positiva de tempo-de-voo (UHPLC-FD/ToF-MS) 12,13. Este manuscrito descreve a análise por espectrometria de massa utilizando as análises através de um espectrômetro de massa triplo quadrupolo (QQQ-MS) em conjunto com HPLC-FD.
Resultados
Os produtos sintetizados nas experiências de descarga eléctrica pode ser bastante complexo, e existem vários métodos de análise que podem ser usados para estudar a eles. Algumas das técnicas mais vulgarmente utilizadas na literatura para a análise de aminoácidos são discutidos aqui. Os métodos de espectrometria de massa e cromatografia são técnicas altamente informativos para analisar as misturas químicas complexas produzidas por tipo de Miller-Urey experimentos de descarga de faísca. As análises de aminoácidos podem ser realizadas usando o -phthaldialdehyde/N-acetyl-L-cysteine (OPA / NAC) 16, um par reagente quiral que marca os grupos amino primários, obtendo-se derivados diastereoméricos fluorescentes que podem ser separados em uma fase estacionária quiral. Figura 2 mostra um cromatograma de um padrão de OPA / aminoácido NAC derivatizada obtido por HPLC acoplado a detecção de fluorescência e QQQ-MS. Os aminoácidos contidos no padrão incluem aqueles tipicamente produzido em Miller-Urey dis tipo de igniçãocobrar experimentos. As identidades destes aminoácidos são listados na Tabela 1. Vestígios de fluorescência representativos de uma amostra típica e analítica em branco são mostrados na Figura 3, que demonstra a complexidade molecular do tipo de Miller-Urey amostras de descarga eléctrica. O cromatograma da amostra na Figura 3, foi produzida a partir de uma experiência de descarga de faísca usando as seguintes condições: a partir de 300 mm Hg de CH 4, 250 mm Hg de NH3, e 250 ml de água.

Figura 2. A região de 3-21 min de cromatogramas HPLC-FD/QqQ-MS produzidos a partir da análise de um padrão de aminoácidos OPA / NAC-derivatizados. Identidades dos picos de aminoácidos são listados na Tabela 1. O rastreio da fluorescência é mostrado na parte inferior e as correspondentes mas extraídoss cromatogramas estão apresentados acima. A ionização por electrospray (ESI) QQQ-MS foi operado no modo positivo e monitorizado um intervalo de massas de 50-500 m / z. As configurações de ESI foram: gás dessolvatação (N2) temperatura: 350 ° C, de 650 L / h; tensão capilar: 3,8 kV; voltagem do cone: 30 V. Os picos não marcados em 367 o cromatograma iónico extraída são os 13 C 2 picos de 365 cromatograma de íon extraído, como resultado da abundância natural de 13 C. aproximadamente 1% Clique aqui para ver a imagem ampliada .
| Pico | Aminoácidos |
| 1 | Ácido D-aspártico |
| 2 | Ácido L-aspártico |
| 3 | Ácido L-glutâmico |
| 4 | Ácido D-glutâmico |
| 5 | D-serina |
| 6 | L-serina |
| 7 | Glycine |
| 8 | b-alanina |
| 9 | D-alanina |
| 10 | Ácido g-amino-n-butírico (L-ABA) |
| 11 | L-alanina |
| Db ácido-amino-n-butírico (Db-ABA) | |
| 13 | a-aminoisobutírico ácido (a-AIB) |
| 14 | Lb ácido-amino-n-butírico (Lb-ABA) |
| 15 | Ácido D / La-amino-n-butírico (D / La-ABA) |
| 16 | D-isovalina |
| 17 | L-isovalina |
| 18 | L-valina |
| 19 | ácido e-amino-n-capróico (AEAC) |
| 20 | D-valina |
| 21 | D-isoleucina |
| 22 | L-isoleucina |
| 23 | D / L-leucina |
Tabela 1. Identidades dos picos para os aminoácidos detectados no padrão e que são tipicamente produzidos no tipo de Miller-Urey experiências de descarga de faísca.

Figura 3. A min região do cromatograma de HPLC representativo de tipo DF-Miller-Urey experiências de descarga de faísca 3-21. Picos foram identificados e quantificados por tempo de retenção e a análise da massa dos compostos alvo em comparação com um padrão vazio e analítica. Todos alvo ana eletrólitos, com tempos de retenção de coeluting fluorescência pode ser separada e quantificada usando espectrometria de massa, excepto para α-AIB e L-β-ABA (picos 13 e 14), e D / L-norleucina, que coelutes com D / L-leucina (pico 23), sob as condições cromatográficas utilizadas. D / L-norleucina foi adicionado como um padrão interno para amostras e brancos analíticos durante a preparação da amostra. Separação de aminoácidos foi realizada utilizando uma 4,6 mm x 250 mm, tamanho de partícula 5 mM coluna de fenil-hexilo de HPLC. A fase móvel foi composta por: A) de água ultra-pura (18,2 mohms cm, <5 ppb TOC), B) de metanol, e C) de formato de amónio 50 mM, com 8% de metanol, a pH 8. O gradiente utilizado foi: 0-5 min, 100% de C; 5-15 min, 0-83% de A, 0-12% de B, 100-5% C; 15-22 min, 83-75% de A, 12 - 20% de B, 5% de C, 22-35 min, 75-35% de A, 20-60% de B, 5% de C, 35-37 min, 35-0% de A, 60-100% de B, 5-0% C; 37-45 min, 100% de B; 45-46 min, 100-0% de B, 0-100% de C, 46-55 min, 100% C. A taxa de fluxo foi de 1 ml / min.hres.jpg "target =" _blank "> Clique aqui para ver imagem ampliada.
Discussão
Várias etapas do protocolo descrito aqui são fundamentais para a realização de experiências de tipo de Miller-Urey forma segura e correta. Em primeiro lugar, todas as ferramentas de manipulação de amostras de vidro e que vai entrar em contacto com o balão de reacção ou de amostra devem ser esterilizados. A esterilização é conseguido através de uma profunda enxaguamento dos artigos em questão com água ultrapura (18,2 mohms cm, <5 ppb COT) e, em seguida, embrulhando-os em folha de alumínio, antes de pirólise de 500 ° C ao ar durante pelo menos 3 horas. Uma vez que o equipamento foi pyrolyzed e durante a preparação de amostras para análise, deve-se tomar cuidado para evitar a contaminação orgânica. O risco de contaminação pode ser minimizada através do uso de luvas de borracha nitrílica, um casaco de laboratório e óculos de proteção. Certifique-se de trabalhar com amostras de distância de seu corpo como fontes comuns de contaminação incluem impressões digitais, pele, cabelo e ar exalado. Evite o contato com luvas molhadas e não use qualquer látex ou materiais de nylon. Segundo desgaseificação, completa de tele balão de reacção, antes da adição de gás para dentro do balão de reacção é crítica. A presença de mesmo pequenas quantidades de oxigénio molecular no balão de reacção apresenta um risco de explosão quando a faísca é descarregado em gases inflamáveis, tais como o CH4. Enquanto desgaseificação do balão, a água no interior do frasco irá ferver, o que irá impedir uma leitura estável. Nesta fase, há duas opções: 1) Degas do frasco através de ciclos de congelamento e descongelamento (normalmente 3 são usados), ou 2) simplesmente Degas a solução líquida. Neste último caso, um pouco de água vai ser perdida, no entanto, a quantidade será relativamente pequena em comparação com o volume remanescente. Em terceiro lugar, uma instalação bem-equipada e eficiente deve ser cuidadosamente construída para estabelecer uma faísca consistente através dos eletrodos ao longo de toda a experiência. Bobinas BD-50E Tesla não são projetados para operação prolongada, uma vez que se destinam a detecção de vazamento de vácuo. Resfriamento intermitente da bobina de Tesla é, portanto, recomendada para a vida operacional prolongada. There várias maneiras de conseguir isso. Uma maneira simples é unir um temporizador em linha entre o testador de ignição e sua fonte de alimentação e programar o temporizador de tal forma que se alterna em 1 hora em ciclos / off. O arrefecimento da bobina de Tesla com um ventilador comercial pode também ser necessário para prolongar a vida útil da bobina de Tesla. A ponta bobina de Tesla deve estar tocando ou quase tocando um dos eléctrodos de tungsténio; uma distância entre os dois de aproximadamente 1 mm ou menos. Além disso, uma descarga intensa pode ser conseguido usando um pedaço de fio de metal condutor com uma ansa em uma extremidade cobertas levemente sobre o eléctrodo oposto o que toca a bobina de Tesla para evitar quebrar o selo para o conteúdo. Recomenda-se também ter um segundo gerador de faísca disponível no caso de o gerador de faíscas primário falhar devido ao uso prolongado.
Há muitas notas adicionais vale a pena manter em mente quando a realização de várias etapas do protocolo descrito aqui. Ao preparar o sistema para um colectorn experimentar e utilizar um manômetro de mercúrio, é geralmente admitido que uma precisão de 1 mmHg é a melhor possível, devido à resolução do olho humano. Alguns gases podem apresentar problemas de condutividade com calibres à base de resistência. Manômetros de mercúrio apresentam riscos potenciais de derramamento, que devem ser preparadas com antecedência.
Durante a montagem do balão de reacção 3 L, o uso de silício graxa de vácuo pode mitigar a contaminação biológica potencial, mas deve ser tomado cuidado para remover esta completamente entre corridas. Se não o fizer, irá resultar na acumulação de depósitos de sílica durante a pirólise de elevada temperatura, o que pode interferir com vedações de vácuo. Além disso, os eléctrodos de tungsténio estão disponíveis comercialmente como 2% de tungsténio thoriated e deve ser recozido em meia-volta acessórios de vidro moído. Não pirolizar os eléctrodos de tungsténio equipado de vidro em um forno. Os coeficientes de expansão térmica do vidro e de tungsténio são diferentes e aqng acima de 100 ° C, pode enfraquecer a vedação em torno dos eléctrodos de vidro recozido e apresentar fugas no sistema. Além disso, a água ultra pura pode ser introduzido no balão de reacção 3 L por vazamento, tomando cuidado para evitar o contacto com qualquer lubrificante na porta usada, ou por pipetagem, utilizando uma pipeta de vidro prepyrolyzed. A fase aquosa no recipiente de reacção pode ser tamponada, se desejado. Por exemplo, Miller e colegas 9 tamponada a solução para pH ~ 8,7 com um tampão de 4 Cl NH 3 / NH. Para isso a fase aquosa é tornada 0,05 M em NH4Cl antes de introduzi-lo no balão de reacção. NH4Cl de 99,5% de pureza, ou superior, deve ser utilizado. O restante do NH3 é então adicionado ao balão de reacção, como um gás.
Em preparação para a introdução de gás dentro do balão de reacção 3 L, o balão pode ser fixado ao colector, colocando o frasco num anel de cortiça, situado no topo de um conector de laboratório e levantando suavemente o conjunto do frasco até umaconexão confortável é alcançado. Ao verificar a existência de vazamentos, é importante notar que as fontes prováveis de vazamentos incluem selos pobres nas junções das articulações semi-redonda em vidro fosco, que ligam os eletrodos de tungstênio para o balão de reacção, ea torneira do adaptador ligado ao pescoço de o balão de reacção 3 L. Se forem detectadas fugas a partir destas fontes, remova cuidadosamente o balão de reacção 3 L do colector, limpe estas áreas com tecido laboratório limpo, reaplicar uma nova camada de graxa de vácuo e recolocar o balão ao colector para localizar vazamentos. Se não existem fugas são encontrados, proceder à introdução de gases, no interior do balão de reacção.
Embora a introdução de gases dentro do aparelho, cilindros de gás devem ser solidamente fixados a um suporte. Cuidados devem ser tomados para introduzir gases lentamente. Válvulas de cilindros de gás devem ser abertas lentamente e com cuidado, enquanto monitora o manômetro para evitar o excesso de pressão sobre o vidro e de acessórios. É importante notar that, enquanto a adição de NH3 para o balão de reacção, porque NH3 é apreciavelmente solúvel em água abaixo do pKa de NH 4 + (~ 9,2), essencialmente todo o gás NH3 introduzida no colector irá dissolver-se na fase aquosa, tornando a pressão final no frasco e colector como a pressão de vapor de água à temperatura ambiente. Uma vez que esta pressão é atingido, pode-se supor a transferência for concluída. A seguir estão exemplos dos cálculos que devem ser executados para introduzir gases precisamente para o balão de reacção às suas pressões desejadas:
Introdução de gases NH 3
Devido à solubilidade do NH3, essencialmente todo ele irá transferir a partir do colector para o recipiente de reacção e dissolve-se na fase aquosa enquanto o NH3 no colector está a uma pressão superior à pressão de vapor de água na reacçãogarrafa. Portanto, a temperatura ambiente, devem ser anotados e a pressão de vapor de água a essa temperatura deve ser referenciado, antes da introdução de NH3 no colector. A pressão alvo de NH 3 a ser introduzida no balão de reacção deve ser igual à pressão do alvo de NH3 no balão de reacção 3 L, mais a pressão do vapor de água no balão de reacção, a temperatura ambiente registada. Por exemplo, a 25 ° C, a pressão de vapor de água é de aproximadamente 24 mm Hg. Assim, a fim de introduzir a 200 mmHg de NH3 para o balão de reacção, a cerca de 225 mmHg carga de NH 3 no colector antes da transferência de NH 3 a partir do colector e para dentro do balão de reacção. Isto irá resultar em cerca de 200 mm Hg de NH 3 a ser introduzidos no balão de reacção.
Introdução de CH 4
Depois de NH3 adição e sua dissolução em poe fase aquosa, a pressão no espaço de topo do balão de reacção será igual à pressão de vapor de água a 25 ° C, aproximadamente, 24 mmHg. Este valor irá ser utilizado, em conjunto com o exemplo de colector mostrado na Figura 4, para levar a cabo um cálculo para a quantidade de CH4 a introduzir no tubo de distribuição de tal modo que 200 mmHg de CH 4 vai ser introduzido no balão de reacção:
P 1 = pressão total desejado ao longo de todo o sistema, incluindo o recipiente de reacção
V 1 = o volume total de todo o sistema, incluindo o recipiente de reacção
P 2 = CH pressão de 4 necessária para preencher o volume do colector antes da introdução no balão de reacção
V 2 = o volume de colector usado para a introdução de gás
P 3 = pressão já no espaço de topo do balão de reacção
V 3 = volume do balão de reacção
P 1 = 200 mmHg de CH 4 + 24 mmHg de H 2 O = 224 mmHg
V 1 = 3000 ml + 100 ml + 300 ml + 40 ml + 20 ml + 3.000 ml + 40 ml + 500 ml = 7000 ml
P 2 = pressão de CH 4 sendo calculada
V 2 = 100 ml + 300 ml + 40 + 20 + 3000 ml + 40 ml + 500 ml = 4000 ml
P 3 = 24 mmHg de H2O
V 3 = 3000 ml

Introdução de N2
Após a introdução de CH 4, o espaço de topo do balão de reacção é ocupado por 200 mm Hg de CH 4 e 24 mmHg de H 2 O para um total de 224 mm Hg. Este valor irá ser utilizado, juntamente com as dimensões do exemplo de colector mostrado na Figura 4, para calcular tele N2 pressão que tem de ser introduzida no tubo de distribuição de tal modo que 100 mmHg de N 2 vai ser introduzido no balão de reacção:
P 1 = pressão total desejado ao longo de todo o sistema, incluindo o recipiente de reacção
V 1 = o volume total de todo o sistema, incluindo o recipiente de reacção
P 2 = pressão de N2 necessária para preencher o volume do colector antes da introdução no balão de reacção
V 2 = o volume de colector usado para a introdução de gás
P 3 = pressão já no espaço de topo do balão de reacção
V 3 = volume do balão de reacção
P 1 = 24 mmHg de H 2 O + 200 mmHg de CH 4 + 100 mmHg de N 2 = 324 mmHg
V 1 = 3000 ml + 100 ml> + 300 ml + 40 ml + 20 ml + 3,000 ml + 40 ml + 500 ml = 7000 ml
P 2 = pressão de N2 a ser calculado
V 2 = 100 ml + 300 ml + 40 ml + 20 ml + 3,000 ml + 40 ml + 500 ml = 4000 ml
P 3 = 200 mmHg de CH 4 + 24 mmHg de H2O = 224 mm Hg
V 3 = 3000 ml

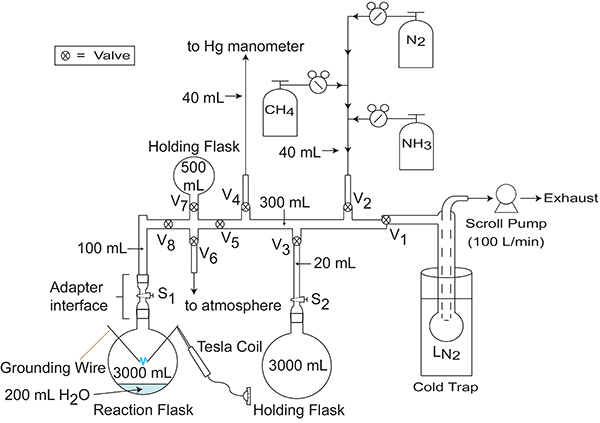
Figura 4. . Manifold / sistema de vácuo usado para introduzir gases para a 3 L balão de reacção Válvulas controlar o fluxo de gás são rotulados como V 1 - V 8, enquanto torneiras que controlam o fluxo de gás são rotulados como S 1 e S 2. É interessante notar que, enquanto válvulas 1, 2 e 6, e Torneira 1 são referidos explicitly no protocolo, as outras válvulas e torneiras no colector mostrado aqui são úteis para a adição ou remoção de volume (isto é, segurando frascos) de ou para o colector. Por exemplo, quando a introdução de gases no colector a pressões relativamente elevadas (cerca de 500 mmHg ou mais), é aconselhável que o pesquisador faz uso de todos os frascos de purga ligados ao colector para aumentar o volume acessível do colector e ajudar a minimizar o risco de excesso de pressão sobre o coletor.
Depois de iniciar o experimento, o sistema deve ser verificado com regularidade para garantir a experiência está sendo executado corretamente. O que verificar incluem: 1) o gerador de faíscas é produzir uma faísca, e 2) a ignição está a ser gerado através dos eléctrodos de tungsténio de um modo contínuo. Se as condições acima não forem atendidas, desconecte a bobina de Tesla de sua fonte de alimentação e substituí-la com a bobina de Tesla backup. Enquanto isso, reparos na bobina de Tesla de mau funcionamento pode ser feita.Muitas vezes, as placas de contacto no interior do encaixe do gerador de faísca pode tornar-se corroída de uso prolongado e deve ser polida, ou substituído.
Após a conclusão do experimento, os gases no espaço-cabeça pode ser irritante para o sistema respiratório. Gases nocivos, tais como o cianeto de hidrogénio 4 pode ser produzido pela experiência. Se o experimentador não é a recolha de amostras para a análise de gás, pode ser útil para ligar o aparelho a um aspirador de água para evacuar os voláteis para aproximadamente uma hora após a conclusão da experiência, ao passo que o aparelho permanece no exaustor de fumos, antes da recolha de amostras de líquidos . Por razões de segurança, é aconselhável que o aparelho é ventilado em um exaustor totalmente operacional. Coleta de amostras deve ser realizada em uma coifa operacional e manipulação da amostra em um HEPA de pressão positiva filtrada banco de fluxo é recomendado.
Entre os vários tipos de produtos formados pela descarga centelha exexperimentos, os aminoácidos são de significado. Os aminoácidos estão prontamente sintetizados por meio de síntese de Strecker 17. A síntese de Strecker de aminoácidos envolve a reacção de aldeídos ou cetonas e HCN geradas pela acção de descarga eléctrica nos gases introduzidos no aparelho de reacção, que, após dissolução na fase aquosa, pode reagir com amoníaco para formar α-aminonitrilos que se submetem hidrólise para produzir aminoácidos. Isto é, é claro, mas um mecanismo de síntese, e outros podem também ser operativo, tal como aminação directa de precursores incluindo acrilonitrilo para dar precursores β-alanina, ou a hidrólise directa de material tholin-como o peso molecular mais elevado, para dar directamente aminoácidos , contornando o mecanismo de Strecker.
Contaminação de aminoácidos das amostras produzidas por experimentos de Miller-Urey pode ocorrer se as precauções mencionados anteriormente não são seguidas explicitamente. Durante a análise da amostra, que é importante para search para sinais de contaminação terrestre que pode ter se originado a partir de manipulação da amostra ou o armazenamento da amostra. O uso de OPA / NAC 16 em conjunção com as técnicas de LC-FD permite a separação cromatográfica de D-e L-enantiómeros de aminoácidos com centros quirais e respectiva, quantificação individual. Aminoácidos quirais sintetizados pelo experimento deve ser racêmica. Erro experimental aceitável durante a síntese de aminoácidos, com centros quirais é geralmente considerado como sendo de aproximadamente 10%. Portanto rácios aminoácido D / L quirais sugestivos de enriquecimento em um enantiómero por mais do que 10% é uma boa medida pela qual para determinar se a amostra está contaminada.
Os métodos aqui apresentados se destinam a instruir como conduzir um experimento de descarga centelha tipo Miller-Urey, no entanto, existem limitações com a técnica descrita aqui que deve ser observado. Em primeiro lugar, aquecendo o balão de 3 L de reacção única (Figura 1B), Irá resultar na condensação do vapor de água sobre as pontas dos eléctrodos, amortecendo a faísca, e reduzir a geração de espécies de radicais que conduzem a maior parte da química que ocorre dentro do experimento. Além disso, o uso de uma manta de aquecimento para aquecer o aparelho não é necessário para a síntese de compostos orgânicos, tais como ácidos aminados. Isto difere da experiência original de Miller, onde utilizado um mais complexo, construído por encomenda, aparelho de frasco duplo (Figura 1A) 5 e aquecido o pequeno frasco na parte inferior do aparelho, que tinha água (Figura 1A). O aquecimento do aparelho ajudou com a circulação das matérias-primas e teve como objetivo imitar a evaporação em um sistema Terra primitiva. Em segundo lugar, o protocolo detalhado aqui recomenda uma 1 hora em ciclo / desligar quando utilizando a bobina de Tesla, que duplica efectivamente a quantidade de tempo que uma experiência leva a concluir, em comparação com as experiências conduzidas por Miller, enquanto continuamente descarregado elementoCTricity no sistema 4. Em terceiro lugar, como geradores de ignição não são destinados para uso a longo prazo, eles são propensos a mau funcionamento durante o uso prolongado e deve ser mantido regularmente e, às vezes substituído por uma unidade de back-up, se o gerador de faísca primário falhar durante o curso de um experimento. Por fim, o protocolo aqui descrito envolve a utilização de válvulas de bloqueio de vidro, que requerem alta graxa de vácuo para fazer vedações adequadas. Se desejado, politetrafluoretileno (PTFE) torneiras podem ser utilizados para evitar a graxa vácuo. No entanto, se examinar essas torneiras para possíveis vazamentos com um detector de vazamento de faísca, tenha cuidado para não expor demais o PTFE para a faísca, pois isso pode comprometer a integridade do PTFE e levar a selos pobres que estão sendo feitas por essas torneiras.
O significado do método relatado no que diz respeito às técnicas existentes, encontra-se dentro da sua simplicidade. Ele usa um disponível comercialmente balão de 3 L, o qual também é consideravelmente menos frágeis e mais fácil de cleum entre os experimentos do que o projeto original usado por Miller 5. Como o aparelho é menos pesado, é pequeno o suficiente para levar a cabo um experimento dentro de um exaustor.
Uma vez que a técnica descrita aqui tem sido dominada, ele pode ser modificado numa variedade de formas para simular vários tipos de ambientes terrestres primitivas. Por exemplo, as misturas de gases mais oxidados podem ser utilizados 14,18,19. Além disso, utilizando modificações do aparelho, a fonte de energia pode ser alterado, por exemplo, utilizando uma descarga silenciosa 4, luz ultravioleta 20, simulando sistemas vulcânicos 4,12,21, imitando radioactividade a partir da crosta terrestre 22, e imitando a energia produzida pela ondas de choque de impactos meteoritos 23, e também a radiação cósmica 18,19.
O clássico experimento de Miller-Urey demonstraram que os aminoácidos, os blocos de construção importantes de proteínas biológicas, pode ser sinsintetizada utilizando materiais de partida simples, sob condições pré-bióticas terrestres simulados. A excitação de moléculas gasosas por descarga eléctrica leva à produção de compostos orgânicos, incluindo aminoácidos, sob tais condições. Enquanto os aminoácidos são importantes para a biologia contemporânea, o experimento de Miller-Urey só fornece um mecanismo possível para a sua síntese abiótica, e não explica a origem da vida, como os processos que dão origem a organismos vivos eram provavelmente mais complexa do que a formação de moléculas orgânicas simples.
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi financiado conjuntamente pela NSF e do Programa de Astrobiologia da NASA, com o Centro de NSF para Evolução Química, CHE-1004570, e do Centro Goddard de Astrobiologia. ETP gostaria de reconhecer o financiamento adicional fornecido pelo Programa de Biologia Estágio NASA Planetário. Os autores também quero agradecer a Dr. Asiri Galhena ajuda inestimável na criação de instalações laboratoriais iniciais.
Materiais
| Name | Company | Catalog Number | Comments |
| Glass Plugs for Manifold | Chemglass | CG-983-01 | |
| High Vacuum Grease | Apiezon | N/A | Type M/N |
| Silicon High Vacuum Grease | Dow Corning | 1597418 | |
| Teflon PFA Tubing | McMaster-Carr | 51805K54 | |
| Ultra-Torr Vacuum Fittings | Swagelok | SS-4-UT-6 | |
| Dry Scroll Vacuum Pump | Edwards | A72401905 | |
| U-Tube Manometer | Alta-Robbins | 100SS | |
| Tungsten Electrodes | Diamond Ground Products | TH2-1/16 | 2% thoriated |
| Methanol | Alfa Aesar | N/A | Ultrapure HPLC Grade |
| Teflon-Coated Magnetic Stir Bar | McMaster-Carr | 5678K127 | |
| Gaseous NH3 | Airgas | AMAHLB | 99.99% purity |
| Gaseous CH4 | Airgas | ME UHP300 | 99.99% purity |
| Gaseous N2 | Airgas | NI UHP300 | 99.999% purity |
| Tesla Coil | Electro-Technic Products | 15001 | Model BD-50E |
| 24 hr Plug-in Basic Timer | General Electric Company | 15119 | |
| Cleaning Detergent | Alconox | 1104 | |
| Toluene | Thermo Fisher Scientific | N/A | Optima Grade |
| Luna Phenyl-Hexyl HPLC Column | Phenomenex | 00G-4257-E0 | Brand: Luna |
| Formic Acid | Sigma-Alrich | F0507 | Used to make 50 mM ammonium formate |
Referências
- Oparin, A. I. The Origin of Life. , Izd. Moskovshii Rabochii. (1924).
- Haldane, J. B. The origin of life. Rationalist Annu. 148, 3-10 (1929).
- Garrison, W. M., Morrison, D. C., Hamilton, J. G., Benson, A. A., Calvin, M. Reduction of Carbon Dioxide in Aqueous Solutions by Ionizing Radiation. Science. 114, 416-418 (1951).
- Miller, S. L. Production of Some Organic Compounds under Possible Primitive Earth Conditions. J. Am. Chem. Soc. 77, 2351-2361 (1955).
- Miller, S. L. A Production of Amino Acids Under Possible Primitive Earth Conditions. Science. 117, 528-529 (1953).
- Heyns, H. K., Walter, W., Meyer, E. Model experiments on the formation of organic compounds in the atmosphere of simple gases by electrical discharges (Translated from German). Die Naturwissenschaften. 44, 385-389 (1957).
- Ponnamperuma, C., Woeller, F. α-Aminonitriles formed by an electric discharge through a mixture of anhydrous methane and ammonia. Biosystems. 1, 156-158 (1967).
- Oró, J. Synthesis of Organic Compounds by Electric Discharges. Nature. 197, 862-867 (1963).
- Ring, D., Wolman, Y., Friedmann, N., Miller, S. L. Prebiotic Synthesis of Hydrophobic and Protein Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 765-768 (1972).
- Wolman, Y., Haverland, W. J., Miller, S. L. Nonprotein Amino Acids from Spark Discharges and Their Comparison with the Murchison Meteorite Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 809-811 (1972).
- Roscoe, S., Miller, S. L. Energy Yields for Hydrogen Cyanide and Formaldehyde Syntheses: The HCN and Amino Acid Concentrations in the Primitive Ocean. Orig. Life. 17, 261-273 (1987).
- Johnson, A. P., et al. The Miller Volcanic Spark Discharge Experiment. Science. 322, 404 (2008).
- Parker, E. T., et al. Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment. Proc. Natl. Acad. Sci. U.S.A. 108, 5526-5531 (2011).
- Cleaves, H. J., Chalmers, J. H., Lazcano, A., Miller, S. L., Bada, J. L. A reassessment of prebiotic organic synthesis in neutral planetary atmospheres. Orig. Life Evol. Biosph. 38, 105-115 (2008).
- Glavin, D. P., et al. Amino acid analyses of Antarctic CM2 meteorites using liquid chromatography-time of flight-mass spectrometry. Meteorit. Planet. Sci. 41, 889-902 (2006).
- Zhao, M., Bada, J. L. Determination of α-dialkylamino acids and their enantiomers in geologic samples by high-performance liquid chromatography after a derivatization with a chiral adduct of o-phthaldialdehyde. J. Chromatogr. A. 690, 55-63 (1995).
- Strecker, A. About the artificial formation of lactic acid and a new Glycocoll the homologous body Justus Liebigs Annalen der Chemie. 75, 27-45 (1850).
- Miyakawa, S., Yamanashi, H., Kobayashi, K., Cleaves, H. J., Miller, S. L. Prebiotic synthesis from CO atmospheres: implications for the origins of life. Proc. Natl. Acad. Sci. U.S.A. 99, 14628-14631 (2002).
- Kobayashi, K., Kaneko, T., Saito, T., Oshima, T. Amino Acid Formation in Gas Mixtures by Particle Irradiation. Orig. Life Evol. Biosph. 28, 155-165 (1998).
- Sagan, C., Khare, B. N. Long-Wavelength Ultraviolet Photoproduction of Amino Acids on the Primitive Earth. Science. 173, 417-420 (1971).
- Harada, K., Fox, S. W. Thermal Synthesis of Natural Amino-Acids from a Postulated Primitive Terrestrial Atmosphere. Nature. 201, 335-336 (1964).
- Ponnamperuma, C., Lemmon, R. M., Mariner, R., Calvin, M. Formation of Adenine by Electron Irradiation of Methane Ammonia, and Water. Proc. Natl. Acad. Sci. USA. 49, 737-740 (1963).
- Bar-Nun, A., Bar-Nun, N., Bauer, S. H., Sagan, C. Shock Synthesis of Amino Acids in Simulated Primitive Environments. Science. 168, 470-473 (1970).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados