Method Article
Gravações patch clamp em células ciliadas da orelha interna Isolado de Zebrafish
Neste Artigo
Resumo
O objectivo deste vídeo é demonstrar os procedimentos para a obtenção de células ciliadas saudáveis, intactas a partir dos órgãos do ouvido interno de peixes-zebra adultos e, em seguida, utilizando-os para os estudos de patch clamp para caracterização das propriedades biofísicas dos seus canais dependentes da voltagem.
Resumo
Patch clamp análises dos canais dependentes da voltagem nas células pilosas sensitivas isoladas a partir de uma variedade de espécies foram descritas anteriormente, mas este vídeo 1-4 representa a primeira aplicação de tais técnicas às células ciliadas do peixe-zebra. Aqui demonstramos um método para isolar saudáveis, células ciliadas intactas a partir de todos os ouvido interno finais órgãos: sáculo, lagena, utrículo e canais semicirculares. Além disso, demonstramos a diversidade no tamanho e morfologia das células do cabelo e dar um exemplo dos tipos de gravações de patch clamp que podem ser obtidos. A vantagem da utilização deste sistema modelo zebrafish sobre os outros deriva da disponibilidade de peixe-zebra mutantes que afectam tanto a audição e equilíbrio. Em combinação com a utilização de linhas transgénicas e outras técnicas que utilizam a análise e manipulação genética, o isolamento de células e métodos electrofisiológicos introduzida aqui deve facilitar uma maior compreensão dos papéis células ciliadas pestava na mediação dessas modalidades sensoriais.
Protocolo
1. Pré-experimentais Preparações
- Preparar seis soluções (ver Tabela 1 para as composições): (a) 100 ml NZR (normal zebrafish Ringer), (b) 50 ml NZR + tricaina (MS222), (c) 10 ml NZR + BSA, (d) 100 Locas ml (baixo Ca 2 + solução), (e) 10 ml Locas + papaína, (f) de 100 ml de K +-solução interna. Soluções (a), (b), (d) e (f) pode ser armazenado durante até um mês a 4 ° C. Soluções de (c) e (e) deve ser preparado no dia da experimentação. Todas as soluções devem estar à temperatura ambiente, antes de começar as experiências.
- Etiqueta e encher quatro 35 pratos de Petri milímetros aproximadamente metade com as soluções (a), (c), (d) e (e).
- Fazer um prato de dissecação, preenchendo uma placa de Petri 60 milímetros com Sylgard (Dow Corning, Midland, MI) e, em seguida, o corte de uma cavidade dentro dela que permitirá que um peixe se sentar direito sem cair.
- Preparar pelo menos duas ferramentas de isolamento de células no final do folículo de colagem de um cabelo cão ao fim de um vidroPipeta de Pasteur com supercola, permitindo que o cabelo se estende para além da extremidade da pipeta por aproximadamente 0,5 cm. Os cabelos de soft-peludos cães como o Labrador Retriever e Weimaraners funcionar bem.
2. Isolamento de auditivos e labirinto vestibular
- Sacrificar um peixe-zebra adulto por imersão em um copo contendo NZR + tricaina. Monitorar visualmente as guelras até que todos os movimentos operculares cessaram. Esperar mais dez minutos antes de retirar os peixes e enxaguar com NZR fresco. Estes procedimentos foram aprovados pelo Institutional Animal Care e Use Committee (IACUC) da Universidade Pepperdine, mas a aprovação deve ser obtido a partir de sua própria instituição.
- Pin do peixe para o prato de dissecação lado dorsal para cima através da inserção de um pino de costura padrão linear (cerca de 2,5 cm de comprimento) através de cada cavidade ocular e um terceiro pino que passa pelo eixo dorsal-ventral cerca de um terço a metade da distância da cabeça a cauda, como ilustrado naFigura 1A.
- Sob um zoom (0,62-5x) estereomicroscópio equipado com estéreo oculares 10x, utilize uma tesoura fina de mola (número de catálogo da Ciência Ferramentas 15000-02) para expor o cérebro e um segmento curto da medula espinhal, removendo da calota craniana a partir de um ponto aproximadamente 0,5 centímetros caudal ao nível das guelras para a frente para o nariz do peixe. Cortar a medula espinhal e levantar o cérebro com uma pinça fina (Fina Ciência número de catálogo Ferramentas 11251-30) ao cortar os nervos espinhais e outros anexos; remover o cérebro e descartar (Figura 1B).
- A metade ventral da cápsula crânio que permanece forma uma "tigela" que contém os órgãos do ouvido interno. Observe as proeminentes, branco, otólitos opaco no lagenas e sáculos localizados simetricamente na extremidade caudal de cada orelha interna e otólitos utrículo lateralmente posicionados mais rostralmente (Figuras 1C e 4A).
- Remover o copo de osso, cortando todos attachmen ventral e lateralts enquanto suavemente levantando-a da cabeça com uma pinça fina. Colocá-lo na placa de Petri contendo Locas (Figuras 1D e 4B).
- O uso de dois pares de pinças finas, rachar além da tigela na sua linha média ou por agarrar as bordas laterais do osso e separá-las ou, em alternativa, separando as metades direita e esquerda, inserindo os pontos de pinça no centro e erguer as metades separados. Remover os dois labirintos do osso utilizando uma pinça fina (Figura 2).
- Inspecione os labirintos para identificar o auditivo e vestibular finais órgãos: os canais semicirculares, utrículos, sáculos e lagenas (Figura 4C). As áreas rosadas sob cada otólitos são as manchas que contém as células ciliadas. Do mesmo modo, uma tira de cor de rosa no interior do ampolas dos canais semicirculares identifica a cúpula, onde as células ciliadas estão localizados.
- Remova cuidadosamente os otólitos do utrículo lagena e usando a pinça fina ( Figuras 2 e 4C). Não é necessário remover o otolítica do sáculo pois isso pode danificar as células ciliadas saculares.
3. Isolamento de células ciliadas
- Utilizando uma pipeta de transferência de plástico (Fisher Scientific número de catálogo 13-711, 09:00), mover os órgãos terminais da placa contendo Locas + papaína minimizando o volume de líquido transferido.
- Incubar estas estruturas nesta solução durante 30 minutos à temperatura ambiente.
- No final do período de incubação, as estruturas para mover o prato contendo NZR + BSA e incubar nesta solução durante pelo menos trinta minutos. Células ciliadas permanecerá saudável nesta solução durante até quatro horas, mas irá deteriorar-se depois de 1-2 horas após o isolamento (ver passos seguintes).
- Em preparação para o isolamento de células, mover um dos órgãos finais para o prato contendo NZR.
- Para os lagenas e utrículos, use um fio de cabelo cão a levantar delicadamente os lençóis máculas de ti-epitelial rosadassue que contêm as células ciliadas (Figura 3A). O máculas pode ser esvaziado (usando um pêlo de cão) sob os otólitos do sáculos, e cúpulas de seus locais dentro do ampolas dos canais semicirculares.
- Utilizando duas ferramentas de células de isolamento elaboradas no passo 1.4, tritura-se uma mácula ou cúpula para gerar um campo que contém os restos de células ciliadas (Figura 3B). Permitir que as células, pelo menos, cinco minutos para se instalar no fundo do prato antes de movê-lo.
- Relocalizar o prato para a fase de um microscópio invertido equipado com óptica de contraste de fase. Observar células em aumento de 40 vezes e observe a diversidade na morfologia. Muitas células são abacate em forma, enquanto outros são longos e finos. A presença de feixes capilares apicais identifica-as como células ciliadas e fase-brilho assegura a sua saúde. Fotomicrografias de células ciliadas isolados são mostrados na Figura 5.
4. Patch clamping células ciliadas Zebrafish
- Em preparação para perforemendo nominal gravações 5,6, contendo anfotericina preparar solução interna como se segue: 5 mg lugar anfotericina B (Sigma A4888) para um tubo de microcentrífuga de 1,5 ml e encher com 100 uL de DMSO. Imediatamente vortex esta solução durante 10-20 segundos até que toda a anfotericina é dissolvido. Em seguida, pipeta K 625 ul + solução interna para um tubo de microcentrífuga de segundo. Adicionar 10 ul da solução de anfotericina ao K +-interno e solução de vórtice como acima. A solução de anfotericina estoque vai durar várias horas, mas descartar a solução final, após uma hora.
- Fabricar pipetas de patch BF 150-86-10 vidro borosilicato (Sutter Instruments), utilizando um extrator de multi-estágio (Sutter P-1000). Pipetas de ponta deve ter diâmetros de cerca de 2 micrómetros e têm resistências de 1-3 MQ, com as soluções da Tabela 1. As definições sobre o extrator que funcionam bem são os seguintes: Calor = Rampa minus10, Pull = 0 Velocidade, = 18 Delay, Pressão = 1, = 600. A forma daa ponta de uma pipeta de bom é evidente a partir da fotografia no c inserção da Figura 5. Blunt "em forma de bala" pipetas são preferidas como eles oferecem a menor resistência acesso durante gravações eletrofisiológicas.
- Use uma agulha de seringa de calibre 28 Microfil (MF28G-5; Instrumentos de Precisão Mundo) para preencher um eletrodo de registro até a metade com o K + anfotericina contendo interna solução.
- Apor a eletrodo para o andar de entrada de um amplificador de patch clamp. Aplicar -10 mV, 10 degraus de tensão ms a 10 Hz e manter uma pressão positiva no eléctrodo em que é manobrado por meio da interface ar / solução e para baixo para o fundo do prato de gravação junto das células.
- Posicione o eletrodo ortogonalmente a uma célula saudável. Quando o eléctrodo é suficientemente próxima para a célula de modo a que ele começa a afastar-se da solução de saída de fluxo, reverter rapidamente a pressão, a aplicação de um vácuo ligeiro ao eléctrodo até que a célula "salta" para dentro dele. Cessar imediatamente sucção no diaeléctrodo e e aplicar um potencial de retenção de -70 mV para o interior do eléctrodo. Dentro de poucos segundos um selo gigaohm irá se formar.
- Observe os transientes corrente capacitiva no início e término das etapas de tensão que aparecem logo após a formação do selo. Continuar a monitorizar a perfuração da membrana sob o eléctrodo pelo anfotericina observando como os transientes de crescer em magnitude ao seu tamanho máximo (em cerca de 10 minutos).
- Para confirmar o estabelecimento de células inteiras de configuração (perfurada) em uma célula saudável, eliciar exteriores correntes de K + através da aplicação e hiperpolarizante despolarizante passos de voltagem. A maioria das células de cabelo têm importantes correntes exteriores (ver Figura 6).
5. Resultados representativos
A Figura 4 mostra imagens obtidas durante as etapas de isolamento de células. No painel A, os otólitos associados aos lagenas, saccluli e utrículos pode ser visto through a fina camada de osso que se sobrepõe a eles. Estas estruturas opacas fornecer pontos de referência conveniente para ajudar na remoção segura dos órgãos terminais do animal durante as etapas subsequentes da dissecção. O painel B mostra o "tigela" de osso que contém os labirintos intactas e os otólitos proeminentes nos utrículos, lagenas e sáculos. O painel C mostra um labirinto que tenha sido removido a partir do osso. Observe o otólito grande com a borda recortada no lagena, o otólito icicle em forma de sáculo e do otólito em forma de feijão no utrículo. Alguma da diversidade no tamanho e na morfologia observada em células isoladas da lagena é ilustrado na Figura 5. Uma célula saudável é prontamente identificado como sendo de fase brilhante, com um perímetro afiada. Formas celulares podem ser divididos em duas classes: em forma de abacate (avo) e longo e fino (thn), embora os tamanhos das células dentro de cada grupo pode variar acentuadamente (compare, por exemplo, um avo e avo 3). Inserção de uma mostra um aglomerado detrês células que não foram completamente isoladas umas das outras. A cor preta e aparência granular da célula em b inset facilmente identifica esta célula como mortos. C inserção mostra a ponta de uma pipeta de patch ilustrando a forma e dimensões apropriadas para a gravação a partir destas células.
Os traços de corrente mostradas na Figura 6 foram obtidos em resposta à despolarização e hiperpolarização do potencial passos impostas a uma célula lagena semelhante ao avo 2 mostrado na Figura 5. Respostas actuais em células de diferentes tamanhos e formas podem variar amplamente sugerindo diversidade no complemento de canais dependentes da voltagem.
As Figuras 1-3 ilustram os passos: Desenhos no isolamento das células ciliadas.
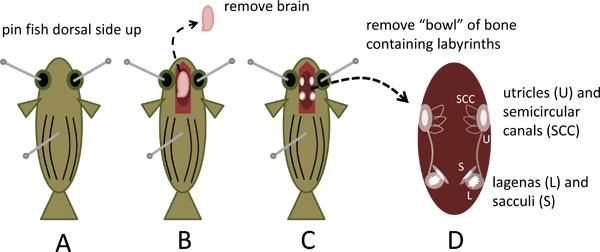
Figura 1. A remoção do crânio capsule contendo os labirintos do ouvido interno do peixe-zebra. Uma. Pin sacrificado lado dorsal do peixe-zebra até dissecar prato. B. Crânio aberto, remover e descartar cérebro. C. Observe otólitos em utrículos, lagenas e sáculos. D. Remover porção ventral do crânio cápsula contendo os labirintos.
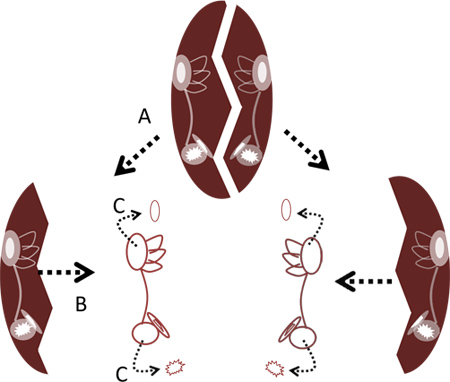
Figura 2. Remoção de labirintos de cápsula crânio. A. Quebrar em pedaços da cápsula, na sua linha média do crânio. B. Remover labirintos de osso. C. Retire os otólitos dos lagenas e utrículos usando uma pinça.

Figura 3. Isolamento de células capilares de labirintos. A. Delicadamente levante maculae com um pêlo de cão. B. Triturar máculas com dois fios de cabelo do cão. C. Utilize células ciliadas isoladas para patch clamp.
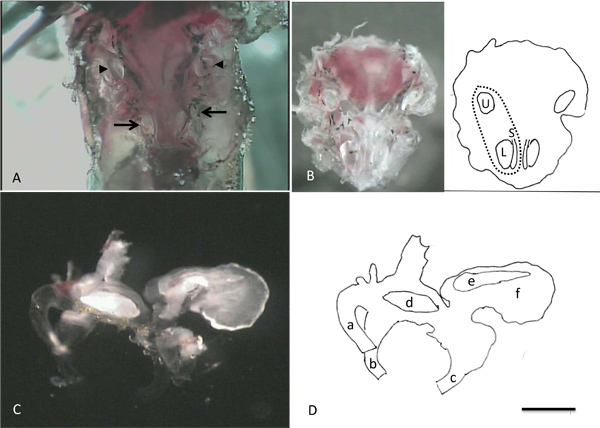
Imagens de Figura 4. Tomadas durante os passos de isolamento de células individuais. A. Após a remoção do cérebro, os otólitos associados aos dois lagenas e sáculos (setas) e utrículos (pontas de seta) pode ser visualizada. B. Após a remoção do ventral porção da cápsula de crânio que contém os órgãos do ouvido interno a partir do animal. O desenho animado na metade direita do B identifica os locais do utrículo esquerda, lagena e sáculo. A linha tracejada indica a posição aproximada do labirinto esquerdo. C. Labirinto direito (vista medial) D: Desenho dos desenhos animados ilustrando partes importantes do labirinto em C. a: semi anteriorcircular canal, b: canal horizontal, c: canal posterior, d: utricular otólito, e: sacular otólito, f: lagenal otólitos. Barra de escala em D representa 1 mm para A e B, 0,5 mm, para C e D.
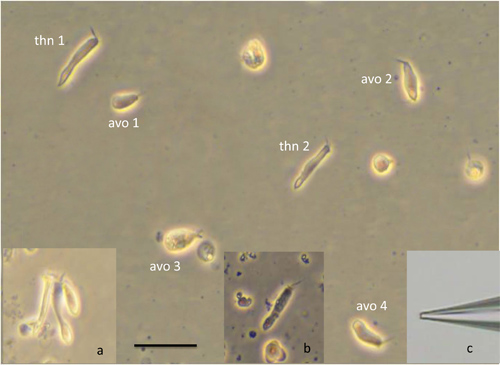
Figura 5 isoladas, as células saudáveis do lagena ilustrando a diversidade da morfologia; avo:. Abacate células em forma; thn: longos, células finas. Inset uma: cluster de três células isoladas incompleta; inset b: célula morta, c inset: ponta do eletrodo sistema usado em gravações eletrofisiológicas das células ciliadas zebrafish. Barra de escala = 20 um se aplica a figura principal e todas as inserções.

Figura 6. Correntes gravadas em um patch preso células ciliadas. Respostas médias em uma célula (t semelhanteso avo 2 na Figura 5) a três apresentações dos passos a tensão aplicada em incrementos de 10 mV de -140 mV a +70 mV de um potencial de manutenção de -70 mV. Observe o atual inativação que aparece na potenciais mais despolarizadas. Magnitudes degrau de tensão são mostrados ao lado de alguns dos traços.
Discussão
Dissecação cuidadosa dos órgãos terminais e tratamento suave das células é essencial para o isolamento de células ciliadas saudáveis, intactos e fisiologicamente activo. Aderindo às dicas a seguir irão garantir o sucesso:
- É mais fácil de obter a partir de células saudáveis peixes mais pequenos (2-2,5 cm de comprimento). Peixes maiores têm muitas gotículas de gordura que mais obscuro de visualização durante o processo de dissecação.
- Cuidados devem ser tomados ao remover os otólitos, que se sobrepõem às células ciliadas. Evite tocar as células quando pegar os otólitos com pinças.
- Os melhores resultados são obtidos quando as manchas e cúpulas são descolou-se as lâminas e as células do epitélio triturados.
- Nós encontramos o uso de um fio de cabelo cão para triturar as células a ser superior a outros métodos, incluindo a utilização das pestanas humanas 7, que não são tão fina e menos flexível.
- Durante remendo de aperto, a aplicação de pressão positiva a tele eléctrodo à medida que passa através da interface ar / solução é importante para manter a ponta limpa. A libertação da pressão positiva para permitir que a célula de "saltar" sobre o eléctrodo também é importante. Este método elimina um pequeno volume de solução contendo anfotericina longe da ponta, o que aumenta a probabilidade de formação de uma vedação gigaohm com a célula. Nas nossas experiências que utilizam a técnica de gravação em vez de adesivo perfurado o mais tradicional configuração de célula total, devido à fragilidade das células. A tentativa de "ir célula inteira" muitas vezes resulta na perda do selo gigaohm.
O método aqui descrito vai produzir centenas de células ciliadas saudáveis por animal. A técnica pode ser realizada à temperatura ambiente e não requer nenhum equipamento especial além de um microscópio de dissecação. Um relatório anterior, em JoVE descreve a dissecção do ouvido interno no peixe-zebra utilizando uma abordagem ventral 8. Esses autores demonstraram a Dissection de inteiros, paraformaldeído-fixados órgãos do ouvido interno. Incentivamos o leitor a assistir a este vídeo para a comparação com os nossos métodos. Uma vantagem dos métodos aqui apresentados é a obtenção de células vivas úteis para investigações fisiológicas. Para além da sua utilização em experiências de patch clamp para estudar os canais dependentes da voltagem (como mostrado aqui) o uso destas células pode ser estendida para o estudo de ressonância célula 9,10, monitor a libertação do neurotransmissor através de medições de capacitância 11,12, investigar neuromodulação induzida pela a ativação de canais fechados ligante 13, bem como explorar a riqueza de informações que pode ser adquirida a partir usando mutantes que afetam tanto a audição e equilíbrio 14.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Financiado pela NSF (0.854.551).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome da solução | Receita | ||
| (A) NZR (Normal Zebrafish Ringer) (em mM) | 116 NaCl, KCl 2, CaCl 2 2, 3 Glucose, 5 de Na +-HEPES, pH 7.35. | ||
| (B) + NZR tricaina | NZR + 0,02% ácido 3-aminobenzóico etil éster sulfonato de metano (Sigma A5040). | ||
| (C) + BSA NZR | NZR + 0,4% Albumina de Soro Bovino (Sigma A2153). | ||
| (D) Locas (Baixo Ca 2 + Solução) (em mM) | 100 NaCl, KCl 2, 0,05 CaCl2, 0,05 MgCl2, 3 Glucose, 30 de Na +-HEPES, pH 7.35. | ||
| (E) + Locas papaína | Locas + 0,05% de L-cisteína (Sigma C1276) + 0,2% de papaína (Sigma P3375). | ||
| (F) K +-solução interna (em mM) | 52 K 2 SO 4,38 KCl, 1-K + EGTA, 5 K +-HEPES, pH 7,3. |
Tabela 1. Solutions.
Referências
- Lewis, R. S., Hudspeth, A. J. Voltage- and ion-dependent conductances in solitary vertebrate hair cells. Nature. 304, 538-5341 (1983).
- Art, J. J., Fettiplace, R. Variation of membrane properties in hair cells isolated from the turtle cochlea. J. Physiol. 385, 207-242 (1987).
- Sugihara, I., Furukawa, T. Morphological and functional aspects of two different types of hair cells in the goldfish sacculus. J. Neurophysiol. 62, 1330-1343 (1989).
- Lee, S., Briklin, O., Hiel, H., Fuchs, P. Calcium-dependent inactivation of calcium channels in cochlear hair cells of the chicken. J. Physiol. 583, 909-922 (2007).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J. Gen. Physiol. 92, 145-159 (1988).
- Rae, J. R., Cooper, K., Gates, P., Watsky, M. Low access perforated patch recordings using amphotericin B. J. Neurosci. Meth. 37, 15-26 (1991).
- Lumpkin, E. A., Hudspeth, A. J. Detection of Ca2+ entry through mechanosensitive channels localizes the site of mechanoelectrical transduction in hair cells. Proc. Natl Acad. Sci. U.S.A. 92, 10297-10301 (1995).
- Liang, J., Burgess, S. M. Gross and fine dissection of inner ear sensory epithelia in adult zebrafish (Danio rerio). J. Vis Exp. 27, e1211(2009).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage- and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. J. Physiol. 400, 237-274 (1988).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. J. Physiol. 400, 275-297 (1988).
- Parsons, T. D., Lenzi, D., Almer, W., Roberts, W. M. Calcium-triggered exocytosis in an isolated presynaptic cell: capacitance measurements in saccular hair cells. Neuron. 13, 875-883 (1994).
- Kim, M. -H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis Exp. 59, e3345(2012).
- Housley, G. D., Ashmore, J. F. Direct measurement of the action of acetylcholine on isolated outer hair cells of the guinea pig cochlea. Proc. R. Soc. Lond. B. 244, 161-167 (1991).
- Nicolson, T. The genetics of hearing and balance in zebrafish. Ann. Rev. Genetics. 39, 9-22 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados