Method Article
Assépticas Técnicas de Laboratório: transferências de volume com pipetas sorológicas e micropipetas
Neste Artigo
Resumo
Quando se trabalha num laboratório, é imperativo para minimizar fontes de contaminação. A técnica asséptica refere-se a procedimentos que permitem a transferência de culturas e reagentes evitando ao mesmo tempo o contacto com as superfícies não-estéreis. Pipetas serológicos e usar micropipetas são usados para medir os volumes precisos, sem comprometer a esterilidade das soluções utilizadas em experiências.
Resumo
Os microrganismos estão por toda parte - no ar, solo e corpo humano, bem como em superfícies inanimadas, como bancadas de laboratório e teclados de computador. A onipresença de micróbios cria uma fonte abundante de contaminantes potenciais em um laboratório. Para garantir o sucesso experimental, o número de contaminantes nas superfícies do equipamento e de trabalho deve ser minimizado. Comum entre muitas experiências em microbiologia são técnicas que envolvem a medição e transferência de culturas contendo células bacterianas ou de partículas virais. Para fazê-lo sem entrar em contato com superfícies não-estéreis ou contaminar meios estéreis requer (1) preparar um espaço de trabalho estéril, (2) precisamente definição e precisão de leitura de instrumentos para transferência asséptica de líquidos, e (3) adequadamente manipular instrumentos frascos, garrafas e culturas, tubos dentro de um campo estéril. Aprender esses procedimentos exige treinamento e prática. Na primeira, as acções devem ser lenta, deliberada e controlada com o objetivo de ser para t assépticasechnique para se tornar uma segunda natureza, quando trabalhava no banco. Aqui apresentamos os passos para a medição de volumes por meio de pipetas sorológicas e micropipetas de dentro de um campo estéril criado por um bico de Bunsen. Volumes variar de microlitros (ul) a mililitros (ml), dependendo do instrumento utilizado. Líquidos comummente transferidos incluem caldo estéril ou soluções químicas, bem como culturas de bactérias e stocks de fagos. Seguindo estes procedimentos, o aluno deve ser capaz de:
- Trabalhar dentro do campo esterilizado criado pela chama do queimador de Bunsen.
- Usar pipetas serológicos sem comprometer a esterilidade do instrumento.
- Aspirar líquidos com pipetas serológicos, precisamente a leitura volumes calibrados através do alinhamento do menisco formado pelo líquido para as marcas de graduação na pipeta.
- Mantenha garrafas de cultura, frascos, tubos e suas respectivas tampas estéreis durante as transferências de líquidos.
- Identificar diferentes aplicações para o plástico contra o vidro pip sorológicoettes.
- Estado limitações de precisão para micropipetas.
- Precisamente e precisa definir volumes de micropipetas.
- Saiba como usar corretamente a primeira parada e segundo em uma micropipeta para aspirar e transferir volumes corretos.
Protocolo
1. Preparar uma área de trabalho estéril
- Antes de iniciar os procedimentos de esterilização em sua área de trabalho, lave bem as mãos com sabonete anti-séptico e água morna.
- Certifique-se de re-lavar as mãos sempre que você suspeitar que você tem a contaminação de suas manipulações experimentais.
- Limpar todos os materiais bagunçando sua área de trabalho na bancada do laboratório. Remover um pré-umedecido desinfetante limpe a lata e limpe toda a área. Deixe o desinfetante para evaporar - não seque!
- Use desinfectantes tais como o álcool (isopropanol ou etanol 70%) ou de compostos fenólicos (o-fenilfenol).
- Para evitar aerossolização, ou a produção de uma névoa fina contendo células bacterianas e propagação dos contaminantes microbianos, evitar dispensar desinfectante a partir de um frasco de compressão.
- Dessecação de microorganismos é uma das formas mais eficazes para descontaminar superfícies.
- Mesmo que alguém tenha usado recentemente a bancada do laboratório e da bancada foi limpo com desinfectante, comece sempre o seu tempo de laboratório, limpando para baixo do banco.
- Após o desinfetante secou completamente, use um dispositivo de ignição para acender o bico de Bunsen. Regular a chama de modo que um cone azul pode ser visto no meio da chama. A chama é agora a produzir uma corrente de ar ascendente, ou correntes de ar de convecção na qual o ar quente sobe cima e para fora a partir da chama (Figura 1). Como o calor aumenta, os microorganismos e partículas de poeira são forçados para cima e para longe da área de trabalho. Trabalhar lentamente, com cuidado, e deliberadamente em todos os momentos dentro desta área criada pelo bico de Bunsen, referido como um campo esterilizado. Manter o bico de Bunsen durante todo o procedimento.
- A ponta do cone azul é a parte mais quente da chama.
- Tenha cuidado para não perturbar o updraft por movimentos rápidos que alteram dramaticamente a air correntes ao redor de bancada do laboratório. Criando uma corrente ascendente com o bico de Bunsen minimiza a possibilidade de microorganismos e pó que caia sobre o banco ou em frascos abertos, tubos ou frascos de área de trabalho.
- Organizar todos os suprimentos necessários para o procedimento na bancada do laboratório perto do campo estéril. Certifique-se de todos os materiais sejam devidamente rotulados.
- Suprimentos podem incluir pipetas sorológicas e micropipetas, tubos de cultura estéreis, frascos estéreis, garrafas de mídia contendo caldo, tubos de microcentrífuga estéreis, dicas micropipetador prateleiras para tubos, culturas de células bacterianas, e estoques de fagos.
- Meios líquidos deve ser esterilizado em autoclave a 121 ° C durante pelo menos 15 minutos sobre a configuração líquido. Maiores volumes de mídia (> 1L) requerem tempos mais autoclave. Labware deve ser esterilizado em autoclave a 121 ° C durante pelo menos 30 minutos a gravidade (seco) de ajuste.
- Em geral, as soluções estéreis podem ser armazenadas a 4° C durante até 5 meses. Note-se que o tempo de armazenamento é significativamente reduzida para soluções contendo componentes instáveis, tais como antibióticos - sempre verificar as recomendações do fabricante.
2. Transferência de líquidos por meio de pipetas sorológicas
- Pipetas sorológicas vêm em muitos tamanhos e opções: plástico ou vidro, descartáveis ou reutilizáveis, conectado ou desconectado. Estes são calibrados para fornecer volumes que variam de um 0,1 ml para 25 ml.
- Os tamanhos comuns para pipetas são serológicos 5 ml, 10 ml e 25 ml e deve ser usado para transferências de assepsia líquidas de 0,1 ml ou mais (painel A da Figura 2). Há também grandes pipetas sorológicas que podem entregar volumes até 100 ml, no entanto, o foco deste protocolo é sobre os mais comuns, pequenas pipetas porte.
- Pré-esterilizados pipetas com um tampão de algodão são necessários para microbiologia e as experiências de cultura de tecidos. A ficha não deve ser removido a partir do parap da pipeta e que se destina a funcionar como uma barreira para o carregamento excessivo da pipeta.
- Diferentes aplicações para chamar de plástico contra vidro pipetas sorológicas. O vidro é necessário para a solventes orgânicos. Ou pode ser usado na realização de NBS-1 experiências sobre o topo da bancada do laboratório. Plástico só pode ser utilizado quando se trabalha num armário de Biossegurança com NBS-2 organismos em que um bico de Bunsen não podem ser usados. Também é recomendado que o plástico ser utilizado para aplicações que envolvam transferência de agar fundido.
- Pipetas sorológicas são de dois tipos: TC ("para conter") ou TD ("entregar"). Pipetas TC entregar todo o volume, incluindo a ponta, e deve ser "apagado" ou lavados para obter o volume especificado. Pipetas TD são calibrados para deixar um pouquinho na ponta que não deve ser entregue. Ter a certeza de verificar o rótulo sobre o corpo da pipeta perto do topo para determinar que tipo que é (Figura 3). Os mais usados são pipetas TD, que são marked com anéis duplos no topo.
- Dê uma pipeta de plástico estéril sorológico (também chamado de uma pipeta volumétrica) e remova cuidadosamente a luva de papel no final com o tampão de algodão por descascar afastado como a pele de uma banana - não remover toda a manga, protegendo a ponta do a pipeta que irá entrar em contacto com o líquido a ser transferido. Toque apenas o topo da pipeta (acima das marcas de graduação) com as mãos.
- Nunca entre em uma solução estéril com uma pipeta usada, mesmo se um grande cuidado foi tomado para mantê-lo estéril.
- Pipetas de vidro serológicos são tipicamente armazenados em caixas metálicas (painel B da Figura 2). Solte a parte superior do recipiente, em seguida, remova cuidadosamente a tampa, e chama as extremidades abertas da tampa e recipiente. Coloque a tampa para baixo, de lado, no banco desinfectados. Remover uma pipeta da lata, segurando-o na horizontal e agitando-lo para os topos de um ou dois pipetates pau para fora cerca de um centímetro e pode ser facilmente compreendido. Deite a lata de lado e remover uma pipeta, mas seja cauteloso para não tocar as pipetas outros no recipiente. Não toque na ponta inferior da pipeta com as mãos e evitar o contato da ponta com outras superfícies não-estéreis.
- Juntar uma pipeta, tais como auxílio de uma lâmpada, bomba, ou a pistola para a extremidade de topo da pipeta serológica. Remover a manga de papel a partir da pipeta de plástico. Segure o auxílio de pipeta na mão direita.
- Se usando uma pipeta de vidro, passar a terceira parte inferior da pipeta através do cone azul na chama do queimador de Bunsen para 1-3 segundos. Rodar a pipeta de 180 ° à medida que passa através da chama. Pipetas de plástico e os tubos não pode ser inflamado.
- Se a mão esquerda, segure o auxílio de pipeta na mão esquerda e realizar manipulações subsequentes de garrafas e tubos de cultura com a mão direita.
- Contaminação tende a ocorrer com pipetas de plástico quando da retirada do último inches da pipeta a partir da manga porque a ponta estéril entra em contacto com a parte da manga tocado por suas mãos.
- Remova a tampa do frasco contendo meios estéreis. Não coloque a tampa na bancada do laboratório, mas mantê-lo entre o dedo anelar e palma da mão direita, enquanto a manipulação da pipeta ajuda com o polegar, indicador eo dedo médio da mesma mão (Figura 4). Segurando o frasco num ângulo de 45 °, passar o aro da garrafa através da chama do queimador de Bunsen, criando um campo esterilizado em torno do frasco aberto.
- Apesar de ser evitados, se você deve colocar a tampa para baixo, coloque-o de bruços sobre uma superfície desinfectada. Com uma tampa que fica voltada para cima, não há uma maior probabilidade de contaminação a partir de movimentos de objectos ou as mãos, criando correntes de ar que causam microorganismos e partículas de poeira para descer para a superfície interior da tampa.
- O objectivo da flamejante não é para esterilizar mas a aquecer até à abertura óf a garrafa e criar as correntes de convecção de ar para cima e para longe da abertura (isto é, corrente de ar ascendente). O ar quente, aumentando ajuda a impedir que as partículas de poeira e outros contaminantes entrem no frasco.
- Mantenha o recipiente estéril aberto para tão pouco tempo quanto possível. É importante manter os pontos de entrada de microrganismos transportados pelo ar para um mínimo durante todo o procedimento.
- Evite tossir, espirrar, falar e movimento involuntário, enquanto outros recipientes esterilizados estão abertas.
- Nunca passe mãos e dos dedos sobre o topo de um campo esterilizado (isto é, garrafas ou frascos abertos, o interior de tubos e tampas de garrafas) uma vez que tenham sido passado através da chama do queimador de Bunsen.
- Sempre trabalhamos com uma chama aberta ao abrir tubos ou frascos estéreis. Nunca ter mais do que um tubo, uma garrafa, ou frasco aberto sobre a bancada de cada vez. Flaming deve ser feito imediatamente após a abertura e fechamento pouco antes de tubos, garrafas e frascos.
- Coloque a ponta do serolpipeta ogical dentro da garrafa que contém os meios estéreis, em seguida, aspirar, ou desenhar a amostra de forma asséptica, a partir da garrafa. Utilizar o auxílio de pipeta para controlar o fluxo da amostra para a pipeta. Precisamente ler o volume arrastado para a pipeta, alinhando o menisco formado no topo da coluna de líquido para as marcas de graduação na pipeta calibrada (Figura 5).
- NÃO BOCA Pipetar! Sempre use uma ajuda pipeta (lâmpada, bomba, ou arma).
- Preste atenção na seqüência de números para determinar o volume aspirado. Os números podem ser impressos a ponta para vice de topo, ou vice, ou frequentemente vezes em ambas as direções.
- Ao ler o volume, sempre mantenha o verticalmente pipeta, perpendicular ao chão, e ver o menisco líquido mortos no nível dos olhos.
- Pipetas serológicos são apenas tão preciso como o menor incremento marcado, que é tipicamente 0,1 ml para 5 ml e 10 ml pipetas e 0,2 ml por 25 ml pipetas. Euf maior precisão é necessária, uma pipeta serológica pode ser usado em combinação com uma micropipeta.
- Passar o aro da garrafa através da chama do queimador de Bunsen, mais uma vez, em seguida, coloca a parte de trás tampa do frasco. Defina a garrafa de mídia de lado.
- Não queimar-se com o bico de Bunsen com pressa para fechar a garrafa.
- Segure um tubo de ensaio ou frasco em sua mão esquerda. Remover e segurar a tampa como descrito no passo # 4 acima. Criar um campo esterilizado por flamejante o aro do tubo ou frasco no bico de Bunsen.
- Dispensar os meios de comunicação a pipeta no tubo ou frasco. Controlar o fluxo da amostra de modo que não espirrar para fora do tubo ou frasco.
- Volumes pode ser medido de tal forma que todo o volume é entregue e da pipeta drena completamente, ou um volume específico é conseguida fazendo uma entrega ponto-a-ponto (um volume de marcação para o outro).
- Passar o aro do tubo ou frasco através da queimadura Bunsener chama mais uma vez, em seguida, recoloque a tampa. Ajuste o tubo ou frasco de lado. Retire o auxílio da pipeta, e descartar a pipeta no recipiente de resíduos adequado.
- Plásticos pipetas serológicos são descartáveis, enquanto pipetas de vidro serológicos pode ser esterilizado e reutilizado. Eliminação adequada requer pipetas de plástico ser colocado em um recipiente designado farelos (caixa rígida forrada com saco de eliminação de plástico), enquanto pipetas de vidro, inicialmente deve ser imersa em um recipiente com solução de água sanitária a 10% para desinfectar as superfícies, dentro e fora. Em seguida, as pipetas de vidro deve ser cuidadosamente lavado com detergente de laboratório, enxaguadas com água destilada, e esterilizado em autoclave.
- Estes mesmos passos devem ser seguidos quando da inoculação de mídia com uma cultura bacteriana ou fago estoque ou quando realizar diluições em série.
3. Líquidos transferir através micropipetas
- Medir com precisão e dispensa volumes minuto pode ser consumadoderramado utilizando micropipetas (também referido como Pipetman; Painel A da Figura 6). Estes instrumentos vêm em diferentes tamanhos, cada um com uma faixa de volume específico: P2 para 0,2-2 ul, P10 para ul 1-10, P20 para 2-20 ul, P200 de 20-200 uL, e P1000 para 200-1000 ul.
- Trate micropipetas com cuidado, pois eles são instrumentos de precisão. Não os deixe na bancada do laboratório autônomo, onde podem ser derrubados e danificados. Não permitir pipetas a entrar em contacto com produtos químicos corrosivos.
- Para volumes maiores do que 1000 uL, utilizar uma pipeta serológica.
- Embora que trabalha dentro do campo esterilizado criado pelo bico de Bunsen, não usar micropipetas de chama, tubos e pontas de plástico. Os tubos e pontas devem ser pré-esterilizado. As micropipetas pode ser varrida para baixo com um desinfectante de pré-humedecido limpe antes de usar.
- A volúmetro numérica mostrando o volume distribuído pode ser definido girando o botão de ajuste. Ajustt o volume antes de prosseguir para a etapa # 3.
- NUNCA DESLIGUE O BOTÃO DE AJUSTE acima da faixa pretendida!
- Para obter o máximo de precisão quando diminuir o ajuste de volume no micropipeta, marque lentamente para baixo a roda polegar, tomando cuidado para não ultrapassar a marca de graduação.
- Para obter o máximo de precisão quando se aumenta o volume no da micropipeta, marcar a roda polegar para cima, passando a marca de graduação desejada por 1/3 de uma vez. Em seguida, marque lentamente para baixo o botão giratório para atingir o volume pretendido, tomando cuidado para não ultrapassar a marca de graduação.
O volúmetro mostra três números. Dependendo da micropipeta, os números são interpretados de forma diferente. Note que cada micropipeta é tão precisa como a marca menor graduação.
P2: Para volumes entre 0,2-2,0 ul. O primeiro número representa o volume em microlitros. O segundo número indidécimos ES de um microlitro (0,1 uL), e representa o número terceira centésimos de um microlitro (0,01 uL). Cada marca de graduação equivale a um incremento de dois milésimos (0,002 ul) de um microlitro.
P10: Para volumes entre 1,0-10,0 ul. O primeiro número é de dezenas de microlitros, o que normalmente é fixado em "0" e só deve ser fixado em "1" com os outros dois números fixados em "0" na dispensação de 10,0 ul. O número do meio indica a volume, em microlitros. O terceiro número indica décimos de um microlitro (0,1 uL). Cada marca de graduação equivale a um incremento de dois centésimos (0,02 ul) de um microlitro.
P20: Para volumes entre 2,0-20,0 ul. O número superior de preto é para dezenas de microlitros, o que só deve ser definido em "2" com os outros dois números fixados em "0" na dispensação de 20,0 ul. O segundo número de negro indica o volume, em microlitros. O terceiro número em vermelho indica 10ths de um microlitro (0,1 uL). Cada marca de graduação equivale a um incremento de dois centésimos (0,02 ul) de um microlitro.
P200: Para volumes entre 20,0-200 ul. O primeiro número é para centenas de microlitros, o que só deve ser definido em "2" com os outros dois números fixados em "0" na dispensação de 200 ul. O número do meio indica o volume distribuído em dezenas de microlitros, eo terceiro número indica a volume, em microlitros. Cada marca de graduação equivale a um incremento de dois um décimos (0,2 ul) de um microlitro.
P1000: Para volumes entre 200-1000 ul. O primeiro número é para milhares de microlitros, o que normalmente é fixado em "0" e só deve ser fixado em "1" com os outros dois números fixados em "0" na dispensação de 1000 ul. O número do meio é para centenas de microlitros. O número de baixo é para dezenas de microlitros. Cada marca de graduação equivale a um incremento de dois (2 l) microlitros.
- Desempenho verificar: Estes instrumentos devem ser calibrados anualmente, garantindo o rigor ea precisão são mantidos para permanecer dentro de ± 5% de especificações. Use uma balança analítica para medir a água, certificando-se as configurações mínimas e máximo correspondem ao volume pretendido. Por exemplo, usar um P1000 para transferências 200 uL de água para um prato de pesagem na escala. Desde que a água tem uma densidade de 1, em seguida, 1 ml de água é equivalente a 1 grama (g). Assim, 200 uL (0,2 ml) de água deve ser igual a 0,2 g. Além disso, certifique-se a ponta não vaza e pode manter o volume desejado até dispensado utilizando o sistema de êmbolo.
- Micropipetas deve ser usado com pontas descartáveis de plástico em todas as vezes. Encaixar uma ponta firmemente na extremidade do cano da micropipeta. Pressione para baixo e torcer um pouco para garantir uma vedação hermética.
- Dicas são geralmente embalados em caixas de plástico que podem ser esterilizadas por autoclavagem. Abra a caixa de ponta para recuperar a ponta, Feche a caixa de ponta para minimizar o contato com contaminantes no ar.
- Algumas dicas têm filtros semelhantes aos tampões de algodão de lã em pipetas sorológicas. Essas dicas são muitas vezes mais caro do que dicas regulares e, portanto, são usadas para aplicações especializadas. Por exemplo, quando se mede produtos químicos voláteis, tais como clorofórmio ou líquidos radioactivos tais como P-32 de DNA etiquetado, utilizando pontas de filtro ajuda a evitar que o cano da micropipeta de ficar contaminada.
- Mantenha a micropipeta numa posição vertical.
- Mantendo a micropipeta vertical irá evitar que os líquidos a partir de execução dentro e contaminando o cano da micropipeta.
- A micropipeta tem três posições: (1) posição de repouso, (2) Primeira parada, e (3) Segunda paragem (Figura 6, painel B). O instrumento tem um sistema de pistão de duas paradas. A primeira parada tem duas funções. O primeiro é desenhar no volume desejado de líquido para dentro do whe pontan libertar o êmbolo a partir da primeira parada para a posição de repouso. A segunda função é a dispensar a maioria do líquido a partir da ponta quando a compressão do êmbolo a partir da posição de repouso para a primeira parada. Além disso a compressão do êmbolo para os dispensa parar segundos qualquer líquido permanece na ponta.
Pressione o botão sobre o êmbolo da posição de repouso para a primeira parada. Ar igual ao volume da configuração será deslocado. - Mergulhe a ponta no líquido enquanto pressiona o botão para a primeira parada.
- Não toque na micropipeta si para os lados de frascos, tubos e frascos, caso contrário as superfícies interiores destes navios irá tornar-se contaminado. Apenas as pontas são estéreis.
- Solte o botão lentamente para aspirar o líquido na ponta. Pare uma vez que o botão de pressão é de volta para a posição de repouso. Espere um momento tão líquido pode ser arrastado para a ponta.
- O volume de líquido na ponta será igual ao volume de of configuração da micropipeta.
- Líquidos viscosos, tais como aqueles contendo glicerol requerem mais tempo para introduzir a ponta.
- Remova a ponta a partir do líquido, e inspeccionar visualmente a ponta para confirmar que o líquido elaborado atingiu o nível esperado na ponta e não existem bolhas de ar na ponta.
- Se necessário, expelir o líquido e manualmente apertar as pontas sobre a micropipeta. Elaborar o líquido e verificar novamente.
- Coloque a ponta com um ângulo (10 ° a 45 °) contra a parede do tubo recebe o líquido. Para expulsar o líquido, lentamente, pressione o botão sobre o êmbolo para a primeira parada. Espere um momento, em seguida, pressione o botão para a segunda parada para expulsar qualquer líquido residual na ponta.
- A compressão do êmbolo demasiado depressa pode causar o líquido a ser expelido para salpicar ou irá produzir bolhas indesejáveis no tubo.
- Antes de libertar o êmbolo para a posição de repouso, remover a ponta do líquido.
- Descarte dicas em contentor de resíduos perfurocortantes, premindo o botão de ejeção na micropipeta.
4. Limpando O Espaço de Trabalho
- Quando terminar com uma experiência que exige a utilização da técnica asséptica, desligue o bico de Bunsen, em seguida, pôr de lado todos os suprimentos e reagentes. Limpar as superfícies exteriores do material de laboratório (garrafas, micropipetas, caixas de pipeta) com um desinfectante de pré-humedecido limpe para garantir os contaminantes não são transferidos para o local de armazenamento.
- Lugar contaminado copos e materiais de resíduos perigosos no receptáculo eliminação adequada. Resíduos de laboratório inclui materiais de laboratório, tais como luvas, pipetas, dicas e tubos. Não infecciosa resíduos perigosos é gerada quando realizando experiências com patogénicos organismos não-(BSL-1) enquanto que os resíduos perigosos infeccioso é gerado quando se utiliza os organismos patogénicos (BSL-2 ou acima). Resíduos infecciosos devem ser befor autoclavado ou desinfectadose ele é descartado. Siga as orientações do laboratório de segurança descritos no BMBL (5 ª ed.), Bem como os fornecidos pela OSHA e institucional Saúde Ambiental e departamentos de segurança.
- Limpar abaixo da área de trabalho inteiro na bancada do laboratório com um pré-humedecido desinfectante limpe a partir do recipiente, uma vez que permite o desinfectante para evaporar.
- Lave bem as mãos com sabonete anti-séptico e água morna antes de deixar o laboratório.
5. Os resultados representativos
Uma aplicação da amostra para a utilização de pipetas serológicos para transferir líquidos é mostrado na Figura 7. Estes pipetas muitas vezes são utilizados em laboratórios de microbiologia para preparar meios para a inoculação com culturas de bactérias. Por exemplo, frascos estéreis primeiro são preenchidos com um volume especificado de caldo de cultura, neste caso Luria Broth (LB), então um pequeno número de células (tais como E. coli) são adicionados aos meios de comunicação. Usando um p serológicaipette, em primeiro lugar o caldo deve ser transferidas assepticamente a partir da garrafa meios de comunicação para o balão. Neste caso, 25 ml de LB foi adicionado a um balão de 125 ml estéril usando um 25 ml de pipeta serológica. Em seguida, o caldo deve ser inoculado com E. células de Escherichia. Aqui, 10 ul de células foram transferidas assepticamente utilizando uma micropipeta P20 a partir de um frasco de cultura previamente crescente para a porção de 25 ml de LB fresco. O balão é incubado numa câmara de crescimento durante um determinado período de tempo, permitindo que as células se replicar (para este exemplo, as células de E. coli foram incubadas durante a noite a 37 ° C em uma plataforma de agitação). O resultado é uma cultura de células turva bacteriana que pode ser usado para as experiências subsequentes.
Pipetas serológicos também pode ser usado para transferir meios originalmente fornecidos em uma garrafa para tubos de ensaio, ou entre os tubos de ensaio, como é feito ao fazer diluições de uma cultura bacteriana. Se uma técnica asséptica não é mantido ao longo destes tipos de manipulações meios , Em seguida, as culturas se tornará contaminado, e experimentos subsequentes usando essas culturas será adiada porque frescas, as culturas não contaminadas terá de ser preparado. Erros ocorrem porque um campo esterilizado que não seja mantida durante todo o procedimento. Por exemplo, você pode esquecer de desinfetar a bancada do laboratório ou chama a borda de um frasco de cultura ou tubo. Você pode tocar com a ponta da pipeta ou definir a tampa de uma garrafa ou tubo de ensaio no banco em vez de segurá-lo em sua mão. Procedimento adequado é crítica para manter a contaminação dos meios de comunicação e culturas a um mínimo. Figura 8A fornece um exemplo de uma cultura pura contra contaminada de E. coli em um tubo contendo 5 ml de LB. O painel esquerdo mostra uma cultura exibindo turbidez fina e uniforme típico de uma E. puro cultura coli. Em contraste, o painel da direita mostra uma cultura contaminada na qual as características de crescimento desviar-se os esperados para esta estirpe bacteriana.
"> Erros técnicos podem ocorrer quando da manipulação de pipetas sorológicas resultam em transferência de volumes incorretos de mídia entre os tubos de ensaio. Por exemplo, você pode ler o volume da pipeta incorretamente (ou seja, superior, versus inferior do menisco) ou você pode expulsar a mídia completamente de uma pipeta de TD, que foi projetado para deixar um pouquinho na ponta para não ser entregue. Ao realizar uma entrega ponto a ponto da mídia, você pode usar as marcas de calibração errados e dispensar o volume incorreto. Figura 8B mostra um exemplo de tubos de ensaio com volumes corretos contra incorreto de mídia. O tubo da esquerda contém 3,5 ml de LB medido com uma pipeta de 5 ml sorológica. O aluno realizou uma entrega ponto a ponto de os meios de comunicação em que LB foi elaborado para a marca de graduação 5,0 ml e dispensados à marca de 1,5 ml. O tubo do lado direito contém 2,5 ml de LB medido com uma pipeta do mesmo tamanho porque o aluno que realizou a entrega ponto-a-ponto de meios de incorrectly dispensada a partir da marca de 5,0 ml até à marca de 2,5 ml. Este erro irá resultar em uma cultura bacteriana que vai estar em maior concentração do que o planejado, causando diluições subseqüentes para ser incorreta. Esta propagação de erros pode resultar em uma experiência falhou que teria de ser repetido com as concentrações de células correctas.Uma aplicação da amostra para a utilização de micropipetas para transferir líquidos é mostrado na Figura 9. Estes pipetadores são usados para uma variedade de experiências em biologia molecular e microbiologia incluindo a preparação de amostras para a PCR e electroforese em gel ou inoculando meios estéreis ou tampão com volumes pequenos (menos de 1,0 ml) de células bacterianas ou de partículas fágicas. No exemplo dado, o estudante transferido 12,5 ul de tampão TE para um tubo de microcentrífuga de 1,8 ml (tubo esquerda no painel A; nota que corante foi adicionado ao tampão para facilitar a visualização do líquido no interior dos tubos de microcentrífuga claros).Este procedimento necessário o primeiro estudante para seleccionar a micropipeta correcta, neste caso um P20, e em seguida para definir o volúmetro para o volume correcto (painel B). Uma ponta foi usado que contém um tampão de algodão no final para evitar a contaminação possível que possa ser expelido a partir do cano da micropipeta de alcançar o tampão de amostra na ponta. Essa precaução não é necessária se o cuidado é tomado quando aspirar líquidos para as pontas, pressionar o êmbolo lentamente de modo que o líquido não espirrar o barril pipetador. Erros técnicos pode ocorrer que resultam em transferência de volumes incorrectos. Por exemplo, você pode selecionar a micropipeta errada para o trabalho ou definir o volúmetro na micropipeta correta para um volume incorreto. Antes de mergulhar a ponta para o buffer, você pode empurrar o êmbolo após a primeira parada, causando um excesso de buffer para ser desenhado na ponta ao liberar o êmbolo. Alternativamente, você não pode mergulhar a ponta longe o suficiente no buffer, para que o ar é puxadopara dentro da ponta, em vez de tampão. Você pode esquecer para empurrar o êmbolo para a segunda parada na dispensação de tampão dentro do tubo de microcentrífuga causando menos do que o volume desejado a ser lançado a partir da ponta. O tubo direito no painel A da Figura 9 mostra um tubo de microcentrífuga contendo o volume incorrecta do tampão em relação ao tubo do lado esquerdo. Em vez de dispensar 12,5 uL de tampão, o estudante dispensado 125 uL. Neste caso, embora os números são definidas de forma idêntica no volúmetro, o micropipeta errado foi seleccionado para o trabalho (o estudante utilizado um P200 em vez de um P20; painel B), resultando na entrega de um volume substancialmente maior de tampão. Se esta solução estava a ser utilizado para preparar uma mistura de reagentes para uma aplicação, tal como PCR, então este erro irá alterar a concentração final de todos os reagentes adicionados posteriormente ao mesmo tubo. Por conseguinte, é improvável que a experiência será bem sucedida, uma vez que os procedimentos de biologia molecular, taiscomo PCR exigir que todas as componentes a estar em concentrações específicas para a reacção para funcionarem correctamente.
Porque nem sempre é viável para garantir micropipetas (especialmente dentro do barril) são estéreis, as soluções de reserva podem ser contaminados causando até mesmo os esforços de solução de problemas a falhar quando a realização de experimentos. Se estiver usando micropipetas para transferir soluções estéreis, é altamente recomendável que as alíquotas das soluções de reserva (mídia, buffer, água) ser feita utilizando uma técnica asséptica com pipetas sorológicas. É comum a manter a soluções de reserva em 15 ml ou 50 ml tubos cónicos estéreis. Estes são frequentemente mais fácil de manipular durante a operação uma micropipeta e podem ser substituídos com uma nova porção da solução de estoque se contaminada durante as transferências de volume.

Figura 1. Campo estéril criado por updraft de Bunsen chama do queimador. Para minzar a contaminação de soluções estéreis e culturas, é fundamental que todas as manipulações ser realizada no campo estéril. Os aros de tubos de vidro de cultura e frascos devem ser passados através da ponta do cone azul, a parte mais quente da chama. Tubos de plástico e dicas não pode ser inflamado - estas devem ser pré-esterilizado por métodos alternativos antes da utilização.

Pipetas Figura 2. Sorológicos utilizado para a transferência asséptica de líquidos. (A) Mostrado da esquerda para a direita são desenhos de 25 ml, 10 ml, e 5 pipetas ml. (B) pipetas serológica pode ser de plástico ou de vidro. Pipetas de plástico são descartáveis (um tempo de uso) e normalmente são embalados individualmente em papel e plástico mangas em que todas as superfícies são estéreis (lado esquerdo). Pipetas de vidro pode ser usado várias vezes desde que sejam limpos e esterilizados entre usos; estes normalmente são armazenados em caixas metálicas (à direitalado).

Figura 3. Pipetas sorológicas são de dois tipos: TC ("para conter") ou TD ("entregar"). É mostrado o rótulo de motivos de uma pipeta de TD de 5 ml.

Figura 4. Técnica asséptica. Quando aspirar líquidos de uma garrafa, frasco ou tubo com tampas, nunca coloque a tampa sobre a bancada. Em vez disso, mantenha a tampa na mesma mão de ajuda de pipeta ao manipular o recipiente contendo o líquido com a mão oposta, como mostrado.
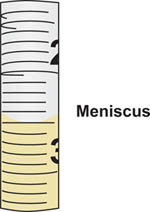
Figura 5. Menisco formado na elaboração líquido em uma pipeta sorológica. O volume corresponde à marca de graduação na pipeta onde a parte inferior do menisco se alinha. Neste exemplo, o menisco se alinha com a 2,5 ml gradua ção marca.

Figura 6. Micropipeta de canal único. (A) é mostrado um micropipeta amostra com uma ponta de plástico ligado ao fundo do suporte da ponta do tambor. Indicados são os locais do volúmetro, a roda de polegar para alterar a configuração volúmetro, o titular da ponta do tambor, a ponta botão ejector, eo botão de pressão para o êmbolo. (B) Two-parar sistema de êmbolo em uma micropipeta.

Figura 7. Usando pipetas sorológicas para transferir mídia em estéreis de 125 balões. O balão esquerdo tem 25 ml de meio apenas (LB), enquanto o balão direita é uma cultura de E. coli resultantes da inoculação de LB com células, em seguida, incubando durante a noite a 37 ° C. Note como os meios de comunicação no balão da direita é turva, devido ao crescimento celular.
e 8 "src =" files/ftp_upload/2754/2754fig8.jpg / "/>
Figura 8. Usando pipetas serológicos para transferir meios em tubos de ensaio estéreis. (A) O tubo da esquerda contém 5 ml de uma E. puro cultura coli, enquanto que o tubo direito contém 5 ml de uma cultura de células contaminadas bacteriana. Observe as diferenças nas características de crescimento entre as duas culturas. Embora ambos são turvas, a cultura à direita foi contaminado com um fungo ou outros microrganismos transportados pelo ar dando a cultura de uma cor diferente e consistência de que o esperado para E. células de Escherichia. (B) O tubo de cultura esquerda contém 3,5 LB ml enquanto que o tubo direito contém apenas 2,5 LB ml. Esta diferença de volume resultou de um erro feito durante a realização de um fornecimento de ponto a ponto-de meios de comunicação para os tubos.

A Figura 9. Usinmicropipetas g para transferir tampão em tubos de microcentrífuga estéreis. (A) O tubo de microcentrífuga esquerdo contém apenas 12,5 ul de tampão TE, enquanto o tubo direito contém 125 uL. Note-se que um corante foi adicionado ao tampão para facilitar a visualização do líquido no interior dos tubos de microcentrífuga claras. (B) O volúmetro esquerdo é a partir de uma micropipeta P20, enquanto que o volúmetro direita é de uma micropipeta P200. Um erro comum é selecionar o micropipetador errado. Embora os números são definidas de forma idêntica no volúmetro P20 e P200, a selecção dos resultados Micropipeta erradas em transferência de volumes incorrectos.

Figura 10. Capuz laminar de fluxo usado para evitar a contaminação de soluções e de culturas. Mostrado é uma cabine de segurança biológica aprovada para o trabalho com BSL-2 organismos.
Discussão
A técnica asséptica refere-se a um conjunto de procedimentos de rotina feito para prevenir soluções estéreis e culturas de ser contaminado por microorganismos indesejados no laboratório. Tais técnicas são essenciais para as experiências que requerem células em crescimento. Embora um ambiente de trabalho que é completamente estéril não pode ser alcançado, os procedimentos, tais como desinfecção de superfícies de laboratório, criando um campo esterilizado usando um bico de Bunsen, limitando a exposição de culturas não niveladas e meios de comunicação para o ar, esterilizando materiais, tais como frascos, tubos e pipetas de vidro, e evitar o contato de instrumentos esterilizados com os não-estéreis superfícies reduz a possibilidade de contaminação de soluções e culturas em um experimento. O objetivo é que esses procedimentos de precaução para se tornar uma segunda natureza, o que vem com treino e prática, enquanto trabalhava em um laboratório.
Transferências de volume com soluções estéreis e culturas, usando instrumentos como pipetas sorológicas e microfoneropipettors são um de muitos tipos de técnicas de rotina feitas em laboratório. Diferentes aplicações experimentais chamar de instrumentos capazes de transferir volumes distintos, mas precisos e exatos. Pipetas serológicos são utilizados em laboratórios de microbiologia para preparar culturas de células que requerem meios preparações envolvem volumes mililitros, enquanto micropipetas são essenciais para as experiências de biologia molecular que necessitam apenas quantidades microlitros de soluções. Quando uma técnica asséptica é praticado com estes instrumentos, a contaminação é minimizado durante as transferências de volume independentemente da quantidade de líquido ou tipo de experimento.
Apesar de não ser discutido neste protocolo, um meio de outros vulgarmente utilizados para prevenir a contaminação é trabalhar dentro de uma câmara de fluxo laminar (Figura 10). Este equipamento é crítico para a cultura de tecidos e para experiências realizadas com microorganismos classificados como BLS-2 ou superior. A capela de fluxo laminar contém um HEPA (alta eficiênciaar filtro de partículas) que remove contaminantes do ar a partir do ar que flui para o capô, evitando ar não filtrado a partir da sala de permeando o espaço de trabalho. Digno de nota, um bico de Bunsen não pode ser utilizado dentro de uma câmara de fluxo laminar porque o calor da chama interrompe o fluxo de ar essencial para a funcionalidade do capuz.
Muitas vezes, é útil para verificar a qualidade de sua técnica asséptica ao realizar experimentos. Para confirmar as soluções e meios de cultura não ficam contaminados durante a manipulações experimentais, sempre preparar um controlo negativo. Por exemplo, se a preparação de tubos de caldo para o crescimento de culturas bacterianas, não inocular um tubo deixando apenas meios estéreis. Incubar o meio ao lado dos tubos inoculados em seguida inspeccionar tubo de controlo não inoculado para sinais de contaminação, tais como turbidez de crescimento das células não desejadas não intencionalmente introduzido dentro do tubo. Se o tubo de controlo está contaminado, o tubo experimentalé provável estão contaminados, bem como, a experiência e terá que ser repetido. Estas medidas de precaução deve ser feito com cada experimento.
Divulgações
Não tenho nada para revelar.
Agradecimentos
Agradecimentos especiais a Cori Sanders em projetos da IROC para a preparação de ilustrações e Kris Reddi na UCLA para a criação de culturas de amostras para as figuras. O financiamento para este projeto foi fornecido pelo HHMI (HHMI Grant No. 52006944).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Caldo LB | Difco | 244620 | Receita também disponível em referência 6 |
| TE Buffer: | |||
| EDTA sal dissódico dihidratado | Sigma | E5134 | |
| Trizma-HCl | Sigma | T-3253 | |
| CiDecon | Decon Laboratories, Inc. | 8504 | Desinfetante |
| Etanol | Fisher Scientific | A406 | Para utilização como desinfectante, preparar a 70% (v / v) com água destilada |
Referências
- Barker, K. At the Bench: A Laboratory Navigator. , Cold Spring Harbor Laboratory Press, Cold Spring Harbor. New York. (1998).
- Biosafety in Microbiological And Biomedical Laboratories (BMBL). , 5th Ed, US Department of Health and Human Services (DHHS), Centers for Disease Control and Prevention (CDC) and National Institutes of Health (NIH), U.S. Government Printing Office. Washington DC. Available from: http://www.cdc.gov/biosafety/publications/bmbl5/index.htm (2009).
- Bykowski, T., Stevenson, B. Aseptic Technique. Current Protocols in Microbiology. Appendix 4, Appendix 4D(2008).
- Coté, R. J. Aseptic Technique for Cell Culture. Current Protocols in Cell Biology. Chapter 1, Unit 1.3(2001).
- Grimes, S. E. A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. RAP Publication. AC802/E, 12-13 (2002).
- Guzman, K. Pipetting: A Practical Guide. The American Biology Teacher. 63 (2), 128-131 (2001).
- Jordan, T., et al. RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , Howard Hughes Medical Institute. (2008).
- Sambrook, J., Russell, D. W. Molecular Cloning - A Laboratory Manual. , 3rd Ed, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 978-087969576 (2001).
- Seidman, L. A., Moore, C. J. Basic Laboratory Methods for Biotechnology: Textbook and Laboratory Reference. , Prentice Hall, Inc. Upper Saddle River, New Jersey. (2000).
- Pipettes, Calibration & Repair Service - Pipette.com [Internet]. , Available from: http://pipette.com/public/staticpages/guidetopipetting.aspx (2012).
- On-Line Resources for Biology: Table of Contents [Internet]. , Available from: http://abacus.bates.edu/~ganderso/biology/resources/index.html (2012).
- PIPETMAN P User's Guide. , Gilson Inc. Available from: http://www.gilson.com/Resources/LT801120_a_eng_030209%20BD.pdf (2012).
- Sterile Technique - Laboratory Wiki [Internet]. , Available from: http://lab.wikia.com/wiki/Sterile_Technique (2012).
- Air displacement pipette - Wikipedia, the free encyclopedia [Internet]. , Available from: http://en.wikipedia.org/wiki/Air_displacement_pipette (2012).
- Disinfectant - Wikipedia, the free encyclopedia [Internet]. , Available from: http://en.wikipedia.org/wiki/Disinfectant (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados