Method Article
BALB/c-nu 마우스의 간암종 확립 및 Sanleng Jiashen 공식의 치료 효과 조사
요약
여기에서는 정립소 간세포암이 있는 BALB/c-nu 마우스에 대한 Sanleng Jiashen 공식의 치료 및 혈관 억제 효과를 조사하기 위한 단계별 프로토콜을 제시합니다.
초록
간암의 치사율과 화학 약물에 대한 내성으로 인해 간암에 대한 전통적인 약초의 효과적인 처방을 모색하지 않을 수 없었습니다. 반복 가능하고, 조작하기 쉬우며, 간암의 병태생리학적 과정을 고도로 모방한 동물 모델은 효과적인 약물 후보를 성공적으로 스크리닝하기 위한 전제 조건입니다. 한편, 신뢰할 수 있는 약물 효능 평가 지표 및 수단은 항간암 약물 연구 및 개발의 보증이기도 합니다.
Sanleng Jiashen 공식, Sparganium stoloni erum, Buch를 함유 한 중국 전통 의학의 대표적인 처방전. -햄. (Sanleng), Panax 인삼 C. A. Mey. (인삼), Rheum officinale Baill. (대황) 및 Ligusticum chuanxiong Hort. (Chuanxiong)는 간에 영양을 공급하고 열을 맑게 하며 독소를 제거하고 혈액 순환을 촉진하여 간암을 치료하기 위해 처방됩니다. 이 실험 프로토콜은 동결건조된 Sanleng Jiashen 공식의 제조 및 BALB/c-nu 마우스에서 제자리 간암의 확립 과정을 설명합니다. 조직병리학적 염색, 암 마커의 면역조직화학적 검출, 생쥐의 생체 내 이미징 및 병아리 배아 융모막 막 검사를 사용하여 간암 조직의 악성 증식에 대한 Sanleng Jiashen 공식의 억제 및 항혈관신생 효과를 조사했습니다. 이 데이터는 Sanleng Jiashen 공식이 종양 질량 부피 감소, 병리학적 손상 개선 및 암 마커 ki67 수치 저하로 나타나는 간암 조직의 악성 증식에 효과적으로 저항할 수 있음을 보여줍니다.
혈관 신생의 우수한 억제는 또한 Sanleng Jiashen 공식이 간암의 진행과 악화를 치료하고 예방할 수 있는 잠재력을 가질 수 있음을 시사합니다. 전체 실험 계획은 쥐 간암 치료에서 전통 의학 구성 요소의 포괄적인 프로세스를 보여주며, 이는 간암 모델의 수립 및 최적화, 간암 예방 및 치료를 위한 약물 연구 및 개발에 대한 참고 자료를 제공합니다.
서문
간암은 간에서 발생하는 치명적인 암으로, 전 세계적으로 암 관련 사망의 두 번째로 흔한 원인입니다1. 미국과 일부 개발도상국의 간 질환 발병률은 높은 수준을 보이고 있으며, 2030년까지 전 세계적으로 100만 명 이상의 간암 환자가 발생할 수 있습니다2. 흡연, 비만, 음주 등 건강에 해로운 생활 습관과 B형 간염, C형 간염 및 기타 바이러스의 파괴로 인해 간암의 발병률과 사망률은3년마다 크게 증가하고 있습니다. 간암은 조직학적 특징이 다르고 예후가 좋지 않은 이질적인 악성 종양으로, 간세포암, 간내 담관암, 섬유층암 등 발병률이 매우 넓다4. 간암은 진행된 단계에서 진단되는 경우가 많으며, 많은 진행성 환자는 방사선 치료를 받을 수 없다5. 멀티키나아제 억제제인 소라페닙(sorafenib)은 진행성 간암 환자에게 널리 받아들여지는 약물이지만, 단기간 내에 상당한 내성이 생기는 경우가 많다6. 현재 면역관문억제제인 PD-1과 PD-L1과 소라페닙을 병용하여 간암의 발병을 조절하는 데 어느 정도 진전을 이루었지만, 치료 효과에 대해서는 여전히 논란의 여지가 있다7.
정소성 간암은 초기 유형의 간암으로, 암세포가 간 조직 주위로 퍼지거나 장기 간 전이가 발생하지 않았으며 간 기능에 큰 영향을 미치지 않았다8. 간암은 일반적으로 뚜렷한 불편감 증상이 나타나지 않기 때문에 일부 환자는 경미한 간 통증, 피로감 및 기타 증상을 보일 수 있다9. 임상 실습에서 간의 컬러 도플러 초음파와 향상된 컴퓨터 단층 촬영 검사는 간에서 상당한 공간 점유 병변을 진단할 수 있습니다10. 전이되지 않고 전이되지 않은 국소 간암은 수술로 제거할 수 있지만, 수술의 위험과 환자에게 불가피한 심리적 부담이 있다11. 화학방사선 요법은 간암 세포의 전부 또는 일부를 사멸시킬 수 있으며, 약물 치료를 받는 환자의 장기 면역 억제는 치료 효과에 영향을 미치고 다른 질병의 위험을 증가시킬 수 있다12. 따라서 조기 간암 예방 및 치료를 위한 안전하고 효과적인 약물 요법을 찾는 것이 간암의 진행과 악화를 억제하는 열쇠입니다.
간암을 치료하는 한의학의 원리는 신체 내의 균형과 조화의 개념에 기반을 두고 있습니다. 한의학에서는 간암을 기에 영향을 미치는 기(氣)로 알려진 신체 에너지의 불균형 또는 부조화로 간주합니다13. 간암에 대한 한의학 치료에는 한약, 침술, 식이 요법 및 생활 방식 권장 사항을 포함한 다양한 접근 방식이 포함됩니다. 원리는 기의 균형을 회복하고, 신체의 방어 기제를 강화하며, 신체의 자체 치유 능력을 촉진하는 것입니다14,15. 중국 전통 의학에서 간암은 "고막"과 "간 축적" 범주에 속합니다. 일찍이 "황제의 내경(內國堂)"에 그 증상에 대한 상세한 기록이 있을 때부터, 간암은 혈액 정체와 정치 결핍으로 인해 발생하며, 혈액 정체를 제거하고, 고막을 제거하고, 신체 저항력을 강화하여 체질을 공고히 함으로써 치료된다13. Sanleng 알약은 Yuan 왕조의 유명한 의사 인 Luo Tianyi가 쓴 "Weisheng Baojian"이라는 책에서 유래했습니다. 그것은 Sparganium stoloni erum, Buch의 세 가지 종류의 약물로 구성되어 있습니다. -햄. (Sanleng), Ligusticum chuanxiong Hort. (Chuanxiong) 및 Rheum officinale Baill. (대황). 이 세 가지 종류의 약물은 간 경락에 진입하여 간암 치료에 치료 효과를 가질 수 있다14. Sanleng Jiashen 공식은 Sanleng 16g, Panax 인삼 C.A.Mey 16g으로 구성됩니다. (인삼), 대황 8g, Chuanxiong 2g(그림 1)은 간을 튼튼하게 하고, 열을 제거하고, 독소를 제거하고, 혈액 순환을 촉진하는 데 처방됩니다. 이 허브는 항암 특성이 있으며 종양 성장을 줄이고 증상을 완화하며 전반적인 웰빙을 개선하는 데 도움이 되는 것으로 여겨집니다. 이전의 체외 실험에서 Sanleng Jiashen 공식은 간암 세포의 증식을 억제 할 수 있습니다15. 그러나 간암에 대한 한약 화합물의 억제 효과를 효율적이고 합리적으로 평가하는 방법은 무엇입니까? BALB/c-nu 마우스 제자리 간암 모델을 확립함으로써 간암 및 혈관 신생에 대한 Sanleng Jiashen 공식의 억제 효과를 주로 소동물 라이브 이미징 및 병아리 배아 융모막 막 검사를 통해 조사했습니다.
프로토콜
특정 병원체가 없고 생후 5주, 체중이 18-22g인 BALB/c-nu 수컷 누드 마우스를 길림대학교 변혁의과대학 동물실험센터에서 먹였습니다. 먹이 조건은 22 °C-24 °C, 상대 습도 40 % -60 %였습니다. 실험동물 허가 번호는 SYXK(Ji) 2018-0006이며 실험 과정은 길림대학교 윤리위원회의 규칙 및 규정을 준수하며 동물 윤리 승인 번호는 20221228-01입니다.
1. 동결 건조 Sanleng Jiashen 공식15의 준비
- 지능형 달인 냄비(재료 표 참조)에 Sanleng 16g, 인삼 16g, 대황 8g, Chuanxiong 2g을 넣고 실온에서 30분 동안 탈이온수 294mL에 담가둡니다. 가열하고 끓인 후 30°C에서 100분 동안 계속 요리하고 이중 의료용 거즈를 통해 액체를 걸러냅니다( 재료 표 참조). 잔여물에 252mL의 탈이온수를 넣고 100°C에서 30분간 조리한 후 이중 거즈로 액체를 걸러냅니다.
- 깨끗한 스테인리스 스틸 접시에 1.1단계의 여과액을 모으고 -80°C에서 12시간 동안 동결합니다( 재료 표 참조).
- 1.2단계의 Sanleng Jiashen 공식을 진공 동결 건조기( 재료 표 참조)(콜드 트랩 온도: -55°C)에 넣고 48시간 동안 건조하여 Sanleng Jiashen 공식의 동결 건조 분말을 얻습니다.
2. 루시페라아제를 안정적으로 발현하는 HCCLM3 세포주의 구축16
- 5 × 105 cells/well과 함께 24-well plate(재료 표 참조)에 HCCLM3 세포 현탁액 1.0mL를 추가하고 세포 배양기(37°C, 5% CO2, 재료 표 참조).
- 2.1단계에서 세포 상등액을 버리고 100μL의 0.25% 트립신 용액을 첨가하여 세포 배양기에서 1분 동안 세포를 분해합니다( 재료 표 참조). 300 μL의 완전한 배지를 추가하고 피펫을 사용하여 부착된 세포를 제거하고 분해를 종료합니다. 모든 세포 현탁액을 수집하여 15mL 원심분리 튜브에 넣고 실온에서 1,000×g으로 5 분 동안 가열 합니다. 상등액을 버린 후 완전한 배지 1mL를 추가하고 피펫팅으로 혼합합니다.
- 2.2단계에서 4 × 103 HCCLM3 세포/웰의 세포 현탁액 100μL를 96웰 플레이트에 추가하고 세포 배양기에서 24시간(37°C, 5% CO2, 재료 표 참조) 동안 배양합니다.
- 2.3단계에서 96웰 플레이트에 0.27μL의 GFP 렌티바이러스를 추가하고 세포 배양기에서 15시간(37°C, 5% CO2, 재료 표 참조) 동안 배양합니다. 세포 상등액을 버리고 100μL의 완전 배양 배지를 첨가한 다음 488nm의 여기 파장과 507nm의 방출 파장에서 형광 현미경을 사용하여 이미지를 획득합니다( 재료 표 참조).
- GFP 렌티바이러스 2mL를 대체하고 24시간 동안 배양을 계속합니다. GFP 렌티바이러스가 없는 완전 배양 배지 2mL를 24시간 더 교체합니다.
참고: GFP 렌티바이러스의 HCCLM3 세포로의 transfection 효율은 도립 형광 현미경에서 볼 수 있듯이 80%였습니다. - 2.1단계의 2 × 105 세포 현탁액 5mL를 60mm 페트리 접시에 추가하고 세포 배양기에서 24시간 동안 배양합니다.64.5μL의 루시페라아제를 추가하고 세포 배양기에서 15시간 동안 배양을 계속합니다(37°C, 5% CO2, 재료 표 참조).
- 상등액을 버리고 5mL의 완전한 배지를 첨가하여 세포가 페트리 접시에서 90% 융합될 때까지 배양을 계속합니다. 세포 상등액을 버리고 PBS 2 x 1mL로 세척한 후 0.25% 트립신 용액 1mL를 첨가하여 세포 배양기에서 1분(37°C, 5% CO2, 재료 표 참조) 세포를 분해합니다. 3mL의 완전한 배지와 피펫을 위아래로 첨가하여 부착 세포를 확보하고 분해를 종결시킵니다. 후속 마우스 주입을 위해 모든 세포 현탁액을 수집합니다.
참고: 충분한 수의 세포를 얻기 위해, 세포를 지속적으로 계대측정하고 배양하였다.
3. 간암 상피 내 BALB/c-nu 누드 마우스 모델 구축 및 치료15
- 2.7단계에서 루시퍼라제로 transfection된 1 × 107 HCCLM3 세포 100 μL와 매트릭스 접착제 100 μL( 재료 표 참조)를 1.5 mL 원심분리 튜브( 재료 표 참조)에 추가하고 1 mL 피펫과 가볍게 혼합합니다( 재료 표 참조).
참고: 용액 준비의 전체 과정은 매트릭스 접착제가 경화되는 것을 방지하기 위해 얼음 위에서 수행해야 합니다. - BALB/c-nu 누드 마우스의 왼쪽 및 오른쪽 겨드랑이를 요오스핀으로 소독하고( 재료 표 참조) 알코올로 탈요오드화합니다( 재료 표 참조).
- 3.1단계의 HCCLM3 세포와 매트릭스 접착제 혼합물 100μL를 1mL 일회용 주사기로 BALB/c-nu 누드 마우스의 왼쪽 및 오른쪽 겨드랑이에 천천히 주입합니다.
참고: 약 10일 후, BALB/c-nu 누드 마우스는 양측 겨드랑이 주사 부위에 약 0.5cm3의 종양 덩어리가 발생했습니다. - 3.3단계에서 BALB/c-nu 누드 마우스를 1%, 50mg/kg 펜토바르비탈 나트륨의 복강 내 주사로 마취합니다. 안과용 가위와 핀셋으로 양쪽 겨드랑이의 피부를 절개하고(재료표 참조), 피하 종양 덩어리를 부드럽게 벗겨 예냉각된 PBS 완충액(재료표 참조)이 들어 있는 세포 배양 접시(재료표 참조)에 넣고 메스로 1mm3조각으로 자릅니다(재료표 참조).
참고: BALB/c-nu 누드 마우스의 겨드랑이 종양 종괴는 종양 세포 활성을 유지하고 모델의 성공률을 높이기 위해 0.5시간 이내에 얼음에서 채취해야 합니다. 표본 채취가 끝날 때, 생쥐는 경추 제거에 의해 죽었다. 종양에 괴사성 부분이 있는 경우, 종양을 제거하고 종양은 흰 물고기 흰 종양만 남겨 정소성 암 이식 시 감염을 예방해야 합니다. - BALB/c-nu 누드 마우스에 1%의 펜토바르비탈 나트륨을 복강내 마취하고( 재료 표 참조), 요오드로 복부를 소독하고( 재료 표 참조), 알코올로 탈요오드화합니다( 재료 표 참조).
- 안과용 가위와 핀셋( 재료표 참조)을 사용하여 xiphoid 돌기 아래 약 1cm 위치에서 약 45° 절개를 0.5cm 절개하여 간을 노출시키고 간을 부드럽게 눌러 간 조직을 짜내고 계량지로 간을 고정합니다.
참고: 면봉이나 막대기를 생쥐의 갈비뼈 아래에 놓아 간을 효과적으로 노출시킬 수 있습니다. - 3.4단계에서 10mL의 일회용 주삿바늘로 작은 종양 조직 조각을 채취하여 간과 평행하게 약 0.5cm 떨어진 간에 종양 덩어리를 이식하여 간낭 아래에 고정하고 천천히 바늘을 빼냅니다.
참고: 1mL 일회용 주사기를 사용하여 녹은 매트릭스 접착제 2방울을 떨어뜨리고 우발적인 미끄러짐이나 출혈이 없는 종양 덩어리를 관찰한 다음 외과적 절개 부위를 봉합합니다. - 집게를 고정하는 12cm 바늘과 6-0 수술 봉합사로 절개 부위를 닫습니다( 자료표 참조). 감염을 예방하기 위해 수술 부위에 에리트로마이신 안연고( 재료 표 참조)를 바르십시오. 생쥐를 가열된 패드( 재료 표 참조)에 놓고 깨어난 후 별도의 우리에 보관합니다.
- 모델링 후 첫날부터 7.5mg/kg 소라페닙 및 싼렝지아셴 포뮬러(7.8g/kg, 15.6g/kg 및 31.2g/kg)를 3.8단계의 마우스에 14일 동안 하루에 한 번 투여합니다. 모델 그룹의 마우스에 동일한 양의 생리식염수를 투여합니다.
4. In vivo 이미징 평가
참고: 14일째에 라이브 이미징은 투여 종료 후 1시간 후에 수행되었습니다.
- 컴퓨터와 생체 내 이미징 기기의 전원을 켭니다( 재료 표 참조). 바탕 화면에서 Living Image 아이콘을 두 번 클릭하여 프로그램을 시작합니다. 제어판에서 IVIS 시스템 초기화 를 클릭하여 전체 IVIS 시스템을 시작합니다.
알림: 기기가 자체 테스트를 완료한 후 제어판의 온도 상태 표시등이 빨간색으로 바뀝니다. 온도가 떨어지고 표시등이 녹색으로 바뀐 후 약 5-10분 정도 기다리면 이미지 획득을 수행할 수 있습니다. - 생쥐의 복부를 알코올로 소독하고 일회용 주사기로 체중 g당 10μL D-루시페린( 재료 표 참조)을 복강내에 주입합니다. 1 %, 50 mg / kg 펜토 바르비탈 나트륨의 복강 내 주사로 마우스를 마취시킵니다.
참고: D-루시페린을 멸균 PBS로 15mg/mL로 희석했습니다. - 4.3단계에서 마취한 마우스를 관찰 상자에 넣고 문을 닫고 제어판에서 노출 시간을 30초로 설정합니다. 모드 선택: 샘플 유형에 따라 발광 을 선택하고 기본적으로 자동 프로그램을 선택한 다음 획득 을 눌러 이미지를 획득합니다.
- 살아있는 이미지 데이터 저장을 클릭하고 모든 살아있는 이미지 데이터 파일을 선택한 다음 컴퓨터 바탕 화면에 저장합니다.
- 메인 화면에서 Exit in Living 이미지를 클릭합니다. 카메라 전원, 이미징 기기 전원 및 컴퓨터 전원을 차례로 끕니다.
- 이미징 후, 마취된 마우스를 경추 탈구로 안락사시킵니다(1%, 50mg/kg 펜토바르비탈 나트륨의 복강 내 주사).
5. Hematoxylin-eosin 염색17
- 4.7 단계에서 마우스의 신선한 간 조직을 4 % 파라 포름 알데히드에 48 시간 동안 고정 한 다음 파라 포름 알데히드를 씻어 내기 위해 매번 5 분 동안 흐르는 물로 3 번 헹굽니다 ( 재료 표 참조).
- 5.1단계에서 30% 에탄올, 50% 에탄올, 70% 에탄올, 95% 에탄올
 , 95% 에탄올
, 95% 에탄올  및 무수 에탄올을 차례로 1시간 동안 탈수합니다( 재료 표 참조).
및 무수 에탄올을 차례로 1시간 동안 탈수합니다( 재료 표 참조). - 탈수된 간 조직을 5.2단계에서 50% 에탄올, 50% 자일렌, 자일렌
 , 자일렌
, 자일렌  , 자일렌
, 자일렌  등을 차례로 넣어 1시간 동안 투명하게 만든다( 재료 표 참조).
등을 차례로 넣어 1시간 동안 투명하게 만든다( 재료 표 참조).
참고: 크실렌은 휘발성이며 독성이 있으며 이 단계는 흄 후드에서 수행됩니다. - 파라핀 왁스를 녹이고 온도를 약 55°C로 유지합니다. 5.3단계의 간 조직 블록을 포매를 위한 왁스 용액으로 채워진 파라핀 임베딩 기계( 재료 표 참조)에 넣습니다.
- 5.4 단계에서 마우스 간 조직의 내장 된 왁스 블록을 파라핀 슬라이스 기계 ( 재료 표 참조)에 고정하고 5μm 두께의 조각으로 자르고 50 °C의 물에 슬라이스를 완전히 평평하게 놓고 슬라이드로 퍼냅니다. 마지막으로 70 °C에서 20 분 동안 건조하기 위해 생물학적 조직 베이킹 기계에 넣습니다 ( 재료 표 참조).
- 5.5 단계에서 5 μm 섹션을 크실렌
 , 크실렌
, 크실렌  , 무수 에탄올
, 무수 에탄올  및 무수 에탄올
및 무수 에탄올  에 10 분 동안 연속적으로 담근 다음 95 % 에탄올, 90 % 에탄올, 80 % 에탄올 및 70 % 에탄올에 각각 5 분 동안 담그고 마지막으로 탈랍 처리를 위해 증류수로 세척합니다 ( 재료 표 참조).
에 10 분 동안 연속적으로 담근 다음 95 % 에탄올, 90 % 에탄올, 80 % 에탄올 및 70 % 에탄올에 각각 5 분 동안 담그고 마지막으로 탈랍 처리를 위해 증류수로 세척합니다 ( 재료 표 참조). - 탈수된 5μm 두께의 파라핀 왁스 간 조직 부분을 헤마톡실린으로 8분 동안 염색한 다음 흐르는 물로 헹굽니다.
- 1% 염산 용액을 10초 동안 구별하고 흐르는 물로 30분 동안 헹굽니다( 재료 표 참조).
- 0.5% 에오신 용액으로 1분 동안 염료합니다( 재료 표 참조).
- 슬라이스를 95% 알코올
 , 95% 알코올
, 95% 알코올  , 무수 에탄올
, 무수 에탄올  , 무수 에탄올
, 무수 에탄올  , 자일렌
, 자일렌  , 크실렌
, 크실렌  에 각각 5분 동안 넣어 탈수시킵니다( 재료 표 참조).
에 각각 5분 동안 넣어 탈수시킵니다( 재료 표 참조). - 중성 껌으로 밀봉하고 도립 광 현미경으로 사진을 찍습니다( 재료 표 참조).
6. 면역조직화학 염색18
- 5.6단계에서 마우스 간의 5μm 절편에 1.5% H2O2 를 떨어뜨리고 실온에서 10분 동안 배양한 다음 2 x 5분 동안 PBS로 세척합니다( 재료 표 참조).
- 구연산 용액( 재료 표 참조)으로 5분 동안 조직을 수리하고 PBS로 3 x 5분 동안 세척합니다.
- 실온에서 0.2% 트리톤 X-100( 재료 표 참조)으로 4분 동안 배양한 다음 실온에서 0.5% 트리톤 X-100으로 4분 동안 배양하고 PBS로 세척합니다.
- 염소 혈청( 재료 표 참조)을 첨가하여 15분 동안 밀봉한 다음 PBS(1:300)로 희석한 ki67 1차 항체( 재료 표 참조)를 추가하여 4°C에서 밤새 배양합니다. PBS로 3 x 5분 동안 세탁합니다.
- PBS(1:200)로 희석한 2차 항체로 실온에서 1시간 동안 배양하고 PBS로 3 x 5분 동안 세척합니다( 재료 표 참조).
- 현상액으로 5분 동안 염색하고 이중 증류수로 헹굽니다( 재료 표 참조).
- 헤마톡실린으로 2분 동안 다시 염색하고 1% 염산 용액에서 10초 동안 분화한 다음 흐르는 물로 30분 동안 헹굽니다( 재료 표 참조).
- 슬라이스를 95% 알코올
 , 95% 알코올
, 95% 알코올  , 무수 에탄올
, 무수 에탄올  , 무수 에탄올
, 무수 에탄올  , 자일렌
, 자일렌  , 크실렌
, 크실렌  에 각각 5분 동안 넣어 탈수시킵니다( 재료 표 참조).
에 각각 5분 동안 넣어 탈수시킵니다( 재료 표 참조). - 중성 껌으로 밀봉하고 도립 광 현미경으로 사진을 찍습니다( 재료 표 참조).
7. 병아리 배아 융모막 박막 검사19
- 흰 깃털 닭 달걀( 재료표 참조)을 실온에 2시간 동안 그대로 두고 알코올을 뿌려 소독합니다. 두개골 드릴로 공기 챔버에 구멍을 뚫고( 재료 표 참조) 공기 챔버에서 최대 7일 동안 알을 부화시킵니다(배양 온도 37.8-38.2 °C, 상대 습도 65%).
알림: 부화 첫 3일 동안에는 자동 알 회전 버튼을 켜서 병아리 배아 융모막막이 껍질에 달라붙어 가짜 공기 챔버를 만드는 것을 방지합니다. - 난자 조명기에 약한/수정되지 않은 난자를 폐기합니다( 재료 표 참조). 두개골 드릴로 가짜 공기 챔버에 구멍을 뚫은 후 아이 핀셋( 재료 표 참조)으로 1 x 1cm 창을 조심스럽게 떼어냅니다( 재료 표 참조).
알림: 달걀 껍질이 병아리 배아 융모막막에 떨어지지 않아야 합니다. - 배양 8일차에 대조군을 제외한 가짜 공기실의 각 난자에 100μL의 종양세포 현탁액(1 × 106 개 세포)을 추가합니다. 약물 그룹에는 100μL의 소라페닙 용액과 Sanleng Jiashen 공식을 추가합니다. 대조군 및 모형 그룹에 100μL의 PBS를 추가합니다.
참고: 종양 세포 현탁액은 HCCLM3 세포와 매트릭스 접착제로 동일한 부피로 구성됩니다. 약물 농도는 7.5mg/kg 소라페닙 및 산렝지아셴 공식(7.8g/kg, 15.6g/kg 및 31.2g/kg)으로 설정됩니다. - 창문을 투명 드레싱으로 덮고( 재료 표 참조) 알코올 스프레이( 재료 표 참조)로 소독합니다. 배양 7일 후 투명 드레싱을 제거하고 가짜 공기 챔버에서 1mL의 고정액(메탄올:아세톤 = 1:1)( 재료 표 참조)을 추가하여 30분 동안 고정합니다.
- 1mL 주사기로 고정제를 버립니다. 안과 가위로 가짜 공기 챔버에서 ~5 x 5cm 융모막막을 자르고 60mm 페트리 접시에 넣습니다.
알림: 혈액이 있는 병아리 배아 융모대류막의 경우 PBS로 헹굽니다. 병아리 배아의 경우 조직에 부착된 융모막대질막을 안과 가위로 분리하십시오. - 7.5단계의 융모막막을 광학 현미경 아래에 놓고 혈관을 촬영합니다( 재료 표 참조).
결과
그림 2A에서 볼 수 있듯이 BALB/c-nu 마우스의 제자리(in-situ) 간암 모델을 구축하고 Sanleng Jiashen 공식의 항종양 효과를 평가했습니다. 그림 2B는 Sanleng Jiashen 공식이 간 종양의 성장을 크게 억제할 수 있음을 보여줍니다. 병리학적 결과는 대조군과 비교하여 모델 그룹의 종양 병소가 주변 조직과의 경계가 명확하고, 종양 병소가 더 크며, 결절 확장 및 압박 성장이 있음을 보여주었습니다. 한편, 종양 조직 내 종양 세포의 배열은 간 소엽 구조가 없이 무질서합니다. 이에 따라 종양 세포는 덜 이질적이며 종양체 주위에 큰 혈관이 있습니다. 모델 그룹과 비교했을 때, Sanleng Jiashen 공식의 농도가 다른 종양 면적이 감소했는데, 이는 약물 개입 후 생쥐의 상피내암의 종양 크기가 억제되었음을 나타냅니다(그림 2C). 그림 2D의 종양 증식 마커인 ki67의 추가 면역조직화학적 결과도 Sanleng Jiashen 공식이 종양 증식을 크게 억제할 수 있음을 입증했습니다. 간 종양의 성장에 대한 Sanleng Jiashen 공식의 효과를 보다 직관적이고 정확하게 조사하기 위해 소동물 이미징을 사용하여 상피내 간암의 종양 덩어리 크기를 시각화했습니다. 그림 3에서 볼 수 있듯이, Sanleng Jiashen 공식은 간 종양의 양을 현저하게 감소시켰습니다. Sanleng Jiashen 공식이 혈관 신생 표현형을 억제하여 간암의 성장을 억제하는지 여부를 추가로 확인하기 위해 그림 4A에 따라 이 연구에서 병아리 배아 융모대립막 검사를 수행했습니다. 그림 4B,C는 대조군과 비교하여 모델 그룹의 새로운 혈관 수가 혼돈 분포에 따라 뚜렷하게 증가했음을 보여줍니다. 모델군과 비교했을 때, Sanleng Jiashen 제형의 농도가 다른 작은 혈관이 현저히 감소했고, 혈액 순환이 불충분한 상태에서 일부 큰 혈관이 파괴되어 약물 개입 후 혈관 신생이 감소한 것으로 나타났습니다.

그림 1: Sanleng Jiashen 공식의 약물 조성 및 비율. (A) 산렝(16g). (B) 인삼(16g). (C) 대황 (8g). (D) Chuanxiong (2g). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
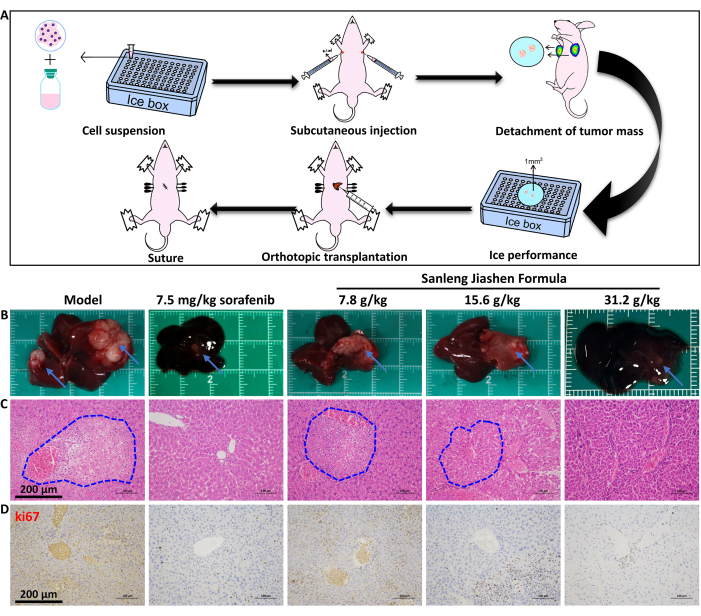
그림 2: BALB/c-nu 마우스에서 상피지 간암 모델의 확립 및 조직 염색. (A) 제자리 간암 모델의 개략도. (B) 간암 조직의 부피를 육안으로 본 것. 파란색 화살표는 간의 종양 부위를 나타냅니다. (C) 간암 조직의 병리학적 염색. 파란색 점선 원은 간 조직병리학적 절편의 종양 영역을 나타냅니다. 스케일 바 = 200 μm. (D) 간세포 암종의 ki67 면역조직화학적 염색. 스케일 바 = 200μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
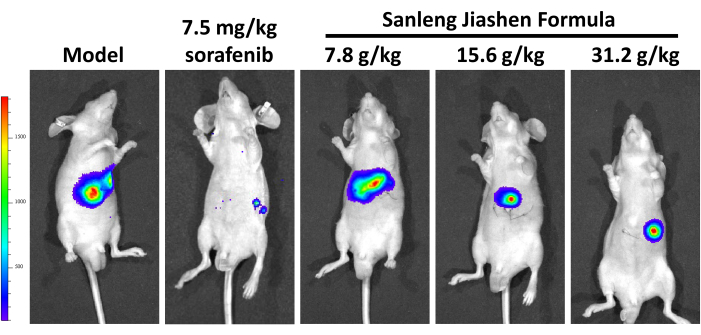
그림 3: BALB/c-nu 마우스의 정형소 간암에 대한 생체 내 이미징. 모델 그룹과 비교했을 때, Sanleng Jiashen 제형 그룹은 BALB/c-nu 마우스에서 간 종양의 농도에 따른 감소를 보여주었습니다. n = 5입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 병아리 배아 융모대립막 검사의 개략도 및 결과. (A) 닭 배아 융모막 박막 검사의 구체적인 과정. (B) 혈관 수를 영상화하는 단계. 스케일 바 = 0.2mm. (C) 병아리 배아 융모막의 혈관 면적에 대한 통계적 결과. 대조군과 비교했을 때, 모델군의 혈관 면적이 유의하게 증가하였다. 모델 그룹과 비교하여, Sanleng Jiashen 공식 그룹은 혈관 증식에서 농도에 따른 감소를 보였다. n = 3입니다. 대조군과 비교했을 때, ###p< 0.001; 모델 그룹과 비교하면 p < 0.001입니다. 데이터는 일원 분산 분석(One-way ANOVA)에 이어 Tukey의 검정으로 분석되었습니다. 데이터는 SD± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
많은 양의 증거에 따르면 Sanleng Jiashen 공식의 Sanleng, 인삼, 대황 및 Chuanxiong이 간암 치료에 약리학적 효과가 있음이 확인되었습니다. 연구에 따르면 Sanleng은 종양 세포의 증식 및 성장을 크게 억제하여 종양 세포의 침입 및 전이를 방지하고 세포 사멸을 유도하며 세포주기 및 종양 미세 환경을 조절할 수 있습니다20. 산렝의 유효성분인 캠페롤(kaempferol)은 위암(21), 전립선암(22), 간암(23)의 증식을 억제하고 자가포식을 촉진하며 산화 스트레스를 조절함으로써 위암(21), 전립선암(22), 간암(23 )의 발생 및 발병을 억제할 수 있음이 입증되었다. Myricetin은 항 종양 활성을 가진 인삼의 핵심 화합물입니다. 미리세틴(myricetin)은 세포사멸(apoptosis)을 유도하여 방광암의 성장을 억제할 수 있는 것으로 알려져 있으며(24 ), 세포주기 정지(cell cycle arrest)를 유도하여 폐선암(lung adenocarcinoma)의 증식을 차단할 수 있다24. 더 중요하게, myricetin는 angiogenesis를 금해서 간암 세포의 성장을 제한할 수 있다25. 현재 미리세틴은 유럽에서 간 보호를 위한 건강 관리 제품으로 판매되고 있으며 그 약물 가치는 더 탐구할 가치가 있습니다.
현재 진세노사이드 Rh2 및 Rg3는 종양 성장, 종양 혈관 형성, 침습 및 전이를 억제할 수 있을 뿐만 아니라 신체의 면역력을 향상시킬 수 있는 임상 항종양 약물에 일반적으로 사용됩니다26. 진세노사이드 Rg3를 주성분으로 하는 Shenyi 캡슐은 종양 환자의 Qi 결핍 증상을 개선하기 위해 판매되고 있습니다. 임상적으로 Shenyi 캡슐은 원발성 폐암27 및 간암 환자의 면역을 조절하고, 진행성 간암 환자에서 화학요법의 독성 및 부작용을 개선하며, 소라페닙 내성 환자를 위한 보조 요법 역할을 할 수 있는 것으로 여겨진다28. 또한, 진세노사이드 Rg3는 혈관신생을 억제하고 항종양 면역을 촉진하여 종양 미세환경을 재형성하고 영양분의 종양 흡수 경로를 효과적으로 차단하여 종양의 성장과 전이를 억제할 수 있다29.
대황의 두 가지 효과적인 구성 요소로서 에모딘과 알로에 에모딘은 대황이 항종양 활성을 발휘하는 핵심 화합물입니다. 증거에 따르면 에모딘은 PI3K/AKT 및 MAPK 신호 경로를 통해 체외 및 생체 내에서 대장암, 간암 및 후두암 세포의 세포사멸을 유도할 수 있습니다30. 생체 내 실험에서, emodin은 간과 신장 증식을 금하고 apoptosis를 유도해서 종양 성장을 금하기 위하여 기능을, 가능하게 개량했다31. 한편, 유방암 세포와 혈관 내피 세포의 공동 배양을 통해, 알로에 에모딘의 개입 후 공동 배양 시스템에서 인간 배꼽 정맥 내피 세포의 증식이 눈에 띄게 감소하여 알로에 에모딘이 혈관 신생 경로를 억제하여 유방암 세포의 증식을 억제할 수 있음을 나타내며32 나타났습니다. 테트라메틸피라진은 간암의 다제내성을 역전시킬 수 있으며, 그 메커니즘은 P-gp33의 발현을 억제하는 것과 관련이 있습니다. Ligusticum chuanxiong 다당류는 HepG2 세포에 대한 명백한 억제 효과가 있으며, 이는 세포주기 정지, 종양 세포 사멸 유도 및 종양 혈관 신생 억제와 관련이 있습니다34,35. 요약하자면, Sanleng Jiashen 공식은 간암 치료에 큰 잠재적 적용 가치를 가지고 있습니다. 이 프로토콜은 또한 Sanleng Jiashen 공식이 BALB/c-nu 마우스에서 제자리 간암의 증식을 억제할 수 있음을 예비 확인했으며, 혈관 신생을 억제하는 우수한 약리학적 활성을 보여주었습니다. 이러한 데이터는 간암 치료에서 Sanleng Jiashen 처방의 잠재적인 분자 메커니즘을 추가로 탐구하기 위한 참고 자료를 제공합니다.
종양 혈관 이형성증은 암 발생 및 발병의 중요한 특징입니다. 본 연구에서는 Sanleng Jiashen 공식이 종양 혈관 신생을 억제할 수 있는지 여부를 평가하기 위해 병아리 배아 융모대립막 검사를 선택했습니다. 첫째, 닭 배아를 이용한 실험은 추가적인 동물 윤리 승인이 필요하지 않으며 비용이 저렴하고 수행하기 쉽습니다. 둘째, 닭배아의 면역체계가 배양 후 15일 이내에 발달하지 않아 비교적 완벽한 종양약물 효능 평가 모델이며, 가격이 누드 마우스보다 저렴하다. 셋째, 닭 배아 알란토막 검사는 광간섭 단층촬영, 컨포칼 현미경, 자기공명영상(MRI) 및 형광 이미징을 결합하여 결과를 실시간으로 감지할 수도 있는 것으로 보고되었습니다. 작은 동물의 생체 내 이미징에서 생물 발광 또는 형광 이미징 등 발광 결과는 많은 요인의 영향을 받습니다. 예를 들어, 생물 발광 과정에서 형광 강도는 주입된 세포의 품질, 루시페라제 주입 시간 및 모델 부위의 깊이와 상당한 관련이 있습니다. 따라서 MRI 기술은 간암의 진단과 약물 효능의 평가에도 필요합니다.
요약하면, 본 논문은 상피내 간암의 BALB/c-nu 마우스 모델을 확립하고, 중국 전통 의학인 Sanleng Jiashen 공식이 혈관신생 억제와 관련이 있을 수 있는 소동물 이미징 및 병아리 배아 융모막 막 실험을 통해 상피내 간암의 증식을 효과적으로 억제할 수 있음을 확인했습니다. 이러한 확립된 방법은 간암 치료를 위한 전통 한의학의 신속하고 효율적인 스크리닝에 대한 참고 자료를 제공합니다. 그러나 간암 치료에 복잡한 성분을 포함하는 Sanleng Jiashen 공식의 물질적 기초와 분자 메커니즘은 화학 분석 기법18 과 고성능 액체 크로마토그래피 및 표면 플라즈몬 공명36,37과 같은 분자 상호 작용 연구 방법을 결합하여 더욱 명확히 할 필요가 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 작업은 중국 철학 사회 과학 재단(20VYJ070), 길림성 교육부 프로젝트(JJKH20230963KJ), 장춘 중의대학 Xinglin 학자 공학 프로젝트 2차 배치(QNKXJ2-2021+ZR25)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin solution | HyClone, America | SH30042.01B | |
| 1 mL disposable syringe | Mingankang Medical Equipment Co., Ltd., China | RWSB | |
| 1% Penicillin & streptomycin solution | Hyclone, America | SV30010 | |
| 1.5 mL centrifuge tube | Corning, America | MCT-150-C-S | |
| 12 cm needle forceps | Hesdick, China | HKQS-211 | |
| 6-0 surgical sutures | Shanghai Jinhuan Medical Equipment Co., Ltd., Shanghai, China | CR631 | |
| 75% alcohol | Sichuan Youbang Enterprise Co., Ltd., Sichuan, China | 1.00009E+11 | |
| 96-well plates | NEST, China | 701001 | |
| Acetone | Tianjin Dingfu Chemical General Plant, Tianjin, China | GB686-89 | |
| BALB/c-nu male nude mice | Beijing Weitonglihua Experimental Animal Technology Co., Ltd., Beijing, China | SYXK(Ji) 2018-0006 | |
| Biological tissue baking machine | Leica, Germany | Leica HI1220 | |
| Cell culture dish | NEST, China | NEST.706001 | |
| Citric acid solution | Wuhan Canos Technology Co., Ltd., Wuhan, China | sj1074 | |
| D-luciferin | Gold Biotechnology®, Inc., China | LUCK-100 | |
| DMEM | Hyclone, America | SH30243.01 | |
| Egg illuminator | Shandong Weizhen Incubation Equipment Company, Shandong, China | WZSDT | |
| Eosin staining solution | Hunan BKMAM Biotechnology Co., Ltd., Hunan, China | 110703061 | |
| Erythromycin eye ointment | Cisen Pharmaceutical Co., Ltd., Shanghai, China | H37022025 | |
| Fetal bovine serum | Clark, America | FB25015 | |
| Fully automatic intelligent chick incubator | Shandong Weizhen Incubation Equipment Company, Shandong, China | 29538 | |
| GFP lentivirus solution | Suzhou GenePharma Co.,Ltd., Suzhou, China | F22AZ | |
| Goat serum | Shenyang Wanlei Biotechnology Co., Ltd., Shengyang, China | WLA067 | |
| Hand-held mouse skull drill | STRONGWT, China | 190 | |
| HCCLM3 cell line | WheLab, Shanghai, China | C1010 | |
| Heating pad | Zhongke Life Technology Co., Ltd., Hangzhou, China | GEJRD-10W | |
| Hematoxylin | Hunan BKMAM Biotechnology Co., Ltd., Hunan, China | B-YH250-1 | |
| Intelligent decoction pot | Hangzhou Jiuyang living Appliance Co., Ltd., Hangzhou, China | 3003BQ | |
| Inverted fluorescence microscope | Olympus, Japan | IX73 | |
| ki67 primary antibody | Wuhan Servicebio Technology Co., Ltd., Wuhan, China | GB121141-100 | |
| Lodophor disinfectant | Cofoe Medical Technology Co.,Ltd., Hunan, China | 202110073 | |
| Luciferase | Suzhou GenePharma Co.,Ltd., Suzhou, China | E26JZ | |
| Matrix glue | Corning, America | 356234 | |
| Medical gauze | Yunnan Chenye Biotechnology Co., Ltd., Yunnan, China | 71712049971 | |
| Methanol | Guangdong Guanghua Sci-Tech Co., Ltd., Guangdong, China | 1.17001.023 | |
| Ophthalmic scissor | Hesdick, China | HKQS-209 | |
| Ophthalmic tweezer | Hesdick, China | HKCL-20 | |
| Paraffin embedding machine | Leica, Germany | EG1150H | |
| Paraffin slicing machine | Leica, Germany | Leica CM1950 | |
| Paraformaldehyde | Biosharp, China | BL539A | |
| PBS buffer | Wuhan Servicebio Technology Co., Ltd., Wuhan, China | G2156-1L | |
| Puromycin | Beijing Solarbio Science & Technology Co., Ltd., Beijing, China | P8230 | |
| Refrigerator | Thermo Scientific, America | TDE40086FV-ULTS | |
| Scalpel | Hesdick, China | HKCL-93 | |
| Secondary antibody | Wuhan Servicebio Technology Co., Ltd., Wuhan, China | GB23301 | |
| Small animal live imaging system | Caliper Life Sciences, America | IVIS Lumina XR | |
| Sorafenib | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | 284461-73-0 | |
| Transparent dressing | 3M, America | 9534HP | |
| Triton X-100 | Beijing Solarbio Science & Technology Co., Ltd., Beijing, China | T8200 | |
| Vacuum freeze dryer | Ningbo Xinzhi Biotechnology Co., Ltd., Ningbo, China | sz-10N | |
| White feather chicken eggs | Shandong Haotai Experimental Animal Breeding Co., Ltd., Shandong, China | SCXK(Lu) 20180004 | |
| Xylene | Sigma-Aldrich, , America | 534056 |
참고문헌
- Sia, D., Villanueva, A., Friedman, S. L., Llovet, J. M. Liver cancer cell of origin, molecular class, and effects on patient prognosis. Gastroenterology. 152 (4), 745-761 (2017).
- Starley, B. Q., Calcagno, C. J., Harrison, S. A. Nonalcoholic fatty liver disease and hepatocellular carcinoma: a weighty connection. Hepatology. 51 (5), 1820-1832 (2010).
- Siegel, R. L., Miller, K. D., Wagle, N. S., Jemal, A. Cancer statistics. CA-A Cancer J. Clin. 73 (1), 17-48 (2023).
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Verslype, C., et al. The management of hepatocellular carcinoma. Current expert opinion and recommendations derived from the 10th World Congress on Gastrointestinal Cancer, Barcelona, 2008. Ann. Oncol. , (2009).
- Greten, T. F., et al. Biomarkers for immunotherapy of hepatocellular carcinoma. Nat. Rev. Clin. Oncol. 20 (11), 780-798 (2023).
- Rimassa, L., Finn, R. S., Sangro, B. Combination immunotherapy for hepatocellular carcinoma. J. Hepatol. 79 (2), 506-515 (2023).
- Wu, Z. H., et al. A terrylene-anthraquinone dyad as a chromophore for photothermal therapy in the NIR-II window. J. Am. Chem. Soc. 145 (48), 26487-26493 (2023).
- Pawlik, T. M. Hepatocellular carcinoma. Sure. Oncol. Clin. N. Am. 33 (1), (2024).
- Schwarze, V., et al. Diagnostic value of contrast-enhanced ultrasound versus computed tomography for hepatocellular carcinoma: a retrospective, single-center evaluation of 234 patients. J. Int. Med. Res. 48 (6), 1-10 (2020).
- Maki, H., Hasegawa, K. Advances in the surgical treatment of liver cancer. Biosci. Trends. 16 (3), 178-188 (2022).
- Pepe, A., et al. Medical radiology: current progress. Diagnostics. 13 (14), 2439 (2023).
- Li, Y., Zhang, C. Significance of 'harmonious' thinking in Inner Canon of Huangdi on the prevention and treatment of primary liver cancer. China Journal of Traditional Chinese Medicine and Pharmacy. 28 (02), 305-308 (2013).
- Luo, T. . Wishing Baojian (M). , (2019).
- Li, Y. . Effect and mechanism of Sanlengjiashen Decoction on hepatocellular carcinoma by JAK2/STAT3 signaling pathway [D]. , (2022).
- Wang, P., et al. BTF3 promotes proliferation and glycolysis in hepatocellular carcinoma by regulating GLUT1. Cancer Biol. Ther. 24 (1), 2225884 (2023).
- Xie, N., et al. Rhodiola crenulate alleviates hypobaric hypoxia-induced brain injury via adjusting NF-κB/NLRP3-mediated inflammation. Phytomedicine. 103, 154240 (2022).
- Wang, X., et al. Rhodiola crenulata attenuates apoptosis and mitochondrial energy metabolism disorder in rats with hypobaric hypoxia-induced brain injury by regulating the HIF-1α/microRNA210/ISCU1/2 (COX10) signaling pathway. J. Ethnopharmacol. 241, 111801 (2019).
- Guerrieri, A. N., et al. A novel patient-derived immortalised cell line of myxofibrosarcoma: a tool for preclinical drugs testing and the generation of near-patient models. BMC Cancer. 23 (1), 1194 (2023).
- Li, Y., Zhao, J., Zhao, H., Yu, C. Research progress of Sparganium Stoloniferum. Journal of Liaoning University of Traditional Chinese Medicine. 20 (09), 92-94 (2018).
- Kim, T. W., Lee, S. Y., Kim, M., Cheon, C., Ko, S. G. Kaempferol induces autophagic cell death via IRE1-JNK-CHOP pathway and inhibition of G9a in gastric cancer cells. Cell Death Dis. 9 (9), 875 (2018).
- Lee, M. J., et al. Kaempferol alleviates mitochondrial damage by reducing mitochondrial reactive oxygen species production in lipopolysaccharide-induced prostate organoids. Foods. 12 (20), 3836 (2023).
- Zhang, Q., et al. Molecular docking and in vitro experiments verified that kaempferol induced apoptosis and inhibited human HepG2 cell proliferation by targeting BAX, CDK1, and JUN. Mol. Cell. Biochem. 478 (4), 767-780 (2023).
- Kumar, S., et al. Myricetin: a potential plant-derived anticancer bioactive compound-an updated overview. N-S Arch. Pharmacol. 396 (10), 2179-2196 (2023).
- Wang, M., et al. Myricetin reverses epithelial-endothelial transition and inhibits vasculogenic mimicry and angiogenesis of hepatocellular carcinoma by directly targeting PAR1. Phytother. Res. 36 (4), 1807-1821 (2022).
- Li, J., Li, F., Jin, D. Ginsenosides are promising medicine for tumor and inflammation: A review. Am. J. Chinese Med. 51 (4), 883-908 (2023).
- Guo, X., Hu, N., Sun, G., Li, M., Zhang, P. Shenyi capsule plus chemotherapy versus chemotherapy for non-small cell lung cancer:A systematic review of overlapping meta-analyses. Chinese Journal of Integrative Medicine. 24 (3), 227-231 (2018).
- Zhang, R., et al. Network Meta-analysis of oral Chinese patent medicine for adjuvant treatment of primary liver cancer. China Journal of Chinese Materia Medica. 46 (09), 2333-2343 (2021).
- Oh, H. M., Cho, C. K., Son, C. G. Experimental evidence for the anti-metastatic action of ginsenoside Rg3: A systematic review. Int. J. Mol. Sci. 23 (16), 9077 (2022).
- Nowak-Perlak, M., Ziółkowski, P., Woźniak, M. A promising natural anthraquinones mediated by photodynamic therapy for anti-cancer therapy. Phytomedicine. 119, 155035 (2023).
- Bai, J., et al. Emodin, a natural anthraquinone, suppresses liver cancer in vitro and in vivo by regulating VEGFR and miR-34a. Invest. New Drug. 38 (2), 229-245 (2020).
- Cheng, G., et al. Cell metabolomics reveals the potential mechanism of aloe emodin and emodin inhibiting breast cancer metastasis. Int. J. Mol. Sci. 23 (22), 13738 (2022).
- Wang, X., et al. Inhibition of tetramethylpyrazine on P-gp, MRP2, MRP3 and MRP5 in multidrug resistant human hepatocellular carcinoma cells. Oncol. Rep. 23 (1), 211-215 (2010).
- Hu, J., et al. Ultrasonic extraction, antioxidant and anticancer activities of novel polysaccharides from Chuanxiong rhizome. Int. J. Biol. Macromol. 85, 277-284 (2016).
- Zhong, C., et al. Physicochemical properties of polysaccharides from Ligusticum chuanxiong and analysis of their anti-tumor potential through immunoregulation. Food Funct. 12 (4), 1719-1731 (2021).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568 (2023).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J. Ethnopharmacol. 293, 115278 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유