Method Article
부유 된 3D 바이오 프린팅을위한 겔화 동안 전단 처리에 의해 형성된 Agarose 유체 겔
* 이 저자들은 동등하게 기여했습니다
요약
하이드로겔 형성 중 전단 처리는 전단력이 제거된 후 전단이 얇지만 빠르게 재구성되는 마이크로겔 현탁액의 생성을 초래합니다. 이러한 물질은 바이오프린팅 복합체, 세포 함유 구조의 지지 매트릭스로 사용되었습니다. 여기서는지지 베드 및 호환 가능한 바이오 잉크를 제조하는 데 사용되는 방법을 설명합니다.
초록
바이오 프린팅 공정 중 부품을지지하기 위해 세분화 된 매트릭스를 사용하는 것은 Bhattacharjee et al. 2015 년에 그 이후로 3D 바이오 프린팅에서지지 겔 베드의 준비 및 사용을위한 몇 가지 접근법이 개발되었습니다. 이 논문은 아가로오스(유체 겔로 알려짐)를 사용하여 마이크로겔 현탁액을 제조하는 공정을 설명하며, 여기서 입자 형성은 겔화 동안 전단의 적용에 의해 제어됩니다. 이러한 처리는 화학적으로나 기계적으로 인쇄 매체를 매립하는 것과 같은 뚜렷한 이점을 부여하는 후속 재료 특성과 함께 신중하게 정의된 미세 구조를 생성합니다. 여기에는 제로 전단에서 점탄성 고체와 같은 물질로 거동하고, 장거리 확산을 제한하고, 응집 시스템의 특징적인 전단 희석 거동을 입증하는 것이 포함됩니다.
그러나 전단 응력을 제거하면 유체 겔은 탄성 특성을 빠르게 회복할 수 있습니다. 이러한 히스테리시스의 부족은 이전에 언급 된 정의 된 미세 구조와 직접적으로 관련이 있습니다. 가공으로 인해 입자 계면에서 반응성이 있는 비겔화 폴리머 사슬은 벨크로 효과와 유사한 입자 간 상호 작용을 촉진합니다. 이러한 탄성 특성의 빠른 회복은 저점도 생체 재료에서 고해상도 부품을 바이오프린팅할 수 있게 하며, 지지 베드의 빠른 개질은 바이오잉크를 제자리에 가두어 모양을 유지합니다. 또한, 아가로스 유체 겔의 장점은 비대칭 겔화/용융 전이(~30°C의 겔화 온도 및 ~90°C의 용융 온도)입니다. 아가로스의 이러한 열 히스테리시스는 지지 유체 겔이 녹지 않고 현장에서 바이오프린팅된 부분을 인쇄하고 배양하는 것을 가능하게 합니다. 이 프로토콜은 아가로스 유체 겔을 제조하는 방법을 보여주고 부유층 첨가제 제조(SLAM) 내에서 다양한 복합 하이드로겔 부품의 생산을 지원하기 위한 사용을 보여줍니다.
서문
하이드로겔은 세포 성장을 위한 보조제로 사용하기에 완벽한 재료이다1. 사용되는 재료에 따라 세포 생존력을 손상시키지 않는 부드러운 메커니즘을 통해 겔화됩니다 2,3. 수분 함량이 높다는 것(일반적으로 >90%)은 영양소와 산소가 물질 속으로 쉽게 확산되고 세포 대사의 노폐물이 확산된다는 것을 의미한다4. 따라서 세포 생존율은1년을 초과하는 기간 동안 보존되는 것으로 나타났으며5, 현재 하이드로겔을 사용하여 향후 치료용으로 세포를 저장하거나 "일시 중지"하는 데 사용되는 사례가 있다6. 그들은 조직과 같은 구조의 생산을 위해 조직 공학에서 널리 사용되어 왔지만, 재료의 구조와 조성을 모두 제어하는 데 어려움이 있기 때문에 사용이 제한되는 경향이 있습니다. 역사적으로, 하이드로겔 강도는 (많은 경조직과 관련하여) 비교적 낮은데, 이는 구조를 형성하는 폴리머 매트릭스가 차지하는 높은 수분 함량과 낮은 부피로 인해. 또한, 겔화에 대한 많은 경로(열, 이온성, 섬유형성)는 상당히 느린 동역학을 제공하며, 이는 기계적 특성이 시간이 지남에 따라 꾸준히 발전하는 경향이 있음을 의미합니다. 상호 침투 네트워크를 제외하고, 낮은 기계적 강성과 느린 경화 시간으로 인해 바이오잉크가 증착 시 자립할 수 없는 경우가 많으며, 초기 압출 시 "슬럼프"가 발생하고 정의를 잃는 경향이 있습니다.
이러한 중요한 문제를 극복하기 위한 시도로서, 프린팅 동안 지지를 제공하는 임베디드 프린팅 기술이 개발되었으며, 구조물의 기계적 특성은 7,8을 개발하고 있다. 겔의 미세구조가 완전히 발달하고 기계적 특성이 최적에 도달하면, 지지체 매트릭스는 전형적으로 지지체상의 부드러운 세척 또는 용융을 통해 제거될 수 있다. 이 접근법에 대한 초기 연구는 2 차 상이 분포 된 점성 플루 로닉 분산을 활용했다9. 보다 최근에, Bhattacharjee et al. 과립화 카보폴 형태의 겔을 사용하여 세포 어레이가 지지 겔10에 현탁될 수 있음을 입증했습니다. 이어서, Hinton et al. 과립 젤라틴으로부터 형성된 마이크로겔 현탁액으로 구성된 지지층으로 세포를 함유하는 겔 기반 물질의 압출에 대해 보고하였다11. 세포-함유 하이드로겔의 압출 및 그 후의 경화 후, 젤라틴은 지지조의 부드러운 가열에 의해 제거되어, 젤라틴의 용융을 가능하게 하였다. 안타깝게도 이 프로세스에는 여전히 몇 가지 제한 사항이 있습니다. 예를 들어, 콜라겐과 비교하여 젤라틴의 화학 구조(결과적으로 가수분해된 형태의 콜라겐임)는 골격을 가로지르는 많은 화학적 부분이 생물학적 실체와 상호 작용할 수 있도록 합니다. 따라서, 잔류 지지 매트릭스는 다운스트림 생물학적 과정을 방해할 수 있다. 또한 동물 유래 제품은 기술의 번역 가능성을 고려할 때 제한적인 사용을 제기합니다. 제조된 부품이 임상적으로 사용되도록 의도된 경우, 또는 이러한 표면 오염이 심각한 문제를 일으킬 수 있는 근본적인 생물학적 질문에 답하는 데 사용되는 경우에도 문제가 발생합니다.
우리는 그 후 생리학적 조건에서 전하가 없고 비동물성 물질로 형성되는 지지 매트릭스 내에서 하이드로겔의 부유 제조를 허용하는 정제된 공정을 만들었습니다. 이 공정은 다양한 생체 고분자 지지체와 함께 사용될 수 있지만, 아가로스는 생리학적 pH12,13에서 당 기반이고 중성으로 하전되기 때문에 생물학적 상호작용에 불활성인 물질을 제공합니다. 이미 존재하는 겔을 단편화하는 것보다는, 지지체 물질은 겔화 동안 전단의 적용을 통해 형성된다(14,15,16). 이것은 표면에서 덴드론과 같은 특징을 나타내고 겔화되지 않은 중합체17,18의 2차 매트릭스에 분산되는 입자의 매트릭스를 생성합니다. 그 결과 흥미로운 재료 특성(19,20,21,22)을 갖는 물질이 생성되는데, 이는 이전에 보고된 과립 겔과 유사한 방식으로 전단할 수 있지만, 전단이 제거될 때 점도를 더 빠르게 회복하는 경향이 있다 23. 지지 매트릭스로 압출된 세포 함유 물질이 완전히 성숙되면 배양에 배치하기 전에 부드러운 교반을 통해 지지 매트릭스를 제거할 수 있습니다. 이 과정을 사용하여 복잡한 구조를 가진 물질을 생산하고 피부와 골 연골 부위 23,24,25의 생물학적 구조를 요약 할 수 있음이 밝혀졌습니다. 이 방법 논문은 지지 재료를 제조하는 방법을 자세히 설명하고 다양한 복잡한 구조 내에서 사용되는 적절한 바이오잉크를 강조합니다.
프로토콜
알림: 이 프로토콜에 사용된 모든 재료, 시약, 장비 및 소프트웨어와 관련된 자세한 내용은 재료 표를 참조하십시오.
1. 유체겔 현탁액 베드의 제조
- 2,000mL 유리병에 1,000mL의 초순수(Type 1, >18mΩ·cm-1)에 5g의 agarose 분말을 첨가하여 1,000mL의 분산된 agarose(0.5% w/v) 1,000mL를 준비합니다.
- 수성 혼합물에 70mm 마그네틱 교반기 막대를 추가하고 먼저 완전히 조인 다음 1/4바퀴 돌려 풀어 병 뚜껑을 고정합니다.
- 유리병을 오토클레이브 바구니에 넣고 뚜껑을 닫고 121°C 및 1Bar에서 15분 동안 사이클을 실행하여 혼합물을 용해하고 멸균합니다.
알림: 이 프로토콜은 추가 단계에서 항상 고압 증기 멸균 솔루션에 사용됩니다. - 오토클레이브가 80°C로 냉각되면 오토클레이브에서 병을 꺼내 800rpm으로 교반하면서 마그네틱 교반기(가열되지 않음)에 놓습니다.
주의 : 병과 액체는 여전히 뜨겁습니다. - 졸을 주위 조건 하에서, 일정한 교반을 유지하면서, 온도가 그의 T 겔(겔화점)보다 낮아질 때까지, 32°C로 냉각시킨다.
- 교반기에서 병을 꺼내 4°C에서 보관합니다.
알림: 유체 젤은 필요할 때까지 보관할 수 있습니다.
2. 바이오잉크의 제조
- 초순수(Type 1, >18 mΩ·cm-1)에 저아실젤란검 1%(w/w) 졸을 이용하여 젤란계 바이오잉크를 제조한다.
- 0.5g의 젤란 분말을 계량 보트에 계량합니다.
- 초순수 49.5g을 100mL 유리병에 마그네틱 교반기와 함께 넣습니다.
- 젤란 파워가 들어있는 계량 보트를 반으로 접고 분말을 물에 천천히 첨가하면서 끊임없이 저어줍니다.
- 오토클레이브를 사용하여 졸을 용해 및 멸균하고 20°C로 냉각시킵니다.
- 바이오잉크는 더 사용할 때까지 4°C에서 보관한다.
- 초순수(Type 1, >18 mΩ·cm-1)에서 펙틴-콜라겐 혼합 바이오잉크를 준비합니다.
- 5%(w/v) 저메톡시 펙틴 용액 2.5g을 계량 보트에 계량하여 준비합니다.
- 마그네틱 교반기와 함께 50mL의 초순수를 100mL 유리병에 넣습니다.
- 펙틴 파워가 들어있는 계량 보트를 반으로 접고 끊임없이 저어 주면서 천천히 분말을 물에 첨가하십시오.
- 수성 혼합물을 오토클레이브하고 20°C로 냉각시킨다.
- 콜라겐 용액 3mL에 펙틴 용액 3mL를 추가하거나 펙틴 용액 4mL를 콜라겐 용액 2mL에 각각 추가하여 1:1 및 2:1 펙틴-콜라겐 블렌드를 준비합니다. 피펫을 사용하여 혼합물을 10x 인출하고 분배하여 블렌드를 부드럽게 혼합합니다.
알림: 이 절차는 콜라겐의 조기 겔화를 방지하기 위해 얼음 위에 차가운 재료를 사용하는 것이 가장 좋습니다. 펙틴과 콜라겐의 예냉각은 혼합하기 전에 4°C에서 저장함으로써 달성될 수 있다. - 더 사용할 때까지 4 °C에서 보관하십시오.
- 초순수(Type 1, >18 mΩ·cm-1)에서 알지네이트-콜라겐 혼합 바이오잉크를 준비합니다.
- 알긴산 분말 2g을 계량 보트에 계량합니다.
- 마그네틱 교반기와 함께 50mL의 초순수를 100mL 유리병에 넣습니다.
- 알긴산 염 동력이 들어있는 계량 보트를 반으로 접고 분말을 물에 천천히 첨가하면서 끊임없이 저어줍니다.
- 알긴산염이 완전히 용해될 때까지(투명하고 약간 갈색 액체) 일정한 교반 하에 분산액을 60°C로 가열한 다음 20°C로 냉각합니다.
- 알지네이트 용액 25mL를 DMEM 25mL에 첨가하여 Dulbecco's modified eagle medium(DMEM)과 같은 세포 배양 배지로 알긴산염 용액을 희석합니다.
- 알지네이트-콜라겐 블렌드(1:1)를 준비하기 위해 알지네이트/DMEM 용액 3mL를 콜라겐 용액 3mL에 첨가합니다. 혼합물을 10x 인출 및 분주하여 피펫을 사용하여 블렌드를 부드럽게 혼합하고 4°C에서 보관합니다.
알림: 이 절차는 콜라겐의 조기 겔화를 방지하기 위해 얼음 위에 차가운 재료를 사용하는 것이 가장 좋습니다. 펙틴과 콜라겐의 예냉각은 혼합하기 전에 4°C에서 저장함으로써 달성될 수 있다.
3. 바이오잉크의 유변학적 특성 분석
- 레오미터를 켜고 톱니 모양의 형상 40mm를 삽입하고 30분 동안 그대로 둡니다.
- 제로 갭 높이 기능을 사용하여 레오미터의 갭 높이를 제로화합니다.
- 하단 플레이트에 ~2mL의 샘플을 추가하고 상단 형상을 낮추어 1mm의 간격 높이를 만듭니다.
- 플레이트 사이에서 배출된 과도한 물질을 제거하여 샘플을 다듬습니다. 이렇게하려면 평평하고 비 마모성 가장자리를 사용하여 틈에서 과도한 액체를 빼내고 티슈 페이퍼를 흡수하십시오.
알림: 3.2-3.4 단계는 다음 단계 각각을 수행하기 전에 샘플을 변경하기 위해 반복됩니다. - 생체잉크의 주입성을 결정하기 위해 점도 측정 프로파일을 수행합니다.
- 사용자 옵션에서 점도 검사를 선택합니다.
- 전단 속도 제어 램프 테스트를 위한 파라미터를 입력합니다: 0.1 - 500 s-1, 램프 시간 1분.
- 3.5.2단계의 전단 속도 제어 램프 테스트에서 결정된 상부 및 하부 응력을 사용하여 응력 제어 하에 있는 새 샘플에 대해 점도 측정 램프 테스트를 반복합니다.
- 바이오잉크의 겔화 특성을 결정하기 위해 작은 변형 테스트를 수행합니다.
- 사용자 옵션에서 진동 테스트를 선택합니다.
- 일정한 변형률 하에서 단일 주파수 테스트에 매개 변수를 입력하십시오 : 주파수 1Hz, 1 시간 동안 0.5 % 변형률, 잉크 젤.
- 겔화된 샘플에 대한 현장 진폭 및 주파수 측정을 수행합니다.
- 사용자 옵션에서 진동 테스트를 선택합니다.
- 진폭 스윕을 선택하고 변형률 제어되는 진폭 스윕 테스트를 위한 파라미터를 입력합니다: 일정한 1Hz 주파수에서 0.01 - 500%.
- 새 샘플을 로드하고 사용자 옵션에서 진동 테스트를 선택합니다. 그 후, 주파수 테스트, 및 0.01 및 10 Hz 사이의 입력 주파수 파라미터 및 단계 3.7.2에서 얻어진 진폭 스윕 데이터로부터 결정된 스펙트럼의 선형 점탄성 영역(LVR) 내에 있는 변형률(전형적으로 LVR의 50% 내지 80% 사이의 값)을 선택한다.
4. 3D 바이오프린터를 이용한 3D 구조 설계 및 프린팅
- CAD 소프트웨어를 실행하여 CAD 모델 생성을 시작합니다.
- 도구 선택 | CAD 소프트웨어의 재료는 선택한 바이오잉크에 대한 인쇄 매개변수를 정의합니다.
- 사용 중인 프린터와 관련된 인쇄 매개변수를 입력합니다. 예를 들어, 3D Discovery의 경우 두께 탭에 추정된 필라멘트 직경 (대부분의 바이오잉크의 경우 ~200-500μm)을 입력하여 각 레이어의 Z 두께 를 결정합니다.
참고: 최종 구조의 박리는 두께 값을 늘릴 필요가 있음을 나타내는 반면, 해상도 손실은 두께를 줄여야 할 필요성을 강조합니다. - 소프트웨어의 Layer 탭을 사용하여 레이어별로 원하는 구조를 설계합니다. 그룹(Group) 탭을 사용하여 레이어를 그룹화 하고 레벨(Level) 탭을 사용하여 Z 평면의 레벨 에 각 레이어를 지정합니다.
- 예를 들어, 격자 구조를 생성하려면(2.3단계에서 제조된 알지네이트-콜라겐 블렌딩된 바이오잉크 사용) x축을 따라 필라멘트가 있는 한 층을 만들고 y축을 따라 필라멘트가 있는 두 번째 레이어를 만듭니다. 둘 다 별도의 레벨에 할당합니다.
- 그룹( Group ) 탭에서 구조물의 반복 단위 수를 선택하여 빌드 높이를 결정합니다.
- 생성 도구를 클릭하여 설계에 대한 G 코드를 만들고 구조의 3D 렌더링을 봅니다.
- BioCAD를 닫고 3D Discovery HMI(인간-기계 인터페이스) 소프트웨어를 실행하여 프린팅 프로세스를 시작합니다.
- 제조업체의 지침에 따라 프린트 헤드를 조립합니다. 마이크로 밸브를 프린트 헤드에 장착하고 선택한 압출 노즐을 조입니다.
- 바늘 길이 측정(Needle Length Measurement) 기능을 클릭하여 프린트 헤드를 보정합니다.
- 배양 용기(예: 6웰 플레이트)를 인쇄 플랫폼에 로드합니다.
- 바이오잉크를 인쇄 카트리지에 분취하고 마이크로 밸브 위의 프린트 헤드에 나사로 고정합니다.
- 조립된 프린트 헤드를 공압 시스템에 연결하고 HMI에서 프린트 헤드 를 선택하여 맞춥니다.
- 압력 확인(Check Pressure)을 클릭하여 압출 압력을 조정할 수 있습니다.
- 적절한 압력이 선택되면(원하는 해상도에 따라 ~30-120kPa ) 이전에 생성된 G 코드를 열고 실행을 클릭하여 인쇄 프로세스를 시작합니다.
5. 피부 유사체의 제조
- 인간 진피 섬유아세포(HDF) 및 지방 유래 줄기 세포(ADSC)를 소태아혈청(FBS)(10%), HEPES 완충액(2.5%) 및 페니실린/스트렙토마이신(1%)이 90% 합류도에 도달할 때까지 T75 플라스크에서 배양합니다. 70%-80% 밀도에 도달할 때까지 각질세포 성장 배지(KGM)에서 인간 표피 각질세포(HEK)를 배양합니다. 배양 동안 모든 세포를 37°C, 5%CO2, 및 95% 공기의 조건하에 인큐베이터에 보관한다.
- 진피 및 지방 바이오잉크용 HDF 및 ADSC를 준비하려면 3mL의 인산염 완충 식염수(PBS)를 플라스크에 부드럽게 피펫팅하여 세포를 세척하고, 플라스크를 기울여 세포 위로 PBS를 소용돌이치게 하고, 부착된 세포를 방해하지 않도록 주의하면서 흡인합니다.
- 세포를 들어 올리기 위해 3mL의 1x 세포 해리 효소를 플라스크에 피펫으로 넣어 세포를 덮고 플라스크를 3분 동안 인큐베이터에 넣고 플라스크를 손바닥에 단단히 두드려 세포를 제거합니다. 완전한 DMEM 6mL를 사용하여 효소의 작용을 중화합니다.
알림: 탭 후에도 세포가 부착된 상태로 유지되면 2분 더 배양합니다. - 진피 및 지방 바이오잉크를 준비하기 위해 세포 현탁액을 별도의 15mL 튜브에 피펫팅하고 혈구계를 사용하여 세포 계수를 위해 각각에서 10μL를 채취합니다. 나머지 세포 현탁액을 300 × g 에서 5 분 동안 원심 분리하여 세포를 펠렛으로 만듭니다.
- 펠릿을 방해하지 않도록 주의하면서 상청액을 흡인하고 적절한 폴리머 용액(2.2단계에서 준비됨)을 첨가하고 다음 밀도로 피펫팅하여 부드러운 자극을 사용하여 혼합합니다.
- 지방층의 경우 1:1 콜라겐 대 펙틴 블렌드당 5 ×10 5 ADSC mL-1 을 피펫팅합니다.
- 유두층의 경우 2:1 콜라겐 대 펙틴 블렌드당 3 ×10 6 HDF mL-1 을 피펫팅합니다.
- 망상 층의 경우 2:1 콜라겐 대 펙틴 블렌드당 1.5 ×10 6 HDF mL-1 을 피펫팅합니다.
- 세포를 들어 올리기 위해 3mL의 1x 세포 해리 효소를 플라스크에 피펫으로 넣어 세포를 덮고 플라스크를 3분 동안 인큐베이터에 넣고 플라스크를 손바닥에 단단히 두드려 세포를 제거합니다. 완전한 DMEM 6mL를 사용하여 효소의 작용을 중화합니다.
- 인쇄하려면 각 바이오잉크를 별도의 카트리지에 넣고 섹션 4의 지침에 따라 유리 페트리 접시에 지지 유체 젤의 구조를 인쇄합니다.
- 인쇄가 완료되면 200mM CaCl2∙2H 2O2mL를 구조체 주위에 주입하고 3mL의 지방 생성 배지(500μM 이소부틸-메틸크산틴[IBMX], 50μM 인도메타신 및 1μM 덱사메타손)를 주사기와 바늘을 사용하여 유체 젤에 주입합니다. 하룻밤 동안 인큐베이터에 두십시오.
- 다음날, 스패튤라를 사용하여 지지조로부터 구축물을 제거하고, PBS로 부드럽게 세척하고, 6-웰 플레이트 내의 지방생성 배지에서 14일 동안 배양하였다.
- 14일 후, 구축물의 표면에 공기-액체 계면을 생성하기에 충분한 배지를 제거하고 구축물 상단에 2 ×10 6 개의 각질세포를 시딩하여 표피층을 생성합니다.
- 분석 전에 1주일 동안 추가로 배양합니다.
6. 경동맥 모델의 제조
- 젤란 껌 바이오잉크 용액(2.1단계에서 준비됨)을 프린터 카트리지에 넣습니다.
- 섹션 4의 인쇄 지침에 따라 유체 젤 지지 재료가 들어 있는 페트리 접시 내에서 경동맥 모델을 인쇄합니다.
- 인쇄가 완료되면 주사기와 바늘을 사용하여 구조체 주위에 200mM CaCl2∙2H 2O2mL를 주입합니다.
- 최소 3시간 후, 주걱을 사용하여 지지조로부터 구조물을 제거하고 PBS로 부드럽게 세척한다.
결과
알지네이트 및 유형 I 콜라겐 바이오잉크
인쇄 해상도(필라멘트 직경의 함수로 기록됨)는 압출 압력의 변화를 통해 직접 조정할 수 있는 것으로 관찰되었습니다(그림 1A-C). 압출 압력 및 인쇄 해상도는 30kPa의 압출 압력에서 인쇄를 통해 생성된 가장 작은 필라멘트 직경과 직접적인 관련이 있습니다. 흥미롭게도, 30kPa의 압출 압력에서, 압출 노즐의 내경과 일치하는 필라멘트가 생성될 수 있으며(평균 필라멘트 직경: 323 μm ± 50 μm; 노즐 직경: 300 μm), 이는 "최대 분해능"이 달성될 수 있음을 시사한다. 또한, 이 분해능에 대한 인쇄 매개변수는 추출 및 관류할 수 있는 알지네이트/콜라겐 혈관관의 생성에 성공적으로 적용될 수 있습니다(그림 1D).
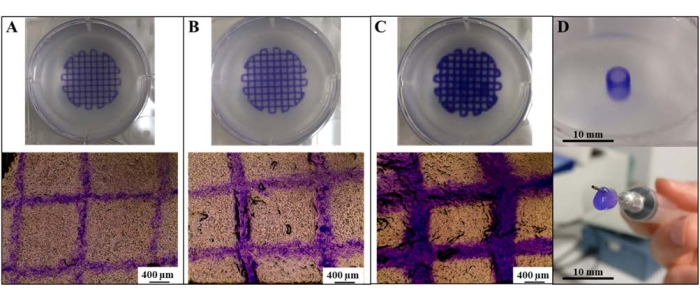
그림 1: SLAM을 사용한 고해상도 인쇄물 생성. (A) 30 kPa, (B) 60 kPa 및 (C) 120 kPa에서 압출을 통한 필라멘트 직경의 함수로 알지네이트/콜라겐 격자의 인쇄 해상도를 조정합니다. (D) 알긴산/콜라겐 혈관관의 생성. 스케일 바 = 400 μm (A-C), 10 mm (D). 약어: SLAM = 부유층 적층 제조. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
피부 유사체
SLAM은 또한 콜라겐 I과 펙틴의 혼합물로 형성된 바이오잉크를 사용하여 피부와 유사한 구조(그림 2A)를 만드는 데 사용되었습니다. 피부에서 발견되는 것과 유사한 기계적 특성의 구배를 얻기 위해 진피(5mg∙mL-1 콜라겐 스톡과 2:1로 혼합된 5% w/w 펙틴) 및 피하(5mg∙mL-1 콜라겐 스톡과 1:1로 혼합된 5% w/w 펙틴) 층. 결과 구조(그림 2Bi-Bii)는 박리의 징후 없이 DMEM에 담근 후 잘 통합되었습니다. 중요하게도, 14일의 배양 기간 후에 구조 전체에 걸쳐 높은 수준의 세포 생존율이 있었다(그림 2Biii). 흥미롭게도, 배양 기간 동안, 재료는24 경화되어 재료의 리모델링을 나타냅니다.
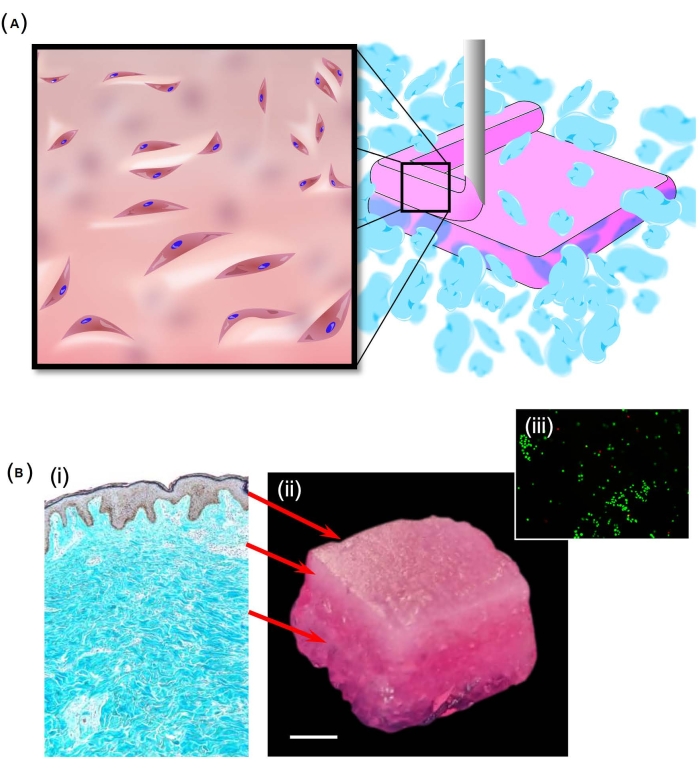
그림 2: 피부와 유사한 구조의 생성 . (A) SLAM 공정을 사용하여 인간 진피 섬유아세포가 내장된 층상 구조를 생성하는 방법을 보여주는 개략도. 여기서 현탁 베드는 아가로스로부터 형성된 입자로부터 제조되었고, 피하 및 진피층은 다양한 비율의 펙틴 및 콜라겐 I.(B)로 형성되었으며, 층상 구조는 피부 (i)의 삼층 구조를 나타내기 위한 것이었다. 이 구조(ii)를 복제하는 데 성공하면 calcein-AM 염색(iii)에서 볼 수 있듯이 샘플 전체에서 높은 수준의 세포 생존율이 관찰되었습니다. 스케일 바 = 5mm(Bii). 약어: SLAM = 부유층 적층 제조. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
경동맥
방법의 한계를 뛰어 넘기 위해 더 복잡한 인쇄물이 제작되었습니다. 한 가지 예에서, 분기된 경동맥을 1% 젤란 바이오잉크(그림 3A)를 사용하여 인쇄한 다음, 유체 겔 베드 내에서 200mMCaCl2를 압출하여 가교결합시키고(그림 3B) 겔화 후 지지체에서 간단히 들어 올렸습니다(그림 3C). 전구체 인쇄 솔루션이 낮은 점도를 나타냈음에도 불구하고 지지 베드는 복잡한 형상을 생산하는 데 성공했습니다. 동맥은 증착, 가교 및 추출 중에 구조를 유지했으며(그림 3), 추가 스캐폴딩을 통합하기 위해 인쇄 코드를 수정할 필요가 없습니다.

그림 3: SLAM을 사용한 젤란 경동맥의 제조 공정. (A) 인쇄 중 유체 겔 베드 내 젤란 압출, (B) 가교 동안 유체 겔 내에서 완료된 경동맥 인쇄, (C) 유체 겔 지지체에서 회수한 후 최종 경동맥 모델. 스케일 바 = 10mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
지지 침대에 사용되는 재료 선택 고려
개발 단계에서 지지 베드에 필요한 다양한 특성이 있었습니다. 이러한 특성은 다음을 포함한다: i) 압출된 재료를 현탁시키기에 충분한 구조를 유지하는 것; ii) 프린트 헤드가 지지 재료를 통해 자유롭게 이동할 수 있도록 하는 전단 박화 능력; iii) 증착된 바이오잉크 주위에 지지체를 형성하는 신속한 구조조정(자가 치유 특성); iv) 실온 및 생리학적 온도 모두에서 열적으로 안정하고; v) 다양한 pH 및 전해질(이온성 종 및 농도)에 걸쳐 상대적으로 생체 불활성인 중성(즉, 전하를 띠지 않은) 물질로, 세포 및 하전된 바이오잉크와의 상호작용을 방지합니다. vi) 무독성; 및, vii) 바람직하게는 비-동물 공급원이다.
이러한 고유 특성 중 몇 가지를 유지하는 많은 생체 고분자 재료가 있지만, 이러한 모든 특성 11,26,27을 준수하지 않고 부유 된 3D 첨가제 제조를 수행 할 수있는 능력으로, 여기서의 의도는 다른 지원 재료와 관련된 특정 실용적인 문제를 극복 할 수있는 지원 침대를 생산하는 것이 었습니다. 아가로스의 화학적 특성으로 인해, 특히 미립자 유체 겔로서 제형화될 때, 이들 모든 특성이 얻어질 수 있었다. 이를 통해 다양한 바이오잉크23,24,25,28에 걸쳐 사용할 수 있는 지지층이 가능해졌습니다. 실제로, 재료의 생체 불활성 특성은 배양 전반에 걸쳐 인쇄 된 구조를 현장에서 유지할 수있는 잠재력을 제공하여 생물학의 변화없이 다양한 바이오 잉크가 완전히 발달 할 수있는 충분한 시간 척도를 허용했습니다. 또한, 미립자, 희석 특성으로 인해 최종 인쇄 구조물에서 쉽게 제거 할 수 있으며, 무독성, 비 동물 기원은 윤리적 및 규제 요구 사항과 관련된 장벽을 극복하여 클리닉으로 신속하게 번역 할 수 있습니다.
바이오잉크 재료 선택에 대한 고려 사항
직접 압출 바이오 프린팅에서 바이오 잉크는 2D 프린트 베드에 증착됩니다. 모노머 바이오잉크 용액이 전단 희석 거동을 갖는 것이 유익합니다. 그러나, 생리학적으로 관련된 치수를 갖는 고충실도 구조물을 생산하기 위해서는, 이들은 낮은 요변성을 가져야 하고, 증착시 고체 필라멘트를 형성할 수 있도록 충분히 높은 점도로 회복되어야 한다 29,30,31. 점도가 증가함에 따라, 압출에 필요한 압력은 훨씬 더 높아져, 종종 캡슐화된 셀 생존율(31,32)에 부정적인 영향을 미친다. 현탁액 바이오프린팅은 압출된 재료가 가교 결합 전반에 걸쳐 현탁 수조에 의해 지지되기 때문에 이러한 제한을 제거합니다. 이러한 개발은 사용할 수 있는 바이오잉크 제형의 범위를 크게 증가시킵니다. 예를 들어, 최근의 연구는 저농도 콜라겐 용액의 사용이 심장의 내부 구조와 유사한 매우 복잡한 기하학으로 인쇄되는 것을 보여주었다33,34,35. 이 방법에서 언급 된 응용 분야에서 임베디드 인쇄를 통해 생체 재료 잉크는 인쇄 능력 대신 의도 된 생리적 환경을 가장 잘 복제하도록 선택할 수있었습니다.
구조 크기의 한계
바이오 제조 문헌 전반에 걸쳐, 대체 프린트 헤드 기술에 의해 구동되는 다양한 종류의 바이오 프린터가 임베디드 제조 기술에 통합 될 수 있음이 입증되었습니다. 여기에서 입증된 기술도 다르지 않으며, Senior et al.에 의해 입증된 공압식 마이크로 압출 기반 바이오프린터(INKREDIBLE)와 제어 가능한 마이크로밸브가 있는 압출 기반 바이오프린터(3D Discovery)23를 예로 들 수 있습니다. 이를 통해 이미 바이오 프린터를 소유하고있는 다양한 사용자가이 기술에 액세스 할 수 있지만, 달성 가능한 구조 크기에 대한 제한은 궁극적으로 해당 바이오 프린터 사양에 달려 있습니다. 초기에, 대형 구조물의 생성에 대한 주요 제한은 프린트 베드의 크기, X, Y 및 Z 궤적의 한계 및 지지 유체 겔이 함유된 용기의 크기에 의해 정의됩니다.
해상도의 한계
복잡한 마이크로미터 크기의 구조물을 제조할 때, 결과적인 분해능은 프린터의 정밀도(스텝 크기, 압출도에 대한 제어), 프린트 노즐의 내부 직경, 및 프린트 속도, 인쇄 압력 및 유속(36)을 포함하는 조정 가능한 소프트웨어 파라미터의 범위에 크게 의존한다. 또한 액적 크기에 대한 제어는 고분해능 구조의 생성을 촉진하는 데 중요한 것으로 보이며, 제어 가능한 마이크로 밸브가 있는 압출 프린터에서 최상의 결과가 관찰됩니다. 궁극적으로, 모든 파라미터가 최적화될 때, 인쇄 해상도는 마이크로미터 스케일(37) 정도의 증착된 필라멘트와 압출 노즐의 내경과 일치하거나 심지어 그보다 작게 달성될 수 있다. 그러나 이것은 앞서 언급한 모든 인쇄 매개변수의 최적화에 의존하며 해상도는 인쇄 메커니즘과 정밀도에 의해 상당히 제한될 수 있습니다. 예를 들어, 공압 압출은 제어 가능한 마이크로 밸브를 사용한 압출과 동일한 인쇄 해상도를 허용하지 않는 것으로 보입니다. 그러므로, 최대 인쇄 해상도를 달성하기 위한 잠재적인 비용 영향이 존재하는데, 이러한 시스템은 사용자에게 상당히 증가된 비용을 발생시키기 때문이다.
미래 전망 및 잠재력
현재로서는 임베디드 셀을 포함하는 복잡한 연질 구조의 생산을 허용하기 위해 중단된 제조 공정을 사용하는 데 많은 관심이 있으며 의심할 여지 없이 향후 몇 년 동안 상당한 발전이 있을 것입니다. 인쇄 해상도 개선에 대한 지속적인 발전이 주어지지만, 대부분의 생물학적 시스템이 분자 수준에서 스스로를 재배열할 수 있다는 점을 감안할 때 이것이 얼마나 필요할지는 두고 봐야 합니다. 미디어에 대한 관심의 초점은 부상이나 질병 후 인체 조직을 직접 대체하기 위해 3D 프린팅 조직을 사용하는 것이지만 이러한 프로세스를 통해 가능해진 강력한 의료 절차는 몇 년이 걸립니다38,39. 이러한 복잡한 배양 시스템의 영향은 생물학적 과정에 대한 이해를 높이기 위해 약물 스크리닝에 영향을 미치거나 도구로 사용될 가능성이 더 큽니다38. 특히, 발달 생물학은 분자의 특수 증착에 대한 정확한 제어를 통해 연구자가 조직 발달 과정에서 다인성 시스템의 역할을 탐구할 수 있는 여기에서 큰 이점을 얻을 수 있습니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
저자는이 작업에 자금을 지원하고 지원해 준 EPSRC (EP / L016346 / 1), MRC 및 Doctoral Training Alliance Biosciences for Health에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 3D Discovery Bioprinter | RegenHU | BIOFACTORY | Microvalve extrusion bioprinter |
| Agarose | Merck | 9012-36-6 | Material used to create fluid gel support baths |
| Benchtop autoclave | Prestige Medical | B8L75814 | Classic |
| Brilliant Blue G | Merck | 6104-58-1 | Dye used to stain structures |
| Calcium Chloride Dihydrate | Merck | 10035-04-8 | Used to reticulate printed structures |
| Dexamethasone | Merck | D4902-25MG | Used in adipogenic media |
| DMEM | Merck | D6429 | Cell culture media |
| Duran bottle | Merck | Z305219 | glass bottle |
| EVOS XL Core Imaging System | EVOS™ | AMEX1000 | Brightfield microscope with phase contrast |
| FBS | Fisher Scientific | 10500-064 | Cell culture media supplement |
| Gellan gum | Special Ingredients | 5060341112638 | Low Acyl Gellan gum used to make the bioink for the corotid artery model |
| HEPES buffer | Merck | H9897-10PAK | Buffer for cell culture media |
| Indomethacin | Merck | I7378 | Used in adipogenic media |
| Isobutyl-methylxanthine (IBMX) | Merck | I7018-100MG | Used in adipogenic media |
| Keratinocyte growth medium | Lonza | 00192060 | Used as media to culture keratinocytes |
| Low Methoxy Pectin | CP Kelco | LM-5CS | Pectin used to make pectin/collagen blends |
| Penicillin-streptomycin | Merck | P4333-100ML | Used to inhibit bacterial growth |
| PureCol EZ Gel solution | Merck | 5074 | Collagen solution used to make alginate/collagen blends |
| Sodium Alginate | Merck | 9005-38-3 | Alginate powder used to make alginate/collagen blends |
| TrypLE select | Fisher Scientific | 12563011 | cell dissociation enzyme |
| T75 Flasks | StarLab | CC7682-4175 | Used for culturing cells |
참고문헌
- Lee, K. Y., Mooney, D. J. Hydrogels for tissue engineering. Chemical Reviews. 101 (7), 1869-1880 (2001).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Drury, J. L., Mooney, D. J. Hydrogels for tissue engineering: scaffold design variables and applications. Biomaterials. 24 (24), 4337-4351 (2003).
- Iordachescu, A., et al. An in vitro model for the development of mature bone containing an osteocyte network. Advanced Biosystems. 2 (2), 1700156(2018).
- Zhang, C., et al. Hydrogel cryopreservation system: an effective method for cell storage. International Journal of Molecular Sciences. 19 (11), 3330(2018).
- McCormack, A., Highley, C. B., Leslie, N. R., Melchels, F. P. W. 3D printing in suspension baths: keeping the promises of bioprinting afloat. Trends in Biotechnology. 38 (6), 584-593 (2020).
- Cheng, W., Zhang, J., Liu, J., Yu, Z. Granular hydrogels for 3D bioprinting applications. View. 1 (3), 20200060(2020).
- Lieben, L. The future of 3D printing of human tissues is taking shape. Nature Reviews Rheumatology. 12 (4), 191(2016).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655(2015).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758(2015).
- Zarrintaj, P., et al. Agarose-based biomaterials for tissue engineering. Carbohydrate Polymers. 187, 66-84 (2018).
- te Nijenhuis, K. Thermoreversible Networks: Viscoelastic Properties and Structure of Gels. , Springer. Berlin. 194-202 (1997).
- Norton, I. T., Jarvis, D. A., Foster, T. J. A molecular model for the formation and properties of fluid gels. International Journal of Biological Macromolecules. 26 (4), 255-261 (1999).
- Fernández Farrés, I., Moakes, R. J. A., Norton, I. T. Designing biopolymer fluid gels: A microstructural approach. Food Hydrocolloids. 42, 362-372 (2014).
- Cooke, M. E., et al. Structuring of hydrogels across multiple length scales for biomedical applications. Advanced Materials. 30 (14), 1705013(2018).
- Foster, N. C., Allen, P., El Haj, A. J., Grover, L. M., Moakes, R. J. A. Tailoring therapeutic responses via engineering microenvironments with a novel synthetic fluid gel. Advanced Healthcare Materials. 10 (16), 2100622(2021).
- Ellis, A. L., Norton, A. B., Mills, T. B., Norton, I. T. Stabilisation of foams by agar gel particles. Food Hydrocolloids. 73, 222-228 (2017).
- Ghebremedhin, M., Seiffert, S., Vilgis, T. A. Physics of agarose fluid gels: Rheological properties and microstructure. Current Research in Food Science. 4, 436-448 (2021).
- Garrec, D. A., Norton, I. T. Understanding fluid gel formation and properties. Journal of Food Engineering. 112 (3), 175-182 (2012).
- Garrec, D. A., Guthrie, B., Norton, I. T. Kappa carrageenan fluid gel material properties. Part 1: Rheology. Food Hydrocolloids. 33 (1), 151-159 (2013).
- Adams, S., Frith, W. J., Stokes, J. R. Influence of particle modulus on the rheological properties of agar microgel suspensions. Journal of Rheology. 48 (6), 1195-1213 (2004).
- Senior, J. J., Cooke, M. E., Grover, L. M., Smith, A. M. Fabrication of complex hydrogel structures using suspended layer additive manufacturing (SLAM). Advanced Functional Materials. 29 (49), 1904845(2019).
- Moakes, R. J. A., et al. A suspended layer additive manufacturing approach to the bioprinting of tri-layered skin equivalents. APL Bioengineering. 5 (4), 046103(2021).
- Moxon, S. R., et al. Suspended manufacture of biological structures. Advanced Materials. 29 (13), 1605594(2017).
- Noor, N., et al. 3D Printing of personalized thick and perfusable cardiac patches and hearts. Advanced Science. 6 (11), 1900344(2019).
- Compaan, A. M., Song, K., Huang, Y. Gellan fluid gel as a versatile support bath material for fluid extrusion bioprinting. ACS Applied Materials & Interfaces. 11 (6), 5714-5726 (2019).
- Moxon, S. R., et al. Blended alginate/collagen hydrogels promote neurogenesis and neuronal maturation. Materials Science and Engineering: C. 104, 109904(2019).
- Hölzl, K., et al. Bioink properties before, during and after 3D bioprinting. Biofabrication. 8 (3), 032002(2016).
- Chimene, D., Lennox, K. K., Kaunas, R. R., Gaharwar, A. K. Advanced bioinks for 3D printing: a materials science perspective. Annals of Biomedical Engineering. 44 (6), 2090-2102 (2016).
- Schwab, A., et al. Printability and shape fidelity of bioinks in 3D bioprinting. Chemical Reviews. 120 (19), 11028-11055 (2020).
- Rutz, A. L., Lewis, P. L., Shah, R. N. Toward next-generation bioinks: Tuning material properties pre- and post-printing to optimize cell viability. MRS Bulletin. 42 (8), 563-570 (2017).
- Mosadegh, B., Xiong, G., Dunham, S., Min, J. K. Current progress in 3D printing for cardiovascular tissue engineering. Biomedical Materials. 10 (3), 034002(2015).
- Zhou, K., Sun, Y., Yang, J., Mao, H., Gu, Z. Hydrogels for 3D embedded bioprinting: a focused review on bioinks and support baths. Journal of Materials Chemistry B. 10 (12), 1897-1907 (2022).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Kyle, S., Jessop, Z. M., Al-Sabah, A., Whitaker, I. S. Printability' of candidate biomaterials for extrusion based 3D printing: state-of-the-art. Advanced Healthcare Materials. 6 (16), 1700264(2017).
- Hinton, T. J., Lee, A., Feinberg, A. W. 3D bioprinting from the micrometer to millimeter length scales: Size does matter. Current Opinion in Biomedical Engineering. 1, 31-37 (2017).
- Seoane-Viaño, I., Trenfield, S. J., Basit, A. W., Goyanes, A. Translating 3D printed pharmaceuticals: From hype to real-world clinical applications. Advanced Drug Delivery Reviews. 174, 553-575 (2021).
- Jovic, T. H., Combellack, E. J., Jessop, Z. M., Whitaker, I. S. 3D bioprinting and the future of surgery. Frontiers in Surgery. 7, 609836(2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유