Method Article
액적 기반 RNA 시퀀싱을 통한 높은 처리량 효모 균주 현상태핑
요약
미생물 공학의 '설계-구축 테스트' 주기의 병목 현상은 균주의 기능적 스크린을 수행할 수 있는 속도입니다. 우리는 액적 기반 RNA 시퀀싱을 활용하는 실험당 수백에서 수천 개의 효모 세포에 적용되는 균주 스크리닝을 위한 높은 처리량 방법을 설명합니다.
초록
효모 게놈을 편집할 수 있는 강력한 도구는 이 미생물을 엔지니어링을 위한 귀중한 플랫폼으로 만들었습니다. 수백만 개의 유전적으로 뚜렷한 균주의 라이브러리를 구성하는 것이 가능하지만 원하는 표현형을 선별하는 것은 여전히 중요한 장애물로 남아 있습니다. 기존 스크리닝 기술을 사용하면 정보 출력과 처리량 간에 장단점이 있으며, 일반적으로 관심 있는 한 제품에 대해 높은 처리량 스크리닝이 수행됩니다. 따라서, 우리는 유전자 조작 효모 긴장의 이소제성 피콜리터 식민지에 단 세포 RNA 순서를 적응해서 긴장 검열을 가속화하는 접근을 제시합니다. 효모 세포에서 RNA 시퀀싱을 수행하는 독특한 과제를 해결하기 위해 RNA 시퀀싱을 수행하기 전에 하이드로겔 및 구형 내에서 이소생효모 콜로니를 배양합니다. RNA 염기서열 분석 데이터는 효모 표현형을 추론하고 엔지니어링 된 경로를 분류하는 데 사용할 수 있습니다. 당사의 방법의 확장성은 미생물 공학에서 중요한 장애물을 해결합니다.
서문
미생물 공학의 1 차적인 목표는 귀중한화합물을생성하기 위하여 그(것)들을 유도하기 위하여 미생물을 수정하는 것입니다1,2. S. cerevisiae 때문에 배문화의 용이성과 게놈 을 엔지니어링 에 사용할 수있는 도구의 폭에 미생물 공학의 주요 유기체되었습니다3,,4,,5. 그러나, 장애물은 수정 된 효모에 기능 적인 스크린을 수행에 남아: 크기의 순서에 의해 게놈 엔지니어링 뒤에 처리량 지연을 선별. 스크리닝은 전형적으로 마이크로웰 플레이트에서 균주를 분리하고 특정 화합물6,,7의생산을 측정하여 이를 자형질화하는 것을 포함한다. 이 프로세스의 처리량은 백 마이크로리터 반응에서 개별 긴장을 비하는 데 필요한 많은 양의 시약에 의해 제한됩니다. 물방울 미세 유체학적 은 일반적으로 웰 플레이트8에서수행되는 다운 스케일링 반응에 의해 크기의 순서에 의해 효모 스크리닝의 처리량을 증가시키는 매력적인 솔루션을 제공한다. 그러나, 웰 플레이트 스크린과 마찬가지로, 액적 스크린은 전형적으로 엔지니어링된 통로9,,10,,11의글로벌 기능으로 제한된 정보를 제공하는 단일 생성물 화합물을 검출한다.
RNA 시퀀싱(RNA-seq)은 모든 관련 유전자의 발현 수준을 동시에 평가할 수 있도록 함으로써 경로 작동의 보다 포괄적인 특성화를 가능하게 할 수있다 12,,13. 또한, 액적 방법은 수천 개의 셀을 실험당 프로파일화할 수 있게 하여, 엔지니어링 된 변이체14,,15의라이브러리를 스크리는 데 필요한 처리량을 제공합니다. 그러나, RNA-seq 방법은 포유류 세포에 최적화되어; 효모는, 비교하여, 기존 방법에 의하여 그들의 순서를 배제하는16를제거하기 어려운 세포벽 및 세포벽 당 더 적은 mRNA가 있습니다. 효모 RNA-seq를 사용하도록 고처리량 액적 방법을 고안할 수 있다면 효모 엔지니어링을 위한 확장 가능하고 비용 효율적이며 정보가 풍부한 자형질 플랫폼을 제공할 수 있습니다.
우리는 고처리량 액적 미세 유체학17을사용하여 효모 세포를 염기서열 분석하기 위한 우리의 최근에 개발된 방법의 상세한 프로토콜을 제시합니다. 제한된 RNA의 도전을 극복하기 위해, 우리는 피콜리터 하이드로겔 구체에서 단일 효모 세포를 캡슐화하고 배양합니다. 배양은 세포를 복제하여 동일한 엔지니어링 경로를 공유하는 수백 개의 복사본을 생성합니다. 이것은 염기서열 분석에 유효한 RNA의 양을 현저하게 증가시키면서 단 하나 세포 유전자 발현 때문에 변이를 감소시킵니다. 배양 기반 증폭 후, 우리는 세포를 구형으로 하여 벌크 효소 소화를 통해 세포벽을 제거합니다. 세포막은 그대로 남아 있으므로 각 등산 식민지와 관련 mRNA가 하이드로겔 구체에 캡슐화되어 있습니다. 이를 통해 개별 콜로니를 mRNA 포획 시약 및 용해 버퍼와 페어링할 수 있으며, mRNA를 캡처, 바코드 화 및 순서화하여 Drop-Seq워크플로우 14에따라 시퀀스화할 수 있습니다. 우리의 방법은 실험 당 수천 개의 등소 성 효모 식민지의 전사체 전체 스크리닝을 허용합니다.
프로토콜
1. 미세 유체 장치 제조
- SU-8 마스터 제작
- 컴퓨터 지원 설계 소프트웨어를 사용하여 장치 A 및B(보조 파일 1 및 2)의미세 유체 채널용 음수 마스크를 설계하고 10μm 이상의 해상도로 회로 기판 필름에 인쇄합니다.
- 깨끗한 75mm 실리콘 웨이퍼를 스핀 코터에 놓고 약 1 mL의 SU-8을 중앙에 붓습니다. 진공을 켜서 웨이퍼를 척에 고정합니다.
- 장치 A의 경우, 스핀 코트 SU-8 2150에서 500 rpm에서 30 s, 2,750 rpm에서 30 s. 장치 B의 경우, 스핀 코트 SU-8 2100에서 500 rpm에서 30 s, 2,500 rpm에서 30 s. 이것은 각각 두께 200 μm 및 120 μm의 SU-8 층을 산출할 것입니다.
- 스핀 코터에서 웨이퍼를 제거하고 95 °C의 핫 플레이트에 60 분 동안 부드럽게 구워줍니다.
- 핫플레이트에서 웨이퍼를 제거하고 실온으로 식힙니다. 마스크를 웨이퍼 위에 놓고 콜리메이터 190 mW, 365 nm UV LED 아래에 2 분 동안 노출하십시오.
- 노출 후 베이킹을 위해 웨이퍼를 95°C로 설정된 핫플레이트에 5분 동안 놓습니다.
- 웨이퍼를 제거하고 실온으로 식힙니다. 웨이퍼를 프로필렌 글리콜 모노메틸 에테르 아세테이트(PGMEA)의 욕조에 20분 동안 놓습니다.
- PGMEA로 웨이퍼를 헹구고 이소프로판올을 바운더링합니다. 이 과정에서 불투명잔류물이 보이면 PGMEA 및 이소프로판올로 헹구어 보라고 합니다. 웨이퍼를 공기 건조시.
- 웨이퍼를 핫플레이트에 95°C에서 3분 동안 놓습니다.
- 웨이퍼를 제거하고 직경 90mm의 페트리 접시에 놓습니다.
- SU-8 마스터에 주조폴리디메틸실록산 (PDMS) 주조
- 실리콘 베이스와 경화제의 10:1 질량 비율을 함께 혼합합니다. 약 30분 동안 혼합한 후 PDMS를 탈기한다.
- 탈기된 PDMS를 SU-8 마스터 위에 부어 웨이퍼 위에 적어도 5 mm 두께의 층이 형성될 때까지.
- 약 30 분 동안 웨이퍼 위에 PDMS를 탈기합니다.
- 웨이퍼를 PDMS를 경화하기 위해 적어도 80분 동안 65°C 오븐에 놓습니다.
- 웨이퍼에서 경화 된 PDMS 슬래브를 잘라냅니다.
- PDMS 슬래브를 위쪽을 향한 미세 유체 특징을 배치하고 0.75mm 생검 펀치로 입구 및 출구 구멍을 펀치합니다.
- 이소프로판올로 50mm x 75mm 유리 슬라이드를 청소하고 테이프로 PDMS 슬래브의 미세 유체 특징 면에서 모든 먼지를 제거합니다.
- 1분 동안 최대 100Pa(1 mbarO2)플라즈마를 마주보며 세척된 유리 슬라이드와 PDMS 슬래브를 노출시켰다.
- 피처가 아래를 향하도록 유리 슬라이드에 접합된 PDMS 슬래브를 놓아 접합이 허용됩니다. 슬라이드를 65°C 오븐에 30분 이상 놓고 접합을 완료합니다.
- 불소 표면 처리 유체로 플러싱하여 모든 미세 유체 채널을 처리합니다. 유체를 증발시키기 위해 적어도 10 분 동안 65 °C 오븐에서 장치를 굽습니다.
2. 장치 A를 사용하여 하이드로겔에 효모 캡슐화
- 현탁액 배양에서 성장하는 효모를 가지고 혈세포계에 의지하십시오.
- 인산염 완충식염수(PBS)에서 세포를 약 750 k/mL의 농도로 재중단시켰다. 이것은 하이드로겔의 30 %가 그들에 하나의 효모 세포를 가질 것을 보장합니다. 효모 세포의 약 절반만이 식민지로 자라며 효모 콜로니를 함유한 하이드로겔의 ~15%를 차지합니다.
- 초저융점 아가로즈를 PBS에서 2%w/v로 혼합하고 90°C에서 녹을 때까지 가열합니다. 이 데 ~10 분 걸립니다.
- 아가로즈 믹스를 0.22 μm 필터를 부착된 주사기에 80°C로 설정된 공간 히터 앞의 주사기 펌프에 적재합니다.
- 효모 현탁액으로 채워진 주사기와 불소 오일이 들어있는 주사기를 2% w/v 이온 성불화활성제18로 주사기 펌프에 적재합니다.
- 섹션 1에서 만든 커플로우 드롭 스플리터 장치를 가지고 장치에 주사기에서 튜브를 연결합니다. 드롭 수집을 위한 얼음 양동이에 있는 15mL 원추형 튜브로 콘센트에서 튜브를 안내합니다.
- 다음 유량으로 세 가지 솔루션을 장치로 플로우합니다.
- 효모 현탁액을 3 mL/h의 유량으로 흐칩니다.
- 아가로즈 혼합물을 3 mL/h의 유량으로 흐르게 한다.
- 15 mL /h의 유량으로 불소 오일을 흐르게합니다.
- 약 1 mL의 에멀젼을 수집합니다. 아가로즈가 완전히 설정될 때까지 추가로 5분 기다립니다.
3. 배양젤 브레이킹 및 세정
- 에멀젼에 불소 오일에 20 % 퍼플루오로 크타놀 (PFO)의 동일한 부피를 추가합니다. 원추형 튜브를 몇 번 반전하여 혼합을 허용합니다.
- 2,000 x g에서 2 분 동안 깨진 에멀젼을 회전시면 됩니다. 겔은 오일 및 PFO 상 위에 펠릿됩니다.
- 오일 상을 제거하고 TE-TW 완충액 2 mL(10 mM Tris pH = 8.0, 1 mM EDTA, 0.01% 트웬-20)를 추가하여 겔을 다시 중단시하였다. 서스펜션을 새로운 15mL 원유관으로 옮김.
- 3.2단계에서와 같이 겔을 아래로 내리고 TE-TW에서 한 번 더 세척하여 총 2회 세척합니다.
- 2 mL의 매체에서 상급 젤을 제거하고 다시 일시 중단하십시오. 5 mL 배양 튜브로 옮김을 옮김.
- 30°C에서 밤새 배양하여 흔들어.
참고 : 하룻밤 배양 후, 효모 하이드로 겔은 며칠 동안 4 °C에서 보관 할 수 있습니다.
4. 효모 식민지 라시스
- 겔을 15 mL 원유관과 펠릿 하이드로겔을 2,000 x g에서 2분 동안 옮긴다.
- 하이드로겔을 PBS 2x로 세척합니다.
- 1x 구형 완충액 1x로 세척합니다.
- 구형 완충액에서 2-50배 의 구형 효소를 희석시키고 하이드로겔에 1 mL을 추가합니다.
- 37°C에서 1시간 동안 배양한다. 처리된 효모는 더 투명하게 보일것이다(그림 3A).
- 하이드로겔 현탁액의 바닥 0.8 mL를 가지고 1 mL의 뚜껑이 없는 주사기로 옮김을 옮김.
- 주사기를 3D 인쇄 주사기 홀더(보충 파일3)에놓고 2분 동안 2,000 x g에서 회전합니다. 이로 인해 하이드로겔이 주사기 헤드에 팩을 닫습니다.
5. 장치 B를 사용하여 용해 된 효모 식민지에서 mRNA 캡처
- 240,000 개의 드롭-세크 비드를 가지고 15 mL 원엽 튜브로 옮김.
- 펠릿 드롭-세크 비즈는 1분 동안 1,000 x g으로 회전합니다.
- 120,000 비드 /mL의 비드 현탁액 농도에 대한 500mMM염화나트륨과 0.9 x 효모 용해 완충제의 2 mL에서 상류및 재중단 구슬을 제거합니다.
- 비드 서스펜션을 교반 막대를 삽입하여 3 mL 주사기로 옮김을 옮김을 삽입합니다.
- 불소 오일에 2%의 수 밀리리터를 함유하는 주사기를 준비합니다.
- 밀착된 하이드로겔이 들어 있는 주사기의 모든 수성 머리를 대피시키고 주사기를 덮습니다.
- 하이드로겔, 비드 서스펜션 및 오일 주사기를 주사기 펌프에 넣고 튜브를 통해 섹션 1에서 만든 캡슐화 장치에 연결합니다.
- 출구 튜브에서 얼음에 50 mL 원엽 튜브에 연결합니다.
- 다음 유량으로 세 가지 솔루션을 장치로 플로우합니다.
- 하이드로겔을 0.4 mL/h로 흐르게 합니다.
- 비드 서스펜션을 0.4 mL/h로 흐르게 합니다.
- 불소 오일을 1.6 mL/h로 흐르게 합니다.
- ~1 mL의 에멀젼을 수집하거나 더 이상 하이드로겔이 남지 않은 때까지 장치를 실행하십시오.
6. cDNA 생성, 시퀀싱 라이브러리 준비 및 시퀀싱
- 드롭-Seq프로토콜(14)에명시된 바와 같이 수집된 에멀젼에 6x SSC 버퍼 및 1 mL의 PFO를 추가한다.
- Drop-Seq 프로토콜을 계속 따라 비드에 포획된 mRNA에서 cDNA를 생성하고, 라이브러리 준비 시퀀싱 및 시퀀싱 데이터 분석을 수행합니다.
결과
우리는 이소제닉 효모 콜로니의 유전자 발현 프로파일링을 수행하기 위해 이전에 발표된 Drop-Seq 워크플로우14를 이소제닉 콜로니 시퀀싱(ICO-seq)에 적용했습니다. 우리는 단 하나 효모 세포를 단분리하고 아가로스 마이크로겔로 캡슐화했습니다(그림 1A). 마이크로겔의 하룻밤 배양 후, 이 캡슐화 효모 세포는 등소성 콜로니로 성장했다. mRNA 포획을 위한 제2 미세유체 장치로 겔을 로딩하기 전에, 우리는 mRNA를 더 쉽게 접근할 수 있도록 효모 세포벽을 소화하였다(그림1B,왼쪽). 우리는 이 마이크로겔을 닫고 mRNA 포획 비드와 용해 완충액을 병합했습니다. 일부 물방울에는 정확히 하나의 비드와 lysed 효모 식민지가 들어 있었습니다. 에멀젼 내의 모든 비드는 드롭-세크 프로토콜에 따라 합성및 시퀀싱된 cDNA를 수집했다.
우리는 8 개의 드롭 스플리터가 부착 된 coencapsulation 미세 유체 장치를 사용하여 아가로즈 마이크로 겔 내의 단일 효모 세포 캡슐화를 통해 이소제 효모 콜로니를 생성했습니다(그림 2A). 우리는 입력 효모 현탁액을 ~ 750,000 /mL의 농도로 희석하여 마이크로 겔의 ~ 30 %가 정확히 하나의 효모를 갖도록했습니다. 초저용융 온도를 장치에 삽입하기 전에, 우리는 이를 높은 온도에서 용해시키고 이 온도에서 주사기를 유지하여 조기 겔화를 방지합니다. 낙하 발생 접합부(도2B)에서효모 세포를 처음에 160 μm 액적으로 캡슐화하였다. 낙하 생성 접합후 8배 스플리터는 이 방울을 80 μm 방울로 나누었다(도2C). 주사기 필터는 낙하 분할 동안 37 μm만큼 좁을 수 있는 채널 내에서 막시가 형성되는 것을 방지하기 위해 용융 아가로오스에 부착되었다. 우리는 얼음에 에멀젼을 수집하여 즉시 아가로스 겔화 과정을 시작했습니다. 우리는 전형적인 에멀젼의 다분산도를 ~6%(보충도1)로계산했지만, 최대 10%의 다분산값을 허용합니다. 아가로즈 겔이 설정되면, 우리는 에멀젼을 깨고 오일 상을 제거했습니다. 겔을 성장 매체에 침지하기 전에 수성 완충액으로 세척하였습니다. 마이크로겔의 하룻밤 배양결과 일부 마이크로겔 내에서 이원성 콜로니가 성장하였다(그림2D). 적어도 20개의 세포의 콜로니를 함유하는 하이드로겔의 백분율은 배양 조건에 의존하였고, 배양 시간 및 배지 조성물을 포함한다. C. albicans를사용하여 우리의 데모에서, 우리는 하이드로겔의 대략 15%가 현탁액 배양의 20 시간 후에 식민지를 포함했다는 것을 결정했습니다.
두 번째 코엔캡슐화 장치는 이소제성 콜로니로부터 mRNA를 추출하였다(도3A). 효모 마이크로겔을 미세 유체 장치에 적재하기 전에, 우리는 효모 세포벽을 소화하기 위해 용액에 젤을 세척하고 침지시켰습니다. 효모 세포의 적절한 소화는 현미경검사법에 의해 확인되었고, 처리된 효모는 보다 반사적인 형태를 갖는것으로확인되었다(도 3B). 우리는 주사기에 마이크로겔을 닫고 한 겔이 각 방울에 들어있도록 겔 입력 유량을 조정했습니다. mRNA 의 스트림은 투하 접합 전에 밀착된 겔 스트림과 혼합된 용해 완충제에서 비드를 포획한다(도3C). 우리는 160 μm 방울의 결과 에멀젼을 수집하고, 식민지는 그들의 세포 내용을 풀어 놓기 시작했습니다. 우리는 여러 개의 구슬을 함유하는 방울의 수를 최소화하기 위해 제한 희석에 구슬을 적재했지만, 드롭 만들기 동안 겔의 밀착 포장은 용해된 콜로니를 가진 하나의 비드를 함유하는 수집 된 방울의 약 10 %를 초래했다(그림 3D).
우리는 ICO-seq 워크플로우를 사용하여 인간 장내 미생물군유전체에 존재하는 효모 종인 C. albicans의유전자 발현을 분석했습니다. C. albicans는 백색과 불투명19에게불리는 2개의 다른 세포 국가 사이를 전환하는 그것의 기능에 대해 주의됩니다. 우리는 YFP20로백혈구에서만 활성화된 WH11 유전자의 1개의 사본을 대체하는 설계한 C albicans 긴장, 긴장 RZY122를 이용합니다. 우리는 워크플로우를 사용하여 유전자 발현 프로필 세트를 획득하고 적어도 300개의 독특한 유전자를 발현하는 콜로니의 분석을 위해 이를 사용하였다. 참조 데이터 집합으로, 우리는 이전에 간행된 연구17에서 얻은 C. Albicans 발현 데이터를 사용하고 600 개 미만의 유일한 유전자를 발현하는 식민지를 필터링했습니다. 주성분(PC) 분석 및 t-스토크계 인접인 부호(tSNE) 입시감소(21)를수행한 후, 샘플 데이터 세트와 참조 간의 일반적인 일치를 발견하였다(도4A). PC 분석에 따르면 YFP와 WH11이 처음 두 PC에 크게 기여한 것으로 나타났습니다. 더욱이, tSNE 분석은 3개의 군집을 밝혔다(그림 4B). 클러스터 2는 주로 샘플 데이터 집합의 셀로 구성되었지만 클러스터 0과 1은 두 샘플의 셀로 구성되었습니다. tSNE(그림4C,상부 패널)에 WH11 식을 오버레이함으로써 클러스터 1에 흰색 콜로니가 포함될 가능성이 높다고 판단했습니다. 또한 STF2 발현이 클러스터1(도 4C,하부 패널)에서 증가한 것으로 나타났으며, 이전에 획득한 데이터17과일치한다. 클러스터 0 및 2에서 WH11 및 STF2는 클러스터1(그림 4D)에비해 상당히 하향 조정되었습니다. ADH1과같은 발효에 관여하는 유전자는 클러스터 0에서 업게질되었고, 불투명 세포22의이전 연구와 일치하였다. 우리는 군집 2에 있는 식민지가 군집 0과 1에 있는 식민지와 비교된 리보소말 RNA를 감소했다는 것을 것을을 발견했습니다. 표본 및 참조 데이터 세트는 세포의 동일한 주식을 사용하여 장악되었지만, 이 결과는 실험 처리에 있는 미묘한 다름조차 유전자 발현에 영향을 미칠 수 있다는 것을 건의합니다.
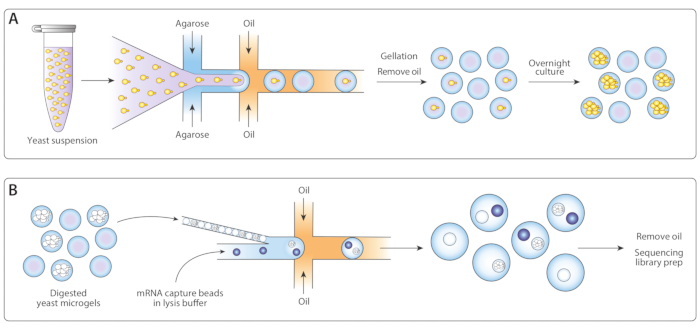
그림 1: ICO-seq 워크플로우 개요. (a)현탁액 배양에서 성장하는 효모는 완충액으로 희석하고 유동 초점 액적 발생기 장치에서 용융 아가로오스와 결합하여 단일 효모 세포로 아가로스 마이크로겔의 푸아송 로딩을 가능하게 하였다. 아가로오스가 냉각되었을 때 설정된 젤은 오일/물 현탁액이 파손되고 오일이 제거되어 물에 젤 비드의 현탁액을 생성했습니다. 하룻밤 배양 후, 효모 세포는 마이크로겔 내의 등소성 콜로니로 성장했습니다. (B)콜로니는 세포벽 분해 완충액을 실시하였고, 그 후 두 번째 미세 유체 장치에서 mRNA 포획 비드로 밀착및 코캡슐화시켰다. 마이크로겔을 닫아 각 방울에 1개의 젤이 있는 것을 보장하고, 구슬의 푸아송 로딩은 한 방울 안에 여러 개의 구슬의 가능성을 감소시켰습니다. 수집된 방울은 cDNA 합성 및 시퀀싱 라이브러리의 생성을 위해 처리되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
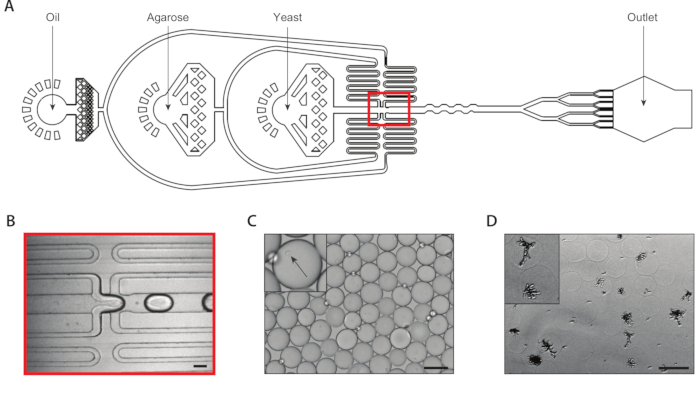
그림 2: 장치 A를 사용하여 아가로즈 마이크로겔 내의 이소생 효모 콜로니 생성. (A)미세 유체 장치의 회로도, 세 가지 입력 및 출력 포트의 위치를 보여주는. 드롭 만들기 접합부는 빨간색으로 강조 표시됩니다. (B)정상적인 장치 작동 중 낙하 접합부클로즈업. (C)캡슐화된 세포(inset)를 포함하는 액적의 클로즈업과 함께 수집된 물방울의 현미경 그래프. (D)24시간 배양 후 아가로즈 마이크로겔에서 이원성 효모 콜로니의 현미경 을 촬영하여 2개의 콜로니(inset)를 클로즈업하였다. 모든 축척 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 장치 B를 사용하여 등소성 콜로니로부터 용해 및 mRNA 포획. (A)미세 유체 장치의 회로도, 세 가지 입력 및 출력 포트의 위치를 보여주는. 드롭 만들기 접합부는 빨간색으로 강조 표시됩니다. (B)세포벽 소화 후 효모 콜로니의 현미경, 1 개의 콜로니 (인세트)를 클로즈업한 후. (C)정상적인 장치 작동 중 낙하 접합부클로즈업. (D)마이크로겔 및 비드 페어링에 이어 수집된 에멀젼의 현미경 그래프, 클로즈업하여 비드 및 용해콜로한 콜로니(inset)를 가진 드롭을 나타낸다. 모든 축척 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: C. 알비칸스의백색 불투명 스위칭 응답 분석. (A)샘플 데이터 집합의 tSNE 플롯은 Liu17의참조 데이터 집합과 결합됩니다. (B)전사체의 군집화는 tSNE 플롯에 시각화된 3개의 클러스터를 드러낸다. (c)백색 불투명 스위칭 반응에 관여하는 주요 유전자는 주성분 분석을 통해 결정된 바와 같이 변이에 기여했다. (D)tSNE 플롯에 표시된 클러스터에 의한 YFP 및 WH11의 정규화된 식 레벨의 바이올린 플롯. **는 p이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1 및 2. 이 필거를 다운로드하려면 여기를 클릭하십시오.
추가 파일 1-3. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
등소 생성 효모 콜로니 RNA 시퀀싱 (ICO-seq)에 대한 우리의 방법은 엔지니어링 효모 균주의 높은 처리량 스크리닝을 위해 게시 된 단일 세포 RNA 염기서열 분석 플랫폼 인 Drop-Seq를 적응시입니다. 효모 세포는 전형적인 포유류 세포의 mRNA 사본의 10% 미만을 함유하고 mRNA 포획16전에 분해될 필요가 있는 세포벽을 갖는다. 이 두 가지 요인은 드롭-세크 또는 다른 액적 기반 scRNA-seq 플랫폼에 효모의 직접적인 적용을 배제한다. 이러한 문제를 해결하기 위해, 우리는 하이드로겔 내의 단일 세포를 캡슐화하고 RNA 시퀀싱을위한 충분한 입력 물질을 제공하기 위해 콜로니로 성장시키고 용해 및 mRNA 캡처 전에 구형 세포를 생성하기 위해 효모 세포 벽을 소화합니다. 이러한 변경 사항은 원래 Drop-Seq 워크플로와 비교할 때 ICO-seq 워크플로우에 복잡성을 더하며 사용자가 원활하게 진행해야 하는 중요한 단계입니다.
장치가로즈 하이드로겔 내의 단일 효모 세포를 캡슐화하기 위해서는 장치 A의 적절한 작동이 필요합니다. 입력 효모 현탁액의 적절한 계수는 mRNA 포획 동안 합리적인 세포 포획 효율을 보장하기 위해 충분한 하이드로겔이 단일 세포를 포함하고 있음을 보장하면서 하나 이상의 효모 셀을 가진 하이드로겔의 수를 최소화하기 위해 따라야 합니다. 미세 유체 장치 작동 중에 아가로즈 겔 혼합물을 잘 용해시키고 주사기 필터를 통과하여 장치 막힘 가능성을 최소화해야 합니다. 아가로즈 젤 혼합물은 점성이 있고 단일 채널이 8개로 분할되는 지역은 특히 막히는 경향이 있습니다. 고속 카메라를 중심으로 장치의 해당 영역에서 장치 작동을 시각화함으로써 사용자는 8개 채널 각각에서 나오는 물방울의 균일성을 모니터링하고 임의의 채널에서 막힘으로 인해 균일성이 변경되면 신속하게 반응할 수 있습니다. 현미경하에서 소량의 수집된 에멀젼의 검사는 고품질 에멀젼을 확인하는 이차적인 방법을 제공한다.
하이드로겔 내 효모 콜로니의 성장에 따라 단일 콜로니 수준에서 양질의 mRNA 추출을 보장하기 위해 몇 가지 예방 조치가 필요합니다. 효모가 하이드로겔 배양에 있는 시간을 최적화하는 것이 중요합니다, 효모가 너무 오래 배양에 남아 있는 경우에, 많은 사람들이 RNA 순서 도중 더 높은 배경 신호로 이끌어 내고 세포 모형 사이 차별할 때 더 낮은 감도로 이끌어 내는 하이드로겔의 경계를 벗어날 것이기 때문에. Zymolyase를 사용하여 구형세포의 적당한 생성은 mRNA가 용해 완충제에 세포 노출 다음에 풀어 놓일 것이라는 점을 보장합니다. Zymolyase 다음 효 모 식민지의 육안 검사는 빛나는 효 모 세포를 얻을 한다. 부적당한 세포벽 소화는 더 낮은 RNA 포획 효율성으로 이끌어 낼 것입니다. 마지막으로, 하이드로겔은 장치 B에 주입될 때 클로즈팩되어야 합니다.
우리의 방법에 대한 잠재적 인 관심사는 효모의 마이크로 겔 문화가 유전자 발현을 크게 바꿀 수 있다는 것입니다. 마이크로겔과 한천에서 효모 유전자 발현을 조사하는 이전 연구는 유전자 발현 평균의 차이를 보여 주지만 전반적으로 긍정적 인 상관 관계17,다양한 효모 균주에 대한이 주장에 대한 추가 조사는 신중하지만. 이 방법은 또한 푸아송 통계14에따른 mRNA 포획 비드의 스토크로 인해 세포 포획 효율이 제한적이다. 현재 약 10%의 방울이 비드와 콜로니를 함유하고 있으며, 이중 캡슐화율은 1% 미만일 것으로 예상됩니다. 이중 캡슐화는 RNA-seq 데이터 분석 중에 혼란스러운 요소로 이어지고 필터링은 여전히 도전적인23; 25%의 캡처율은 이중 캡슐화의 상응하는 증가로 이어질것입니다(보충 그림 2). Drop-Seq 플랫폼을 사용하여 ICO-seq를 입증하지만, mRNA 포획 비드를 통계적으로 보다 결정적으로 도입하는 다른 액적 RNA-seq 플랫폼이 있는데, 예를 들어 시판되는 10x 유전체학 크롬 플랫폼15,,24. 이러한 플랫폼을 ICO-seq와 통합하면 푸아송 통계가 허용하는 것 이상으로 캡처 효율성을 높일 수 있습니다. 마지막으로, 액적 RNA-seq의 근본적인 한계는 시퀀싱 후 관심 있는 세포를 복구할 수 없다는 것입니다. 이 방법을 사용하여 분석할 효모 라이브러리의 유형을 고려할 때 이러한 제한을 고려해야 합니다.
대장균 E. coli25 및 S와같은 미생물에 대한 클론 수준에서 세포 간 이질성이 입증되었습니다. cerevisiae26은 대량 수준 분석이 그렇지 않으면 마스크 할 것이라는 새로운 세포를 밝히는. C. albicans에 수행된 대량 RNA-seq 분석은 인구 전체 전사체 변경을 보는 경향이 있습니다, 또는2개의별개의 인구로 백색 및 불투명 한 세포27,28. ICO-seq의 적용은 추가 하위 상태의 발견으로 이어질 수 있으며 다른 효모 종 내에서 새로운 세포 상태를 발견하기위한 분석 프레임 워크를 제공 할 수 있습니다. 그러나, 하이드로겔 내세포의 성장은 효모에 한정되지 않는다:포유동물, 세균, 및 기타 곰팡이 세포와 같은 다른 세포 유형은 또한 하이드로겔29,,30내에서 경작될 수 있다. 단일 세포 대 등소원 콜로니의 시퀀싱은 세포 간 변이로 인한 생물학적 잡음의 평균화로 이어져 세포 유형 간의 차별을 개선합니다. 이것은 유전 다양성이 특정 합성 통로에 센터 세포를 분석할 때 도움이 될 수 있습니다. ICO-seq에 대한 세포 유형 입력의 확장 된 가능성과 상업적으로 이용 가능한 액적 RNA-seq 플랫폼과의 잠재적 인 통합은 유전 수준에서 세포 이질성을 해부하기위한 유망한 플랫폼으로 ICO-seq를 배치합니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 프로젝트는 국립 과학 재단 경력 상 DBI-1253293, 국립 보건 원 새로운 혁신상 DP2AR068129 및 R01HG008978, 국립 과학 재단 기술 센터 보조금 DBI-1548297, 그리고 세포 건설을위한 UCSF 센터에 의해 지원되었다. ARA와 ZJG는 찬 - 주커 버그 바이오 허브 조사자입니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | Used to make TE-TW buffer |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | Used to make TE-TW buffer |
| 27 gauge needles | BD | 305109 | |
| 3 mL syringes | BD | 309657 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | See Supplemental Files for 3D print file |
| Agarose, low gelling temperature | Sigma-Aldrich | a9414 | |
| Aquapel (hydrophobic glass treatment) | Pittsburgh Glass Works | 47100 | |
| Drop-Seq Beads | ChemGenes | MACOSKO-2011-10 | |
| Glass microscope slides (75 mm x 50 mm) | Corning | 294775X50 | |
| Ionic Krytox Surfactant | Synthesis instructions in ref 14. Can substitute with PEG-PFPE surfactant. | ||
| Isopropanol | Sigma-Aldrich | 109827 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec 7500 | 3M | 98-0212-2928-5 | Commonly knowns as HFE 7500 |
| PBS | Fisher Scientific | BP243820 | |
| PE-2 polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| PEG-PFPE surfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | See Supplemental Files for mask designs |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| SSC Buffer | Sigma-Aldrich | S6639 | |
| SU-8 2100 | MicroChem | Y111075 | |
| SU-8 2150 | MicroChem | Y111077 | |
| Sylgard 184 silicone elastomer kit | Krayden | 4019862 | |
| Tween-20 | Sigma-Aldrich | P1379 | Used to make TE-TW buffer |
| YR Digestion buffer | Zymo Research | R1001-1 | Spheroplasting buffer |
| YR Lysis Buffer | Zymo Research | R1001-2 | |
| Zymolyase | Zymo Research | E1005 | Spheroplasting enzyme mixture |
참고문헌
- Peralta-Yahya, P. P., Zhang, F., Del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Curran, K. A., Alper, H. S. Expanding the chemical palate of cells by combining systems biology and metabolic engineering. Metabolic Engineering. 14 (4), 289-297 (2012).
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Mager, W. H., Winderickx, J. Yeast as a model for medical and medicinal research. Trends in Pharmacological Sciences. 26 (5), 265-273 (2005).
- Krivoruchko, A., Siewers, V., Nielsen, J. Opportunities for yeast metabolic engineering: Lessons from synthetic biology. Biotechnology Journal. 6 (3), 262-276 (2011).
- Vanella, R., et al. Yeast-based assays for screening 11β-HSD1 inhibitors. Microbial Cell Factories. 15 (1), (2016).
- Zhuang, X., Chappell, J. Building terpene production platforms in yeast. Biotechnology and Bioengineering. 112 (9), 1854-1864 (2015).
- Agresti, J. J., et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution. Proceedings of the National Academy of Sciences. 107 (9), 4004-4009 (2010).
- Wang, G., et al. RNAi expression tuning, microfluidic screening, and genome recombineering for improved protein production in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 116 (19), 9324-9332 (2019).
- Beneyton, T., et al. Droplet-based microfluidic high-throughput screening of heterologous enzymes secreted by the yeast Yarrowia lipolytica. Microbial Cell Factories. 16 (1), 18(2017).
- Sjostrom, S. L., et al. High-throughput screening for industrial enzyme production hosts by droplet microfluidics. Lab on a Chip. 14 (4), 806-813 (2014).
- Nadal-Ribelles, M., et al. Sensitive high-throughput single-cell RNA-seq reveals within-clonal transcript correlations in yeast populations. Nature Microbiology. 4 (4), 683-692 (2019).
- Gasch, A. P., et al. Single-cell RNA sequencing reveals intrinsic and extrinsic regulatory heterogeneity in yeast responding to stress. PLoS Biology. 15 (12), 2004050(2017).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Klein, A. M., et al. Droplet barcoding for single-cell transcriptomics applied to embryonic stem cells. Cell. 161 (5), 1187-1201 (2015).
- von der Haar, T. A quantitative estimation of the global translational activity in logarithmically growing yeast cells. BMC Systems Biology. 2, 87(2008).
- Liu, L., Dalal, C. K., Heineike, B. M., Abate, A. R. High throughput gene expression profiling of yeast colonies with microgel-culture Drop-seq. Lab on a Chip. 19 (10), 1838-1849 (2019).
- Fallah-Araghi, A., Baret, J. C., Ryckelynck, M., Griffiths, A. D. A completely in vitro ultrahigh-throughput droplet-based microfluidic screening system for protein engineering and directed evolution. Lab on a Chip. 12 (5), 882-891 (2012).
- Berman, J., Sudbery, P. E. Candida albicans: A molecular revolution built on lessons from budding yeast. Nature Reviews Genetics. 3 (12), 918-930 (2002).
- Srikantha, T., Soll, D. R. A white-specific gene in the white-opaque switching system of Candida albicans. Gene. 131 (1), 53-60 (1993).
- van der Maaten, L., Hinton, G. Visualizing data using t-SNE. Journal of Machine Learning Research. 9, 2579-2605 (2008).
- Sun, Y., et al. Deletion of a yci1 domain protein of Candida albicans allows homothallic mating in MTL heterozygous cells. mBio. 7 (2), 00465-00516 (2016).
- McGinnis, C. S., Murrow, L. M., Gartner, Z. J. DoubletFinder: Doublet Detection in Single-Cell RNA Sequencing Data Using Artificial Nearest Neighbors. Cell Systems. 8 (4), 329-337 (2019).
- Baran-Gale, J., Chandra, T., Kirschner, K. Experimental design for single-cell RNA sequencing. Briefings in Functional Genomics. 17 (4), 233-239 (2018).
- Silander, O. K., et al. A Genome-Wide Analysis of Promoter-Mediated Phenotypic Noise in Escherichia coli. PLoS Genetics. 8 (1), 1002443(2012).
- Newman, J. R. S., et al. Single-cell proteomic analysis of S. cerevisiae reveals the architecture of biological noise. Nature. 441 (7095), 840-846 (2006).
- Tuch, B. B., et al. The Transcriptomes of Two Heritable Cell Types Illuminate the Circuit Governing Their Differentiation. PLoS Genetics. 6 (8), 1001070(2010).
- Romo, J. A., et al. Global Transcriptomic Analysis of the Candida albicans Response to Treatment with a Novel Inhibitor of Filamentation. mSphere. 4 (5), 00620(2019).
- Huang, H., et al. Generation and manipulation of hydrogel microcapsules by droplet-based microfluidics for mammalian cell culture. Lab on a Chip. 17 (11), 1913-1932 (2017).
- Lin, X., Nishio, K., Konno, T., Ishihara, K. The effect of the encapsulation of bacteria in redox phospholipid polymer hydrogels on electron transfer efficiency in living cell-based devices. Biomaterials. 33 (33), 8221-8227 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유